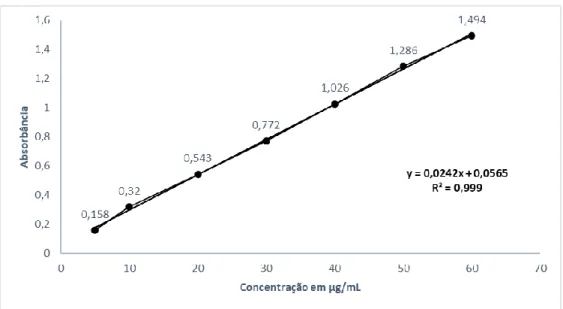
Para avaliar o perfil de liberação do fármaco, foi simulado um meio biológico representando o pH fisiológico. Por outro lado, essa tecnologia já era descrita na década de 1950 em sistemas simples envolvendo pellets de liberação controlada (SANTOS et al., 2004). Vale a pena notar que existe uma grande variedade de sistemas e que estes visam condicionar a velocidade e o local de liberação do fármaco.
BIOMATERIAIS
Além disso, a utilização de sistemas matriciais permite a inclusão de quantidades relativamente altas de fármacos em sua matriz (LOPES et al, a obtenção de um sistema carreador de fármacos à base de polímeros naturais biocompatíveis tem sido objeto de diversos estudos na maioria dos de algumas áreas.
SISTEMAS DE LIBERAÇÃO DE FÁRMACOS
Por outro lado, a curva laranja é representada por uma forma farmacêutica que resulta da administração de múltiplas doses diárias de um medicamento de liberação regular, e quando a concentração do ativo atinge um nível baixo, uma nova dose é administrada, causando um pico na concentração plasmática do paciente. Esse tipo de liberação é destinado a formas farmacêuticas em comprimidos que são administrados com intervalo de seis a oito horas (janela terapêutica). 6 A liberação sustentada, representada na curva rosa, caracteriza-se pela manutenção da concentração plasmática do fármaco por longo tempo - geralmente de 8 a 12 horas, intervalo de tempo maior do que as formas farmacêuticas convencionais.
Após a administração, ocorre uma rápida liberação do fármaco e, posteriormente, a manutenção do efeito com sua liberação gradual e contínua, que se caracteriza por uma cinética de liberação de ordem zero (ALBANEZ, 2012). Em azul temos um perfil típico de liberação retardada, esta forma farmacêutica é desenvolvida de forma que os princípios ativos sejam liberados com retardo, ou seja, são desenvolvidos para passar intactos pelo estômago. É uma estratégia inteligente, pois protege a mucosa gástrica do efeito irritante da droga; impede a destruição da substância ativa pela ação do suco gástrico e direciona o fármaco para ser absorvido em determinadas áreas do intestino.
Podemos, sob uma das formas mais utilizadas com perfil de liberação controlada, as suspensões injetáveis, baseadas na administração intramuscular do fármaco sob a fórmula particulada, que forma um “depósito” do fármaco, que é liberado lentamente na corrente sanguínea, menção. (SOSCOLONES, FREIDMAN, 1996). Diante desses diferentes perfis de liberação e suas peculiaridades, estudos sobre as novas possibilidades de sistemas que monitoram a velocidade e o local de liberação de fármacos têm sido investigados principalmente na indústria farmacêutica, a fim de melhorar o conforto do paciente em relação às formas farmacêuticas. (LOPES et al., 2005).
MECANISMOS DE LIBERAÇÃO CONTROLADA DE FÁRMACOS
É de grande importância a utilização de modelos matemáticos de liberação para o desenvolvimento de dispositivos de liberação controlada. Modelos matemáticos são de extrema importância, pois elucidam com maior clareza os aspectos inerentes à cinética envolvendo sistemas matriciais de liberação controlada de fármacos. Este modelo apresenta fortes limitações na interpretação de mecanismos de liberação controlada, mas ainda é o que mais se aproxima do que ocorre em sistemas matriciais de ordem zero (TAHARA et al., 1996).
Este trabalho foi baseado em um estudo de liberação controlada utilizando um fármaco modelo impregnado em uma matriz funcionalizada. Assim, um dispositivo robusto foi criado e colocado em um meio simulado para avaliar seu perfil de liberação. Impregnar o fármaco (Secnidazol) em um sistema modificado de matriz de liberação controlada baseado em celulose funcionalizada líquida iônica (celulose [(MeO)3Sipmim] [Cl]) e realizar ensaios de liberação controlada comparando os dois meios de liberação com membrana de diálise e sem ela.
20 Para avaliar o perfil de liberação controlada do medicamento Secnidazol, o meio biológico de escolha foi o PBS (solução tampão fosfato) para simular o pH fisiológico do organismo. 23 Figura 10 - Adaptação matemática do perfil de liberação controlada em pH 7,4 para o fármaco Secnidazol (escala entre 0 – 400 minutos). 24 Figura 11 - Adaptação matemática do perfil de liberação controlada em pH 7,4, para o fármaco Secnidazol (aumento de escala entre 400 – 750 minutos).
Portanto, este estudo nos mostra que a droga luta para mudar seu perfil de liberação. Sistemas poliméricos de liberação controlada utilizando micro e nanopartículas encapsulando violacina: caracterização, atividade biológica, consequências e perspectivas. Síntese e caracterização de nanocompósitos de sílica mesoporosa com partículas magnéticas para dispositivos de liberação controlada de fármacos [dissertação].
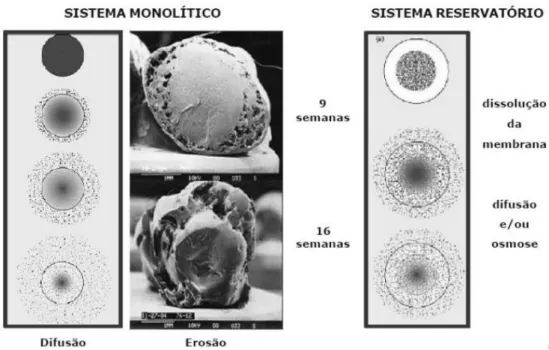
CINÉTICA DE ANÁLISE DE MECANSMOS DE LIBERAÇÃO
LÍQUIDOS IÔNICOS
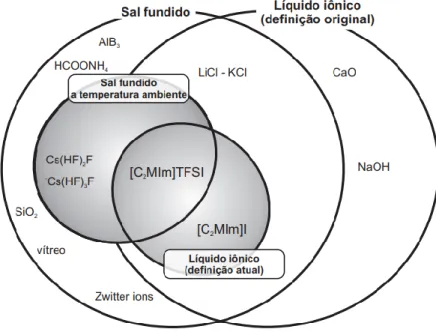
Os líquidos iônicos (LI) podem ser entendidos como sais fundidos que possuem ponto de fusão abaixo do ponto de ebulição da água (100°C). Também conhecidos como clássicos e convencionais, os LIs apróticos são constituídos por grandes cátions orgânicos e uma ampla gama de ânions (MACHANNOVÁ et al., 2014; PERIC et al., 2014). Isso significa que o estado líquido desses compostos é termodinamicamente favorável mesmo em baixas temperaturas (KROSSING et al., 2006).
No entanto, o conhecimento sobre suas propriedades físicas e químicas dos IL ainda é limitado e o grande número de diferentes combinações de cátions e ânions. Íons biologicamente ativos têm sido usados para produzir novos LI, mas o principal direcionador para esses materiais tem sido o uso de íons com baixa toxicidade conhecida para obter o conjunto de propriedades físicas de líquidos iônicos (CARTER et al., 2004). Uma classe importante de LI são os agentes antimicrobianos derivados de cátions quaternários de amônio que são conhecidos há algum tempo, e que recentemente foram mostrados em estudos onde esses derivados demonstraram ser biologicamente ativos (PERNAK et al., 2003).
14 Por exemplo, o uso de sais de amônio quaternário ultrapassou o campo de aplicação em que eram usados como compostos de transferência de fase, para passar a fazer parte do campo de aplicação de cátions para obtenção de líquidos iônicos. Além disso, existe uma grande variedade de cátions de amônio quaternário, que possuem propriedades antibacterianas eficazes contra várias cepas (TROUTMAN et al., 2009).
SECNIDAZOL
Determinar o perfil de liberação controlada in vitro das moléculas usando a técnica de espectroscopia UV-Vis em meio salino tamponado com PBS (pH 7,4). Dois tipos diferentes de sistemas foram escolhidos para avaliar o perfil de liberação: o primeiro sistema consistia em uma membrana de diálise semipermeável, que utiliza um processo para separar as moléculas com base em seu tamanho (difusão) e o segundo sistema escolhido foi sem membrana de diálise. Assim posteriormente com o objetivo de comparar os dois perfis de liberação do fármaco de escolha Secnidazol.
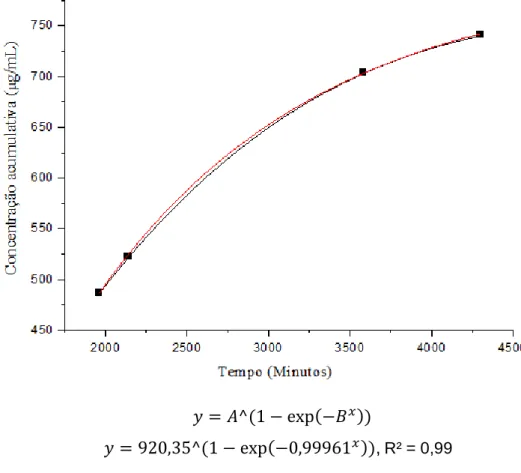
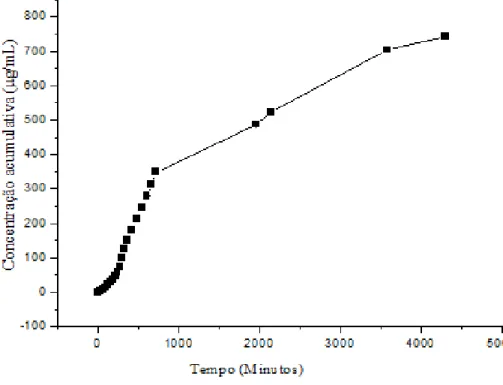
21 Em relação ao perfil de lançamento do sistema em questão, a Figura 8 representa o gráfico sem nenhuma ampliação (aumento de escala) e sem nenhum ajuste por modelo matemático. Os outros gráficos apresentados neste estudo mostram a mesma curva com três incrementos de escala, e cada período de tempo apresenta dois perfis de liberação diferentes. Aqui identificamos que nesta figura existem pelo menos dois perfis de liberação diferentes (Figuras 10, 11 e 12).
A Figura 10 representa o intervalo de liberação de 0 a 400 min, cujos dados apresentaram comportamento exponencial, sendo o modelo que melhor se ajustou aos dados o modelo Weibull comumente utilizado para estudos avaliando diluição e liberação (PAPADOPOULOU et al., 2006). ). Quanto aos ajustes matemáticos, a curva da Figura 11 mostra a linearização no perfil de liberação. Assim, o modelo de liberação mais adequado também é o modelo de Weibull, que mostra a proporção cumulativa do fármaco (m) na solução no tempo t.
Isso indica que a tecnologia envolvendo dispositivos de liberação controlada de fármacos apresenta muitas vantagens, como maior estabilidade do fármaco no ambiente fisiológico, maior adesão do paciente ao tratamento devido à menor frequência de administração.
![Figura 6 - Processo de funcionalização da celulose com o líquido iônico [(MeO) 3 Sipmim][Cl]- (Celulose[(MeO) 3 Sipmim][Cl])](https://thumb-eu.123doks.com/thumbv2/123dok_br/17627390.4197122/29.893.135.824.603.735/figura-processo-funcionalização-celulose-líquido-iônico-sipmim-celulose.webp)
OBJETIVOS GERAIS
OBJETIVOS ESPECÍFICOS
SÍNTESE DO LÍQUIDO IÔNICO [(MeO) 3 Sipmim][Cl]
FUNCIONALIZAÇÃO DA CELULOSE MICROCRISTALINA COM
O produto resultante do processo de funcionalização foi mantido em estufa por 24 horas a 50 ºC até a completa secagem. A Figura 6 mostra a reação resultante do processo de funcionalização da celulose microcristalina com o líquido iônico previamente sintetizado.
INCORPORAÇÃO DOS FÁRMACOS NA MATRIZ POLIMÉRICA
Com relação à estrutura resultante (Celulose[(MeO)3Sipmim][Cl]), observa-se que o líquido iônico está covalentemente ligado à estrutura com seu contra-íon cloreto no meio em questão. Em relação a essa incorporação do fármaco na matriz, observa-se um fenômeno de adsorção, onde o Secnidazol é o contra-íon da reação ao invés do cloreto (troca iônica), resultando no produto (Celulose[(MeO)3Sipmim][Secnidazol ]).
EXPERIMENTOS DE LIBERAÇÃO CONTROLADA DE FÁRMACOS
A caracterização da matriz polimérica funcionalizada com o líquido iônico (Celulose[(MeO)3Simmim][Cl]), está descrita em SALES et al. 2020) onde temos diversas análises que comprovam a importação do líquido iônico [(MeO)3Sipmim][Cl] na matriz celulósica polimérica, são elas: análise termogravimétrica, análise elementar (CHN), espectroscopia de infravermelho (IR), sólido magnético núcleo de ressonância de fase e difração de raios X (XRD). 25 Ainda em relação ao modelo de Siepmann e Peppas, temos que a quantidade inicial de fármaco liberada no meio é resultado de uma liberação imediata ("efeito burst"), motivada seja pela liberação do fármaco existente na superfície sistema matricial ou por alterações encontradas na estrutura do sistema. Isso leva a uma posterior liberação imediata do fármaco seguida de uma liberação mais lenta, o que explica essa linearização.
Este modelo representa ajustes bem-sucedidos para dados de drogas que representam difusão Fickiana pura (KOSMIDIS et al., 2003) e também mostra a vantagem de aplicar uma lei de potência, facilitando sua aproximação quando atb é pequeno, possibilitando o uso de his para modelos de drogas que apresentam não clássico -difusão em mecanismos de liberação combinada (PAPADOPOULOU et al., 2006). Por outro lado, b≈1 na Figura 12 indica que há um efeito pronunciado de uma liberação de primeira ordem e que obedece à primeira lei de difusão de Fick, então a constante a controla a cinética de liberação e a relação sem dimensão se dissolve e se dissolve e , ou, determina o fim da fração da dose dissolvida (RINAKI et al., 2003). Nesse sentido, destaca-se também que devido ao comportamento exponencial da curva de liberação nos períodos de 0 a 400 e de 2000 a 4500 minutos, o modelo Weibull também mostra que nesses intervalos houve um efeito pronunciado de segunda ordem . cinética no intervalo de 0 a 400 minutos e cinética de primeira ordem de 400 a 4500 minutos, pois no intervalo de 400 a 750 minutos a droga apresentou efeito cinético de primeira ordem, contatado pelo ajuste do modelo linear de Peppas.
Conclui-se assim que de acordo com os experimentos de liberação cinética foi possível analisar que os dois experimentos possuem o mesmo tipo de comportamento, sem alterações nos dados relacionados ao uso ou não da membrana de diálise. No processo de metátese, mostra que a incorporação do fármaco Secnidazol na matriz constituída por celulose foi relativamente baixa, sendo de aprox. 26% em relação à massa original. Este resultado mostra que o processo de incorporação do fármaco não foi eficiente, este baixo valor pode estar relacionado com a solubilidade do fármaco em meio PBS (pH 7,4).
Portanto, conclui-se com este trabalho que ao combinar dispositivos robustos e avaliações matemáticas e estatísticas, é possível visualizar como um fármaco pode se comportar em um ambiente fisiológico simulado, indicando que os modelos propostos são adequados para descrever a liberação. curvas.
RESULTADO DA INCORPORAÇÃO PARA O FÁRMACO SECNIDAZOL. 21