Dentre as espécies desse gênero, destacamos a Camisala paulensis Sleumer, uma espécie endêmica do Brasil, mais difundida nos estados da Bahia, Ceará, Pernambuco, Rio de Janeiro e São Paulo. 26 Tabela 3 - Sistemas de eluição utilizados no fracionamento cromatográfico da fase hexânica da BSE de Camisala paulensis. 43 Tabela 5 – Sistemas de eluição utilizados no fracionamento cromatográfico da fase acetato de etila da Camisala paulensis.
90 Tabela 11 - Concentração média ± coeficiente de variação dos fenólicos totais encontrados no EEB e nos estádios da Camisala paulensis.
Objetivo geral
Objetivos específicos
Considerações sobre a família Proteaceae Juss
Componentes químicos frequentemente relatados na literatura, os ácidos graxos também são característicos desta família, como podemos destacar os ácidos isolados hexadecenóico, octadecenóico, eicosenóico, cis-hexadec-9-enóico e cis-octadec-11-enóico (VICKERY, 1971). Outra classe muito importante na literatura sobre a família Proteaceae é a classe das naftoquinonas, que representa substâncias isoladas de espécies do gênero Lomatia (L. arborescens, L. silanfolia, L. tinctoria, L. fraxinifolia, L. longifólia, L. obliqua e L. . silanfolia): lomatiol (I), juglona (II), β-hidrojuglona (III) e naftazarina (IV) como mostrado na Figura 2 (p. 24) (MOIR; THOMSON, 1973). Outras substâncias relatadas na literatura foram isoladas da família Proteaceae com espécies dos gêneros Grecillea e Orites descritas na Tabela 1 (p. 25).
Dentre os estudos realizados e relacionados às atividades biológicas da família Proteaceae, destacam-se as atividades antimicrobianas dos diversos extratos obtidos de espécies desta família, conforme pode ser observado na Tabela 2 (p. 26).

Considerações sobre o gênero Roupala Ablu
Espécies desse gênero são geralmente utilizadas na medicina popular para limpeza de feridas e contra úlceras, além de sua importância na economia devido ao seu uso na carpintaria, carpintaria, construção civil e naval e ornamentação (FLORA SBS, 2015). Dentre eles, pode-se citar o já citado estudo realizado com a Camisala montana, que promove mortalidade moderada das formas adultas do Schistossoma mansoni, além de ser responsável pela redução da genotoxicidade induzida pelo metil metanossulfonato (MMS), um agente alquilante tóxico de alto índice de carcinogenicidade (OLIVEIRA, et al., 2014). Além dos escassos relatos de atividades biológicas realizadas, não foram encontrados estudos fitoquímicos em espécies desse gênero, o que despertou grande interesse na escolha de uma espécie pertencente a ele, com o objetivo de
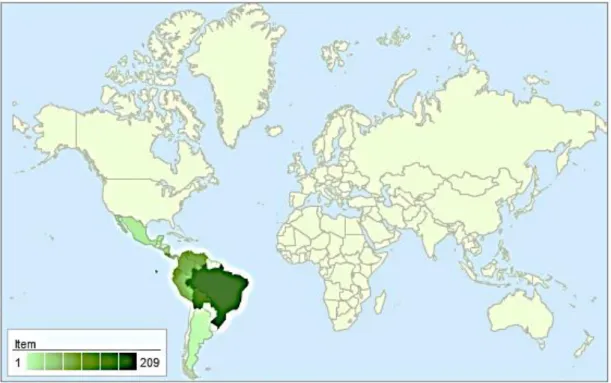
Considerações sobre Roupala paulensis Sleumer
Considerações químicas e biológicas sobre as classes de constituintes
- Esteroides
- Feofitinas
- Flavonoides
- Terpenoides
As feofitinas são substâncias formadas a partir de um núcleo tetrapirrólico semelhante à clorifila, da qual são extraídas biossinteticamente quando sofre perda de magnésio em meio ácido (Fig. 6, p. 30). Após esse processo conhecido como feofitinização, a estrutura principal é chamada de núcleo porfirínico (Fig. 7, p. 30) (TOMAZ, 2008; MOREIRA et al, 2010). Biossintetizados a partir da via dos fenilpropanóides, a maioria deles possui 15 átomos de carbono como núcleo básico, formando três anéis fenólicos (C6-C3-C6), dois anéis aromáticos (núcleos A e B) e um anel heterocíclico (núcleo C), que podem pode ser visto na Figura 8 (p. 31) (ZUANAZZI; MONTANHA, 2007).
Dentre as inúmeras atividades biológicas relacionadas aos flavonoides estão as atividades antioxidante, antimicrobiana, antiviral, anti-inflamatória, antialérgica, vasodilatadora, antiespasmódica, antitumoral, antinociceptiva, antiulcerogênica, antiplaquetária e hepatotóxica (PELZER, et al., 1998, 1998; ., 1999; .

Atividade antioxidante de produtos naturais
Sequestro do radical livre DPPH
Determinação do teor de fenólicos totais
A absorbância medida é comparada com a absorbância do branco e calculada levando em consideração a absorbância do controle negativo, que é a absorbância do DPPH sem a presença de amostra. A determinação do teor de fenólicos totais é realizada pela reação da amostra de teste com o reagente de Folin-Ciocalteau, uma mistura de ácido fosfomolibdico e fosfotungstico. Neste teste, o aparecimento de uma cor azul (a cerca de 725 nm) indica a presença de compostos fenólicos, uma vez que estes ácidos, ao reagirem com estes compostos com efeito redutor, sofrem oxidação e formam complexos de molibdénio e tungsténio, dos quais o estado de oxidação é + % e +6.
Estudo fitoquímico de Roupala paulensis
- Coleta do material vegetal e processamento da planta
- Obtenção do extrato etanólico bruto (EEB) das partes aéreas de Roupala
- Isolamento e purificação dos constituintes químicos de Roupala
- Processamento cromatográfico da fase hexânica
- Processamento cromatográfico da fase diclorometano
- Processamento cromatográfico da fase acetato de etila
- Teste do sequestro do radical livre DPPH
- Determinação do teor de fenólicos totais
- Análise estatística
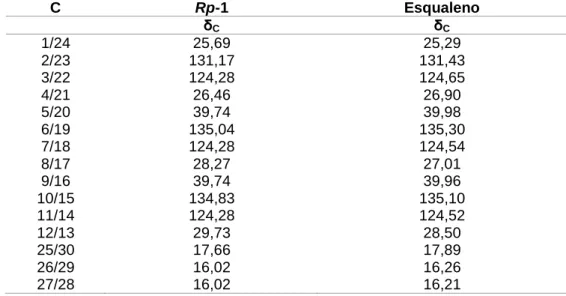
O isolamento e a purificação dos constituintes químicos da Camisala paulensis foram realizados utilizando técnicas cromatográficas como cromatografia líquida de média pressão (MLMP), cromatografia em coluna de adsorção (CC) e exclusão molecular. Uma alíquota da fase hexânica (11 g) foi submetida à CC utilizando sílica gel 60 como fase estacionária e hexano, EtOAc e MeOH, puros ou em misturas binárias, em gradiente crescente de polaridade como fase móvel. Tabela 3 - Sistemas de eluição utilizados no fracionamento cromatográfico em fase hexânica de BSE de Camisala paulensis.
Uma alíquota da fase diclorometano (8 g) foi submetida à CC utilizando sílica gel 60 como fase estacionária e hexano, EtOAc e MeOH, puros ou em misturas binárias, em gradiente crescente de polaridade como fase móvel. Eles foram então analisados pelo TDAH usando diferentes sistemas de eluição e classificados em 50 grupos de acordo com seus respectivos Rf (Tabela 4, p. 43; Esquema 3, p. 43). Uma alíquota da fase acetato de etila (10 g) foi submetida ao CLMP usando sílica gel 60 como fase estacionária e Hex, EtOAc e MeOH como fases móveis, puras ou em misturas binárias, com um sistema de gradiente em ordem crescente de polaridade.
E então analisados por TDAH usando diferentes sistemas de eluição, e agrupados em 15 grupos, de acordo com os respectivos Rfs (Tabela 5, p. 44; Esquema 4, p. 45). Tabela 5 - Sistemas de eluição utilizados no fracionamento cromatográfico da fase acetato de etila da Camisala paulensis. Para a determinação da atividade antioxidante de Camisala paulensis, o EEB e suas fases hexano, diclorometano e acetato de etila foram submetidos aos métodos fotocolorimétricos in vitro de sequestro de radicais livres DPPH e determinação do teor de fenóis, ambos realizados em triplicata.
Para a quantificação dos compostos fenólicos totais nas amostras de roupala paulensis foi utilizado o ensaio de Folin-Ciocalteau com adaptações (Cabral et al. 2009). Para a quantificação dos fenóis totais nas amostras, soluções diluídas em MeOH:H2O (1:1), com concentrações variando entre 10 e 500 μg/mL, foram preparadas a partir das fases extrato e hexano, diclorometano e acetato de etila, e então submetido ao mesmo procedimento descrito para soluções padrão de ácido gálico.
Determinação dos constituintes químicos isolados de Roupala paulensis
Determinação estrutural de Rp-1
Determinação estrutural de Rp-2
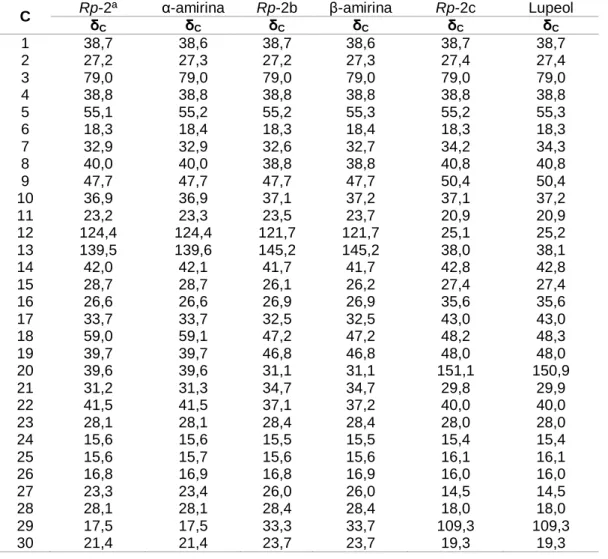
Outros marcadores foram determinados por comparação com dados da literatura e estão resumidos na Tabela 4 (p. 56). Desligar. 28, pág. 61) também podem ser observados íons de fragmentação com m/z 189 e 207, característicos da fragmentação de triterpenos com esqueleto lupano com substituição OH na posição 3 (CARVALHO et al., 2010). Assim, após a análise desses dados, juntamente com a comparação com dados da literatura, foi confirmado que Rp-2 consistia em uma mistura dos triterpenos urs-12-en-3β-ol (Rp-2a), olean -12 - en-3β-ol (Rp-2b) e 3β-hidroxi-lup-20(29)-eno (Rp-2c), mais conhecidos como α-amirina, β-amirina e lupeol, respectivamente.
Quando misturadas, essas duas substâncias também apresentaram atividade antinociceptiva em estudos com ratos (LIMA JUNIOR et al., 2007) e efeitos ansiolíticos e antidepressivos (ARAGÃO et al., 2006). Estudos demonstraram que o lupeol possui atividade antitumoral em células de câncer de próstata in vivo, inibindo o potencial proliferativo das células por meio da modulação do nível de expressão de genes relacionados à proliferação e sobrevivência desse tipo celular (SALEEM et al., 2009).

Determinação estrutural de Rp-3
Determinação estrutural de Rp-4
45, pp. 78 e 79), foram observados sinais intensos e duplicados, confirmando as suposições obtidas nos espectros de 1 H NMR de que o composto codificado como Rp-4 era uma mistura de duas substâncias, ambas exibindo o mesmo esqueleto de carbono. Como os derivados de porfirina podem ser do tipo a ou b, para realizar esta classificação, foram observados deslocamentos químicos em δH 3,24 e 3,23 (ambos s, 3H), permitindo classificar os dois derivados de porfirina da mistura ( Rp-4a e Rp- 4b) como tipo a, pois correspondem aos átomos de hidrogênio do grupo metil na posição 71. Confirmado pela ausência de sinais em cerca de δH 11,00 referentes ao hidrogênio do grupo aldeído em C-71 dos derivados porfirínicos do tipo b , e reforçaram essa classificação (BUCHANAN; HASHIMOTO; ASAKAWA, 1996; SCHWIKKARD; MUKHOLLAND; HUTCHINGS, 1998).
O envelope de sinal na imagem δH dos hidrogênios CH, CH2 e CH3 das cadeias alifáticas indica a presença de um grupo fitila (-C20H39), que geralmente é encontrado em moléculas de porfirina. Os derivados de porfirina são mais frequentemente encontrados na natureza com um anel E do tipo ciclopentanona. O sinal intenso em δC 192,1 (C-131 de ambos os compostos), bem como os sinais em δC 89,1 e 88,4 (C-132 para Rp-4b e Rp-4a, respectivamente) nos permitiram confirmar a estrutura do tipo ciclopentanona com uma hidroxila em C-132 para o anel E dos dois derivados de porfirina da mistura.
Confirmado com desvios químicos mostrados nos espectros de 1 H NMR em 8 H 5,54 e 5,33, pois correspondem aos hidrogênios hidroxila de Rp-4a e Rp-4b, respectivamente. Como todos os deslocamentos químicos dessa mistura de feofitinas eram ora intensos ora duplicados, a análise dos dados dos espectros de RMN 1H e 13C nos permitiu deduzir que Rp-4 é uma mistura de diastereoisômeros R e S, como já relatado por Nakati et al.(1981) e Kobayashi et al.(1991). Portanto, com base nos dados dos espectros de 1 H e 13 C NMR, bem como em comparações com dados da literatura, foi possível identificar Rp-4 como uma mistura de 132-hidroxi-(132-R)-feofitina a e 132-hidroxi -( 132-S)-feofitina a.

Determinação estrutural de Rp-5
Determinação estrutural de Rp-6
Avaliação da atividade antioxidante e quantificação do teor de fenólicos
Como esperado, dentre as fases testadas, a fase acetato de etila apresentou a maior concentração de compostos fenólicos, o que provavelmente é responsável pelos melhores resultados de atividade antioxidante apresentados no teste DPPH realizado. Se relacionarmos esses resultados com o estudo fitoquímico realizado com o EEB e a fase acetato de etila da Camisala paulensis, é possível confirmar a maior atividade da fase acetato de etila da qual foi isolado o flavonoide quercetina, sendo esta fase uma fonte promissora para o isolamento de outros compostos fenólicos, incluindo outros flavonóides. Além de uma mistura de três triterpenos e uma mistura de dois derivados de porfirina, quatro substâncias foram isoladas por meio de pesquisas fitoquímicas das partes aéreas de Camisala paulensis.
O estudo da atividade oxidante pelo método de sequestro do radical DPPH mostrou maior atividade do EEB, seguido da fase acetato de etila. A quantificação de fenóis totais mostrou maior concentração de compostos fenólicos na fase acetato de etila, fator associado aos melhores resultados apresentados no teste DPPH da fase acetato de etila entre as fases testadas. E também submete a BSE, as fases e substâncias isoladas da Camisala paulensis a outros testes farmacológicos com o objetivo de descobrir novas atividades biológicas potenciais, como testes para avaliação da atividade antimicrobiana já relatados na literatura para outras espécies da família Proteaceae.
Viper and cobra venom neutralization by β-sitosterol and stigmasterol isolated from the root extract of Pluchea indica Less. Mechanisms underlying the inhibitory effects of the pentacyclic triterpene α-amyrin in mouse skin inflammation induced by the phorbol ester 12-O-tetradecanoylphorbol-13-acetate. Simultaneous determination of chlorogenic acid, caffeic acid and caffeine in hydroalcoholic and aqueous extracts of Ilex paraguariensis by HPLC and correlation with the antioxidant capacity of the extracts by DPPH· reduction.
A study of the chemical constituents of Roupala montana and an approach to the synthesis of trans-2-(trans-1-cis-3-hexadienyl)-5-methyltetrahydrofuran. Potential antitumour-promoting activity of lupine-type triterpenoids from the stem bark of Glochidion zeylanicum and Phyllanthus flexuosus.