Giulia Mastrorosa Nascimento DIRETRIZES PARA FARMACÊUTICOS: GERENCIAMENTO DE RISCOS NA DISTRIBUIÇÃO E TRANSPORTE DE MEDICAMENTOS E PRODUTOS MÉDICOS. O Comitê Assessor de Distribuição e Transporte do Conselho Regional de Farmácia do Estado de São Paulo (CRF-SP), por meio do Grupo de Trabalho de Gestão de Riscos (GR), elaborou este manual com o objetivo de transferi-lo de forma simples e prática caminho. conceitos básicos, metodologia e aplicabilidade do GR para distribuidores e transportadoras. Este manual mostra a importância da utilização do GR para distribuidores e transportadores de produtos farmacêuticos e outros produtos de interesse à saúde, pois auxilia efetivamente o farmacêutico na tomada de decisões, reduzindo riscos e promovendo a garantia da qualidade e segurança dos produtos na cadeia logística.
Passos para construção do procedimento de gerenciamento de riscos utilizando a análise de modos e efeitos de falha (FMEA) 5. O gerenciamento de riscos (GR) caracteriza-se como um método que utiliza ferramentas para as tarefas de análise, avaliação, controle e monitoramento dos riscos associados a um determinado produto ou processo, com o objetivo de evitar erros nos processos logísticos e nas condições de armazenamento e manuseio, reduzindo riscos à segurança, qualidade e eficácia dos produtos farmacêuticos e de saúde¹. Em termos de processos, a GR tornou-se tendência e ao longo dos anos consolidou-se em toda a cadeia logística.
Servir como ferramenta de tomada de decisão para farmacêuticos que atuam na cadeia logística; Para tal, o farmacêutico deve cumprir as Boas Práticas de Armazenamento, Distribuição e Transporte (SDP) e manter um sistema de gestão de qualidade em vigor. É possível e benéfico aplicar GR em todas as etapas da cadeia logística para reduzir os fatores acima.
A administração da companhia deve nomear os profissionais responsáveis, determinar a política para determinação dos critérios de aceitabilidade dos riscos, bem como estabelecer uma revisão periódica das atividades de gerenciamento de riscos para garantir sua adequação e eficácia.
APLICABILIDADE DO GR NA CADEIA FARMACÊUTICA
2 DEFINIÇÕES
Registro: documento físico ou eletrônico que evidencia dados, fatos, eventos específicos e resultados alcançados quanto ao cumprimento dos procedimentos e padrões do sistema de qualidade.
3 GERENCIAMENTO DE RISCO
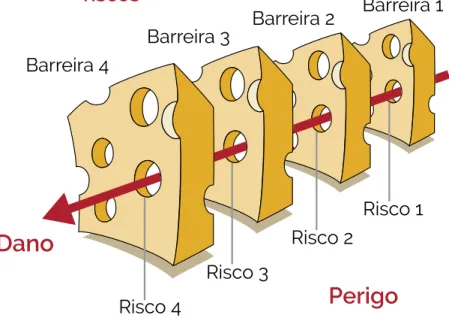
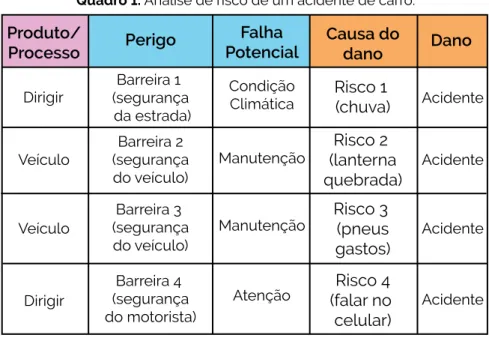
Barreira 4
Dano
PerigoAlinhamento dos
Barreira 2 Barreira 1
Política de qualidade: este é um dos primeiros itens definidos quando a empresa começa a implementar o SGQ, assim como a missão, visão e valores. Envolvimento da alta direção para conscientizar os colaboradores de que as áreas “qualidade” e “regulação” devem estar unidas para o sucesso dos processos, para evitar retrabalhos que acarretarão maiores custos desnecessários; Análise de riscos e pontos críticos de controle – entre outros HACCP (HACCP, Análise de Perigos e Pontos Críticos de Controle).
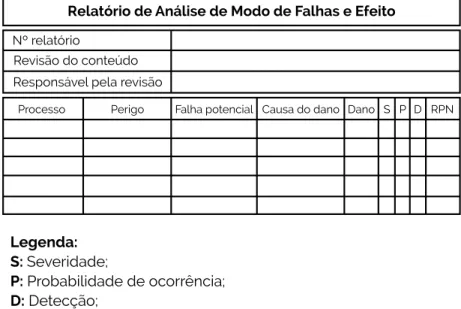
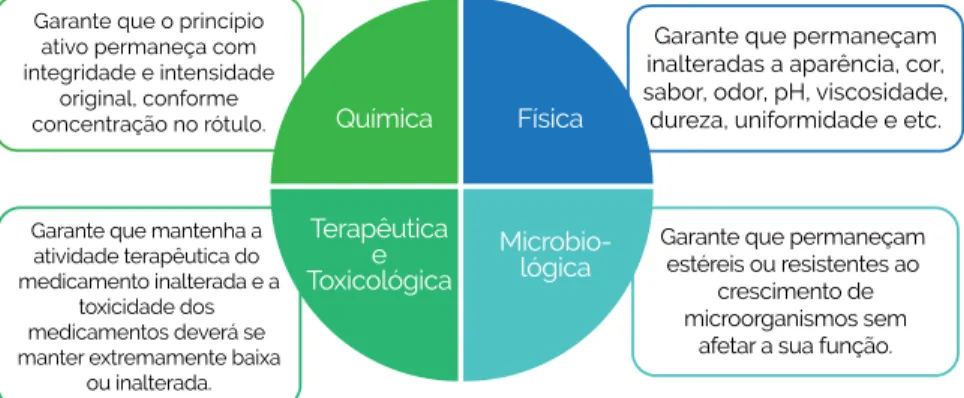
O Ponto Crítico de Controle (PCC) é a ferramenta através da qual o controle pode ser aplicado nos processos e é essencial para prevenir, eliminar ou reduzir um risco a níveis aceitáveis. A FMEA deve sempre ser aplicada quando falhas indicarem danos e riscos potenciais para o usuário final do produto. É um documento editável, pois novos modos de falha podem ser introduzidos dependendo da avaliação dos resultados do monitoramento, de novas regulamentações e do feedback do cliente (indicando problemas no processo).
No caso de detentores de registro de produto, deverão ser incluídos comentários de clientes indicando problemas com o produto (reclamações do produto). Deve-se projetar o fluxo, identificar os pontos críticos e possíveis falhas que podem acontecer com as pessoas envolvidas na GR (deve-se formar e treinar uma equipe), verificar as condições adequadas de armazenamento e os fatores que podem afetar o fluxo. deve ser identificada a integridade do produto. Determinar a ferramenta de GR a ser utilizada, planejar e definir como será processado o plano de GR e sua execução.
Para esta fase, sugerimos a criação de um POP dentro do SMC da empresa, no qual você descreve as atividades a serem seguidas para a gestão do GR. Descrição de como será realizada a identificação, determinação da gravidade e probabilidade de ocorrência dos riscos e detecção (se necessário), determinação dos critérios de aceitabilidade dos riscos (Risk Priority Number - RPN) e a forma como serão ser monitorado, controlado e revisado, os relatórios de análise foram preparados e o processo GR foi registrado, etc. No caso de importador registrado, o GR inclui a fase de pós-comercialização, pois assume a responsabilidade por todo o ciclo de vida do produto como fabricante.
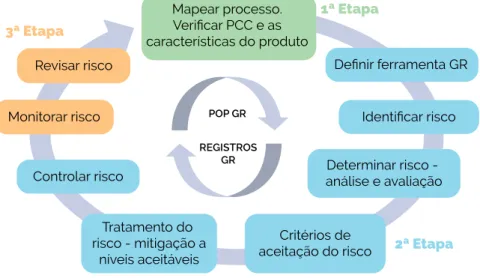
O monitoramento e a periodicidade da avaliação de riscos deverão estar descritos no POP mencionado acima, bem como nos documentos nos quais será registrado. Veja a figura 5 abaixo para as etapas para implementação da ferramenta GR dentro do SGQ. Para o tratamento do risco, a tomada de decisão inclui avaliações do impacto e da probabilidade de ocorrência desse risco. É importante que todas as partes interessadas discutam cada risco para melhor avaliar a aceitação do risco residual, ou seja, o risco a ser mitigado. porém não completamente eliminado.
4 ETAPAS PARA CONSTRUÇÃO DO
PROCEDIMENTO DE GR COM APLICAÇÃO DO FMEA
Severidade;
Probabilidade de ocorrência;
Detecção;
A cada causa deve ser atribuído um peso numérico que indique a probabilidade dessa causa (Tabela 4). Cada controle deve ser testado para determinar quão boa é sua capacidade de reconhecer ou detectar modos de falha. A utilização ou não da detecção dependerá dos critérios definidos pela empresa e do tipo de produto ou processo.
Portanto, cabe ao grupo CA, em conjunto com a gestão executiva, definir se a detecção será incluída no cálculo que chamamos de Número de Prioridade de Risco (RPN) ou não. Remoto: Improvável que aconteça, mas possível durante o processo. Ocasional: Isso provavelmente acontecerá em algum momento durante o processo. No nosso exemplo, estipulamos um índice de 1 a 75, que é obtido multiplicando-se “gravidade do dano”, “níveis de probabilidade de um perigo causar dano” e a.
Um risco que pode ser considerado aceitável/tolerável se for escolhido um conjunto de medidas para controlá-lo. Formulários de qualidade como RNC (Relatório de Não Conformidade), RP (Reclamação de Produto), CAPA, etc. podem ser utilizados para alimentar o FMEA. De acordo com o número de riscos prioritários alcançados, deve ser dada prioridade àqueles cujo número é maior, ou seja, o risco é maior e são considerados inaceitáveis.
Plano de ação: a ser definido juntamente com o tipo de falha e relatório de análise de impacto com base em medidas de mitigação. Envio de relatórios GR: O relatório de perigo e a análise de erros potenciais são concluídos para cada verificação de risco e todas as revisões do relatório de análise de risco devem ser aprovadas.
5 CONSIDERAÇÕES FINAIS
6 BIBLIOGRAFIA
ENDEREÇOS E TELEFONES