CUIDADO Um conceito importante que não pode ser omitido em nenhum momento é que o calor e o trabalho nunca são armazenados em nenhum corpo ou sistema: apenas. A temperatura, como veremos mais detalhadamente adiante, está intimamente relacionada à energia de um corpo ou sistema. Então dizemos que o calor sempre vai de um corpo com temperatura mais alta para outro corpo com temperatura mais alta para a transferência de energia na forma de calor.
O calor, que é uma variável de processo como o trabalho, nunca é armazenado em um corpo ou sistema: ele existe apenas como energia em trânsito. No primeiro caso, o calor transferido é denominado calor sensível; no segundo caso é chamado de calor latente. Como forma de energia, a unidade de calor também é o joule (J) ou o quilojoule (kJ), embora historicamente tenham sido.
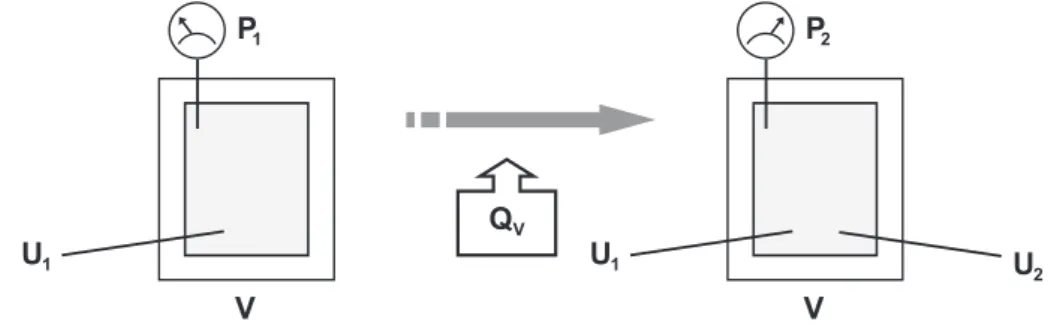
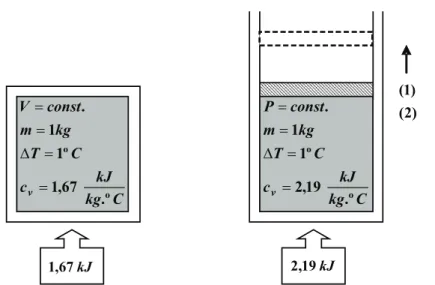
Condução: transferência de calor da parte quente de um corpo para a parte fria, sem movimento visível de qualquer parte deste corpo. Radiação: transferência de calor entre sistemas que não estão em contato por ondas eletromagnéticas. A figura acima representa um processo isovolumétrico, onde QV denota uma transferência de calor realizada a volume constante.
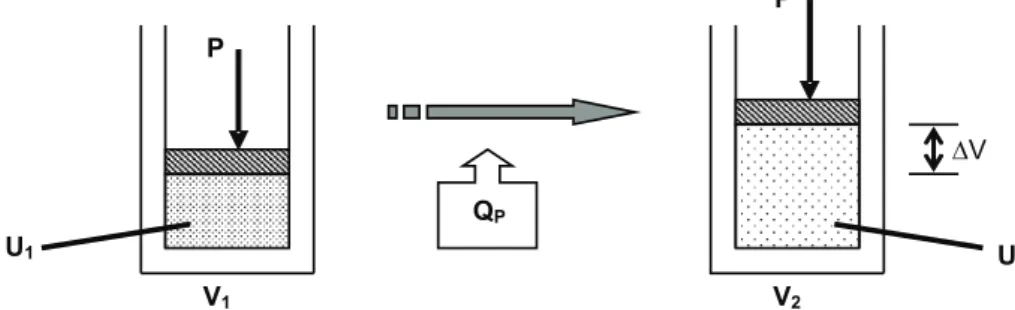
A figura a seguir, por sua vez, mostra um processo isobárico, onde QP indica uma transferência de calor realizada a pressão constante.
C alor e speCíFiCo
O cp é sempre maior que o cv porque o sistema pode se expandir a pressão constante, e a energia para esse trabalho de expansão pode ser fornecida ao sistema. O termo do lado esquerdo desta equação (δQ-δWother) representa a quantidade de energia transferida para o sistema na forma de calor ou trabalho. O cv refere-se a mudanças na energia interna de uma substância por unidade de mudança de temperatura a volume constante.
cp pode ser definido como a variação de entalpia de uma substância por unidade de variação de temperatura a pressão constante. Em outras palavras, cv é uma medida da variação da energia interna de uma substância com a temperatura, e cp é uma medida da variação da entalpia de uma substância com a temperatura. A razão do calor específico, K, também chamada de fator isentrópico, por definição a razão do calor específico a pressão constante dividida pelo calor específico a volume constante.
Embora R seja constante, cv varia com a temperatura, então K depende da temperatura. Entretanto, se para um dado processo envolvendo gases ideais, o calor específico for considerado constante, então K = constante. Além disso, como os calores específicos aumentam com a temperatura, a razão K entre eles é uma função menos pronunciada da temperatura do que cp e cv sozinhos.
Muitos gases diatômicos (gás que consiste na ligação de dois átomos, por exemplo, H2, N2, O2), incluindo o ar, têm uma relação de calor específico de cerca de 1,4 à temperatura ambiente.
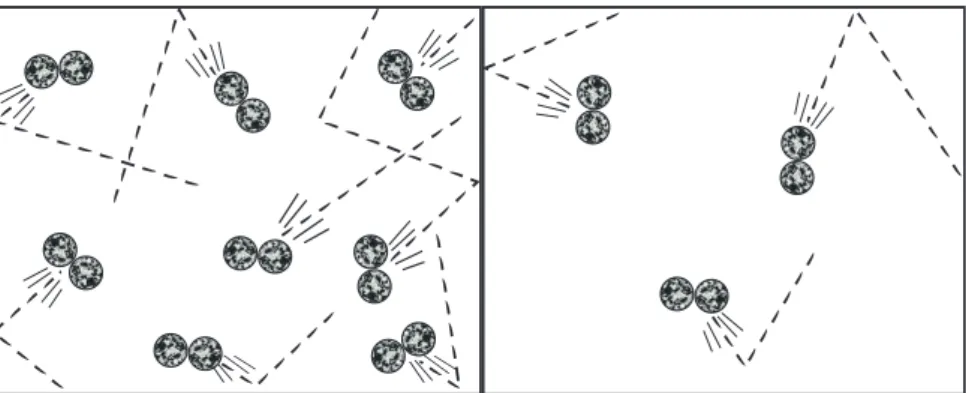
Um gás consiste em um número muito grande de moléculas, que estão relativamente distantes umas das outras no espaço vazio. As moléculas de um gás estão em movimento contínuo, desorganizado e muito rápido, muitas vezes esbarrando umas nas outras e também colidindo com as paredes internas do recipiente em que se encontram. A pressão de um gás é resultado dessa colisão contínua de moléculas contra as paredes internas do recipiente e é igual em todas as direções.
Quanto maior o volume de gás dentro de um recipiente, significa que há mais moléculas de gás ocupando aquele espaço (ou volume). Quanto maior a quantidade de gás que ocupa um espaço (ou volume), mais comprimido (ou pressurizado) o gás está, e maior a pressão. A área das paredes internas do recipiente também é menor e há menos espaço para as moléculas se movimentarem.
Quando um gás é comprimido ou pressurizado em um recipiente (como em um pneu cheio), a pressão dentro do recipiente é maior que a pressão externa. No entanto, embora a expansão de um gás possa ocorrer continuamente (na verdade, até que sua pressão absoluta seja igual a zero), nem sempre ele pode se comprimir. Além disso, se o gás for mantido dentro de um volume fechado, quando a temperatura do gás aumenta, a maior quantidade de calor causa maior movimentação das moléculas.
Para uma pressão constante: ↑ Temperatura do gás = ↑ volume No estado gasoso, o volume de uma amostra é determinado pelo volume interno do recipiente no qual ela está contida. Portanto, o volume de um gás só reflete a quantidade de matéria se as condições de pressão e temperatura forem especificadas. Outro conceito básico é o de fluxo, entendido como o movimento de um gás de uma área de alta pressão para uma área de baixa pressão.
Se a válvula no tubo que liga os dois recipientes for aberta, o gás flui do recipiente "A" para o recipiente "A". Podemos medir a quantidade de gás que passa pela válvula em um determinado intervalo de tempo e em uma determinada direção. Como se vê, a medida da quantidade de gás que "vaza" ou escoa, neste caso, é dada em volume (metro cúbico ou pé cúbico) por unidade de tempo - é o chamado vazão volumétrica.
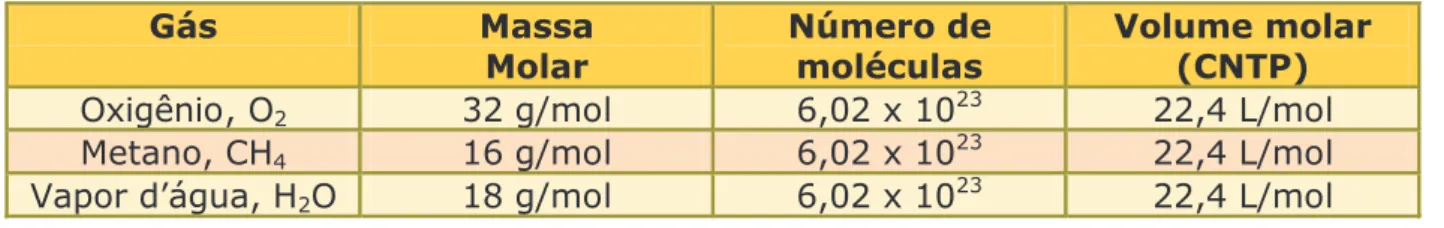
Porém, à medida que a diferença entre as pressões "A" e "B" diminui gradualmente, o fluxo de gás, por sua vez, também diminui gradualmente. SAIBA MAIS O Princípio de Avogadro, ou Lei de Avogadro, recebeu esse nome em homenagem ao físico italiano Lorenzo Romano Amedeo Carlo Avogadro, um dos primeiros cientistas a distinguir entre átomos e moléculas. É importante lembrar que, de acordo com o Princípio de Avogadro, discutido anteriormente, esse volume é o mesmo independente do gás, conforme exemplos da tabela abaixo.
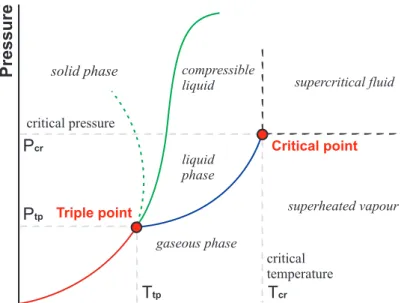
Transformações nas quais mudanças de volume e pressão ocorrem a temperatura constante são chamadas de transformações isotérmicas. Nesse tipo de transformação, em que a temperatura T de uma determinada massa gasosa é mantida constante, o volume V desse gás é inversamente proporcional à pressão P exercida sobre ele. Esta expressão é válida para todos os estados de um dado sistema gasoso fechado que sofreu uma transformação a temperatura constante.
Aumentar a pressão de um gás a temperatura constante faz com que o gás se comprima, reduzindo o volume que ele contém. As transformações a pressão constante de uma determinada massa gasosa em sistemas fechados nos quais o volume e a temperatura mudam são chamadas de transformações isobáricas. Nas transformações onde não há variação de volume, transformações isocóricas ou isovolumétricas, a pressão do gás é diretamente proporcional à temperatura absoluta.
Isso significa que, se tivermos um determinado volume de gás em um recipiente inelástico (com parede rígida), o aumento de temperatura se traduzirá em aumento de pressão, pois não há possibilidade de expansão do gás.
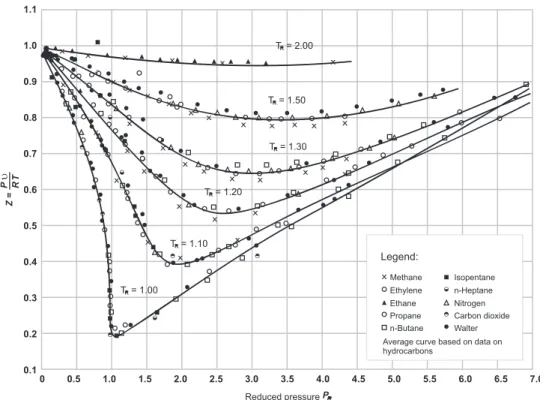
O desvio de um gás em relação ao comportamento de um gás ideal pode ser corrigido inserindo um fator de correlação denominado fator de compressibilidade Z na equação PV=nRT. Também pode ser definido como o volume do gás real dividido pelo volume ocupado pela mesma massa de um gás ideal nas mesmas condições de pressão e temperatura. Fisicamente, o fator de compressibilidade é o desvio ou desvio do comportamento do gás real em relação ao gás ideal e perfeito.
Quanto mais Z estiver da unidade, mais o gás se desviará do comportamento do gás ideal. Para a maioria das medições de fluxo de gás, o fator de compressibilidade raramente é inferior a 0,85; geralmente entre 0,85 e 1,00. Deve-se notar que os gases a baixas pressões e altas temperaturas se aproximam do comportamento dos gases ideais.
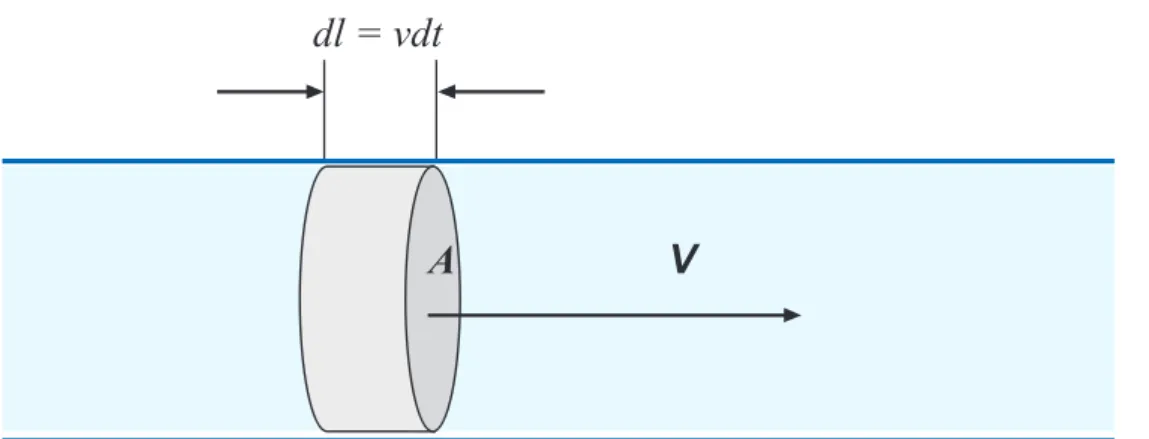
NOTA Ao calcular a medição de vazão de líquidos inteligíveis usando medidores de depressogênese, um fator de correção deve ser introduzido na equação para corrigir as variações de volume causadas pela expansão do líquido após a passagem pelo elemento de fluxo primário. Este fator é chamado de expansibilidade e depende do expoente isentrópico, restrição do elemento sensor de fluxo, razão das pressões antes e depois da restrição e densidade do fluido. Esta é a equação de Bernoulli, que prova que a soma da energia potencial, energia cinética e energia de pressão é constante em um escoamento de um fluido com viscosidade zero e incompressível, em estado estacionário, sem atrito.
A equação de Bernoulli não pode ser usada diretamente para vazões reais, pois na prática há perdas de pressão devido à viscosidade do líquido e à rugosidade do tubo. A aplicação prática da equação de Bernoulli só é possível com a introdução do coeficiente de vazão (C), que por definição é a razão entre a vazão real e a vazão teórica. Para calcular o coeficiente C, o fluxo teórico é calculado com base em medições precisas das dimensões do elemento primógeno, da densidade do líquido e da pressão diferencial.
O fluxo real é medido pelo tempo que leva para encher um determinado volume ou para encher um peso definido de líquido. Fisicamente, pode ser considerado como a relação entre as forças dinâmicas do fluxo de massa e a tensão de cisalhamento devido à viscosidade. O número de Reynolds é de grande importância na teoria do cálculo dos elementos deprimogênicos, pois é um dos parâmetros modificadores dos coeficientes de descarga.
A distribuição de pressão e densidade depende do valor da velocidade local em relação à velocidade do som no fluido. O número de Mach caracteriza os efeitos da compressibilidade em um fluxo e indica se esses efeitos devem ser considerados.