I – elaborar diretrizes para a implantação e funcionamento do Programa Academia da Saúde em nível nacional no SUS; (Origem: PRT MS/GM Art. 8º, I). II - ter profissionais atuando em programa similar conforme lista de códigos CBO descritos no Anexo III, sendo no mínimo 1 (um) profissional com carga horária de 40 (quarenta) horas semanais ou 2 (dois) profissionais com carga horária de carga horária mínima de 20 (vinte) horas semanais cada, que desenvolverão atividades em programa semelhante ao Programa Academia da Saúde; (Origem: PRT MS/GM Art. 25, II).
DA ALIMENTAÇÃO E NUTRIÇÃO
VI - a implantação e implementação do Programa Nacional de Suplementação de Vitamina A em todas as maternidades estaduais; (Fonte: PRT MS/GM 729/2005, Art. 5º, VI). XI - a implantação e implementação do Programa Nacional de Suplementação de Vitamina A em todas as maternidades municipais; e (Fonte: PRT MS/GM 729/2005, Art. 6º, XI).
DA VIGILÂNCIA EM SAÚDE
1º Os diretores referidos neste artigo são responsáveis por indicar seus respectivos representantes suplentes à Coordenação do Comitê de Gestão no prazo de até 30 (trinta) dias contados da data de publicação da Portaria nº. 3.244/GM/MS, de 30 de dezembro de 2011. O suporte administrativo e os meios necessários à realização dos trabalhos do Comitê Gestor e do Comitê Executivo referidos nesta Seção serão fornecidos pela SE/MS.
DA TRIAGEM NEONATAL
I - Fase I - Fenilcetonúria e Hipotireoidismo Congênito: Inclui triagem neonatal para fenilcetonúria e hipotireoidismo congênito, com detecção dos casos suspeitos, confirmação diagnóstica, acompanhamento e tratamento dos casos identificados. II - Serviços de Referência em Triagem/Acompanhamento e Tratamento Neonatal de Doenças Congênitas Tipos I, II ou III.
DO ALEITAMENTO MATERNO
Os Estados e o Distrito Federal devem garantir a execução de todas as fases do processo e para isso devem utilizar a rede de coleta organizada na fase I e organizar/cadastrar serviço(s) de referência Tipo III em triagem/acompanhamento e tratamento neonatal de doenças congênitas que justifiquem triagem, confirmação diagnóstica e também acompanhamento e tratamento adequados dos pacientes triados. Ficam aprovadas as normas de funcionamento e cadastramento dos postos de coleta e serviços de referência para triagem/acompanhamento neonatal e tratamento de doenças congênitas de acordo com o Anexo XXIV.
DA SEGURANÇA DO PACIENTE
Os entes federativos habilitados no programa de Mamografia Móvel devem: (Origem: PRT MS/GM Art. 9º). As características específicas do órgão responsável pela vigilância sanitária estadual são: (Fonte: PRT MS/GM Art. 8º).
DA VIGILÂNCIA EPIDEMIOLÓGICA
V - apoiar a implantação da rede nacional de vigilância da resistência microbiana; (Origem: PRT MS/GM Art. 4º, V). Compete aos centros técnico-científicos de telessaúde na atenção básica: (Origem: PRT MS/GM Art. 8º).
DA ATENÇÃO HOSPITALAR
II - Serviço de Atenção Domiciliar (SAD): serviço complementar aos cuidados prestados na atenção básica e nos serviços de emergência, em substituição ou complementar à internação hospitalar, responsável pelo gerenciamento e funcionamento das equipes multiprofissionais de atenção domiciliar (EMAD) e equipes multiprofissionais de apoio (EMAP); e (Origem: PRT MS/GM 825/2016, art. 2º, II). II - identificar, orientar e capacitar a(s) equipe(s) assistencial(es) do usuário assistido, envolvê-la na realização do cuidado, respeitar seus limites e potencialidades, considerá-la(s) sujeito(s) do processo; (Origem: PRT MS/GM 825/2016, art. 7º, II). I - população municipal igual ou superior a 20.000 (vinte mil) habitantes, com base na última população estimada pelo Instituto Brasileiro de Geografia e Estatística (IBGE); (Origem: PRT MS/GM 825/2016, art. 25, I).
DA ASSISTÊNCIA FARMACÊUTICA
A política de redução de doenças e agravos não transmissíveis deve visar: (Fonte: PRT MS/GM Art. 2º). I - um representante do Departamento de Ações Programáticas Estratégicas (DAPES/SAS/MS); (Fonte: PRT MS/GM Art. 1º, parágrafo único, I). V - um representante da Secretaria de Ciência, Tecnologia e Insumos Estratégicos (SCTIE/MS); (Fonte: PRT MS/GM Art. 1º, parágrafo único, V).
DA ATENÇÃO ONCOLÓGICA
I - serviço de referência para atendimento integral à mulher em situação de violência sexual; (Origem: PRT MS/GM 485/2014, Art. 4º, I). II - Serviço de referência para atendimento integral a adolescentes em situação de violência sexual; (Origem: PRT MS/GM 485/2014, art. 4º, II). III - Serviço de referência para atendimento integral à criança em situação de violência sexual; (Origem: PRT MS/GM 485/2014, Art. 4º, III).
DA ORGANIZAÇÃO DO SUS
Compete ao Ministério da Saúde e às secretarias de saúde estaduais, municipais e do distrito federal: (Fonte: PRT MS/GM Art. 6º). O programa de bolsas de educação pelo trabalho terá a seguinte abrangência: (Fonte: PRT MS/GM Art. 4º). 762 devem atender aos seguintes requisitos para participação no componente I do ProgeSUS: (Fonte: PRT MS/GM Art. 4º-A).
DAS TECNOLOGIAS EM SAÚDE
I - Departamento do Complexo Industrial e Inovação em Saúde do Departamento de Ciência, Tecnologia e Insumos Estratégicos do Ministério da Saúde (DECIIS/SCTIE/MS); (Origem: PRT MS/GM Art. 2º, I). II - Departamento de Vigilância de Doenças Transmissíveis da Secretaria de Vigilância em Saúde do Ministério da Saúde (DEVIT/SVS/MS); (Origem: PRT MS/GM Art. 2º, II). Incumbe à Secretaria de Ciência, Tecnologia e Insumos Estratégicos do Ministério da Saúde (SCTIE/MS): (Fonte: PRT MS/GM Art. 4º).
DAS DISPOSIÇÕES FINAIS
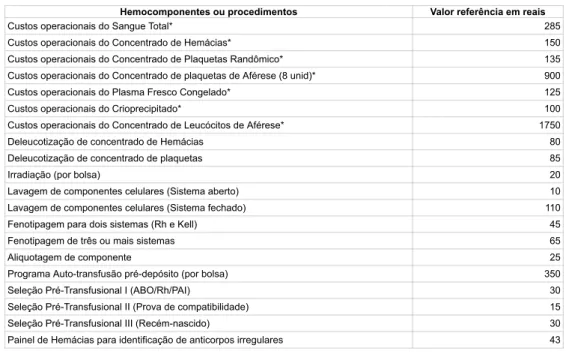
XXVI - Procedimentos Operacionais (OP): documentos detalhados baseados em processos e procedimentos que refletem a prática atual da instituição e visam à sua padronização, apresentados, geralmente, em módulos, além da inclusão de “Boas Práticas de Fabricação (BPF)” atividades)” e as especificações necessárias; (Origem: PRT MS/GM 158/2016, Art. 5º, XXVII). I - tenho evidência clínica ou laboratorial de infecções transmitidas por transfusão de sangue; (Origem: PRT MS/GM 158/2016, Art. 62, I). A liberação de unidade de sangue ou hemocomponente para armazenamento em outro serviço de hemoterapia será feita: (Origem: PRT MS/GM 158/2016, Art. 173).
Os registros de produção de hemocomponentes contêm os seguintes dados: (Origem: PRT MS/GM 158/2016, art. 234). I - data de entrada dos hemocomponentes no serviço de hemoterapia que realizou a liberação para transfusão; (Origem: PRT MS/GM 158/2016, Art. 236, I).
DA GARANTIA DA QUALIDADE
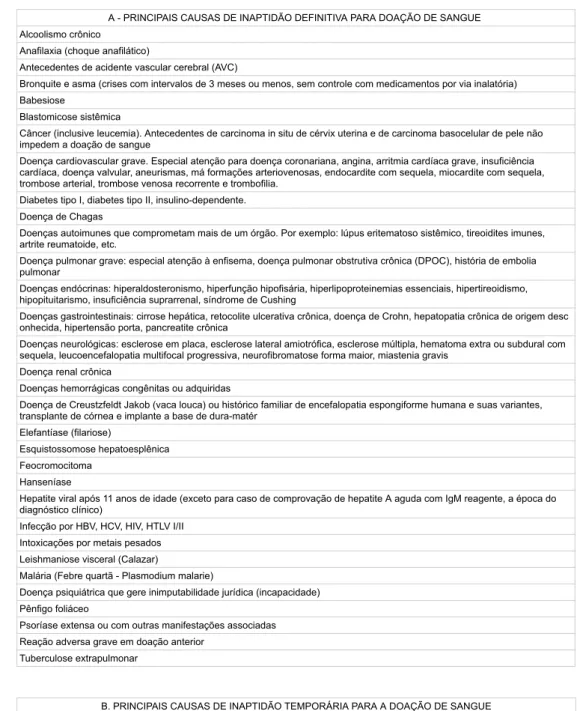
PRINCIPAIS CAUSAS DE INAPTIDÃO TEMPORÁRIA PARA A DOAÇÃO DE SANGUE Causas de inaptidão temporária Tempo de inaptidão
Piercing, tatuagem ou maquiagem definitiva 6 meses após o procedimento; 12 meses se não houver condição de avaliar a segurança do procedimento realizado; se houver na cavidade oral e/ou na região genital, por risco permanente de infecção, a inadequação é de 12 meses a partir da retirada.
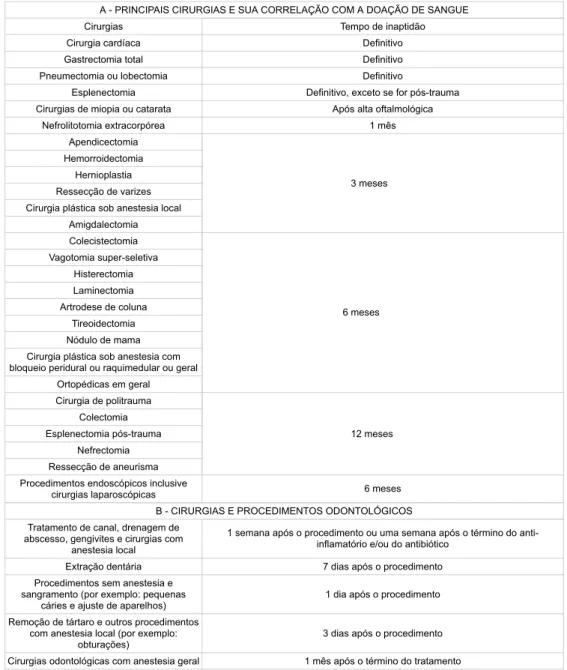
DO ANEXO IV
DO ANEXO IV
DO ANEXO IV
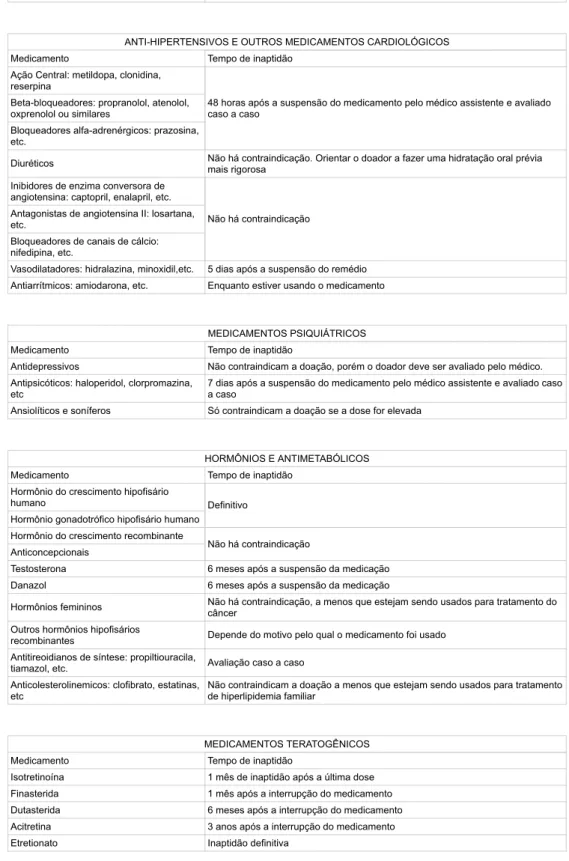
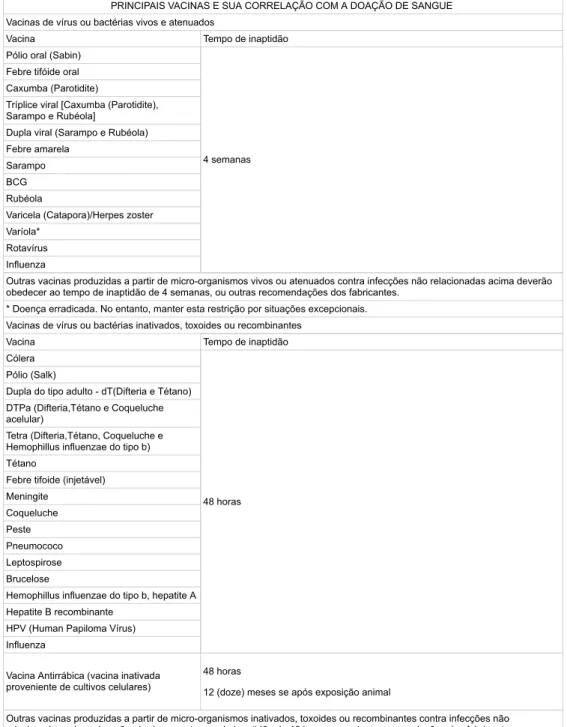
Outras vacinas produzidas a partir de microorganismos vivos ou atenuados contra infecções não listadas acima devem cumprir o período de carência de 4 semanas ou as recomendações de outros fabricantes. Outras vacinas produzidas a partir de microorganismos inativados, toxóides ou recombinantes contra infecções não listadas acima devem obedecer ao período de carência de 48 horas ou às recomendações de outros fabricantes. No caso de uso de vacinas que ainda estejam em processo de registro, considerar inaptas por 1 (um) ano após o término do protocolo vacinal.
DO ANEXO IV
A vacinação para hepatite A (inativada) e B (recombinante) é considerada inadequada por 48 horas se não estiver relacionada à exposição ao vírus. No caso de utilização de vacinas em situação de contenção de surtos, o período de incapacidade será relacionado com o período de incubação da doença. No caso de sujeitos participantes de ensaios clínicos para vacinas, considerar inaptos por 1 (um) ano após o término do protocolo vacinal.
DO ANEXO IV
Preparação de plasma rico em plaquetas inferior a 2,0 x 10e8/unidade Preparação de revestimento leucocitário inferior a 0,5 x 10e8/unidade. O parâmetro volume deve ser avaliado mensalmente em todas as unidades produzidas, os demais em 1% da produção ou 4 (quatro) unidades (o que for maior). O parâmetro volume deve ser avaliado em todas as unidades produzidas, as demais em 1% da produção ou 4 unidades (o que for maior), em unidades com no máximo 30 (trinta) dias de estocagem, nos meses de produção.
DO ANEXO IV
Pode ser avaliada pela intensidade de aglutinação do soro não diluído com hemácias contendo os antígenos relevantes. Intensidade de aglutinação esperada e parâmetros de titulação para fenótipos de hemácias de anti-soro anti-RhD. Pode ser estimada pela intensidade da aglutinação de AGH com hemácias RhD-positivas (preferencialmente R0r Dccee) sensibilizadas com anticorpos da classe IgG após adsorção (plasma humano com anti-RhD comercial ou soro anti-RhD policlonal). diretamente Coombs) com nem.
DO ANEXO IV
3º O controle interno de qualidade (CQI) é realizado com o objetivo de demonstrar a perda de sensibilidade dos testes, identificar variações lote a lote e embarque a embarque e detectar erros aleatórios ou sistemáticos. 1º O Controle Positivo Interno de Qualidade (CQIP) é obtido ou produzido de acordo com os critérios de boas práticas. 3º Os ensaios das amostras dos painéis de controle externos serão realizados nas mesmas condições e com os mesmos procedimentos adotados na rotina, de acordo com as orientações do fornecedor.
DO ANEXO IV
4. Produção de CQIP para métodos imunoenzimáticos (EIE), quimioluminescência (QLM) e métodos de floculação (VDRL/RPR) para testes anti-HIV1/2, HBsAg, anti-HBc, anti-HCV, anti-HTLV I/II, Chagas e sífilis serão específicos de cada metodologia. 7º Recomenda-se que a determinação do coeficiente de variação (CV) específico para cada sistema analítico seja medida dentro e entre os testes. O controle de qualidade interno positivo (CQIP) pode ser produzido de acordo com critérios de boas práticas ou adquirido.
DO ANEXO IV
Os resultados do CQIP devem ser monitorados em todas as rotinas e atender aos critérios de aceitação pré-definidos. Resultados diferentes dos esperados devem ser analisados quanto às suas causas (erros técnicos, equipamentos, reagentes, entre outros) e medidas corretivas devem ser implementadas, se necessário. O teste de amostras de painéis de controle externos deve ser realizado nas mesmas condições e com os mesmos procedimentos aprovados rotineiramente, de acordo com as instruções do fornecedor.
DO ANEXO IV
I - certificar os fornecedores de matérias-primas quanto aos procedimentos operacionais adotados pelos serviços de hemoterapia, segundo os critérios estabelecidos pela legislação vigente, respeitando a periodicidade prevista na legislação sanitária vigente; e (Origem: PRT MS/GM 158/2016, anexo 11, art. 6º, § 2º, I). II - apresentar relatório circunstanciado da avaliação dos serviços de hemoterapia ao CGSH/DAHU/SAS/MS para reconhecimento e autorização de entrega em até 30 (trinta) dias da consulta. 4e O relatório de não aprovação servirá para ações de melhoria dos serviços de hemoterapia para qualificação do plasma.
DO ANEXO IV
5. Para a retirada de plasma dos serviços de hemoterapia autorizados, a indústria produtora em conjunto com o fornecedor determinará o cronograma de retirada do excesso de plasma de uso terapêutico. 7. O SINASAN incentivará os serviços de hemoterapia a buscar qualificação para a produção de plasma, de forma a atender o interesse nacional na produção de hemoderivados, sem interferir na terapêutica. Art. 8º Quando houver necessidade de exportação temporária de plasma para fins de processamento no exterior, a indústria que realizará o procedimento deverá requerer autorização de exportação temporária de plasma da CGSH/DAHU/SAS/MS antes de solicitar alvarás sanitários e demais providências necessárias.
DO ANEXO IV
DO ANEXO IV
DO ANEXO IV
DO ANEXO IV
DO ANEXO IV
DO ANEXO IV
DO ANEXO IV
DO ANEXO IV
DO ANEXO IV
Membro do conselho técnico de assessoria de empresas fabricantes de medicamentos, vacinas, exames laboratoriais ou outros equipamentos e tecnologias que integrem ou possam integrar protocolos utilizados em atividades na área de sangue e hemoderivados: (nome. Por fim, comprometo-me perante o CGSH/ SAS/MS a ocorrência de qualquer alteração posterior em sua situação de conflito de interesses, para conhecimento e avaliação.
DO ANEXO IV
DO ANEXO IV
DO ANEXO IV
DO ANEXO IV
DO ANEXO IV
- DADOS DO ESTABELECIMENTO
- DADOS PESSOAIS
- DADOS ESPECÍFICOS QUANTO AO PROGRAMA DE VOLTA PARA CASA (DADOS NÃO OBRIGATÓRIOS) -Tipo de Moradia: Serviço Residencial Terapêutico; Moradia com Familiares; Mora Sozinho ou Outro
- JUSTIFICATIVA
- ÁREAS PRIORITÁRIAS PARA O DESENVOLVIMENTO DO PROJETO
- OBJETIVOS 1 OBJETIVO GERAL
- OBJETIVOS ESPECÍFICOS
- ESTRATÉGIAS OPERACIONAIS
- METODOLOGIA
- MONITORAMENTO E AVALIAÇÃO
A Comissão de Acompanhamento do Programa “De Volta Para Casa” é responsável por definir estratégias de acompanhamento e avaliação da execução do programa junto aos Municípios. O gráfico do Índice de Acidentes de Trânsito (Anexo II) mostra o índice construído e aplicado nas cidades e aglomerações urbanas priorizadas no Projeto, que abrangerá 84 municípios em 26 regiões metropolitanas de 14 estados, atingindo uma população total de residentes, conforme demonstrado na Tabela de Áreas Metropolitanas Prioritárias (Anexo I). HABILIDADES E ATRIBUTOS RELACIONADOS À IMPLEMENTAÇÃO/GESTÃO DO PROGRAMA NACIONAL DE ATENDIMENTO COMUNITÁRIO INTEGRADO A USUÁRIOS DE ÁLCOOL E OUTRAS DROGAS (Fonte: PRT MS/GM Anexo 1) HABILIDADES.