A estrutura atômica da matéria
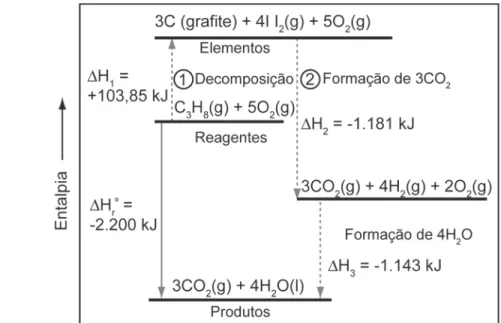
Dentro de um mesmo nível existem subníveis de energia, com regiões (orbitais) e quantidades de energia muito específicas; Em outras palavras, se estiverem no mesmo nível de energia (primeiro número quântico), no mesmo subnível de energia (segundo número quântico) e no mesmo orbital (terceiro número quântico), deverão ter spins diferentes (quarto número quântico). . Dentro de um nível de energia podem existir vários subníveis de energia (número quântico secundário);
Ligações químicas
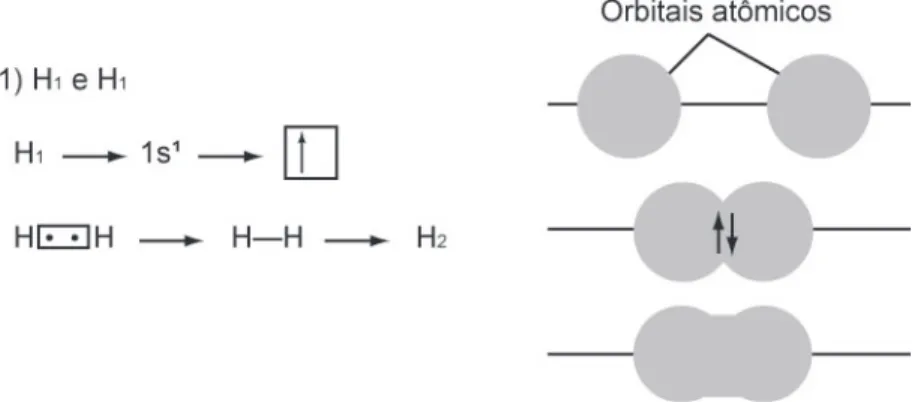
Camada de valência do átomo central com dois pares de elétrons, os orbitais serão orientados 180º um do outro (linear). Camada de valência do átomo central com três pares de elétrons, os orbitais estarão orientados a 120º entre si (trigonal plano). Uma aparente falha na teoria das ligações de valência é a ausência de uma explicação para a capacidade do carbono de formar quatro ligações.

Estequiometria
Se tivermos uma equação balanceada e a massa de um dos reagentes, chegaremos à quantidade de qualquer outro reagente ou produto. A massa de um dos reagentes, os coeficientes estequiométricos, e precisamos chegar à massa de um dos produtos. Neste caso, o dano pode ser causado pelo simples excesso de um dos reagentes.

Reações químicas
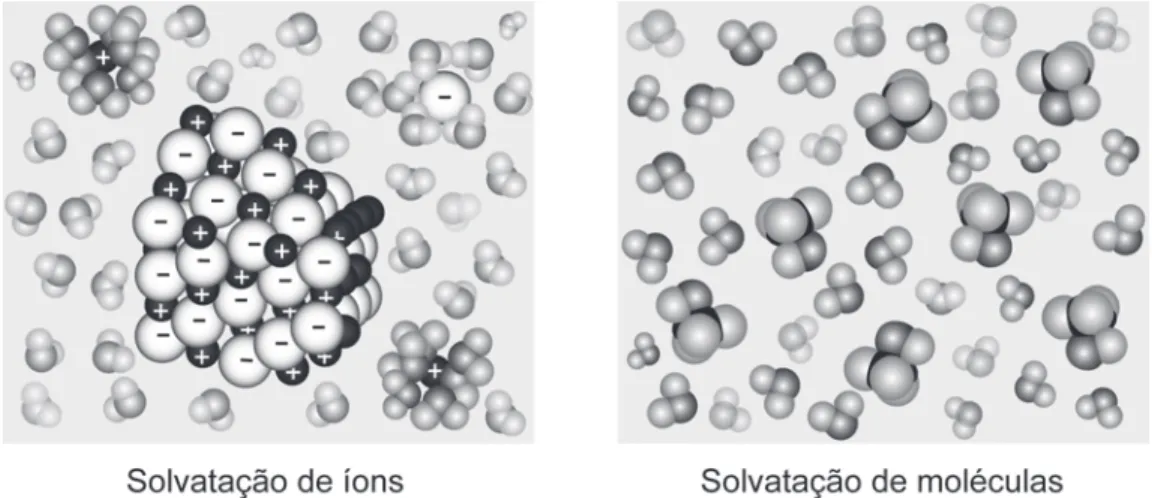
Uma substância cuja solução aquosa contém íons é chamada de eletrólito (por exemplo NaCl), enquanto uma substância que não forma íons em solução. Em geral, só faz sentido falar em reação química em qualquer solução se conseguirmos de alguma forma separar os produtos, caso contrário o que teremos são íons espalhados na solução. Para determinar se se forma um precipitado quando duas soluções são misturadas, é necessário verificar todos os íons presentes na solução e suas combinações, bem como confirmar se alguma dessas combinações forma compostos insolúveis, conforme os valores de solubilidade tabelados.
Portanto, ocorrerá uma dupla reação de troca entre os íons, com precipitação de AgCl e NaNO3 permanecendo em solução. Assim, ácidos e bases fortes são eletrólitos fortes, ou seja, estão completamente ionizados ou dissociados em solução. Ácidos e bases fracos são eletrólitos fracos, ou seja, são parcialmente ionizados ou dissociados em solução.
Se nenhuma das regras anteriores se aplicar, o composto é provavelmente um não eletrólito, ou seja, não se dissocia em solução aquosa. Um fio de zinco mergulhado em uma solução de níquel irá corroer enquanto os depósitos de níquel e a cor azulada da solução diminuem. Quando falamos de reações químicas em solução aquosa, o que nos impressiona imediatamente é a quantidade da substância que está dissolvida na água.
Como exemplo, vamos calcular a concentração, em mol L-1, de uma solução feita de 23,4 g de sulfato de sódio em água suficiente para perfazer 125 mL de solução e a concentração dos íons na solução.
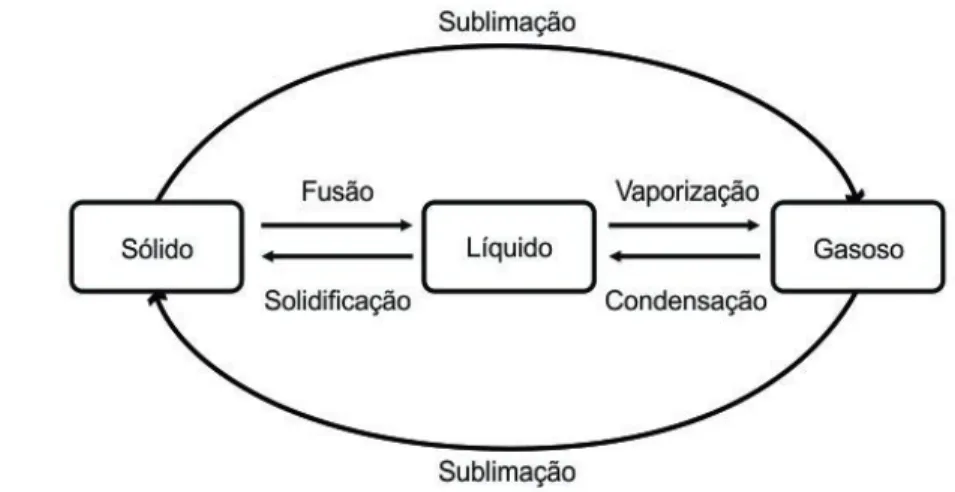
Estados físicos da matéria
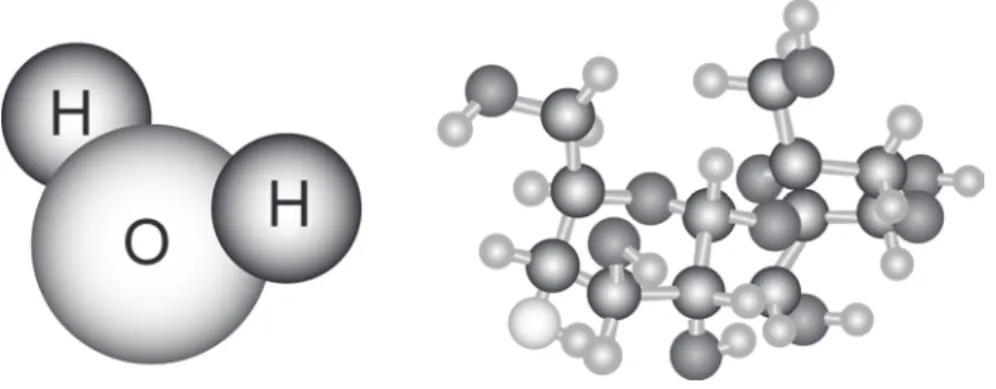
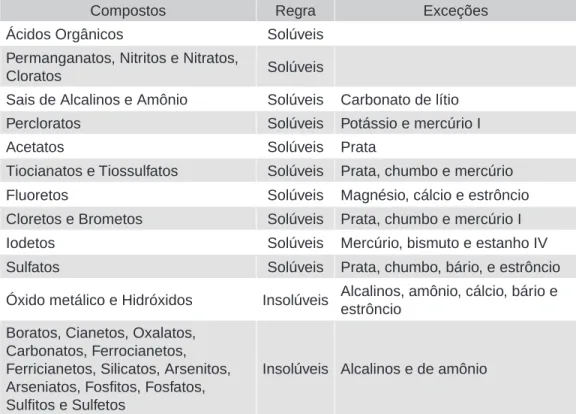
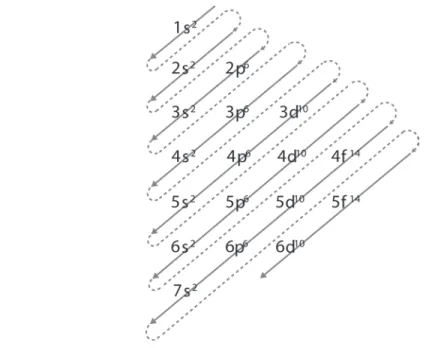
Assim pode-se entender o fato de um sal, como o cloreto de sódio (NaCl), ser um sólido cristalino à temperatura ambiente, conforme mostrado na Parte 2. Porém, este é um caso específico, que não permite explicar por que aparecem moléculas neutras. também à temperatura ambiente como sólidos cristalinos, como é o caso do açúcar (sacarose, C12H22O11). Como o hidrogênio é muito pequeno, ele pode chegar perto o suficiente de um desses átomos eletronegativos para interagir com ele e formar uma ligação polar.
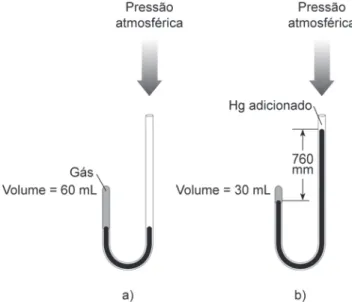
Os vapores ocorrem naturalmente como líquidos em condições ambientais normais; O vapor pode ser extraído de um líquido aquecendo-o ou também reduzindo a pressão sobre ele. A pressão do gás é medida com um manômetro quando o gás está contido em um recipiente fechado, ou com um barômetro quando medido em um recipiente aberto, pois neste caso a pressão atmosférica é levada em consideração. A lei de Boyle-Marriott, mais conhecida apenas como lei de Boyle, diz-nos que, à mesma temperatura, o volume de uma certa quantidade de gás é inversamente proporcional à sua pressão.
A lei de Charles nos diz que o volume de uma quantidade fixa de gás a pressão constante aumenta com o aumento da temperatura. A lei de Avogadro, também conhecida como lei dos volumes combinados de Gay-Lussac, relaciona o volume de um gás com a quantidade de matéria: a uma determinada temperatura e pressão, os volumes dos gases reagentes são proporções de pequenos números inteiros. Lei de Avogadro: o volume de gás a uma determinada temperatura e pressão é diretamente proporcional à quantidade de matéria no gás.
Porém, sabemos que em condições normais de temperatura e pressão (CNTP) o volume de um mol de qualquer gás é 22,4 L.
Termoquímica e termodinâmica
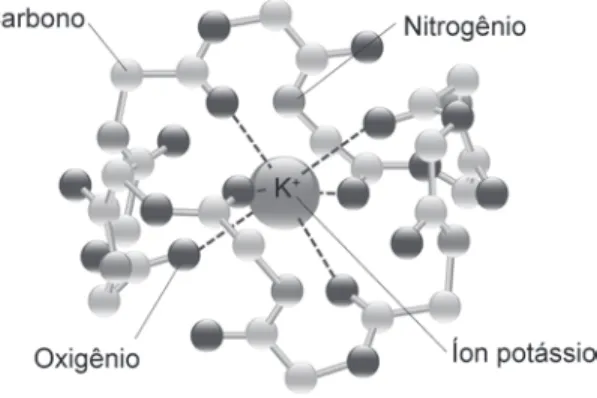
Tomando o solo como referência, a água é elevada até uma altura h (os galhos), portanto há um aumento na energia potencial. As reações químicas envolvem uma troca de energia porque quando uma ligação química se forma ou se rompe, o calor é absorvido ou liberado. Calor: fluxo de energia entre dois objetos devido à diferença entre suas temperaturas;
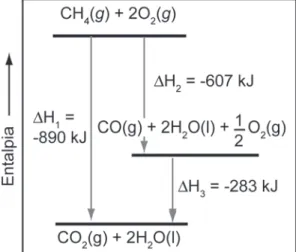
Não é possível medir a energia interna absoluta, mas é possível medir com boa exatidão e precisão a variação da energia observada durante qualquer processo, seja físico ou químico. Não importa se você conectou os postes com um fio ou um aparelho, você passou de um valor inicial de energia para um valor final, então a diferença de energia é a mesma, sendo função de estado. Quando a reação absorve calor, a quantidade final de calor será maior que a quantidade inicial, portanto, a diferença de energia (DE = Ef – Ei > 0) entre o sistema e a vizinhança será positiva.
Da mesma forma, a liberação de calor causará uma variação negativa na energia (DE = Ef – Ei < 0). Mas a liberação ou absorção de calor não é a única característica da liberação ou absorção de energia de uma reação química. As reações químicas espontâneas ocorrem na direção de diminuir a energia ou aumentar a entropia.
Assim, a energia livre também tende a um mínimo de energia estabelecido pela coexistência de equilíbrio de reagentes e produtos.
Cinética química
Agora vejamos os fatores que afetam a taxa de uma reação e como o controle das condições experimentais é importante para acelerar ou desacelerar uma reação. A taxa de uma reação é definida como a mudança que ocorre durante um determinado período de tempo na concentração (ou pressão parcial, no caso de gases) de um ou mais reagentes ou produtos. Da mesma forma que medimos a velocidade de um carro, podemos medir a velocidade de uma reação química.
Uma reação é de ordem zero em um reagente se a alteração da concentração desse reagente não tiver efeito. Numa reação de primeira ordem, a taxa duplica à medida que a concentração de um reagente duplica. Para uma reação de segunda ordem, um gráfico de ln A[ ]txt é não linear, mas o gráfico 1/[A] é graficamente linear com coeficientes lineares e angulares conhecidos.
Ao contrário das reações de primeira ordem, para uma reação de segunda ordem, a meia-vida depende da concentração inicial dos reagentes e, portanto, muda à medida que a reação progride. Essa energia mínima necessária para iniciar uma reação química é chamada de energia de ativação (Ea) e seu valor varia de reação para reação. Observe que se uma reação direta é exotérmica (CH3NC → CH3CN), então a reação inversa é endotérmica (CH3CN → CH3NC).
A catálise pode ser entendida como uma alteração na velocidade de uma reação a partir da adição de uma substância (catalisador) que permite uma nova via reacional com menor energia de ativação e é recuperada ao final do processo.

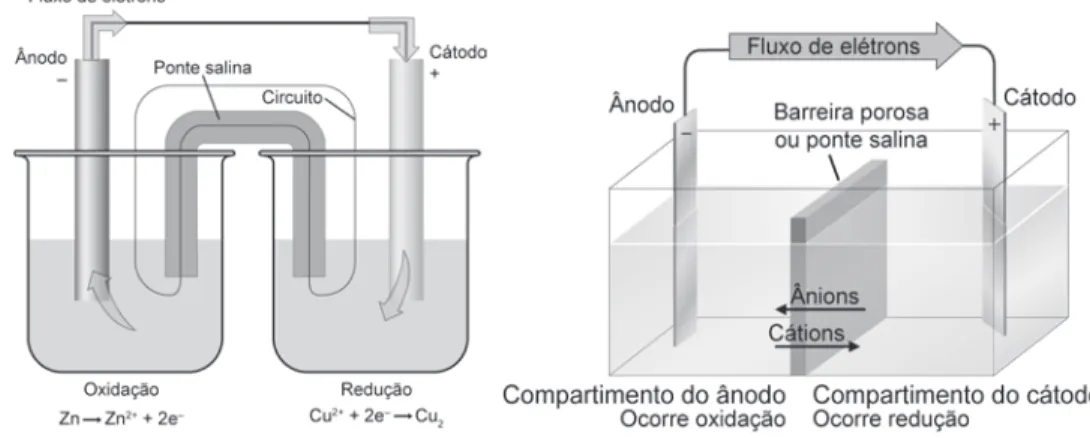
Eletroquímica
Mas também veremos como forçar uma reação química para obter produtos fundamentais ao bom funcionamento da sociedade, através de reações de eletrólise, reação eletroquímica não espontânea possibilitada pelo fornecimento de energia elétrica a um sistema químico para movê-lo. situação desfavorável em comparação com uma situação predeterminada. Aprenderemos também como a concentração dos reagentes é importante e determinaremos o potencial de uma célula ou bateria e entenderemos que muitas vezes nem precisamos de duas substâncias para fazer uma célula voltaica, mas apenas de uma espécie em concentrações diferentes. Para facilitar a compreensão do processo eletroquímico e o equilíbrio de uma equação eletroquímica, podemos dividir a reação em duas ou mais semi-reações.
As meias reações são uma forma conveniente de separar e estudar as reações de oxidação e redução. Para tentar entender melhor isso, considere titular uma solução ácida de Na2C2O4 (oxalato de sódio, incolor) com KMnO4 (permanganato de potássio, violeta escuro). Os elétrons fluem para o ânodo onde são usados na reação de redução.
Da mesma forma que temos semi-reações de oxidação e redução, podemos pensar em dividir a célula em duas meias-células, uma para redução e outra para oxidação. Porém, como não é possível ler um potencial absoluto, mas apenas um ddp, o eletrodo de hidrogênio (devido à sua alta reprodutibilidade) é escolhido como eletrodo padrão e todos os potenciais de redução padrão, Eredo, são medidos em comparação com o hidrogênio padrão. eletrodo (EPH). Como vimos na termodinâmica, a mudança na energia livre de Gibbs (DG) mede a espontaneidade de uma reação enquanto mantém a pressão e a temperatura.
As reações de eletrólise não são espontâneas e esse tipo de reação requer uma corrente externa para causar a reação.
Química nuclear
Em outras palavras, as mesmas reações que ocorrem na eletrosfera de um átomo ocorrerão, seja ele radioativo ou não. Além de liberar essas partículas, o núcleo também pode capturar um elétron da nuvem eletrônica ao seu redor. Um pósitron é uma partícula com a mesma massa de um elétron, mas com carga positiva.
O tipo de decaimento que um radionuclídeo sofre depende da proporção nêutron-próton em comparação com a dos núcleos próximos dentro da banda de estabilidade. Para responder isso, primeiro é necessário entender que a taxa de decaimento radioativo varia dependendo dos elementos químicos, ou seja, diferentes núcleos possuem diferentes taxas de decaimento. O decaimento radioativo é um processo de primeira ordem, portanto a taxa é proporcional ao número de núcleos ativos.
A taxa de decaimento é chamada de atividade (desintegração por unidade de tempo ou Becquerel – Bq – em homenagem ao físico Antoine Henri Becquerel que em 1895 descobriu a radioatividade). A fissão nuclear é a quebra do núcleo de um átomo instável (plutônio ou urânio, por exemplo) em dois átomos menores e mais leves. Após um período muito curto, eles se dividem em dois fragmentos, que são os núcleos dos átomos dos elementos menores, e emitem uma série de partículas (elétrons, fótons, raios gama e dois ou três nêutrons rápidos).
No entanto, são necessárias altas energias para superar a repulsão entre os núcleos antes que a reação possa ocorrer.