Dissertação apresentada como parte dos requisitos para obtenção do título de Mestre em Química, no Programa de Pós-Graduação em Química, no Instituto de Biociências, Letras e Ciências Exatas da Universidade Estadual Paulista "Júlio de Mesquita Filho", Campus de São José do Rio Preto. Aos meus pais, Andréa e Paulo, por toda contribuição na minha formação como pessoa e Química, sempre me motivaram, me apoiaram e não mediram esforços para que eu chegasse até aqui. Aos meus avós, Manoela e Sebastião, Geusa e Paulo, que sempre acreditaram em mim e me apoiaram em todas as decisões.
Aos meus tios Elaine e Adriano, e aos primos Giovanna e Lucas, por me receberem com todo amor e carinho durante 6 meses para realizar meu sonho.
INTRODUÇÃO 1 As bactérias 1 As bactérias
Antibacterianos
A resistência ocorre quando as bactérias conseguem sobreviver ao tratamento antibacteriano, muitas vezes porque evoluíram para se adaptar ao medicamento. Também é importante evitar o uso desnecessário, como em infecções virais ou outras condições que não respondem a esses medicamentos.
Chalconas
No entanto, o uso excessivo e inadequado de antibacterianos tem levado a um aumento da resistência bacteriana a esses medicamentos. Para combater a resistência aos antibióticos, é importante usar esses medicamentos com responsabilidade e seguir as orientações do seu médico quanto à dosagem e duração do tratamento. Além disso, é fundamental investir na pesquisa e desenvolvimento de novos antibacterianos, bem como promover práticas de prevenção de infecções para reduzir a necessidade de tratamento antibacteriano.
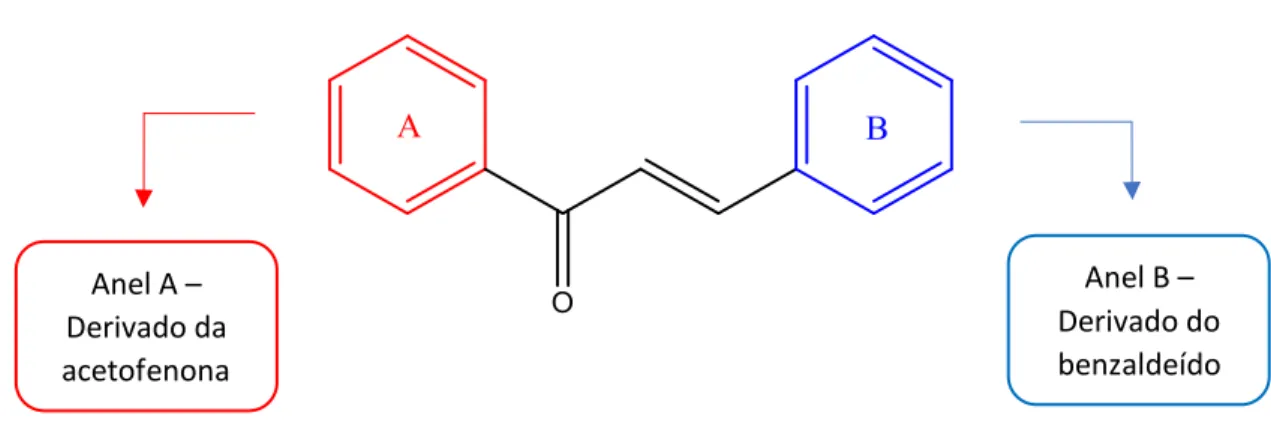
Devido às suas propriedades farmacológicas, as chalconas tornaram-se um dos principais alvos de pesquisas científicas em busca de análogos calcônicos (que podem ou não conter substituintes nos anéis A e B) que possam potencializar as atividades biológicas. O objetivo geral deste trabalho é a síntese de análogos de chalconas com modificações no anel A e B, e a avaliação da atividade antibacteriana de chalconas preniladas.
Objetivos específicos
METODOLOGIA
Planejamento Molecular dos Análogos Chalcônicos - Séries I e II
Planejamento molecular dos análogos chalcônicos das séries I e II
Modificações no anel A – Série I
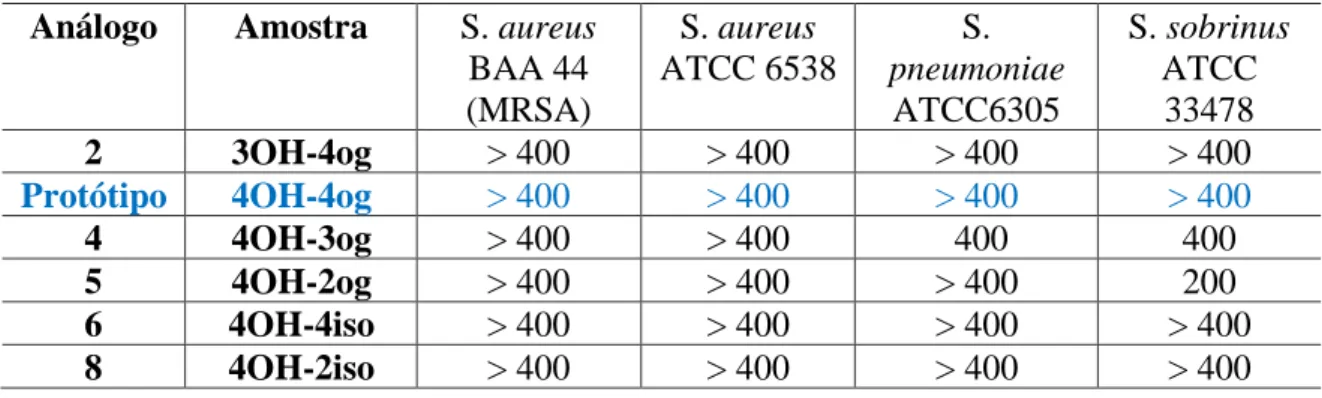
Esta série é baseada apenas nas modificações do anel A, com o anel B tendo um grupo O-geranil para-posicionado. Com essas propostas de substituições para esses análogos, será possível entender o significado da presença do grupo hidroxila fenólico, bem como o significado da posição (orto, meta e para) em que esse grupo está localizado.
Estratégia de modificações no anel A – Série I
Modificações no anel B – Série II
Estratégia para modificações no anel B – Série II
Estratégia sintética para obtenção das chalconas
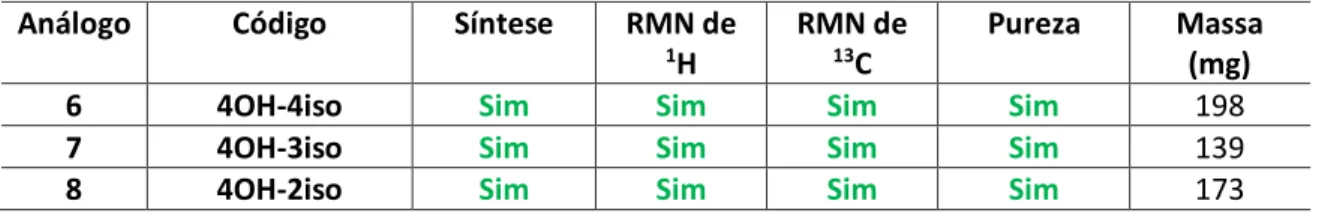
Síntese dos compostos da série I
Síntese do análogo 2: Semelhante ao análogo 1, a reação de O-prenilação foi realizada com 780 mg de carbonato de potássio e 200 mg de 4-hidroxibenzaldeído (1,64 mmol) usando acetona como solvente e depois brometo de geranil (0,32 mL, 164 mmol) A reação foi seguida por cromatografia em camada delgada e interrompida após 2,5 h. Na segunda etapa, 200 mg de 3'-hidroxiacetofenona (3,42 mmol) dissolvidos em 5 ml de etanol foram colocados em um frasco em banho de gelo. Paralelamente, uma solução de 2 mL de KOH 60% foi preparada e adicionada gota a gota à solução de 3'-hidroxiacetofenona.
Em seguida, o aldeído 4-O-geranilado foi dissolvido em 2 ml de etanol, que foi adicionado em quatro alíquotas de 0,5 ml em intervalos de 10 minutos. O produto bruto foi purificado em cromatografia em coluna de sílica gel usando uma mistura de hexano e acetato de etila (8:2). Síntese do análogo 3: A síntese deste análogo foi realizada em duas etapas, sendo a primeira uma reação de O-prenilação.
Em um balão e em banho de gelo, foram adicionados 250 mg de 2'-hidroxiacetofenona (3,42 mmol) dissolvidos em 5 mL de etanol. Finalmente, o aldeído 4-O-geranilado foi adicionado em quatro alíquotas de 0,5 ml em intervalos de 10 minutos. O produto bruto foi purificado por duas técnicas, sendo a primeira cromatografia em coluna de sílica gel eluída em hexano e acetato de etila (95:5) e posteriormente por cromatografia em coluna de octadecilsilano eluída em etanol e água (6:4).
Síntese dos compostos da série II
250 mg de 4'-hidroxiacetofenona (1,68 mmol) foram adicionados ao frasco com etanol (5 mL) em um banho de gelo com agitação constante. Síntese do Análogo 6: 780 mg de carbonato de potássio e 5 mL de acetona foram adicionados a um frasco em banho de gelo, seguidos de 300 mg (2,45 mmol) de 4-hidroxibenzaldeído dissolvido em 2 mL de acetona. Uma partição líquido-líquido foi realizada com acetato de etila e água para extrair o produto bruto da fase orgânica, que foi evaporado em rotaevaporador.
O produto bruto foi purificado por cromatografia em coluna de sílica gel eluindo com hexano e acetato de etila (7:3), gerando 198 mg de sólido amarelo, 28% de rendimento total. Síntese do Análogo 9: 780 mg de carbonato de potássio em 5 mL de acetona foram adicionados a um frasco e em banho de gelo, seguidos por 200 mg de 4-hidroxibenzaldeído (1,64 mmol) dissolvido em 2 mL de acetona. Em um balão foram adicionados 250 mg de 4-hidroxiacetofenona (3,25 mmol), que foi dissolvido em 5 mL de etanol.
780 mg de carbonato de potássio em 5 ml de acetona foram adicionados ao frasco e em banho de gelo, seguidos de 200 mg de 4-hidroxibenzaldeído (1,64 mmol) dissolvidos em 2 ml de acetona. Na reação de condensação, 235 mg de 4-hidroxiacetofenona (172 mmol) foram adicionados ao balão, que foi dissolvido em 5 ml de etanol. Uma partição líquido-líquido foi realizada com acetato de etila e água para extrair o produto bruto da fase orgânica, que foi enviado para um evaporador rotativo para remover o solvente.
Métodos cromatográficos e espectroscópicos
- Cromatografia em Camada Delgada
- Cromatografia em Coluna de Gel de Sílica
- Cromatografia em Coluna de Octadecilsilano
- Cromatografia em Coluna de Permeação em Gel
- Ressonância Magnética Nuclear
- Ensaio Biológico
Para realizar a cromatografia em coluna de sílica gel, foi utilizada sílica gel 100 a 200 Mesh (Sigma Aldrich®) como fase estacionária. Como fase móvel, foram utilizadas misturas de solventes incluindo hexano, acetato de etila, acetona e diclorometano. A cromatografia em coluna de octadecilsilano (ODS, C18) é uma técnica de cromatografia de fase reversa que usa misturas de água e etanol como eluentes.
As porcentagens de etanol/água variaram por amostra no processo de purificação. A cromatografia de permeação em gel (ou cromatografia de exclusão molecular) foi realizada utilizando Sephadex LH-20 (Sigma Aldrich®) como suporte cromatográfico. Placas de 96 poços foram preenchidas com 80 µL de CICC e, em seguida, foram adicionados 100 µL de cada solução estoque de chalcona, realizando microdiluição seriada e complementando os poços com 10 µL de inóculo bacteriano e 10 µL de corante resazurina 0,1% estéril.
Também foram realizados o controle de esterilidade do meio de cultura, o controle de crescimento bacteriano, o controle negativo (DMSO) e o controle de suscetibilidade, sendo Vancomicina para S. Pela leitura visual do resultado, o crescimento bacteriano foi indicado pelo consumo de resazurina mudando a cor do meio para verde claro e a inibição de foi indicada pela manutenção do tom verde-azulado do meio. Assim, para mudanças na estrutura da molécula, os derivados de acetofenona foram variados para mudanças no anel A e os derivados de benzaldeído para mudanças no anel B.
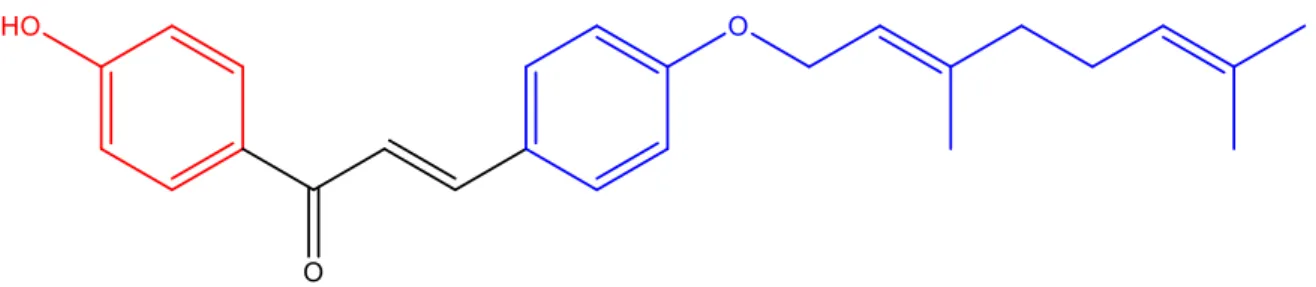
Formação do núcleo chalcônico
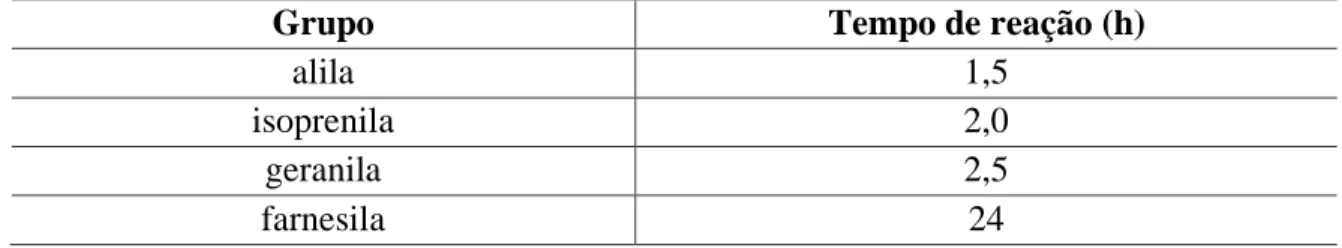
As diferenças no tempo de reação podem ser explicadas pelo impedimento estérico causado pelos grupos prenila maiores. Durante a reação, o carbono metileno ligado ao haleto (Cl ou Br) é atacado pelo oxigênio nucleofílico do fenolato do outro lado do grupo abandonador. Quando ocorre esse ataque, os grupos maiores dificultam a aproximação do carbono nucleófilo metileno, retardando a reação.
Devido às propriedades periódicas da família dos halogênios, sabe-se que átomos maiores e menos eletronegativos formam melhores grupos de saída, de modo que o bromo é um grupo de saída privilegiado em comparação com o cloro. Este nucleófilo ataca o carbono (que tem carga parcial positiva) que está ligado ao halogênio. À medida que o nucleófilo se aproxima do carbono, o grupo abandonador (bromo) se afasta até que a ligação seja completamente quebrada.
Mecanismo para a reação de O-prenilação
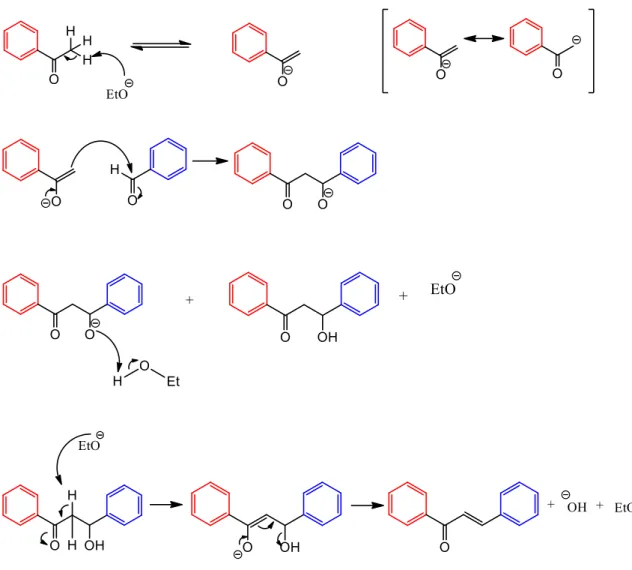
Inicialmente, a reação é montada em um ambiente básico e, quando submetido a essas condições, o grupo hidroxila (OH) do benzaldeído libera H+ para a solução, formando o ânion enolato, que atua como nucleófilo. A reação se inicia com a retirada de um hidrogênio do OH do meio reacional, formando o ânion fenolato, que atua como nucleófilo. O enolato ataca o carbono benzaldeído, criando um íon alcóxido, que remove um próton do solvente, criando um íon etóxido e um aldol.
Por fim, o íon etóxido remove um α-hidrogênio e, então, ocorre a produção de hidróxido (OH) via E1cb (eliminação unimolecular via base conjugada), formando o núcleo da chalcona.
Mecanismo para a reação de condensação aldólica de Claisen-Schmidt
Série I
Para obter os compostos da série I, na primeira etapa (O-prenilação), para os análogos 1-3, todo o material de partida foi totalmente consumido e não houve formação de subprodutos. Na segunda etapa (Claisen-Schmidt), todas as acetofenonas foram utilizadas como reagentes em excesso, visando consumir todo o aldeído da primeira etapa. A síntese do análogo 2 foi continuada por 24 horas e a presença do reagente limitante (derivado de benzaldeído) foi observada ao realizar a análise por cromatografia em camada delgada.
Observou-se a presença de matéria-prima e a presença de subprodutos, dificultando a purificação do produto bruto devido à complexidade da separação. Assim, as reações de condensação dos análogos 1 e 3 foram mantidas por 24 h, e mesmo com um tempo menor, produtos secundários ainda foram formados. Durante o processo de separação cromatográfica dos análogos 1 e 3 da série I, as análises por cromatografia em camada delgada indicaram que os produtos calcônicos e seus respectivos aldeídos e acetofenonas apresentaram fatores de retenção (RF) muito próximos ou iguais.
Diante desse desafio, foi necessário um estudo da fase móvel para otimizar a resolução cromatográfica e o uso de outras técnicas cromatográficas. Os análogos 1 e 3 foram submetidos à cromatografia em coluna de sílica gel, eluídos em hexano e acetato (95:5) para remover os subprodutos formados e, em seguida, submetidos à cromatografia em coluna de octadecilsilano eluído em etanol e água (6:4). O processo para o análogo 2 foi mais simples, utilizando apenas uma coluna de sílica gel, eluída em hexano/acetato (8:2).
Série II
- Chalconas O-geraniladas
- Chalconas O-isopreniladas
- Chalconas O-aliladas e O-farnesiladas
O brometo de alila proporcionou uma reação mais rápida do que o brometo de isoprenila, resultando em uma reação de O-prenilação em 1,5 h. O produto bruto do análogo 9 foi submetido à purificação usando todas as técnicas cromatográficas disponíveis no laboratório, mas todas falharam.
Ensaios de Atividade Antibacteriana e Antimicobacteriana
Os resultados dos ensaios biológicos realizados contra bactérias Gram-positivas e Gram-negativas estão disponíveis nas Tabelas 8 e 9. Analisando os resultados, conclui-se que embora o Análogo 5 tenha uma Concentração Inibitória Mínima (CIM) menor que o protótipo Composto, ainda falhou para atingir uma MIC satisfatória abaixo de 25μg/ml.
CONCLUSÕES E PERSPECTIVAS
As mortes por tuberculose aumentam pela primeira vez em mais de uma década devido à pandemia de COVID-19 em 2021. Uma vez na segunda década, é devido a.
ANEXOS