The experiments were performed using human cell lines that naturally express LRP2, JEG-3 and HK-2. The cytotoxicity studies were performed using modified cells compared to the parent JEG-3 and HK-2 cell lines.
Ledvinný transport
ABC a SLC transportéry
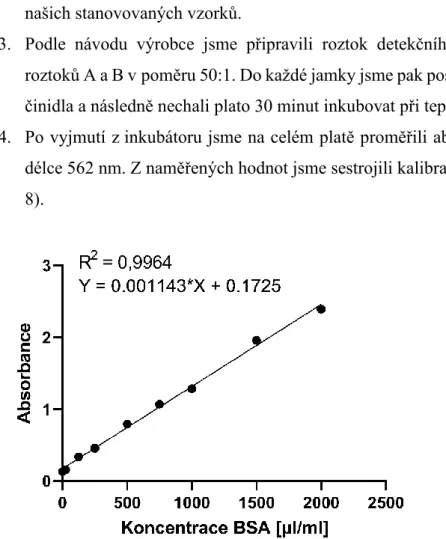
Přesuneme-li se k buňkám proximálních tubulů (obrázek 1), na bazolaterální straně buňky usnadňují transportéry pro kationty příjem substrátu do buňky, zejména OCT2 (přenašeč organických kationtů), zatímco OAT1, OAT3 (přenašeče organických aniontů ) jsou zodpovědné hlavně za zachycení aniontů. Zvýšená exprese OCT2 na membráně buněk proximálních tubulů potencuje toxicitu cisplatiny, naopak snížená nebo žádná exprese OCT2 je z tohoto pohledu protektivní proti selhání ledvin.
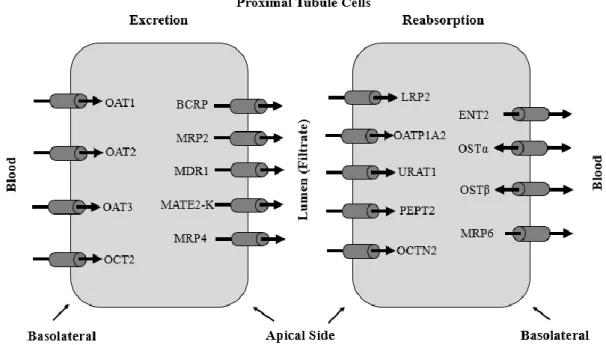
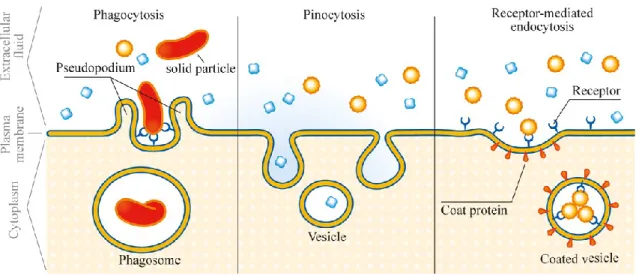
Přenos látek přes membrány pomocí endocytózy
CFTR ovlivňuje iontovou rovnováhu a jeho mutace způsobuje zvýšenou produkci plicního sputa u pacientů s cystickou fibrózou (Li et al. 2010). Jde o velmi specifický proces, na kterém se podílí velké množství regulačních proteinů (Casartelli et al. 2008).
Megalin
- Struktura a lokalizace
- Funkce
- Ligandy a jejich interakce s LRP2
- Onemocnění ovlivněná megalinem
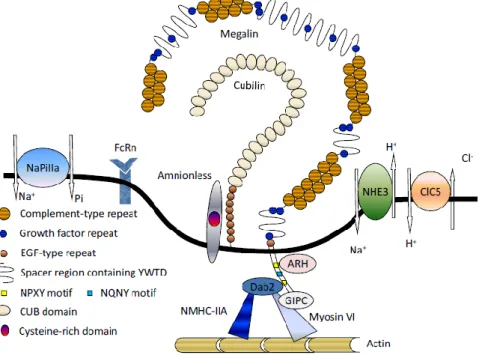
Všechna uspořádání jsou organizována do 3 domén: cytoplazmatické, jednoduché transmembránové a rozsáhlé extracelulární domény (obrázek 5) (De et al. 2014). Extracelulární doména (ECD) obsahuje 4400 aminokyselin, což je významný zlomek celkové velikosti proteinu (4655 aminokyselin) (Saito et al. 1994).
Cubilin
Výskyt a struktura
Mutanti s knockoutem genu LRP2 se zdají být myopičtí, ale mechanismus působení megalinu na sítnici nebyl dosud objasněn (Cases et al. 2017). Kromě výše uvedeného je megalin důležitým faktorem při vzniku Alzheimerovy choroby, neboť usnadňuje clearance β-amyloidu, peptidu, který hraje významnou roli při vzniku onemocnění (Marzolo a Farfán 2011). Jeho N-konec je zodpovědný za ukotvení proteinu v membráně, tato oblast netvoří klasickou transmembránovou doménu, ale vlásenkovou helikální strukturu zodpovědnou za ukotvení v cytoplazmatické membráně (Kristiansen et al. 1999).
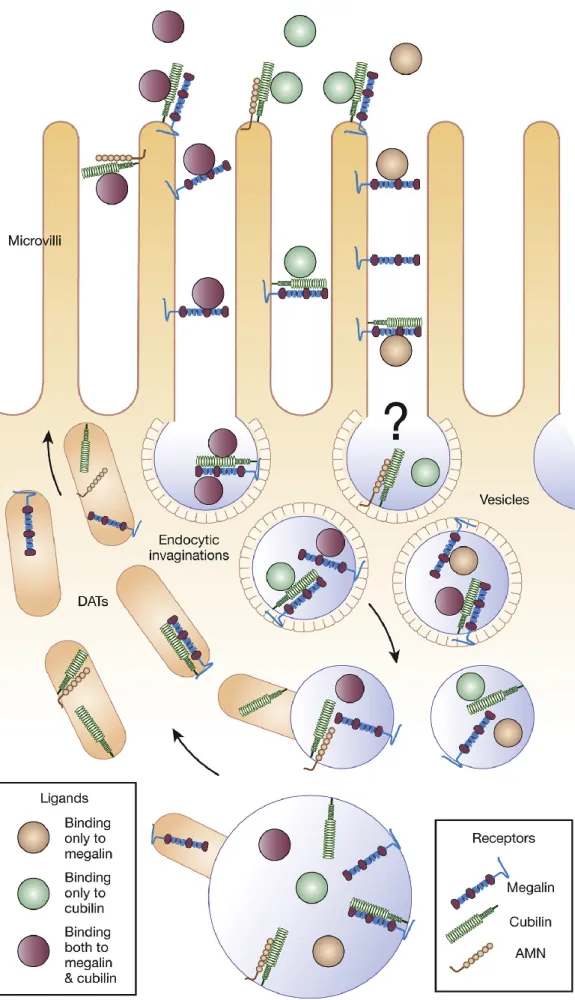
Správná poloha cubilinu na membráně v prostoru extracelulárního prostředí závisí na proteinu zvaném amnionless (AMN), který interaguje s EGF repeticemi cubilinu a řídí tak jeho orientaci na cytoplazmatické membráně. Vzhledem k absenci AMN proteinu zůstává cubilin intracelulárně zkroucený a přítomnost cubilinu je stejně důležitá pro správné umístění AMN (Nielsen et al. 2016).
Funkce
Po navázání vitaminu B12 v komplexu s vnitřním faktorem na cubilin se AMN váže na stericky nebráněné místo cubilinu a internalizuje ligand. Cubilin spolu s AMN zjevně tvoří komplex známý také jako kubam, který je schopen fungovat nezávisle na megalinu, proteinu normálně nutném pro správnou aktivitu kubilinu (Fyfe et al. 2004). Pouze vazba na kubilin nestačí, protože samotný receptor není schopen internalizace a při vazbě na albumin působí jako megalinový koreceptor, proto kubilinem zprostředkovaná reabsorpce albuminu závisí na megalinu.
Cubilin, ačkoli není schopen vázat cholesterol nebo jiné lipidy sám o sobě, se významně podílí na regulaci homeostázy lipidů, protože pravděpodobně váže a internalizuje nosný protein pro lipid v komplexu s lipidem (např. apoA-I spolu s triacylglyceroly).
Metody transfekce
Fyzikální metody
Fyzicky lze transfekce dosáhnout mikroinjekcemi, optickou transfekcí, elektroporací, sonoporací a dalšími metodami (Kaestner et al. 2015). Fyzikální metody obecně vykazují velmi vysokou úspěšnost při posuzování inkorporace vloženého segmentu DNA do buněčného genomu a produkce požadovaného proteinu (Khantakova et al. 2018). Úspěch této metody, ve které je napětí, které narušuje buněčnou membránu, použito k dodání požadovaného segmentu DNA do buňky, závisí na napětí aplikovaném na elektrodu, době trvání a koncentraci vektorové DNA.
Z popisu metody vyplývá, že buňky jsou při genetické modifikaci vystaveny velké zátěži a proto musí být zajištěny podmínky pro podporu regenerace buněk, včetně výběru vhodného média (Khantakova et al. 2018). V praxi se jedná o zavedení a dávkování přesně definovaného objemu směsi reagencií a DNA do buněk pomocí mikropipet (Chow et al. 2016).
Biologické metody
Chemické metody
Nejnovější chemické metody představuje lipozomální transfekce, velmi slibná vývojová technika a v posledních letech intenzivně studovaná metoda genetického inženýrství (Digiacomo et al. 2018). Současnou lipofekci lze chápat jako spontánní reakci kationtových lipidů spolu s DNA za vzniku vezikul schopných fúze s cytoplazmatickou membránou (Kumar et al. 2019b). Během tvorby liposomů pozitivně nabitá lipidová hlava interaguje s negativní fosfátovou skupinou DNA (Kumar et al. 2019b).
Po vytvoření lipozomu následuje připojení dodaného komplexu DNA-lipid na cytoplazmatickou membránu, poté je internalizován endocytózou, uvnitř buňky je DNA uvolněna z obalu a přenesena do jádra, následuje transkripce (Audouy a Hoekstra 2001). Vývoj této metody umožňuje přenos různých typů nukleových kyselin do širokého spektra buněk (Kumar et al. 2019b). Zvýšení koncentrace lipidů obecně zvyšuje šanci na úspěch, ale příliš vysoká koncentrace se jeví jako toxická, podobně vysoká koncentrace DNA může působit jako inhibitor reakce, přičemž optimální množství činidel závisí na konkrétním typu buňky (Kingston et kol., 2003).
Lipozomální transfekci dále ovlivňují transfekující látky, např.: Lipofectamine 2000, který je často používán pro svou nízkou toxicitu a snadnou manipulaci. Důležitým hlediskem je syntéza účinných a cytotoxických lipozomů, protože lipoplexy mohou být toxické, i když vykazují dobrou transfekční účinnost (Digiacomo et al. 2018). V lipoplexech se lipidy a vodná fáze buď oddělují do vrstev, díky nimž celý komplex připomíná cibuli, nebo tvoří micely (Digiacomo et al. 2018).
CRISPR-Cas9
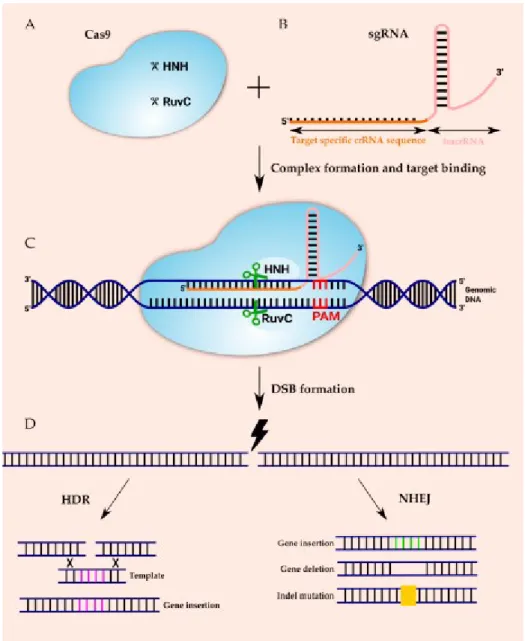
Zatímco lipofekce in vitro nabízí uspokojivé výsledky, překážkami in vivo jsou především nízká účinnost a nestabilita komplexů, aby bylo možné tyto překážky odstranit, je nutné uspokojivěji korelovat data z in vitro studií (Audouy a Hoekstra 2001). Cas9 (kaspáza 9) složená z domén nukleázy HNH (His – Asn – His) a RuvC je schopna rozpoznat a štěpit dvouvláknovou DNA obsahující specifickou sekvenci patřící do Cas9 (Gong et al. CRISPR-Cas9 (obrázek 7) se skládá z nukleázu Cas9 a jedinou vodící RNA (sgRNA), ve které sgRNA zahrnuje transaktivující crispr RNA (tracrRNA) a crispr RNA (crRNA) obsahující 20 nukleotidovou oblast vázající DNA a několik dalších nukleotidů komplementárních k tracrRNA.
Tyto komplementární části spolu hybridizují a vážou se na Cas9 za vzniku komplexu Cas9-sgRNA, který je schopen se vázat na dsDNA pomocí volné části sgRNA. Výsledný komplex umožňuje doménám HNH a RuvC štěpit komplementární a nekomplementární řetězce DNA, což má za následek dvouřetězcový zlom tři báze před vodicí sekvencí PAM (protospacer-adjacent Motiv), bez kterého by štěpení DNA nenastalo. Oba konce upravené DNA jsou ligovány buď homologně nebo nehomologně pomocí DNA ligázy (Janik et al. 2020).
Homologní párování vyžaduje sesterskou chromatidu, kterou lze použít jako templátovou DNA, nehomologní naopak pracuje s krátkými homologními sekvencemi, což zvyšuje šanci na nepřesnosti a vytvoření frameshift mutace v místě sestřihu. Kromě toho posun čtecího rámce způsobuje chybné čtení kodonů, které může vést k tiché mutaci, strukturálně změněnému proteinu nebo zastavení syntézy proteinů během procesu (Bower et al. 2021). Tento krok zvýší úspěšnost a omezí výskyt mutací, správně vyrobená sgRNA se vyznačuje vysokou účinností a nízkou specificitou vůči necílovým sekvencím (Bower et al. 2021).
Aminoglykosidová antibiotika
Gentamicin
Perorální podání není možné, jelikož se lék nevstřebává z trávicího traktu, proto se pro systémovou léčbu používá především intravenózně nebo intramuskulárně (Balakumar et al. 2010). Biologický poločas je dvě až tři hodiny a gentamicin je vylučován v nezměněné podobě močí glomerulární filtrací (Ali 1995). Gentamicinová nefrotoxicita způsobuje akumulaci v proximálním tubulu, která je spojena se zánětlivou imunitní odpovědí vedoucí k apoptóze až nekróze a je vážným problémem (Balakumar et al. 2010).
Toxická reakce se projevuje především zvýšením sérového kreatininu a albuminurií, což může vést k selhání ledvin (Balakumar et al. 2010). Na druhé straně pokročilý věk, již existující onemocnění ledvin a léky jako furosemid přispívají k toxicitě, která je spojena se sníženým objemem filtrované krve v důsledku diurézy (Balakumar et al. 2010). Hodnocení účinku modifikace LRP2 v modelových lidských buněčných liniích přirozeně exprimujících LRP2 na akumulaci a cytotoxické účinky modelových ligandů LRP2 na knockoutované a nemodifikované buňky.
Materiál
Přístroje a pomůcky
Chemikálie
Buněčné linie
HK-2
Pro buněčnou kulturu bylo použito živné médium DMEM doplněné o 10% FBS (fetální bovinní sérum) a L-glutamin v koncentraci 2 mmol/l.
JEG-3
Příprava roztoků
Fosfátový pufr (PBS)
Roztok DMSO 10%
Roztok gentamicinu 6 mg/ml
Transfekce
Pracovní postup
Akumulační studie
Pracovní postup
Kromě buněk jsme na plato umístili také pozitivní kontrolu sestávající ze 150 μl čistého zásobního roztoku a měřili fluorescenci při excitační vlnové délce 490 nm a emisní vlnové délce 525 nm.
Stanovení množství proteinu
Poté, co jsme destičku vyjmuli, nechali jsme ji roztavit, poté jsme obsah jamek řádně promíchali pipetou a z každé jamky nakapali 130 µl na černou destičku, poté jsme změřili fluorescenci. Poté jsme postupně přidali 200 μl činidla do každé jamky a poté nechali destičku inkubovat 30 min při teplotě 37 °C.
Testování viability
Pracovní postup
Statistická analýza
Výsledky akumulačních studií
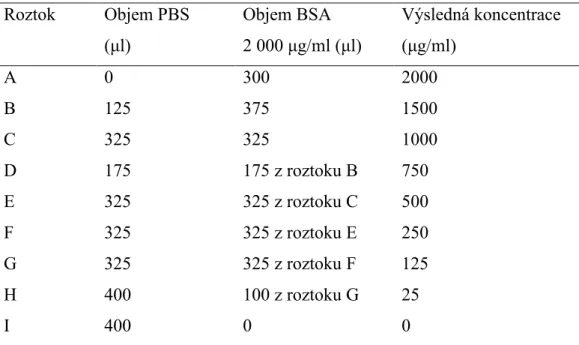
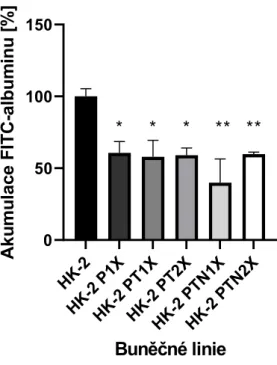
Následující experiment byl rozšířen o testování většího počtu modifikovaných linií, graf (obrázek 13) ukazuje, že modifikované buňky vykazují nižší akumulaci albuminu ve srovnání se základní linií HK-2. Na základě statistické analýzy lze s jistotou konstatovat, že akumulace albuminu u modifikovaných buněčných linií byla snížena ve srovnání se základní linií HK-2. Akumulace albuminu byla také provedena s buňkami JEG-3 a stejně jako v předchozích stanoveních jsou výsledky relativní k hodnotě naměřené pro JEG-3 jako základní buněčnou linii, pro kterou je akumulace znázorněna na obrázku (obrázek 14).
Modifikované buněčné linie značené JEG-3 P1X a JEG-3 P2X vykazují nižší schopnost akumulovat fluorescenčně značený albumin, ale vzhledem k širšímu rozptylu naměřených hodnot není tento pokles statisticky významný. Naopak u řady označené JEG-3 PT1X je patrný trend nárůstu akumulace FITC-albuminu, který je v případě řady JEG-3 PT2X dokonce významný.
Výsledky testování viability
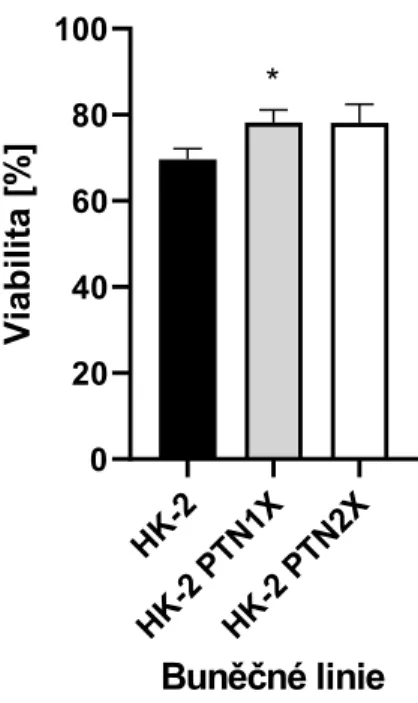
Předpoklad byl potvrzen zvýšením životaschopnosti obou linií oproti základní linii, což odpovídá našim očekáváním. Všechny ostatní modifikované linie (po zmrazení) vykazovaly nižší životaschopnost ve srovnání se základní linií, ale statisticky nevýznamnou. Druhou buněčnou linii JEG-3 jsme vystavili stejným podmínkám, z obrázku 14 je vidět, že modifikované linie JEG-3 P1X a JEG-3 P2X vykazují nižší akumulaci albuminu ve srovnání s rodičovskými buňkami.
Po testování životaschopnosti buněk HK-2 jsme přešli ke studiu placentárních buněk JEG-3, kdy první experiment (obrázek 18) splnil očekávání výrazného zvýšení životaschopnosti modifikovaných linií, proto jsme testování rozšířili zahrnout více pozměněných linií (obrázek 19), kdy došlo k výraznému zvýšení životaschopnosti linie JEG-3 PTN1X ve srovnání s liniemi připravenými před dlouhou dobou a poté zmrazenými. U těchto linií nebyla pozorována žádná významná změna životaschopnosti v důsledku cytotoxického účinku gentamicinu ve srovnání s nemodifikovanou kontrolní buněčnou linií JEG-3. Nikdy přitom nelze předpokládat 100% úspěšnost transfekce, takže časem ve směsi buněk získají převahu nezměněné buňky, kterým se prostě bude dařit lépe ve srovnání s buňkami upravenými.
The role of megalin in the transport of gentamicin across BeWo cells, an in vitro model of the human placenta. Ostα-Ostβ is required for bile acid and conjugated steroid disposition in the intestine, kidney and liver. A megalin-like receptor is involved in protein endocytosis in the midgut of an insect (Bombyx mori, Lepidoptera).
Impaired vitreous composition and retinal pigment epithelial function in FoxG1::LRP2 myopic mice: Impaired vitreous composition and retinal pigment epithelial function in FoxG1::LRP2 myopic mice. Molecular dissection of the intrinsic factor-vitamin B12 receptor, Cubilin, reveals regions important for membrane binding and ligand binding.