Ich bestätige, dass ich die eingereichte Diplomarbeit am Lehrstuhl für Anorganische Chemie der LUDWIG-MAXIMILIANS-UNIVERSITÄT München unter der Leitung eines Dozenten verfasst habe. Mein ganz besonderer Dank gilt Herrn PD DR.AXEL SCHULZ für die Bereitstellung dieses interessanten Themas, für die umfangreiche Unterstützung, seine unschätzbare Hilfe bei einer Vielzahl von Problemen aller Art, unzählige Tipps und Anregungen für die quantenmechanischen Berechnungen und für die Bereitschaft den zweiten Bericht bereitzustellen, damit diese die Arbeit übernehmen können. Besonders möchte ich mich bei der gesamten Arbeitsgruppe für den freundlichen Empfang, die vielen technischen Tipps, die ich aus den häufigen Gesprächen mitnehmen konnte, und die angenehme Arbeitsatmosphäre bedanken.
Besonders danken möchte ich meiner Freundin Sabine und meiner Familie für ihr Verständnis und ihre Unterstützung bei dieser Arbeit.
Aufgabenstellung
Allgemeiner Teil
Abkürzungen
Masseinheiten
Kenntnisstand
Schwefel-Stickstoff-Halogen-Verbindungen
- Trimeres Thiazylchlorid (NSCl) 3
- Monomeres Thiazylchlorid NSCl
Sowohl in der verdünnten Gasphase als auch in der Lösung liegt dieses Gleichgewicht auch bei Temperaturen über 50 °C weitgehend rechts.3.
Binäre Schwefel-Stickstoff-Verbindungen
- Monoschwefeldinitrid SN 2
- Thiazylkation SN +
Das 1,2-Dithia-3,4,5-triazolium-Kation S2N3+ ist – wenn auch in schlechten Ausbeuten – als schwerlösliche Salze erhältlich, die entweder das Pentachlortellurat-Anion TeCl5- enthalten. Im Allgemeinen ist das Verfahren zur Herstellung der 1,2-Dithia-3,4,5-triazoliumsalze wie folgt: 1,2: Eine klare Lösung von trimerem Thiazylchlorid (NSCl)3 und Tellurtetrachlorid TeCl4 oder nach der Röntgenaufnahme Die Strukturanalyse von 1,2-Dithia-3,4,5-triazoliumsalz-Einkristallen zeigt das planare, ringförmige S2N3+-Kation mit leicht verzerrter C2v-Symmetrie.1,2.
Monoschwefeldinitrid SN2 ist eine vorübergehende Spezies, die bei der Pyrolyse und als eines der beiden Primärprodukte auch bei der photolytischen (UV-Licht) Cycloreversion von 5-substituierten 1,2,3,4-Thiatriazolen entsteht.9. Hochauflösende IR-Spektroskopie von Monoschwefeldinitrid SN2 in der verdünnten Gasphase zeigte, dass das SN2-Molekül wie das isovalente elektronische Distickstoffoxid N2O eine lineare Struktur aufweist und die C∞v-Symmetrie NN-Bindungslänge mit 1,139 Å ermittelt wurde.9, 11 . Lösungen der Salze des Thiacylkations NS+ können leicht in situ erzeugt werden, beispielsweise kann eine Lösung von trimerem Thiacylchlorid (NSCl)3 in Dichlormethan mit einer Lewis-Säure wie Aluminiumtrichlorid AlCl3,3,12 behandelt werden.
Schwefeldikationen
Die NS+-Notation für das Thiazylkation ist besser, da die positive Ladung stark am Schwefelatom lokalisiert ist (siehe Tabelle 13 unten), das aus dem Salzdisulfid-Bistetrafluorborat [S2]2+[BF4]-2 bestehen würde. Eine Studie, die die anodische Oxidation von elementarem Schwefel S8 in einer Natriumchlorid-Aluminiumchlorid-Schmelze spektrophotometrisch verfolgt, spekuliert über das Vorhandensein der Spezies S22+, in der Schwefel die Oxidationsstufe +1 haben würde.
Schließlich konnte das Vorhandensein von S22+ in dieser Studie aufgrund der Messungenauigkeit kommerziell erhältlicher Spektrophotometer nicht eindeutig nachgewiesen werden.19.
Ergebnisse der rechnerischen Reaktionsuntersuchungen und
Übersicht über die untersuchten Reaktionsrouten und die zugehörigen
Systematische Fehler
Dies bedeutet, dass einige Reaktionsschritte in der realen Thermodynamik möglicherweise energetisch günstiger sind, als die Berechnung vorhersagt. Katalysatoren: Es wird nicht untersucht, ob neben der Lewis-Säure noch weitere katalytische Spezies entstehen oder ob diese in die Reaktionen eingreifen.
Erläuterung der Farbgebung in Kugel-Stab-Abbildungen von Mole-
Dissoziation des trimeren Thiazylchlorids (NSCl) 3
- Minimumstruktur von trimerem Thiazylchlorid (NSCl) 3
- Übergangszustand und Energiebarrieren für die Dissoziation von (NSCl) 3
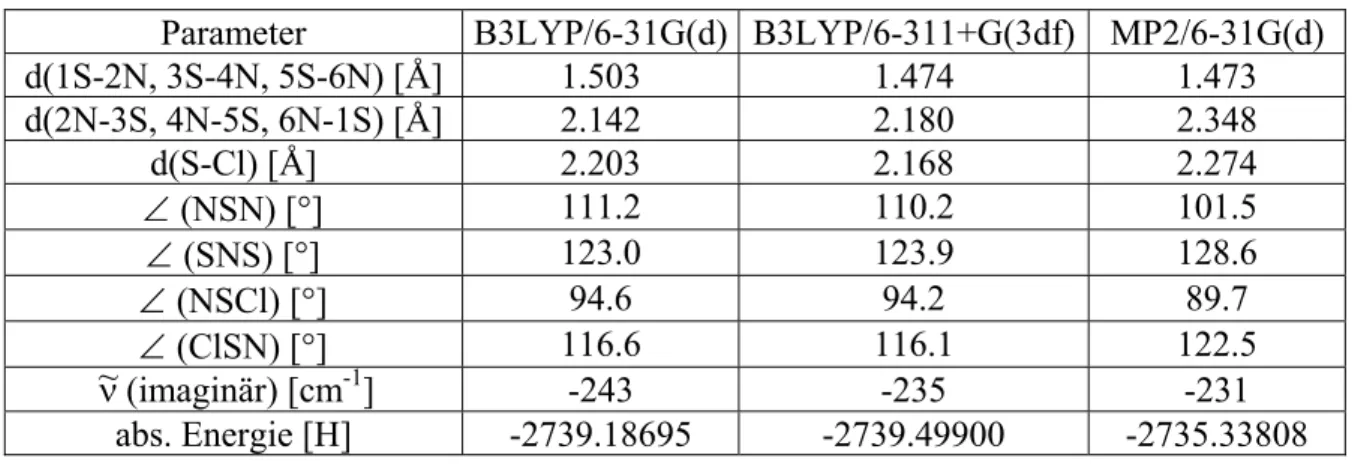
In Abbildung 4 auf der folgenden Seite ist ersichtlich, dass die minimal berechnete Struktur von (NSCl)3, wie die experimentell bestimmte Struktur5 (vgl. Tabelle 6), enthält das (NSCl)3-Molekül starke polare, kovalente Bindungen, mit insgesamt Die negative Ladung ist 4 zu 1 auf die N- und Cl-Atome verteilt und die gesamte positive Ladung auf die S-Atome. Übergangszustand und Energiebarrieren für die Dissoziation von (NSCl)3Tabelle 7 Übergangszustandsgeometrie Tabelle 7 Übergangszustandsgeometrie.
Tabelle 8 zeigt die Aktivierungsenergien für die Hin- und Rückreaktionen des Dissoziationsgleichgewichts. Man erkennt, dass die Hinreaktion, die Dissoziation von (NSCl)3, kinetisch stärker gehemmt ist als die Rückreaktion, nämlich die Assoziation von drei NSCl-Molekülen.
Reaktionen ausgehend von monomerem Thiazylchlorid NSCl 3
- Dissoziation von NSCl
- Minimumstruktur von monomerem Thiazylchlorid NSCl
- Minimumstruktur des Thiazylkations NS +
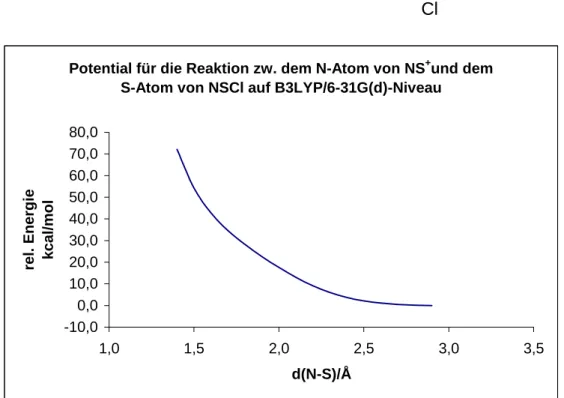
- Reaktion zwischen den Schwefelatomen von NS + und NSCl
- Reaktion zwischen dem N-Atom von NS + und dem S-Atom von NSCl
- Reaktion zwischen dem S-Atom von NS + und dem N-Atom von NSCl
- Minimumstruktur des SN-Adduktes
- Reaktion zwischen den Stickstoffatomen von NS + und NSCl
- Minimumstruktur des elektrostatischen NN-Adduktes
- Minimumstruktur des kovalenten NN-Adduktes
- Übergangszustand und Energiebarrieren zwischen SN-Addukt und elektrostatischem
- Übergangszustand und Energiebarrieren zwischen elektrostatischem NN-Addukt und
- Reaktion zwischen einem Chloridion und dem S-Atom des kovalenten cis-NN-
- Minimumstruktur von Schwefeldichlorid SCl 2
- Minimumstruktur von Monoschwefeldinitrid SNN
- Cycloaddition eines NSCl-Moleküls an ein kovalentes cis-NN-Adduktmolekül
- Minimumstruktur des 1-Chlor-4-chlorsulfenyl-1,2-dithia-3,4,5-triazoliumkations
- Übergangszustand und Energiebarrieren für die Cycloaddition eines NSCl-Moleküls
- Cycloaddition eines NSCl-Moleküls an ein Monoschwefeldinitridmolekül
- Minimumstruktur des 1-Chlor-1,2-dithia-3,4,5-triazols
- Übergangszustand und Energiebarrieren für die Cycloaddition eines NSCl-Moleküls
- Cycloaddition eines Thiazylkations an ein Monoschwefeldinitridmolekül
- Minimumstruktur des 1,2-Dithia-3,4,5-triazoliumkations
- Übergangszustand, Energiebarrieren und Grenzorbitalbetrachtung für die Cycloaddi-
- Abdissoziation des Cl-Substituenten vom 1-Chlor-1,2-dithia-3,4,5-triazol
- Reaktion zwischen einem Cl - -Ion und dem Chlorsulfenylrest des 1-Chlor-4-chlor-
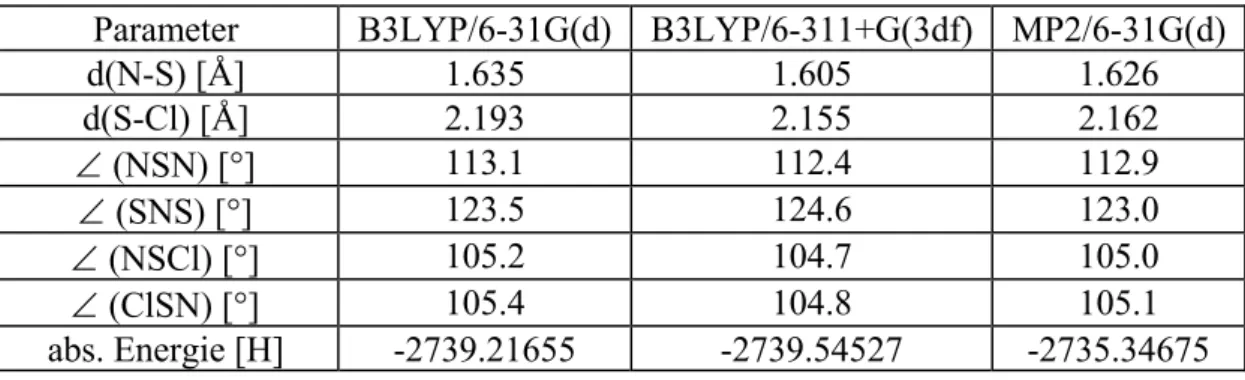
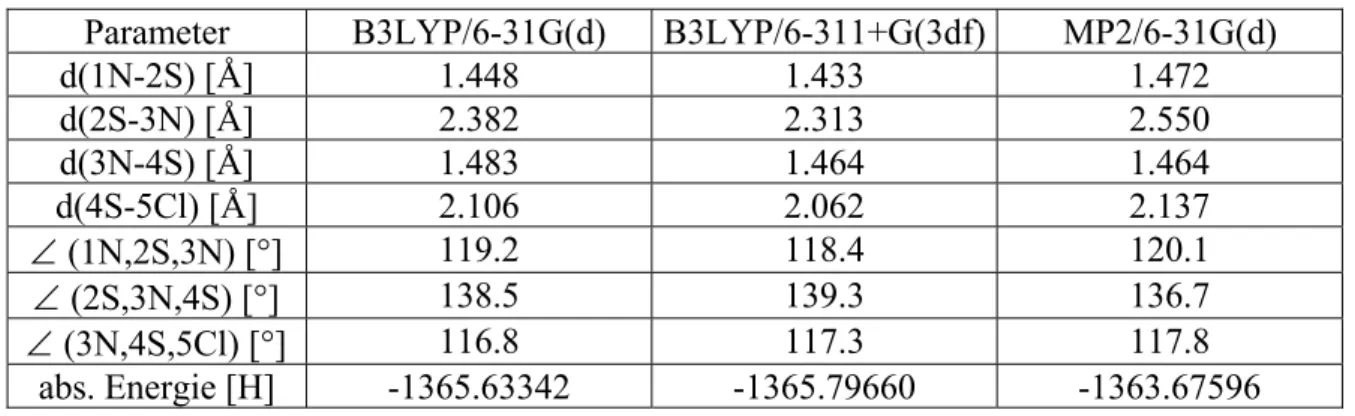
Die 2S-3N-Bindung lässt sich am besten als lange (vgl. Tabelle 16) Van-der-Waals-Bindung beschreiben, sodass das „Partikel“ als lockeres, elektrostatisches SN-Addukt eines NS+-Kations gebunden werden kann. Charakterisieren Sie das NSCl-Molekül. Die 2N-3N-Bindung lässt sich am besten als lange (vgl. Tabelle 19) Van-der-Waals-Bindung beschreiben, das „Partikel“ stellt also ein lockeres, elektrostatisches NN-Addukt eines NS+-Kations an ein NSCl-Molekül dar. Die mit B3LYP/6-311+G(3df) und MP2/6-31G(d) erhaltenen Mindeststrukturen des 1-chlorierten -4-Chlorsulfenyl-1,2-dithia-3,4,5-triazolium-Kations unterscheiden sich nicht deutlich von der in Abbildung 17 gezeigten B3LYP/6 -31G(d)-Minimalstruktur ab und ist daher nicht dargestellt, insbesondere wurde das 1-Chlor-4-chlorsulfenyl-1,2-dithia-3,4,5-triazolium-Kation durch optimiert Alle drei Methoden sind in der C1-Symmetrie und den Geometrien (siehe Tabelle 32) in etwa vergleichbar.
Gemäß den Tabellen 32 und 33 liegen alle Bindungen des 1-Chlor-4-chlorsulfenyl-1,2-dithia-3,4,5-triazolium-Kations nahezu im Einfachbindungsbereich. Übergangszustand und Energiebarrieren für die Cycloaddition von NSCl-Molekülen an kovalente cis-NN-Adduktmoleküle. NSCl-Moleküle an kovalente cis-NN-Adduktmoleküle. Es ist ersichtlich, dass die Cycloreversion des 1-Chlor-4-chlorsulfenyl-1,2-dithia-3,4,5-triazolium-Kations kinetisch stärker gehemmt ist als die Cycloaddition des NSCl-Moleküls an das kovalente Molekül des cis- NN-Addukt.
Gemäß Tabelle 37 auf der vorherigen Seite und Tabelle 38 liegen alle Bindungen von 1-Chlor-1,2-dithia-3,4,5-triazol nahezu im Bereich einer Einfachbindung. Übergangszustand und Energiebarrieren für die Cycloaddition eines NSCl-Moleküls an ein Monoschwefeldinitrid-Molekül eines NSCl-Moleküls an ein Monoschwefeldinitrid-Molekül. Es ist ersichtlich, dass die Cycloaddition eines NSCl-Moleküls an ein Monoschwefeldinitrid-Molekül kinetisch stärker gehemmt ist als die Cycloreversion von 1-Chlor-1,2-dithia-3,4,5-triazol.
Das 1,2-Dithia-3,4,5-triazolium-Kation wurde mit allen drei Methoden in C2v-Symmetrie optimiert und die resultierenden Geometrien (siehe Tabelle 42) sind ungefähr ähnlich, daher B3LYP/6-311+G(3df) und Die MP2/6-31G(d)-Minimalstruktur ist nicht dargestellt. Die experimentell bestimmten und B3LYP-berechneten Geometrie- und Bindungsdaten für das 1,2-Dithia-3,4,5-triazolium-Kation in den Tabellen 42 und 43 wurden bereits von A veröffentlicht. Dies zeigt, dass für B3LYP/6-31G (d ) und für B3LYP/6-311+G(3df) ist die Cycloreversion des 1,2-Dithia-3,4,5-triazolium-Kations kinetisch stärker gehemmt als die Cycloaddition eines Thiazyl-Kations an ein Monoschwefeldinitrid-Molekül.
Als Nullpunkt der Energieskala und aller anderen wird die minimale Strukturenergie B3LYP/6-31G(d) von 1-Chlor-1,2-dithia-3,4,5-triazol (siehe Abschnitt 4.5.8.1) gewählt Daraus werden Werte ermittelt. Reaktion zwischen Cl-Ion und Chlorsulfenyl-Einheit des 1-Chlor-4-chlorsulfenyl-1,2-dithia-3,4,5-triazolium-Kations 4-Chlorsulfenyl-1,2-dithia-3,4,5-triazolium-Kation. Die Energien der B3LYP/6-31G(d)-Minimumstrukturen von Schwefeldichlorid (siehe Abschnitt 4.5.6.1.) und 1-Chlor-1,2-dithia-3,4,5-triazol (siehe Abschnitt 4.5.8.1. ) ausgewählt und alle anderen Werte relativ dazu bestimmt.
Diskussion der Ergebnisse von 4.5. in Verbindung mit den Ergebnissen
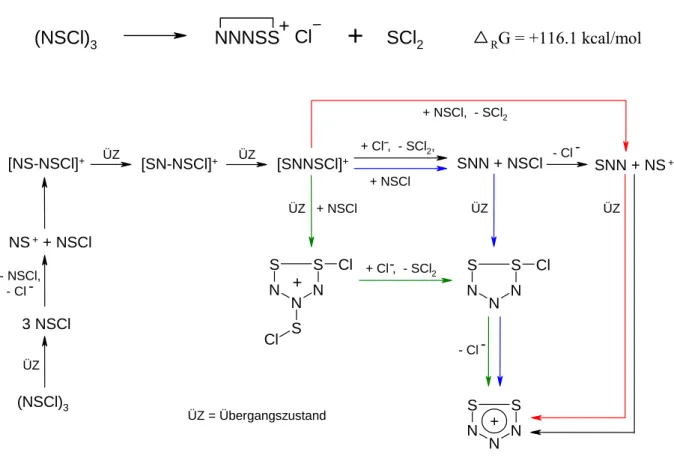
Die Dissoziation von (NSCl)3 erfolgt über einen Übergangszustand, der mit einem relativen Wert der freien Enthalpie (∆G-Wert) von 25,3 kcal/mol leicht zugänglich ist. Darüber hinaus erfolgt die Bildung der drei NSCl-Moleküle exergonisch mit einem Enthalpiegewinn von ∆G = -11,1 kcal/mol. Ein NSCl-Molekül wird dann in ein Chloridion und ein Thiazylkation gespalten, was mit den großen Enthalpiekosten von ∆G = +172,1 kcal/mol in der Gasphase verbunden ist.
Das resultierende NS+-Kation bindet mit einem Enthalpiegewinn von ∆G = -16,2 kcal/mol an ein NSCl-Molekül und bildet das lose elektrostatische Addukt SN [NS-NSCl]+. Unter der geringen Enthalpiezufuhr (∆G = +10,7 kcal/mol) zum Erreichen des Übergangszustands lagert sich das SN-Addukt zum elektrostatischen Addukt NN [SN-NSCl]+ um, mit einem sehr geringen Enthalpiegewinn von ∆G = -2,3 kcal / resultierende Mol. Übergangszustand zum energetisch günstigsten Addukt, kovalentes cis-NN [SNNSCl]+, mit einem Enthalpiegewinn von ∆G = -34,7 kcal/mol.
Anschließend muss ein weiteres NSCl-Molekül in ein Chloridion und ein Thiacylkation gespalten werden. Wie erwähnt geht dieser Prozess mit einer Enthalpie von ∆G = +172,1 kcal/mol in der Gasphase einher und ist daher stark endergonisch. Nun erfolgt die [3+2]-Cycloaddition von SNN und NS+ über einen Übergangszustand mit der niedrigen Aktivierungsenthalpie von ∆G = +3,5 kcal/mol. Dieser Reaktionsschritt durchläuft einen Übergangszustand mit einer Aktivierungsenthalpie von ∆G = +21,2 kcal/mol und ist mit einer Enthalpiebilanz von ∆G = +2,1 kcal/mol nur leicht endergonisch.
Der nun stattfindende barrierefreie Angriff des Chloridions am S-Atom des Chlorsulfenylrestes des 1-Chlor-4-chlorsulfenyl-1,2-dithia-3,4,5-triazolium-Kations und die damit verbundene Abspaltung von SCl2 ist verbunden mit einem Enthalpiegewinn von ∆ G = -151,0 kcal/mol stark exergonisch. Dieser Reaktionsschritt, bei dem ein SCl2- und ein SNN-Molekül gebildet werden, ist stark exergonisch mit einem Enthalpiegewinn von ∆G = -174,3 kcal/mol. Diese Cycloaddition durchläuft einen Übergangszustand mit der Aktivierungsenthalpie von ∆G = +33,7 kcal/mol und ist gemäß der Enthalpiebilanz mit a endergonisch.
Branch, die hoch endergonische, barrierefreie Dissoziation eines Chloridions aus 1-Chlor-1,2-dithia-3,4,5-triazol mit einem Enthalpieaufwand von ∆G = +139,5 kcal/mol.
Alternativer Reaktionsweg?
- Umlagerung des trimeren Thiazylchlorids (NSCl) 3
- Minimumstruktur des Umlagerungsproduktes
- Vergleich der Ergebnisse von 4.7.1. mit Ergebnissen von 4.4. und Schlussfol-
Die Verzweigung beginnt, wie der weitere Verlauf des obigen Reaktionswegs, mit dem ungehinderten Angriff eines Chloridions am S-Atom des kovalenten cis-NN-Addukts, das den Chlorsubstituenten trägt. Darüber hinaus wird die Umlagerung des trimeren Thiazylchlorids kinetisch sehr stark behindert, wie in Abbildung 30 auf der nächsten Seite dargestellt. Die MP2/6-31G(d) minimale Strukturenergie des trimeren Thiazylchlorids (siehe Abschnitt 4.4.1. in Kapitel 4.4.) wurde ausgewählt und alle anderen Werte in Bezug darauf angegeben.
Das mit B3LYP/6-31G(d) erhaltene Potenzial wird nicht gezeigt, da es gut mit dem Potenzial in Abbildung 30 vergleichbar ist. Der Übergangszustand mit MP2/6-31G(d) und B3LYP/6-31G(d) beträgt etwa 160 kcal/mol auf die Minimalstruktur von trimerem Thiazylchlorid. Die Chloratome liegen nicht über der SSS-Ebene, sondern darunter und bewegen sich helixartig vom Zentrum des Moleküls weg.
Haas, die Umlagerung des trimeren Thiazylchlorids, ist endergonisch, endotherm und kinetisch so behindert, dass zur Überwindung der Energiebarriere eine Bestrahlung mit UV-Licht erforderlich wäre. Im Gegensatz dazu ist die Dissoziation des trimeren Thiazylchlorids exergonisch, obwohl sie auch endotherm ist. Zudem wird die Dissoziation kinetisch deutlich weniger gehemmt als die Umlagerung, so dass die Energiebarriere der Dissoziation thermisch sehr einfach überwunden werden kann.
Das beste Argument gegen seinen Reaktionsweg liefert Haas selbst im experimentellen Teil seiner Ausführungen2a, wenn er schreibt, dass das Reaktionsgemisch aus trimerem Thiazylchlorid und Tellurtetrachlorid in Dichlormethan zwei Tage lang auf 65 °C erhitzt wird.
![Tabelle 49 Thermodynamik der Reaktion (in Pfeilrichtung) Energieumsatz [kcal/mol] B3LYP/6-31G(d) MP2/6-31G(d)](https://thumb-eu.123doks.com/thumbv2/1library_info/19311419.0/53.892.235.664.218.341/tabelle-thermodynamik-der-reaktion-pfeilrichtung-energieumsatz-kcal-lyp.webp)
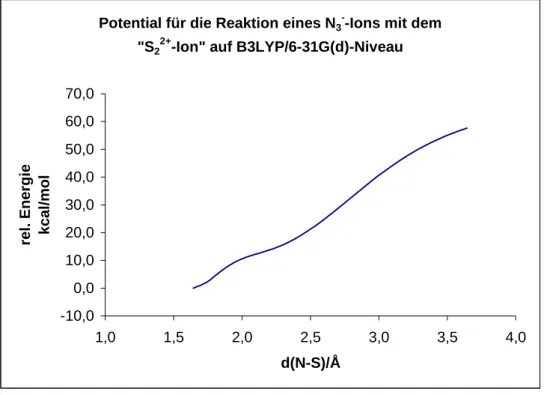
Reaktion des Azidions N 3
- Minimumstruktur des Azidions
- Minimumstruktur des hypothetischen Dischwefeldikations
Gemäß Tabelle 55 gibt es im S22+-Ion eine Dreifachbindung, wobei jedes S-Atom die Hälfte der gesamten positiven Ladung trägt, daher ist die Resonanzstruktur mit dem größten Gewicht:
Zusammenfassung
Verwendete Rechner und Rechenmethoden
Literatur
![Tabelle 17 Thermodynamik der Reaktion (in Pfeilrichtung, Bildung des cis-NN-Adduktes) Energieumsatz [kcal/mol] B3LYP/6-31G(d) B3LYP/6-311+G(3df) MP2/6-31G(d)](https://thumb-eu.123doks.com/thumbv2/1library_info/19311419.0/26.892.144.756.730.1194/tabelle-thermodynamik-reaktion-pfeilrichtung-bildung-adduktes-energieumsatz-kcal.webp)