Vivian Narana Ribeiro El Achkar
AVALIAÇÃO DO PROCESSO DE REPARAÇÃO TECIDUAL APÓS EXÉRESE REALIZADA COM BISTURI CONVENCIONAL E BISTURI HARMÔNICO HARMONIC® DE NECROSE INDUZIDA EM LÍNGUA DE
RATO: ESTUDO MACROSCÓPICO E HISTOLÓGICO
AVALIAÇÃO DO PROCESSO DE REPARAÇÃO TECIDUAL APÓS EXÉRESE REALIZADA COM BISTURI CONVENCIONAL E BISTURI HARMÔNICO HARMONIC® DE NECROSE INDUZIDA EM LÍNGUA DE
RATO: ESTUDO MACROSCÓPICO E HISTOLÓGICO
Dissertação apresentada ao curso de Odontologia do Instituto de Ciência e Tecnologia, UNESP – Univ Estadua Paulista, Campus de São José dos
Campos, como parte dos requisitos para obtenção do título de MESTRE, pelo Programa de Pós- Graduação em BIOPATOLOGIA BUCAL, Área Patologia.
Orientador: Prof. Titular Walter D. Niccoli Filho
Prof. Titular Walter D. Niccoli Filho (Orientador) Instituto de Ciência e Tecnologia
UNESP – Univ Estadual Paulista
Campus de São José dos Campos
Prof. Dr. Rubens Guimarães Filho
Faculdade de Odontologia Universidade de Taubaté - UNITAU Campus de Taubaté
Profa. Dra. Graziella Nuermberg Back-Brito
Instituto de Ciência e Tecnologia UNESP – Univ Estadual Paulista
Campus de São José dos Campos
DEDICATÓRIA
Ao Prof. Titular Walter Nicolli Filho, meu orientador. Meu agradecimento especial, por todo incentivo, apoio, aprendizado e confiança. Coadjuvante do meu crescimento profissional e, principalmente, pessoal, o tenho como grande amigo.
À Banca do Exame Geral de Qualificação e Defesa de Dissertação. Prof. Dr. Rubens Guimarães Filho, que contribuiu com seu conhecimento e generosidade. E Profa. Dra. Graziella Nuernberg Back Brito, pessoa e profissional excepcional, a admiro e tenho como exemplo, tal como professora e amiga.
À Faculdade de Odontologia de São José dos Campos pela base e pela oportunidade.
Ao Programa de Pós-Graduação em Biopatologia Bucal, á coordenadora, Profa. Adj. Juliana Campos Junqueira e vice-coordenadora, Profa. Dra. Ana Lia Anbinder.
À CAPES, pela concessão da bolsa de mestrado.
À Johnson e Johnson, em especial à Aliny Pimentel, que colaborou e incentivou este estudo, nos mais diversos aspectos. Aos professores do Programa, por ampliar meus conhecimentos e mostrar novos horizontes.
Aos meus colegas do curso, parceiros dessa jornada, que tornavam leves os momentos difíceis, cada um a sua maneira. Aos alunos do Ambulatório de Propedêutica, que auxiliaram direta e indiretamente na execução desse estudo e foram ótimas companhias nas quartas-feiras.
À Gerusa de Oliveira Moura Cardoso. Parceira, amiga, conselheira e grande colaboradora na execução de todo o trabalho. Muito obrigada por estar sempre disponível, fosse para o trabalho, para um conselho ou para momentos de descontração.
Aos meus poucos e bons amigos de longa data. Quem o é, sabe! Amigos que me acompanharam de perto e de longe, obrigada, infinitamente, pelo apoio, carinho e compreensão. Sei que pude contar com cada um e chegou a hora de dividir com vocês a concretização de um objetivo.
ABSTRACT ... 10
LISTA DE ABREVIATURAS E SIGLAS ... 11
1 INTRODUÇÃO ... 12
2 REVISÃO DA LITERATURA ... 14
2.1 Tecido Conjuntivo e componentes ... 14
2.2 Células da inflamação ... 17
2.3 Cicatrização da ferida ... 23
2.4 Bisturi Harmônico Harmonic® ... 33
3 OBJETIVOS ... 35
3.1 Objetivos gerais ... 35
3.2 Objetivos específicos ... 35
4 MATERIAIS E MÉTODO ... 36
4.1 Caracterização da amostra ... 36
4.2 Indução da área necrótica em borda lateral de língua ... 36
4.3 Procedimentos cirúrgicos ... 37
4.4 Períodos de observação ... 40
4.5 Análise Macroscópica ... 41
4.6 Análise Microscópica ... 41
5 RESULTADOS ... 43
5.1 Análise Clínica ... 43
5.1.1 Pós-operatório de sete dias ... 43
5.1.2 Pós-operatório de 14 dias ... 44
5.1.3 Pós-operatório de 28 dias ... 45
5.2 Análise Histológica ... 46
5.2.1 Língua Normal ... 46
5.2.2 Língua com necrose induzida por Ethamolin®... 47
5.2.3 Pós-operatório de sete dias ... 48
RESUMO
O bisturi harmônico Harmonic® foi introduzido na prática cirúrgica há mais de uma década, com o intuito de minimizar os riscos das tecnologias eletro-cirúrgicas, dano energético local e/ou periférico, além de complicações associadas a energia monopolar. Tem como característica a conversão da energia elétrica em energia mecânica, levando a lâmina ativa à vibração de 55.500Hz por segundo produzindo um aquecimento secundário, que promove a formação de um coágulo adesivo enquanto corta, selando veias e vasos linfáticos de até 5 mm de diâmetro. Contribui com a diminuição do tempo de cirurgia, perda sanguínea e dor pós-operatória, com temperaturas inferiores quando comparado com bisturi elétrico e lasers de alta potência. Tendo em vista as diversas vantagens atribuídas ao bisturi harmônico e a escassez de literatura concernente, julgou-se necessário um estudo que avalie os parâmetros na reparação tecidual do tratamento cirúrgico com bisturi harmônico Harmônic® quando comparado com o convencional, levando-se em consideração os estágios da reparação tecidual na língua. Para isso, foi realizada indução a necrose em borda lateral de língua em 18 ratos, divididos em 2 grupos para remoção cirúrgica da lesão com bisturi harmônico Harmônic® e bisturi convencional. Tomadas as medidas pós-operatórias, 3 ratos por grupo foram sacrificados em 7, 14 e 28 dias e submetidos às análises macroscópica e microscópica. Apesar das diferenças clínicas e histológicas observadas nos tempos iniciais, ao final, a qualidade do processo de reparo foi semelhante em ambos os grupos.
ABSTRACT
The Harmonic® scalpel (HS) was shown in surgical practice for more than a decade, with the aim of minimizing the risks of electro-surgical technologies, local energy damage and/or peripheral, in addition to complications associated with monopolar energy. Characterize by the conversion of electrical energy into mechanical energy leading to active blade vibration of 55,500 Hz per second producing a secondary heating which promotes the formation of a blood clot while cutting, adhesive sealing veins and lymphatic vessels of up to 5 mm in diameter. Contributes to the reduction of the time of surgery, postoperative pain and blood loss with lower temperatures when compared to electric scalpel and high-power lasers radiation. Considering the several advantages attributed to HS and the paucity of literature regarding was deemed necessary a study that evaluates the parameters on tissue repair of surgical treatment with HS when compared with the conventional scalpel (CS), taking into account the stages of tissue repair in the tongue. For that a necrosis induction of lateral border of tongue was held in 18 rats divided into 2 groups for surgical removal of the lesion with HS and CS. Three rats per group were sacrificed at 7, 14 and 28 days and subjected to macroscopic and microscopic analyses. Despite the clinical and histological differences observed in early times and in the end, the quality of the repair process was similar in both groups.
BC Bisturi Convencional
BH Bisturi Harmônico
CD Cluster de Diferenciação
ECF-A Fator Quimiotático Eosinofílico para Anafilaxia
GAG’s Glicosaminoglicanas
HE Hematoxilina e Eosina
IFN Interferon
IL Interleucinas
LAK Célula matadora ativada por linfocina LGG Linfócitos Grandes Granulares
MHC Complexo Principal de Histocompatibilidade NK Natural Killer
PAF Fator de Ativação Plaquetária TA Células T auxiliares
TC Célula T citotóxica TCR Receptor de célula T TH Célula T helper
TNF-α Fator de Necrose Tumoral Alfa
A reparação tecidual é um fenômeno dinâmico e complexo que compreende diferentes processos, interdependentes e simultâneos, entre eles, inflamação, proliferação celular e síntese de elementos que constituem a matriz extracelular, como colágeno, elastina e fibras reticulares (Thomas et al., 1995). A síntese de colágeno é um
processo rápido e harmônico que tem seu início com a lesão intersticial e se estende até o final da fase de cicatrização, quando ocorre a remodelação dos tecidos.
As respostas teciduais às lesões, sejam induzidas por traumatismo ou por cirurgia, envolvem inflamação. Este é um componente necessário no processo de reparação por proporcionar mecanismos pelos quais o tecido lesionado ou a etiologia seja eliminado, embora a resposta varie de acordo com a causa.
Os tecidos lesionados curam-se por regeneração, reparo ou combinação destas duas modalidades. A regeneração tecidual é a reposição do tecido lesionado ou perdido por um tecido que é estrutural e funcionalmente similar, enquanto o reparo tecidual é a formação do tecido cicatricial não funcional.
granulação (segunda intenção) ou optar por técnicas de anaplastia (terceira intenção). (Hess, 2003; Johnstone, 2005 e Enoch, 2007).
As feridas cirúrgicas tendem de um modo geral a cicatrizarem. Quatro componentes principais estão presentes no processo de cicatrização: os macrófagos tissulares, os fibroblastos, os capilares (angiogênese) e os granulócitos.
Os tratamentos cirúrgicos convencionais são rápidos, mas também podem afetar as partes saudáveis do corpo, muitas vezes produzindo efeitos colaterais indesejados. A técnica cirúrgica comprometida pela lesão tecidual, a excessiva manipulação tecidual e o traumatismo intenso, comprometem o aporte sanguíneo para os tecidos envolvidos.
O bisturi harmônico Harmonic® foi introduzido na prática cirúrgica a, aproximadamente, uma década, como esforço para minimizar os riscos das tecnologias eletro-cirúrgicas, dano elétrico local e periférico, e, as raras complicações associadas com energia monopolar (Matthews
et al, 2008). Durante este período, pesquisas das diversas especialidades
da medicina, in vitro como in vivo, com o uso de instrumentação
ultra-sônica, tais como bisturi e tesoura, demonstraram uma melhora na segurança do ato cirúrgico.
Esta pesquisa tem por objetivo analisar determinados parâmetros da reparação tecidual frente ao tratamento cirúrgico convencional versus bisturi harmônico Harmonic®. Levando-se em
2.1 Tecido conjuntivo e componentes
O tecido conjuntivo desempenha as funções de sustentação, preenchimento, armazenamento, transporte, defesa e reparação. Originam-se do mesênquima, embrionário, caracterizado por possuir células com prolongamentos, mergulhadas em abundante substância extracelular pouco viscosa. As células mesenquimais possuem núcleos ovóides, com a cromatina fina. O mesênquima deriva principalmente do folheto embrionário médio ou mesoderme e suas células migram, envolvendo os órgãos em formação e neles penetrando. Além de dar origem aos tecidos conjuntivos, a mesoderme forma outras estruturas, como vasos sanguíneos, células do sangue e tecidos musculares (Cleary; Gibson, 1983).
O tecido conjuntivo apresenta diversos tipos de células separadas pela matriz, composta por fibras e substância fundamental amorfa, constituída por um gel viscoso de macromoléculas alongadas (glicosaminoglicanas, proteoglicanas e glicoproteínas adesivas) muito hidratadas, que formam um arcabouço entrelaçado e ligado às fibras e a receptores celulares (Alberts et al., 1997).
organizada, associada à superfície celular que os produz, ocupando os espaços que as circundam (Alberts et al., 1997).
Três grupos de macromoléculas associam-se fisicamente para formar a matriz extracelular: proteínas estruturais fibrosas, como os colágenos e as elastinas, um grupo distinto de glicoproteínas adesivas, incluindo fibronectina e laminina e um gel formado de cadeias de polissacarídeos da classe glicosaminoglicanas (GAGs), que são encontradas ligadas covalentemente a proteínas na forma de proteoglicanas (Alberts et al., 1997; Cotran; Kumar; Collins, 2000).
Essas macromoléculas reúnem-se em duas organizações distintas, a saber, matriz intersticial e membrana basal. A matriz intersticial é encontrada nos espaços entre células epiteliais, endoteliais e musculares lisas, bem como no tecido conjuntivo. Consiste em colágeno (tipos I, III, IV), elastina, fibronectina, proteoglicanas, hialuronato e outros componentes. A membrana basal é produzida por células epiteliais, mesenquimatosas, dentre outras e estão estreitamente associadas à superfície celular. São constituídas por uma rede de colágeno não–fibrilar
amorfo (principalmente do tipo IV), laminina, heparan-sulfato, proteoglicano e outras glicoproteínas (Cotran; Kumar; Collins, 2000). É uma estrutura fina, porém resistente, que possui papel importante no controle do comportamento celular (Alberts et al., 1997).
matriz extracelular também estão ligadas diretamente na formação de novos vasos sanguíneos (angiogênese). (Lochter; Bissell, 1995).
Diferentes componentes da matriz extracelular podem competir pelo mesmo receptor potencializando o número de possíveis interações entre a matriz extracelular e receptores celulares da mesma. O modo preciso de ações da matriz extracelular permanece indefinido, mas evidências disponíveis sugerem que a matriz extracelular influencia os procedimentos celulares por mudanças na organização tridimensional do citoesqueleto e ativação de segundo mensageiro e via da proteína quinase (Lochter; Bissel, 1995).
As células do tecido conjuntivo são os fibroblastos, macrófagos, mastócitos, plasmócitos, células adiposas e leucócitos (glóbulos brancos). Algumas células se originam localmente, enquanto outras, como os leucócitos, vem de outros locais e são habitantes temporários. As células do conjuntivo tem a capacidade de se multiplicarem para regenerar ou reparar o tecido destruído (Stites; Terr; Parslow, 2000).
Os fibroblastos sintetizam as fibras colágenas e elásticas, as glicoproteínas e as proteoglicanas da matriz extracelular. A célula ativa é denominada de fibroblasto, enquanto se quiescente é conhecida como fibrócito (Minor, 1988).
Há uma célula que tem características intermediárias entre o fibroblasto e a célula muscular lisa: o miofibroblasto. Este participa da contração da ferida. Essa célula tem a morfologia de um fibroblasto, mas contém maior quantidade de actina (microfilamentos) e de miosina. No tecido conjuntivo de adulto os fibroblastos não se dividem com frequência, entrando em mitose apenas quando ocorre uma solicitação, como por exemplo, em lesões do tecido conjuntivo (Stites; Terr, 1992, 2000).
2.2 Células da inflamação
Os macrófagos são originários de células precursoras do saco vitelínico, migrando para o fígado, baço e medula óssea, antes e logo após o nascimento. Já nos indivíduos adultos, os macrófagos têm origem em uma célula pluripotente mielóide, presente na medula óssea, a partir da qual são originadas diferentes células progenitoras, entre elas as
“unidades formadoras de colônias de granulócitos e monócitos”. Estas
dão origem aos pró-monócitos, que apresentam capacidade de pinocitose e expressam uma série de receptores característicos de macrófagos. Os pró-monócitos, por sua vez, dão origem aos monócitos que saem da medula óssea e ganham a circulação sanguínea. Os monócitos permanecem na circulação por cerca de 1 a 3 dias, período após o qual migram para os diversos tecidos, onde se diferenciam e formam uma população residente de macrófagos, com tempo de vida variando entre 2 e 4 meses (Neveu, 1986; Nelson; Jow, 1990).
Durante o processo de transformação do monócito em macrófago, ocorre aumento da síntese proteica, do tamanho da célula, do tamanho do aparelho de Golgi e do núcleo de lisossomos, microtúbulos e microfilamentos (Rappoplee; Werb, 1988; Greenberg, 1995).
O macrófago é uma célula muito ativa na movimentação amebóide, com grande capacidade de fagocitose, morfologia variável conforme seu estado funcional e sua localização, núcleo ovóide ou em forma de rim, com cromatina condensada (Roitt; Brostoff; Male, 1999; Gordon, 1999). Tem importante papel na remoção de restos de células, de elementos extracelulares que se formam nos processos involutivos fisiológicos e de material extracelular alterado. Influenciam a atividade celular e a homeostase em vários tecidos; são células apresentadoras de antígenos para o reconhecimento inicial e remoção de células senescentes e providenciam uma linha frontal de defesa contra antígenos invasores e células tumorais recém-formadas.
Além das moléculas envolvidas nos mecanismos microbicidas e citotóxicos, os macrófagos secretam uma série de citocinas regulatórias, como fator de necrose tumoral alfa (TNF-α), interleucinas e
fator de crescimento de fibroblastos. Essas citocinas podem exercer efeitos autócrinos ou parácrinos, controlando a proliferação, diferenciação e função efetora dos próprios macrófagos, linfócitos e outras células envolvidas na resposta imunológica (Nathan, 1987; Bianchi et al, 1998).
Os macrófagos interagem com outras células e com a matriz extracelular em diversas situações durante sua ontogenia e diferenciação, assim como em resposta a estímulos fisiológicos apropriados. Sua habilidade de interagir com moléculas da matriz extracelular, tais como, colágeno, laminina e fibronectina, é um fator determinante para o desenvolvimento de suas funções. Essa interação permite que as células possam aderir-se e espraiar-se sobre a matriz e se dá via receptores específicos presentes na membrana celular, entre os quais se destacam as integrinas. Além de serem receptores de adesão, as integrinas funcionam como transdutores de sinal via fosforilação de resíduos de tirosina (Lin et al, 1994). Assim, a interação dos receptores
integrínicos com seus ligantes na matriz extracelular desencadeia uma série de cascatas de sinalização intracelular, influenciando a expressão gênica e regulando, dessa forma, processos como crescimento celular e apoptose (Unanue et al, 1987).
Os linfócitos são exemplos de células do sistema imune que reconhecem antígenos estranhos, proteínas sanguíneas, e respondem com barreiras físico-químicas. As respostas imunes específicas são mediadas pelos linfócitos, as únicas células do organismo capazes de reconhecer e distinguir especificamente determinantes antigênicos diferentes. Ainda que morfologicamente semelhantes, os linfócitos são constituídos por sub-populações bem distintas (Abbas et al, 2000a, 2000b).
Uma classe de linfócitos é constituída pelos linfócitos B (células B) que iniciam maturação na medula óssea (Greenberg, 1994; Schultz et al., 1990). Eles são classicamente definidos pela presença de
CD22, são atualmente os principais marcadores utilizados na identificação de células B humanas e em camundongos (Roitt et al, 1999; Lai et al., 1998).
Uma segunda classe de linfócitos é formada pelos linfócitos T, cujos precursores originam-se na medula óssea, depois migram pela corrente sanguínea para o timo e aí amadurecem, constituindo os linfócitos T CD3. Subdividem-se em populações funcionalmente distintas, das quais as mais bem definidas são as células T auxiliares ou helper (TA, TH ou TCD4) e as células T citotóxicas ou
citolíticas (TC, CTLs ou TCD8). Essas células T reconhecem e respondem aos antígenos associados à superfície celular e não aos solúveis, de tal modo que o seu receptor de antígenos (TCR - constituído de polipeptídios) reconhece somente antígenos peptídicos ligados as proteínas codificadas por genes no complexo de histocompatibilidade principal (MHC) e expressas na superfície de outras células (Abbas et al, 2000b).
A função de reconhecimento de antígenos no organismo não está restrita somente às imunoglobulinas, mas é realizada também pelos receptores de células T (TCR), que se ligam aos peptídeos antigênicos. Em um determinado evento das respostas imunes, esses fragmentos antigênicos são apresentados para as células T no contexto das moléculas do MHC. O reconhecimento do antígeno/MHC pelo TCR é a interação biológica fundamental para iniciar e perpetuar a resposta imune, como ativar a proliferação e diferenciação das células T, assim como o desempenho de suas funções efetoras (Frazer et al, 1999).
Tanto o CD4 como o CD8 são membros glicoprotéicos transmembrânicos da superfamília das imunoglobulinas (Ig), mas estruturalmente distintos (Parnes, 1989).
A diversidade funcional das células T foi demonstrada por análises de clones de células T helper para os padrões de secreção de
de clones TCD4 . O grupo TH1, que secreta IL-2 e IFN-ß, e o grupo TH2, que produz IL-4, IL-5, IL-6 e IL-10. As células TH1 determinam funções associadas a citotoxidade e às reações inflamatórias. As células TH2 são mais eficazes na estimulação da proliferação e da produção de anticorpos pelas células B (Roitt et al, 1999).
Uma terceira classe de linfócitos que não expressa marcadores para célula T e B, designados matadores naturais (Natural Killer - NK), são grandes linfócitos (linfócitos grandes granulares - LGG)
derivados da medula óssea. Apresentam numerosos grânulos citoplasmáticos, contendo perforinas, granzimas e proteoglicanas (como as células TC). A exocitose desses grânulos pode lisar osmoticamente as células alvos e induzir a morte apoptótica pelas vias perforina/granzima B. A ausência de CD3 e presença de CD56 e CD16, ou ambos, são características atualmente empregadas como marcadores definitivos de células NK humanas, embora ambos os marcadores possam ser encontrados em uma minoria de linfócitos T (Roitt et al, 1999 e Abbas et al, 2000a).
Células NK são uma subpopulação distinta de linfócitos que, sem sensibilização prévia e sem necessidade de restrição ao MHC, podem matar células tumorais e células normais infectadas por vírus. O mecanismo pelo qual as células NK preferencialmente reconhecem e lisam alvos transformados em vez de normais, encontra-se na obscuridade. A atividade citotóxica das células NK pode ser aumentada in vitro e in vivo com linfocinas IL-2 e IFN, originando as células LAK (células
matadoras ativadas por linfocinas). (Greenberg, 1994).
As células LAK matam as células tumorais resistentes para as células NK e não atingem as células normais, in vitro. Assim, a
atividade das células NK pode ser intensificada pelas respostas imunes de célula T (Greenberg, 1994; Schreiber, 1999).
posição excêntrica e estão mais presentes nos locais sujeitos à penetração de bactérias e proteínas estranhas, como a mucosa intestinal e em grande quantidade nas inflamações crônicas (onde predominam plasmócitos, linfócitos e macrófagos) (Greenberg, 1995).
Os plasmócitos sintetizam e secretam anticorpos específicos, fabricados em resposta a penetração de moléculas estranhas denominadas antígenos. A reação antígeno-anticorpo traz diversos efeitos, dentre eles a neutralização de ações prejudiciais que o antígeno poderia ter sobre o organismo (Greenberg, 1995).
O mastócito se origina da medula óssea, é uma célula globosa, grande e com citoplasma carregado de grânulos basófilos eletrondensos que se coram intensamente, frequentemente sobrepondo-se sobre sobrepondo-seu núcleo esférico e central (Cohn, 1978). Seus grânulos são metacromáticos por conterem heparina ou sulfato de condroitina e glicosaminoglicanas sulfatadas. Esses grânulos contêm também mediadores químicos da inflamação, como histamina e fator quimiotático dos eosinófilos na anafilaxia, mais conhecida pela sigla ECF-A (Eosinophil Chemotactic Factor of Anaphylaxis), que atrai eosinófilos. Como as moléculas produzidas pelos mastócitos atuam localmente, tem-se uma secreção parácrina (Ioachim et al., 2002).
Existem pelo menos duas populações diferentes de mastócitos, porém com a mesma morfologia. Uma delas encontra-se no tecido conjuntivo em geral, e contém grânulos com heparina, substância anticoagulante. A outra está presente nas mucosas e seus grânulos contêm sulfato de condroitina. Segundo Krstic (1984), grande parte das moléculas de imunoglobulinas-E fixa-se na superfície dos mastócitos, que contêm seus receptores específicos.
No tecido conjuntivo são encontrados ainda outros leucócitos como neutrófilos e eosinófilos.
2.3 Cicatrização de feridas
A cicatrização visa à restauração dos tecidos lesados, a fim de preservar sua estrutura (Fine et al, 2001).
O conceito mais importante a este respeito é a compreensão de que a cicatrização não consiste em uma série de
eventos, e sim, em um “concerto” de processos de ocorrência simultânea,
alguns dos quais continuam por muitos anos após o restabelecimento da integridade física do tecido lesado. Para o epitélio caracterizam-se três tipos principais de lesões:
a) lesão superficial: quando atinge somente o epitélio sem comprometer a camada basal da derme, existe epitelização por deslocamento das células sem resultar em cicatriz;
b) lesão profunda: constituída por ferida incisa limpa com perda inapreciável de tecido, mínima hemorragia, ausência de infecção e com bordas bem justapostas;
Há uma grande variabilidade nos processos de regeneração, dependendo de fatores locais e sistêmicos como fatores do hospedeiro, locais e externos. Embora o tipo de ferimento, tempo de evolução, órgão ou tecido envolvido e as técnicas utilizadas interfiram na cicatrização, o processo é basicamente o mesmo. Este processo ocorre em todo o organismo. Em termos clínicos, pode ser classificada em primeira, segunda ou terceira intenção (Cotran et al, 2000):
a) primeira intenção: quando os bordos são unidos;
b) segunda intenção: quando não é possível unir os bordos; neste caso o próprio organismo preenche o espaço necessário à cicatrização;
c) terceira intenção: está evoluindo por segunda intenção e sutura-se para ajudar. Não é primeira nem segunda intenção (Johnstone et al, 1995, Hess et al, 2003 e Enoch et al, 2007).
A cicatrização por primeira intenção é a mais rápida e forma cicatrizes menores, visto que a fenda da ferida é mais estreita e a destruição tecidual nas suas bordas é menor. O exemplo clássico é o das feridas cirúrgicas (Weissman, 1992).
Na primeira fase da cicatrização, ou fase inflamatória, os principais eventos são: hemostasia, quimiotaxia leucocitária e diapedese, fagocitose e liberação de fatores de crescimento. A segunda fase, ou fase de proliferação celular é dividida em outros três eventos: angiogênese, proliferação fibroblástica e epitelização (Kohn, 1992). Na terceira fase conhecida como formação do tecido conjuntivo, continua se formando o tecido de granulação, sendo sua principal característica a presença de fibroblastos que produzem matriz extracelular, colágeno e glicosaminoglicanas. A quarta fase, ou fase da contração, caracteriza-se pela aproximação das bordas da ferida pela movimentação das mesmas através dos miofibroblastos. A quinta fase, chamada de remodelação, é basicamente descrita por modificações no tecido conjuntivo, principalmente na matriz extracelular, como o aumento na resistência entre as fibras colágenas, ação das colagenases e diminuição da quantidade de água, devido à diminuição de proteoglicanos e da vascularização (Springer, 1994).
Logo a cicatrização de feridas envolve a indução de um processo inflamatório agudo pelo ferimento, a regeneração de células parenquimatosas, a migração e a proliferação de células teciduais parenquimatosas e conjuntivas, a síntese de proteínas da matriz extracelular, o remodelamento do tecido conjuntivo e dos componentes parenquimatosos, a colagenização e a aquisição de força pela ferida (Weissman, 1992).
Celsus, escritor romano do primeiro século d.C.,
enumerou quatro sinais cardeais da inflamação: rubor, tumor, calor e dor e Virchow acrescentou um quinto sinal clínico: perda de função (Cotran;
Kumar; Collins, 2000).
formas superiores de vida como uma reação dos vasos sanguíneos, que conduz um acúmulo de líquido e de leucócitos no tecido extracelular (Springer, 1994). A inflamação atua no sentido de bloquear, diluir ou destruir o agente agressor, substituindo tecido agredido pela regeneração das células parenquimatosas nativas e pelo preenchimento de tecido fibroblástico, reconstituindo e cicatrizando o tecido lesado (Majno, 1992).
As células do tecido conjuntivo envolvidas na resposta inflamatória são mastócitos, fibroblastos, macrófagos e linfócitos residentes; as células circulantes incluem neutrófilos, monócitos, eosinófilos, linfócitos, basófilos e plaquetas (Kohn, 1992).
A inflamação é dividida em padrões agudo e crônico. A inflamação aguda é a resposta imediata e inicial a um agente agressor, tem duração relativamente curta e tem como características principais a exsudação de líquidos e de proteínas plasmáticas e a migração de leucócitos, principalmente neutrófilos (Springer, 1994). Para que os leucócitos possam alcançar o interstício, é preciso que haja adesão ao endotélio e transmigração, conhecida como diapedese.
Os fenômenos vasculares na inflamação aguda caracterizam-se pela dilatação arteriolar e abertura de leitos capilares resultando num aumento do fluxo sanguíneo para a região agredida, e este aumento de líquido extravascular rico em proteínas constitui o exsudato (Weissman, 1992).
A inflamação crônica tem longa duração, e ao contrário da aguda que se manifesta por alterações vasculares, edema e infiltração basicamente neutrofílica, caracteriza-se por infiltração de células mononucleares que incluem macrófagos, linfócitos e plasmócitos, destruição tecidual, proliferação de pequenos vasos sanguíneos e fibrose (Majno, 1992).
A fase inflamatória inicia-se imediatamente após a injúria. Quando ocorre o ferimento, a lesão dos vasos produz sangramento, e a resposta do organismo frente a esse evento é a hemostasia, que se traduz por vasoconstricção e formação de coágulo (Fine; Mustoe, 2001; Young, 2001). O coágulo auxilia na aproximação das bordas lesadas e na formação de uma matriz, na qual fibroblastos, células endoteliais e queratinócitos podem ingressar (Horn, 1993).
Após a hemostasia ocorre vasodilatação, mediada por várias substâncias, como a histamina e serotonina, bradicinina, prostaglandinas e óxido nítrico, que permite um aumento do fluxo sanguíneo para a área do ferimento, causando calor e rubor, levando mais nutrientes, células reparadoras e oxigênio para o interstício, aumentando sua pressão osmótica. A vasodilatação aumenta a pressão hidrostática, levando a uma fuga de líquidos para o meio extravascular. A associação desses fenômenos leva ao edema local (Fine et al, 2001).
e liberação de grânulos para a rede de fibrina, provocando hidrólise enzimática da matriz extracelular. Todos esses eventos visam à promoção da limpeza da área lesada e o início da fase seguinte (Springer, 1994; Witte et al, 1997 e Fine et al, 2001).
Durante os dois ou três dias seguintes, as células predominantes são os macrófagos, os quais são provenientes da migração e diapedese dos monócitos circulantes ou são residentes do próprio tecido (Fine et al, 2001).
Linfócitos também aparecem no local da lesão, mas em número pequeno. Acredita-se que os linfócitos estejam relacionados aos processos inflamatórios crônicos (Fine et al, 2001).
A angiogênese é o processo pelo qual surgem novos vasos para refazer a circulação local, necessária para oxigenação e nutrição da ferida, diante da hipóxia e a diminuição do pH no centro da lesão. Esse evento tem como componente fundamental os macrófagos, que fazem uma interação com os tromboxanos e as prostaglandinas produzindo assim o fator angiogênico (quimiotático) que atrai as células meso e endoteliais (Witte et al, 1997).
características ultraestruturais dos fibroblastos e da célula muscular lisa, denominada miofibroblasto, dando-lhe capacidade contrátil, reduzindo a área cruenta da ferida e facilitando a epitelização (Witte et al, 1997).
A epitelização é importante, pois o epitélio oferecerá ao organismo uma dupla proteção: a partir do meio interno, contra as perdas de fluidos, eletrólitos e proteínas, e a partir do meio ambiente, contra a penetração de agentes infecciosos (Witte et al, 1997). Na pele, a epiderme espessa-se e as células basais da borda da ferida aumentam de tamanho e migram para a mesma, não se dividindo até ser restaurada a continuidade epidérmica. A migração é influenciada pelo tipo de matriz e presença ou não de infecção. As células basais fixas em uma zona próxima à borda cortada da ferida continuam a se dividir, e suas células-filhas achatam-se e migram sobre a matriz da ferida como uma lâmina. Essa proliferação celular iniciada após a migração é no máximo 48-72 h após a lesão. O estágio final da reepitelialização é a maturação das células epidérmicas. Em torno do décimo dia há um extrato córneo, que, comumente, é mais espesso que o da pele sã circunjacente (Young, 2001).
A formação do tecido de granulação se inicia entre o terceiro e quarto dia após a injúria tecidual e é mantida até que a reepitelização esteja completada. O fibroblasto produz o colágeno fibrilar, sintetiza elastina, fibronectina, glicosaminoglicanas e proteases, como a colagenase, importante para o debridamento e o remodelamento (Van Winkle, 1967).
A pele normal e uma cicatriz madura contêm colágeno dos tipos I e III, com predomínio do tipo I. Contrariamente, o tecido de granulação é amplamente composto por colágeno tipo III (Gabbiani et al.,
colágeno tipo VI é sintetizado por fibroblastos da pele e possui qualidades adesivas tissulares únicas (Olsen et al., 1989). O colágeno tipo VII é de
extrema importância no estabelecimento e na manutenção de uma junção dermoepidérmica funcional (Burgeson, 1994; Mc Grath et al., 1993).
A fibronectina é importante para o ingresso dos fibroblastos por funcionar não apenas como um quimioatraente, mas também, quando entrelaçado à fibrina como um suporte adesivo sobre o qual o miofibroblasto possa se acoplar, via um mecanismo de receptores específicos, migrar e, subsequentemente, sintetizar o colágeno (Clark et al., 1983).
As glicosaminoglicanas não apenas auxiliam na manutenção da hidratação da ferida, mas também podem conduzir a migração e à proliferação celular na ferida (Balaas et al, 1950).
Nos estágios tardios da formação do tecido de granulação, o ácido hialurônico é substituído por proteoglicanas. Evidências sugerem que as proteoglicanas possam ser importantes contribuidoras à resistência tissular e desenvolverem algum papel na regulação da síntese de colágeno. Tendem a estabilizar a adesão célula-matriz, desencorajando a migração celular ao longo da estrutura de fibronectina (Wood, 1960; Lark et al., 1985).
celulares e elementos contráteis de fibroblastos e miofibroblastos com uma reorganização concomitante do citoesqueleto (Cohn, 1978).
A remodelação da cicatriz normalmente se inicia por volta da terceira semana após o trauma e persiste por meses ou anos. Esta fase se caracteriza por modificações no tecido conjuntivo, sobretudo da matriz extracelular, como a ação de enzimas proteolíticas que metabolizam o excesso de ligações mais estáveis entre as fibras proteicas para ganho de uma maior resistência mecânica na ferida, e por último há uma diminuição da vascularização (Witte; Barbul, 1997; Fine; Mustoe, 2001; Young, 2001).
Eventos que ocorrem próximos ou sobre a cicatrização de feridas, como técnica cirúrgica, formação de hematomas, infecção, reação de corpo estranho, radioterapia, condições de base, drogas, localização e dessecação, podem ter grande influência no grau de cicatrização (Saarialho-Kere et al., 1992).
Durante a técnica cirúrgica, a manipulação rude da pele por causa da inexperiência e do uso de instrumentação inapropriada podem levar à formação de crostas, descamação da pele, desvitalização do tecido, aumento da reação inflamatória ao redor da ferida, promovendo um local ideal para infecção bacteriana secundária. Por outro lado, ferimentos fechados com material de sutura reativamente inapropriados podem levar à reação de corpo estranho, inflamação persistente, necrose e infecção secundária (Levenson et al, 1965).
Suturas com tensão excessiva promovem uma isquemia tecidual e podem resultar na necrose das bordas da ferida, deiscência ou uma propensão para uma infecção secundária. Esses fatores também podem promover formação de uma cicatriz hipertrófica nas áreas de máxima tensão ou áreas de deiscências deixadas para cicatrizar por segunda intenção (Borges et al, 1962).
uso da radiação laser, eletrocirurgia, criocirurgia e o peeling químico são
técnicas indispensáveis, mas também produzem quantidades variáveis de injúria nos tecidos. As proteínas denaturadas e os debris necróticos prolongam o estágio de inflamação na cicatrização de feridas. A cirurgia com o uso de bisturi convencional minimiza o dano mecânico aos tecidos e deve ser considerada sempre que possível (Young et al, 2001).
Um sangramento excessivo associado à formação de um hematoma em um segmento suturado podem romper mecanicamente o fechamento e levar a deiscência da ferida. O sangue coagulado serve como um excelente meio de cultura contribuindo para o desenvolvimento de uma séria infecção bacteriana da ferida. A dissecção cuidadosa do tecido, a ligação apropriada dos vasos e a meticulosa eletrodissecação por ponto de sangramento de capilares minimizam a formação de hematomas (Angel et al., 1986).
Infecção bacteriana da ferida é a causa local mais comum de uma cicatrização prolongada (Silver, 1984). Todas as feridas são contaminadas pela microbiota residente. Infecções clínicas ocorrem quando um número crítico de organismos patogênicos está presente. A bactéria lentifica a cicatrização pela ativação da via alternada do complemento prolongando a fase inflamatória da cicatrização de feridas (Fearso; Austen, 1977).
Um corpo estranho em uma ferida propicia uma superfície apropriada para ativação da via do complemento com a subsequente acumulação excessiva de células inflamatórias. Assim como na infecção da ferida, essa resposta inflamatória exagerada é prejudicial aos estágios subsequentes da cicatrização. Feridas contendo material estranho são caracterizadas por uma relativa hipóxia e acidificação, o que prejudica as células e o reparo normal (Kischer et al., 1982). Pouco óxido nítrico
ativação celular. O óxido nítrico induz também a um fenótipo de deslocamento de queratinócitos, auxiliando no processo de fechamento da incisão (Witte; Barbul, 2002).
2.4 Bisturi Harmônico Harmonic®
O bisturi harmônico Harmonic® tem como característica a conversão da energia elétrica em energia mecânica na peça de mão, levando a lâmina ativa a vibração de 55.500Hz por segundo e de 50 a 100µm. A pressão da lâmina no tecido produz um aquecimento secundário, este faz com que as proteínas denaturadas formem um coágulo adesivo enquanto cortam, selando veias e vasos linfáticos de até 5mm de diâmetro. A vibração transfere energia mecânica ao tecido, resultando em corte e coagulação simultâneo. Mas, assim como vários estudos sobre tecnologia energética, o preciso mecanismo de ação permanecem na obscuridade (Foschi et al, 2002).
A vibração da lâmina do bisturi gera uma intensidade de calor entre 500C a 1000C, bem menor do que as produzidas pelo bisturi elétrico ou pela radiação laser de alta potência (150-4000C), sendo que a vibração resulta em cavitação, o que facilita a dissecação (Kadesky et al,
1997).
Salami et al (2008) estudaram as diferenças entre 160
Deo et al (2002), realizaram mastectomias radicais
com bisturi harmônico Harmonic® e observaram que há outras vantagens deste tipo de bisturi, tais como:
a) mínima dispersão térmica lateral e destruição do tecido
b) visualmente sem formação de escaras
c) sem passagem de eletricidade através do paciente
3.1 Objetivos gerais
Avaliar a cronologia do processo de reparação tecidual em borda lateral de língua de rato após exérese de área de necrose induzida, realizada com bisturi convencional e bisturi harmônico Harmonic® através das análises macroscópica e microscópica.
3.2 Objetivos específicos
a) Avaliar macroscopicamente o tempo e a qualidade da cicatrização;
4.1 Caracterização da amostra
Após a aprovação do presente projeto de pesquisa pela Comissão de Ética do Instituto de Ciência e Tecnologia de São José dos Campos - UNESP foram utilizados 18 ratos (Rattus norvegicus albinus, Wistar), machos, clinicamente sadios, com idade aproximada de doze
semanas de vida e peso corporal variando de 140 a 160 gramas. Os animais foram alojados no Biotério do Instituto de Ciência e Tecnologia de São José dos Campos – UNESP, mantidos sob as condições ambientais,
em salas não-climatizadas, providas de exaustor de ar, e alimentados com ração comercial e água ad libitum.
4.2 Indução da área necrótica em borda lateral de língua
Para o procedimento de indução à necrose, os animais foram sedados utilizando-se infusão intraperitoneal de Rompum ®*⁄Dopalen® *** na proporção de 2:1 e dose de 0,05 ml⁄100g de peso corporal.
A necrose em borda lateral da língua foi induzida por solução aquosa de Ethamolin administrada em dose única de 0,2 ml, por via infiltrativa local, seguindo as sugestões de Morosolli et al (2010), (Figura 1). O oleato de monoetanolamina (Ethamolin) é um composto esclerosante que age solubilizando a membrana celular e as adesões intercelulares, aumentando a permeabilidade vascular (Masaki et al, 1990 e Cruz-Filho 2002). Sua alta toxicidade e a injeção do líquido viscoso no tecido levam a necrose na profundidade da língua (Morosolli et al, 2010).
Após a inoculação, utilizou-se uma gaze para secar a superfície lingual, com finalidade de retirar possível excesso da solução no sentido de minimizar e/ou evitar a deglutição da droga.
Figura 1: Administração de Ethamolin®, em borda lateral esquerda.
Ethamolin
4.3 Procedimentos cirúrgicos
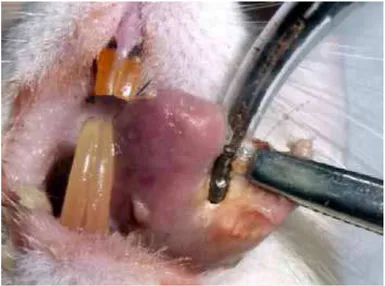
Após o período de indução à necrose tecidual (3 dias), foram realizados procedimentos de exérese da área necrótica (Figura 2)
Figura 2: Área necrótica em borda lateral esquerda da língua
Os animais foram divididos aleatoriamente em dois grupos, sendo cada grupo constituído de 9 animais:
Grupo BC (controle) – Tratamento cirúrgico com bisturi
convencional.
Grupo BH - Tratamento cirúrgico com bisturi harmônico Harmonic®
As cirurgias propostas a cada grupo foram realizadas no mesmo dia e pela mesma profissional.
GRUPO BC (controle): após a comprovação da efetividade anestésica, foi feito o tracionamento da língua do animal com uma pinça Allis e realizada a remoção da lesão com lâmina de bisturi número 15 no limite da lesão. Após a exérese, efetuou-se a lavagem do leito cirúrgico com solução estéril de NaCl a 0,9% e o fechamento das bordas remanescentes através de sutura com pontos simples com fio de seda 4-0.
GRUPO BH (bisturi harmônico Harmonic®): a mesma
sequência operatória utilizada no grupo BC foi executada, exceção à remoção da lesão que foi realizada utilizando-se bisturi harmônico Harmonic® (Figura 3), sistema Harmonic Focus® Curved Shears (Ethicon Endo-Surgery®, Johnson & Johnson Medical EUA). Este sistema é constituído de um gerador, peça de mão e ponta ativa com acionamento manual integrado e haste e 5 mm de diâmetro (Figura 4), sendo apresentado em embalagem estéril blister com uma unidade e um torquímetro (Registro ANVISA: 80145901149).
Durante os procedimentos foram seguidas as medidas de biossegurança para utilização do aparelho, ressaltando o uso de óculos de proteção, luvas e máscara para o operador e demais pessoas envolvidas.
Figura 4: Bisturi harmônico Harmonic®, Sistema Harmonic Focus® Curved Shears
Também foram realizados os seguintes cuidados pós-operatórios:
1. Terapia medicamentosa
Durante as primeiras 24 horas pós-cirúrgicas foi feita terapia medicamentosa com analgésico, sendo empregado 200mg/ml paracetamol, 18 gotas do fármaco dissolvidas em 300ml da água oferecida.
2. Distribuição dos animais em gaiolas
4.4 Períodos de observação
Decorridos 7, 14 e 28 dias pós-operatórios, três animais de cada grupo foram sacrificados por overdose de sedativos de uso veterinário (Dopalen* e Rompum**) (SOUZA, 1996). As peças anatômicas foram cortadas em bloco, fixadas em formol a 10% por 72 horas e submetidas às análises macroscópica e microscópica.
4.5 Análise Macroscópica
O aspecto macroscópico da região de bordo lateral de língua foi analisado durante todos os períodos de observação dos grupos estudados, tais como: coloração, textura da mucosa, presença de sangramento e/ou úlceras, presença ou não de edema. Os sinais foram documentados com o auxílio de fotografias (Morosolli, 2010).
4.6 Análise Microscópica
Para estudo microscópico, após a fixação com formol a 10% por 72 horas, as peças foram processadas, incluídas em parafina e cortadas no sentido longitudinal com aproximadamente 5m de
espessura. A coloração utilizada foi de hematoxilina-eosina (HE) para posterior análise por meio de microscopia de luz.
As lâminas obtidas foram descritas com o auxílio de um microscópio de luz (Axioskop 40®, Carl Zeiss, Alemanha), levando-se em consideração seu aspecto histológico, verificando a velocidade do processo cicatricial, as células envolvidas em cada estágio do processo inflamatório e a qualidade do tecido e das fibras musculares, com o auxílio de fotomicrografias obtidas por uma câmera digital (AxioCam MR5®, Carl Zeiss, Alemanha) conectada ao computador com o programa digital
AxioVision Release® 4.6 (Carl Zeiss, Alemanha, vesrão 2007). (Morosolli,
5.1 Análise Clínica
5.1.1 Pós-operatório de sete dias
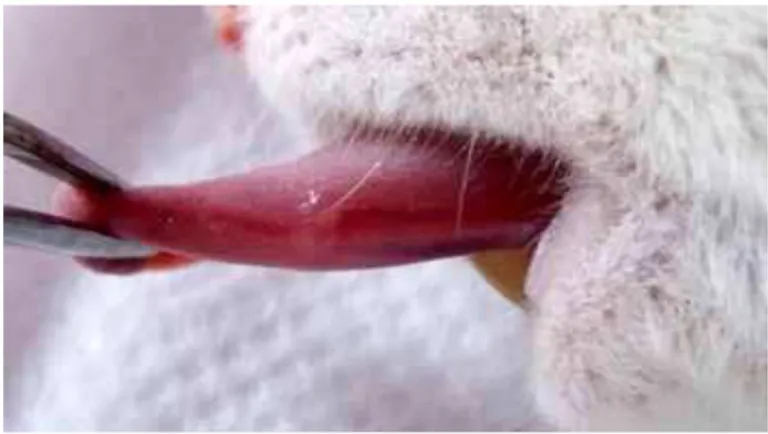
No grupo BC notou-se uma superfície irregular, devido a sutura, áreas hiperemiadas localizadas e uma camada de fibrina denaturada, sem sangramento (Figura 5A). No grupo BH é possível notar a presença da camada de fibrina denaturada e discreto sangramento (Figura 5B). Em ambos casos nota-se área edemaciada de pequena monta.
Figura 5B: Pós-operatório de sete dias, grupo BH.
5.1.2 Pós-operatório de 14 dias
No grupo BC nota-se que ocorreu, efetivamente, a reparação epitelial, pois é possível observar que a área submetida a cirurgia encontra-se dentro dos aspectos de normalidade (Figura 6A).
No grupo BH observa-se que a superfície tem, em sua maior parte, coloração normal. As áreas que não o são apresentam-se avermelhadas e não se observada contração da ferida (Figura 6B).
Figura 6B: Aspecto clínico do grupo BH, após 14 dias.
5.1.3 Pós-operatório de 28 dias
Em ambos grupos observa-se o mesmo nível de reparação, com evidente neoformação de papilas linguais (Figura 7A e 7B). No grupo BC foi possível verificar a formação de tecido cicatricial na região da sutura. Nos dois grupos houve uma perda tecidual, porém não levando a um comprometimento funcional.
Figura 7B: Após 28, aspecto clínico do Grupo BH.
5.2 Análise histológica
5.2.1 Língua Normal
No que se refere à análise histológica, utilizou-se como parâmetro um corte transversal de uma língua de rato sadia, observando-se dois principais aspectos: mucosa especializada, considerando observando-seu epitélio e a lâmina própria, e o plano muscular.
Uma língua normal é revestida por epitélio pavimentoso estratificado ortoqueratinizado. Na superfície dorsal, este epitélio apresenta papilas filiformes em toda sua extensão. Enquanto, o ventre da língua é revestido por um epitélio delgado, de 5 a 6 camadas, onde algumas vezes, a camada basal apresentou-se duplicada.
de médio porte e feixes de fibras nervosas. Sua disposição é longitudinal, na porção mediana da língua, e perpendicular na periferia (Figura 8).
Figura 8: Fotomicrografia de fragmento de língua normal, em corte transversal [H.E., aumento original: 25x].
5.2.2 Língua com necrose induzida por Ethamolin®.
Figura 9: Fotomicrografia de fragmento de língua com lesão provocada por oleato de monoetanolamina. Intenso infiltrado inflamatório ( ) e fibras musculares (setas) sendo substituídas por tecido conjuntivo bem celularizado [H.E., aumento original: 50x].
5.2.3 Pós-operatório de sete dias
Figura 10A: Pós-operatório de sete dias, grupo BC: tecido conjuntivo e fibras musculares (setas) permeados por células inflamatórias ( ) [H.E., aumento original: 100x].
Figura 10C: Pós-operatório de sete dias, grupo BC: áreas de hemorragia (setas) e intenso infiltrado inflamatório ( ) [H.E., aumento original: 50x].
Figura 11A: Pós-operatório de sete dias, grupo BH: solução de continuidade do epitélio e membrana serofibrinosa (setas) [H.E., aumento original: 50x].
Figura 11C: Pós-operatório de sete dias, grupo BH: intenso infiltrado inflamatório, neoformação e congestão vascular ( ) [H.E., aumento original: 50x].
Figura 11D: Pós-operatório de sete dias, grupo BH: áreas de hemorragia ( ) permeando as fibras musculares [H.E., aumento original: 200x].
5.2.4 Pós-operatório de 14 dias
mononucleares e o tecido essencialmente vascularizado. Notou-se fibras musculares em fase de organização, em algumas regiões, estas fibras foram regeneradas, e, em outras, atróficas (Figura 12A). Houve notável reepitelização, porém não observou-se a formação das papilas, normalmente encontradas no epitélio normal (Figura 12B).
Figura 12A: Pós-operatório de 14 dias, grupo BC: tecido conjuntivo organizado, permeando fibras musculares ( ) [H.E., aumento original: 100x].
Grupo BH: Neste momento, aos 14 dias, observou-se um tecido conjuntivo desorganizado, com suas fibras colágenas permeando as fibras musculares juntamente ao infiltrado inflamatório e áreas de hemorragia. Notou-se, também, algumas fibras musculares em processo de reparo. O epitélio apresentou-se lesado, com áreas de degeneração hidrópica e edema intracelular, recoberto por queratina e material semelhante a uma membrana serofibrinosa. Subjacente a este epitélio, encontrou-se uma lâmina própria aumentada, contendo um tecido conjuntivo bem celularizado e vascularizado e cujas fibras apresentavam-se desorganizadas, provocando projeções volumosas (Figuras 13A e 13B).
Figura 13B: Pós-operatório de 14 dias, grupo BH: hemorragia ( ) entre as fibras musculares [H.E., aumento original: 200x].
5.3.5 Pós-operatório 28 dias
Figura 14A: Pós-operatório 28 dias, grupo BC: papilas filiformes (setas), organização muscular ( ) [H.E., aumento original: 50x].
Figura 14A: Pós-operatório 28 dias, grupo BC: tecido conjuntivo organizado na profundidade do corte histológico ( ) [H.E., aumento original: 50x].
regiões, era predominante sobre a quantidade de feixes musculares, que por vezes, apresentavam-se de forma isolada. O epitélio e a lâmina própria encontravam-se com características de normalidade, embora, em algumas regiões, a superfície estivesse lisa, sem a formação das papilas.
Figura 15A: Pós-operatório 28 dias, grupo BH: áreas de tecido conjuntivo frouxo, com vasos de médio calibre ( ), epitélio reparado (setas) [H.E., aumento original: 50x].
O objetivo de aumentar a segurança e a qualidade de um procedimento cirúrgico, visando possibilitar a diminuição do tempo e complicações trans e pós-operatórias, tem levado a estudos constantes no sentido de se buscar novas ferramentas que venham a substituir e/ou complementar, com vantagens, o bisturi convencional. Como exemplos, podemos citar: o bisturi elétrico, radiação laser de alta potência com diferentes comprimentos de onda, criocirurgia e, atualmente, o bisturi harmônico. Todos eles apresentam vantagens e desvantagens, que devem ser levadas em consideração quando do planejamento cirúrgico.
Quanto ao bisturi harmônico, tem sido utilizado há pouco mais de 15 anos em diversas especialidades da medicina, tais como: cirurgia geral, ginecologia, gastroenterologia e otorrinolaringologia (Matthews et al, 2008; Ali et al, 2011 e Dean et al, 2014), demonstrando algumas vantagens, quando corretamente indicado.
Mais recentemente, o bisturi harmônico vem sendo indicado na odontologia como parte do arsenal para realização de cirurgias em tecido mole (Cardoso et al, 2014). Entre as vantagens oferecidas, destaca-se a redução no tempo de trabalho, campo exangue, diminuição da dor e edema associados com outras possíveis complicações pós-operatórias (Matthews et al, 2008; Irfan et al 2011; Duan et al, 2013; Dean et al, 2014 e Tirelli et al 2014).
Um dos efeitos preconizado pelo fabricante é uma hemostasia imediata, que está na dependência de dois mecanismos intrínsecos: denaturação das proteínas com a quebra das pontes de hidrogênio (ligações de hidrogênio terciário) selando a luz dos capilares e fricção das células, que também desencadeia denaturação da proteína celular e, assim, sela vasos maiores (Johnson & Johnson Medical).
A vibração da ponta ativa do bisturi harmônico produz rápida mudança de pressão nos tecidos causando a vaporização da água intra e extracelular, promovendo a separação dos planos anatômicos, facilitando assim a visualização e dissecção cirúrgica com temperaturas entre 60ºC e 80ºC (Eman e Cuschieri, 2003; Blankenship et al, 2004 e Dean et al, 2014). O calor produzido é diretamente proporcional ao nível de potência e duração do toque do instrumento no tecido, permitindo, assim, controlar seus efeitos, através dos seguintes fatores: variação do nível de energia, tempo de exposição e pressão aplicada. Quanto maior a potência, mais rápido é o corte e menor a hemostasia. Com um nível de potência mais baixo, a hemostasia é mais intensa e o corte mais lento (Dean et al, 2014). Este efeito hemostasia/corte foi observado neste experimento.
ocorre uma regeneração do tecido muscular, portanto, o que é possível verificar é a qualidade e a cronologia relativos à cicatrização, tanto clinica quanto histologicamente, sendo este fato a base para este estudo.
No primeiro período de análise clínica (sete dias), ambos os grupos apresentavam uma camada serofibrinosa na superfície da área incisada, discreto edema e coloração avermelhada localizada, porém, o grupo BH apresentou ainda, pontos de sangramento quando da manipulação.
Aos 14 dias, no grupo BC, a aparência clínica foi de uma cicatrização completa, onde a coloração da superfície era homogênea, enquanto o grupo BH, ainda apresentava áreas avermelhadas e despapiladas. Este contexto indica um atraso no processo de cicatrização do grupo BH em relação ao grupo BC, pois a reepitelização do grupo BC mostrou-se avançada em relação ao grupo BH.
Aos 28 dias, esse atraso é superado em ambos os grupos, sem diferenças significativas no resultado final, onde se apresentaram reparados.
No tocante as análises histológicas, foi possível classificar os períodos de observação em 3 etapas, de acordo com o fenômeno fisiopatológico predominante em cada momento: fase inflamatória (sete dias), fase substitutiva (14 dias) e fase de remodelação (28 dias).
Na fase inflamatória, além do intenso infiltrado inflamatório de células predominantemente mononucleares, observou-se proliferação tecidual e angiogênese intensa, formando tecido de granulação. Bem como a presença da camada serofibrinosa, em ambos os grupos, cumprindo seu papel de curativo biológico.
reepitelização. Este dado está em concordância com o estudo de Morosolli et al (2010), enquanto, segundo Sinha e Gallangher (2003), este fenômeno foi observado apenas aos 28 dias.
Quando se diz respeito à fase de remodelação, refere-se ao momento em que o tecido conjuntivo, bem como suas fibras colágenas, atingem seu estado de maturação, permitindo que as fibras musculares remanescentes se reagrupem em feixes, promovendo uma reorganização e aproximando a estrutura da língua ao aspecto de normalidade.
Para ser observado o retardo na cronologia do processo de reparo no grupo BH, é preciso levar em conta que ambos os grupos passam pelas mesmas etapas, porém cada um com sua dinâmica, fazendo-se necessário entender que essas etapas, em determinados momentos, ocorrem simultaneamente.
Os resultados apresentados neste estudo indicam que o bisturi harmônico é uma alternativa viável ao uso do bisturi convencional, uma vez que promove uma reparação adequada e sem a presença de cicatrizes. Extrapolando estes resultados para seres humanos, pode-se dizer que o uso do bisturi harmônico além de trazer o resultado clínico esperado, ainda carrega uma melhor qualidade do ponto de vista estético e permite que haja conforto pós-operatório para o paciente.
Nos últimos anos, os estudos direcionados às cirurgias de cabeça e pescoço, especialmente as oncológicas, tem enfatizado a qualidade de vida do indivíduo. Quando possível, os procedimentos são realizados com especial atenção a manutenção funcional do órgão associada a procedimentos reconstrutivos (Zhang et al, 2011 e Tirelli et al, 2014).
Alexiou (2011) não encontrou diferenças em relação a hemorragia trans e pós-operatória e dor, quando comparou com o uso de bisturi harmônico, eletocautério e lâmina fria, em tonsilectomias. Resultado divergente ao de Walker (2001), que constatou que pacientes submetidos à tonsilectomias com o bisturi harmônico retornaram à dieta e atividades habituais mais rapidamente, além de apresentarem menor taxa de hemorragia tardia.
Outro benefício a ser atribuído ao bisturi harmônico é a diminuição das doses de analgésicos administrados no período pós-operatório (Djanic et al, 2012). Ali et al (2001), quando compararam o bisturi harmônico e o bisturi elétrico em tonsilectomias, notaram que os pacientes operados com bisturi harmônico tinham dor menos intensa nas primeiras 72 horas. Os mesmos autores não encontraram diferença significativa no tempo de cirurgia, mas atribuíram tal fator à falta de prática com o instrumento.
concluindo que o menor dano térmico foi produzido pelo laser CO2, Sinha e Gallagher (2003) afirmaram que o bisturi harmônico é superior a radiação laser e ao eletrocautério, quando comparado os fatores: hemostasia, coagulação, reepitelização e inflamação. A temperatura de trabalho do bisturi harmônico foi inferior aos outros instrumentos, sendo assim, o dano térmico aos tecidos adjacentes menor. Além disso, não há transmissão de estímulo elétrico ao tecido nervoso ou muscular. Dessa forma, a soma dessas características leva a redução no desconforto pós-operatório (Diamantis et al, 2006).
Estudos permitem enumerar outras vantagens do bisturi harmônico, tais como: a não transmissão de eletricidade, diminuindo os riscos ao paciente e a equipe cirúrgica; a adesão insignificante de tecido na ponta ativa do instrumento, que poderia interferir na diminuição da potência (Sherman e Davies, 2000; Barrett e Garber, 2003 e Dean et al, 2014). Além disso, uma vez que o bisturi hermônico serve tanto para a dissecção como para a coagulação, há menos substituições de instrumentos (Ali et al, 2001; Matthews et al, 2008 e Mantke et al, 2011). Matthews et al (2008) ainda acrescenta que o bisturi harmônico pode ser utilizado em pacientes portadores de marca-passo, condição esta que não permite o uso do bisturi elétrico.
Mantke et al (2011) explicam que a seleção do instrumento deve ser feita conforme a necessidade e o planejamento do cirurgião, pois não há um equipamento ideal para as diversas situações cirúrgicas. Há situações em que os danos térmicos e elétricos são mais relevantes que o selamento de vasos, como, por exemplo, na proximidade de um nervo ou tecido cartilaginoso.
et al, 2013). O dispositivo utilizado numa biópsia deve ser de conhecimento do patologista que realiza a análise das margens de um tumor, somente dessa forma é possível diminuir os resultados falso-positivos ou falso-negativos e assim permitir, com cautela, o uso do laser de CO2 ou do bisturi harmônico para exérese de tumores. Exemplificando com casos de câncer em laringe, um resultado falso-positivo pode levar a uma cirurgia revisional ou uma radioterapia pós-operatória, sendo assim, autores defendem o uso do bisturi de lâmina fria nestes casos (Manelli et al, 2014).
Uma das maiores desvantagens atribuídas ao BH é o alto custo do equipamento, porém vários autores refutam este argumento. Tirelli et al, em 2014, demonstraram que há uma redução no custo das cirurgias de exérese de câncer bucal e orofaríngeo, quando utiliza-se o bisturi harmônico, correlacionando o custo do equipamento com o tempo em centro cirúrgico. Irfan et al (2011) acreditam que todas as vantagens citadas a respeito do bisturi harmônico justificam os custos, desde o investimento inicial aos gastos com manutenções. Ainda assim, para as cirurgias bucais menores realizadas em ambulatório, o custo do equipamento utilizado pode representar uma desvantagem considerável em relação ao bisturi de lâmina fria, fato que outros autores estão de acordo (Michelsen et al, 2011). O confronto dessas opiniões divergentes chama atenção para um aspecto importante na relação custo/benefício: o grau de habilidade do cirurgião para manipular o equipamento, pois quanto mais evoluída a habilidade menor é o tempo da cirurgia, o que diminuiria os custos hospitalares.
Embasados na metodologia aplicada e nos resultados obtidos, julgamos poder concluir que:
1. No grupo tratado com BH, observamos um retardo na cronologia de reparo nos tempos iniciais (sete e quatorze dias), porém aos vinte e oito dias, ambos os grupos apresentavam características de normalidade;
2. Aos quatorze dias o infiltrado inflamatório era menos evidente no grupo tratado com BC;
3. O grupo tratado com BC apresentou, histológicamente, uma melhor organização, traduzindo-se em um reepitelização mais rápida e aceleração no processo de reparo, quando comparado ao BH;
Abbas AK, Lichtman AH, Pober, J.S. Imunologia Celular e Molecular, 3.ed. Rio de Janeiro: Revinter, 2000 a.
Abbas AK, Lichtman AH, Pober JS. Cellular and Molecular immunology, 4.ed. Phyladelphia: W.B. Saunders Company, 2000 b.
Alberts B. et al. Biologia Molecular da Célula, 3. ed. Porto Alegre: Artes Médicas, 1997.
Alexiou VG, Salazar-Salvia MS, Jervis PN, Falagas ME Modern Technology–Assisted vs Conventional Tonsillectomy - A Meta-analysis of
Randomized Controlled Trials. , Arch Otolaryngol Head Neck Surg, Vol 137: 6, june 2011.
Ali, N., Ikram, M., Akhtar, S., Moghira, I., Nawaz, A., Arain, A. Harmonic scalpel versus electrocautery tonsillectomy: a comparative study in adult patients. Journal of the Pakistan Medical Association, 61(3), 256-9, 2011.
Angel ME, Narayana K, Swartz WM, The etiologic role of free radicals in hematoma-induced flap, necrosis, Plast Reconstr Surg, 77: 795, 1986.
__________________________
Arasshiro DS, Rapley JW, Cobb CM, Killoy WJ. Histologic evaluation of porcine skin incisions produced by CO2 laser, electrosurgery, and scalpel. Int J Period Dent, v.16, p.479-91, Oct. 1996.
Balaas A, Holmgren HJ. The basic dye uptae and the presence of growth inhibiting substance in the healing tissue of skin wounds, Exp Cell Res, 1:206, 1950.
Barrett WL, Garber SM: Surgical smoke: a review of the literature. Is this just a lot of hot air? Surg Endosc 17: 979e987, 2003
Bianchi M, Sacerdote P, Panerai AE. Cytokines and cognitive function in mice. Biol Signals Receptors, v.7, n.1, p.45-54, 1998.
Borges AF, Alexander JE. Relaxed skin tension lines, Z-plasties for scars, and fusiform excision of lesions. Br J Plast Surg, v.125. p.242, 1962.
Burgeson RE. Type VII collagen, anchoring fibrils, and epidermolysis bulbosa. J Invest Dermatol, v.101, p.252-255, 1994.
Cardoso GOM, Achkar VNR, Botrel T, Niccoli-Filho W, Efficacy of the Harmonic Synergy® Scalpel in the surgical removal of fibrous hyperplasia, National Journal of Medical Research; 4, 1 (Jan – Mar), 2014.
Clark JJ. Wound repair and factors influencing healing. Crit Care Nurs Q, 2002; 25(1):1-12.
Cleary EG, Gibson MA. Elastin-associated microfibrils and microfibrilar proteins. Int Rev Tissue Res, 10:97, 1983.
Cohn ZA. The activation of mononuclear phagocytes: Fact, fancy and future. J Immunol, v. 121, p. 813-816, 1978.
Contran RS, Kumar V, Collins T. Reparo dos tecidos: crescimento celular, fibrose e cicatrização das feridas. In: Robbins: Patologia estrutural e
funcional. 6ed. Rio de Janeiro: Guanabara Koogan, 2000. Cap.4, p.79-100.
Cotran RS, Kumar R, Collins T. Patologia estrutural e funcional, 6. ed. Rio de Janeiro: Guanabara Koogan S. A., 2000.
Cotran RS. Endothelial cells. In KELLEY, W.N., et al. (eds.):Textbook of
Reumathology, 4 ed. Philadelphia, W.B.Saunders Co., 1993, p 327-336.
Cruz-filho M, Maia CC, Abrahão S, Baptista Silva JCC, Gomes PO. Efeitos do oleato de etanolamina na parede venosa, de cães. Acta Cir Bras, v.17, n.5, p. 317-25, set/out. 2002.
Danic D, Hadibegovi A, Stojadinovi T, Damjanovi D,Gudelj A, Mahovne I. Harmonic Scalpel Surgical Treatment of the Tongue Angioleomyoma –
Case Report and Review of the literature. Coll. Antropol. 36 Suppl. 2: 167–170, 2012
Deo SV, Shukla NK, Asthana S, Niranjan B, Srinivas G. A comparative study of modified radical mastectomy using Harmonic Scalpel and electrocautery. Singapure Med J, 2002;43(5):226-228.
Diamantis T, Kontos M, Arvelakis A, Syroukis S, Koronarchis D, Papalois A, et al: Comparison of monopolar electrocoagulation, bipolar electrocoagulation, ultracision, and ligasure. Surg Today 36: 908e913, 2006
Duan Y, Xue W, Zhu F, Sun D, FOCUS Harmonic Scalpel compared to conventional hemostasis in open total thyroidectomy – a prospective
randomized study, Journal of Otolaryngology - Head and Neck Surgery, 42:62, 2013.
Eman TA, Cuschieri A, How safe is high-power ultrasonic dissection? Ann Surg 237: 186-191, 2003
Enoch S, Leaper D. Basic science of wound healing. Surgery, v.26, n.2, p.31-36, Mar. 2007.
Fearson DT., Austen KR. Activation of the alternative complement pathway by E coli: resistance of bound c3b to inactivation by c3b INA and BIH, J Immunol 120: 1772, 1977.
Fine N, Mustoe TA. Wound Healing. In: Greenfield, L.J.; Mulholland, M.W.; Oldham KT, Zenelock GB, Lillemoe KD. Surgery: scientific principles and practice. 3 ed. Philadelphia: Lippincott Williams e Wilkins; 2001. p 69-85.
Fisher SE, frame JW, Browne RM, Trante RM. A comparative histological study of wound healing following CO2 laser and conventional surgical excision of canine buccal mucosa. Arch Oral Biol, v.28, n.4, p.287-291, 1983.
Foschi D, Cellerino P, Corsi F et al. The mechanisms of blood vessel closure in humans by the application of ultrasonic energy. Surg Endosc. 2002;16(5):814-819.
Frazer JK, Capra JD. Immunoglobulins: Struture And Function. In: PAUL, W. Fundamental immunology. 4 ed. Philadelphia: Lippincott-Raven, 1999, p. 37-74.
Gabbiani, G.;Lelous, M. Bailey, A.J. Collagen and myofibroblasts of granulation tissue. A chemical, ultraestructural and immunologic study, Cell Pathol, 21: 133, 1976.
George S, Hyde NC, Wilson P, Smith GI, Does the method of resection affect the margins of tumoursin the oral cavity? Prospective controlled study in pigs. British Journal of Oral and Maxillofacial Surgery 51, 600–
603; 2013.
Gordon S. Biology of the macrophages. J Cell Sci, v. 4, p. 267-286, 1986.
Gordon S. Macrophage-restricted molecules: role in differentiation and activation. Immunol Lett, v. 65, p. 1-2, 5-8, 1999.






![Figura 8: Fotomicrografia de fragmento de língua normal, em corte transversal [H.E., aumento original: 25x]](https://thumb-eu.123doks.com/thumbv2/123dok_br/15816584.135727/48.892.259.680.282.479/figura-fotomicrografia-fragmento-língua-normal-transversal-aumento-original.webp)
