i
MINISTÉRIO DA EDUCAÇÃO
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS DA SAÚDE
AVALIAÇÃO DAS ATIVIDADES ANTINOCICEPTIVA E ANTI-INFLAMATÓRIA DE UMA HETEROFUCANA DA ALGA Dictyota menstrualis.
IVAN RUI LOPES DE ALBUQUERQUE
ii
IVAN RUI LOPES DE ALBUQUERQUE
AVALIAÇÃO DAS ATIVIDADES ANTINOCICEPTIVA E ANTI-INFLAMATÓRIA DE UMA HETEROFUCANA DA ALGA Dictyota menstrualis.
Orientador: Hugo Alexandre de Oliveira Rocha
NATAL/RN
2013
iii
MINISTÉRIO DA EDUCAÇÃO
UNIVERSIDADE FEDERAL DO RIOGRANDE DO NORTE
CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS DA SAÚDE
iv
IVAN RUI LOPES DE ALBUQUERQUE
AVALIAÇÃO DAS ATIVIDADES ANTINOCICEPTIVA E ANTI-INFLAMATÓRIA DE UMA HETEROFUCANA DA ALGA Dictyota menstrualis.
APROVADA EM 13 DE DEZEMBRO DE 2013.
Banca Examinadora:
Presidente da Banca:
Dr. Hugo Alexandre de Oliveira Rocha - UFRN Membros da Banca:
Drª. Luciana Guimarães Alves Filgueira – UFRN Dr. Moacir Franco de Oliveira – UFESAR
v
DEDICATÓRIA
vi
AGRADECIMENTOS
Ao TODOS que fazem parte do CEJA LIA CAMPOS: Professores, Coordenadores e Administrativos, mas de modo especial aos Diretores e coordenadores, nas pessoas de Silvana, Marcos e Ivanize, que de modo especial elaboraram meus horários para facilitar os dias de experimentos. Aos meus alunos que de modo especial, demonstram perseverança na continuidade dos estudos. Para eles todo este esforço de sempre me manter atualizado.
A TODOS que fazem parte da SEMURB, que de modo DIRETO ou INDIRETO me incentivaram a prosseguir nesta luta.
Em especial aos meus amigos Fiscais Ambientais e Urbanísticos, que sempre tiveram incentivando na busca constante do aprimoramento técnico e pessoal.
Aos Meus AMIGOS:
Jacques e Vanize – Meus compadres, com os quais compartilho momentos muito especiais.
Rafael e Sara – Meus compadres e parceiros para toda hora.
A todos que me deram exemplos POSITIVOS, os quais sempre tento seguir para alcançar a felicidade, e aos exemplos NEGATIVOS, com os quais tento aprender para não cometê-los.
Laboratório TODA A EQUIPE DO LABOTATÓRIO. Os alunos de I.C. fundamentais para a renovação das cabeças pensantes. Aos mestrandos essenciais para maturação do trabalho e aos doutorandos responsáveis pela consolidação do pensamento científico. Mesmo não sendo possível citar a TODOS, não posso deixar de fazer um agradecimento especial aos que tive mais contato direto: Rafael, Rute, Raniere Fagundes, Almino Afonso, Jailma Almeida, Karol Melo, Mariana Santana, Maxsueel Lucas, Moacir Queiroz, Monique, Pablo Câmara, Rony Lucas, Sara Cordeiro, Vinicios Campelo, Pedro Ajax, Dyannne Gomes.
vii
Ao meu Sogro (Seu Guaraci) e minha Sogra (Dona Cleia) donos de um coração enorme. Pessoas as quais tenho o maior carinho e admiração.
As minhas cunhadas Deborah e Daliana. Obrigado pela força e pela presença sempre constante. E ao meu concunhado Lindenberg exemplo de perseverança.
A Bia, minha protegida. Menina de um futuro lindo.
A Tia Aldinha e Naninha duas das pessoas mais amáveis que tive o prazer de conhecer.
A Gilson e família, pessoas fenomenais. Exemplo de família.
Aos meus Cunhados Elba e Kleison. Pessoas abençoadas que entraram na família e nos fizeram mais felizes.
Aos meus sobrinhos Augusto Cesar e Antony Gabriel. Presentes de DEUS para nossa família.
Aos meus irmãos FERNANDO e CEIÇA. Dividi com vocês os melhores momentos da minha vida. AMO vocês tanto que não sei quantificar.
A minha esposa DAHÍRES MAYARA. Companheira, amiga e amante que esta sempre do meu lado, me dando força e carinho. Nosso encontro foi uma das melhores coisas da minha vida!!!!! TE AMO.
Aos meus PAIS:
Seu Severino, para os mais chegados SEU SEVE. Exemplo de homem trabalhador e honesto.
DONA IDENILDA. Exemplo de mulher lutadora e batalhadora.
PAI e MÃE ser filho de vocês é motivo de ORGULHO. Passei muito tempo procurando palavra que expressasse o que sinto por vocês, na intensidade que sinto, mas não existe no português. AMO TANTO VOCÊS QUE NÃO TENHO COMO EXPRESSAR!!!!!
viii RESUMO
Fucana é um termo que define uma família de hetero e homopolissacarídeos que contem L-fucose em sua estrutura. Neste trabalho uma hererofucan F 2,0v da alga Dictyota menstrualis foi avaliada como agente antinociceptivo e antiinflamatório. A fucana F 2,0v inibiu a migração de leucócitos em até 100% (20.0 mg/kg) para a cavidade peritoneal após estimulo químico, porém, não alterou a expressão das interleucinas IL-1β, IL-6 e de TNF-α. Com relação a sensação dolorosa a F 2,0v (20.0 mg/kg) possui atividade antinociceptiva periférica com potência semelhante à dipirona. Por outro lado não apresentou efeito no teste da placa quente. Análises de microscopia confocal e citometria de fluxo mostram que a F 2,0v se liga a superfície dos leucócitos. O conjunto de resultados apresentados pela fucana F 2,0v sugerem que o mecanismo de ação está relacionado com sua capacidade de inibir a migração de leucócitos para o local da injúria tecidual. Em resumo os dados mostram que F 2,0v apresenta grande potencial como composto antinociceptivo e antiinflamatório. Estudos futuros serão realizados para caracterizar melhor o mecanismo de ação da F 2,0v.
ix
LISTA DE ABREVIATURAS E SIGLAS
1- Frações – F 0,5v; F1,0V; F1,5v; F2,0v; F3,0v: Frações precipitados com volumes crescentes de acetona.
2- Fuc A; Fuc B e Fuc C: Classificação das fucanas quanto a migração eletroforética em gel de agarrose.
3- PDA: Tampão 1,3 diamino propano acetato pH 9,0. 4- i. p.: Método de administração Intra – peritoneal. 5- i. v.: Método de administração Intra – venoso. 6- PT: Tempo de protombina
7- PBS: Tampão fosfato salino. 8- FBS: Soro fetal bovino. 9- IU: Unidades Internacionais. 10- ELISA: Ensaio Imunoenzimático.
11- UFRN: Universidade Federal do Rio Grande do Norte. 12- UNIFESP: Universidade Federal de São Paulo.
13- BIOPOL: Laboratório de Biotecnologia e Biopolímeros Naturais.
x
LISTA DE FIGURAS
xi
LISTA DE TABELAS
xii SUMÁRIO
Pag
1 INTRODUÇÃO... 15
1.1 Dor e nociceoção... 15
1.2 Nocicepção x inflamação... 16
1.3 Fucanas... 17
2 JUSTIFICATIVA... 20
3 OBJETIVO... 21
4 METODOS... 22
4.1 Extração e fracionamento do polissacarídeos ácidos da alga Dictyota menstrualis... 22
4.1.1 Obtenção do pó cetônico... 22
4.1.2 Proteólise... 22
4.1.3 Fracionamento... 22
4.2 Purificação... 24
4.2.1 Cromatografia em coluna de Troca Iônica... 24
4.2.2 Cromatografia em Gel Filtração... 24
4.3 Caracterização... 24
4.3.1 Eletroforese em Gel de Agarose... 24
4.3.2 Analises Químicas... 25
4.3.2.1 Açucares Totais... 25
4.3.2.2 Proteína... 25
xiii
4.3.3 Infravermelho... 26
5 ARTIGO... 27
6 COMENTÁRIOS, CRITICAS E CONCLUSÕES...48
xiv 1 INTRODUÇÃO
1.1 Dor e nocicepção
O sistema sensorial tem como função primordial manter o cérebro informado das condições externas, do meio ambiente, bem como, as condições internas do organismo. Dentre as sensações do organismo, a dor pode ser classificada como uma das mais importantes para a manutenção da homeostase. O sentimento de dor serve como um alarme que leva, na maioria dos casos, um indivíduo afetado a ter um comportamento de esquiva, principalmente quando ela é aguda e intensa, que por sua vez diminui o dano na área do corpo agredida.
A Associação Internacional para o Estudo da Dor, em 1986, propôs um conceito atualizado sobre a dor: “dor é uma experiência sensorial e emocional desagradável associada a uma lesão potencial ou real, ou descrita em termos de tal lesão”.
A experiência dolorosa, como dito anteriormente, é resultado da inter-relação entre a interpretação das qualidades sensoriais com os componentes afetivos, cognitivos, comportamentais com as reações fisiológicas que se expressam frente à estimulação ou disfunção do sistema nociceptivo. A interpretação do fenômeno dor é individual [1].
16
qualquer alteração ou disfunção neurológica aparente. Dor nociceptiva é aquela que vivenciamos a todo instante. Depende da ativação dos nociceptores (receptores) por estímulos mecânicos, térmicos ou químicos tóxicos, fenômeno este denominado transdução e da transmissão dos impulsos aí gerados pelas vias periféricas e centrais intactas da dor [3]. A excitação dos nociceptores, fenômeno inicial imprescindível para o aparecimento da dor nociceptiva, pode ser breve ou prolongada, continuada. Nesta última eventualidade, a dor torna-se crônica. A dor nociceptiva é usualmente responsiva aos anti-inflamatórios, analgésicos comuns e opióides, a fisioterapia e a interrupção transitória (bloqueios analgésicos) ou permanente (cirúrgica) das vias da dor em algum ponto do sistema nervoso periférico ou central [3].
Apesar da definição atual da dor ser 1986, o termo nocicepção é mais antigo, surgiu no inicio de século XX e vem do latim “nocere”, que significa prejudicar, danificar. Ele está relacionado com o reconhecimento de sinais dolorosos pelo sistema nervoso, sua complexidade é resultado da pressão evolutiva, sofrida pelas espécies, para evitar danos aos organismos. O processo de nocicepção e dor envolve diversos mecanismos e parece óbvio que um único fármaco não seja capaz de aliviar a dor completamente. Um plano efetivo inclui fármacos de diferentes classes analgésicas, atuando em pontos diferentes dos mecanismos fisiopatológicos que envolvem a dor. Embora a dor tenha seu efeito protetor, a persistência da sensação dolorosa pode levar a comportamentos negativos, tais como: Depressão e Irritabilidade, causando problemas sociais e econômicos.
1.2 Nocicepção x Inflamação
17
A e C, para o corno posterior da medula, onde fazem sinapses principalmente com neurônios das lâminas I, II e V e, como consequência, geram a “sensibilização central” da dor. A partir da medula, o estímulo doloroso ainda prossegue via trato espinotalâmico para estruturas como tálamo e córtex cerebral, onde existe muito mais a se esclarecer sobre a sensibilização dolorosa nessas áreas [5].
Co-administração de fármacos analgésicos e anti-inflamatórios é uma abordagem muito utilizada no tratamento de doenças inflamatórias tais como artrite reumatóide e a osteodistrofia. Uma vantagem de usar a terapia da combinação é que se podem maximizar os efeitos analgésicos ao minimizar a incidência de efeitos colaterais adversos [5].
1.3 Fucanas
Fucana é uma denominação utilizada para polissacarídeos sulfatados, lineares ou não, que tem como característica estrutural mais marcante a presença de L-fucose sulfatada [6]. Apesar desta definição simples, as fucanas só são sintetizadas por algas marrons (Phaeophyceae) e em equinodermos (ouriços e pepinos do mar). Nas algas elas estão localizadas na matriz mucilagenosa e devido ao seu caráter altamente higroscópico, acredita-se que protejam a alga da desidratação quando essa é submetida a longos períodos de exposição ao sol durante as marés baixas. A natureza mucilagenosa destes compostos, também parece contribuir para tornar a alga flexível o bastante para crescer em ambiente líquido e rígida o suficiente para permanecer estendida, e assim, melhor captar a luz e os nutrientes existentes [7].
18
de uma nova fucana traz sempre novas perspectivas de descoberta de um novo fármaco ou de um novo composto a ser utilizado por diversas indústrias, como: química, farmacêutica ou alimentícia [9]. Na tabela I tem-se um resumo das principais atividades farmacológicas atribuídas as fucanas de algas.
Tabela I
Principais Atividades Farmacologias atribuídas a Fucanas de Algas
Atividade Alga
Angiogênico Fucus vesiculosus
Anti complemento Laminaria cichorioides,
L. japonica, Fucus evanescens, Ascophyllum nodosum
Antiadesiva Laminaria sacharina, L.digitata, Fucus serratus, F .vesiculosus, Spatoglossum schröederi
Anticoagulante Lessonia vadosa, L. cichorioides, Dictyota menstrualis, Padina gmynospora
Antioxidante Fucus vesiculosus, Laminaria japonica
Antiproliferativo A. nodosum, F. vesiculosus, S. schroederi, Sargassum filipendula, Dictyopteris delicatula, Antitrombótico S. schröederi
Antitumoral A. nodosum
Anti-úlcera Cladosiphon okamuranus
Antiviral Stoechospermum marginatum, Cystoseira
indica, Undaria pinatifida
Antimetastático Fucus evanescens, Sargassum thumbergii Bloqueio de ligação
célula-célula via selectina
F. vesiculosus
Liberação de TNF- F. vesiculosus Estímulo de síntese de
heparan antitrombótico
S. schröederi
Fibrinolítica E. kurome, F. vesiculosus Impedir a rolagem de
leucócitos
F. vesiculosus
19
Produtos naturais, como polissacarídeos sulfatados, são uma fonte importante de substâncias químicas com potencial de aplicabilidade terapêutica [10,11]. Atividade anti-inflamatória já foi demonstrada para polissacarídeos sulfatados isolados de algas. Porém há poucos relatos referentes à atividade antinociceptiva de polissacarídeos sulfatados de algas. Pode-se citar galactanas sulfatadas das algas vermelhas Bryothamnion seaforthii [10]. Champia feldmannii [12], Solieria filiformis [13] e Acanthophora muscoides [14]. A única alga verde que teve um polissacarídeo sulfatado avaliado como antinociceptivo foi a alga Caulerpa cupressoides [15].
20 2. JUSTIFICATIVA
21 3. OBJETIVO
3.1 OBJETIVO GERAL
Investigar a atividade antinociceptiva e anti-inflamatória de uma fucana extraída da alga marrom Dictyota menstrualis.
3.2 OBJETIVOS ESPECÍFICOS
Extrair e purificar a fucana denominada de F2,0v; Avaliar a atividade anticoagulante de F2,0v;
Avaliar o efeito da F2,0v no processo inflamatório através de testes de indução de migração de leucócitos in vivo;
Verificar a capacidade da F2,0v modular a produção de citocinas. Desafiar essa fucana através de modelos químicos de nocicepção em camundongos;
22 4 METODO
Serão descritos a seguir apenas os métodos que necessitam de um maior detalhamento para sua compreensão e/ou replicação, os demais métodos encontram-se claramente descritos no artigo.
4.1. Extração e Fracionamento dos Polissacarídeos Ácidos da Alga
Dictyota menstrualis
4.1.1. Obtenção do Pó cetônico
A alga seca e pulverizada (100 g) foi tratada quatro vezes, com dois volumes de acetona, durante 12 horas para despigmentação e delipidação do material.
A acetona foi decantada e o resíduo colocado para secar a temperatura ambiente, após nova aferição do seu peso seco (95,3g), o material, que se convencionou chamar de “pó cetônico” foi, então, armazenado em garrafas de polietileno até o momento da extração.
4.1.2. Proteólise
Ao pó cetônico foram adicionados dois volumes de NaCl 0,25M e o pH ajustado para 8,0 com NaOH. A este material foi adicionada a enzima proteolítica Maxatase (15 mg por grama de pó cetônico) e esta suspensão permaneceu a 60°C, sob agitação constante, durante 24 h. A suspensão foi em seguida centrifugada a 10.000 x g por 15 minutos. O sobrenadante, denominado de “cru de polissacarídeos”, foi medido e estocado a 4°C. Este material foi submetido a um processo de fracionamento com concentrações crescentes de acetona que separou os polissacarídeos de acordo com a solubilidade em meio apolar.
4.1.3. Fracionamento com acetona.
23
10.000 x g por 10 min. e seco a pressão reduzida. Ao sobrenadante foi adicionado um volume de acetona necessário para uma concentração final de 100% de acetona com relação ao volume inicial do cru de polissacarídeos, sendo mantido a 4°C durante 18h. Esse procedimento foi repetido usando se volumes de acetona necessários para que a solução ficasse nas concentrações finais de acetona de 150, 200, e 300%, com relação ao volume inicial de acetona, dando origem, respectivamente, as frações de acetona F0,5v; F1,0v; F1,5v; F2,0v e F3,0v; que correspondem, às frações precipitadas com 50, 100, 150, 200 e 300% de acetona (figura 01).
Figura 01: Esquema de extração dos polissacarídeos por precipitação com acetona. 2 Vol. de NaCl 0,25M pH 8,0 Maxatase (15mg/g Pó
Cetônico) 60°C “overnigth”
10.000 x g 10 min.
100g de alga + 8V de acetona.
Acetona Vol. 0,5; 18h 10.000 x g, 10 min.
Acetona Vol. 3,0; 18h 10.000 x g, 10 min. Acetona Vol. 2,0; 18h 10.000 x g, 10 min.
Acetona Vol. 1,5; 18h 10.000 x g, 10 min.
Acetona Vol.1,0; 18h 10.000 x g, 10 min. F 0,5v
Pó Cetônico
F 1,0v
F 2,0v
F 1,5v
F 3,0v
24 4.2 Purificação
4.2.1. Cromatografia em Coluna de Troca Iônica
A fração F2,0v contendo a fucana C (Fuc C) foi submetida à fracionamento, com resina de troca iônica Lewatite (2,5 g do material para 200ml de resina) e eluição com concentrações crescentes de sal, essencialmente como descrito por DIETRICH [21].
A eluição do material complexado foi realizada por “step wise” utilizando -se molaridades crescentes de NaCl. Foram coletadas frações, com volume total de três vezes o volume da resina para cada molaridade de sal (0,25 - 0,5 - 0,7 - 1,0 - 1,5 - 2,0 - 3,0M), nas quais foi determinado pela ausência de positividade para o método de fenol-sulfúrico [22]. O fluxo de coleta foi de 1ml/min.
4.2.2 Cromatografia em Gel Filtração (Sephadex G75)
Foram aplicados 250 mg da fração F2,0v em coluna de gel filtração Sephadex G-75 (101,9 x 1,94 cm) que fraciona polissacarídeos com massa molecular compreendida entre 1.000 e 50.000 Da. A coluna foi eluída com solução de ácido acético 0,2 M e NaCl 0,25 M, coletando-se frações de 3 mL com um fluxo de 3mL/min. à temperatura ambiente. O perfil de eluição foi monitorado pelas dosagens de açúcares totais [22] e fucose [23].
4.3 Caracterização
4.3.1. Eletroforese em Gel de Agarose
A eletroforese em gel de agarose foi iniciada pelo preparo das lâminas de vidro (7,5 x 5,0 x 0,2cm e 7,5 x 7,5 x 0,2cm) que foram devidamente limpas. Posteriormente, a agarose (0,6%) dissolvido no tampão de escolha, foi acomodado sob as lâminas de vidro, formando assim uma camada de gel sob cada lâmina. Alíquotas de 5 µl (50µg) da amostra foram aplicadas em canaletas no gel e submetidas à eletroforese, em caixa resfriada a 4°C. A origem corresponde ao pólo negativo.
As eletroforeses foram realizadas em tampão (PDA):
25
Nestas eletroforeses foram usados como referência de mobilidade os padrões de glicosaminoglicanos sulfatados e amostras de fucana A, fucana B e fucana C da alga marinha marrom Spatoglossum schröederi. Decorrido o tempo previsto para a migração eletroforética em cada sistema de tampão, os compostos foram precipitados com solução de CETAVLON 0,1%, por um tempo mínimo de duas horas, à temperatura ambiente.
Em seguida o gel foi seco sob uma corrente de ar quente e corado com azul de toluidina 0,1%, numa solução de ácido acético 1% e etanol 50%, sendo o excesso de corante removido por uma solução de ácido acético 1% em etanol 50% (solução descorante). A operação foi repetida até a descoloração completa do fundo da lâmina. A seguir o gel foi seco à temperatura ambiente.
4.3.2. Análises Químicas 4.3.2.1 Açúcares Totais
Açúcares totais foram determinados pelo método do fenol/ácido sulfúrico de acordo com DUBOIS [22], empregando-se como padrão L-fucose, sendo as leituras realizadas a 490 nm.
4.3.2.2 Sulfato
O sulfato total foi medido após hidrólise ácida (HCl 8N, 6 horas, 100°C) e foi quantificado por turbidimetria pelo método da gelatina-bário [24]. Sulfato de sódio (1,0 mg/ml) foi empregado como padrão.
4.3.2.3 Proteína
Foi determinada com o reagente Comassie Blue R segundo o método de SPECTOR [25], sendo a leitura realizada à 595nm.
4.3.2.4 Relação molar dos monossacarídeos
26
monossacarídeos. O material foi na sequência neutralizado, seco e ressuspenso em água.
A composição de açúcar foi determinado por um sistema de HPLC LaChrom Elite ® da VWR-Hitachi com um detector de índice de refracção (RI detector modelo L-2490). Uma coluna LiChroCART ® 250 (250 mm x 40 milímetros). Foram aplicados 0,2mg da fração F 2,0v e o tempo de análise foi de 25 min. Como referências, foram analisados os seguintes açúcares: arabinose, frutose, fucose, galactose, glicose, glicosamina, ácido glucurónico, ácido manurónico manose, ramnose e xilose. Dexametasona (Decadron, Aché, Campinas, SP, Brasil).
4.3.3. Infravermelho
27 5 ARTIGO
O artigo foi publicado no Periódico Marine Drugs, que possui fator de impacto XXXX e Qualis XXXX da CAPES para a área Medicina II
m
arine drugs
ISSN 1660-3397 www.mdpi.com/journal/marinedrugs
Article
Evaluation of Anti-Nociceptive and Anti-Inflammatory
Activities of a Heterofucan from Dictyota menstrualis
Ivan Rui Lopes Albuquerque 1,2, Sara Lima Cordeiro 1, Dayanne Lopes Gomes 1, Juliana Luporini Dreyfuss 3, Luciana Guimarães Alves Filgueira 1, Edda Lisboa Leite 1, Helena Bonciani Nader 3 and Hugo Alexandre Oliveira Rocha 1,2,*
1
Laboratory of Biotechnology of Natural Polymers (BIOPOL), Department of
Biochemistry, Federal University of Rio Grande do Norte (UFRN), Natal-RN 59078-970, Brazil;
E-Mails: ivanruilopes@gmail.com (I.R.L.A.); sara-cordeiro@hotmail.com (S.L.C.); dayanne_gomes@hotmail.com (D.L.G.); lucianagalves@hotmail.com (L.G.A.F.); eddaleite@cb.ufrn.br (E.L.L.)
2
Graduate Program in Health Sciences, Federal University of Rio Grande do Norte (UFRN), Natal-RN 59078-970, Brazil
3
Department of Biochemistry, Federal University of São Paulo (UNIFESP), São Paulo-SP 04044-020, Brazil; E-Mails: jdreyfuss@gmail.com (J.L.D.);
hbnader.bioq@epm.br (H.B.N.)
* Author to whom correspondence should be addressed; E-Mail: hugo@cb.ufrn.br;
Tel.: +55-84-32153416 (ext. 207); Fax: +55-84-32119208.
Received: 3 May 2013; in revised form: 4 June 2013 / Accepted: 17 June 2013 / Published:
Abstract: Fucan is a term that defines a family of homo- and
28
beta (IL-1β) and interleukin-6 (IL-6), as well as tumor necrosis factor alpha (TNF-α). F2.0v (20.0 mg/kg) has peripheral antinociceptive activity with potency similar to dipyrone. On the other hand, it had no effect on pain response on the hot plate test. Confocal microscopy analysis and flow cytometry showed that F2.0v binds to the surface of leucocytes, which leads us to suggest that the mechanism of action of anti-inflammatory and antinociceptive F2.0v is related to its ability to inhibit the migration of leukocytes to the site of tissue injury. In summary, the data show that F2.0v compound has great potential as an antinociceptive and anti-inflammatory, and future studies will be performed to further characterize the mechanism of action of F2.0v.
Keywords: fucan; brown seaweed; pain; analgesic; dictyotales
1. Introduction
The main function of the sensory system is to keep the brain informed of external conditions, the environment and internal conditions of the body. Among the sensations of the body, pain can be classified as one of the most important for the maintenance of homeostasis. The feeling of pain serves as an alarm, which leads, in most cases, to an affected individual having an avoidance behavior, especially when it is sharp and intense, which reduces the damage to the attacked area of the body [1].
The term, nociception, being related to the recognition of pain signals through the nervous system, is complexity and is a result of evolutionary pressure, experienced by species, to prevent damage to organisms. The process of nociception and pain involves diverse mechanisms, and it is obvious that a single drug will not be able to relieve the pain completely. An effective plan includes different classes of analgesic drugs acting at different points of the pathophysiological mechanisms that involve pain. Although the pain has its protective effect, the persistent soreness can lead to negative behaviors, such as depression and irritability, causing social and economic problems [1].
Although there are several drugs currently being used as modulators of the nociceptive system, there is always a search for new more potent and safe drugs, which may be used in specific situations. Furthermore, in this search, a tool that has performed with great value for the identification of compounds is anti-nociceptive animal models [1].
29
flexibility to the seaweeds, like its growth in the aquatic environment and sufficient rigidity to remains extended and, thus, capturing light and nutrients more effectively [2]. Among the sulfated polysaccharides from seaweed, those that stand out, because they have pharmacological activity, are fucans. They are a family of homo- and hetero-polysaccharides having in its constitution monomer sulfated L-fucose [3]. Recent
studies have demonstrated that fucans presented various pharmacological activities, such as: anticoagulant [4], antioxidant [5], immune modulator [6], viral [7,8], anti-inflammatory [9] and anti-tumoral [10].
Spatoglossum schröederi is a seaweed from the Dictyotaceae order and synthesizes
three different types of sulfated fucans, which were named fucans A, B and C, according to their electrophoretic mobility in agarose gel in 1,3-diaminopropane acetate buffer [11]. These fucans exhibit antiproliferative [12], anti-adhesive [13] and antithrombotic activities [14]. Recently, Farias and colleagues [15] demonstrated that one of the fucans from S. schröederi presents anti-nociceptive activity. At best, we know this is a unique study that analyzed the anti-nociceptive activity of fucans.
Dictyota menstrualis is a different seaweed from the Dictyotaceae order; it is found in
almost all of the Brazilian coast (about 8000 km), as well as in the Caribbean and Mexico. This, added to its constant presence and biomass production, makes this organism an excellent choice for prospecting bioactive compounds. Studies with fucans-rich extract from this seaweed showed that it has antioxidant activity in vitro and cytotoxicity against tumor cells (HeLa) [16].
In a previous work, we extracted and purified heterofucans from D. menstrualis [17]. Those that were obtained in larger quantities were named fucans F1.0v, F1.5v and F2.0v. The fucans, F1.0v and F1.5v, have presented anticoagulant activity. However, the fucan known as F2.0v showed no anticoagulant activity, which allows the use of this fucan for other new applications, since the anticoagulant effect could be an unwanted side effect. Thus, this study was aimed at evaluating the potential anti-inflammatory and antinociceptive activities of fucan F2.0v from the seaweed, Dictyota menstrualis.
2. Results and Discussion
2.1. Obtaining Fucan F2.0v from D. menstrualis
30
fraction was dialyzed, dried, suspended in distilled water and subjected to agarose gel electrophoresis (see Methods). As can be seen in Figure 1B, fucan 2.0v is shown as a single band with electrophoretic mobility similar to the seaweed fucan C (Fuc C), from
Spatoglossum schröederi, which confirms the homogeneity of F2.0v and its identity as
fucan C. The amount of F2.0v obtained after purification steps correspond to 0.1% of seaweed dry weight.
Chemical analysis showed that F2.0v is composed by fucose:xylose:galactose:sulfate in the ratio of 1:0.4:1.5:1.3, respectively; traces of glucuronic acid have also been identified. The presence of protein in the sample was observed. This composition is very similar to Fuc C from S. schröederi [20], and in both cases, the two fucans are sulfated galactofucans. Such polymers are not as common; however, there is a description of galactofucans in seaweeds from the Laminariales order (Undaria pinnatifida [7], Saccharina longicruris [21]), the Ectocarpales order (Adenocystis utricularis [8]), the Dictyotales order [13,20] and the Fucales order (Sargassum horneri [22]). Furthermore, antithrombotic [18] and anti-viral [7] activities have been described for these heterofucans.
Figure 1. (A) Elution profile of F2.0v in gel filtration chromatography (A).
Gel filtration chromatography fractions of a 1 mL/tube were collected and checked by the method of phenol/sulfuric [18], as well as by the presence of fucose [19]; (B) F2.0v representative agarose gel electrophoresis in 1,3-diaminopropane acetate buffer, stained with
toluidine blue.
(A) (B)
2.2. Infrared Analysis of F2.0v
31
vibration associated with a C–O–SO3 group. The peaks at 810–850 were caused by the
bending vibration of C–O–S [23]. At 3000–3400 cm−1, Fuc C showed bands from the stretching vibration of O–H and C–H, respectively [24], at 2932 cm−1 and Fuc C showed stretching vibrations of CH2 [25]. The peak of the C–H symmetric deformation
vibration was at 1416 cm−1 [26]. A band at 1655 cm−1 was assigned to the antisymmetric stretching vibration of the COO– of glucuronic acid [3], which is overlapped with the vibration of water.
Figure 2. FTIR spectra of F2.0v from D. menstrualis.
2.3. Anticoagulant Activity
Fucans from various seaweeds, including different Dictyotales [3,4], possess anticoagulant activity. In this way, we evaluated the anticoagulant activity of the Fuc C test by Prothrombin time (PT) and Partial thromboplastin time (APTT). However, in all conditions evaluated (10 to 100 μg/mL), F2.0v showed no anticoagulant activity (data not shown).
2.4. Anti-Inflammatory Activity
2.4.1. Fuc C Inhibits Leukocyte Migration into the Peritoneal Cavity
32
Since F2.0v from D. menstrualis presented absent anticoagulant activity, we decided to evaluate its anti-inflammatory potential. According to Lima and colleagues [28], an excellent indicator of anti-inflammatory activity of new compounds is the peritoneal cell migration inhibition in acute inflammation models. In the present study, it was verified that F2.0v polysaccharide is be able to inhibit the migration of leukocytes into the mice peritoneal cavity after stimulation with peptone in all tested concentrations (Figure 3). After 15 mg/kg, the inhibition reached a plateau, since concentrations of 15, 20 and 40 mg/kg showed no significant differences when compared to each other; compared to the saline group, 15, 20 and 40 mg/kg showed no substantial differences, pointing out that F2.0v, in these concentrations led to 100% of inhibition of leukocyte migration induced by peptone. In addition, F2.0v at 15 mg/kg was more potent than the positive control.
2.4.2. F2.0v Does Not Influence the Production of Pro-Inflammatory Cytokines
Many compounds inhibit leukocyte migration into the abdominal cavity by the inhibition of pro-inflammatory cytokines, which act as chemoattractants. Many fucans have the property of inhibiting the synthesis of cytokines, such as a fucan extracted from Ascophyllum nodosum, which has the ability to modulate the production of TNF-α and IL-6 when stimulated with lipopolysaccharides (LPS) [29]. Therefore, in order to understand the mechanism of leukocyte migration evoked by F2.0v, we evaluated the effect of this fucan in cytokine (TNF-α, interleukin 1β (IL-1β) and interleukin 6 (IL-6)) release. For this experiment, murine macrophages were incubated with F2.0v at different concentrations (10, 50, 100 and 200 μg/mL) for 24 h. In addition, 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT) test showed no cytotoxicity (viability more than 96%), independently of the concentration of F2.0v (data not shown). Therefore, macrophages were exposed to F2.0v (10, 50, 100 and 200
33
Figure 3. The effect of F2.0v in the migration of leukocytes in mice with
induced peritonitis peptone. The bars show the media of the number of leukocytes per mL of peritoneal fluid, 6 h after intra-peritoneal administration of peptone. Peptone (10%) and dexamethasone (1.0 μg/g) are the negative and positive control, respectively. The effect of F2.0v when compared to the positive control (* p < 0.05; ** p < 0.001). ∆: There are no significant differences when compared to each other.
2.4.3. Fuc C Binds to Murine Leukocyte Surface
34
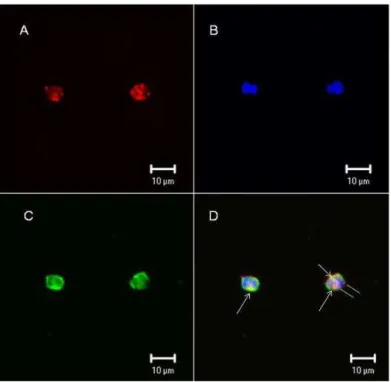
Confocal microscopy tests were performed in leukocytes from human blood to confirm whether F2.0v binds the leukocyte surface. Figure 5 clearly shows that F2.0v binds the cell surface. Biotinylated F2.0v was incubated with streptavidin conjugated with Alexafluor 594, and the staining is shown in red (Figure 5). In order to locate the binding of F2.0v, a triple staining was performed by using wheat germ agglutinin (WGA) lectin conjugated with fluorescein isothiocyanate (FITC) and a nuclear staining
in blue using 4 ,6-diamidino-2-phenylindole (DAPI). The lectin staining is shown in green and is specific for N-acetyl glucosamine from the cell surface. The merge of images showed a colocalization of WGA-lectin and F2.0v, depicted by yellow dots. This result confirms that F2.0v binds to the leukocyte surface.
Figure 4. F2.0v binds leukocytes. Equal number of cells from peritoneal
35
Figure 5. F2.0v binds leukocyte cell surface. (A) Biotinylated F2.0v is
shown in red; (B) Nuclei are shown in blue, stained with DAPI; (C) WGA-lectin conjugated with FITC is shown in green; (D) Merge of the three images and the yellow color indicates colocalization of F2.0v and WGA-lectin. Similar results were obtained in two independent experiments.
36
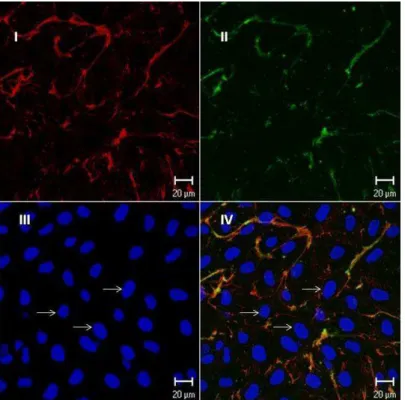
Figure 6. Endothelial cells exposed to biotinylated fucan; the cells were
grown for three days and exposed to biotinylated fucan. The image was obtained by confocal microscopy. Barr = 20 μm. Similar results were obtained in two independent experiments. (I) The cells were exposed to biotinylated fucan and revealed with streptavidin conjugated with Texas Red; (II) Fibronectin revealed with anti-fibronectin conjugated with FTIC; (III) Nucleus stained in blue with DAPI; (IV) Superposition of images A and B. Arrows indicate the cell nucleus stained with DAPI.
37
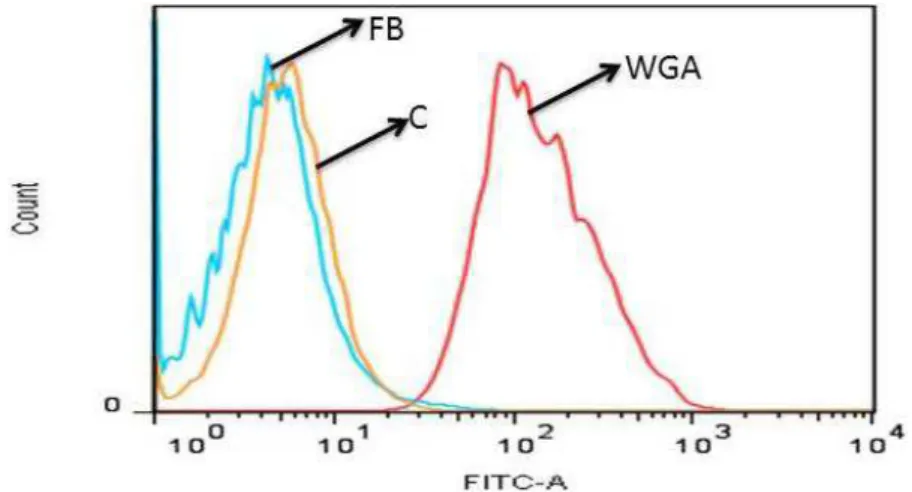
Figure 7. Biotinylated fucan does not bind to the endothelial cell surface;
the biding of fucan on the endothelial cell surface was analyzed by flow cytometry. WGA: FITC conjugated WGA-lectin; C: endothelial cell; FB:
endothelial cell exposed to biotinylated fucan. A representative out of three experiments yielding identical results is shown.
2.5. Anti-Nociceptive Activity
Since F2.0v has an anti-inflammatory activity and the intimate relationship between the inflammatory process and the development of pain is known, the analgesic and/or anesthetic activity of F2.0v was verified. Two animal models were used to investigate pain: The acetic acid-induced writhing and hot plate tests. These tests have been reported, and they bring information from peripheral and central activity, respectively [30].
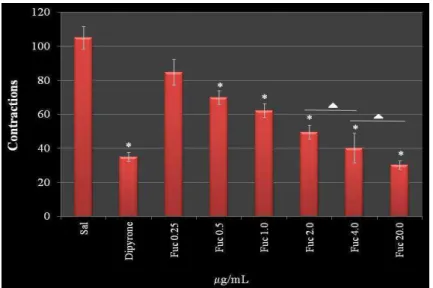
Figure 8 demonstrates a dose-dependent effect of F2.0v in reducing nociceptive sensation in the chemical induction test. This effect reached the maximum of 61.2% at a concentration of 4.0 mg/kg of animal, which was similar with higher concentrations (20.0 mg/kg). In addition, there was no difference between the effect observed with 2.00 mg/kg and 4.0 mg/kg. Interestingly, at 4.0 mg/kg, the protective effect of F2.0v was similar to dipyrone (65.6%), a reference drug used in tests of peripheral analgesia. These data show that F2.0v has a peripheral antinociceptive activity.
38
The hot plate test showed that F2.0v had no effect in the tested concentrations. The results were not significantly different from the negative control. Taken together, F2.0v was not able to decrease the sensation of pain (Figure 9).
Figure 8. The effect of administration of F2.0v in the number of abdominal
contractions in acetic acid-induced mice. Data are expressed as the mean ± S.E.M. of six animals for each group. * p < 0.001 indicates significant
difference from the saline group. ∆: There are no significant differences
when compared to each other.
Figure 9. The effect of administration of F2.0v in the reaction time of the
39
The fucan of Spatoglossum schröederi, the only other fucan where an analgesic effect was analyzed, also showed peripheral antinociceptive effect [15]. These data suggest that fucans act as peripheral anti-nociceptives. However, there are few data to sustain this hypothesis.
In this study, we show that F2.0v does not diminish the sensation of pain via the central nervous system, but is an antinociceptive when the pain is peripheral. Previous studies have suggested that induction of contraction by acetic acid has an indirect mechanism of action; it induces the release of endogenous mediators that lead to stimulation of the nociceptive neurons sensitive to non-steroidal anti-inflammatory drugs and opioids, and many of these mediators are derived from immune cells that migrate to the focus of irritation, such as TNF-α and IL-1β [32]. The data obtained using cultures of macrophages have shown that F2.0v does not stimulate the synthesis of these pro-inflammatory cytokines. Moreover, F2.0v decreases the amount of migratory cells (leukocytes) to the peritoneal cavity, which, consequently, could lead to decreased amounts of endogenous mediators. Therefore, we believe that F2.0v has peripheral antinociceptive activity by decreasing the migration of leukocytes to the focus of irritation. The data of Ribeiro et al. [32] corroborate our hypothesis. These authors found a significant effect of 0.6% acetic acid in inducing the feeling of pain and decreased when it was promoted in a low number of leukocytes in the peritoneal cavity, suggesting that induced nociceptive activity promoted by acetic acid occurs through a mechanism dependent on the presence of leukocytes.
3. Experimental Section
3.1. F2.0v Purifying
The brown seaweed, Dictyota menstrualis, was collected on Búzios beach (05°58 23 S–35°04 97 W), Rio Grande do Norte State (Brazil’s Northeast), in November 2010. Immediately after collection, algae were identified by Valquiria P. Medeiros from the Centro de Biociências/UFRN, Natal, RN, Brazil. It was brought to the laboratory for Biotechnology Natural Polymers (BIOPOL), which was clean, dried and crushed. One hundred grams of tissue were treated with dry acetone to remove lipid contaminants, after evaporation of acetone; the material was subjected to protein digestion, according to Rocha et al., 2005 [11], for the release of polysaccharides. They were separated by an increasing precipitation with acetone, as described in Albuquerque
et al., 2004 [17].
40
and eluted with a solution of 0.2 M acetic acid and 0.15 M NaCl. Fractions of 1 mL were collected and tested by the phenol/H2SO4 reaction [18] and by detection of fucose
using the Dische method [19]. Fractions containing sulfated fucose-rich polysaccharides were pooled, dialyzed against distilled water and lyophilized.
3.2. Agarose Gel Electrophoresis
Agarose gel electrophoresis of fucans was performed in 0.6% agarose gel (7.5 cm × 10 cm × 0.2 cm thick) prepared in 0.05 M 1,3-diaminopropane acetate buffer, pH 9.0, as described previously [33]. Aliquots of the polysaccharides (about 50 μg) were applied to the gel and subjected to electrophoresis. The gel was fixed with 0.1% cetyltrimethylammonium bromide solution for 2 h, dried and stained for 15 min with 0.1% toluidine blue in 1% acetic acid in 50% ethanol. It was then distained using the same solution without the dye.
3.3. Chemical Analysis and Monosaccharide Composition
Total sugars were estimated by the phenol-H2SO4 reaction [18] using L-fucose as the
standard. After acid hydrolysis of polysaccharides (4 M HCl, 100 °C, 6 h), sulfate content was determined according to the gelatin-barium method [34], using sodium
sulfate as standard. Protein content was measured by Spector’s method [35]. To
determine the best polysaccharide acid hydrolysis using HCl, that is, where polymer degradation occurs without destroying monosaccharaides released by this degradation, F2.0v was hydrolyzed with HCl 0.5 M, 1 M, 2 M and 4 M, at 30 min, 1, 2 and 4 h, respectively. A temperature of 100 °C was maintained in all hydrolysis conditions. The material was later neutralized, dried and resuspended in water, and reducing sugars were determined, as described in Camara et al. [3]. The best hydrolysis condition was 2 M of HCl for 2 h. Thus, F2.0v hydrolyzed (2 M HCl, 100 °C, 2 h) and their sugar composition was determined by a LaChrom Elite® HPLC system from VWR-Hitachi with a refractive index detector (RI detector model L-2490). A LichroCART® 250 column (250 mm × 40 mm) packed with Lichrospher® 100 NH2 (5 μm) was coupled to
the system. The sample mass used was 0.2 mg, and the analysis time was 25 min; as references, the following sugars were analyzed: arabinose, fructose, fucose, galactose, glucose, glucosamine, glucuronic acid, mannose, mannuronic acid, rhamnose and xylose. Dexamethasone (Decadron, Aché; Campinas, SP, Brazil).
3.4. Fourier Transformed Infrared Spectroscopy (FTIR)
41
3.5. Anticoagulant Activity
APTT and PT tests were performed, as described in [36]. Unfractionated heparin (Sigma, São Paulo, Brazil) was used as the standard.
3.6. Animals and Cells
Male BALB/c mice, 6 to 8 week old, were bred and maintained in cages with food and ad libitum water, in the animal housing facility of the Department of Biochemistry, Federal University of Rio Grande do Norte, Natal, Brazil.
The experimental protocol for animal use was submitted to the Ethics Committee on Animal Use, approved under protocol number 003/2011 by the Federal University of Rio Grande do Norte.
The cells used for the present work were an endothelial cell line from the rabbit thoracic aorta. The cells were grown in F-12 medium (Life Technologies, Rockville, MD, USA), supplemented with 10% FBS (fetal bovine serum) (Cultilab, São Paulo, Brazil), 100 μg/mL streptomycin and 100 IU/mL penicillin (Sigma) at 37 °C in atmosphere of 2.5% CO2.
3.7. Migration of Leukocytes into the Peritoneal Cavity
The animals (mice—Balb C, weighing 20 to 25 g) were separated from the colony 12 h before the experiment for adaptation. Random groups containing 5 animals were formed. Groups were defined as substances administered to the negative control (saline i.v. and 10% peptone i.p.); positive control (dexamethasone (1.0 μg/g) i.v. and i.p.); saline group (saline i.v. and i.p.); test group (F2.0v was administered intravenously (100
μL) under different doses (from 0.25 to 40 mg/kg). Thirty minutes later, peptone 10% (1 mL) was administered intra-peritoneally. After the migration time (6 h), the animals were euthanized with a high dosing of sedative. The cells were collected by peritoneal lavage with 10 mL of saline and counted. The result was expressed as the number of cells per mL of peritoneal lavage.
3.8. Quantification of Cytokines
Cells (1 × 106 in duplicate) obtained from peritoneal lavage were cultured in 24-well plates at 37 °C and 5% CO2 in medium RPMI-1640, supplemented with fetal bovine
42
3.9. Biotinylation of F2.0v
F2.0v was biotinylated as described in [13], using biotin-hydrazide (Pierce Chemical Co.; Rockford, IL, USA). Briefly, about 10 mg of F2.0v biotin-hydrazide (200 mmol) were dissolved in 20 mL HCl (0.1 M) pH 4.8. Then, 200 mmol of 1(3 -dimetilaminopropil)-3-etilcarbodiimida (EDAC) (Sigma) was added. The pH of the reaction was kept at 4.8, with addition of HCl (0.01 M) for 60 min with stirring. The reaction was stopped by the addition of sodium acetate to a final concentration of 0.5 M, pH 4.8, and the solution stirred for an additional 60 min.
3.9.1. Flow Cytometric Analysis
Cells (1 × 106 in duplicate) obtained from peritoneal lavage were washed twice with RPMI (4 °C) medium and resuspended in 1 mL of phosphate buffer saline (PBS) (4 °C), containing saturating amounts of biotinylated F2.0v. After incubation for 1 h at 4 °C, cells were washed and suspended in a solution containing fluorescein isothiocyanate (FITC) (Molecular Probes; Eugene, OR, USA) conjugated with streptavidin. Again, after incubation for one hour, cells were washed and suspended in a solution containing anti-CD11a (Integrin αL Antibody—Santa Cruz Biotech., Dallas, TE, USA). After one hour of incubation, cells were washed tree times, as recommended by the manufacturer. Events (n = 40,000) were analyzed with a FACscan flow cytometry (Becton and Dickinson Immunocytometry System, San Jose, CA, USA).
Endothelial cells were harvested after a short exposure to 2 mM phosphate buffered saline-ethylene diamine tetra-acetic acid (EDTA-PBS). Cells (1 × 106 per sample) were washed twice with F-12 medium and resuspended in 1 mL of PBS containing saturating amounts of biotinylated fucan. After incubation for 1 h at 4 °C, cells were washed and resuspended in a solution containing fluorescein isothiocyanate (FITC) (Molecular Probes; Eugene, OR) conjugated with streptavidin or WGA-FITC (5 mg/mL). Again, after incubation for 1 h, cells were washed and analyzed by flow cytometry (FACSCalibur, Becton and Dickinson, Sparks, MD, USA.
3.9.2. Immunocytochemistry
43
Zeiss, Weimar, Germany). In order to study the localization of different components, double-labeled experiments were performed.
The endothelial cells (1 × 105) were placed on 12 mm-diameter glass cover slips in 24-well cluster plates (Nunc; Naperville, IL, USA). After 3 days in culture, the cells were washed three times with PBS (0.1 M pH 7.4), and the biotinylated fucan (10
μg/mL in PBS) was added to the cells before fixation (2% formaldehyde for 30 min). Fucan binding was revealed with Texas Red (Jackson ImmunoResearch, West Grove, PA, USA) conjugated streptavidin (5 μg/mL in PBS). The cells were then incubated with DAPI (1:2000) (Molecular Probes) for 2 min, washed five times in PBS, once in water, mounted in Fluoromount-G (E. M. Sciences; Ft. Washington, WA, USA) and examined with a confocal microscopy or fluorescence microscope.
3.9.3. Acetic Acid-Induced Writhing Test
This was performed as described by Ribeiro et al. [32]. The animals were separated from the colony for a period of 12 h of fasting. Later, the animals were grouped (n = 05). The animals were treated prophylactically with F2.0v (0.25, 0.5, 1, 2, 4 and 20 mg/kg of animal) (i.v.). After 30 min, the pain induction was performed by administering 0.6% of acetic acid (i.p.). Quantitation was performed by painful cumulative count of the number of abdominal contractions occurring within 30 min after induction by stimulus of 0.6% of acetic acid. The positive control group received only 0.9% of saline i.v., and the negative control received dipyrone 20 mg/kg.
3.9.4. Hot Plate Test
This was performed according to Eddy and Leimbach [37]. The test was performed on hot plate (51.5 ± 1 °C). The animals passed under a screening, those showing sensitivity to temperature being discarded. The animals were treated prophylactically (30 min) with F2.0v at concentrations of 1.0 and 20.0 mg/kg of animal and immediately placed back on the hot plate for a verification response at time zero; the mice were placed back on the hot plate at intervals of 30, 60 and 90 min from the beginning of the experiment. To avoid tissue injury, the maximum exposure to the plate was 40 s. The test was conducted with groups of five animals. We used morphine 5 mg/kg of animal and saline 0.9% for positive and negative controls, respectively.
3.10. Statistical Analysis
All data were expressed as the mean ± standard deviation. Statistical analysis was performed by one-way ANOVA. Student-Newman-Keuls post-tests were carried out for multiple group comparison. In all cases, statistical significance was set at p < 0.05.
44
When taken together, the effects of F2.0v on nociception (the acetic acid-induced writhing) and inflammation shows significant peripheral antinociceptive and anti-inflammatory activity. We demonstrated for the first time that a heterofucan seaweed, D.
menstrualis (F2.0v), showed antinociceptive and anti-inflammatory activities that are
related to its ability to bind the cell surface of leukocytes, preventing the migration of these cells to the site of tissue injury. However, pharmacological studies are continuing in order to characterize the mechanism(s) responsible for the F2.0v antinociceptive and anti-inflammatory effects.
Acknowledgments
We wish to thank Conselho Nacional de Desenvolvimento Científico e Tecnológico—CNPq, Fundação de Apoio a Pesquisa do Estado do Rio Grande do Norte—FAPERN, Coordenação de Aperfeiçoamento de Pessoal de Nível Superior— CAPES and Ministério de Ciência, Tecnologia e Inovação—MCTI for their financial support in the form of grants and fellowship awards. This research was submitted to the Graduate Program in Health Sciences at the Federal University of Rio Grande do Norte as part of the Ph.D. thesis of Ivan R. L. Albuquerque.
Conflict of Interest
The authors declare no conflict of interest.
References
1. Le Bars, D.; Gozariu, M.; Cardden, S.W. Animal models of nocicepcion.
Phamacol. Rev. 2001, 53, 597–652.
2. Michel, G.; Tonon, T.; Scornet, D.; Cock, J.M.; Kloareg, B. The cell wall polysaccharide metabolism of the brown alga Ectocarpus siliculosus. Insights into the evolution of extracellular matrix polysaccharides in Eukaryotes. New Phytol.
2010, 188, 82–97.
3. Camara, R.B.G.; Costa, L.S.; Fidelis, G.P.; Nobre, L.T.D.B.; Dantas-Santos, N.; Cordeiro, S.L.; Costa, M.S.S.P.; Alves, L.G.; Rocha, H.A.O. Heterofucans from the brown seaweed Canistrocarpus cervicornis with anticoagulant and antioxidant activities. Mar. Drugs 2011, 9, 124–138.
4. Magalhães, K.D.; Costa, L.S.; Fidelis, G.P.; Oliveira, R.M.; Nobre, L.T.; Dantas-Santos, N.; Camara, R.B.; Albuquerque, I.R.; Cordeiro, S.L.; Sabry, D.A.; et al. Anticoagulant, antioxidant and antitumor activities of heterofucans from the seaweed Dictyopteris delicatula. Int. J. Mol. Sci. 2011, 12, 3352–3365.
45
heterofucans from the seaweed Sargassum filipendula. Mar. Drugs 2011, 9, 952– 966.
6. Jiao, G.; Yu, G.; Zhang, J.; Ewart, H.S. Chemical structures and bioactivities of sulfated polysaccharides from marine algae. Mar. Drugs 2011, 9, 196–223.
7. Thompson, K.D.; Dragar, C. Antiviral activity of Undaria pinnatifida against herpes simplex virus. Phytother. Res. 2004, 18, 551–555.
8. Ponce, N.M.A.; Pujol, C.A.; Damonte, E.B.; Flores, M.L.; Stortz, C.A. Fucoidans from the brown seaweed Adenocystis utricularis: Extraction methods, antiviral activity and structural studies. Carbohydr. Res. 2003, 338, 153–165.
9. Paiva, A.A.; Castro, A.J.; Nascimento, M.S.; Will, L.S.; Santos, N.D.; Araújo, R.M.; Xavier, C.A.; Rocha, F.A.; Leite, E.L. Antioxidant and anti-inflammatory effect of polysaccharides from Lobophora variegata on zymosan-induced arthritis in rats. Int. Immunopharmacol. 2011, 11, 1241–1250.
10. Sokolova, R.V.; Ermakova, S.P.; Awada, S.M.; Zvyagintseva, T.N.; Kanaan, H.M. Composition, structural characteristics, and antitumor properties of polysaccharides from the brown algae Dictyopteris polypodioides and Sargassum sp. Chem. Nat.
Comp. 2011, 47, 329–334.
11. Rocha, H.A.O.; Moraes, F.A.; Trindade, E.S.; Franco, C.R.C.; Torquato, R.J.S.; Veiga, S.S.; Valente, A.P.; Mourão, P.A.; Leite, E.L.; Nader, H.B.; et al. Structural and haemostatic activities of a sulfated galactofucan from the brown alga
Spatoglossum schroederi. An ideal antithrombotic agent? J. Biol. Chem. 2005, 280,
41278–41288.
12. Almeida-Lima, J.; Costa, L.S.; Silva, N.B.; Melo-Silveira, R.F.; Silva, F.V.; Felipe, M.B.M.C.; Medeiros, S.R.B.M.; Leite, E.L.; Rocha, H.A.O. Evaluating the possible genotoxic, mutagenic and tumor cell proliferation-inhibition effects of a non-anticoagulant, but antithrombotic algal heterofucan. J. Appl. Toxicol. 2010, 30, 708–715.
13. Rocha, H.A.O.; Franco, C.R.C.; Trindade, E.S.; Veiga, S.S.; Leite, E.L.; Dietrich, C.P.; Nader, H.B. Fucan inhibits Chinese hamster ovary cell (CHO) adhesion to fibronectin by binding to the extracellular matrix. Planta Med. 2005, 71, 628–633. 14. Almeida-Lima, J.; Dantas-Santos, N.; Gomes, D.L.; Cordeiro, S.L.; Sabry, D.A.;
Costa, L.S.; Freitas, M.L.; Silva, N.B.; Moura, C.E.B.; Lemos, T.M.A.M.; et al. Evaluation of acute and subchronic toxicity of a non-anticoagulant, but antithrombotic algal heterofucan from the Spatoglossum schröederi in wistar rats.
Rev. Bras. Farmacogn. 2011, 21, 674–679.
15. Farias, W.R.; Lima, P.C.; Rodrigues, N.V.; Siqueira, R.C.; Amorim, R.M.; Pereira, M.G.; Assreuy, A.M. A novel antinociceptive sulphated polysaccharide of the brown marine alga Spatoglossum schroederi. Nat. Prod. Commun. 2011, 6, 863– 866.
46
Biological activities of sulfated polysaccharides from tropical seaweeds. Biomed.
Pharmacother. 2010, 64, 21–28.
17. Albuquerque, I.R.L.; Queiroz, K.C.S.; Alves, L.G.; Santos, E.A.; Leite, E.L.; Rocha, H.A.O. Heterofucans from Dictyota menstrualis have anticoagulant activity. Braz. J. Med. Biol. Res. 2004, 37, 167–171.
18. Dubois, M.; Gilles, K.A.; Hamilton, J.K.; Rebers, P.A.; Smith, F. Colorimetric method for determination of sugars, and related substances. Anal. Chem. 1956, 28, 350–356.
19. Dische, Z. Color Reactions of 6-Deoxi and 3-6-Dideoxioses. In Methods in
Carbohydrate Chemistry; Whistler, R.L., Wolfrom, M.L., Eds.; Academic Press,
Inc: New York, NY, USA, 1962; Volume 1, pp. 501–503.
20. Rocha, H.A.O.; Bezerra, L.C.; Albuquerque, I.R.L.; Costa, L.S.; Guerra, C.M.; Abreu, L.D.; Nader, H.B.; Leite, E.L. A xylogalactofucan from the brown seaweed
Spatoglossum schroederi stimulates the synthesis of an antithrombotic heparan
sulfate from endothelial. Planta Med. 2005, 71, 379–381.
21. Laurie-Eve, R.; Sylvie, L.T.; Martin, B. Structural characterization of laminaran and galactofucan extracted from the brown seaweed Saccharina longicruris.
Phytochemistry 2010, 71, 1586–1595.
22. Ermakova, S.; Sokolova, R.; Kim, S.; Um, B.; Isakov, V.; Zvyagintseva, T. Fucoidans from brown seaweeds Sargassum hornery, Eclonia cava, Costaria
costata: Structural characteristics and anticancer activity. Appl. Biochem. Biotechnol. 2011, 164, 841–850.
23. Barroso, E.M.; Costa, L.S.; Medeiros, V.P.; Cordeiro, S.L.; Costa, M.S.P.; Franco, C.R.; Nader, H.B.; Leite, E.L.; Rocha, H.A.O. A non-anticoagulant heterofucan has antithrombotic activity in vivo. Planta Med. 2008, 74, 708–712.
24. Wang, X.; Wang, J.; Zhang, J.; Zhao, B.; Yao, J.; Wang, Y. Structure-antioxidant relashionships of sulfated galactomannan from guar gum. Int. J. Biol. Macromol.
2010, 46, 59–66.
25. Shumbula, P.M.; Moloto, M.J.; Tshikhundo, T.R.; Fernandes, M. Dichloro(bis[diphenylthiourea]) cadmium complex as a precursor for HDA-capped CdS nanoparticles and their solubility in water. S. Afr. J. Sci. 2010, 106, 1–7. 26. Xu, X.; Li, S.; Jia, F.; Liu, P. Synthesis and antimicrobial activity of nano-fumed
sílica derivative with N,N-dimethyl-N-hexadecylamine. Life Sci. J. 2006, 3, 59–62. 27. Brito, A.S.; Arimateia, D.S.; Souza, L.R.; Lima, M.A.; Santos, V.O.; Medeiros, V.P.;
Ferreira, P.A.; Silva, R.A.; Ferreira, C.V.; Justo, G.Z.; et al. Anti-inflammatory properties of a heparin-like glycosaminoglycan with reduced anticoagulant activity isolated from a marine shrimp. Bioorg. Med. Chem. 2008, 16, 9588–9595.
28. Lima, G.M.; Quintans-Júnior, L.J.; Thomazzi, S.M.; Almeida, E.M.S.A.; Melo, M.S.; Serafi, M.R.; Cavalcanti, S.C.H.; Gelain, D.P.; Santos, J.P.A.; Blank, A.F.; et al. Phytochemical screening, antinociceptive and anti-infl ammatory activities of
47
29. Anastase-Ravion, S.; Carreno, M.P.; Blondin, C.; Ravion, O.; Champion, J.; Chaubet, F.; Haeffner-Cavaillon, N.; Letourneur, D. Heparin-like polymers modulate proinflammtory cytokine production by lipopolysaccharide-stimulated human monocytes. J. Biomed. Mater. Res. 2002, 60, 375–383.
30. Coura, C.O.; de Araújo, I.W.; Vanderlei, E.S.; Rodrigues, J.A.; Quinderé, A.L.; Fontes, B.P.; de Queiroz, I.N.; de Menezes, D.B.; Bezerra, M.M.; e Silva, A.A.; et
al. Antinociceptive and anti-inflammatory activities of sulphated polysaccharides
from the red seaweed Gracilaria cornea. Basic Clin. Pharmacol. Toxicol. 2012,
110, 335–341.
31. Assreuy, A.M.S.; Gomes, D.M.; Silva, M.S.J.; Torres, V.M.; Siqueira, R.C.L.; Pires, A.F.; Criddle, D.N.; Alencar, N.M.N.; Cavada, B.S.; Sampaio, A.H.; et al. Biological effects of a sulfated-polysaccharide isolated from the marine red algae
Champia feldmannii. Biol. Pharm. Bull. 2008, 31, 691–695.
32. Ribeiro, R.A.; Vale, M.L.; Thomazzi, S.M.; Paschoalato, A.B.; Poole, S.; Ferreira, S.H.; Cunha, F.Q. Involvement of resident macrophages and mast cells in the writhing nociceptive response induced by zymosan and acetic acid in mice. Eur. J.
Pharmacol. 2000, 387, 111–118.
33. Dietrich, C.P.; Dietrich, S.M.C. Electrophoretic behaviour of acidic mucopolysaccarides in diamine buffers. Anal. Biochem. 1976, 70, 645–647.
34. Dodgson, K.S.; Price, R.G. A note on the determination of the ester sulphate content of sulphated polysaccharides. Biochem. J. 1962, 84, 106–110.
35. Spector, J. Refinemente of the comassie blue method of protein quantification. A simple and liner spectrofotometric assay of 0.5 to 50 μg of protein. Anal. Biochem.
1978, 86, 142–146.
36. Costa, M.S.S.P.; Costa, L.S.; Cordeiro, S.L.; Almeida-Lima, J.; Dantas-Santos, N.; Magalhães, K.D.; Sabry, D.A.; Albuquerque, I.R.L.; Pereira, M.R.; Leite, E.L.; Rocha, H.A.O. Evaluating the possible anticoagulant and antioxidante effects of sulfated polysaccharides from the tropical green alga Caulerpa cupressoides var.
flabella. J. Appl. Phycol. 2012, 24, 1159–1167.
37. Eddy, N.B.; Leimbach, P. Synthetic analgesics; dithienylbutenyland dithienylbutylamines. J. Pharmacol. Exp. Ther. 1953, 107, 385–389.
Reference list: We recommend the use of reference management software to prepare the references list (e.g. Endnote, http://www.mdpi.com/files/word-templates/MDPI.ens).
48
6 COMENTÁRIOS, CRÍTICAS E CONCLUSÕES
No projeto proposto no inicio do doutorado tinha-se como meta a caracterização estrutural da fucana 2,0v, com a finalidade de correlacionar as características estruturais da fucana com a possível atividade antinociceptiva que esta viesse a apresentar. Contudo, esta meta não foi alcançada por completo, já que as técnicas de ressonância magnética nuclear e os estudos de metilação, que seriam de extrema importância para conclusão dessa meta não foram realizados. Isto ocorreu devido à impossibilidade da minha ida para realizar esses experimentos em outro centro de pesquisa, que se localizava no departamento de Bioquímica da Universidade Federal do Paraná. Já que assumi que no decorrer do doutoramento um cargo em público após a aprovação em concurso.
Também fazia parte das nossas metas identificar o mecanismo de ação antinociceptivo ou pelo menos identificar os principais pontos desse mecanismo de ação. Essa meta foi alcançada, pois nós conseguimos demonstrar que a fucana F 2,0v tem atividade antinociceptiva por impedir a rolagem de leucócitos para o local da injúria. Vale salientar que esta foi a primeira vez que alguém conseguiu demonstrar este tipo de mecanismo de ação antinociceptivo para polissacarídeos sulfatados.
Durante o desenvolvimento do Doutorado foi sensível a minha evolução intelectual, devido o treinamento e aprimoramento, em diversas técnicas laboratoriais em diferentes áreas do conhecimento, tais como: imunologia, farmacologia, bioquímica, biologia celular, dentre outras. Além disso, tive também a oportunidade de aprofundar minhas relações com pessoas de diversas origens sócio-cuturais, que durante este período conviveram comigo no Departamento de Bioquímica da UFRN, bem como, em momentos em que estive fora de Natal, em congressos, simpósios, etc.
Com relação à produção a científica vale salientar que durante o período de doutoramento fui autor ou co-autor de 08 resumos publicados em congressos científicos, bem como, cinco artigos publicados em revistas internacionais.
49
fármacos pode desencadear um efeito dominó, que abrangerá melhorias que vão desta área social, principalmente na vida das comunidades caiçaras que venham a cultivar algas com finalidade de venda, até no desenvolvimento de novas tecnologias pela indústria farmacêutica. Passando também pela área da ecologia, pois com o desenvolvimento de fazendas de cultivo de algas proporcionará a atração de várias espécies de peixes e crustáceos, aumentando a diversidade local. E, por conseguinte, auxiliará a pesca de subsistência.
50 7 REFERÊNCIAS
1. Pimenta, C.A.M.; Portinoi, A.G. Dor e cultura. In Carvalho M M M J. Dor: um estudo multidisciplinar. Summus, 1999, P 159-173.
2. Woolfe, G.; MacDonald, A.D. The evaluation of the analgesic action of pethidine hydrochloride (demerol). Journal of Pharmacology and Experimental Therapeutics, 1944, 80: 300-307.
3. Vilela Filho, O.; Corrêa, C.F.; Neuroestimulação e dor. Biotecnologia Ciências e Desenvolvimento. 1999, v.6, p.2-16.
4. Tilley, 2001
5. Kummer, C.L.; Coelho, T.C.R.B. Cycloxygenase-2 Inhibitors Nonsteroid Anti-Inflammatory Drugs:Current Issues. Rev Bras Anestesiol, 2002, 52: 4: 498 – 512.
6. Camara, R.B.G.; Costa, L.S.; Fidelis, G.P.; Nobre, L.T.D.B.; Dantas-Santos, N.; Cordeiro, S.L.; Costa, M.S.S.P.; Alves, L.G.; Rocha, H.A.O. Heterofucans from the brown seaweed Canistrocarpus cervicornis with anticoagulant and antioxidant activities. Mar. Drugs, 2011, 9, 124–138.
7. Michel, G.; Tonon, T.; Scornet, D.; Cock, J.M.; Kloareg, B. The cell wall polysaccharide metabolism of the brown alga Ectocarpus siliculosus. Insights into the evolution of extracellular matrix polysaccharides in Eukaryotes. New Phytol. 2010, 188, 82–97.
8. Structural and Biological Insights into Antitumor Seaweed Sulfated Polysaccharides. Rocha HAO, Costa, LS, Leite EL. IN Seaweed: Ecology, Nutrient Composition and Medicinal Uses Editor Victor Hugo Pomim, Ed. Nova Publisher (LIVRO)
51
10. Vieira, L.A.P.; Freitas, A.L.P.; Feitosa, J.P.A.; Silva, D.C.; Viana, G.S.B. The alga Bryothamnion seaforthii contains carbohydrates with antinociceptive activity. Rev Bras Pesqui Med Biol, 2004, v. 37, n. 7, p. 1071-1079.
11. Heidari, M.R.; Azad, E.M.; Mehrabani, M. Evaluation of the analgesic effect of Echium amoenum Fisch & C.A. Mey. extract in mice: Possible mechanism involved. J Ethnopharmacol, 2006, v. 103, n. 3, p. 345-349. 12. Assreuy, A.M.S.; Gomes, D.M.; Silva, M.S.J.; Torres, V.M.; Siqueira,
R.C.L.; Piresade, F.; Criddle, D.N.; DE Alencar, N.M.N.; Cavada, B.S.; Sampaio, A.H.; Farias, W.R.L. Biological Effects of a Sulfated-Polysaccharide Isolated from the Marine Red Algae Champia feldmannii. Biol Pharm Bull, 2008, v. 31, n. 4, p. 691-695.
13. Araujo, I.W.F.; Vanderlei, E.S.O.; Rodrigues, J.A.G.; Coura, C.O.; Quinderé, A.L.G.; Fontes, B.P.; Queiroz, I.N.L.; Jorge, R.J.B.; Bezerra, M.M.; Silva, A.A. R.; Chaves, H.V.; Monteiro, H.S.A.; Paula, R.C.M.; Benevides, N.M.B. Effects of a sulfated polysaccharide isolated from the red seaweed Solieria filiformis on models of nociception and inflammation. Carbohydr Polym, 2011, v. 86, n. 3, p. 1207-1215.
14. Quinderé, A.L.; Fontes, B.P.; Vanderlei, E. de S.; de Queiroz, I.N.; Rodrigues, J.A.; de Araújo, I.W.; Jorge, R.J.; de Menezes, D.B.; e Silva, A.A.; Chaves, H.V.; Evangelista, J.S.; Bezerra, M.M.; Benevides, N.M. Peripheral antinociception and anti-edematogenic effect of a sulfated polysaccharide from Acanthophora muscoides. Pharmacol Rep. 2013; 65(3), 600-13.