DOUTORADO EM ENGENHARIA DE MATERIAIS
ÁREA DE CONCENTRAÇÃO: MATERIAIS METÁLICOS
LINHA DE PESQUISA: PROCESSAMENTO
ANÁLISE EXPERIMENTAL DE DANOS EM PISTÕES DE
MOTOR À GASOLINA OPERANDO COM ADIÇÃO DE
GÁS HIDRÓXI
Doutorando: Robson Guimarães Sanabio
Orientador: Prof. Dr. Rubens Maribondo do Nascimento
ENGENHARIA DE MATERIAIS
ANÁLISE EXPERIMENTAL DE DANOS EM PISTÕES DE
MOTOR À GASOLINA OPERANDO COM ADIÇÃO DE
GÁS HIDRÓXI
ROBSON GUIMARÃES SANABIO
Tese apresentada como quesito obrigatório para a obtenção do título de Doutor em Ciências e Engenharia de Materiais, no Programa de Pós-Graduação Em Ciências e Engenharia de Materiais (PPGCEM) da UFRN.
Prof. Dr. Rubens Maribondo do Nascimento
–
Orientador
Catalogação da Publicação na Fonte. UFRN / SISBI / Biblioteca Setorial Centro de Ciências Exatas e da Terra – CCET.
Sanabio, Robson Guimarães.
Análise experimental de danos em pistões de motor à gasolina operando com adição de gás hidróxi / Robson Guimarães Sanabio. - Natal, 2015.
159 f.: il.
Orientador: Prof. Dr. Rubens Maribondo do Nascimento.
Tese (Doutorado) – Universidade Federal do Rio Grande do Norte. Centro de Ciências Exatas e da Terra. Programa de Pós-Graduação de Ciências e Engenharia de Materiais.
1. Hidrogênio combustível – Tese. 2. Corrosão – Tese. 3. Energia alternativa – Tese. I. Nascimento, Rubens Maribondo do. II. Título.
DEDICATÓRIA
À memória do meu pai, Joaquim José Sanabio, que do alto do seu semi-analfabetismo, aos 92 anos, pôs a mão no meu ombro e me lembrou da
AGRADECIMENTOS
Ao Professor Wanderson Santana da Silva por ter sido o primeiro do PPGCEM/UFRN a conhecer o meu projeto de trabalho e ter se prontificado a me ajudar no que fosse preciso.
Ao Professor Rubens Maribondo do Nascimento por ter me recebido como orientando e me passado toda a sua experiência e posto à minha disposição toda infraestrutura necessária à conclusão deste trabalho.
Ao Doutor Adelci Menezes de Oliveira pelo apoio logístico e fornecimento de equipamentos utilizados na banca de testes.
Ao Professor Uilame Umbelino por ter disponibilizado toda estrutura física do seu laboratório para a sequência deste trabalho.
Ao Professor Francisco de Assis Oliveira Fontes por abrir seu laboratório para que eu pudesse montar o sistema de observação e pelas várias informações valiosas que me repassou.
À minha esposa Rosiane Lima Soares por ter dado todo seu apoio à minha busca pela realização deste sonho.
Ao Grande Mestre Prof. Wilson Ribeiro de Barros, que tantos truques e habilidades me ensinou, pela ajuda moral e financeira nos momentos mais difíceis da minha vida e pelas ferramentas que deixou em meu poder e que foram utilizadas para a realização de diversas atividades pertinentes a esta tese.
Ao meu amigo Valter Bezerra Dantas por ter me acompanhado por várias vezes entrando pela madrugada na sala de estudos e me ajudando a carregar o material pesado de um lado ao outro dentro da Universidade.
Aos colegas de turma por toda a acolhida e carinho com que me trataram ao longo deste curso.
Aos técnicos dos laboratórios Vavá, Murillo e Zezinho por toda ajuda que me deram em todas as oportunidades em que nessecitei.
RESUMO
A adição de hidrogênio gasoso como fonte alternativa de combustível vem sendo largamente utilizada. Hoje em dia, várias experiências estão em andamento para a utilização de geradores de hidrogênio (eletrolisadores) por demanda em veículos automotores. Em todos os anúncios desses produtos seus fabricantes afirmam que este procedimento fornece uma redução de consumo de combustível, reduz os níveis de emissão de gases tóxicos pela descarga e melhora a vida útil do motor. A presente pesquisa faz uma análise da estrutura física de peças de motores que utilizam eletrolisadores por demanda. Para isto, foi montado um sistema estacionário com um motogerador de energia elétrica, monocilíndrico, e adaptados dois eletrolisadores um de célula seca e outro de célula molhada. Nas etapas de observação, foram feitas análises de consumo em quatro faixas de carga de trabalhos e observado o pistão do motor, que foi cortado e analisado por microscopia ótica (MO), Microscopia Eletrônica de Varredura e de Energia Dispersiva (MEV-EDS), Microscopia Confocal e Difração de Raios - X (DRX), no sistema estacionário, em cada etapa. Os resultados mostraram uma redução considerável no consumo de combustível e uma corrosão acentuada no pistão original de fábrica, feito de liga alumínio-silício. Como barreira à corrosão foi feita uma nitretação por plasma na cabeça do pistão, que se mostrou resistente ao ataque pelo hidrogênio, embora tenha apresentado evidências de também ter sido atacada. Concluiu-se que os eletrolisadores automotivos podem ser uma boa opção em termos de consumo e redução de emissões de gases tóxicos, porém o material das câmaras de combustão dos veículos devem ser preparados para este fim.
ABSTRACT
The addition of hydrogen gas as an alternative fuel source has been widely used, as well reported in scientific literature. Today, several experiments are underway for the use of hydrogen generators (electrolysers) demand for motor vehicles. In all these products their ads manufacturers claim that this provides a reduction of fuel consumption, reduces the emission levels of toxic gas by the discharge and improves engine life. This research analyzes the physical structure of engine components using electrolysis on demand. To this end, a stationary system was fitted with a power generator of electricity, drum roller and adapted two electrolyzers: a dry cell and wet cell other. In steps observation were consumption analyzes in four work load ranges and observing the piston engine, which has been cut and analyzed by Optical Microscopy (OM), Scanning Electron Microscopy and Dispersive Energy (SEM-EDS), X – Ray Diffraction (XRD) and Confocal Microscopy, the stationary system in each step. The results showed a considerable reduction in fuel consumption and a high corrosion in the original factory piston constituted of aluminum-silicon alloy. As corrosion barrier was made a plasma nitriding in the piston head, which proved resistant to attack by hydrogen, although it has presented evidence also, of having been attacked. It is concluded that the automotive electrolysers can be a good choice in terms of consumption and reducing toxic gas emissions, but the material of the combustion chambers of vehicles must be prepared for this purpose.
SUMÁRIO
DEDICATÓRIA ... i
AGRADECIMENTOS ... ii
RESUMO ... iii
ABSTRACT ... iv
SUMÁRIO ... v
LISTA DE FIGURAS ... viii
LISTA DE TABELAS ... xii
LISTA DE EQUAÇÕES ... xiv
LISTA DE SÍMBOLOS ... xvi
LISTA DE ABREVIATURAS ... xviii
1 – INTRODUÇÃO ... 1
2 – OBJETIVOS ... 6
3 - REVISÃO TEÓRICA ... 7
3.1 – O Hidrogênio e suas generalidades ... 7
3.2 – Propriedades básicas do hidrogênio ... 7
3.3 – Um combustível diferenciado: necessidades e cuidados ... 8
3. 4 – O Hidrogênio como combustível: obtenção ... 11
3.4.1 – A Eletrólise ... 12
3.4.1.1 - Qualidade do eletrólito ... 15
3.4.1.2 – Temperatura ... 16
3.4.1.3 – Pressão ... 19
3.4.1.4 - Resistência elétrica do eletrólito ... 20
3.4.1.4.1 - Espaçamento entre eletrodos ... 21
3.4.1.4.2- Tamanho e alinhamento dos eletrodos ... 22
3.4.1.4.3 – Velocidade de subida das bolhas ... 22
3.4.1.5 - Material do eletrodo ... 25
3.4.1.6 - Material separador ... 26
3.4.1.7 - Formato de onda da tensão aplicada ... 27
3.4.2 – Propriedades do hidrogênio combustível ... 30
3.4.2.1 - Ampla inflamabilidade ... 31
3.4.2.3 - Distância de extinção pequena ... 32
3.4.2.4 - Alta temperatura de autoignição ... 32
3.4.2.5 - Alta velocidade de chama e chama adiabática ... 33
3.4.2.6 - Alta difusividade ... 34
3.4.2.7 - Muito baixa densidade ... 35
3.4.3 - A razão ar / combustível (A/F): estequiometria da combustão .. 36
3.5 – Eletrolisadores portáteis automotivos ... 38
3.5.1 Células molhadas ... 39
3.5.2 – Células secas ... 40
3.6 – O hidrogênio como combustível adicional ... 42
3.6.1 – Adicionado ao gás natural veicular (GNV) ... 43
3.6.2 – Adicionado à gasolina ... 44
3.6.3 – Adicionado ao diesel ... 46
3.7 – O poder corrosivo do hidrogênio ... 47
3.7.1 - Solubilidade do hidrogênio ... 50
3.7.2 - Difusividade do hidrogênio ... 50
3.7.3 - Permeabilidade do hidrogênio ... 51
3.7.4 - Difusividade do hidrogênio em função a microestrutura do material ... 52
3.7.5 - O hidrogênio e as interações com microestruturas ... 54
3.7.6 - Teorias de fragilização por hidrogênio ... 59
3.7.6.1 - Teoria da pressão ... 60
3.7.6.2 - Teoria da formação de hidretos ... 61
3.7.6.3 - Teoria da energia superficial ... 62
3.7.6.4 - Teoria da decoesão ... 63
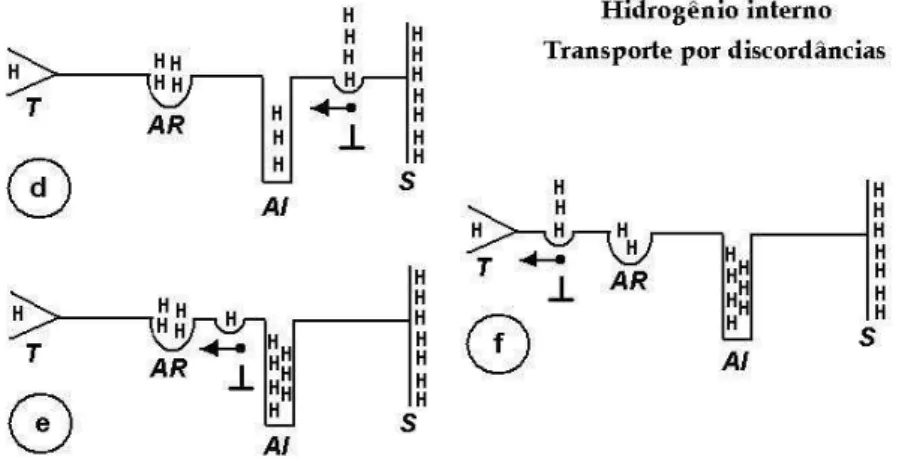
3.7.6.5 - Modelos de interação do hidrogênio com as discordâncias .. 64
3.8 - A fragilização por hidrogênio em termos gerais ... 65
3.9 – Tratamentos anticorrosivos em ligas de alumínio ... 66
3.9.1 – O tratamento das ligas de alumínio por nitretação ... 68
3.9.2 - Propriedades físicas e microestruturais do nitreto de alumínio 69
3.9.3 – A formação de ALN por deposição e por implantação ... 71
3.10 – A deposição de filmes finos por Magnetron Sputtering ... 74
4 – MATERIAIS E MÉTODOS ... 84
4.1 – Amostragem ... 87
4.2 – Coleta de dados ... 88
4.3– Caracterização ... 102
5 – RESULTADOS E DISCUSSÃO ... 103
5.1- Caracterizações do pistão ... 103
5.2 – Acionamento do gerador de energia elétrica ... 104
5.3 – Acionamento do gerador de energia elétrica com a utilização de um gerador de hidróxi ... 107
5.4 – Ensaios de 500h sem a adição de hidróxi ... 110
5.5 - Ensaios de 500h com a adição de hidróxi ... 110
5.5 – Ensaios utilizando pistão com superfície endurecida e adição de 1,5L de hidróxi ... 111
5.6 – Ensaios utilizando pistão novo original de fábrica por 1000h com adição de 1,5l de hidróxi ... 114
5.7 – Ensaios utilizando pistão com superfície endurecida por 1000h com adição de 1,5l de hidróxi ... 115
5.8 – Remontagem do sistema para os ensaios finais ... 117
5.9 – Reflexões acerca da vida útil do motor em atmosfera rica em hidróxi ... 120
5.10 – Emissões de gases de descarga ... 122
5.11 – Rendimento dos Eletrolisadores ... 123
6 – CONCLUSÕES ... 124
7 – SUGESTÕES PARA OUTRAS PESQUISAS 126
Lista de Figuras
Figura 1– Esquema da Eletrólise (hidrólise) ... 12
Figura 2 - Componente de voltagens entre eletrodos [12] ... 13
Figura 3: Formação de fração de vazio em um eletrólito ... 23
Figura 4. (a) Corrente direta pulsada. (b) Corrente direta constante ... 27
Figura 5– Formato de onda de pulso ultra-curto ... 28
Figura 6 –Mínima energia de ignição do hidrogênio no ar [66] ... 32
Figura 7 - Temperatura adiabática de chama para misturas hidrogênio-ar ... 34
Figura 8 – Velocidade laminar de chama para (—) misturas de hidrogênio, oiygênio e nitrogênio e (◦, - -) para misturas de gasolina e ar [68] ... 34
Figura 9 - Câmara de combustão volumétrica e comparação de energia para motores alimentados a gasolina e a hidrogênio [69] ... 37
Figura 10– Arranjo das placas do eletrolisador de célula molhada [71] ... 40
Figura 11– Eletrolisador de célula molhada idealisado por Kelly (2008) ... 40
Figura 12– Eletrolisador de célula seca idealisado por William Rhodes ... 41
Figura 13 – Eletrolisador célula seca patenteado por William Rhodes Montado ... 42
Figura 14 - Poder Calorífico de várias misturas de combustíveis [72] ... 42
Figura 15–Emissões de CO2 [73] ………..……... 46 Figura 16 - Emissões de NOx [73] ... 46
Figura 17 – Efeito da condição de tratamento da liga de paládio na difusividade aparente de hidrogênio. Adaptado de [86] ... 53
Figura 18 - Representação esquemática da energia potencial para um átomo de hidrogênio na rede cristalina ... 55
Figura 20 - Classificação das frentes de estudo de teorias de
fragilização por hidrogênio [93] ... 59
Figura 21 - Representação esquemática da concentração de
hidrogênio à frente da trinca e propagação da mesma [92] ... 65
Figura 22 - Estrutura do AlN com parâmetros de rede a ≈ 0,311 nm
e c ≈ 0,498 nm [123] ... 70
Figura 23– Diagrama de fase binário do Al-N [124] ... 71
Figura 24 - Densidade de probabilidade para N2 a 298 e 573 K; e H2
a 298 K (Adpatado de Material Processing Handbook [150] ... 75
Figura 25– Processo de sputtering típico (Adpatado de Material
Processing Handbook [150] ... 77
Figura 26 - Descargas em um processo de sputtering típico
(Adpatado de Material Processing Handbook [150] ... 78
Figura 27 - Spputering Yield (rendimento) para vários materiais em
função da energia do íon ... 79
Figura 28 - Descargas em um processo de sputtering rf típico ... 80
Figura 29- Magnetron sputtering mostrando os elétrons confinados
próximos a superfície do alvo pelo campo magnético dos ímãs ... 80
Figura 30 - Plasma de argônio, confinado próximo ao alvo pelo magnetron.. 81
Figura 31 - Alvo de AlN depois de utilizado para deposição em um
magnetron sputtering ... 81
Figura 32– Peças da matriz do eletrolisador ... 85
Figura 33 –(a) Eletrolisador montado, (b) detalhe do arranjo das
placas - Célula Molhada ... 86
Figura 34 - Eletrolisador, Célula Seca construído em nosso
laboratório, baseado no modelo de William Rhodes ... 87
Figura 35– Pistão fundido em liga de alumínio-silício ... 89
Figura 36– Matriz do eletrolisador de célula molhada [71] ... 90
isoladas (a), Visão em perspectiva da matriz presa à tampa (b) ... 91
Figura 38 –Fluxo de corrente através do eletrólito (a), distribuição da voltagem nas células eletrolíticas (b) [71] ... 91
Figura 39 – Efeito voltaico do fluxo de corrente [71] ... 92
Figura 40 - Visão esquemática do conjunto Eletrolisador + Borbulhador ... 93
Figura 41 – Fonte de alimentação dos eletrolisadores ... 93
Figura 42 –Quadro de carga 1 ... 95
Figura 43– Balança de precisão ... 95
Figura 44 –Processo de nitretação por plasma (a), pistão nitretado (b) ... 99
Figura 45– Microdurômetro do Laboratório de Tribologia da UFRN ... 100
Figura 46 – Trabalho conjunto das células seca e molhada ... 100
Figura 47 - Detalhes da topografia da superfície da cabeça do pistão. Área rugosa(a) e área central (b) ... 104
Figura 48 - Consumo de gasolina pura por carga aplicada ... 105
Figura 49– Crostas carbonizadas na cabeça do pistão (100h gasolina comum pura) ... 106
Figura 50 –Pistão após 100h usando gasolina comum pura ... 106
Figura 51 –Consumo de gasolina comum adicionada de 1,5L de hidróxi por minuto ... 108
Figura 52 –Gráfico do consumo de gasolina comum, sem e com adição de hidróxi ... 108
Figura 53 – Crostas carbonizadas na cabeça do pistão (100h gasolina comum adicionada de 1,5l de hidróx por minuto) ... 109
Figura 54 – Detalhe da cabeça do pistão após 500h com gasolina comum adicionada de hidróx (1,5l/h) ... 110
por minuto (b) ... 110
Figura 56 – Trilha de indentações no ensaio de Dureza Vickers ... 112
Figura 57 – MEV: Filme fino de ALN aderido na cabeça do pistão ... 113
Figura 58– Pequenas formações de crostras carbonizadas no pistão tratado, após 500h de trabalho... 114
Figura 59 –Áreas degradadas após 1000h com adição de hidróxi ... 114
Figura 60 - MEV secção transversal e topo do pistão tratado ... 115
Figura 61– MEV, indícios de trinca no filme AlN ... 116
Figura 62– MEV, trinca bem estabelecida no filme fino AlN ... 116
Figura 63 - Pequenas formações de crostras carbonizadas no segundo pistão tratado, após 1000h de trabalho ... 117
Figura 64 – Consumo de gasolina aditivada com adição de hidróx (1,5L por min.) ... 118
Figura 65– Consumo de gasolina aditivada, sem adição de hidróxi ... 119
Figura 66 - Comportamento da gasolina aditivada (sem e com hidróxi) ... 120
Figura 67– Pistão novo em condições de fábrica (a) e região central do pistão fortemente atacada após 500h de trabalho na presença de gás hidróxi ... 121
Lista de tabelas
Tabela 1 –Propriedades do hidrogênio [2] ………... 8
Tabela 2– Características de Inflamabilidade e Ignição [4] ... 9
Tabela 3– Temperaturas de Auto-ignição [4] ... 10
Tabela 4– Características de Explosão [4] ... 10
Tabela 5– Propriedades Relevantes para os cuidados de segurança a ter com o hidrogénio e outros gases comumente utilizados [6] ... 11
Tabela 6 – Comparação do hidrogênio com outros combustíveis [67] ... 35
Tabela 7 - Composição dos Combustíveis Examinados [4] ... 44
Tabela 8 - Valor mais aixo de aquecimento, valor estequiométrico da Relação ar combustível e Temperatura adiabática da chama para os gases examinados [4] ... 44
Tabela 9– Consumos médios para diversos tipos de combustível [75] ... 47
Tabela 10 - Energia de ligação do hidrogênio com diferentes armadilhas que podem estar presentes em ligas metálicas [77] ... 56
Tabela 11 - Classificação e usos de ligas de alumínio. [112] ... 67
Tabela 12 - Características do gerador de energia elétrica ... 84
Tabela 13 - Características do eletrolisador: Célula molhada (wet Cell) .. 85
Tabela 14 - Características do eletrolisador: Célula seca (dry Cell) ... 86
Tabela 15 –Resumo da coleta de dados ... 88
Tabela 16 – Distribuição das cargas de acordo com os períodos de funcionamento ... 94
Tabela 17 –Parâmetros de nitretação das amostras ... 99
Tabela 18 – Componentes da liga dos pistões ... 103
Tabela 19 - Consumo por carga de trabalho (gasolina comum, sem adição de hidróxi) ... 104
Tabela 20 - Emissões de gases – Gasolina comum, sem hidróxi ... 105
Tabela 21 –Consumo de gasolina por carga de trabalho (gasolina comum + hidróxi) ... 108
Tabela 23– Parâmetros de tratamento dos pistões ... 112
Tabela 24 –Condições de nitretação x dureza Vickers atingida ... 112
Tabela 25– Composição do filme de ALN aderido à cabeça do pistão .... 113
Tabela 26– Consumo por carga de trabalho (gasolina aditivada
Adicionada de 1,5L de hidróxi por minuto) ... 118
Tabela 27– Consumo por carga de trabalho (gasolina aditivada sem
adição de hidróxi) ... 119
Lista de equações
Equação (1) - Produção de hidrogênio por eletrólise ... 14
Equação (2) – Formação de hidrogênio no catodo ... 14
Equação (3) – Formação de oxigênio no anodo ... 14
Equação (4) – Volume de hidrogênio produzido na eletrólise ... 15
Equação (5) – Cálculo da pressão ambiente da eletrólise ... 15
Equação (6) – Carga aplicada durante a eletrólise em cada par ... 15
Equação (7) – Resistência do eletrólito ... 20
Equação (8) – Aumento da resistência pela presença de bolhas ... 23
Equação (9) – Aumento da temperatura em função da compressão ... 32
Equação (10) – Massa do ar na combustão com hidrogênio ... 36
Equação (11) - Percentagem da câmara de combustão ocupada pelo hidrogênio por uma mistura estequiométrica ... 37
Equação (12) – Razão A/F: mistura pobre ... 38
Equação (13) – Razão A/F: mistura rica ... 38
Equação (14) – Átomos de hidrogênio dissolvidos no metal ... 50
Equação (15) – Hidrogênio dissolvido na rede metálica em equilíbrio com o hidrogênio gasoso ... 50
Equação (16) – Solubilidade do hidrogênio ... 50
Equação (17) – Primeira Lei de Fick ... 50
Equação (18) – Difusividade do hidrogênio (tipo de Arrhenius) ... 51
Equação (19) – Segunda lei de Fick ... 51
Equação (20) – Permeabilidade do hidrogênio ... 51
Equação (21) – Fluxo da difusão ... 51
Equação (22) – Permeabilidade do hidrogênio (tipo Arrhenius) ... 52
Equação (23) – Solubilidade em função da permeabilidade e difusividade . 52 Equação (24) – Distribuição de velocidades para um gás monoatômico ... 74
Equação (25) – Velocidade média para um gás monoatômico ... 75
Equação (26) – Velocidade quadrática para um gás monoatômico ... 75
pressão de da temperatura ... 76 Equação (29) – quantidade de moléculas que atingem os substratos por
Lista de símbolos
A – Ampéres
A/F – Razão ar-combustível
C – Coulombs
cL – Concentração de gás dissolvido
D – Coeficciente de difusão
DK – Permeabilidade
F(v) - Distribuição de velocidades para um gás monoatômico
H2 – Hidrogênio molecular H2O – Molécula de água
J – Fluxo de átomos transportados
K – Solubilidade
kB - Constante de Boltzman L– Litro
li – Distância entre eletrodos
n – Número de massa
N2– Molécula de nitrogênio O2– Dióxido
P0– Pressão Inicial P1– Pressão finall Q – Carga aplicada R – Resistência elétrica
S – Eficiência em arrancar átomos do alvo
t – Tempo
T1 – Temperatura final absoluta
v - Velocidade média
2
v - Velocidade média quadrática
V0– Volume inicial V1– Volume final
ρ - Resistividade do material
- Relação dos calores específicos
– Proporção estequiométrica de A/F
Lista de abreviaturas
BMI.BF4 -1butil, trimetilimidazólio, tetrafluoroborato
CNTP – Condições normais de temperatura e pressão
CVD – Deposição química por vapor
DRX – Difração de raios X
EDS – Detecção de energia dispersiva
EPA combinado ciclo de direção cidade / estrada
FHP - Fragilização por hidrogênio
GLP – Gás liquefeito de petróleo
GNV – Gás natural Veicular
HD – Dureza Vickers
HHV – Maior calor de combustão
HTGR – Higth Temperature of Gas Reactor – Reator de alta temperatura de gás
HTSE – Higth Temperature of Steam Eficience – Temperatura de eficiência de alto vapor
KOH – Hidróxido de potássio
LHV – Menor calor de combustão
MBE – Feixe molecular epitaxial
MEV – Microscopia eletrônica de varredura
MO – Microscopia ótica
MPGGE - Milhas por galão equivalente de gasolina
NG – Gás natural
NOx – Óxido de nitrogênio PG – Gás produtor
RNG – Gás natural reformado
Sccm – Centímetro cúbico padrão
fósseis. Estes são utilizados na maioria das indústrias e no setor dos transportes.
Os combustíveis fósseis são um bem escasso, na posse de apenas alguns países, o que consequentemente provoca uma escalada mundial dos seus preços. Estes combustíveis, além dos seus preços elevados, têm outro aspecto contra, os elevados níveis de poluição derivados da sua utilização [1].
De acordo com este panorama, tem-se procurado uma forma alternativa e competitiva de produzir energia que possa vir a substituir esses combustíveis, tais como o biogás, o gás natural, o óleo vegetal, ésteres de álcoois e também combustíveis hidrogenados.
Para que o mercado dos combustíveis deixe de ser dominado pelos combustíveis fósseis há que se continuar a aplicar esforços para o desenvolvimento de outras tecnologias que superem as atuais fontes de energia, que além do fator econômico também sofrem pressões ambientais, que exigem formas de energia mais limpas, para evitar a mesma emissão de gases para a atmosfera que os atuais combustíveis fósseis [1], [2].
Esta não é, exatamente, uma preocupação dos dias atuais, visto que há algumas décadas já se estudava uma alternativa de maior oferta de combustíveis e menores emissões de gases tóxicos na atmosfera, como afirmava Nicanor Maia [1].
“Os resultados de tais estudos, se positivos, poderão representar uma solução para a redução dos índices de poluição atmosférica nas grandes cidades e centros industriais, enquanto que a perspectiva de um substituto para o petróleo como combustível reveste-se de uma importância incomensurável para todo o sistema político-econômico mundial.” (p.08)
É um elemento não tóxico, que ocorre naturalmente na atmosfera e quando é queimado com o oxigênio só água pura é produzida como resíduo [12].
Ao longo da história dos últimos dois séculos a utilização do hidrogênio vem sendo estudada e aplicada para fins de produção de combustível e atualmente já se tem vários veículos circulando com este como combustível, agregado ou não a outros combustíveis [13].
Porém, sabe-se que o hidrogênio é um agente que, combinado a certas condições ambientais, pode acelerar o processo de deteriorização de alguns materiais, sobretudo nos metais. Logo, aqui se lança luzes à possibilidade de adicionar o hidrogênio gasoso a outros combustíveis, para que estes em conjunto trabalhem em câmaras metálicas, em alta pressão e alta temperatura, o que seria uma condição favorável ao “ataque” do hidrogênio, visto que sua permeabilidade, solubilidade e difusividade é bastante alta, principalmente com essas condições ambientais.
As respostas a estas questões formam a base de sustentação desta pesquisa. O que se busca aqui são estas respostas. Com elas poder-se-á saber se a adaptação de um gerador de gás hidróxi é realmente viável para um motor de combustão interna e quais as condições que devem ser atendidas para proceder esta adaptação.
A hipótese aqui assumidaé que como as peças em funcionamento hoje nos motores não foram projetadas para a adição de hidrogênio gasoso ao combustível, sua vida útil seria seriamente comprometida caso passassem a ser utilizadas na presença de hidrogênio gasoso em alta pressão e temperatura, devido à alta permeabilidade, difusividade e solubilidade do hidrogênio em metais e ligas. Assim, esta pesquisa trata de um tema atual, com alta relevância para a ciência e para a humanidade em geral e que poderá servir de referência para estudos e aplicações posteriores visando melhorias em termos sociais, ambientais e econômicos.
No desenvolvimento deste estudo apresenta-se no capítulo 3 uma revisão sobre o hidrogênio suas generalidades e propriedades básicas. Suas possibilidades de uso como combustível, seus processos de obtenção, com destaque para a eletrólise pelo fato de ser a forma de obtenção utilizada nesta pesquisa. Passando, em seguida, ao estudo de eletrolisadores automotivos e suas aplicações para automóveis com alguns tipos de combustível.
Como trata da degradação microestrutural, também estuda-se o poder corrosivo do hidrogênio passando por sua permeabilidade, solubilidade e difusividade chegando até a fragilização pelo hidrogênio. Daí seguiu-se para os tratamentos anticorrosivos para superfícies metálicas dando uma atenção especial à deposição de filmes finos por Magnetron Sputtering e testes de dureza Vickers. Ambos usados neste estudo.
para as observações dos desgastes. Ainda neste capítulo descreve-se a montagem de dois eletrolisadores um de célula seca, outro de célula molhada, que foram confeccionados para o desenvolvimento dos testes.
Os testes iniciaram com a caracterização do material do pistão, através de análises MEV-EDS, uma vez que não foi cedida esta informação pelo fabricante. Em seguida foram feitos testes de consumo sem utilização de hidróxi, para que fosse registrado o consumo do motor do gerador em determinadas faixas de carga (0W, 500W, 1000W e 2000W), que seria utilizado posteriormente, em comparações com os testes onde seriam adicionadas porções de hidróxi.
Seguindo a metodologia adotada, foram feitos testes de funcionamento do motor em seções de cargas horárias de trabalho de 100h, 500h e 1000h, com e sem adição de hidróxi, sendo que a cada etapa de testes o motor foi desmontado e o pistão cortado para as análises microscópicas que deram as informações parciais para que se pudesse avaliar as condições do material dos pistões que íam saindo dos testes. Estes testes, MEV, MO, DRX e EDS indicaram que o pistão precisaria de um tratamento para não sofrer a ação do hidrogênio. Assim foram feitos tratamentos de nitretação, por aplicação de filmes finos de AlN, para observar se estes ofereceriam uma barreira à ação do hidrogênio, devidamente acompanhado de microscopia ótica e eletrônica, além de ensaios de Dureza Vickers (HV). Terminada esta fase de coleta de dados seguiu-se adiante com as análises dos resultados.
servir como barreira contra a ação corrosiva do hidrogênio na cabeça do pistão.
No Capítulo 6 são apresentadas as conclusões tomadas a partir dos resultados desta pesquisa. Pode-se concluir que o uso de gás hidróxi propicia uma economia considerável de combustível e que a adição deste gás ao combustível evita em grande parte a formação de crostas carbonizadas na câmara de combustão. Além disso, concluiu-se que no caso de pistões fabricados com liga de alumínio-silício, a adição de hidróxi poderá forçar o surgimento de pontos de corrosão pelo hidrogênio e que isso pode levar à diminuição da vida útil dos componentes do motor.
Também está inserido na conclusão que o tratamento de endurecimento da superfície da cabeça do pistão, com uma nitretação por plasma serviu como barreira à corrosão provocada pela atmosfera pesquisada e que com a adição de gás hidróxi os níveis de emissões de gases tóxicos pela descarga de motores à gasolina fica significativamente reduzido. Por fim, fechou-se a conclusão com a observação de que o eletrolisador de célula seca teve um melhor desempenho que o de célula molhada, por conta do excesso de acúmulo de temperatura deste último.
No Capítulo 7 discorreu-se sobre a possibilidade de novos estudos e pesquisas que podem ser desenvolvidos a partir deste trabalho. Tanto na área da mecânica, com pesquisas acerca da melhoria da produção de hidróxi por demanda em veículos automotores, por exemplo, como na área de energias renováveis e até mesmo na área de corrosão em outros materiais que ainda são encontrados como componentes de peças automotivas que estão ligadas à câmara de combustão de motores a explosão.
2 - OBJETIVOS
Geral
Investigar os efeitos provocados na estrutura metálica dos componentes pela presença de hidrogênio gasoso injetado na câmara de combustão de motores, para queima conjunta com a gasolina.
Específicos
- Estudar a capacidade de redução do consumo de combustível em motores com a injeção de gás hidróxi na mistura ar-combustível;
- Avaliar a possibilidade de utilizar o gás hidróxi como combustível auxiliar em motores à gasolina;
- Comparar o consumo de combustível do motor com e sem a adição de gás hidróxi;
- Analisar os efeitos corrosivos do hidrogênio na liga metálica de pistões que trabalharam em contato com este gás em alta pressão e alta temperatura;
3 - Revisão Teórica
3.1 – O Hidrogênio e suas generalidades
Em 1766, Henry Cavendish descobriu o átomo de hidrogênio, em uma experiência de decomposição da água. Porém, este nome como o conhecemos hoje, lhe foi dado por Lavoisier.
O hidrogênio é o mais simples e abundante elemento do Universo. Existe em milhões de substâncias, em aproximadamente 76% da massa do Universo e 93% de suas moléculas, como a água (H2O) e as proteínas nos seres vivos. Existe em grande quantidade nas estrelas no estado de plasma. No planeta Terra, representa aproximadamente 70% da superfície terrestre. Como o hidrogênio não aparece naturalmente na terra, e a sua concentração na atmosfera é muito reduzida de 1ppm, e por se encontrar combinado com outros elementos, não pode ser considerado como um recurso de energia primária, tal como o petróleo ou o gás natural, mas sim como um vetor de energia.
3.2 – Propriedades básicas do hidrogênio
À temperatura e pressão normais - 0ºC e 1atm - o hidrogênio apresenta-se como um gás extremamente inflamável, inodoro, insípido, incolor, insolúvel em água e muito mais leve que o ar. Para se apresentar no estado líquido, tem de estar armazenado numa temperatura de –253ºC, em sistemas de armazenamento conhecidos como sistemas criogênicos. Acima desta temperatura, o hidrogênio pode ser armazenado em forma de gás comprimido em cilindros de alta pressão.
combustível de baixo peso molecular, ocupa um espaço equivalente a 1/700 do que ocuparia no estado gasoso. A sua massa volumétrica é de 0,08967 kg/m3, ou seja, o ar é 14,4 vezes mais denso –ρ ar = 1,2928 Kg/m3. A temperatura de mudança de fase de líquido para gás é de -252,88ºC e de fusão -259,20ºC. Quando submetido a uma pressão muito baixa, o hidrogênio tende a existir na forma de átomos individuais, no entanto quando submetidas à alta pressão, as moléculas mudam a sua natureza e o hidrogênio torna-se um líquido metálico.
Tabela 1 –Propriedades do hidrogênio [2]
Propriedades Diesel Gasolina sem chumbo Hidrogênio
Fórmula CnH1, 8n
C8-C20
CnH1, 87n
C4-C12
-
H2
Temperatura de Autoignição (K) 530 533-733 858
Energia mínima de ignição (mJ) - 0,24 0,02
Limite de flamabilidade (% vol. no ar). 0,7-5 1,4-7,6 4-75
Razão ar combustível esteq. Em massa 14,5 14,6 34,3
Limite de flamab. (razão de equivalência) - 0,7-3,8 0,1-7,1
Densidade a 16ºC e 1,01 bar (Kg/m3) 833-881 721-785 0,0838
Densidade de energia (MJ/Kg) 42,5 43,9 119,93
Velocidade de chama (cm/s) 30 37-43 265-325
Faixa de extinção no ar em CNTP (cm) - 0,2 0,064
Difusividade no ar (cm2/s) - 0,08 0,63
Número de octanas 92-98 130
Número de cetanos 44-55 13-17 -
3.3 – Um combustível diferenciado: necessidades e cuidados
o butano, o propano ou até mesmo a gasolina – 34 a 43%. Esta característica torna o hidrogênio menos perigoso em caso de acidente porque a radiação transmitida é menor, no entanto pode não ser possível perceber a sua existência facilmente. A chama do hidrogênio é muito quente, sendo a sua densidade energética de 38 KWh/kg contra a densidade da gasolina que é de apenas 14 KWh/Kg. A energia necessária para a ignição de uma mistura hidrogênio – ar é de apenas 0,04 mJ, contra os 0,25 mJ dos hidrocarbonetos.
O hidrogênio é extremamente inflamável no ar, entre 4% e 75% por volume de ar. A energia necessária para inflamá-lo é muito pequena e, em algumas condições, pode ocorrer autoignição [3]. O hidrogênio pode se difundir rapidamente através de materiais e sistemas que estejam presentes no ar ou em outros gases comuns devido à sua baixa densidade. Em alguns materiais, a difusão é mais pronunciada com temperaturas elevadas. Este também é mais volátil que a gasolina, GNV, propano (C3H8) e metano (CH4), assim como tende a dispersar-se mais rapidamente.
A única exceção é para libertações criogênicas, onde o vapor muito frio que inicialmente se forma, pode ser mais denso que o ar circundante. [4]. Nas tabelas 2, 3 e 4 apresentam-se os índices de inflamabilidade e temperatura de ignição, temperaturas de autoignição e características de explosão respectivamente.
Tabela 2– Características de Inflamabilidade e Ignição [4].
Hidrogênio Metano Propano Gasolina
Limites de Inflamabilidade (% de volume no ar)
Limite inferior (LFI)
Limite Superior (LFS)
4
75
5,3
15
2,1
9,5
1
7,8
Tabela 3– Temperaturas de Autoignição [4]
Temperaturas de autoignição (ºC) Hidrogênio Metano Propano Gasolina
Mínima
Jato de ar aquecido (diâmetro 0,4 cm)
Fio de Nicromo
585 670 750 540 1220 1220 487 885 1050 228-471 1040
Tabela 4– Características de Explosão[4]
Hidrogênio Metano Propano Gasolina
Limites de detonabilidade (% de vol. No ar)
Limite inferior Limite superior 11-18 59 6,3 13,5 3,1 7 1,1 3,3
Máxima velocidade laminar de chama (m/s)
Concentração máxima (% em Vol.)
Velocidade laminar de chama esteq. (m/s)
Concentração estequiométrica (% em Vol.)
3,46 42,5 2,37 29,5 0,43 10,2 0,42 9,5 0,47 4,3 0,46 4,1 0,42 1,8
inflamação, visto a sua expansão ser acima de -40°C, podendo ocorrer aquecimento [3]. Todas estas características do hidrogênio, o colocam num patamar de utilização como combustível bastante privilegiado. No entanto essas mesmas características traduzem-se em fortes implicações contra o ser humano, devido à extrema sensibilidade para se detonar [3].
Para que seja usado em público, o hidrogênio teria de ser manuseado com o mesmo nível de confiança e nunca com mais riscos, que os combustíveis convencionais. As propriedades físicas relevantes para a segurança do hidrogênio são comparadas com as da gasolina, propano e metano [5], como mostra a tabela 5.
Tabela 5– Propriedades relevantes para os cuidados de segurança a ter com o hidrogênio e outros gases comumente utilizados [6]
Hidrogênio Metano Propano
Densidade, Kgm-3 em CNTP
Limites de ignição no ar, % em Vol. E em CNTP
Temperatura de ignição, ºC
Mín. energia de ignição no ar, MJ
Máx. razão de combustão no ar, m.s-1
Limites de detonação no ar, % em Vol.
Razão estequiométrica no ar
0,084
4,0 a 77
560
0,02
3,46
18 a 59
29,5
0,65
4,4 a 16,5
540
0,3
0,43
6,3 a 14
9,5
2,01
1,7 a 10,9
487
0,26
0,47
1, a 1,3
4,0
3. 4 – O Hidrogênio como combustível: obtenção
Discutem-se aqui alguns dos equipamentos básicos necessários e vários métodos para dissociar a água através da eletrólise simples. Alguns desses métodos têm sido utilizados com sucesso para corridas de carros ou só para aumentar a quilometragem do veículo por litro de combustível. Todos eles funcionam, mas alguns melhores que outros.
3.4.1 – A Eletrólise
Fazer funcionar um motor a água requer a dissociação da água (H2O) em hidrogênio (H ou H2) e oxigênio (O ou O2) gasoso. Isto é tradicionalmente feito usando "eletrólise", que também é chamada de "hidrólise", que nada mais é do que passar corrente contínua através de dois eletrodos colocados na água misturada a um eletrólito, um positivo (anodo) e outro negativo (catodo) (Figura 1).
Oxigênio Hidrogênio
Bateria ou fonte DC Anodo (+) Catodo (-)
Figura 1– Esquema da Eletrólise (hidrólise)
A eletrólise da água é uma tecnologia muito importante para uma produção em larga escala de hidrogênio. A energia do hidrogênio tem a capacidade de ser utilizada como energia secundária no futuro próximo [10, 11], aplicável aos combustíveis para veículos e foguetes, uso com produtos químicos, célula elétrica Ni-H2, motor térmico utilizando ligas de armazenamento de hidrogênio, combustão direta de calor e assim por diante.
Além disso, a energia do hidrogênio pode ser utilizada para construir um sistema de energia dispersiva, juntamente com energia elétrica por uso de eletrólise da água e célula de combustível. Em tal sistema de energia, a
eletrólise da água vai se tornar uma tecnologia-chave, e um elevado desempenho da eletrólise da água deve ser alcançado.
A tensão necessária para realizar a eletrólise da água consiste em grande parte do potencial reversível (= 1: 23 V, a 1 atm; 25◦C), sem sobretensão em eletrodos e perda ôhmica em solução aquosa, como mostrado na fig. 2 [12].
Figura 2 - Componente de voltagens entre eletrodos [12]
Com o propósito de realizar uma boa eficiência na eletrólise da água, muitas pesquisas têm sido conduzidas até agora, focadas principalmente na diminuição do potencial reversível e sobretensão por perceber que a eletrólise da água sob alta temperatura e pressão não é boa, ou para o desenvolvimento de novos materiais para os eletrodos [13]. No entanto, pouca atenção tem sido dada à perda ôhmica em solução aquosa para a hidrodinâmica e para o ponto de vista de fluxo de duas fases. LeRoy et al. [12] apontaram que o aumento da fração de volume de bolhas de hidrogênio ou de oxigênio entre os eletrodos, ou seja, o aumento da fração de vazio provocaria um aumento da resistência elétrica na solução aquosa, resultando em diminuição da eficiência da eletrólise da água. Funk e Thorpe [14] apresentaram um modelo analítico de fração de vazio e distribuições de densidade de corrente entre os eletrodos. Hine e Sugimoto [15] obtiveram informações detalhadas sobre a fração de vazio, levantando-se as distribuições de velocidade e diâmetro de bolhas.
[18] examinaram a difusão de bolhas, convecção e transporte entre os eletrodos em detalhes. Esses trabalhos anteriores [12, 14, 18] foram bem sucedidos para explicar genericamente os efeitos das bolhas na eficiência da eletrólise da água, em vez de uma densidade de corrente baixa ou de um espaço relativamente grande entre os eletrodos. É facilmente postulado, no entanto, de que existe um espaço ótimo sob altas densidades de corrente no eletrodo; isto é, quando a densidade de corrente é bastante elevada e o espaço é bastante pequeno entre os eletrodos, a fração de vácuo fica bastante grande, resultando em aumento da resistência elétrica entre os eletrodos, e, em seguida, a diminuição da eficiência de eletrólise da água.
Nagai et all [19] estudaram os efeitos das bolhas entre eletrodos na eficiência da eletrólise da água. O estudo foi realizado com a eletrólise da água com hidróxido de potássio (KOH), solução aquosa em várias condições experimentais. Especialmente, a atenção dos autores estava focada na existência ou não, de uma condição ótima para a produção de hidrogênio por eletrólise.
De acordo com os químicos, a reação que ocorre através deste processo é traduzida pela seguinte equação química na proporção molar de 2 para 1:
H2O H2 + ½ O2 (1)
cuja reação inversa, combustão de hidrogênio para obter H2O, é uma fonte de energia.
No eletrodo negativo, os prótons são removidos do eletrólito, e o hidrogênio é formado através da reação:
4H++4e- 2H2 (2)
No eletrodo positivo, a água é oxidada e o oxigênio é formado através da reação:
2H2O O2+4H++4e- (3)
Um estudo efetuado na Universidade do Texas comprova os benefícios da obtenção do hidrogênio através da eletrólise da água. [20]
0 0 1 1
0 1
P xV P xV
T T (4)
Onde P0 é a pressão de 760 mm Hg, T0 é a temperatura 273K, P1 é a pressão efetiva de realização da eletrólise, T1 é a temperatura (K) ambiente da eletrólise e V0 é o volume de gás inicial da eletrólise.
O cálculo de V0 é dado pela relação entre carga e massa que diz que a
carga de 96500 C (Coulombs) sempre formará um equivalente-grama em qualquer eletrodo. Uma regra de três simples completa o cálculo.
0
96500 22, 4
nx C l
Q V
0
22, 4 96500
Qx l
V
nx C
(5)
Onde n é o número de massa da substância deslocada, 96500C é a carga necessária para a libertação de um equivalente grama e Q (Coulombs) é a carga aplicada no período de realização da eletrólise, em cada par de eletrodos.
( ) (s)
Qi A xt (6)
Mazloomi e Sulaiman [21] estudaram os fatores que influenciam a eficiência elétrica da eletrólise da água e apontaram os seguintes:
3.4.1.1 - Qualidade do eletrólito
Sabe-se que o desempenho das células de eletrólise eletrocatalíticas comuns, hoje é limitado [25, 26]. Isto leva a uma redução da eficiência pelo fato da resistência elétrica global do sistema ser afetada pelo referido parâmetro. Assim, as substituições tais como líquidos iônicos foram introduzidas recentemente para melhorar a condutividade e fatores de estabilidade de soluções eletrolíticas [27, 28].
De Souza et al. [29], realizaram uma investigação sobre a utilização de uma amostra de líquido iônico de 1-butil-3-metil-imidazólio-tetrafluoroborato (BMI.BF4) [30], em água como uma solução de eletrólito (que é tratado como um material barato) em temperatura ambiente o uso de alguns materiais de eletrodo facilmente encontrados, como aço carbono (CS), níquel (Ni), liga níquel-molibdênio (Ni-Mo) e molibdênio (Mo). Uma taxa de eficiência de 96% foi registrada por alguns pesquisadores, no caso da utilização de eletrodos de aço de baixo carbono [31]. Esta experiência foi realizada sob um valor de densidade de corrente de 44 mA cm-2. A eficiência conseguida foi maior do que aquelas dos eletrolisadores de tipo comercial e industrial de hoje, que são geralmente inferiores a 73% [32].
No entanto, deve-se considerar que a maioria de tais eletrolisadores serem executados sob as densidades de corrente muito mais elevadas do que este valor experimental.
Somando-se ao acima exposto, a existência de impurezas tem outros efeitos no sentido de reduzir bem a eficiência e realização das reações secundárias [33]. Magnésio ou outros contaminantes iônicos, tais como os íons de cloreto de cálcio podem ser exemplos destes materiais. Além disso, as contaminações podem bloquear passivamente os eletrodos e/ou as superfícies da membrana [22, 34], que interferem na transferência de massa e de elétrons. Esta última, na verdade, é outra causa do aumento da resistência ôhmica no caminho da corrente elétrica.
3.4.1.2 – Temperatura
eficiente em temperaturas mais elevadas [31]. Este comportamento pode ser analisado de acordo com as características termodinâmicas de uma molécula de água, em que a divisão do seu potencial de reação é conhecida por reduzir com o aumento da temperatura. Além disso, a superfície de reação e a condutividade iônica de um eletrólito deverão ser aumentadas com a temperatura [35]. Realizações do processo de eletrólise em temperaturas mais elevadas mostraram uma menor quantidade de tensão aplicada ao requisito, de modo a atingir os mesmos níveis de densidade de corrente [36, 37]. Este fato tem sido conhecido e estudado por algumas décadas. Bailleux [38] acompanhou a operação de um projeto de produção de hidrogênio em teste por dois anos. Como seria previsível, a tecnologia do processo era muito mais simples por volta do início da década 1980, em contraste com a de hoje. O relatório mostra que a fábrica funcionou com solução alcalina de hidróxido de potássio (40% em peso), nível de pressão de 20 bar, densidade de corrente de 10 kA m-2 e temperatura na faixa de 120-160◦C. Parâmetros de análises foram utilizados para monitorar a pureza da densidade, a tensão, a temperatura, pressão e corrente de gás. Esta última foi necessária a fim de calcular o conteúdo de gás não desejado de cada madida de oxigênio e hidrogênio. A pesquisa apontou uma redução de 120 mV na tensão necessária para a temperatura elevada de 120ºC a 150ºC. Em contraste com essa conquista, o relatório menciona claramente alguns tipos de "problemas de estabilidade", como rachaduras e vazamentos de vedação, as quais foram causadas pela temperatura e pressão do sistema.
Os autores do artigo acima mencionado dividiram a eficiência de um processo de eletrólise em três parâmetros individuais: eficiência elétrica, eficiência de eletrólise e eficiência térmica. Eles calcularam a participação de cada um deles na eficiência global e foi de 70%, 22% e 8%, respectivamente. Um aumento na temperatura do processo mostrou um aumento no nível da participação de eficiência térmica no geral como a eficiência elétrica diminuiu gradualmente. Neste caso, a eficiência de eletrólise quase não se alterou.
O relatório também cobriu os resultados de acoplamento do HTSE com um gás de alta temperatura do reator (HTGR) arrefecido. Quando a temperatura da eletrólise foi aumentada até 1000ºC, a eficiência global do processo foi alterada de 33% para 59%, o que é quase duas vezes maior do que a eficiência de um eletrolisador convencional de água alcalina no mesmo tempo e adicionados de uma tecnologia similar.
Ganley [40] estudou a eficácia do processo de eletrólise a uma elevada temperatura e pressão do eletrólito (vapor). Uma célula resistente a produtos químicos foi utilizada para efetuar esta experiência. O eletrólito da amostra, uma solução de KOH com alta concentração foi aquecido até 400ºC e comprimido em diferentes dimensões. A concentração eletrolítica foi de 19M na fase inicial de cada teste, o que é altamente corrosivo para muitos metais e suas ligas. A outra variável foi o material dos eletrodos. Os resultados da realização de experiências à pressão atmosférica e diferentes níveis de temperatura entre 200ºC e 400ºC mostrou uma queda aceitável na quantidade de tensão aplicada exigida no caso de um determinado alvo de densidade de corrente. Os gráficos indicaram que os resultados no aparato experimental de eletrólise da pesquisa, mais de 1,8 V deve ser aplicado aos eletrodos para atingir uma densidade de corrente de 200mA cm-2, quando o eletrólito é aquecido até 200ºC. A quantidade de tensão necessária nas mesmas condições de pressão e de densidade de corrente é cerca de 1,5V, quando o eletrólito é aquecido até 400ºC.
últimos itens mencionados levam a uma maior fração de vazio no eletrólito e diminuem a eficiência da eletrólise, como resultado.
Além disso, Ulleberg [25] realizou uma pesquisa para construir um modelo do processo de eletrólise. O modelo termodinâmico e o eletroquímico obtido mostraram claramente uma redução notável, tanto do potencial reversível como da sobretensão do sistema em altas temperaturas. Esta conclusão também é apoiada pela comparação da corrente consumida contra curvas de tensão em ambos os casos de baixa e alta temperatura de eletrólise. Notavelmente a eficiência dos processos mais eficientes poderia ser mencionada como a resultante de todos os efeitos da realização da eletrólise em temperaturas mais elevadas mencionadas.
A realização da eletrólise da água em temperaturas muito altas no eletrólito em estado de gás parece ter maior eficiência do que os sistemas de baixa temperatura, embora, fisicamente, mecanicamente e o tempo de vida estável das células de eletrólise podem ainda continuar a ser uma preocupação para os designers e fabricantes de eletrolisadores comerciais e industriais.
3.4.1.3 – Pressão
O nível de pressão é outro fator com influência sobre a eficiência de eletrólise. Mansouri et al. [41], tentaram aumentar a eficiência e reduzir os custos de capital de produção de hidrogênio atingindo maiores densidades de corrente nos eletrolisadores convencionais. Os resultados da pesquisa mostraram que o aumento da pressão do eletrólito leva ao menor consumo de energia, uma vez que reduz os diâmetros das bolhas de gás produzidos. Por conseguinte, a queda de tensão e de dissipação da potência óhmica entre os elétrodos são reduzidos. Além disso, a eletrólise da água em alta pressão reduz a quantidade de energia necessária para a compressão adicional do produto, que é um processo de consumo de energia.
(99,99%) e placas com uma área de superfície de 1cm2. Os autores mediram uma redução na tensão global de até 100 mV quando o processo de eletrólise estava acontecendo, colocando sob a pressão de 30 atm. Por outro lado, nenhuma outra redução de tensão significativa foi registrada para os valores de pressão superiores (até 40 atm), no caso de densidades de corrente elevadas e o gráfico pressão x tensão teve sua inclinação de redução maior quando a pressão foi elevada de 1 atm a 10 atm para todos os valores de temperatura.
Onda et al. [42], também expressaram que comprimindo a água consome-se muito menos energia em comparação com a energia requerida para comprimir o gás hidrogênio. Os cálculos dos autores se basearam em uma pesquisa feita por LeRoy et al. [43], que estimaram as condições de pressão e temperatura ideais de produção de hidrogênio por meio de eletrólise da água ser relativamente até 70 MPa e 250ºC.
Considerando mudanças de entalpia e energia de Gibbs, a tensão de eletrólise da água diminuiu à medida que a temperatura aumenta em altas pressões e vice-versa. No entanto, no caso de elevados níveis de pressão de 20 MPa, foi descoberto que o aumento de tensão é reduzido quando a temperatura cai. Por fim, eles mencionaram a possibilidade de um aumento de eficiência de 5% na fase da eletrólise e de 50% na fase de compressão de produção de hidrogênio, usando alta pressão na eletrólise da água.
3.4.1.4 - Resistência elétrica do eletrólito
A resistência elétrica de um objeto é uma avaliação da sua oposição para a passagem de corrente elétrica. O valor dessa oposição é proporcional ao comprimento, área da seção transversal do objeto, do tamanho do caminho da corrente e da resistividade do material. A relação entre os fatores mencionados é mostrada na Equação (7) a seguir.
R A
l
(7)
do eletrólito e, finalmente, termina sua jornada na superfície do outro elétrodo. Este caminho pode ser assumido como um objeto com o mesmo comprimento da distância entre os elétrodos, a seção transversal da área de elétrodos e a resistividade, que é um composto de diferentes fatores, tais como
o material de eletrodo, permissividade elétrica do eletrólito e a superfície de reação entre eletrodos e eletrólito. Por todo o composto e como em um único objeto, existem alguns fatores, que são capazes de alterar a sua resistência, tais como:
3.4.1.4.1 - Espaçamento entre eletrodos
A Eq. (7) expressa claramente que através da redução do espaço entre os eletrodos, uma resistência elétrica mais baixa poderia ser obtida. No entanto, a questão que pode ocorrer é qual redução dessa distância é possível?
Nagai et al. [19] realizaram uma série de experiências para descobrir o espaço ideal entre eletrodos em relação a este assunto. A pesquisa baseou-se em examinar os efeitos da porção de vazio entre os elétrodos que é causada pela presença de bolhas de gás produzidas. A célula de eletrólise da investigação acima mencionada foi submetida à pressão atmosférica com eletrodos feitos de liga Ni-Cr-Fe. Outras variáveis da pesquisa foram a densidade de corrente, temperatura e sistema de distância de eletrodos, tamanho, molhabilidade e inclinação. Como eletrólito foi usada uma solução aquosa de hidróxido de potássio 10% em peso. Os resultados desta pesquisa indicam claramente que o excesso de redução do espaço entre os elétrodos aumenta a fração de vazio e, finalmente, causa um processo menos eficiente.
volume de gás entre os eletrodos levará a um decréscimo maior da resistência elétrica e eficiência da eletrólise da água.
3.4.1.4.2- Tamanho e alinhamento dos eletrodos
Outra variável é a área da seção transversal do objeto. De acordo com Nagai et al [19], utilizando eletrodos com maior área de superfície pode resultar em menor resistência elétrica. Mais uma vez, neste caso, seria muito melhor definir o termo como a "área mais superficial". A questão é se o único limite para o uso de eletrodos maiores são os de fabricação, limites mecânicos, dimensionais e técnicos do aparelho. Referindo-se ao papel mencionado anteriormente [19], os autores conduziram uma série de experimentos, a fim de comparar os resultados do uso de diferentes tamanhos de eletrodos, a fim de calcular o seu efeito sobre a eficiência da eletrólise.
Os resultados foram muito interessantes ao notar como eles os encontraram, utilizando a mesma largura do eletrodo, um aumento na sua altura, conduz a uma exigência de voltagem da célula mais alta. A razão foi estabelecida como sendo a formação de uma maior fração de vazio causada por bolhas de gás em altitudes mais elevadas. O modelo de movimento das bolhas de gás [44] mostra claramente a acumulação de bolhas nas partes mais altas dos eletrodos.
Os últimos experimentos de Nagai et al.[19], também mostraram que a colocação dos elétrodos em modo vertical, é a melhor escolha para obter a mínima resistência óhmica relativamente ao comportamento de saída das bolhas.
3.4.1.4.3 – Velocidade de subida das bolhas
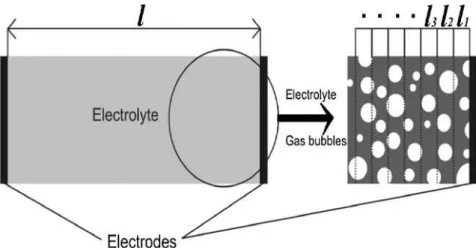
bolhas de gás [46]. A taxa de desocupação das bolhas de gás e sua velocidade de saída dos eletrodos, a placa separadora (quando existe) e a superfície do eletrólito e do espaço entre os eletrodos, tem um papel notável no valor da resistência elétrica de uma célula de eletrólise. A Fig. 3 pode justificar este assunto. Nesta figura, a distância entre os elétrodos de "l" é quebrada para n segmentos menores "li".
Figura 3: Formação de fração de vazio em um eletrólito.
Portanto, a Eq. (7) poderia ser utilizada para calcular a resistência para cada comprimento parcial de “li”, a área de seção transversal eficiente e como cada “li” é significativamente reduzido pela presença de bolhas de gás, a quantidade total de R aumenta. Assim, a Eq. (7) pode ser reescrita como abaixo:
(8)
A eq. (8) e a fig. 5 mostram o efeito da quebra provocada pelo vazio das bolhas de gás. Os esforços têm sido feitos para forçar as bolhas a soltarem das superfícies e deixarem o ambiente tão rapidamente quanto possível. Por exemplo, Li et al. [47], expuseram seu aparelho de eletrólise experimental a um campo de ultrassom.
A eficiência do sistema e o consumo de energia foram anotados em ambos os casos com presença e ausência do campo de ultrassons. A presença de um campo de ultrassons causou uma grande diminuição na tensão da célula, especialmente em densidades de corrente elevadas e baixas concentrações de eletrólito. A melhoria foi relatada como sendo de 15-18%, em
R li
A
experiências de densidade de corrente elevada, o que causou uma economia de energia de 10-25% a uma determinada concentração de eletrólito.
O desprendimento de bolhas dos eletrodos, da membrana separadora, e o eletrólito são de uma grande importância, a fim de melhorar tanto a transferência de massa e a transferência de calor local, em adição ao aumento da eficiência. A exigência de energia para a geração do campo ultrassônico pode ser ignorada em analogia com a demanda de energia da eletrólise. Um gerador de ultrassom de 0.05 kW foi suficiente para ser usado em uma célula de eletrólise de 100 kA. Neste caso, a aplicação do campo de ultrassons causou uma redução de 30 kW em consumo de energia do sistema.
Outro conjunto de experiências foi feito por Wang et al. [48] para reduzir as perdas nas células provocadas por bolhas de gás adsorvido sobre os eletrodos e na membrana separadora. A exposição da célula a um campo de super gravidade foi o conceito de pesquisa. As condições de super gravidade poderiam ser alcançadas por diferentes meios, incluindo centrífuga (rotação) instalada em uma célula eletrolítica horizontal. Nesta experiência, os sinais de entrada e de saída foram lidos fazendo arranjos apropriados na parte superior e eixo inferior.
A temperatura da célula foi mantida a 60ºC, utilizando um banho de água. Era conhecido antes desta pesquisa que o ambiente de aceleração de alta gravidade aumentava ambas as velocidades do fluxo de convecção e interfase de deslizamento [49]. Este efeito conduz a uma melhor separação em multifase de gás-líquido e fases de gás-sólido [50], que por outras palavras, significa a melhoria do desprendimento e da saída de bolhas de gás de um aparelho de eletrólise. Assim, a perda ôhmica menor e maior potencial ocorre. Wang et al. [48], mediram e compararam a tensão necessária para atingir as densidades de corrente diferentes, em diferentes condições de gravidade.
indicado pelos autores por ser eficiente o suficiente para ser usado na indústria. Por exemplo, em uma célula eletrolítica 100 kA industrial com uma densidade de corrente de 0,5 A cm-2, se gasta 3 kW de energia elétrica para atingir um valor de gravidade de 161atm, isto causa uma redução de 0,51V na tensão aplicada necessária, o que significa uma redução de 51 kW na demanda de potência e consumo.
3.4.1.5 - Material do eletrodo
Há uma grande variedade de materiais utilizados como eletrodos em eletrolisadores. Cada metal tem um nível diferente de atividade, resistência elétrica, resistência contra a corrosão e tempo de vida. Platina e ouro são conhecidos por serem duas das melhores opções para serem usadas como eletrodos. Níquel, níquel de Raney e cobalto são materiais de eletrodos simples e podem ser utilizados em soluções alcalinas de banhos eletrolíticos porque o seu preço, resistência à corrosão e estabilidade química são de níveis satisfatórios [51].
Mansouri et al. [41] repetiram suas experiências com uma série de elétrodos diferentes, tais como Ni, Pt, Ir e Rh todos em níveis de pureza elevada (99,99%). Além disso, os seguintes materiais foram testados: tecido de Ni, Ni sinterizado, Ni-Cd e de baixo níquel e, ainda, catalisador de molibdato com impregnação de cobalto em níquel sinterizado. No que diz respeito aos resultados obtidos, os de níquel apresentaram melhores características do que os outros metais potenciais testados [29].
Comparando os resultados registrados, os autores descobriram que a atividade do eletrodo sinterizado de tecido ou poroso é de 30 vezes maior do que os eletrodos lisos. A razão é pelo fato de ser maior a área de superfície de eletrodo em contato com o eletrólito.
líquido iônico em temperatura ambiente, a eletrólise tem um desempenho muito melhor com eletrodos de molibdênio [29].
Neste trabalho foi usado o aço 316L para a confecção dos eletrodos, pois este material é o que vem sendo usado pelas empresas que comercializam eletrolisadores para veículos. O aumento da área de contato com o eletrodo foi feito com ranhuras em padrão cruzado, simulando a área de contato do tecido de níquel. O eletrólito utilizado foi o KOH, também utilizado pelos fornecedores de eletrolisadores.
3.4.1.6 - Material separador
A colocação de um separador entre os eletrodos reduz a eficiência da eletrólise, uma vez que bloqueia a livre circulação de massa e íons. Além disso, a presença de um separador faz uma maior acumulação de bolhas de gás no eletrólito [19] e aumenta a quebra de vazio. Além disso, a resistência elétrica eficaz de um separador é frequentemente tão grande quanto 3-5 vezes à do eletrólito [52].
A resistência elétrica de um separador depende de diferentes variáveis do sistema, tais como a corrosão, temperatura e pressão [53], Ao medir e comparar a resistência elétrica de um eletrólito com uma condutividade conhecida ou determinada molaridade de solução na presença de separadores feitos de materiais diferentes, é possível classificar, escolher e usar o melhor no caso.
![Figura 6 – Mínima energia de ignição do hidrogênio no ar [66]. 3.4.2.3 - Distância de extinção pequena](https://thumb-eu.123doks.com/thumbv2/123dok_br/15585912.103558/54.892.204.701.142.380/figura-mínima-energia-ignição-hidrogênio-distância-extinção-pequena.webp)
![Figura 7 - Temperatura adiabática de chama para misturas hidrogênio-ar [68].](https://thumb-eu.123doks.com/thumbv2/123dok_br/15585912.103558/56.892.222.628.132.468/figura-temperatura-adiabática-de-chama-para-misturas-hidrogênio.webp)
![Figura 9 - Câmara de combustão volumétrica e comparação de energia para motores alimentados a gasolina e a hidrogênio [69].](https://thumb-eu.123doks.com/thumbv2/123dok_br/15585912.103558/59.892.197.697.807.1056/figura-câmara-combustão-volumétrica-comparação-alimentados-gasolina-hidrogênio.webp)
![Figura 12 – Eletrolisador de célula seca idealisado por William Rhodes, apresentado por Kelly [71]](https://thumb-eu.123doks.com/thumbv2/123dok_br/15585912.103558/63.892.170.714.513.817/figura-eletrolisador-célula-idealisado-william-rhodes-apresentado-kelly.webp)
![Tabela 7 - Composição dos Combustíveis Examinados [4]](https://thumb-eu.123doks.com/thumbv2/123dok_br/15585912.103558/66.892.265.623.184.441/tabela-composição-dos-combustíveis-examinados.webp)
![Figura 16 - Emissões de NOx [73]. 3.6.3 – Adicionado ao diesel](https://thumb-eu.123doks.com/thumbv2/123dok_br/15585912.103558/68.892.140.758.139.937/figura-emissões-de-nox-adicionado-ao-diesel.webp)