Verônica da Silva Oliveira
Síntese e Caracterização de Compostos de Coordenação Homolépticos
e Heterolépticos com o Ligante Ácido Kójico
_____________________________________
Dissertação de Mestrado
Natal/RN, janeiro de 2014
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE
CENTRO DE CIÊNCIAS EXATAS E DA TERRA
INSTITUTO DE QUÍMICA
2 VERÔNICA DA SILVA OLIVEIRA
SÍNTESE E CARACTERIZAÇÃO DE COMPOSTOS DE COORDENAÇÃO
HOMOLÉPTICOS E HETEROLÉPTICOS COM O LIGANTE ÁCIDO KÓJICO
Dissertação apresentada ao Programa de Pós-Graduação em Química da Universidade Federal do Rio Grande do Norte, como parte dos requisitos para obtenção de grau de Mestre.
Orientadora: Prof.ª Dra. Ana Cristina Facundo de Brito Pontes
Co-orientador: Prof. Dr. Daniel de Lima Pontes
Natal, RN
Divisão de Serviços Técnicos
Catalogação da Publicação na Fonte. UFRN / Biblioteca Central Zila Mamede
Oliveira, Veronica da Silva.
Síntese e caracterização de compostos de coordenação homolépticos e heterolépticos com o ligante ácido kójico / Veronica da Silva Oliveira. – Natal, RN, 2013.
190 f. : il.
Orientador: Ana Cristina Facundo de Brito Pontes.
Dissertação (Mestrado) – Universidade Federal do Rio Grande do Norte. Instituto de Química. Programa de Pós-Graduação em Química.
1. Química Inorgânica – Dissertação. 2. Química de Coordenação – Dissertação. 3. Compostos de Coordenação - Dissertação. 4. Ácido Kójico – Dissertação. I. Pontes, Ana Cristina Facundo de Brito. II. Universidade Federal do Rio Grande do Norte. III. Título.
4 AGRADECIMENTOS
Ao Deus Pai todo poderoso e misericordioso, pela graça de ter conquistado mais essa vitória em minha vida, iluminando e abençoando-me, fortalecendo-me nos momentos mais difíceis dessa caminhada. Obrigada meu Deus por todas as maravilhas que realizas em minha vida.
Aos meus pais Vanízia Maria da Silva Oliveira e Aberaci Pereira de Oliveira, por todo amor, carinho e apoio. Por tudo que aprendi e pela pessoa a qual me tornei. Aos meus irmãos Albercy, Aldeir e Vanessa que torcem por minhas conquistas e se alegram com o meu sucesso. Aos meus sobrinhos, amores da minha vida, Álipher Gabriel, Ana Vitória, Ana Cecília e Nicole Gabrielle, pelo carinho e momentos de descontração, nos momentos de estresse da dissertação.
Ao meu namorado Railson Carlos Souza da Luz, pelo amor, carinho, apoio, incentivo, consolo e principalmente paciência, nos momentos de desespero na reta final do mestrado. Meu muito obrigado por está ao meu lado, sempre dando força, ajudando-me e colaborando em tudo.
A toda minha família e a todos os meus amigos que mesmo distante torcem e vibram
com minhas conquistas, e souberam compreender a minha ausência durante esses últimos meses para a finalização desse trabalho.
Ao Prof. Dr. Daniel de Lima Pontes, por esses dois anos de ensinamentos, pela sua ajuda, paciência e disponibilidade para me orientar. Pelas diversas conversas, preciosos momentos de aprendizado profissional e também crescimento pessoal, pelos incentivos, apoio, confiança e conselhos. Meu muito obrigada!
A Professora Dra. Ana Cristina pela atenção, apoio e carinho durante esse tempo. Ao Prof. Francisco Ordelei pela sua ajuda e colaboração no desenvolvimento desse trabalho, nos estudos dos complexos de rutênio.
5 Ao laboratório de Bioinorgânica da UFC, na pessoa do professor Dr. Luiz Gonzaga de França Lopes, pela disponibilidade de estrutura do laboratório.
A central analítica do Departamento de Química da UFPE, pela análise elementar (CHN).
Ao instituto de Química da Universidade Federal do Rio Grande do Norte; a central analítica na pessoa do técnico Joadir.
Ao programa de Pós-Graduação em Química da UFRN e a CAPES pela ajuda financeira, com a concessão de bolsa de estudo.
“Algo só é impossível até que alguém duvide e resolva provar ao contrário.”
6 RESUMO
Com o presente trabalho tem-se como objetivo contribuir com a química de coordenação do ligante ácido kójico, com a síntese e caracterização de compostos homolépticos [Al(kj)3], [Fe(kj)3], [Fe(kj)2], [Cu(kj)2] e [Ru(kj)3], assim como dos novos complexos heterolépticos, trans-K2[Fe(kj)2(CN)2] e trans-Na2[Ru(kj)2(CN)2]. Os compostos obtidos foram caracterizados através da espectroscopia vibracional na região do infravermelho e da espectroscopia eletrônica na região do ultravioleta e visível (Uv-Vis). Os resultados de infravermelho comprovaram a coordenação do ligante bidentado ácido kójico, devido às reduções dos valores das frequências de estiramento da carbonila e das duplas ligações, comparativamente ao ligante livre, para todos os complexos obtidos. Assim como a verificação de novos modos vibracionais, em decorrência da alteração de simetria da molécula na formação de novas estruturas para os compostos sintetizados. Além de modos vibracionais atribuídos aos estiramentos metal-oxigênio, evidenciando coordenação dos íons metálicos ao ligante. Através dessa técnica, também foi possível realizar correlações dos números de modos vibracionais, na região de 1400 a 900 cm-1, com a geometria dos compostos. Adicionalmente aos complexos homolépticos, os compostos heterolépticos exibiram
frequências de υC≡N em 2065 e 2053 cm-1
, respectivamente, para o trans-K2[Fe(kj)2(CN)2]e o trans-Na2[Ru(kj)2(CN)2], indicando coordenação do ligante ciano aos íons metálicos de FeII
e RuII. Comparativamente com dados da literatura, foi possível propor a isomeria, caracterizando os complexos em configuração trans. E com relação aos resultados da espectroscopia eletrônica, os estudos da variação do pH do ácido kójico forneceram informações sobre a distribuição de densidade eletrônica na molécula, apresentando perfil espectral característico do íon kójico na sua forma protonada (Hkj, ácido kójico), com duas bandas em 215 e 269 nm, ou desprotonada (kj-), com bandas em 226 e 315 nm. E os espectros eletrônicos obtidos para todos os complexos em meio aquoso, na região do ultravioleta exibiram variações das energias atribuídas às transições intraligantes do ácido kójico, e na região do visível, só foram identificadas transições para os complexos de ferro e rutênio, atribuídas em sua maioria as transferência de carga.
7 ABSTRACT
The present work has as main objective to contribute to the coordination chemistry of the ligand kojic acid, with the synthesis and characterization of the homoleptic compounds [Al(kj)3], [Fe(kj)3], [Fe(kj)2], [Cu(kj)2] e [Ru(kj)3], and the new heteroleptic complexes, trans-K2[Fe(kj)2(CN)2] and trans-Na2[Ru(kj)2(CN)2]. The obtained compounds were characterized by vibrational spectroscopy in the infrared region (IV) and Electronic spectroscopy in the ultraviolet and visible region (Uv-Vis). The infrared results indicated the coordination of the bidentate ligand kojic acid, due to reductions in the values of the stretching frequencies of the carbonyl and double bonds, compared to the free ligand for all complexes obtained. The presence of new vibrational modes indicated the change of symmetry of the molecules in the new compounds synthesized. Additionally, the presence of vibrational modes assigned to metal-oxygen also contributed to confirm the ligand coordinating to the metal ions. Through this technique, was also possible to perform correlations of the numbers of vibrational modes, in the region 1400-900 cm-1 and the compounds geometry. The heteroleptic compounds exhibited υC≡N in 2065 and 2053 cm-1, respectively, for the trans-K2[Fe(kj)2(CN)2] and
trans-Na2[Ru(kj)2(CN)2], indicating coordination of the cyano ligand to metal ions FeII e RuII. Comparing the obtained values with literature data was possible to identify the complex isomerism as trans. In relation to the results of electronic spectroscopy, studies of pH
variation of kojic acid provided information on the distribution of electron density in the molecule, showing characteristic spectral profile of kojic ion and its protonated form (Hkj, kojic acid), with two bands at 215 and 269 nm, or deprotonated (kj-), with bands at 226 and 315 nm. The electronic spectra obtained for all complexes in aqueous medium, in the ultraviolet region, exhibited variations of the energies assigned to kojic acid intraligand transitions while in the visible region, only transitions assigned to charge transfer of iron and ruthenium complex have been identified.
8 LISTA DE FIGURAS
Figura 1- Estrutura química do ácido kójico ... 24
Figura 2 - Possibilidades de modificações estruturais dos hidroxipironas. ... 27
Figura 3 - Representação de Hidroxipironas. ... 28
Figura 4 - Representação das Possibilidades de Derivações do Ácido kójico com Aminoácidos. ... 29
Figura 5 - Representação da Síntese de Ácido Kójico com Sais Diazonioaromáticos. ... 29
Figura 6 - Estrutura do Derivado do Ácido Kójico com Ácido Láurico. ... 30
Figura 7- Representação da Reação de N-Alquilação da Quitosana ao Ácido Clorokójico. ... 30
Figura 8 - Reação de síntese para obtenção dos derivados 3-hidroxi-6-metil-2-[(4-substituintepiperazin-1-il)metil]-4H-piran-4-ona. ... 31
Figura 9 - Sistema de Síntese dos Derivados l,2,5-trisubstituintes-4(1H)-piridinona a partir do Ácido Kójico. ... 32
Figura 10 - Representação da Derivação do Ácido Kójico em Tioeter. ... 33
Figura 11 - Representação da Conversão dos Derivados de Tioeter em Sulfóxidos (a) e em Sulfonas (b). ... 34
Figura 12 - Representação de Derivados do Ácido Kójico com vanilina e orto-vanilina. ... 34
Figura 13 - Representação dos Complexos Formados em Meio Aquoso na Proporção de uma Molécula e Duas Moléculas do Ligante Ácido Kójico... 35
Figura 14 - Representação dos ligantes hidroxipironas (na parte superior), e representação estrutural dos complexos formados com os íons de alumínio e gálio (na parte inferior). ... 36
Figura 15 - Representação dos Complexos de Índio obtidos com Ligantes Pironas (parte superior) e Piridonas (parte inferior). ... 37
Figura 16 - Representação do Complexo de Oxovanádio com o Ácido Kójico. ... 37
Figura 17 - Proposta de representação para os complexos sintetizados com os ligantes ácido kójico e maltol a partir de organoestanho. ... 38
Figura 18 - Representação dos Ligantes. ... 39
Figura 19 - Representação dos Complexos de Rutênio. ... 40
Figura 20 - Representação Estrutural dos Complexos de Metais de Transição com Ácido Kójico e L-prolina como Ligantes, onde M= Co (II), Ni (II) e Zn (II) (à esquerda) e M= Mn (II) (à direita). ... 41
Figura 21 - Representação Esquemática dos Compostos Derivados do Ácido Kójico. ... 41
Figura 22 - Síntese do Ligante Macrocíclico 6,6′,6′′ -(1,4,7-triazonana-1,4,7-triil)tris(metileno)tris(5-hidroxi-2-(hidroximetil)-4H-piran-4-ona). ... 42
Figura 23 - Representação do Ligante Macrocíclico e de seus Complexos Sintetizados. ... 42
Figura 24 - Síntese de Complexos de Rutênio-Cimeno Reagindo com Ligantes Pironas e Tiopironas. ... 43
Figura 25 - Estrutura Química do Ácido Azidokojico. ... 44
Figura 26 - Representação Esquemática do Potencial de Aplicação dos Hidroxipiridona, atuando como Ligante (cinza) e na Forma de Complexos, para Fins Terapêuticos (azul) e Aplicações em Diagnósticos (violeta). ... 45
Figura 27 - Transições de Energia entre Orbitais. ... 48
Figura 28 - Fluxograma de síntese do complexo [Al(kj)3]. ... 55
Figura 29 - Proposição de estrutura (à esquerda) e foto do complexo [Al(kj)3] (à direita). ... 55
Figura 30 - Fluxograma de síntese do complexo [Fe(kj)3]. ... 56
Figura 31 - Proposição de estrutura (à esquerda) e foto do complexo [Fe(kj)3] (à direita). ... 57
Figura 32 - Fluxograma de síntese do complexo [Fe(kj)2]. ... 58
Figura 33- Proposição de estrutura (à esquerda) e foto do complexo [Fe(kj)2] (à direita). ... 58
10 Figura 62 - Espectro vibracional na região do infravermelho para o complexo [Ru(kj)3] na faixa de 4000 a 400 cm-1... 93 Figura 63 - Espectro vibracional na região do infravermelho para o complexo [Ru(kj)3] na faixa de 1800 a 1400 cm-1... 94 Figura 64 - Espectro vibracional na região do infravermelho para o complexo [Ru(kj)3] na faixa de 1400 a 900 cm-1... 95 Figura 65 - Espectro vibracional na região do infravermelho para o complexo [Ru(kj)3] na faixa de 900 a 400 cm-1... 96 Figura 66 - Representação do efeito de conjugação do heterocíclico mediante deslocalização da densidade eletrônica da carbonila com a coordenação do metal. ... 99 Figura 67 - Representação do Diagrama do orbital molecular para o CN-. ... 102 Figura 68 - Representação dos orbitais do metal e do ligante CN- envolvidos na retrodoação e
na σ doação, respectivamente à esquerda e à direita. ... 102 Figura 69 - Espectro vibracional na região do infravermelho para o complexo trans-K2[Fe(kj)2(CN)2] na faixa de 4000 a 400 cm-1. ... 103 Figura 70 - Espectro vibracional na região do infravermelho para o complexo trans-K2[Fe(kj)2(CN)2] na faixa de 1800 a 1400 cm-1. ... 104 Figura 71 - Espectro vibracional na região do infravermelho para o complexo trans-K2[Fe(kj)2(CN)2] na faixa de 1400 a 900 cm-1. ... 106 Figura 72 - Espectro vibracional na região do infravermelho para o complexo trans-K2[Fe(kj)2(CN)2] na faixa de 900 a 400 cm-1. ... 107 Figura 73 - Espectro vibracional na região do infravermelho para o complexo trans-Na2[Ru(kj)2(CN)2] na faixa de 4000 a 400 cm-1. ... 108 Figura 74 - Sobreposição dos espectros vibracionais na região de 1800 a 1400 cm-1 para os complexos [Fe(kj)3] e [Fe(kj)2], respectivamente, no espectro em preto e vermelho. ... 113 Figura 75 - Sobreposição dos espectros vibracionais na região de 1400 a 900 cm-1 para os complexos [Fe(kj)3] e [Fe(kj)2], respectivamente, no espectro em preto e vermelho. ... 115 Figura 76 - Sobreposição dos espectros vibracionais na região de 900 a 400 cm-1 para os complexos [Fe(kj)3] e [Fe(kj)2], respectivamente, no espectro em preto e vermelho. ... 116 Figura 77 - Sobreposição dos espectros vibracionais na região de 1400 a 900 cm-1 para os complexos [Fe(kj)2] e [Cu(kj)2], respectivamente, no espectro em preto e vermelho... 118 Figura 78 - Sobreposição dos espectros vibracionais na região de 1400 a 900 cm-1 para os complexos [Al(kj)3], [Fe(kj)3] e [Ru(kj)3], respectivamente, no espectro em preto, vermelho e verde. ... 120 Figura 79 - Sobreposição dos espetros vibracionais na região de 1800 a 1400 cm-1
evidenciando as frequências de υC=O e υC=C, indicadas respectivamente por asterisco e
quadrado, para os complexos homolépticos [Al(kj)3], [Fe(kj)3] e [Ru(kj)3], possuindo três ligantes coordenados, respectivamente, no espectro em preto, vermelho e verde. ... 121 Figura 80 - Comportamento linear do υC=O do ácido kójico e dos complexos [Al(kj)3], [Fe(kj)3] e [Ru(kj)3] versus o raio iônico corresponte aos íons metálicos de Alumínio, ferro e rutênio, todos no estado de oxidação III. ... 122 Figura 81 - Regressão linear do comportamento do υC=O nos complexos [Al(kj)3], [Ga(kj)3], [Fe(kj)3] e [Ru(kj)3] versus o raio iônico correspondente aos íons metálicos de alumínio, gálio, ferro e rutênio, todos no estado de oxidação III. ... 123 Figura 82 - Sobreposição dos espetros vibracionais na região de 1800 a 1400 cm-1
evidenciando as frequências de υC=O e υC=C, indicadas respectivamente por asterisco e
12 Figura 108 - Representação do Diagrama de desdobramento de campo para complexos octaédricos com configuração eletrônica d5, campo forte. ... 159 Figura 109 - Sobreposição do espectro eletrônico do complexo [Ru(kj)3] em água, metanol e DMF, respectivamente nas cores preta, vermelha e verde.. ... 160 Figura 110 - Sobreposição do espectro eletrônico com elevada concentração do complexo [Ru(kj)3] em água, metanol e DMF, respectivamente nas cores, preta, vermelha e verde. E a direita expansão do mesmo espectro na região de 400 a 1000 nm.. ... 162 Figura 111 - Espectro eletrônico do complexo trans-K2[Fe(kj)2(CN)2] em meio aquoso.. ... 163 Figura 112 - Diagrama de Tanabe-Sugano para centros metálicos com configuração d6, à
13 LISTA DE TABELAS
Tabela 1 - Reagentes utilizados no procedimento experimental ... 53 Tabela 2 - Atribuição das bandas do Ácido kójico no infravermelho. ... 74 Tabela 3 - Atribuição das frequências de υC=O e υC=C para ligantes e complexos pironas e complexos da classe piridona. ... 98 Tabela 4 - Variação das frequências de υC=O dos complexos homolépticos comparativamente ao ligante ácido kójico, para a primeira e segunda banda referente à carbonila. ... 100 Tabela 5 - Dados comparativos entre as frequências de estiramento C≡N e C=O, respectivamente, para Diciano complexos e dicarbonil complexos. ... 110 Tabela 6 - Atribuições das principais bandas encontradas no espectro de infravermelho do ácido kójico e dos complexos homolépticos e heterolépticos analisados. ... 112 Tabela 7 - Atribuições da literatura para os complexos [Ga(kj)3] e [Zn(kj)2]. ... 126 Tabela 8 - Atribuição das transições no espectro eletrônico do ácido kójico em meio aquoso. ... 128 Tabela 9 - Comparação das atribuições das bandas no espectro eletrônico do ácido kójico em diferentes solventes... 129 Tabela 10 - Valores de pKa calculados para a banda encontrada em 315 nm no espectro do ácido kójico. ... 135 Tabela 11 - Atribuições das bandas no espectro eletrônico do complexo [Al(kj)3] em meio aquoso. ... 141 Tabela 12 - Comparação entre transições no espectro eletrônico do complexo [Al(kj)3] em diferentes solventes... 143 Tabela 13 - Atribuição das bandas no espectro eletrônico do complexo [Fe(kj)3] em meio aquoso. ... 145 Tabela 14 - Comparação das atribuições no espectro eletrônico do complexo [Fe(kj)3] em diferentes solventes... 150 Tabela 15 - Atribuição das bandas no espectro eletrônico do complexo [Fe(kj)2] em meio aquoso. ... 151 Tabela 16 - Comparação das atribuições no espectro eletrônico do complexo [Fe(kj)2] em diferentes solventes... 153 Tabela 17 - Atribuição das bandas no espectro eletrônico do complexo [Cu(kj)2] em meio aquoso. ... 155 Tabela 18 - Comparação das atribuições no espectro eletrônico do complexo [Cu(kj)2] em água e metanol. ... 156 Tabela 19 - Atribuição das bandas no espectro eletrônico do complexo [Ru(kj)3] em meio aquoso. ... 159 Tabela 20 - Comparação entre os comprimentos de onda no espectro eletrônico do complexo [Ru(kj)3] em diferentes solventes. ... 161 Tabela 21 - Atribuição das bandas no espectro eletrônico do complexo trans-K2[Fe(kj)2(CN)2] em meio aquoso. ... 164 Tabela 22 - Comparação entre os comprimentos de onda no espectro eletrônico do complexo
14 LISTA DE ABREVIAÇÕES E SIGLAS
Acac Acetilacetonato 2-amp 2-aminometilpiridina Bipy 2,2-Bipiridina Bu4N Tetra-n-butilamônio
Cyclam 1,4,8,11 - tetraazaciclotetradecano DMF Dimetilformamida
Dmit 1,3-ditiol- 2-tiona-4,5-ditiolato Dpe 1,2-difosfinaetano
Dpp 3-hidroxi-1,2-dimetil-4-piridinona Hck Ácido clorokójico
Hma Maltol
HOMO Orbital molecular ocupado de maior energia Hpa Ácido piromeconico
IL Intraligante ImN Imidazol IV Infravermelho Kj- Íon kójico
LMCT Transferência de Carga do Metal para o Ligante LUMO Orbital molecular desocupado de menor energia MLCT Transferência de Carga do Ligante para o Metal Mpp 3-hidroxi-2-metil-4-piridinona
PF6- Íon Hexafluorofosfato Phen 1,10-Fenantrolina Ph4P Tetrafenilfosfônio
RMN 13C Ressonância Magnética Nuclear de Carbono RMN 1H Ressonância Magnética Nuclear de Hidrogênio Salen N,N'-Etilenobis(salicilimina)
15 LISTA DE SÍMBOLOS
Variação de desdobramento de campo
Absortividade molar
υ Frequência de estiramento
16 SUMÁRIO
1. INTRODUÇÃO ... 19
2. OBJETIVOS ... 22
2.1. OBJETIVO GERAL ... 22
2.2. OBJETIVOS ESPECÍFICOS ... 22
3. REVISÃO BIBLIOGRÁFICA ... 24
3.1. ÁCIDO KÓJICO ... 24
3.2. APLICAÇÕES DO ÁCIDO KÓJICO ... 25
3.3. DERIVADOS DO ÁCIDO KÓJICO ... 26
3.4. COMPLEXOS DE ÁCIDO KÓJICO ... 35
3.5. COMPLEXOS DE DERIVADOS DO ÁCIDO KÓJICO ... 41
3.6. TÉCNICAS INSTRUMENTAIS DE ANÁLISE ... 45
3.6.1. Espectroscopia de Absorção na Região do Infravermelho ... 45
3.6.2. Espectroscopia Eletrônica na Região do Ultravioleta e Visível ... 47
4. MATERIAIS E MÉTODOS ... 53
4.1. REAGENTES UTILIZADOS ... 53
4.2. PROCEDIMENTOS DE SÍNTESE DOS COMPOSTOS DE COORDENAÇÃO HOMOLÉPTICOS ... 54
4.2.1. Síntese do complexo [Al(kj)3]... 54
4.2.2. Síntese do complexo [Fe(kj)3] ... 56
4.2.3. Síntese do complexo [Fe(kj)2] ... 57
4.2.4. Síntese do complexo [Cu(kj)2] ... 59
4.2.5. Síntese do complexo [Ru(kj)3] ... 60
4.3. PROCEDIMENTOS DE SÍNTESE DOS COMPOSTOS DE COORDENAÇÃO HETEROLÉPTICOS ... 62
4.3.1. Síntese do complexo trans-K2[Fe(kj)2(CN)2] ... 62
4.3.2. Síntese do complexo trans-Na2[Ru(kj)2(CN)2] ... 63
4.4. PREPARAÇÃO DA AMÁLGAMA DE ZINCO ... 65
4.5. MÉTODOS DE CARACTERIZAÇÃO ... 65
4.5.1. Espectroscopia Vibracional na Região do Infravermelho ... 65
4.5.2. Espectroscopia Eletrônica na Região do Ultravioleta e Visível (UV-Vis) ... 65
4.5.2.1. Procedimentos utilizados para obtenção dos espectros por Espectroscopia Eletrônica.. ... 66
4.5.2.1.1.Monitoramento da Variação do pH do Ácido Kójico via Espectroscopia Eletrônica66 4.5.2.1.2.Monitoramento da Redução do Ácido Kójico via Espectroscopia Eletrônica ... 66
4.5.2.1.3.Monitoramento em meio aquoso do complexo [Fe(kj)2] via Espectroscopia Eletrônica. ... 67
4.5.3. Análise Elementar (CHN) ... 67
5. RESULTADOS E DISCUSSÃO ... 69
5.1. ESPECTROSCOPIA VIBRACIONAL NA REGIÃO DO INFRAVERMELHO .... 69
5.1.1. Ácido Kójico ... 69
5.1.2. Compostos de Coordenação Homolépticos ... 75
5.1.2.1. Complexo [Al(kj)3] ... 75
5.1.2.2. Complexo [Fe(kj)3] ... 80
5.1.2.3. Complexo [Fe(kj)2] ... 84
5.1.2.4. Complexo [Cu(kj)2] ... 88
5.1.2.5. Complexo [Ru(kj)3] ... 92
17
5.1.3. Compostos de Coordenação Heterolépticos ... 101
5.1.3.1. Complexo trans-K2[Fe(kj)2(CN)2] ... 103
5.1.3.2. Complexo trans-Na2[Ru(kj)2(CN)2] ... 107
5.1.4. Comparação entre os complexos de Ferro sintetizados ... 112
5.1.5. Comparações dos espectros vibracionais entre complexos homolépticos com mesma geometria ... 117
5.1.6. Correlação dos Complexos Homolépticos ... 120
5.1.6.1. Correlação dos Estados de Oxidação III e II nos Complexos Homolépticos... 120
5.2. ESPECTROSCOPIA ELETRÔNICA NA REGIÃO DO ULTRAVIOLETA E VISÍVEL ... 127
5.2.1. Ligante Ácido Kójico ... 127
5.2.1.1. Estudo da influência do pH sobre o espectro eletrônico do ácido kójico e determinação do pKa ... 130
5.2.1.2. Monitoramento da Redução do ácido kójico com Amálgama de Zinco via Espectroscopia Eletrônica... 136
5.2.2. Espectros Eletrônicos dos Compostos de Coordenação Homolépticos ... 139
5.2.2.1. Complexo [Al(kj)3] ... 139
5.2.2.2. Complexo [Fe(kj)3] ... 144
5.2.2.3. Complexo [Fe(kj)2] ... 150
5.2.2.4. Complexo [Cu(kj)2] ... 153
5.2.2.5. Complexo [Ru(kj)3] ... 156
5.2.3. Espectros Eletrônicos dos Compostos de Coordenação Heterolépticos ... 162
5.2.3.1. Complexo de trans-K2[Fe(kj)2(CN)2] ... 163
5.2.3.2. Complexo trans-Na2[Ru(kj)2(CN)2] ... 167
5.2.4. Comparações entre os Espectros Eletrônicos dos Compostos de Coordenação Sintetizados ... 170
5.2.5. Comparação Uv-Vis entre do Ácido Kójico e os Complexos [Fe(kj)3] e [Fe(kj)2] em meio aquoso. ... 173
5.2.6. Comparação entre os espectros eletrônicos no estado sólido para os Complexos [Fe(kj)3], [Fe(kj)2] e trans-K2[Fe(kj)2(CN2] ... 175
5.3. ANÁLISE ELEMENTAR ... 179
5.3.1. Complexo [Fe(kj)3] ... 179
6. CONCLUSÃO ... 181
18
19
1. INTRODUÇÃO
A busca por novos compostos químicos que apresentem menor grau de toxicidade e menores efeitos colaterais é essencial e contínua, principalmente em áreas relacionadas à farmacologia, agricultura, indústria de cosméticos e na indústria de alimentos, incorporando substâncias benéficas à saúde.
Nesse contexto, o ácido kójico, assim como outros compostos pertencentes à classe química deste ácido orgânico, tem sido alvo de diversos estudos, devido principalmente as suas relevantes propriedades biológicas e as diferentes possibilidades de modificações de sua estrutura (BURDOCK et al., 2001; BRTKO et al., 2004). Alguns membros desse grupo já são utilizados inclusive na área farmacêutica, e além do mais, são compostos de origem natural, com possibilidade também de serem produzidos artificialmente, podendo ser convertidos em uma gama de outros derivados, por exemplo, através de reações de complexação (ZBOROWSKI et al., 2004; KANDIOLLER et al., 2011).
O ácido kójico é particularmente interessante para a química de coordenação por apresentar átomos de oxigênio propícios à interação com centros metálicos (JAIN;
KAUSHIK, 1997; FINNEGAN et al., 1987; NURCHI et al., 2010). De acordo com Kwak (2010), os compostos de coordenação podem ser aplicados como sistemas de entrega de
substâncias hidrofílicas com baixa permeabilidade celular, permitindo assim a atuação do fármaco, por exemplo, dentro da própria célula. Também têm sido avaliadas as possibilidades dessas substâncias atuarem como agentes sequestrantes de íons metálicos, no tratamento de pacientes com enfermidades caracterizadas pelo acúmulo de metais no organismo, e ainda, como ligantes com função transportadora de espécies metálicas (YUEN et al., 1997; SUDHIR
et al., 2005).
O desenvolvimento de estudos dos compostos de coordenação com aplicação na área médica tem conquistado bastante destaque nas últimas décadas, motivado principalmente pela relevante utilização da cisplatina no tratamento de diferentes tipos de câncer (ALDERDEN et
al., 2006). Por tal razão, a busca por modificações estruturais através da coordenação de
20 Estudos de substâncias coordenantes e de compostos de coordenação são de grande importância para o desenvolvimento de medicamentos mais eficazes no tratamento de doenças (SHARMA et al., 2011) ou problemas de toxicidade com sobrecarga de íons metálicos (SUDHIR et al., 2005). Estes têm a capacidade de ativar ou desativar compostos farmacêuticos devido às suas interações com substâncias biologicamente ativas, portanto, sendo de suma relevância os estudos dessas interações, visando conhecer as atividades e os processos envolvidos para esses compostos (SUDHIR et al., 2005; SANTOS et al., 2012). Como exemplo, pode-se mencionar o íon metálico ferro, que é responsável pelo transporte de oxigênio a todas as células, e também por participar das funções de diversas metaloproteínas nos sistemas biológicos (SUDHIR et al., 2005).
Com base em dados da literatura, os derivados de ácido kójico têm apresentado resultados satisfatórios em testes biológicos (BALAZ et al., 1993; HUDECOVÁ et al., 1996), tendo-se uma perspectiva promissora para o desenvolvimento dessa classe de compostos em novos medicamentos.
No presente trabalho foi efetivada a síntese de complexos de ácido kójico sendo os
compostos obtidos caracterizados através de análises espectroscópicas de infravermelho e espectroscopia eletrônica e ainda determinando correlações espectroscópicas entre eles.
21
22 2. OBJETIVOS
2.1. Objetivo Geral
O presente trabalho tem como objetivo principal contribuir para o maior entendimento da Química de Coordenação do ácido kójico, a partir da síntese e estudo de compostos homolépticos e heterolépticos com diferentes centros metálicos a partir deste ligante, visando o desenvolvimento de novos compostos que possam apresentar propriedades farmacológicas relevantes.
2.2. Objetivos Específicos
Sintetizar complexos homolépticos hexacoordenados, apresentando apenas o ligante ácido kójico na esfera de coordenação, com os íons alumínio, ferro e rutênio, no estado de oxidação III, e também complexos tetracoordenados com os íons metálicos ferro e cobre, no estado de oxidação II.
Sintetizar novos compostos de coordenação heterolépticos de ferro (II) e rutênio (II), apresentando em sua esfera de coordenação também o íon cianeto como ligante, além do íon kójico, originando os novos complexos, trans-K2[Fe(kj)2(CN)2] e trans-Na2[Ru(kj)2(CN)2]. Assim, propondo uma nova metodologia de síntese para complexos heterolépticos.
Caracterizar e estudar todos os complexos homolépticos e heterolépticos sintetizados através da Espectroscopia Vibracional na Região do Infravermelho (IV) e Espectroscopia Eletrônica na Região do Ultravioleta e Visível (Uv-Vis), além de Análise Elementar para complementar a caracterização do complexo [Fe(kj)3].
Estabelecer correlações entre as frequências de estiramento da carbonila nos compostos sintetizados com a natureza dos íons metálicos.
23
24
3. REVISÃO BIBLIOGRÁFICA
3.1. ÁCIDO KÓJICO
O ácido kójico é um ácido orgânico produzido biologicamente durante os processos de fermentação aeróbicos pela ação de fungos dos gêneros Penicillium e Aspergillus, com destaque especial à espécie Aspergillus oryzae ou por bactérias do gênero Acetobacter, fazendo uso de diferentes tipos de substratos (BURDOCK et al., 2001).
Dentre estes organismos, os fungos do gênero Aspergillus destacam-se por produzirem o ácido kójico como também por serem tradicionalmente empregados, já há muitos séculos, em processos de fermentação de alimentos tipicamente utilizados por sociedades orientais, como miso (pasta de grãos de soja), shoyu (molho de soja) e sake (bebida alcoólica obtida a partir da fermentação do arroz) (BURDOCK et al., 2001; EMAMI et al., 2007; MOHAMAD; ARIFF, 2007).
O ácido kójico foi descoberto e isolado do micélio do fungo Aspergillus oryzae cultivado no arroz cozido, em 1907 no Japão por Saito. O nome comum deste composto orgânico, entretanto, só foi atribuído em 1913 por Yabuta, que mais tarde, também foi responsável por elucidar sua estrutura molecular (BENTLEY, 2006).
A estrutura do ácido kójico, conforme pode ser observada na Figura 1, consiste de um heterociclo polifuncional da classe das pironas, contendo um anel de seis membros, dos quais um corresponde a um átomo de oxigênio e uma carbonila, respectivamente, nas posições 1 e 4. Adicionalmente estão presentes um grupo enol no carbono 5 e um grupo álcool na posição 2.
Figura 1- Estrutura química do ácido kójico
O O
OH
O H
Fonte: Burdock et al. (2001)
25 reações de substituição nucleofílicas e eletrofílica, além de reações inorgânicas com a obtenção de compostos de coordenação (BRTKO et al., 2004).
As reações de coordenação do ácido kójico relatadas na literatura, simultaneamente, envolvem os átomos de oxigênio da carbonila e do grupo enol, atuando portanto na química de coordenação como um ligante bidentado (JAIN; KAUSHIK, 1997; FINNEGAN et a.l, 1987; NURCHI et al., 2010).
Segundo Aytemir, reações de desprotonação e protonação do ácido kójico (Hkj) podem originar, respectivamente, espécies aniônicas (kj-) ou catiônicas (H2Kj+) (AYTEMIR; ÇALIS, 2010). Investigações quânticas por cálculos teóricos, sobre o equilíbrio tautomérico em derivados do ácido kójico, indicam a existência de uma ligação intramolecular de hidrogênio envolvendo os grupos ceto e hidroxila, além de uma segunda interação de hidrogênio, podendo ser formada entre o hidroximetil e o oxigênio contido no anel (ZBOROWSKI et al., 2004).
3.2. APLICAÇÕES DO ÁCIDO KÓJICO
O ácido kójico, bem como muitos dos seus derivados orgânicos, apresentam propriedades biológicas bastante relevantes, tais como atividade antibactericida, antifúngica,
inseticida e ainda antioxidante. Portanto, o ácido kójico tem se mostrado como um composto importante em diferentes áreas de interesse econômico, com especial destaque na medicina, no desenvolvimento de novos fármacos, na agricultura, na indústria de alimentos e cosméticos (HUDECOVÁ et al., 1996).
Esse composto orgânico tem sido usado como um aditivo alimentar, atuando diretamente na prevenção do escurecimento enzimático de carnes frescas de caranguejo e camarão (BURDOCK et al., 2001; EMAMI et al., 2007), assim como na prevenção do escurecimento oxidativo de frutas cortadas (NURCHI et al., 2010).
26 2010). Ainda na indústria de produtos de beleza, o ácido kójico pode estar presente em formulações de cosméticos atuando como conservante, prevenindo a degradação química ou microbiana, proporcionando assim um aumento da vida útil do produto (BURDOCK et al., 2001).
A estrutura química do ácido kójico permite diversas possibilidades de derivações, e com base nesse fato, representa um atraente esqueleto polifuncional para o desenvolvimento de compostos biologicamente ativos. Assim seus derivados orgânicos podem ser utilizados vantajosamente na medicina humana e/ou veterinária. Por essas características Brtko e colaboradores acreditam que em estudos futuros as propriedades biológicas dos derivados do ácido kójico possam propiciar o desenvolvimento de uma nova classe específica e eficaz de agentes farmacêuticos (BRTKO et al., 2004).
3.3. DERIVADOS DO ÁCIDO KÓJICO
A estrutura química do ácido kójico, pela reatividade dos diferentes grupos funcionais que o compõe, possibilita modificações estruturais em várias posições da molécula, seguindo diferentes mecanismos reacionais, permitindo assim que as estruturas dos seus derivados
sejam ajustadas de acordo com as propriedades em que se tem interesse (KANDIOLLER et
al., 2011).
27
Figura 2 - Possibilidades de modificações estruturais dos hidroxipironas.
Fonte: Adaptado Kandioller et al. (2011, p.1001).
Essa classe de compostos pode propiciar a obtenção de outra classe de moléculas, podendo ser convertidas em hidroxipiridonas, a partir da substituição do oxigênio heterocíclico pelo átomo de nitrogênio, por exemplo, a partir da reação com amônia ou aminas primárias (OZTURK et al., 2002). Já as reações de tionação ou selenação consistem na substituição do oxigênio do grupo carbonílico por enxofre ou selênio, respectivamente, formando as tiopir(id)onas e os selenopir(id)onas (KANDIOLLER et al., 2011).
As reações de Mannich são exemplos de adições nucleofílicas de aminas com um grupo carbonil, obtidas a partir da condensação de um aldeído e aminas primárias ou secundárias a um substrato contendo hidrogênios ativos, como por exemplo, fenóis e heterocíclicos (NARVAEZ; FERREIRA, 1985). Outras possibilidades de derivações dessa classe de compostos são através das reações de complexação e condensação (BARRET et al.,
2001; SZKLARZEWICZ et al., 2012).
Segundo Kandioller e colaboradores, as pironas são encontradas com grande
28 O ácido kójico, por ser constituindo por uma estrutura química capaz de originar novos compostos ou derivados mais reativos ou eficazes, como por exemplo, o clorokójico, allomatol e piromeconico, Figura 3, são tidos como compostos de partida ou intermediários na síntese de novas espécies na química medicinal, por serem considerados bons reagentes em reações de substituição nucleofílica ou eletrofílica (AYTEMIR; ÖZÇELIK, 2010).
Figura 3 - Representação de Hidroxipironas.
O
OH O
O H
O
OH O
Cl
O
OH O
H3C O
OH O
Ácido Kójico Ácido Clorokojico Allomaltol Ácido Piromeconico
Fonte: Aytemir; Özçelik (2010, p.4090).
Há relatos de que os compostos pirona, também denominados de Halo-4-piranonas, como os 5-hidroxi-2-clorometil-4H-piran-4-ona, 5-hidroxi-2-bromometil-4H-piranona e 5-hidroxi-2-iodometil-4H-5-hidroxi-2-bromometil-4H-piranona, apresentam significativo efeito antifúngico, sendo reportados na literatura como uma nova classe de fungicidas (BRTKO et al., 2004). Assim como, alguns desses derivados, o 5-hidroxi-2-azidometil-4-piranona, exibiu atividade herbicida (ZBOROWSKI et al., 2004).
Diversos estudos de modificação estrutural do ácido kójico vêm sendo desenvolvidos desde 1962, quando O’Brien trabalhando com essa molécula, sintetizou novos derivados a partir de substituições do hidrogênio da posição 6 do anel do ácido kójico por aminoácidos, através de reações de Mannich, obtendo bons resultados em síntese para os aminoácidos sarcosina, valina, leucina, isoleucina, metionina e prolina. Entretanto, não foi possível a obtenção de derivados a partir do ácido aspártico, asparagina, ácido glutâmico, glutamina, fenilalanina e tirosina, podendo-se então, atribuir o insucesso nestas reações à baixa reatividade e à insolubilidade dos compostos na mistura reacional (O'BRIEN et al., 1962). Na Figura 4 são mostradas duas possibilidades para a formação dos derivados do ácido kójico
29
Figura 4 - Representação das Possibilidades de Derivações do Ácido kójico com Aminoácidos.
Fonte: O’Brien et al. (1962, p.1712).
Uma série de novas bases de Mannich, obtidas mediante reações de condensação, foram sintetizadas através de reações do ácido kójico ou do allomatol com derivados de
piperidina e formalina, resultando na formação de compostos com atividade anticonvulsivante, entre os quais os derivados do ácido kójico se mostraram bem mais ativos do que os derivados de allomatol. A necessidade do desenvolvimento de novos medicamentos para o tratamento da epilepsia, doença que ataca 60 milhões de pessoas em todo mundo, deve-se ao fato de cerca de 30 % das pessoas afetadas não apredeve-sentam controle de suas crideve-ses de forma adequada, com as terapias médicas disponíveis, além dos medicamentos convencionais anticonvulsivantes acarretarem efeitos colaterais indesejáveis, variando de insônia à anemia megaloblástica (AYTEMIR; ÇALIS, 2010).
Adicionalmente, Miyagawa relatou a obtenção de derivados do ácido kójico utilizado reações de condensação deste ácido com sais diazonioaromáticos, Figura 5, sendo os compostos obtidos caracterizados através de análise elementar e infravermelho. Dentre as aminas utilizadas estavam a anilina, orto-cloroanilina, meta-cloroanilina, para-cloroanilina,
orto-toluidina, meta-toluidina, α-naftilamina, -naftilamina, orto-anisidina e ácido sulfanílico (MIYAGAWA et al., 1964).
Figura 5 - Representação da Síntese de Ácido Kójico com Sais Diazonioaromáticos.
Fonte: Miyagawa et al. (1964, p. 57).
30 cadeia apolar na estrutura do composto. O resultado dessa modificação estrutural, proveniente da condensação do ácido kójico ao ácido láurico (ácido dodecanoíco), Figura 6, originou o 7-O-Lauroil ácido kójico, um derivado com melhor solubilidade em hexano e óleo de soja, visto que a aplicação do ácido kójico em alimentos gordurosos e nos cosméticos poderia ser restrita, considerando a sua maior solubilidade em meio aquoso (KOBAYASHI et al., 2001).
Figura 6 - Estrutura do Derivado do Ácido Kójico com Ácido Láurico.
O
OH O
O
O
Fonte: Adaptada a Kobayashi et al (2001, p. 88).
Interessantes aplicações nas indústrias de alimento, cosmética e farmacêutica podem ocorrer através da modificação química da quitosana com o ácido kójico, levando-se em consideração a combinação das vantagens de ambas às substâncias. Visando obter novos compostos, foram realizados alguns procedimentos, em que um deles, conforme Figura 7, resultou da reação entre o ácido clorokójico com a quitosana, mediante ligação covalente entre o ácido e a quitosana, através dos grupos amino livres, sendo o produto obtido caracterizado através de análises espectroscópicas (SYNYTSYA et al., 2008).
Figura 7- Representação da Reação de N-Alquilação da Quitosana ao Ácido Clorokójico.
Fonte: Synytsya et al. (2008, p.23).
Modificações estruturais decorrentes das reações de Mannich, associadas a combinações de mecanismos reacionais envolvendo as hidroxipironas, foram obtidos e
31 descritos na literatura, resultando em vários derivados provenientes da molécula de ácido kójico. Como exemplo pode-se mencionar os trabalhos de Aytemir e Özçelik (2010), em que o ácido clorokójico utilizado foi sintetizado a partir do ácido kójico e os derivados do ácido clorokójico com bases de Mannich foram testados e apresentaram resultados in vitro relevantes contra alguns tipos de bactérias, fungos e vírus.
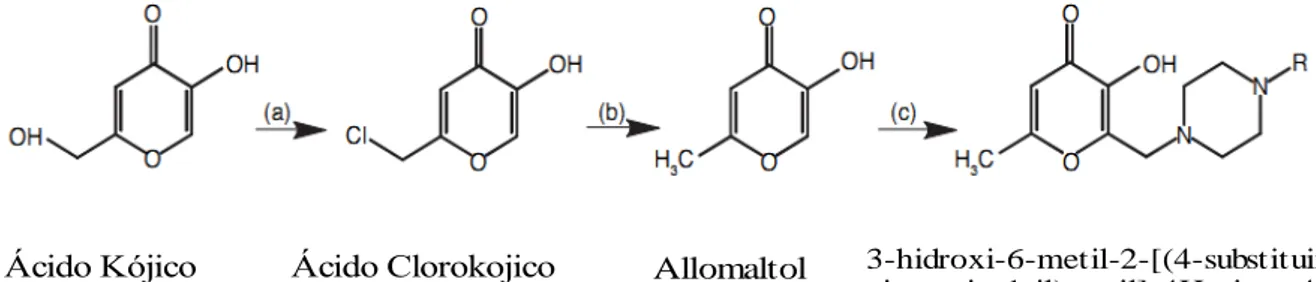
A tuberculose está listada entre as três principais doenças causadoras de morte por agentes infecciosos, conforme dados da Organização Mundial da Saúde. Na tentativa de melhorar os medicamentos aplicados no tratamento dessa enfermidade, Erol e colaboradores, sintetizaram 11 novos compostos, reagindo o 5-hidroxi-2-metil-4H-piran-4-ona com derivados de piperazina através de reações de Mannich, caracterizando-os por análise elementar, espectroscopia vibracional na região do infravermelho e ressonância magnética nuclear de hidrogênio (RMN H1). Vale ressaltar que o ácido kójico foi o reagente de partida para originar os demais derivados, como pode ser visualizado de forma geral na Figura 8 (EROL et al., 2011) .
Figura 8 – Reação de síntese para obtenção dos derivados
3-hidroxi-6-metil-2-[(4-substituintepiperazin-1-il)metil]-4H-piran-4-ona.
Ácido Kójico Ácido Clorokojico Allomaltol 3-hidroxi-6-metil-2-[(4-substituinte
piperazin-1-il)metil]-4H-piran-4-on
Fonte: Erol et al. (2011, p.320).
32 alterações no heterocíclico consiste na substituição do oxigênio pelo nitrogênio (OZTURK et
al., 2002).
Figura 9 - Sistema de Síntese dos Derivados l,2,5-trisubstituintes-4(1H)-piridinona a partir do Ácido Kójico.
Fonte: Ozturk et al. (2002, p.830).
Outra enfermidade que vem apresentando demanda por novas terapias químicas é a malária, devido a crescente resistência do Plasmodium falciparum aos medicamentos antimaláricos atualmente disponíveis. De acordo com relatos na literatura, ligantes capazes de formar complexos estáveis envolvendo o ferro são promissores para o controle da doença. No tratamento da malária, procuram-se agentes que dentre outras características sejam capazes de capturar o ferro, que é um micronutriente essencial para muitas reações bioquímicas envolvidas no crescimento e na multiplicação do plasmoduim. Quando o parasita invade os glóbulos vermelhos (eritrócito), origina molécula de baixo peso molecular em decorrência da digestão da hemoglobina, liberando ferro para suas reações. Então o uso de substâncias com capacidade de se coordenar ao ferro, formando complexos estáveis, pode acarretar, em princípio, redução da taxa de incorporação do íon metálico às metaloenzimas, levando o
33 de mamíferos. Portanto, para melhorar a eficiência no combate a malária e a redução dos efeitos tóxicos, é necessário que os compostos apresentem seletividade e eficiência para com as células infectadas. Tentando-se alcançar melhores resultados, foi investigado o potencial malárico dos derivados de 3-hidroxipiridin-4-onas com a introdução de substituintes nitrogenados, sintetizados a partir da conversão de 4-pirona a 4-piridinona, obtendo-se atividade antimalárica maior do que a classe de ligantes simples (DEHKORDI et al., 2008).
Os derivados de ácido kójico contendo grupos tioeter, sulfóxido e sulfona foram sintetizados e tiveram suas atividades anti-inflamatórias e inibitórias da tirosinase examinadas. Os resultados obtidos mostraram que os derivados de tioéter com cadeia lipofílica exibem potencial de inibir a tirosinase, enquanto as sulfonas e os sulfóxidos mostram diminuição da atividade (RHO et al., 2010). No caso, os produtos analisados foram sintetizados a partir do ácido kójico, formando o ácido clorokojico e originando os derivados de tioeter, conforme Figura 10. Posteriormente os derivados sulfóxidos e sulfonas foram provenientes dos tioeter produzidos, conforme visualizado na Figura 11.
Figura 10 - Representação da Derivação do Ácido Kójico em Tioeter.
Fonte: Rho et al. (2010, p.6570).
34
Figura 11 - Representação da Conversão dos Derivados de Tioeter em Sulfóxidos (a) e em Sulfonas (b).
Fonte: Rho et al. (2010, p.6570).
Buscando a obtenção de novos compostos com maior capacidade de coordenação de metais, o que poderia representar um desempenho promissor em patologias que envolvem excesso de metais tais como ferro e alumínio, Nurchi e colaboradores em 2011, sintetizaram dois novos compostos orgânicos apresentando duas moléculas de ácido kójico condensadas em uma única estrutura, cujas estruturas são apresentadas na Figura 12. Um dos ligantes foi obtido a partir da reação do ácido kójico com orto-vanilina (Figura 12, estrutura 2) enquanto que o segundo derivado foi proveniente da reação com vanilina (Figura 12, estrutura 3). Ambos os ligante obtidos mostraram potencial como agentes terapêuticos para o tratamento de doenças com sobrecarga de íons metálicos (NURCHI et al., 2011).
Figura 12 - Representação de Derivados do Ácido Kójico com vanilina e orto-vanilina.
Fonte: Nurchi et al. (2011, p. 5985).
6d R= n-Pentil 6e R= n-Hexil 6h R= Ciclohexil 4d R= n-Pentil
4e R= n-Hexil 4h R= Ciclohexil
5d R= n-Pentil 5e R= n-Hexil 5h R= Ciclohexil
Ácido Kójico
35 3.4.COMPLEXOS DE ÁCIDO KÓJICO
O Ácido kójico contém um heterocíclico polifuncional, apresentando vários átomos e grupos químicos ativos que permitem reações subsequentes, possibilitando, dentre os vários tipos de reações, também à coordenação a centros metálicos (BRTKO et al., 2004).
Wiley, em 1942, verificou a possibilidade de sintetizar e determinar os valores de susceptibilidade magnética para compostos de coordenação de ácido kójico com íons metálicos de manganês, ferro, cobalto, níquel e cobre, todos no estado de oxidação II. Através dos resultados foi possível determinar o número de elétrons desemparelhados em cada complexo, sendo respectivamente 1, 2, 3, 4 e 5 para os íons de Cu, Ni, Co, Fe e Mn. Desse modo atribuindo-se à configuração spin alto e geometria tetraédrica para todos os complexos, com exceção do composto de cobre, visto que os dados de susceptibilidade não evidenciam se o composto seria quadrado planar ou tetraédrico, pois ambas as formas, exibem apenas um único elétron não emparelhado (WILEY et al., 1942). Apesar de relevante, este artigo não apresentou nenhuma caracterização ou estudo adicional em relação aos complexos sintetizados além da determinação da susceptibilidade magnética.
Em 1962, o comportamento dos complexos de ácido kójico com íons metálicos de magnésio e manganês foram investigados por titulação potenciométrica em meio aquoso, e os
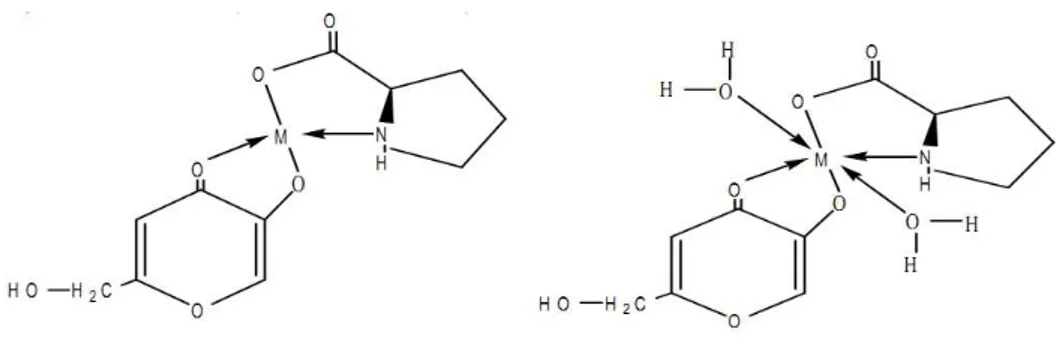
tratamentos matemáticos, estabeleceram a existência de três formas para as espécies metálicas, sendo estas [M(H2O)4]2+, [ML(H2O)2]+ e [ML2], onde M = metal e L= ácido kójico, para as razões molares 1:1 e 1:2 metal-ligante. Apesar da diferença de configuração eletrônica, os íons apresentaram semelhanças na formação dos complexos, sendo ambos considerados compostos tetracoordenados, exibindo geometria tetraédrica, conforme Figura 13 (MURAKAMI, 1962).
Figura 13 - Representação dos Complexos Formados em Meio Aquoso na Proporção de uma Molécula e Duas Moléculas do Ligante Ácido Kójico.
36 Para analisar as modificações estruturais ocorridas na molécula do ácido kójico em decorrência da coordenação, Murakami e Mera em 1966, obteve os espectros de infravermelho de complexos com íons metálicos de cobre, níquel, zinco e cobalto, todos no estado de oxidação II (MURAKAMI; MERA, 1966).
Em 1974, complexos de terras raras com ácido kójico foram preparados com os íons de lantânio (La), cério (Ce), praseodímio (Pr), neodímio (Nd), samário (Sm) e gadolínio (Gd) todos no estado de oxidação III. Os compostos foram caracterizados com base em análise elementar, condutividade, espectroscopia eletrônico e vibracional, e os resultados obtidos mostraram que o ácido kójico atua como um ligante bidentado e que na esfera de coordenação, além de três moléculas do kójico, também estão presentes duas moléculas de água (AGARWAL; RASTOGI, 1974).
Finnegan e colaboradores em 1987, sintetizaram vários complexos de tris(3-hidroxi-4-pironato) com os íons de alumínio (III) e gálio (III), utilizando como pironas os ácidos kójico (Hka), clorokójico (Hck), maltol (Hma) e piromeconico (Hpa), sendo os mesmos caracterizados por infravermelho, espectroscopia eletrônica na região do ultravioleta,
espectroscopia de massa e RMN 1H. Na Figura 14 são representados de forma simplificada os ligantes utilizados, assim como os complexos obtidos (FINNEGAN et al., 1987).
Figura 14 - Representação dos ligantes hidroxipironas (na parte superior), e representação estrutural dos complexos formados com os íons de alumínio e gálio (na parte inferior).
Fonte: Finnegan et al. (1987, p.2172).
37 1
H. Os complexos de índio descritos exibiram solubilidade em água, estabilidade em pH fisiológico e carga neutra (ORVIG et al., 1988).
Figura 15 - Representação dos Complexos de Índio obtidos com Ligantes Pironas (parte superior) e Piridonas (parte inferior).
Fonte: Orvig et al. (1988, p.3935).
Particularmente as formas inorgânicas de vanadato (VO4)3+ e vanadil (VO)2+ têm despertado interesse pela possibilidade de uso como agentes terapêuticos no combate da diabetes. Os vanadatos exibem relevância nos efeitos in vitro, entretanto in vivo, quando avaliados em ratos, apresentaram pobre absorção gastrointestinal, o mesmo acontecendo com
o vanadil. Para superar esse problema, tem-se buscado criar formulações de fácil absorção desses agentes terapêuticos administrados em baixa concentração. Por isso, na tentativa de obter compostos de vanádio, o bis(kójico)oxovanadio(IV), abreviado [VO(Ka)2], conforme representado na Figura 16, foi sintetizado e comparado ao seu análogo, que apresenta como ligante o maltol ao invés do ácido kójico. O complexo obtido foi caracterizado através de analise elementar, infravermelho, espectroscopia de massa, UV-vis e eletroquímica variando o pH (YUEN et al., 1997).
Figura 16 - Representação do Complexo de Oxovanádio com o Ácido Kójico.
38 Levando-se em consideração que tanto o ácido kójico quanto o maltol são substâncias antibióticas conhecidas por inibir o crescimento E. coli e S. aureus, e que esses ligantes na presença de íons metálicos originam complexos relativamente estáveis, devido a formação de um anel quelado de cinco membros, Jain R. sintetizou compostos de coordenação, reagindo organoestanho com ácido kójico e maltol, obtendo-se, conforme Figura 17, complexos de estanho com uma molécula do ligante coordenada de forma bidentada ao centro metálico. Os produtos formados tiveram suas atividades antibióticas testadas e comparadas com as dos ligantes livres. Nas amostras analisadas o poder inibitório dos complexos foi maior do que o dos ligantes, e os complexos de maltol exibiram melhor atividade do que os complexos de ácido kójico (JAIN; KAUSHIK, 1997).
Figura 17 - Proposta de representação para os complexos sintetizados com os ligantes ácido kójico e maltol a partir de organoestanho.
Fonte: Jain; Kaushik. (1997, p.716).
Em 2001, compostos de coordenação de Zinco (II) e estanho (II) foram sintetizados com os ligantes de maltol (Hmalt), etilmaltol (Hetmalt), tropolone (Htrop), hinokitiol (Hhino) e ácido kójico (Hkj), conforme Figura 18, sendo caracterizados por análise elementar e infravermelho. Com exceção dos complexos de ácido kójico e do complexo de tropolone com zinco, os demais também foram caracterizados através de RMN 1H e 13C. Além de obter estrutura do cristal para os compostos Zn(trop)2, Sn(trop)2, Sn(malt)2, Zn(hino)2.EtOH, em que o composto de tropolone com zinco apresentou uma estrutura polimérica (BARRET et
39
Figura 18 - Representação dos Ligantes.
R
Hinokitiol -R=C3H7 T ropolone -R=H O
O
OH
R
Etilmaltol - R=C2H5 Maltol - R=CH3
O O
OH
O H
Ácido Kójico O
OH
Fonte: Adaptado Barret et al. (2001, p.4384).
O ácido kójico e outras hidroxipironas são amplamente estudados devido a sua capacidade de coordenação a diversos íons metálicos, originando complexos com razoável estabilidade hidrolítica, carga neutra e relevante lipofilicidade (ZBOROWSKI et al., 2004). Para o tratamento de doenças como anemia e diabetes tem-se testado esses compostos como novos medicamentos.
Em trabalhos publicados em 2007, tem-se avaliado a atividade do ácido kójico e de seus complexos de manganês e zinco na atividade de radioproteção in vivo, e os resultados obtidos mostram que os compostos testados exibem efeitos de radioproteção contra doses letais de irradiação gama em ratos (EMAMI et al., 2007). De acordo com os resultados alcançados, essas substâncias podem ser empregadas em pacientes com câncer que sejam submetidos a tratamentos com radioquímica, para que dessa forma, possam atuar na proteção dos tecidos normais associados ao tumor, e também permitir a aplicação de doses de radiação mais elevadas, favorecendo a morte de mais células cancerosas do que normais. Então qualquer substância química que possa melhorar a tolerância, a resistência das células normais frente à radiação é de significativa relevância (EMAMI et al., 2007).
Em 2009, cinco novos complexos apresentando o fragmento (RuNO) foram produzidos mediante coordenação a biomoléculas, dentre elas a L-histidina e os ácidos rac-2,3-diaminopropionico, kójico, metiliminodiacetico e tiodiacetico. Os compostos sintetizados
com esses ligantes desprotonados, numerados respectivamente de 1 a 5, são visualizado na Figura 19, e foram caracterizados através de análise elementar, difração de raio-X e técnicas
40
Figura 19 - Representação dos Complexos de Rutênio.
Fonte: Zangl et al. (2009, p.1035).
Algumas caraterísticas dos complexos, como o equilíbrio ácido-base, semelhantemente ao tipo de ligações e estabilidade, são questões interessantes que devem ser
conhecidas mediante pretensão de atividades biológicas e melhorias de suas propriedades na projeção de novas substâncias. Visando obter conhecimento das propriedades dos compostos, Nurchi, em 2010, realizou o estudo do equilíbrio de formação dos complexos de ácido kójico e de seu derivado 6-[5-hidroxi-2-hidroximetil-piran-4-ona]-5-hidroxi-2-hidroximetil-piran-4-ona, com os íons metálicos de alumínio (III) e ferro (III), obtendo também resultados de raio-X para o complexo de ácido kójico e ferro, [Fe(kj)3] (NURCHI et al., 2010).
41
Figura 20 - Representação Estrutural dos Complexos de Metais de Transição com Ácido Kójico e L-prolina como Ligantes, onde M= Co (II), Ni (II) e Zn (II) (à esquerda) e M= Mn( II) (à direita).
Fonte: Sharma et al. (2011, p.380 e 381).
3.5.COMPLEXOS DE DERIVADOS DO ÁCIDO KÓJICO
De acordo com dados da literatura, dezenove compostos derivados do ácido kójico e
quatro de seus complexos de cobre, representados de forma esquemática na Figura 21, tiveram suas atividades testadas contra vinte e cinco tipos de fungos, obtendo-se resultados satisfatórios e concluindo-se que o aumento da lipofilicidade provavelmente produzirá mais análogos ativos (BALAZ et al., 1993).
Figura 21 - Representação Esquemática dos Compostos Derivados do Ácido Kójico.
Fonte: Balaz et al. (1993, p.387).
42 foram exibidos para os derivados de níquel, mostrando fortes efeitos antifúngicos (HUDECOVÁ et al., 1996).
Novos compostos de coordenação com os íons metálicos gálio, índio, ferro e cobre, foram obtidos através de um novo ligante macrocíclico, sintetizado a partir da reação entre o ácido kójico com 1,4,7-triazaciclononana, na presença de excesso de formaldeído, como demostrado na Figura 22. Todos os complexos obtidos, como representados estruturalmente na Figura 23, foram caracterizados por análise elementar, espectroscopia de massa, infravermelho e espectroscopia eletrônica Uv-Vis, sendo ainda os compostos de Ga, Fe e Cu também determinados por cristalografia de raio-X (YANG et al., 2008).
Figura 22 - Síntese do Ligante Macrocíclico 6,6′,6′′
-(1,4,7-triazonana-1,4,7-triil)tris(metileno)tris(5-hidroxi-2-(hidroximetil)-4H-piran-4-ona).
Fonte: Yang et al. (2008, p.2722).
Figura 23 - Representação do Ligante Macrocíclico e de seus Complexos Sintetizados.
Fonte: Yang et al. (2008, p.2720).
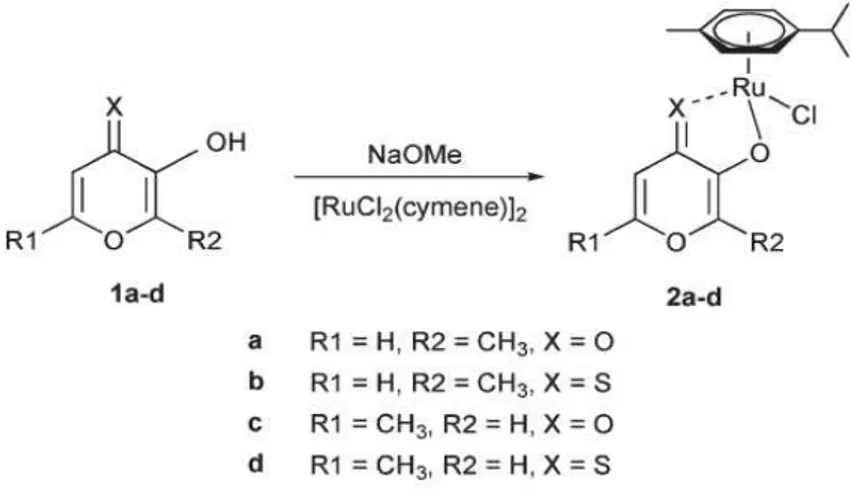
-p-43 cimeno)]rutênio(II) reagindo com os ligantes desprotonados, como por exemplo maltol e allomaltol, conforme visualizado na Figura 24 (KANDIOLLER et al., 2009).
Figura 24 - Síntese de Complexos de Rutênio-Cimeno Reagindo com Ligantes Pironas e Tiopironas.
Fonte: Kandioller et al. (2009,4249).
O peso molecular e a hidrofílicidade de uma substância são características que limitam acessibilidade de penetração na membrana plasmática, tendo em vista a sua natureza. Embora seja de extrema importância à existência de barreiras biológicas, que sejam seletivas no meio intracelular, impedindo a entrada de agentes invasores, também constituem um enorme desafio na atuação de agentes terapêuticos. Portanto, buscando-se aumentar a compatibilidade de substância com a membrana plasmática, Kwak e colaboradores em 2010, preparam compostos de coordenação com um derivado do ácido kójico, pela incorporação de um aminoácido e um grupo amino (Ak-F-NH2), que já apresenta atividade de inibir a tirosinase, complexados aos íons de cobre e zinco, objetivando aumentar a lipofilicidade e avaliar o efeito de inibição em sistemas celular. A complexação resulta na diminuição da característica
hidrofílica do ligante, pois bloqueia as ligações de hidrogênio (KWAK et al., 2010).
44
Figura 25 - Estrutura Química do Ácido Azidokojico.
Fonte: Sipos et al. (2011, p.1201).
É crescente o interesse por substâncias coordenantes a íons de ferro, participantes no tratamento de doença. Atualmente reagentes empregados nesse tipo de terapia são baseados
em grupos hidroxi substituintes piridononas ou em sistemas de anel aromático (NUCHI et al., 2011). Nas ultimas décadas vem se analisando que os elevados níveis de alumínio podem propiciar prejuízos à saúde, principalmente por esse elemento não desempenhar função essencial nos organismos vivos, sugerindo que a sua acumulação no cérebro pode ser responsável pelo desenvolvimento de doenças, como Alzheimer (KANDIOLLER et al., 2011).
Santos (2012) utilizou em seu trabalho um esquema representativo, como demostrado na Figura 26, evidenciando de forma ilustrativa as aplicações dos possíveis derivados dos hidroxipiridonas. Esses compostos quando atuando como ligantes podem capturar íons metálicos, como por exemplo, o ferro e o alumínio, que quando em excesso causam distúrbios e acarretam doenças, por esse motivo podem inibir doenças neurodegenerativas, evitar sobrecarga de metais no organismo (NUCHI et al., 2011) ou impedir o desenvolvimento de bactérias e protozoários que possuem o ferro como um micronutriente de extrema importância para a sua sobrevivência e proliferação (DEHKORDI et al., 2008). Dessa forma, essa classe de compostos funcionalizados exibe grande potencial farmacêutico.
A classe das hidroxipiridonas quando formando complexos, são usados como metalofármacos empregados para fins terapêuticos, como por exemplo, contra a diabetes e
câncer, e também podem ser utilizados em diagnósticos como agentes de contraste (SANTOS
et al., 2012). A elevada afinidade por íons metálicos e também por originarem complexos
45 de administração oral, como por exemplo, em complexos de vanádio, largamento estudado como alternativa no tratamento de diabetes (YUEN et al., 1997).
Figura 26 - Representação Esquemática do Potencial de Aplicação dos Hidroxipiridona, atuando como Ligante (cinza) e na Forma de Complexos, para Fins Terapêuticos (azul) e Aplicações em Diagnósticos (violeta).
Fonte: Santos et al. (2012, p.242).
3.6.TÉCNICAS INSTRUMENTAIS DE ANÁLISE
3.6.1. Espectroscopia de Absorção na Região do Infravermelho
A espectroscopia vibracional na região do infravermelho é uma técnica bastante empregada na caracterização estrutural de compostos químicos, fornecendo informações relevantes tanto a respeito dos grupos funcionais presentes em uma molécula quanto fornecendo informações a respeito de sua simetria (SILVERSTEIN et al., 2007; PAVIA et
al., 2010).
46 400 cm-1; e infravermelho distante, de 400 a 10 cm-1 (VOGEL, 2006), sendo a região mais utilizada na caracterização de compostos orgânicos e inorgânicos, a do infravermelho médio.
Na espectroscopia de infravermelho as moléculas absorvem radiações de frequências específicas que são características de sua estrutura. As frequências vibracionais das ligações em moléculas, íons ou radicais poliatômicos dependem da geometria, das massas reduzidas dos átomos envolvidos na ligação e das constantes de força das ligações (PAVIA et al., 2010).
As bandas observadas no espectro raramente correspondem ao número teórico de vibrações fundamentais, tendo em vista que são acompanhadas por vibrações harmônicas, correspondente a múltiplos de uma frequências fundamental, e por combinações de vibrações (SILVERSTEIN et al., 2007). Sendo então, as frequências aproximadas das deformações axiais ou estiramentos, determinadas usando-se a lei de Hooke, conforme a seguinte equação:
√
Sendo: = frequência vibracional (cm-1)
= velocidade da luz (cm/s)
= constante de força de ligação (dyn/cm)
= massa dos átomos x e y, respectivamente.
A constante de força de ligação ( ), presente na equação é analisada como uma
medida da rigidez da ligação, podendo ser, portanto, correlacionada com propriedades como a energia de ligação e a ordem de ligação. Assim, quanto maior a energia envolvida na ligação entre dois átomos, maior será a ordem de ligação e menor será o comprimento da ligação entre os átomos, portanto maior a rigidez e mais elevada será a constante de força. Vale ressaltar que o aumento da constante de força, que cresce na tabela periódica da esquerda para direita, tem efeito mais significativo do que o aumento das massas reduzidas dos átomos (SILVERSTEIN et al., 2007).
47 modificações nos ângulos de ligações. As deformações axiais por sua vez podem ser classificadas como simétricas e assimétricas, em que os modos simétricos referem-se a movimentos de contração e alongamento uniformes nas ligações, porém nos modos assimétricos os movimentos ocorrem sem uniformidade, ou seja, enquanto uma ligação se contrai a outra se estende (PAVIA et al., 2010).
As bandas presentes no infravermelho podem apresentar suas intensidades expressas em termos de absorbância (A) ou transmitância (T). A razão entre a energia radiante transmitida (I) pela energia radiante incidida (Io) na amostra é definida como transmitância,
enquanto a absorbância corresponde ao logaritmo decimal do inverso da transmitância, tendo como expressões matemáticas as equações:
Na química de coordenação, uma das aplicações mais conhecidas dessa técnica instrumental refere-se ao estudo de compostos que envolvem o ligante carbonila (CO). Este ligante é um forte oscilador, no sentido de apresentar bandas características de intensa absorção. Porém, quando coordenado observam-se alterações em suas frequências de estiramentos (SHRIVER, ATKINS, 2008), e essas mudanças no espectro de IV, possibilitam
um melhor entendimento dos sistemas moleculares contendo ligantes receptores.
3.6.2. Espectroscopia Eletrônica na Região do Ultravioleta e Visível
A Espectroscopia de absorção na região do ultravioleta e visível (Uv-Vis), também denominada de Espectroscopia eletrônica, compreende a região espectral de 190 a 1000 nm, com as radiações eletromagnéticas da região do visível, normalmente atribuídas à faixa entre 350 a 750 nm (PAVIA et al., 2010).
Quando um feixe de radiação com comprimento de onda nessa faixa é absorvida por um certo material, átomos ou moléculas passam do seu estado de menor energia, ou seja, estado fundamental, para um estado eletrônico excitado, de maior energia. Assim, a diferença

![Figura 48 - Espectro vibracional na região do infravermelho para o complexo [Al(kj) 3 ] na faixa de 1400 a 900](https://thumb-eu.123doks.com/thumbv2/123dok_br/15688035.117658/80.892.174.756.744.1123/figura-espectro-vibracional-região-infravermelho-para-complexo-faixa.webp)
![Figura 52 - Espectro vibracional na região do infravermelho para o complexo [Fe(kj) 3 ] na faixa de 1400 a 900](https://thumb-eu.123doks.com/thumbv2/123dok_br/15688035.117658/84.892.170.767.537.1024/figura-espectro-vibracional-região-infravermelho-para-complexo-faixa.webp)
![Figura 53 - Espectro vibracional na região do infravermelho para o complexo [Fe(kj) 3 ] na faixa de 900 a 400 cm](https://thumb-eu.123doks.com/thumbv2/123dok_br/15688035.117658/85.892.176.764.552.1026/figura-espectro-vibracional-região-infravermelho-para-complexo-faixa.webp)
![Figura 57 - Espectro vibracional na região do infravermelho para o complexo [Fe(kj) 2 ] na faixa de 900 a 400](https://thumb-eu.123doks.com/thumbv2/123dok_br/15688035.117658/90.892.176.759.198.691/figura-espectro-vibracional-região-infravermelho-para-complexo-faixa.webp)
![Figura 60 - Espectro vibracional na região do infravermelho para o complexo [Cu(kj) 2 ] na faixa de 1400 a 900](https://thumb-eu.123doks.com/thumbv2/123dok_br/15688035.117658/93.892.180.751.520.880/figura-espectro-vibracional-região-infravermelho-para-complexo-faixa.webp)
![Figura 63 - Espectro vibracional na região do infravermelho para o complexo [Ru(kj) 3 ] na faixa de 1800 a 1400](https://thumb-eu.123doks.com/thumbv2/123dok_br/15688035.117658/96.892.180.767.407.810/figura-espectro-vibracional-região-infravermelho-para-complexo-faixa.webp)