VINICIUS NAHIME DE BRITO
Estudo do gene da subunidade alfa-1 do receptor tipo A do
ácido gama-aminobutírico (
GABRA1
) e avaliação
eletroencefalográfica em meninas com puberdade precoce
dependente de gonadotrofinas
Tese apresentada ao Departamento de Clínica Médica da Faculdade de Medicina da Universidade de São Paulo para obtenção do título de Doutor em Ciências.
Área de concentração: Endocrinologia Orientadora: Profa. Dra. Ana Claudia Latronico Co-orientadora: Profa. Dra. Berenice Bilharinho de Mendonça
São Paulo
Agradeço todos os que direta ou indiretamente contribuíram para a realização deste trabalho. Algumas menções especiais:
Às pacientes e seus familiares, sem a colaboração dos quais não seria possível a realização deste estudo.
À Profa. Dra. Ana Cláudia Latronico, orientadora, admirável pela competência, pela ética, pelo brilho profissional e pessoal e ao mesmo tempo pela perspicácia, simplicidade e pela amizade, tornando o trabalho mais prazeroso. Agradeço especialmente a você pelo incentivo e pela dedicação aos seus alunos e amigos. Outro dia ainda pensei: - que pena que está terminando esta etapa...; e fiz uma avaliação da nossa convivência saudável e proveitosa nestes anos.
À Profa. Dra. Berenice Bilharinho de Mendonça, co-orientadora, percebo que num determinado momento as palavras não expressam minha gratidão pelo apoio, pelo ensinamento, pela oportunidade e pela amizade, resultando numa admiração cada vez maior. Obrigado pelo auxílio e orientação nos inúmeros trabalhos e apresentações, os quais são enriquecidos com suas brilhantes idéias e sugestões.
Ao Prof. Dr Ivo J. P. Arnhold, pelas valiosas discussões científicas e pelo apoio.
À Dra. Ana Elisa Correa Billerbeck, bióloga, pelo auxílio no trabalho de bancada, bem como pela constante disponibilidade em ensinar, e principalmente pela amizade.
À Emília Modolo Pinto, bióloga, além do apoio técnico, pela amizade. À Dra. Laura Maria de Figueiredo Ferreira Guilhoto, doutora em Neurologia, pelo auxílio na avaliação eletroencefalográfica, bem como pela constante disponibilidade em discutir os laudos e pelas sugestões que contribuíram para o enriquecimento do trabalho.
A Dra. Rosi Mary Grossimann, chefe da Secção de Eletroencefalografia da Divisão de Clínica Neurológica, pela disponibilidade.
Ao Prof. Dr. Paulo A Otto, geneticista do Instituto de Biociências da Universidade de São Paulo, pela sua importante colaboração na análise estatística.
Aos Funcionários do Ambulatório da Unidade de Endocrinologia do Desenvolvimento, representados pelo Sr. José.
Aos Funcionários do Laboratório de Hormônios e Genética Molecular LIM/42, especialmente as secretárias Francinilda da Silva P. Oliveira (Nildinha), Cristiane Sandri e Ana Lúcia Farah, além da Dona Alzira, Francisca, Cida, Mírian e Cristina.
Aos Colegas pós-graduados: Elaine Costa , Sorahia Domenice, Maria Candida Barisson Villares Fragoso, Tânia Bachega, Luciani Renata Carvalho, Rogerio Santiago, Rafaela Vieira Correa, Regina Martin, Alexander Jorge, pela colaboração e cooperação.
Aos Colegas pós-graduandos: Maria Edna, Karina Berger, Karina Cocco Monteiro Freitas, Márcia Helena, Frederico, Milena Teles, Rocio, Antonio, Catarina, pelo convívio e aprendizado mútuo.
Aos Residentes e estagiários da Disciplina de Endocrinologia e Metabologia que auxiliaram no atendimento dos pacientes.
Aos amigos, estas pessoas maravilhosas com quem tenho o imenso prazer de conviver: Fernando César Buttignol, pela amizade incondicional, pelo companheirismo; Leila Nascimento, pelo carinho e amizade; Lili, Zezinho, Gabriel e meu afilhado João, pela torcida e pelo apoio.
Aos meus pais e minha família, pelo apoio, compreensão e pela base sustentável na qual mesmo distante tenho sempre como modelo.
Finalmente, para Walt Whitman peço emprestadas algumas palavras:
“Eu ouvi o que os faladores estavam falando
Conversas sobre o início e o fim
Mas não falo sobre o início nem o fim,
Nunca houve mais começo do que há agora
Nem mais juventude ou velhice do que há agora,
E nunca haverá mais perfeição do que há agora,
SUMÁRIO
Lista de Abreviaturas Lista de Símbolos Lista de Tabelas Lista de Figuras Resumo
Summary
1 . Introdução... 1
1.1 – Diagnóstico clínico e laboratorial da puberdade precoce dependente de gonadotrofinas ... 6
1.2 – GABA e puberdade ... 8
1.3 – A superfamília dos receptores de canais iônicos abertos por ligantes (Ligand-Gated Ion Channel – LGICs)... 12
1.4 – Estrutura molecular do gene da subunidade α1 do receptor GABAA... 13
1.5 – Puberdade e epilepsia... 15
1.6 – GABA nos distúrbios puberais e neuropsiquiáticos... 16
2 – Objetivos... 19
3 – Métodos... 20
3.1 – Casuística... 20
3.2 – Cálculo da taxa de penetrância gênica... 22
3.3 – Extração de DNA genômico ... 22
3.4 – Reação de polimerização em cadeia (PCR)... 24
3.5 – Seqüenciamento automático... 25
3.6. – Predição de mudança do sítio de splice... 25
3.7 – Determinação do número de repetições GT do polimorfismo IVS2 –712(GT)n... 26
3.8 – Digestão enzimática... 27
3.9 – Estudo eletroencefalogáfico... 28
3.10 – Análise estatística... 28
4 – Resultados... 30
4.1 – Forma familial da Puberdade precoce: freqüência e modo de herança.... 30
4.2 – Dados clínicos e laboratoriais... 30
4.3 – Estudo molecular... 32
4.4 – Estudo eletroencefalográfico... 35
5 - Discussão... 37
6 – Conclusões... 44
7 – Anexos... 46
LISTA DE TABELAS
Tabela 1 – Oligonucleotídeos iniciadores e condições de amplificação por PCR da região codificadora do GABRA1... 46
Tabela 2 - Dados clínicos das meninas com a forma idiopática de PPDG... 47 Tabela 3 - Dados hormonais das meninas com a forma idiopática de
PPDG... 49 Tabela 4 - Genótipo do GABRA1 nas meninas com a forma idiopática
de PPDG... 50 Tabela 5 - Distribuição genotípica e freqüência alélica dos
polimorfismos exônicos em meninas com a forma idiopática de PPDG e nos controles... 51 Tabela 6 - Freqüência alélica do polimorfismo IVS2-712(GT)n nas
meninas com a forma idiopática de PPDG e nos controles... 52 Tabela 7 - Distribuição genotípica do polimorfismo IVS2-712(GT)n nas
meninas com a forma idiopática de PPDG e nos controles... 53 Tabela 8 - Comparação entre os genótipos com e sem o alelo (GT)12
nas meninas com a forma idiopática de PPDG e nos controles... 54 Tabela 9 - Comparação entre os genótipos com e sem o alelo (GT)17
nas meninas com a forma idiopática de PPDG e nos controles... 54 Tabela 10 - Distribuição genotípica e freqüência alélica dos
polimorfismos intrônicos nas meninas com a forma idiopática de PPDG... 55 Tabela 11 - Comparação da distribuição genotípica e da freqüência
alélica dos polimorfismos do GABRA1 entre as pacientes
com PPDG com EEG normal e anormal... 56 Tabela 12 - Distribuição genotípica do polimorfismo IVS2-712(GT)n nas
pacientes com PPDG com EEG normal e anormal... 57 Tabela 13 - Freqüência alélica do polimorfismo IVS2-712(GT)n naspacientes com PPDG com EEG normal e
LISTA DE FIGURAS
Figura 1- Fatores regulatórios da secreção de GnRH... 58
Figura 2 - Representação esquemática do GABRA1... 59
Figura 3 - Modelo molecular da subunidade α1 do receptor GABAA... 60
Figura 4 - Heredograma das 3 famílias com as 6 pacientes com a forma idiopática de PPDG... 61
Figura 5 - Representação esquemática do GABRA1 com a localização dos polimorfismos exônicos e intrônicos do GABRA1... 62
Figura 6 - Polimorfismo exônico silencioso 156T>C... 63
Figura 7 - Polimorfismo exônico silencioso 1323G>A ... 63
Figura 8 - Digestão enzimática para estudo do polimorfismo 1323 G>A em controles... 64
Figura 9 - Estudo do polimorfismo IVS2-712(GT)n, localizado no íntron 2. Resultados obtidos pelo GeneScan e pelo sequenciamento automático... 65
Figura 10 - Artefato in vitro no sequenciamento automático de uma região rica em base timina (T) no íntron 9... 66
Figura 11 - EEG - Caso 13... 67
Figura 12 - EEG - Caso 19... 67
Figura 13 - EEG - Caso 29... 68
Figura 14 - EEG - Caso 30... 68
Figura 15 - EEG - Caso 14... 69
LISTA DE ABREVIATURAS
A Adenina
Asp Ácido aspártico
C Citosina
DNA Ácido desoxirribonucleico
DP Desvio-padrão
EEG Eletroencefalograma et al. e outros
FIE Fluoroimunoensaio
FSH Hormônio folículo-estimulante
G Guanina
GABA Ácido gama-aminobutírico GABAA Receptor tipo A do GABA
GABRA1 Gene que codifica a subunidade α1 do receptor GABAA
GAD Descarboxilase do ácido glutâmico
Gly Glicina
GnRH Hormônio liberador de gonadotrofinas IC Idade cronológica
IFME Ensaio imunofluorométrico
IO Idade óssea
LH Hormônio luteinizante
LIM Laboratório de Investigação Médica
Lys Lisina
NPY Neuropeptídeo Y
pb Pares de base
PCR Reação de polimerização em cadeia
PPDG Puberdade precoce dependente de gonadotrofinas RIE Radioimunoensaio
RNAm RNA mensageiro
SNC Sistema Nervoso Central
T Timina
LISTA DE SÍMBOLOS
α alfa (A)
β beta B)
γ gama (G)
δ delta (D)
η eta (H)
ρ rô (R)
> maior que ≥ maior ou igual a < menor que
± mais ou menos
% por cento
°C graus Celsius
µg/mL micrograma por mililitro µl Microlitro
µM Micromol
mg Miligrama
mg/mL miligrama por mililitro
mM Milimol
ng Nanograma
pg/mL picogramas por mililitro
U Unidade
U/L Unidades por litro
Kb Kilobase
RESUMO
BRITO, V.N. Estudo do gene da subunidade alfa-1 do receptor tipo A do ácido gama-aminobutírico (GABRA1) e avaliação eletroencefalográfica
em meninas com puberdade precoce dependente de gonadotrofinas. [tese] São Paulo: Faculdade de Medicina, Universidade de São Paulo; 2005. 75p.
O ácido gama-aminobutírico (GABA), principal neurotransmissor inibitório, está envolvido no mecanismo intrínseco do início da puberdade. Os efeitos inibitórios do GABA sobre a secreção de GnRH (hormônio hipotalâmico estimulador da secreção das gonadotrofinas) são mediados pelo receptor tipo A (GABAA) que é composto por diferentes subunidades organizadas de
forma heteropentamérica. A subunidade α1, codificada pelo gene GABRA1
localizado no locus 5q34-35, é a mais implicada na atividade inibitória do
GABA. A puberdade precoce dependente de gonadotrofinas (PPDG) predomina no sexo feminino, sendo na maioria dos casos idiopática. Recentemente, defeitos moleculares das subunidades dos receptores de GABA têm sido identificados em pacientes com anormalidades eletroencefalográficas específicas. Neste estudo, investigamos a presença de mutações funcionais ou polimorfismos do GABRA1 em meninas com a
forma idiopática de PPDG e avaliamos as anormalidades EEG neste grupo. Trinta e uma meninas com diagnóstico clínico e hormonal da forma idiopática da PPDG, sendo 6 casos familiais (19,4%) e 25 casos esporádicos (80,6%), e 73 controles não relacionados foram selecionados. Todas as pacientes com PPDG apresentaram ressonância magnética de sistema nervoso central normal. Vinte e três meninas foram submetidas a estudo eletroencefalográfico (EEG). O DNA genômico foi extraído do sangue periférico de todas as pacientes e controles. A região codificadora do
GABRA1 foi amplificada utilizando-se oligonucleotídeos intrônicos
específicos, seguida por purificação enzimática e seqüenciamento automático. Dois polimorfismos conhecidos do GABRA1 foram também
mutações funcionais. Identificamos 7 polimorfismos no GABRA1: duas
variantes exônicas 156T>C e 1323G>A, localizados no éxons 4 e 11, respectivamente, e 5 polimorfismos intrônicos - IVS2-712(GT)n, no íntron 2, caracterizado por número variável de repetições GT; IVS3+12A>T, no íntron 3; IVS8+45T>G no íntron 8; IVS9+76T>G no íntron 9 e IVS10+15G>A, no íntron 10. Estes polimorfismos não alteram o uso do sítio de splice original.
Não houve diferença estatisticamente significante entre a distribuição genotípica e a freqüência alélica dos 2 polimorfismos exônicos e do polimorfismo IVS2-712(GT) encontrados no grupo de pacientes e no grupo controle. O EEG revelou anormalidades em 6 de 23 meninas (4 sem epilepsia). A distribuição genotípica e a freqüência alélica dos polimorfismos
do GABRA1 não difereriram significativamente entre as pacientes com
PPDG sem e com anormalidades eletroencefalográficas. Nós concluímos que mutações funcionais ou polimorfismos no GABRA1 não estão
envolvidos na etiologia da forma idiopática da PPDG e não estão associadas às anormalidades eletroencefalográficas encontradas. Adicionalmente, a presença de alterações eletroencefalográficas em pacientes com PPDG sem epilepsia sugere que a análise eletroencefalográfica deva ser incluída na investigação da PPDG
SUMMARY
BRITO, V.N. Study of the gamma-aminobutyric acid type A receptor alpha-1 subunit gene (GABRA1) and electroencephalographic analysis
in girls with gonadotropin-dependent precocious puberty [thesis]. São Paulo: Faculdade de Medicina, Universidade de São Paulo; 2005. 75p.
The gamma-aminobutyric acid (GABA), a dominant inhibitory neurotransmitter, is involved in the intrinsic mechanism of the onset of the puberty. Their inhibitory effects on the GnRH (hypothalamic gonadotropin release hormone) secretion are mediated by type A receptor (GABAA),
composed by different subunits which are organized in a heteropentameric form. The alpha-1 subunit, encode by GABRA1 gene located at locus
5q34-35, is the most implicated in the inhibitory activity of GABA. The gonadotropin-dependent precocious puberty (GDPP) is predominant in females, being idiopathic in the majority of the cases. Recently, molecular defects of the GABA receptor subunits have been identified in patients with specific electroencephalographic (EEG) abnormalities. In this study, we investigated the presence of functional mutations or polymorphisms of the
GABRA1 in girls with the idiopathic form of the GDPP and evaluated EEG
abnormalities in this group. Thirty-one girls with clinical and hormonal diagnosis of GDPP idiopathic form, being 6 familial cases (19.4%) and 25 sporadic cases (80.6%), and 73 unrelated controls were selected. All patients with GDPP had normal magnetic resonance of central nervous system. Twenty-three girls were submitted to electroencephalographic study. Genomic DNA was extracted from peripheral blood of all patients and controls. The entire coding region of the GABRA1 was amplified using
specific intronic oligonucleotides, followed by enzymatic purification and automatic sequencing. Two known polymorphisms of the GABRA1 were also
studied by GeneScan software and digestion with restriction endonuclease
TaiI. The automatic sequencing of the GABRA1 did not reveal any functional
mutations. We identified 7 polymorphisms in the GABRA1: two silent exonic
polymorphisms - IVS2-712(GT)n, at intron 2, characterized by a variable number of repeat GT; IVS3+12A>T, at intron 3; IVS8+45T>G at intron 8; IVS9+76T>G at intron 9 and IVS10+15G>A, at íntron 10. These polymorphisms did not alter the use of original splicing site. No significant statistical difference of the genotypic distribution and allele frequency of the exonic polymorphisms (156T>C and 1323G>A) and IVS2-712(GT)n between unrelated patients and control group was obtained. Electroencephalographic tracings were abnormal in 6 of 23 girls (4 without epilepsy). No significant statistical difference of the genotype distribution and allele frequence were found between patients without and with EEG abnormalities. We conclude that functional mutations or polymorphisms in the GABRA1 are not involved
in the etiology of idiopathic GDPP in this study, and they are not associated with electroencephalografic abnormalities. In addition, EEG abnormalities present in girls with GDPP without epilepsy, suggest that EEG analysis should be included in the investigation of the precocious puberty.
1 - INTRODUÇÃO
A puberdade compreende o período de transição entre a infância e a idade adulta quando ocorrem os caracteres sexuais secundários, o estirão do crescimento, a produção dos gametas maduros (esperma ou oócito) com conseqüente aquisição da função reprodutiva1,2. Estas mudanças físicas sãoacompanhadas de relevantes alterações psicológicas. A puberdade tem início a partir do aumento da amplitude da secreção pulsátil do hormônio decapeptídeo de origem hipotalâmica, liberador de gonadotrofinas (GnRH), que estimula a secreção hipofisária das gonadotrofinas - LH (hormônio luteinizante) e FSH (hormônio folículo-estimulante). O LH, considerado o principal hormônio da puberdade, exerce os seus efeitos através do seu receptor, estimulando a síntese e a secreção dos esteróides gonadais: testosterona nos testículos e estradiol nos ovários1. No período fetal e pós-natal, a elevada atividade do eixo gonadotrófico, caracterizada pela alta secreção pulsátil do GnRH e conseqüentemente das gonadotrofinas, é seguida por um período de baixa atividade na infância, o chamado período quiescente. Posteriormente, a reativação da secreção de GnRH desencadeia o processo puberal1-3. O mecanismo responsável pela inibição do pulso gerador de GnRH durante a infância e sua posterior reativação tem sido objeto de vários estudos experimentais e clínicos.
Hohlweg3,4 e baseia-se na observação de que doses pequenas de estrógenos podem suprimir o aumento das gonadotrofinas em ratos imaturos após castração. De acordo com esta hipótese, a puberdade inicia-se quando o sistema envolvido na secreção de gonadotrofinas torna-se menos sensível a inibição por retro-alimentação dos esteróides, permitindo a secreção de LH e FSH. A segunda hipótese, atualmente a mais aceita, envolve a inibição central da secreção de GnRH independente da inibição exercida pelos esteróides gonadais3,5. Esta hipótese baseia-se no fato de que a secreção
das gonadotrofinas em macacos submetidos a gonadectomia e em humanos portadores de disgenesia gonadal está elevada durante o período neonatal, mas sofre posterior supressão e permanece reduzida até o início da puberdade. Medidas diretas do GnRH na eminência média de macacos
Rhesus também reforçam esta hipótese6. Portanto, o início da puberdade é
dependente de um mecanismo central que controla a secreção pulsátil do GnRH.
Vários neurotransmissores e neuromoduladores apresentam propriedades excitatórias e/ou inibitórias sobre a secreção de GnRH1,3. O ácido gama-amino butírico (GABA), neuropeptídeo Y (NPY), opióides endógenos, β endorfinas e melatonina são os principais neurotransmissores
inibitórios, enquanto a glicina, glutamato, norepinefrina, dopamina, prostagandinas, serotonina, fatores de crescimento derivados da glia, tais como TGFα e β (fatores de crescimento de transformação), IGF-1 (fatores
A leptina, hormônio secretado principalmente pelos adipócitos, tem sido implicada no início da puberdade humana1,7. No entanto, as
evidências obtidas através dos estudos em modelos animais e em humanos apontam para um papel permissivo deste hormônio no eixo reprodutivo. A leptina atua como mediadora do tônus de GnRH, e não como desencadeadora do processo puberal2,7. As principais evidências que
favorecem o papel mediador da leptina são: 1- não ocorre uma aumento na leptina circulante no início da puberdade1,8, 2 - em meninas pré púberes e no
início da puberdade, o aumento dos níveis de leptina não correlaciona-se com o aumento nos níveis de estradiol1,9, 3 - no atraso constitucional do
crescimento e puberal, um aumento nos níveis de leptina não é essencial para o início da puberdade1,10, 4 - no diabetes lipoatrófico congênito, apesar da ausência de tecido adiposo visceral e subcutâneo e consequentemente, hipoleptinemia severa, a puberdade pode ocorrer na idade normal e a fertilidade é relatada1,11. Por outro lado, em situações de deficiência severa
de leptina, alguns relatos atribuem um papel fundamental da leptina no início do processo puberal: a deficiência congênita de leptina ou a resistência a leptina devido a mutações no gene da leptina ou no seu receptor, respectivamente, são associadas a atraso puberal e hipogonadismo hipogonadotrófico1,12,13. Os fatores regulatórios da secreção de GnRH nas
diferentes fases do desenvolvimento estão sumarizados na Figura 1.
processo puberal1,2. O período de início da puberdade humana está relacionada com fatores ambientais, sócio-culturais, étnicos e econômicos14.
No entanto, evidências recentes apontam para uma influência genética no início da puberdade, dentre elas: a correlação entre a idade de menarca entre mãe e filha; a variação entre os diferentes grupos raciais e os estudos em gêmeos demonstrando que os eventos puberais ocorrem com maior concordância cronológica entre gêmeos monozigóticos do que em dizigóticos14,15. Entretanto, a modulação genética da idade de início da
puberdade provavelmente decorre do efeito aditivo de múltiplos genes, não exibindo um padrão clássico de herança Mendeliana14.
Uma recente análise de 156 casos de puberdade precoce dependente de gonadotrofinas (PPDG) (147 meninas e 9 meninos) revelou que 43 destes casos (42 meninas e 1 menino) (27,5%) eram de origem familiar. A análise da segregação nestas famílias sugeriu um modo de herança autossômica dominante com penetrância incompleta, sexo-dependente16.
Inúmeros defeitos monogênicos implicados nos distúrbios puberais têm sido descritos, explicando algumas condições de precocidade e de atraso puberal17. Mutações nos genes do receptor de LH, da 21-hidroxilase, 11-21-hidroxilase, 3β-hidroxiesteróide-desidrogenase, aromatase,
(hipoplasia adrenal congênita), SF-1 (fator esteroidogênico-1), PC-1 (pro
hormônio convertase-1), da leptina, do receptor do GnRH, PROP-1 (na
deficiência hipofisária combinada), FSHβ (subunidade β do receptor de
FSH), FSHR (receptor de FSH), LHβ (subunidade β do receptor de LH), LHR
(receptor de LH), da aromatase, da 5α redutase, do receptor estrogênico e
do receptor androgênico, e mais recentemente no gene GPR 5417,18.
Embora tais defeitos monogênicos expliquem alguns casos de precocidade sexual independente de gonadotrofinas (PPIG) ou pseudo puberdade precoce, a etiologia da puberdade precoce dependente de gonadotrofinas (PPDG) ou puberdade precoce central , situação na qual o eixo gonadotrófico apresenta reativação precoce, permanece desconhecida. Hamartomas hipotalâmicos, lesões tumorais, infecções, traumas e irradiação do SNC, são fatores conhecidos na ativação precoce do eixo gonadotrófico19. No entanto, a maioria (80%) não apresenta causa orgânica detectável e é classificada como idiopática19. Considerando que fatores
genéticos estão implicados nesta etiologia, torna-se necessária a compreensão dos mecanismos envolvidos na regulação da secreção de GnRH. Nessa direção, estudos de alguns genes candidatos para explicar esta patologia têm sido de interesse crescente14.
Historicamente, o primeiro gene examinado neste contexto foi o do próprio GnRH (GnRH-I). Concluiu-se que a regulação transcricional do
GnRH-I não tem papel crítico no início da puberdade2. O conceito de que as
desenvolvimento sexual precoce levou posteriormente a investigação destes neurotransmissores que regulam a secreção de GnRH, principalmente GABA e neuropeptideo Y (NPY), sendo então objeto de intensa investigação em modelos animais1-3,20-22. Os resultados evidenciam o papel de ambos na secreção de GnRH. A utilização de bloqueadores de receptores específicos tanto do GABA quanto do NPY provocou aumento da secreção de GnRH e consequentemente desenvolvimento de puberdade20,22. Estes resultados indicam que o GABA e o NPY são fundamentais na redução da atividade e inibição do eixo gonadotrófico na fase pré puberal.
1.1 - Diagnóstico clínico e laboratorial da puberdade precoce
dependente de gonadotrofinas
O diagnóstico clínico da precocidade sexual é baseado na idade de aparecimento e desenvolvimento dos caracteres sexuais secundários em ambos os sexos. É considerada precoce, a puberdade que se inicia antes dos 8 anos nas meninas e dos 9 anos nos meninos19. A história clínica deve enfatizar a cronologia e a velocidade de aparecimento dos caracteres sexuais secundários, o uso de medicamentos por via oral ou tópica, história de trauma crânio encefálico, infecções do SNC, ocorrência de menarca no sexo feminino, bem como uma história familiar detalhada sobre o processo puberal dos pais e parentes mais próximos.
estadiamento dos caracteres sexuais secundários baseia-se nos critérios de Tanner & Marshall23,24.
O diagnóstico laboratorial objetiva diferenciar a forma dependente da independente de gonadotrofinas através da demonstração da ativação ou não do eixo hipotálamo-hipófise-gonadal. Com a utilização de métodos laboratoriais mais sensíveis e específicos, como o método imunofluorométrico (IFME), a dosagem de gonadotrofinas, principalmente do hormônio luteinizante (LH), em condição basal permite o diagnóstico de ativação do eixo hipotálamo-hipófise-gonadal em ambos os sexos. No entanto, valores de LH em condição basal em nível pré-puberal não afastam a possibilidade de ativação do eixo, tornando necessária a realização do teste de estímulo com GnRH exógeno25.
Na avaliação por imagem, o raio X de punho e mão esquerda para avaliação da idade óssea, ultrassom pélvico e ressonância magnética do sistema nervoso central (SNC) são úteis no diagnóstico da puberdade precoce e contribuem na monitorização das pacientes19.
1.2 - GABA e puberdade
GABA é considerado o principal neurotransmissor com ação inibitória dominante no hipotálamo médio basal 1-3. Neurônios pré sinápticos sintetizam o GABA a partir da descarboxilação do glutamato na presença da descarboxilase do ácido glutâmico (GAD). O GABA é estocado em vesículas e secretado por exocitose na presença de cálcio extracelular3. Duas formas de GAD com diferente peso molecular são identificadas: GAD67 e GAD65, e são codificadas por dois genes distintos 3,26. Ambas as formas de GAD estão presentes em várias regiões do cérebro, porém com distribuição variável27.
Três diferentes receptores do GABA (A, B e C) foram identificados no cérebro3. Os receptores GABAA e GABAC estão localizados na
membrana e pertencem a superfamília dos receptores de canais iônicos abertos por ligante (Ligand-Gated Ion Channel - LIGCs), enquanto o receptor
GABAB está acoplado aos canais de cálcio e potássio e às proteínas
guanosina-trifosfato (GTP) 3. O receptor GABA
C é um canal de cloro sendo
identificado predominantemente na retina de vertebrados3.
Os receptores GABAA são os mediadores da inibição exercida
pelo GABA na secreção do GnRH, sendo portanto, particularmente importante na determinação do início da puberdade3,28. A inibição
GABAérgica no período da infância ocorre por um mecanismo direto sobre os neurônios secretores de GnRH que possuem receptores GABAA, e
glutamatérgicos que são primariamente excitatórios sobre os neurônios secretores de GnRH1,3. Conseqüentemente, no período pré puberal
observa-se uma baixa liberação de GnRH.
A ligação do GABA ao seu receptor promove um influxo de cloro (Cl-) que causa hiperpolarização do neurônio secretor de GnRH e
conseqüente inibição da atividade neuronal 3.
Os receptores GABAA são canais iônicos permeáveis ao cloro, e
em menor escala, ao bicarbonato. A ação de GABA nos receptores GABAA
depende do potencial de ação da membrana e da concentração do cloro intracelular. Este último evento está sob regulação de um mecanismo homeostático do cloro 3. Na maioria dos neurônios maduros, a baixa
concentração intracelular de cloro (<10 nM) é mantida por um co-transportador de cloro neurônio-específico acoplado ao potássio, KCC-2, o qual é amplamente expresso no cérebro adulto, mas pouco expresso em cérebro fetal/neonatal 29-31.
DeFazio et al.29, examinaram o efeito direto do GABA sobre os
neurônios secretores de GnRH, e definiram a expressão dos co-transportadores envolvidos na homeostase do cloro. Em contraste com outros trabalhos 32, os autores concluíram que a ativação sináptica dos receptores GABAA tem efeito excitatório sobre os neurônios secretores de
receptor GABAB, sendo este tipo de receptor capaz de mediar, de forma
direta e potente, os impulsos inibitórios GABAérgicos sobre a atividade do neurônio de GnRH. Uma interação de duas forças opostas, uma excitatória mediada pelos receptores GABAA e outra inibitória mediada pelos receptores
GABAB seria responsável pela regulação homeostática da secreção de
GnRH. A ação inibitória induzida pela ativação dos receptores GABAA sobre
a secreção de GnRH, deve ser consequência da ação inibitória do GABA sobre o sistema neuronal excitatório conectado transinapticamente aos neurônios de GnRH 29.
Até o momento, são conhecidas 18 subunidades geneticamente diferentes (α1-6, β1-4, γ1-4, δ, η, ρ1-2) que participam da composição do
receptor GABAA3. O receptor GABAA apresenta estrutura heteropentamérica,
ou seja, cinco diferentes subunidades agrupadas formando um canal iônico
1-3. A forma mais expressa no SNC é a α1β2γ2 que está organizada na razão
2:2:12,3. As características funcionais e farmacológicas do receptor GABA A
são determinadas pela composição das subunidades. A distribuição das subunidades no cérebro difere durante os períodos de desenvolvimento pré-natal e pós-pré-natal. A expressão da subunidade ·2 está muita elevada antes do nascimento e sofre redução gradual após o nascimento, enquanto a expressão da subunidade α1 é mínima antes do nascimento e aumenta gradualmente após o nascimento até a idade adulta. De fato, os receptores GABAA contendo a subunidade α2 são substituídos pelos receptores
indica a maturação cerebral e o início da inibição sináptica exercida pelo GABA 3,32. Portanto, a subunidade α1 que compõe o receptor GABAA é a
mais implicada na inibição sináptica exercida pelo GABA.
Em macacos Rhesus do sexo feminino, o papel do GABA como
importante inibidor da secreção de GnRH foi demonstrada pelas seguintes observações: 1- a secreção de GABA no SNC está reduzida no início da puberdade 21,33; 2- a infusão de GABA no SNC suprime a secreção de GnRH apenas no início da puberdade 33; 3- a infusão de bicuculine, um antagonista
do receptor GABAA, ou de oligonucleotídeos antisense para o RNAm do
GAD no SNC estimula a secreção de GnRH em macacos prépuberes 21,33 4-a infusão crônic4-a de bicuculine n4-a b4-ase do terceiro ventrículo induz 4-a puberdade precoce 20. Em contraposição aos achados descritos acima, ElMajdoubi et al.19 recentemente demonstraram que o RNAm do GAD não
sofre alterações antes do início da puberdade em macacos do sexo masculino, sugerindo que a síntese do GABA não difere nos períodos pré puberal e puberal no sexo masculino. Este dado reforça o dimorfismo sexual no papel do GABA como inibidor da secreção pulsátil do GnRH. As evidências sugerem que o GABA exerce um papel proeminente na regulação da secreção do GnRH no sexo feminino, enquanto que o NPY seria mais importante no sexo masculino 2.
neurônios induz o aumento da secreção de GnRH levando ao início do processo puberal 1-3,32. Entretanto, outros peptídeos e neurotransmissores,
tais como NPY, glicina, norepinefrina, endorfinas, TGFα e β participam
simultaneamente da complexa regulação da reativação da secreção pulsátil do GnRH. Devido ao fato de vários genes no SNC estarem sendo ativados e desativados estabelecendo uma complexa cascata de eventos, é possível que “genes mestres” ainda desconhecidos controlem o início da puberdade
normal 3.
1.3 - A superfamília dos receptores de canais iônicos abertos por
ligante (Ligand-Gated Ion Channel – LGICs)
A superfamília dos receptores de canais iônicos abertos por ligantes é constituída pelos receptores nicotínicos, pelo receptor 5-HT3 de serotonina, pelos receptores GABAA e GABAC, pelos receptores de
glutamato e de glicina34. São receptores de membrana, formados por
dos receptores de acordo com o ligante endógeno é sumarizada no quadro abaixo 34:
Superfamília dos receptores nicotinicóides Família dos receptores nicotínicos
Subfamilía dos receptores endoteliais
Subfamília dos receptores neuronais sensíveis a α-bungarotoxina Subfamília dos receptores musculares
Subfamília dos receptores neuronais heteroméricos Subfamília dos receptores neuronais protostomianos Família dos receptores de serotonina
Família dos receptores de GABA
Subfamília dos receptores de GABAA Subfamília dos receptores de GABAC Família dos receptores agonistas variáveis Subfamília dos receptores de GABA Subfamília dos receptores de glutamato Subfamília dos receptores de glicina
Superfamília dos receptores excitatórios de glutamato
Família dos receptores excitatórios de glutamato Subfamília das subunidades de receptores NMDA Subfamília de subunidades de receptores de AMPA Subfamília de subunidades de receptores Kainato Subfamília de proteínas ligadoras ao kainato Subfamília de subunidades delta
Superfamília dos receptores ATP
Família dos receptores ATP
1.4 Estrutura molecular do gene GABRA1 e da subunidade α1 do
receptor GABAA
5q34-35 e 4p13-p12, respectivamente. Em 1992, Johnson et al.38, confirmaram a localização do GABRA1 na porção distal 5q. Dez anos após o
mapeamento da isoforma da subunidade do receptor, Russek 39 caracterizou
o GABRA1, como membro de um cluster de genes distribuídos em
aproximadamente 480 Kb no cromossomo 5q 34.
O gene GABRA1 é constituído de 11 éxons
(www.ncbi.nlm.nhi.gov - NT_023133), sendo que os éxons 3 a 11 codificam uma proteína de membrana de 456 aminoácidos. Esta proteína é constituída por uma ampla região aminoterminal extracelular, 4 domínios transmembrana (TM1, TM2, TM3 e TM4) e uma curta região intracelular carboxiterminal. O domínio extracelular contém uma região altamente conservada, chamada alça de Cys. Os domínios TM3 e TM4 são ligados por uma alça citosólica de comprimento variável. Todas estas características são encontradas nos receptores nicotínicos de acetilcolina, receptores de glicina e de serotonina, que pertencem à mesma superfamília 34. A representação
esquemática do GABRA1 está apresentada na Figura 2.
Recentemente, Kash et al.40 demonstraram que o perfeito funcionamento do receptor GABAA depende de interações eletrostáticas
do canal iônico. O modelo computacional da estrutura terciária da subunidade α1 do receptor GABAA está representado na Figura 3.
1.5 – Puberdade e Epilepsia
A relação entre epilepsia e alterações endocrino-reprodutivas foi registrada primeiramente na literatura por Locock, em 1857, por Gowers, em 1893, e um pouco mais tarde, por Turner, em 1907 41. Esses autores
observaram que, em meninas, havia uma tendência de início da epilepsia com a puberdade assim como de reinício de crises convulsivas durante a puberdade. A associação entre puberdade precoce e epilepsia também foi previamente relatada 42,43. É possível que o aumento dos esteróides gonadais possa sensibilizar neurocircuitos envolvidos na epileptogênese, mas também se especula que a desinibição GABAérgica que ocorre no início da puberdade possa estar envolvido na precocidade sexual e na gênese da epilepsia3,42,43.
36,8% delas, também caracterizadas por paroxismos e ondas lentas difusas45.
Sendo o eletroencefalograma (EEG) uma técnica não invasiva que avalia a atividade elétrica do córtex cerebral e de forma indireta a atividade dos neurotransmissores, incluindo a atividade GABAérgica46,47,
mais recentemente alguns trabalhos relacionam anormalidades eletroencefalográficas com alterações específicas nos receptores GABAérgicos48.
A relação entre as anormalidades eletroencefalográficas descritas nas crianças com precocidade sexual e possíveis defeitos genéticos envolvendo as subunidades dos receptores GABAA poderiam justificar
ambos os achados e consiste numa estratégia interessante e original de investigação.
1.6 –GABA nos distúrbios puberais e neuropsiquiátricos
Algumas evidências clínicas suportam o papel do GABA como um dos reguladores da secreção de GnRH. Bourguignon et al.49, em 1997,
descreveram um caso clínico de uma menina de 11 meses com hiperglicinemia não cetótica, anormalidade metabólica resultante de um defeito genético na metabolização da glicina, que apresentava crises convulsivas e desenvolveu puberdade precoce que involuiu após o uso de loreclezol e vigabatrina, ambos agonistas GABAérgicos. Estudos in vitro em
concentrações de glicina aumentaram a secreção do GnRH49. Loreclezol e vigabatrina além de controlar as crises convulsivas, suprimiram o aumento na frequência da secreção pulsátil de GnRH49. Estas observações sugeriram que tanto a glicina, um neurotransissor excitatório da secreção de GnRH, como o GABA, um neurotransmissor inibitório estão envolvidos no início do processo puberal49.
Puberdade atrasada tem sido observada em meninos epilépticos tratados com valproato de sódio, uma droga com atividade GABAérgica
3,50,51.No entanto, a farmacologia do valproato de sódio é complexa e há
outros relatos de que esta e outras drogas anti-epilépticas não retardam o início da puberdade3,50.
O tratamento da epilepsia com agonistas GABAérgicos (valproato de sódio) em mulheres jovens resultou em maior incidência de síndrome dos ovários policísticos (SOP) com secreção elevada de testosterona3,52. Considerando que a SOP ocorre habitualmente durante o período puberal, especula-se que a irregularidade na secreção de GnRH desencadeada pela desinibição GABAérgica pode estar envolvida na gênese da SOP3,52.
Variantes alélicas no GABRA1 têm sido associadas a doenças
neuropsiquiátricas. Horiuchi et al.53 examinaram o GABRA1 como um
alélicas do GABRA1 podem conferir susceptibilidade genética a distúrbios
neuropsiquiátricos.
Com base nestes achados, nós hipotetizamos que mutações inativadoras ou variantes alélicas no GABRA1 possam comprometer a ação
2 - OBJETIVOS
1- Estabelecer a freqüência e o modo de herança da forma familial idiopática de PPDG.
2- Analisar a região codificadora do gene da subunidade α1 do receptor
GABAA (GABRA1), em meninas portadoras da forma idiopática de
PPDG.
3- Estabelecer e comparar as freqüências alélica e genotípica de polimorfismos exônicos identificados no GABRA1 em meninas com a
forma idiopática de PPDG e em um grupo controle.
4- Estabelecer e comparar as freqüências alélica e genotípica do polimorfismo (IVS2-712(GT)n) no íntron 2 do GABRA1 em meninas
com a forma idiopática de PPDG e em um grupo controle.
5- Avaliar o padrão eletroencefalográfico das meninas com a forma idiopática de PPDG.
6- Estabelecer e comparar as freqüências alélica e genotípica dos polimorfismos identificados no GABRA1 entre as meninas com a
forma idiopática de PPDG sem e com anormalidades eletroencefalográficas.
7- Correlacionar os achados moleculares do GABRA1 com o fenótipo
3 - MÉTODOS
Este estudo foi aprovado pela Comissão de Ética do Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo (HCFMUSP/ aprovação n°1498/02) e o consentimento formal foi concedido
pelas pacientes ou responsável.
3.1 - Casuística
O diagnóstico laboratorial baseou-se nas dosagens basais de gonadotrofinas (LH e FSH), principalmente do LH. O teste de estímulo com GnRH de ação curta foi realizado em todas as pacientes pela administração de 100 mcg de gonadorelina i.v. no tempo zero e coleta de sangue nos tempos –15, 0, 15, 30, 45 e 60 minutos. As dosagens de LH e FSH foram realizadas utilizando ensaio imunofluorométrico (IFME), exceto numa paciente que teve as dosagens realizadas utilizando radioimunoensaio (RIE); as dosagens de estradiol foram realizadas utilizando fluoroimunoensaio (FIE) ou radioimunoensaio (RIE). Os critérios para definir ativação do eixo hipotálamo-hipófise-gonadal, e consequentemente diagnosticar PPDG, foram: LH basal >0,6 U/L e/ou pico de LH> 6,9 U/L para o método IFME25 e
pico de LH> 15 U/L para o método RIE após estímulo com GnRH exógeno54, ou alternativamente LH>10 U/L dosado 2 hs após a administração da primeira ampola de acetato de leuprolide 3,75mg, via subcutânea55.
A avaliação da boa resposta terapêutica foi evidenciada pelo exame clínico trimestral e pela a monitorização laboratorial com dosagens das gonadotrofinas e estradiol em condição basal e após estimulo com GnRH exógeno ou após análogo de GnRH depot. Os critérios utilizados para considerar bom controle hormonal foram: LH basal <0,6 U/L, LH pico após estimulo com GnRH clássico <2,3 U/L ou LH <6,6 U/L 2 hs após acetato de leuprolide depot55. A idade óssea foi estimada utilizando o método de
O grupo controle foi composto de mulheres brasileiras jovens cuja idade da menarca ocorreu após os 10 anos 15.Antecedentes neurológicos ou
doenças crônicas foram critérios de exclusão.
3.2 - Cálculo da taxa de penetrância
O critério para classificar como forma familial foi a presença de mais de 1 caso de precocidade sexual na prole ou no heredograma. O valor da taxa de penetrância (K) do GABRA1 em famílias com mais de um membro
afetado por PPDG foi estimado utilizando um programa compilado de rotinas matemáticas, denominado “Mathematica”, desenvolvido no Instituto de Biologia da Universidade de São Paulo 57. Neste cálculo foi assumido que a PPDG tem mecanismo autossômico dominante com penetrância incompleta como previamente demonstrado por De Vries et al16.
3.3 - Extração do DNA genômico
Amostras de DNA foram extraídas de leucócitos periféricos pela técnica de proteinase-K-extração com sal (salting out)58. As amostras
pertencem ao banco de DNA do Laboratório de Hormônios e Genética Molecular (LIM/42) da Disciplina de Endocrinologia do Hospital das Clínicas da Faculdade de Medicina da USP.
volumes de solução de lise (NH4Cl 114 mM, NH4HCO3 1 mM) e
incubando-se a 4º C por 30 minutos. O material foi centrifugado a 4º C durante 15 minutos a 3000 rpm (Sorvall, RT7, Germany), desprezando-se o sobrenadante. O procedimento da lise de glóbulos vermelhos foi repetido por mais uma vez. O botão de células brancas foi suspenso em 9 mL de solução de lise de glóbulos brancos (NaCl 150 mM, Tris - HCl 10 mM, pH 8,0; EDTA 10 mM pH 8,0) com 180 µL de dodecilsulfato de sódio a 10% (SDS) (Sigma,
St. Louis, MO, USA) e 150 µL de proteinase K (10 mg/mL) (Invitrogen, Life
Technology, Gaithersburg, MD, USA), sendo o material incubado a 37º C por 18 horas.
Após esse período, 3,6 mL de solução saturada de cloreto de sódio (6M) foi adicionada agitando-se o conjunto vigorosamente durante 15 segundos. O material foi centrifugado por 15 minutos a 3000 rpm (Sorvall, RT7, Germany). O sobrenadante foi transferido para um tubo limpo e o DNA foi precipitado acrescentando-se 2 volumes de etanol absoluto gelado, homogeneizando-se com cuidado por inversão. O DNA precipitado foi retirado do tubo, em seguida lavado em etanol 70%, repetindo-se a operação por mais três vezes. Por último, o DNA foi lavado em etanol absoluto, sendo secado em centrífuga a vácuo (Eppendorf, Concentrator 5301, Germany). Após tal procedimento, o DNA foi ressuspendido em tampão TE (10:0,1) (Tris-HCL 10 mM, pH 8,0; EDTA 0,1 mM, pH 8,0)
relação de 1,8 entre as leituras de 260 e 280 nm seria ideal para a caracterização da pureza do material. As amostras de DNA foram submetidas à eletroforese em gel de agarose 1% em TAE (Tris 0,004 M; ácido acético glacial; EDTA 0,001 M, pH 8,0) para verificar a sua integridade.
3.4 - Reação de polimerização em cadeia (PCR)
O DNA genômico foi utilizado como substrato para amplificação da região codificadora do GABRA1 constituída de 1055 nucleotídeos
utilizando oligonucleotídeos específicos intrônicos que flanqueiam cada éxons (Tabela 1). Os oligonucleotídeos iniciadores intrônicos foram
selecionados pelo programa Prime3OutPut59. Em um volume final de 50 µL
foram utilizados 100 ng de DNA genômico, 200 µM de cada desoxinucleotídeo (dNTP), 20 pmol de cada oligonucleotídeo iniciador, 2,5 U de enzima Taq DNA polimerase (Amersham, Pharmacia, Upsala, Suécia) e
tampão da reação fornecido pelo fabricante. A amplificação foi realizada em um termociclador GeneAmp PCR System 9600 (Applied Biosystems, Foster City, CA, USA). O programa de amplificação consistiu de: 98°C 5 minutos,
seguidos por 35 ciclos de 98°C 30 segundos, 55°C 30 segundos a 1 minuto
de acordo com o tamanho do fragmento, 72°C 3 minutos e extensão final de
para confirmar a amplificação do fragmento de interesse. O tamanho de cada fragmento amplificado está demonstrado na Tabela 1.
3.5 - Seqüenciamento Automático
A concentração de DNA dos produtos gerados pela PCR foi determinada através da comparação da intensidade de sinal emitido pelos produtos amplificados com os fragmentos de um marcador de peso molecular, de concentração conhecida após eletroforese em gel de agarose 2%. Posteriormente, os produtos de amplificação foram submetidos à pré-purificação enzimática. A reação de seqüenciamento foi realizada utilizando o kit ABI PrismTM BigDye Terminator (Applied Biosystem, Foster City, CA) e concentrações variáveis de DNA foram utilizadas de acordo com o tamanho do fragmento. Os produtos desta reação foram submetidos a eletroforese capilar em sequenciador automático ABI Prism Genetic Analyzer 3100 automatic DNA sequencer (Applied Biosystem, Foster City, CA).
3.6 - Predição de mudança de sítio de splice
Para investigar se os polimorfismos exônicos e intrônicos do GABRA1
ocasionam alteração no uso do sítio de splice original, utilizamos um
programa computacional de predição de alteração do uso do sítio de splice
3.7 - Determinação do número de repetições GT do polimorfismo
IVS2 -712(GT)n
Um polimorfismo previamente descrito no GABRA1, localizado no
íntron 2, IVS2-712(GT)n, com um número variável de repetições GT, foi estudado pela amplificação do fragmento correspondente a uma região específica no íntron 2, utilizando um par de oligonucleotídeos iniciadores53: oligo sense marcado com um corante fluorescente na extremidade 5' I2F 5´ FAM TCCAGCTTCCATCTGTTTGA e o oligo antisense I2R 5’
CCGGAGTCGTGCTTTTATTC. Em um volume final de 50 µL foram
utilizados 100 ng de DNA genômico, 200 µM de cada desoxinucleotídeo (dNTP), 20 pmol de cada oligonucleotídeo iniciador, 2,5 U de enzima Taq
DNA polimerase (Amersham, Pharmacia, Upsala, Suécia), tampão da
reação fornecido pelo fabricante. A amplificação foi realizada em um termociclador GeneAmp PCR System 9600 (Applied Biosystems, Foster
City, CA, USA). O programa de amplificação consistiu de: 98°C 5 minutos,
seguidos por 40 ciclos de 98°C 30 segundos, 55°C 1 minuto, 72°C 1 minuto e
extensão final de 72°C 30 minutos. O produto resultante da reação foi submetido a eletroforese capilar em seqüenciador automático ABI Prism Genetic Analyzer 310 automatic DNA sequencer (Applied Biosystem, Foster City, CA).
Biosystems, Foster City, CA, USA). O sequenciamento automático foi utilizado posteriormente para estabelecer a seqüência nucleotídea dos fragmentos amplificados. Com o objetivo de correlacionar o tamanho do fragmento com o número de repetições GT, uma amostra de DNA de um individuo homozigoto, identificado pela presença de um único sinal na representação gráfica fornecida pelo GeneScan, teve a região das repetições GT analisadas por sequenciamento automático. Adicionalmente,
uma amostra controle, de tamanho previamente conhecido, foi incluída em todas as eletroforeses, a fim de se corrigir possíveis variações na análise do tamanho dos fragmentos.
3.8 - Digestão enzimática
Um polimorfismo no GABRA1, 1323G>A, localizado no éxon 11,
foi estudado no grupo controle pela técnica de digestão enzimática. A presença da base nucleotídea G do polimorfismo 1323G>A cria um sítio de restrição da enzima TaiI (MBI, Fermentas, Hanover, MD, USA). Portanto, na
A reação de digestão foi realizada utilizando 3 µL do produto de PCR do éxon 11, 1 U da enzima TaiI e o tampão da reação fornecido pelo
fabricante por 2 horas a 65°C. O produto da digestão foi submetido a eletroforese em gel de agarose a 3% corado com brometo de etídio (0,5 µg/mL) e fotografado sob luz ultravioleta.
3.9 – Estudo eletroencefalográfico
O EEG foi realizado no Serviço de Eletroencefalografia da Disciplina de Neurologia do HCFMUSP em aparelho analógico (Neurofax, Nihon Kohden) ou digital (Neuromap, Neurotec). Foram utilizadas derivações mono e bipolares, com eletrodos dispostos segundo o sistema internacional de colocação de eletrodos (sistema 10-20)61.
3.10 - Análise estatística
Os dados clínicos e hormonais foram apresentados em média ± DP e intervalo.
Para comparar as freqüências genotípica e alélica dos polimorfismos no GABRA1 entre pacientes com PPDG e controles, foram
Para a análise dos dados, foi utilizado o programa GraphPad Instat3 (GraphPad software, Inc., San Diego, CA). A distribuição genotípica e
a freqüência alélica entre pacientes com PPDG e o grupo controle foram avaliadas em tabelas de contingência, pelo teste exato de Fisher ou teste qui-quadrado (χ2). Foram considerados significantes valores de p < 0,05.
Para comparar a distribuição genotípica e a freqüência alélica dos polimorfismos do GABRA1 entre os grupos de pacientes com PPDG sem e
com anormalidades eletroencefalográficas, foi utilizado o teste exato de Fisher seguido pela correção de Bonferroni, que consiste em corrigir o valor crítico de significância (α), dividindo 0,05 pelo número de testes realizados
4 . RESULTADOS
4.1 - Forma familial da puberdade precoce: freqüência e modo de
herança.
Trinta e uma pacientes do sexo feminino com diagnóstico clínico e laboratorial da forma idiopática de PPDG foram estudadas. Vinte e cinco das 31 pacientes (80,6%) apresentavam a forma esporádica de PPDG e 6 (19,4%) a forma familial pertencentes a 3 famílias não relacionadas. O heredograma das meninas com a forma idiopática de PPDG forma familial é apresentado na Figura 4. A análise de segregação da família 3 sugeriu uma forma de herança autossômica dominante. A taxa de penetrância calculada para as três genealogias foi de 70% (K=0,7).
4.2 - Dados clínicos e hormonais
A idade cronológica (IC) média do início do aparecimento dos caracteres sexuais secundários foi de 4,7 ± 2,1 anos (0,33 – 7 anos), e a IC
média da primeira consulta foi 7 ± 2 anos (1,66 – 10,25 anos).
Duas pacientes (casos 14 e 23) apresentavam diagnóstico prévio de epilepsia generalizada idiopática, e já estavam em seguimento neurológico e em tratamento com anticonvulsivantes.
pacientes. O tratamento com análogo de GnRH foi instituído, e a evolução clínico-laboratorial confirmou o diagnóstico de PPDG. Os dados laboratoriais das pacientes são mostrados na Tabela 3.
4.3 – Estudo molecular
Todos os fragmentos exônicos do GABRA1 que codificam a
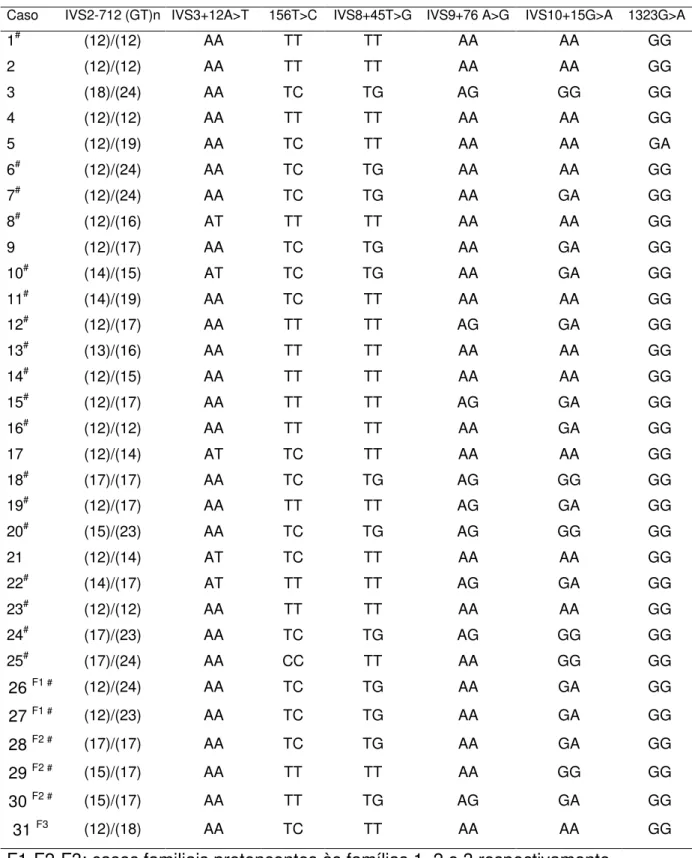
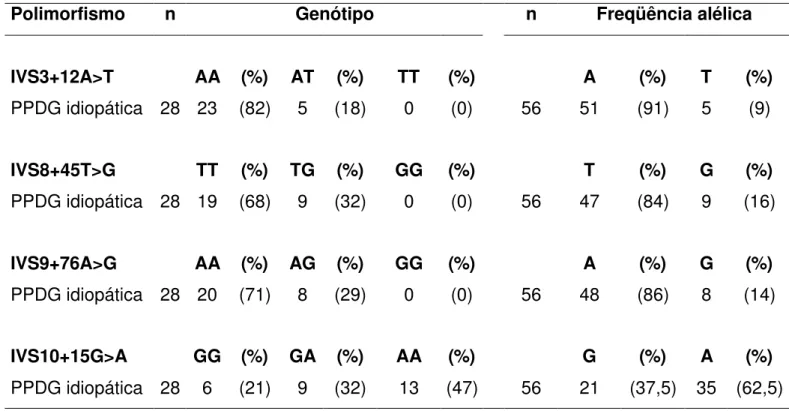
subunidade a1 do receptor tipo A do GABA e um fragmento do íntron 2, foram amplificados com sucesso. Identificamos 7 polimorfismos distintos: 2 silenciosos exônicos (156T>C e 1323G>A) e cinco variantes alélicas intrônicas (IVS2-712(GT)n, no íntron 2; IVS3+12A>T, no íntron 3; IVS8+45T>G, no íntron 8; IVS9+76A>G, no íntron 9 e IVS10+15G>A, no íntron 10). A representação esquemática do GABRA1 com a localização dos
polimorfismos identificados é apresentada na Figura 5. O genótipo das 31 pacientes estudadas com os 7 polimorfismos identificados está apresentado na Tabela 4. Nenhuma mutação funcional foi identificada na região codificadora do GABRA1.
O polimorfismo exônico 156T>C, localizado no éxon 4, já descrito num banco de dados (www.ncbi.nlm.nih.gov/SNP), foi caracterizado pela substituição da terceira base do códon 52 (Gly). Um novo polimorfismo 1323G>A, localizado no éxon 11, foi caracterizado pela substituição da terceira base do códon 441 (Thr) (Figuras 6 e 7).
digestão enzimática com a enzima Tail deste polimorfismo no grupo controle
está demonstrada na Figura 8.
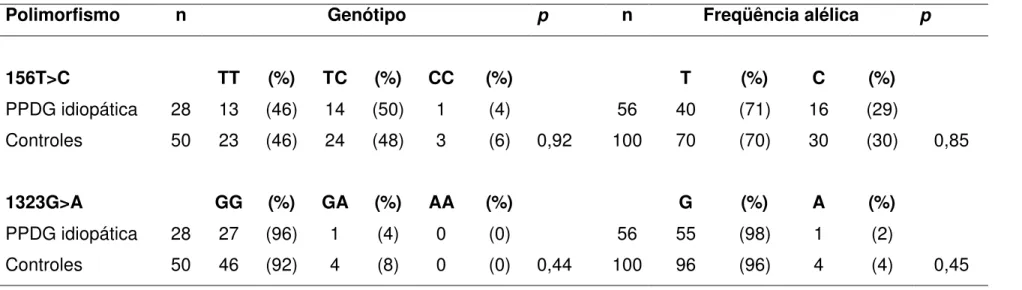
A distribuição genotípica e a freqüência alélica dos 2 polimorfismos exônicos do GABRA1, 156T>C e 1323G>A, nas pacientes
com a forma idiopática da PPDG e em 50 controles não relacionados estão apresentadas na Tabela 5. Não houve diferença estatisticamente significante da distribuição genotípica e da freqüência alélica dos dois polimorfismos exônicos entre os grupos (p=0,92 e 0,44, para a distribuição genotípica e
p=0,85 e 0,45, para a freqüência alélica, respectivamente).
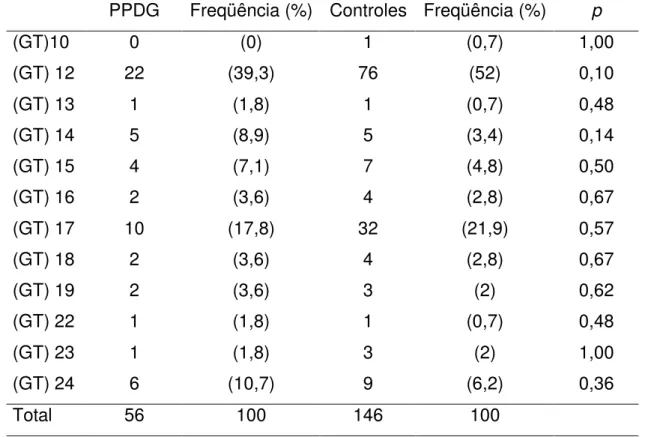
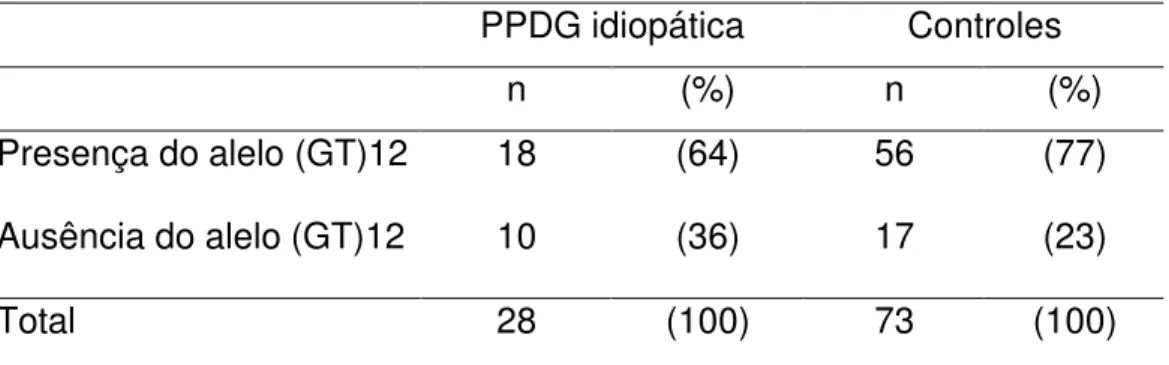
formado pelo alelo (GT)12 em homo ou heterozigose. No entanto, a comparação da freqüência genotípica entre as pacientes com PPDG e os controles não foi estatisticamente significante (p=0,22) (Tabela 8).
Considerando a presença do alelo (GT)17, 32% das pacientes e 38% dos controles apresentaram genótipo formado pelo alelo (GT)17 em homo ou heterozigose. No entanto, a comparação da freqüência genotípica entre as pacientes com forma idiopática da PPDG e os controles não foi estatisticamente significativa (p=0,64) (Tabela 9).
Os demais polimorfismos intrônicos IVS3+12A>T; IVS8+45T>G; IVS9+76A>G e IVS10+15G>A foram identificados nas posições adjacentes aos éxons 3, 8, 9 e 10, respectivamente. A distribuição genotípica e a freqüência alélica dos polimorfismos IVS3+12A>T; IVS8+45T>G; IVS9+76A>G e IVS10+15G>A, no grupo das pacientes com PPDG estão apresentados na Tabela 10. Tratando-se de polimorfismos já descritos (www.ncbi.nlm.nih.gov/SNP), não estimamos as suas freqüências no grupo controle. Nenhum destes polimorfismos apresentou alteração na predição do uso do sítio de splice original.
4.4 - Estudo eletroencefalográfico
Vinte e três (74,2%) das 31 pacientes realizaram estudo eletroencefalográfico (EEG), incluindo as duas portadoras de epilepsia (casos 14 e 23). O traçado eletroencefalográfico foi normal em 17 pacientes (78,3%) e anormal em 6 (21,7%). Entre as 21 pacientes sem epilepsia, 4 evidenciaram anormalidades no EEG caracterizadas por paroxismos raros de espículas e de ondas agudas de projeção na região frontal direita (caso 13 - Figura 11); paroxismos de espículas e ondas agudas de projeção na região temporal média direita (caso 19 - Figura 12); ondas delta ritmadas, intermitentes nas regiões occipitais bilaterais (caso 29 – Figura 13) e paroxismos de espículas, ondas agudas e ondas lentas irregulares de projeção nas regiões temporo - parietais bilaterais, ora a esquerda, ora a direita, principalmente em períodos de sonolência e durante o sono (caso 30 – Figura 14). As duas pacientes portadoras de epilepsia apresentavam as seguintes alterações no EEG: paroxismos de ondas pontiagudas e de ondas lentas irregulares de projeção no hemisfério esquerdo com difusão para a região fronto central mediana (caso 14 – Figura 15) e paroxismos de complexos de espícula-onda ritmados a 3/seg de projeção generalizada com predomínio no hemisfério direito (caso 23 – Figura 16).
genótipo das meninas com PPDG, que foram submetidas ao EEG está demonstrado na Tabela 4.
A comparação das freqüências genotípica e alélica dos polimorfismos identificados no GABRA1 entre as meninas não relacionadas,
com a forma idiopática de PPDG sem (n=15) e com (n=5) anormalidades eletroencefalográficas está demonstrada na Tabela 11. A distribuição genotípica e a freqüência alélica de 6 polimorfismos identificados no
GABRA1 não diferiram significativamente entre os grupos de pacientes com
PPDG sem e com anormalidades eletroencefalográficas, considerando o nível crítico de p <0,005.
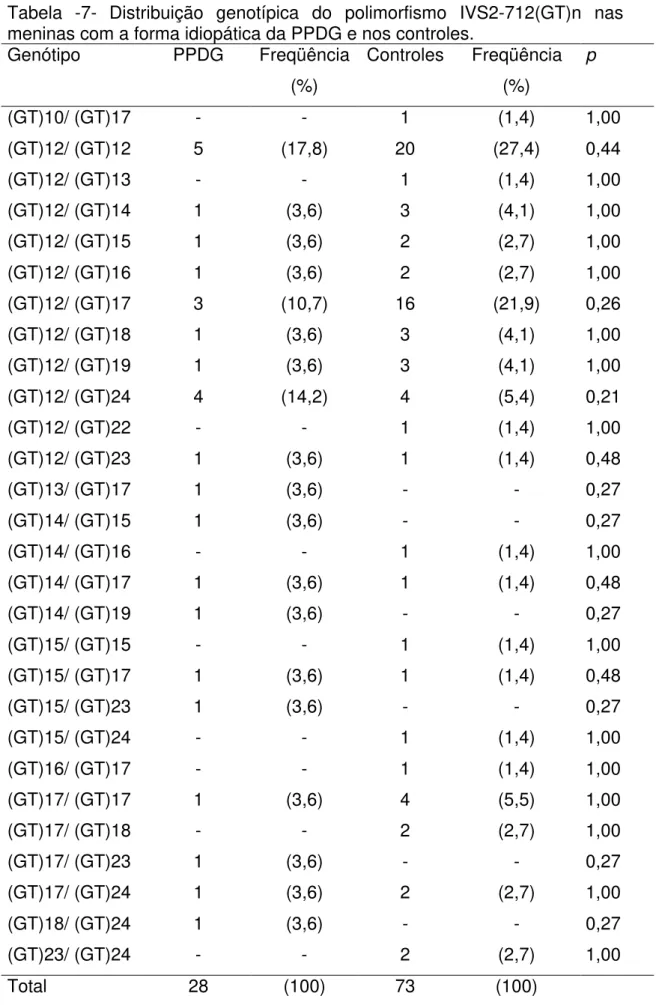
A comparação da distribuição genotípica e da freqüência alélica do polimorfismo IVS2-712(GT)n no GABRA1, entre as meninas com a forma
idiopática de PPDG sem e com anormalidades eletroencefalográficas, não evidenciou diferença estatisticamente significativa (p>0,05) (Tabela 12 e13).
5 – DISCUSSÃO
A identificação de genes que regulam o tempo de puberdade representa uma oportunidade de aumentarmos nossa compreensão dos fatores que modulam o eixo hipotálamo-hipófise-gonadal na espécie humana14. Os fatores que regulam a idade de início da puberdade humana
ainda não estão totalmente esclarecidos. As evidências sugerem que fatores ambientais, sócio-culturais e metabólicos são reguladores críticos do início da puberdade, mas tais fatores encontram-se sob uma regulação genética ainda pouco conhecida14. A busca por genes envolvidos no controle da transcrição gênica durante o processo puberal ainda está no seu início.
Do ponto de vista etiológico, a minoria dos casos de PPDG no sexo feminino tem uma causa definida (hamartomas hipotalâmicos, processos expansivos, infecções, malformações do SNC,etc)22. As lesões do SNC predispõem de forma equivalente tanto o sexo masculino quanto o feminino ao início precoce da puberdade. No entanto, quando nenhuma causa orgânica é detectada e o processo é considerado idiopático, um predomínio no sexo feminino é nitidamente observado (10 F:1 M) na maioria dos relatos14,22. Na outra extremidade, tem-se que o predomínio do atraso constitucional do início da puberdade, sem etiologia definida, predomina no sexo masculino14.
nosso estudo, sugere herança autossômica dominante na família 3. A partir das configurações das três genealogias estimamos o valor da taxa de penetrância gênica considerando a hipótese de mecanismo autossômico dominante com penetrância incompleta (K=0,7). Estes dados indicam a necessidade de uma história familiar detalhada e alertam para o risco de um novo caso de puberdade precoce na mesma família.
Neste estudo, nenhuma mutação funcional foi encontrada na região codificadora do GABRA1. Em contrapartida, tratando-se de um gene
polimórfico, as variações nucleotídeas sinônimas encontradas na região codificadora (156T>C, códon 52 no éxon 4 e 1323G>A, códon 441 no éxon 11) e o já conhecido polimorfismo intrônico IVS2-712(GT)n não diferiram significativamente em freqüência na população com a forma idiopática da PPDG e no grupo controle.
O artefato encontrado na análise da sequência do íntron 9/éxon 10 remete ao fenômeno de mecanismo mutacional denominado slippage, no
qual a probabilidade de inserções ou deleções aumenta diretamente com o aumento do número de repetições nucleotídeas62. No entanto, este achado que foi encontrado em todos os pacientes e no grupo controle, sugere não representar qualquer efeito biológico, tendo sido considerado apenas um evento in vitro.
Até o momento, mais de 145 polimorfismos no GABRA1 foram
têm sido relacionados com distúrbios psiquiátricos (transtorno bipolar, unipolar, ansiedade, alcoolismo)53,63. Tal correlação tem sido baseada
exclusivamente em estudos de freqüência e associação de polimorfismos (haplótipos) que diferem estatisticamente dos grupos controle.
Algumas interações entre polimorfismos em genes que codificam outras subunidades do receptor de GABAA têm sido descritas63. O
polimorfismo IVS10+15G>A no GABRA1 associado ao 1497C>T no
GABRA6, gene que codifica a subunidade α6 do receptor GABAA mostra
significante associação com distúrbios do humor em pacientes do sexo feminino63. Houriuch et al.53 demonstraram a associação dos polimorfismos IVS2-712(GT)n, localizado no íntron 2 e do polimorfismo 156T>C, no éxon 4, com distúrbios bipolares, motivando-nos a investigá-los nas meninas com a forma idiopática da PPDG. Os autores demonstraram que um haplótipo específico composto pelo alelo (GT)17 associado ao alelo C teria possível efeito protetor na ocorrência dos distúrbios bipolares. Nenhum estudo funcional foi realizado nesta investigação53. No nosso estudo, nenhuma
associação foi encontrada entre estes polimorfismos e a puberdade precoce. A única mutação descrita no GABRA1 com alteração funcional,
Ala 322Arg (OMIM ID 137160), a substituição de um aminoácido alanina por uma arginina na posição 322, foi identificada em uma família franco-canadense com epilepsia mioclônica juvenil familial64. Esta condição é uma
descritas64. O estudo funcional desta mutação evidenciou in vitro uma menor
amplitude de corrente elétrica ativada pelo GABA, sugerindo que as convulsões poderiam resultar da perda da função inibitória exercida pelo GABA no seu receptor64.
O fato de não termos encontrado mutações ou variantes alélicas que correlacionem o GABRA1 com puberdade precoce, não exclui a
possibilidade de que defeitos em outras subunidades, principalmente β2 e γ2, que juntamente com a subunidade α1 representam a composição
heteropentamérica mais abundante no sistema nervoso central, ou em outros passos na complexa cascata de síntese, ação e degradação deste neurotransmissor possam ocorrer. O comprometimento das outras subunidades do receptor de GABA e conseqüentemente das suas interações com a subunidade α1, ainda são pouco conhecidas. Finalmente, tratando-se
de um evento multifatorial, a compreensão dos mecanismos envolvidos na regulação do início da puberdade continua desafiador.
anormalidades eletroencefalográficas pertencem à mesma família, sugerindo que o fenótipo composto por anormalidade eletroencefalográficas e PPDG podem ser modulados por fatores genéticos. Não houve diferença estatisticamente significativa da distribuição genotípica e da freqüência alélica dos polimorfismos do GABRA1 entre os grupos de pacientes sem e
com anormalidades eletroencefalográficas. Apenas a comparação da freqüência alélica do polimorfismo 156T>C entre as meninas com PPDG sem e com anormalidades eletroencefalográficas foi inicialmente estatisticamente significativa (p=0,04). No entanto, quando utilizamos a
correção do valor crítico de p (<0,005), esta diferença não mais representa
uma significância estatística. Uma ampliação do estudo, incluindo um grupo controle com avaliação do EEG, é necessária para estabelecer uma possível associação dos polimorfismos do GABRA1 com anormalidades
eletroencefalográficas. Não obtivemos correlação entre os demais polimorfismos no GABRA1 e as anormalidades no EEG nas pacientes com
PPDG. Outras subunidades do receptor necessitam ser investigadas para excluir definitivamente esta associação, uma vez que tais anormalidades são presumivelmente causadas por hiperexcitabilidade cortical idade-dependente, na qual o GABA tem um papel importante44-47.
A correlação entre anormalidades eletroencefalográficas e alterações GABAérgicas tem sido demonstrada em algumas situações neuropsiquiátricas, como em algumas formas na epilepsia, no alcoolismo e nos estudos que objetivam estudar os efeitos de substâncias neuroativas atuando nos diferentes receptores de GABA46-48. Por exemplo,
anormalidades nas subunidades do receptor GABAA já foram associadas a
alterações eletroencefalográficas específicas. O GABA está envolvido na gênese de diferentes atividades rítmicas cerebrais que podem ser moduladas por algumas drogas que exercem seus efeitos por ligarem-se aos receptores de GABA, através do seus efeitos nas subunidades α1, α2, α3 e
α5, como por exemplo os benzodiazepínicos46,47. Alterações na subunidade
α2 do receptor GABAA estão implicadas com o alcoolismo, que é uma
doença complexa com fatores de risco tanto genéticos quanto ambientais, na qual são detectadas alterações eletroencefalográficas típicas (freqüência beta)48.
Dois trabalhos que realizaram estudo EEG em pacientes com puberdade precoce descreveram notavelmente uma alta prevalência de anormalidades44,45. No entanto, nestes 2 estudos, os pacientes apresentavam tanto a forma idiopática de PPDG quanto a forma orgânica. Liu et al.44, na década de 70, descreveram que 34 de 42 (81%) pacientes
com puberdade precoce idiopática avaliados tinham anormalidades no EEG, sendo que 4 destes tinham crises convulsivas. No grupo de pacientes com puberdade precoce de causa orgânica (n=16), 96% dos traçados eram anormais. A maioria das anormalidades eletroencefalográficas se caracterizava pela presença de ondas lentas e paroxismos, bem como de complexos espícula-onda de natureza difusa44. Posteriormente, Theodore et al45, descreveram 19 pacientes, sendo 8 com a forma idiopática de PPDG, 3
anormalidades no EEG em 5 dos 16 pacientes com PPDG e em 2 dos 3 com pubarca precoce. Nenhum paciente tinha história de crises convulsivas. Em ambos os trabalhos, os autores concluíram que o EEG anormal nestas pacientes poderia refletir uma doença diencefálica oculta com uma disfunção neurofisiológica difusa. Após estes dois estudos, nossa análise eletroencefalográfica representa o primeiro estudo em crianças com a forma idiopática de PPDG que foram submetidas ao exame de ressonância magnética do SNC. Do ponto de vistas clínico, não está definida a importância das anormalidades eletroencefalográficas em pacientes sem crises convulsivas. Uma avaliação neuropsiquiátrica refinada, focalizando distúrbios comportamentais ou de cognição, serão úteis no esclarecimento do papel fisiopatológico destas anormalidades eletroencefalográfica, como por exemplo, uma alteração neurológica subclínica. É de interesse notar que anormalidades eletroencefalográficas na população normal variam de 6 a 16% de acordo com as maiores séries da literatura44,45,65. Nossos resultados
6 –CONCLUSÕES
1. Identificamos PPDG idiopática de origem familial em 19,4% das pacientes, com modo de herança autossômico dominante em uma família, com penetrância incompleta, indicando a origem genética nesta condição.
2. O GABRA1 é um gene altamente polimórfico, tendo sido identificados
2 polimorfismos exônicos e 5 intrônicos em nossa casuística.
3. Nenhuma mutação funcional foi identificada no GABRA1 nas meninas
com a forma idiopática da PPDG.
4. A distribuição genotípica e a freqüência alélica dos polimorfismos no
GABRA1 não diferiram significativamente entre as pacientes com a
forma idiopática da PPDG e o grupo controle.
5. Anormalidades eletroencefalográficas foram detectadas em 26% das pacientes com a forma idiopática de PPDG, indicando a importância da realização do EEG na investigação da puberdade precoce idiopática.
6. Não houve associação entre a distribuição genotípica e a freqüência alélica dos polimorfismos do GABRA1 com as anormalidades
7. Alterações genotípicas do GABRA1 não foram associadas ao fenótipo