Anderson Brito da Silva
Revisitando o eletrocorticograma
intra-operatório na epilepsia mesial do lobo
temporal:
Relevância das oscilações de alta frequência
Natal
Anderson Brito da Silva
Revisitando o eletrocorticograma intra-operatório na
epilepsia mesial do lobo temporal:
Relevância das oscilações de alta frequência
Dissertação submetida ao Programa de Pós-Graduação em Neurociências da Universidade Federal do Rio Grande do Norte, como parte dos requisitos para obtenção do título de Mes-tre em Neurociências.
Universidade Federal do Rio Grande do Norte – UFRN
Instituto do Cérebro
Programa de Pós-Graduação em Neurociências
Orientador: Claudio Marcos Teixeira de Queiroz
Catalogação da Publicação na Fonte Universidade Federal do Rio Grande do Norte – UFRN Catalogação de Publicação na Fonte. UFRN - Biblioteca Setorial do Instituto do Cérebro
S231e Silva, Anderson Brito.
Revisitando o eletrocorticograma intra-operatório na epilepsia mesial do lobo temporal: relevância das oscilações de alta
frequência / Anderson brito da Silva. - Natal, 2013. 95f: il.
Dissertação (Mestrado em Ciências, Área de concentração: Neurociências). Universidade Federal do Rio Grande do Norte. Orientador: Profº. Dr. Cláudio Marcos Teixeira Queiroz. .
1. Neurociências - Dissertação. 2. Epilepsia mesial do lobo temporal. 3. Oscilação de Alta Frequência. 4. Lobectomia temporal anterior. I. Título
RN/UF/BSET/ICe CDU 612.8
Agradecimentos
À Unidade de Pesquisa e Estudo das Epilepsias da Universidade Federal de São Paulo, em nome da Dra. Elza Marcia Yacubian, do Dr. Luiz Otávio e Dra. Taissa Ferrari, pela disponibilização dos sinais de ECoG e dados clínicos presentes nesta dissertação;
Agradeço a toda minha família pelo apoio incondicional em todas as minhas conquistas;
Em especial à minha mãe, Sara Brito da Silva, por todo amor demonstrado, mesmo à distância, essencial para meu fortalecimento emocional para suportar todas as dificuldades enfrentadas;
Ao meu pai, João Antonio da Silva, por ter fomentado em todos os filhos a busca pelo conhecimento desde cedo;
À minha irmã, Aline Brito da Silva, nossa primeira professora (minha e do meu irmão), que sempre nos incentivou a estudar muito mais daquilo que nos era ensinado no colégio, semeadora do instinto de pesquisador o qual tento colher;
Ao meu irmão, João Antonio da Silva Junior, colega de profissão, que sempre soube me aconselhar sobre os caminhos da vida, sendo um grande parceiro nesta jornada;
Agradeço ainda aos colegas do Instituto do Cérebro, pelo conhecimento adquirido nestes dois anos, que servirão não só para minha vida acadêmica quanto a pessoal;
Em especial ao meu Orientador, Claudio Marcos Teixeira de Queiroz, que abriu-me os olhos às inúmeras possibilidades de trabalhos e sem o qual este trabalho não teria se concretizado;
Aos professores Adriano Tort e Rodrigo Pereira, membros do meu comitê de acompanhamento, pelas relevantes contribuições ao meu trabalho;
Aos meus colegas do grupo de pesquisa, Kelly e Aron, pela disponibilidade e convivência durante os experimentos;
Aos amigos Sergio Arthuro e Fábio Caixeta, por serem meus orientadores não-oficiais, porém de fundamental importância para minha formação;
À minha turma de mestrado, Juliana Brandão, Hermany, Fabio Freitag e Renzo pelo companheirismo e todas emoções vividas durante estes 2 anos;
"If I wished to show a student the difficulties of getting at truth from medical experience, I would give him the history of epilepsy to read"
Resumo
As epilepsias são distúrbios neurológicos caracterizados por crises espontâneas e recorrentes, resultantes de uma atividade elétrica anormal de uma rede neural. Dentre os diferentes tipos de epilepsia, a epilepsia mesial do lobo temporal (EMLT) é a mais observada em adultos, sendo frequentemente associada à esclerose hipocampal. Infelizmente, nem todos os pacientes são beneficiados pelo tratamento farmacológico (pacientes fármaco-resistentes). Para estes sujeitos, uma alternativa é a realização de cirurgia, um procedimento de alta complexidade e elevado custo. Atualmente, o procedimento mais realizado é a lobectomia temporal anterior com amigdalo-hipocampectomia seletiva, uma cirurgia padronizada por marcos anatômicos. Entretanto, uma parcela dos pacientes continua a apresentar crises incapacitantes após o tratamento cirúrgico. Desta forma, para aumentar a eficiência deste tipo de tratamento, é fundamental a compreensão do encéfalo humano epiléptico com vistas a se criar ferramentas que auxiliem na realização de procedimentos individualizados.
O objetivo do presente trabalho foi identificar e quantificar a ocorrência de atividade epileptiforme - espículas interictais (EI) e oscilações de alta frequência (OAF) - em registros eletrocorticográficos (ECoG) realizados durante procedimento cirúrgico em pacientes com EMLT refratária ao tratamento farmacológico.
Registros ECoG (32 canais a uma taxa de amostragem de 1 kHz) foram realizados na superfície do lobo temporal em 3 momentos cirúrgicos: no córtex intacto, após lobectomia temporal anterior e após amigdalo-hipocampectomia (duração média de cada um desses registros: 10 min; N=17 pacientes). A ocorrência de EI e OAF foi quantificada automatica-mente, por meio de rotinas em MATLAB, e validadas manualmente. A taxa de ocorrência em cada um dos tempos cirúrgicos foi correlacionada com o resultado cirúrgico quanto ao controle das crises, num seguimento de 2 anos.
Desta forma, podemos concluir que as OAF, juntamente com as EI, podem ser encontradas no registro ECoG intra-operatório, mesmo na presença de anestésicos e em uma curta sessão de registro. Além disso, a observação de que a ocorrência desses eventos no início da cirurgia permite classificar o paciente quanto ao prognóstico cirúrgico abre caminho para aplicar o ECoG intra-operatório, por exemplo, na decisão sobre o uso de tratamento farmacológico adjuvante ou da conversão para ressecções individualizadas. No entanto, o mecanismo responsável por esse efeito ainda é desconhecido, logo novos estudos são necessários para melhor esclarecê-lo.
Palavras-chaves: 1. Epilepsia mesial do lobo temporal 2. Eletrocorticografia
Abstract
Epilepsies are neurological disorders characterized by recurrent and spontaneous seizures due to an abnormal electric activity in a brain network. The mesial temporal lobe epilepsy (MTLE) is the most prevalent type of epilepsy in adulthood, and it occurs frequently in association with hippocampal sclerosis. Unfortunately, not all patients benefit from pharmacological treatment (drug-resistant patients), and therefore become candidates for surgery, a procedure of high complexity and cost. Nowadays, the most common surgery is the anterior temporal lobectomy with selective amygdalohippocampectomy, a procedure standardized by anatomical markers. However, part of patients still present seizure after the procedure. Then, to increase the efficiency of this kind of procedure, it is fundamental to know the epileptic human brain in order to create new tools for auxiliary an individualized surgery procedure.
The aim of this work was to identify and quantify the occurrence of epilepticform activity -such as interictal spikes (IS) and high frequency oscillations (HFO) - in electrocorticographic (ECoG) signals acutely recorded during the surgery procedure in drug-resistant patients
with MTLE.
The ECoG recording (32 channels at sample rate of 1 kHz) was performed in the surface of temporal lobe in three moments: without any cortical resection, after anterior temporal lobectomy and after amygdalohippocampectomy (mean duration of each record: 10 min; N = 17 patients; ethic approval #1038/03 in Research Ethic Committee of Federal University of São Paulo). The occurrence of IS and HFO was quantified automatically by MATLAB routines and validated manually. The events rate (number of events/channels) in each recording time was correlated with seizure control outcome.
In 8 hours and 40 minutes of record, we identified 36,858 IS and 1.756 HFO. We observed that seizure-free outcome patients had more HFO rate before the resection than non-seizure free, however do not differentiate in relation of frequency, morphology and distribution of IS. The HFO rate in the first record was better than IS rate on prediction of seizure-free patients (IS: AUC = 57%, Sens = 70%, Spec = 71% vs HFO: AUC = 77%, Sens = 100%, Spec = 70%). We observed the same for the difference of the rate of pre and post-resection (IS: AUC = 54%, Sens = 60%, Spec = 71%; vs HFO: AUC = 84%, Sens = 100%, Spec = 80%). In this case, the algorithm identifies all seizure-free patients (N = 7) with two false positives.
patients before any cortical resection suggest that ECoG can be important to decide the use of adjuvant pharmacological treatment or to change for tailored resection procedure. The mechanism responsible for this effect is still unknown, thus more studies are necessary to clarify the processes related to it.
Key-words: 1.Mesial Temporal Lobe Epilepsy Surgery 2.Electrocorticography 3.High
Lista de ilustrações
Figura 1 – Classificação das crises epilépticas . . . 23
Figura 2 – Classificação das epilepsias . . . 25
Figura 3 – Posição dos eletrodos na primeira etapa de registro . . . 42
Figura 4 – Distribuição do resultado cirúrgico em relação ao controle das crises no segundo ano. . . 44
Figura 5 – Detecção e classificação de espículas interictais . . . 45
Figura 6 – Detecção e classificação de oscilações de alta frequência . . . 46
Figura 7 – Método de bootstrap . . . 47
Figura 8 – Duração por etapa de registro . . . 51
Figura 9 – Número de canais por etapa de registro . . . 52
Figura 10 – Espículas interictais . . . 53
Figura 11 – Taxa de ocorrência de espículas interictais nos canais ativos. . . 53
Figura 12 – Proporção de canais com espículas interictais . . . 54
Figura 13 – Taxa de ocorrência e proporção de canais ativos das espículas interictais na região neocortical remanescente . . . 54
Figura 14 – Distribuição espacial das espículas interictais . . . 55
Figura 15 – Taxa de ocorrência das espículas interictais na predição do resultado cirúrgico . . . 56
Figura 16 – Oscilações de alta frequência. . . 56
Figura 17 – Taxa de ocorrência das oscilações de alta frequência nos canais ativos.. 57
Figura 18 – Proporção de canais com oscilações de alta frequência . . . 58
Figura 19 – Taxa de ocorrência e proporção de canais ativos das oscilações de alta frequência na região neocortical remanescente . . . 58
Figura 20 – Distribuição espacial das oscilações de alta frequência . . . 59
Figura 21 – Taxa de ocorrência das oscilações de alta frequência na predição do resultado cirúrgico . . . 59
Figura 22 – Prognóstico determinado pelas oscilações de alta frequência. . . 60
Figura 23 – Características clínicas discretas por taxa de ocorrência de oscilações de alta frequência . . . 62
Figura 24 – Características clínicas contínuas por taxa de ocorrência de oscilações de alta frequência . . . 62
Figura 25 – Oscilações de alta frequência em eletrocorticografia crônica . . . 63
Figura 26 – Oscilações de alta frequência em eletrocorticografia intra-operatória na determinação da conduta . . . 73
Figura 28 – Mapas de espículas interictais na segunda etapa de registro, para cada paciente . . . 88 Figura 29 – Mapas de espículas interictais na terceira etapa de registro, para cada
paciente . . . 89 Figura 30 – Mapas de oscilações de alta frequência na primeira etapa de registro,
para cada paciente . . . 90 Figura 31 – Mapas de oscilações de alta frequência na segunda etapa de registro,
para cada paciente . . . 91 Figura 32 – Mapas de oscilações de alta frequência na terceira etapa de registro,
Lista de tabelas
Tabela 1 – Características clínicas dos pacientes . . . 41 Tabela 2 – Classificação de resultado cirúrgico de Engel . . . 43 Tabela 3 – Características clínicas, eletrofisiológicas e de imagem relacionadas com
Lista de abreviaturas e siglas
AHS Amigdalo-Hipocampectomia Seletiva
CIREP Centro de Cirurgia de Epilepsia
ECoG Eletrocorticograma
EEG Eletroencefalograma
EI Espícula Interictal
ELT-M Epilepsia do Lobo Temporal Mesial
FIR Finite Impulse Response
HCFMRP Hospital das Clínicas da Faculdade de Medicina de Ribeirão Preto
Hz Hertz
OAF Oscilações de Alta Frequência
IFCN Federação Internacional de Neurofisiologia Clínica - do Inglês Internati-onal Federation of Clinical Neurophysiology
ILAE Liga Internacional Contra Epilepsia - do Inglês International League Against Epilepsy
IPSP Potenciais Inibitórios Pós-Sinápticos - do Inglês Inhibitory Post-Sinaptic Potential
LOO Leave One Out
LTA Lobectomia Temporal Anterior
ROC Receiver Operating Characteristic
UNIPETE Unidade de Pesquisa e Tratamento das Epilepsias
UNIFESP Universidade Federal de São Paulo
Sumário
I
Fundamentação Teórica
21
1 As epilepsias . . . 23
1.1 Classificação das crises epilépticas . . . 23
1.2 Classificação por etiologia . . . 24
1.3 Classificação das epilepsias . . . 24
2 Epilepsia mesial do lobo temporal . . . 27
2.1 Epidemiologia e fisiopatologia. . . 27
2.2 Manifestações clínicas e tratamento farmacológico . . . 28
2.3 Tratamento cirúrgico da epilepsia mesial do lobo temporal. . . 28
3 Eletrocorticografia intraoperatória . . . 31
3.1 Espículas interictais . . . 32
3.2 Oscilações de alta frequência . . . 32
II
Objetivos
35
4 Objetivos . . . 37III
Métodos
39
5 Métodos . . . 415.1 Características clínicas dos pacientes . . . 41
5.2 Procedimento cirúrgico e registro eletrográfico . . . 42
5.3 Controle das crises no pós-operatório . . . 43
5.4 Detecção e classificação de espículas interictais . . . 44
5.5 Detecção e classificação de oscilações de alta frequência . . . 44
5.6 Análise estatística . . . 45
IV
Resultados
49
6 Resultados . . . 516.1 O registro eletrocorticográfico. . . 51
6.2 Espículas interictais . . . 52
6.3 Oscilações de alta frequência . . . 56
6.4 Características clínicas . . . 60
V
Discussão
65
7 Discussão . . . 67
7.1 Do sinal eletrocorticográfico. . . 68
7.2 Dos métodos de detecção dos eventos . . . 69
7.3 Da ocorrência por etapa de registro e distribuição espacial . . . 70
7.4 Do resultado cirúrgico e a determinação do prognóstico . . . 70
Conclusão. . . 75
Referências . . . 77
Apêndices
85
APÊNDICE A – Figuras Complementares . . . 87APÊNDICE B – Tabela Complementar . . . 93
Parte I
23
1 As epilepsias
De acordo com a Liga Internacional Contra Epilepsia (ILAE), a epilepsia é uma desordem cerebral duradoura caracterizada pela presença de pelo menos uma crise epilép-tica e pelas consequências neurobiológicas, cognitivas, psicológicas e sociais desta condição (FISHER et al.,2005). As epilepsias figuram entre os mais prevalentes distúrbios
neuroló-gicos. Estima-se que 1 em cada 16 pessoas experimente uma crise durante toda a vida. Atualmente existem aproximadamente 50 milhões de pessoas no mundo com epilepsia, sendo registrados 2,5 milhões de novos casos por ano (DUA et al., 2006).
Apesar dessa alta incidência, ainda é uma doença desconhecida por boa parte da população e cercada por muitos estigmas, mitos e crenças, o que leva aos portadores implicações sociais e psicológicas (EISENBERG,2008). Devido à precariedade do sistema de saúde de muitos países, cerca de 80% desses indivíduos não são propriamente diagnosticados ou tratados (DUA et al., 2006). Por fim, a diversidade dos tipos de crises epilépticas e a dificuldade de acesso a um estudo neurofisiológico são os principais fatores de confusão para o diagnóstico correto, e consequentemente de um tratamento adequado (IRIARTE et al., 2003;BERG et al., 2010;BERG; SCHEFFER, 2011).
1.1 Classificação das crises epilépticas
De acordo com a nova proposta de classificação da ILAE (BERG et al., 2010; BERG; SCHEFFER, 2011), as crises epilépticas podem ser classificadas quanto ao seu modo de início ictal, podendo ser divididas em três categorias: (1) Generalizadas; (2) Focais; ou (3) De origem desconhecida (Figura 1).
24 Capítulo 1. As epilepsias
As crises generalizadas são caracterizadas pelo engajamento rápido de redes neuro-nais bilateralmente distribuídas. Podem ser classificadas como: tônico-clônicas; ausências; clônicas; tônicas; atônicas; e mioclônicas.
As crises focais são caracterizadas pelo envolvimento de rede neuronal localizada, mas podem também evoluir para uma crise convulsiva bilateral, de forma mais lenta que as generalizadas. Neste grupo, a sintomatologia irá depender da região cortical afetada (zona sintomatogênica, i.e. região cortical responsável pela geração dos sintomas), e pode ser evidenciada por uma ou mais das características: auras; crises motoras e autonômicas; alterações cognitivas e de consciência.
Os espasmos epilépticos se encontram no grupo das crises de origem desconhe-cida por não possuírem evidências suficientes para serem caracterizados como focal ou generalizado.
1.2 Classificação por etiologia
Ainda pela ILAE (BERG et al., 2010; BERG; SCHEFFER, 2011), as epilepsias podem ser classificadas quanto à etiologia como: (1) Genéticas; (2) Estrutural/metabólica; (3) De causa desconhecida.
1 - Etiologia genética: são caracterizadas por um defeito genético que contribui diretamente para a epilepsia, e as crises são o principal sintoma do distúrbio, como por exemplo, nas canalopatias.
2 - Etiologia estrutural/metabólica: ocorrem quando uma condição cerebral es-trutural ou metabólica está associada com aumento do risco de desenvolver crises, como ocorre no acidente vascular cerebral, trauma, infecção e anóxia perinatal.
3 - Etiologia desconhecida: se definem quando não há estudos evidenciando a etiologia específica, podendo ser genética, metabólica ou estrutural.
1.3 Classificação das epilepsias
Podemos dividir as epilepsias em quatro subtipos de acordo com a ILAE (BERG et al., 2010; BERG; SCHEFFER, 2011): (1) Síndromes eletroclínicas; (2) Constelações; (3) Epilepsias estrutural/metabólicas; (4) Epilepsias de causa desconhecidas (Figura 2).
1.3. Classificação das epilepsias 25
Figura 2 – Classificação das epilepsias Adaptado de Berg e Scheffer(2011).
2 - Constelação: também é um conjunto de sinais e sintomas clínicos, só que neste caso, apresenta uma maior variabilidade entres os pacientes, porém possuindo uma característica específica em comum, geralmente etiológica. Fazem parte deste grupo a Epilepsia do Lobo Temporal Mesial(ELT-M), hamartoma hipotalâmico e Síndrome de Rasmussen.
3 - Epilepsia estrutural/metabólica: possui uma menor especificidade do que os outros dois grupos anteriores. São secundárias a lesões ou condições específicas estruturais ou metabólicas.
4 - Epilepsias de causas desconhecidas: anteriormente chamadas de criptogênicas, são epilepsias que não possuem evidências, principalmente em relação à etiologia, para serem encaixadas em uma das categorias anteriores.
Outras formas de classificações das epilepsias podem envolver outras dimensões como evolução natural da doença (encefalopatias, autolimitadas, fármacoresistentes etc.), idade de início (neonatal, lactente, infância, adulto e idoso) e outras características como a presença de gene específico, de padrão em neuroimagem ou eletroencefalográfico.
síndro-26 Capítulo 1. As epilepsias
27
2 Epilepsia do lobo temporal
2.1 Epidemiologia e fisiopatologia
As epilepsias que acometem o lobo temporal são as de maior prevalência na idade adulta. Estima-se que em cerca de 25% de todos os pacientes, a epilepsia é de localização temporal, e se analisarmos apenas as epilepsias focais, temos que 66% são deste lobo (TELLEZ-ZENTENO; HERNÁNDEZ-RONQUILLO,2012).
As epilepsias do lobo temporal podem ser divididas por sua etiologia (ENGEL, 1996). No grupo das genéticas, o principal exemplo é a Epilepsia Temporal Familiar (BERKOVIC et al.,1996). Podemos dividir as epilepsias de causa estrutural/metabólica em ELT-M e Epilepsia Lesional/Neocortical do Lobo Temporal (WALCZAK, 1995). Há ainda a descrição de epilepsias de origem desconhecida como a Epilepsia do Lobo Temporal Familiar Idiopática (WARD; EVANSON; COCKERELL, 2002).
Normalmente é difícil fazer a separação das epilepsias temporais a nível ambulatorial, e por isso não se tem uma real prevalência de cada subtipo na população geral. Geralmente os trabalhos são realizados em séries de pacientes que foram referenciados a grandes centros cirúrgicos devido à refratariedade farmacológica. Nestas séries, cerca de 70% dos pacientes com epilepsia do lobo temporal possuem esclerose do hipocampo, sendo assim diagnosticadas como ELT-M (ENGEL; WILLIAMSON; WIESER,2008).
A esclerose temporal mesial é definida por gliose e perda neuronal no hipocampo, subículo, giro parahipocampal e córtex temporal ínfero-medial. As mudanças são visualiza-das em CA1, CA3 e hilo. Existem três hipóteses sobre a epileptogenicidade da esclerose hipocampal (RATZLIFF et al., 2002). A mais difundida é que com a perda seletiva das células musgosas no hilo, há um brotamento das fibras musgosas que fazem um feedback inibitório para as células granulares do giro denteado (LÜDERS, 2008). Entretanto, há evidências contrárias a esta hipótese, já que o giro denteado parece não ser a fonte de crises espontâneas (QUEIROZ et al., 2009) e que esta epileptogenicidade hipocampal não precisa de mecanismos secundários como o espalhamento das fibras musgosas (SLOVITER; BUMANGLAG,2013).
Uma outra hipótese é que as células em cesto estão adormecidas pela retirada da aferência excitatória proveniente das células musgosas (SLOVITER,1991). A terceira hipó-tese propõe que a hiperexcitabilidade hipocampal não é devido às células musgosas mortas, mas sim pelas remanescentes que amplificam o padrão de atividade das células granulares (SANTHAKUMAR et al., 2000). Porém, nenhuma dessas hipóteses foi comprovada.
28 Capítulo 2. Epilepsia mesial do lobo temporal
pessoal está relacionado com a maior incidência de esclerose mesial temporal. Os principais insultos na infância relatados são as crises febris, as meningoencefalites, os traumas e a anóxia neonatal (FRENCH et al., 1993).
2.2 Manifestações clínicas e tratamento farmacológico
De acordo com a nova classificação da ILAE, a ELT-M é considerada uma conste-lação, pois possui diversificadas manifestações clínicas em cada paciente, porém com a presença de esclerose mesial temporal em comum (BERG et al.,2010;BERG; SCHEFFER, 2011). As crises focais, na qual a sintomatologia depende da região cerebral afetada, são o tipo de crise mais frequente. Podemos dividir as crises em subjetivas (que são relatadas pelo paciente) ou objetivas (que podem ser observadas).
As crises subjetivas estão presentes em 90% dos pacientes, sendo comumente chamadas de auras. As auras mais prevalentes são as epigástricas e as de medo. Outras descritas são o déjà vu, jamais vu, micropsia, macropsia, alucinações olfatórias e sentimentos de despersonificação (FRENCH et al.,1993;ENGEL; WILLIAMSON; WIESER,2008). As crises objetivas, no entanto, geralmente iniciam-se com um comprometimento motor, olhos arregalados e dilatação das pupilas, que evoluem para automatismos. Outros sintomas que podem estar presentes são a versão dos olhos e da cabeça, vômitos e distúrbios da fala (ENGEL; WILLIAMSON; WIESER, 2008). Apesar da possibilidade de generalização secundária, as crises tônico-clônicas generalizadas são infrequentes e nunca são o tipo de crise predominante (FRENCH et al., 1993).
Apesar das evidências eletrofisiológicas de que o hipocampo é o local onde se iniciam as crises, a clínica ocorre devido à propagação das descargas para regiões adjacentes. Por exemplo, as auras epigástricas ocorrem quando o córtex insular é atingindo, auras de medo na ativação da amígdala, auras psíquicas na propagação para região temporal basal e automatismos quando é o giro cingulado que é afetado (LÜDERS, 2008).
Quanto ao tratamento, são utilizadas muitas drogas na ELT-M, incluindo carbama-zepina, oxcarbacarbama-zepina, lamotrigina e topiramato. Porém, muitos pacientes são refratários ao tratamento farmacológico e são candidatos à realização de cirurgia (ENGEL; WILLI-AMSON; WIESER, 2008).
2.3 Tratamento cirúrgico da epilepsia mesial do lobo temporal
2.3. Tratamento cirúrgico da epilepsia mesial do lobo temporal 29
Especificamente nas epilepsias temporais, utilizando apenas EEG de escalpe com eletrodos esfenoidais, era possível realizar o diagnóstico e submeter o paciente para realização de lobectomia temporal (BINDER; SCHRAMM, 2008). Logo se percebeu que apenas a retirada cortical, sem retirar as estruturas mais profundas como hipocampo e amígdala, estava associada com um mau prognóstico cirúrgico. Porém, a ressecção bilateral do hipocampo não é realizada devido a uma importante amnésia anterógrada (BINDER; SCHRAMM, 2008).
Com o refinamento das técnicas neurofisiológicas invasivas como a eletrocorticografia e mapeamentos funcionais, surgem técnicas de ressecções individualizadas. Entretanto, especificamente na ELT-M, não foi observado melhora nos resultados quando comparada a cirurgia padrão por marcos anatômicos e a cirurgia sob medida (NAIR; NAJM, 2008; BINDER; SCHRAMM, 2008). Em 99 estudos sobre a lobectomia temporal revisados por McIntosh, Wilson e Berkovic (2001), a taxa de pacientes livres de crises variou entre 33 e 93% (média de 70%). Quando avaliados apenas os estudos com segmento de 2 a 5 anos, esta variação caiu para 52 a 58%.
No Brasil, o procedimento descrito pelo neurocirurgião Paulo Niemeyer, a amida-lohipocampectomia por abordagem transventricular, apresentada em 1957 com uma série de 42 pacientes, obteve uma taxa de resultados satisfatórios de 74% no segmento de 6 meses à 10 anos, similar à série de 35 pacientes do mesmo grupo, que foram submetidos a ressecção sob medida por registro eletrocorticográfico (GODOY; A.C.; PALMINI,2008).
31
3 Eletrocorticografia intraoperatória
A eletrocorticografia, isto é, o registro da variação do potencial elétrico feito por meio de eletrodos diretamente sobre o córtex cerebral, foi primeiramente descrita por Berger em pacientes com deformidades no crânio na década de 30 do século passado. O primeiro uso em cirurgias foi nas ressecções de tumores corticais após a observação que estes modificavam os padrões elétricos por lesões das regiões adjacentes (HOLMES; CHATRIAN, 2008; NAIR; NAJM, 2008).
O eletrocorticograma (ECoG) foi utilizado pela primeira vez na epilepsia por Wilder Penfield e Herbert Jasper no final da década de 1930. Dentre outras coisas, estes estabeleceram que a convergência da área de lesão anatômica epileptogênica e da lesão fisiológica epileptogênica é sempre necessária para um bom prognóstico cirúrgico (ALMEIDA; MARTINEZ; FEINDEL, 2005;NAIR; NAJM, 2008).
A lesão epileptogênica é a região com alteração anatômica/estrutural responsável pelo circuito epileptogênico, como, por exemplo, a esclerose mesial temporal. Essa área é cercada por outra região que apresenta atividade epileptiforme interictal, chamada de zona irritativa. A região onde é detectado o início das crises é denominada zona de início ictal. A zona epileptogênica é uma zona teórica, apenas determinada após a cirurgia, que quando removida totalmente deixa o paciente livre de crises. A zona sintomatogênica é a área cortical atingida responsável pelos sintomas dos pacientes (NAIR; NAJM,2008).
Desta forma, são utilizadas técnicas de imagem como a ressonância magnética, PET e SPECT para a determinação da lesão epileptogênica. A zona de início ictal só é determinada em registros crônicos de ECoG, já que são raras as crises durante uma cirurgia aguda (NAIR; NAJM, 2008). Outra região importante a ser localizada, é a chamada zona eloquente, responsável pelas funções motoras, sensitivas e cognitivas, devendo ser evitada de ser ressecada, diminuindo a iatrogenicidade. Tais zonas eloquentes, quando não são evitadas por marcos anatômicos nas cirurgias padronizadas, são geralmente detectadas por mapeamento cortical e potencial evocado (HOLMES; CHATRIAN,2008;NAIR; NAJM, 2008).
32 Capítulo 3. Eletrocorticografia intraoperatória
3.1 Espículas interictais
As EI são descargas paroxísticas, morfologicamente definidas, intermitentes, que refletem breves salvas de disparos neuronais, sendo frequentemente observadas no EEG de pacientes com epilepsias focais (GASTAUT, 1972). A Federação Internacional de Neurofisiologia Clínica (IFCN) define as EI como uma descarga interictal transiente, que se destaca da atividade de base, com um pico pontiagudo, com duração entre 20 e 70 ms, com o componente principal geralmente negativo e de amplitudes variadas (BENICZKY, 2012).
A ocorrência desse tipo de grafoelemento no EEG de escalpe, quando associada a uma boa história clínica, é determinante no diagnóstico das diferentes síndromes epiléticas, por exemplo, as epilepsias focais (NIEDERMEYER; SCHOMER; SILVA, 2011). Apesar de terem sido descritas pela primeira vez a mais de 70 anos, a exata relação desses eventos com a gênese, manutenção e término das crises ainda é motivo de debates (MCBRIDE et al., 1991; ALARCON et al., 1997; HUFNAGEL et al., 2000;STALEY, 2005). A taxa de espículas pouco varia com o tratamento farmacológico, frequência ou proximidade das crises, não sendo assim um bom marcador para a gravidade ou prognóstico da doença (ALARCON et al., 1997). Além disso, as espículas possuem pouca especificidade na localização da fonte da atividade epileptiforme (ALARCON et al.,1997; HUFNAGEL et al.,2000; NIEDERMEYER; SCHOMER; SILVA,2011). Entretanto, alguns pesquisadores advogam que a quantificação das EI no ECoG intraoperatório são uteis para a determinação do prognóstico cirúrgico (MCBRIDE et al.,1991;ALARCON et al., 1997;HUFNAGEL et al., 2000; CHEN et al., 2006).
Uma hipótese sugerida é que existam dois tipos diferentes de EI, as ditas vermelhas, que estariam intimamente ligadas à zona epileptogênica, e as ditas verdes geradas em tecidos normais (LÜDERS et al.,2006). Porém, ainda não há características definidas que consigam separar as espículas nestes dois grupos. Contudo,Engel et al. (2009) hipotetizam que a associação das EI com as oscilações de alta frequência (OAF) seriam as espículas vermelhas, e as sem associação, as verdes.
3.2 Oscilações de alta frequência
3.2. Oscilações de alta frequência 33
Para caracterizar uma oscilação cerebral, devemos seguir alguns critérios como a descrição da localização da rede oscilatória, a frequência dominante, a amplitude, a extensão da rede, os possíveis mecanismos de propagação e as correlações comportamentais e clínicas (DRAGUHN et al., 2000).
Desde os primeiros estudos em humanos, apesar de controversa, houve a separação em dois tipos de OAF (BRAGIN et al., 1999a; BRAGIN et al.,1999b). O primeiro tipo, denominado de “ripples”, são oscilações breves, em salvas de 5 a 15 ondas sinusoidais, com ciclo aproximado de 5 milissegundos (aproximadamente 200 Hz, variando de 80 à 250 Hz), que aparecem durante o sono de ondas lentas, vigília relaxada ou comportamentos de consumação, semelhante ao encontrado nas descrições iniciais (BRAGIN et al., 1999a; BRAGIN et al., 1999b;BUZSAKI et al., 1992). Em registros extracelulares, os “ripples” apresentam-se com baixa amplitude (<500 uV) normalmente associados a uma onda aguda (do inglês, “sharp-wave”) de alta amplitude (BUZSAKI; LEUNG; VANDERWOLF, 1983;
SUZUKI; SMITH, 1987). Os “ripples” são oscilações fisiológicas, envolvidas na formação de memória (GIRARDEAU et al., 2009) e acredita-se que sejam o resultado da somação espacial de potenciais inibitórios pós-sinápticos (IPSPs) gerados por um subgrupo de interneurônios que controlam as descargas de neurônios principais (BUZSAKI et al.,1992; DRAGUHN et al., 2000; YLINEN et al.,1995).
O segundo tipo de OAF é denominado de “fast ripples”, e foram descritos no hipocampo de modelos de epilepsia em animal com o uso de micro-eletrodos bem como em pacientes com epilepsia submetidos à cirurgia de ressecção do lobo temporal (BRAGIN et al.,1999a;BRAGIN et al.,1999b;BRAGIN et al.,2002). Em seguida, foi relatado o registro de “fast ripples” em estruturas neocorticais, utilizando-se macro-eletrodos (JACOBS et al.,2008; URRESTARAZU et al., 2007). A frequência de oscilação dos “fast ripples” varia entre 250 e 600 Hz. É importante notar que enquanto os “ripples” são encontrados em tecidos normais, os “fast ripples” estão intimamente associados ao tecido patológico da zona epileptogênica (BRAGIN et al., 2004; JACOBS et al., 2008), podendo coexistir na zona de início ictal (BRAGIN et al., 2002; JIRSCH, 2006), bem como em regiões com lesões epileptogênicas (BRAGIN et al.,2002; STABA et al., 2007;CREPON et al., 2009).
34 Capítulo 3. Eletrocorticografia intraoperatória
da área epileptiforme (JACOBS et al.,2008). Por exemplo, crianças submetidas as cirurgias em que foram ressecadas as regiões com maior taxa de atividade de OAF, em análise posterior ao ato, obtiveram um melhor prognóstico cirúrgico (AKIYAMA et al., 2011).
Há também a descrição recente da presença de OAF patológicas em eletrodos de escalpo (ANDRADE-VALENCA et al., 2011;KOBAYASHI et al., 2010; KOBAYASHI et al., 2011; MELANI et al., 2013), no entanto com sua validade ainda está em debate.
Parte II
37
4 Objetivos
Considerando que: (1) a EMLT é o tipo de epilepsia com o maior número de procedimentos cirúrgicos realizados e que, aproximadamente, apenas 50% destes ficam livres de crise num segmento de 2 anos; (2) o ECoG intra-operatório possui um potencial para a previsão do controle das crises, e que entretanto não há relatos do uso de OAF nesta modalidade; (3) as OAF possuem uma maior afinidade com o tecido epileptogênico.
Nossa hipótese é de que a ocorrência de OAF em ECoG intra-operatório, em comparação às EI possui maior acurácia na predição do controle das crises em pacientes com EMLT submetidos à cirurgia padronizada de lobectomia temporal.
Dessa forma, nosso objetivo geral é avaliar a relevância da quantificação dos marcadores eletrocorticográficos intra-operatórios da EMLT para a determinação do prognóstico cirúrgico.
Nossos objetivos específicos são: (1) quantificar as EI e OAF neste tipo de registro; (2) avaliar a ocorrência dos marcadores nas diferentes etapas de registro; (3) avaliar a
Parte III
41
5 Métodos
5.1 Características clínicas dos pacientes
A casuística foi formada por dezessete pacientes com ELT-M unilateral, refratários ao tratamento farmacológico e com indicação clínica para a realização de cirurgia, que foram submetidos à lobectomia temporal anterior associada a amidalo-hipocampectomia seletiva (LTA−AHS), e com registro intra-operatório de ECoG. Esses procedimentos
foram realizados entre 2003 e 2011 na Unidade de Pesquisa e Tratamento das Epilepsias (UNIPETE) da Universidade Federal de São Paulo (UNIFESP). O procedimento foi provado pelo Comitê de Ética em Pesquisa do Hospital São Paulo/UNIFESP sob o número 1038/03 (Anexo A).
A maioria dos pacientes era do sexo masculino (n = 11; 64%), com média de idade na época da cirurgia de 31 anos, variando de 11 a 50 anos. Todos apresentavam crises há mais de 10 anos (variando de 10 a 42 anos de epilepsia). A frequência de crises registradas por pacientes variou de 1 a 180 por mês (média = 20 ± 48 ; mediana = 4), com duração
média de 2,5 minutos (variando de 30 segundos a 7 minutos). Em relação à lateralização, 11 (64%) eram do hemisfério esquerdo. Na tabela1 podemos observar algumas características
clínicas de cada paciente.
Tabela 1 – Características clínicas dos pacientes
NOME GÊNERO
INÍCIO IDADE FREQUÊNCIA DURAÇÃO
LATERALIZAÇÃO DA EPILEPSIA NA CIRURGIA DAS CRISES DAS CRISES
(anos) (anos) (crises/mês) (minutos)
1 AEF Masculino 12 34 4 1 Direita
2 CSS Masculino 16 35 4 1.5 Esquerda
3 DPV Masculino 15 41 2 1 Esquerda
4 ECS Feminino 12 50 5 3 Esquerda
5 FNP Feminino 13 29 - 5 Esquerda
6 LMP Feminino 16 35 3 2 Direita
7 MBB Feminino 32 51 2,5 5 Direita
8 OS Masculino 13 44 2,5 2,5 Direita
9 OPR Masculino 2 12 180 0,5 Direita
10 RLA Masculino 4 21 1 1 Esquerda
11 RB Masculino 0,6 16 75 1 Direita
12 RGS Masculino 7 20 12 7 Esquerda
13 RIO Masculino 14 34 1,5 3 Esquerda
14 SAT Feminino 18 29 - 3 Esquerda
15 TFFC Feminino 7 49 4 1,8 Esquerda
16 TPS Masculino 0,6 11 30 - Esquerda
17 WAS Masculino 8 44 16 2 Esquerda
42 Capítulo 5. Métodos
74 macro-eletrodos subdurais, com duração total de 1568 segundos (aproximadamente 25 minutos), do paciente JFDV, sexo feminino, com 22 anos no momento da cirurgia.
5.2 Procedimento cirúrgico e registro eletrográfico
O procedimento cirúrgico ocorreu em quatro tempos, com três etapas de registro. No primeiro tempo, após a indução anestésica, foi realizada a exposição lateral do córtex temporal através da incisão no escalpe, reflexão inferior do músculo temporal, craniotomia temporal e reflexão anterior da dura-máter (BINDER; SCHRAMM, 2008).
Após a exposição, foram colocados os eletrodos, sendo 3 tiras com 8 eletrodos, uma em cada um dos giros temporais (superior, médio e inferior) e 2 tiras com 4 eletrodos no córtex basal, transversalmente, em contato com a porção inferior do giro temporal inferior, o giro occipito-temporal lateral e o giro parahipocampal, realizando o registro por 10 minutos em média (Figura 3). Nas tiras utilizadas, os contatos têm um diâmetro de 4 mm (Área de 12,5 mm2) e o espaço entre cada eletrodo é de 6 mm, totalizando uma
distância de 1 cm entre os centros de contatos adjacentes.
a
b
S P
A I
L
M
P A
Figura 3 – Posição dos eletrodos na primeira etapa de registro. (a) Desenho esquemático com a posição aproximada dos eletrodos neocorticais. Três tiras de 8 eletro-dos posicionadas nos giros temporais superior, médio e inferior. (b) Desenho esquemático com a posição aproximada dos eletrodos basais. Duas tiras de 4 eletrodos. P: Posterior; A: Anterior; I: Inferior; S: Superior; M: Medial; L: Lateral.
5.3. Controle das crises no pós-operatório 43
e foram recolocadas as 3 tiras nos giros temporais superior, médio e inferior remanescentes, e em seguida registrando por mais 10 minutos.
No terceiro tempo, foi realizada a ressecção em bloco das estruturas mediais: hipocampo, giro parahipocampal, amigdala e fimbria (BINDER; SCHRAMM,2008). Após a ressecção, foi realizado o registro do sinal por mais 10 minutos, com os canais situados nos giros temporais remanescentes, como na etapa de registro anterior. O último tempo cirúrgico foi a sutura por planos e recuperação anestésica.
Todos os registros foram realizados por um aparelho Nihon-Koden de 32 canais, com uma taxa de amostragem de 1 kHz e filtro analógico passa baixa de 300 Hz. Os canais que apresentavam cheios de artefatos foram eliminados em uma fase de pré-processamento.
5.3 Controle das crises no pós-operatório
Todos os pacientes realizaram um acompanhamento extensivo com toda a equipe do UNIPETE/UNIFESP, antes e depois do ato cirúrgico. Para determinar o resultado cirúrgico quanto ao controle das crises, foi utilizada a escala de Engel, descrita na tabela 2.
Tabela 2 – Classificação de resultado cirúrgico de Engel. Adaptada deTonini et al. (2004).
Engel I - Livre de crises incapacitantes A. Completamente livre desde a cirurgia;
B. Crises parciais simples não incapacitantes desde a cirurgia; C. Algumas crises incapacitantes após a cirurgia, mas livre de crises
incapacitantes por >2 anos
D. Crises generalizadas apenas com descontinuidade de DAE. Engel II - Crises incapacitantes raras
A. Inicialmente livre de crises incapacitantes, mas ainda apresenta raras crises; B. Raras crises incapacitantes desde a cirurgia;
C. Crises incapacitantes ocasionais desde a cirurgia, mas raras nos últimos 2 anos D. Crises noturnas apenas.
Engel III - Melhora evidente A. Redução evidente das crises;
B. Intervalos prolongados livres de crises somando mais de 50 % do período de
seguimento, mas inferior a 2 anos
Engel IV - Sem melhora evidente A. Sem redução significativa das crises; B. Sem alterações evidenciadas;
C. Piora das crises;
44 Capítulo 5. Métodos
não apresentaram melhora evidente com o procedimento, sendo classificados como Engel IV (Figura4).
1A 1B-D 2 3 4
Figura 4 – Distribuição do resultado cirúrgico em relação ao controle das crises no segundo ano, de acordo com a classificação de Engel.
5.4 Detecção e classificação de espículas interictais
O método de detecção e classificação das EI é uma adaptação da ferramenta utilizada para separação de potenciais de ação em registro extracelular (QUIROGA; NADASDY; BEN-SHAUL,2004).
A etapa de detecção é realizada por limiar de amplitude, ou seja, são selecionados todos os eventos no qual o potencial elétrico é maior que a soma de cinco desvios-padrões com a média. Em seguida, os eventos detectados passam por um processo intermediário de extração de características por transformada discreta de wavelets. Com as características extraídas, realiza-se o agrupamento através do método superparamagnético, objetivando separar os eventos pela morfologia.
A última etapa consiste na exclusão dos grupos que não possuem características de EI, como os artefatos de clipagem. Na figura 5 podemos observar a representação esquemática do método aplicado. Todo este processo foi realizado através de rotinas desenvolvidas na plataforma MATLAB¥R
(The MathWorks, Inc.).
5.5 Detecção e classificação de oscilações de alta frequência
5.6. Análise estatística 45
Sinal Original
Seleção de eventos por Limiar de Amplitude
Extração de Características por Wavelet
+
Agrupamento pelo método Superparamagnetico
Inspeção Visual
EI Artefato
PT17T1CH29
Figura 5 – Detecção e classificação de espículas interictais. Do sinal original, seleciona-se eventos com amplitude maior que o limiar de 5 desvios-padrões acima da média. Por um processo de extração de características e agrupamento supraparamagnético, os eventos são divididos em grupos e classificados em EI ou Artefato por inspeção visual.
De forma semelhante ao método de detecção das EI, também se utiliza um critério de amplitude. Desta forma, eventos que ultrapassam o limiar de cinco desvios-padrões acima da média são considerados candidatos à OAF. O algoritmo considera o início e fim do evento o momento em que o envelope de amplitude cruza o limiar.
A etapa seguinte consiste em verificar se o evento candidato tem no mínimo 3 ciclos completos. Isto é avaliado pela presença de pelo menos 7 máximos locais dos valores absolutos do sinal filtrado no período do evento. Na última etapa, todos os eventos passam por uma inspeção visual no qual são excluídos os artefatos. Na figura 6podemos observar o desenho esquemático do método.
5.6 Análise estatística
46 Capítulo 5. Métodos
Inspeção Visual
Sinal Original Sinal Filtrado
Envelope de Amplitude
a
b
c
Valores Absolutosd
e
0.01 0.03 0.05 10ms 50 CWT Tempo (ms) 300 250 200 150 100 50í í 0 25 50
300 200 100 (UA) Frequência (Hz) início fim início fim
Figura 6 – Detecção e classificação de oscilações de alta frequência (a) Sinal original. (b) Sinal filtrado entre 80-300Hz. (c) Envelope de amplitude do sinal filtrado. Calculamos um limiar acima de 5 desvios-padrões da média. Determinamos o início e o fim do evento ao cruzar o limiar. (d) Verificamos se o evento tem o critério de duração que consiste ter pelo menos 7 máximos locais (3 ciclos completos) dos valores absolutos do sinal filtrado. (e) Os eventos detectados passam por uma inspeção visual onde são mostrados ao avaliador o sinal original, o sinal filtrado e o espectrograma por transformada contínua de wavelets. Nesta etapa são eliminados artefatos.
Da curva ROC, extraímos os valores de corte do maior valor da soma da sensibilidade e especificidade.
Para cada característica avaliada, obtemos apenas um valor de de AUC. Objetivando obter uma variabilidade para cada um destes valores, utilizamos o método que denominamos de Leave One Out (LOO) o qual consiste em realizar a análise com subgrupos de pacientes, deixando sempre um de fora desta. Com este tipo de análise podemos observar se o resultado encontrado é consistente entre os pacientes e ou se é influenciado por apenas um.
5.6. Análise estatística 47
Consideramos estatisticamente significativos se os valores obtidos pelos valores originais for acima do percentil 95% da distribuição aleatorizada (p > 0,05).
0 10 20 30 40 50 60 70 80 90 100
0 500 1000 1500 2000 2500 3000 3500 4000
AUC (%)
p = 0,05
A B C D
C A D B
B D A C
1º 2º 3º 4º
a b
Parte IV
51
6 Resultados
6.1 O registro eletrocorticográfico
Analisamos sinais de ECoG de 17 pacientes, gravados em três etapas cada um, em um total de 8 horas e 40 minutos de registro. Na primeira etapa de registro, a duração média foi de 700 segundos por paciente, variando entre 386 e 1030 segundos. Na segunda etapa, a variação foi de 401 a 864, com média de 617 segundos. Por fim, na última etapa a média foi de 616, variando de 481 a 978. Na figura 8 podemos observar a duração de cada paciente em cada etapa de registro. Note que não houve diferença estatística entre as diferentes etapas (Figura 8d).
300 650 1000 17 16 15 14 13 12 11 10 9 8 7 6 5 4 3 2 1
# do Paciente
Duração (s) 300 650 1000 17 16 15 14 13 12 11 10 9 8 7 6 5 4 3 2 1
# do Paciente
Duração (s) 300 650 1000 17 16 15 14 13 12 11 10 9 8 7 6 5 4 3 2 1
# do Paciente
Duração (s)
1ª 2ª 3ª 400 500 600 700 800 900 1000 Duração(s)
Etapa de Registro
a
1ªb
2ªc
3ªd
Figura 8 – Duração por etapa de registro, na primeira (a), segunda (b) e terceira etapa de registro (c). Boxplot da duração por etapa de registro (d).
Em relação ao número de canais registrados por paciente, na primeira etapa de registro a média foi de 25, variando entre 13 e 31 canais. Na segunda etapa, a média foi de 23 canais (variação: 13 a 28) e na terceira foi de 18 canais (variação: 10 a 24). Na figura 9 podemos observar o número de canais registrados por paciente em cada etapa de registro. Note que houve uma queda significativa entre a primeira e a última etapa.
52 Capítulo 6. Resultados
0 8 16 24 32 17 16 15 14 13 12 11 10 9 8 7 6 5 4 3 2 1
# do Paciente
# de canais 1ª
0 8 16 24 32 17 16 15 14 13 12 11 10 9 8 7 6 5 4 3 2 1
# do Paciente
# de canais 2ª
0 8 16 24 32 17 16 15 14 13 12 11 10 9 8 7 6 5 4 3 2 1
# do Paciente
# de canais 3ª
1ª 2ª 3ª 8
16 24 32
# de canais
Etapa de Registro
a
b
c
d
*
Figura 9 – Número de canais de registro, na primeira (a), segunda (b) e terceira etapa de registro (c). Boxplot do número de canais por etapa de registro (d). * p < 0,05 no teste de Kruskal-Wallis.
duração da etapa (De) e multiplicada por um fator de correção (600), obtendo-se a taxa
de ocorrência do canal (T Och) em número de eventos em 10 minutos.
T Och = n∗600
De (6.1)
Os canais que não possuíram eventos foram eliminados do cálculo da taxa de ocorrência por paciente (T Opt), que foi calculada como o somatório das taxas de ocorrências
dos canais (T Och), pelo número de canais ativos (Na).
T Opt = qNa
ch=1T Och
Na (6.2)
Para estimar o tamanho da área irritativa, calculamos para cada evento a proporção de canais ativos (PA) por paciente em uma etapa de registro, representado pela razão do número de canais ativos (Na) pelo número total de canais registrados (Nt) nesta etapa.
P A= Na
Nt (6.3)
6.2 Espículas interictais
6.2. Espículas interictais 53
200uV
Pt=4; ch=1; N = 620
200uV
Pt=10; ch=1; N = 240
50ms
50uV
Pt=13; ch=24; N = 156
Figura 10 – Exemplos de espículas interictais identificadas na primeira etapa de registro. Pt: Número do pacientes; ch: Número do canal; N: Número de eventos no canal. Linha preta: Média dos eventos. Área cinza: Desvio-padrão.
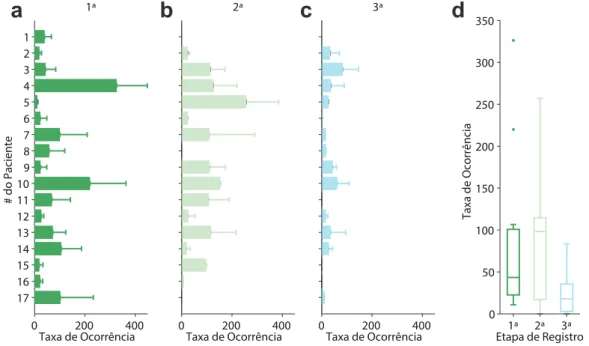
Na primeira etapa de registro, a taxa de ocorrência por paciente das EI variou de 10 a 326 eventos em 10 minutos (Média = 75; Mediana = 43); Na segunda a média foi de 76 em 10 minutos (Mediana = 98; Variação de 0 à 256); Na última a variação foi de 0 à 83, com média de 24 eventos em 10 minutos (Mediana = 17 - Figura 11).
0 200 400 17 16 15 14 13 12 11 10 9 8 7 6 5 4 3 2 1
# do Paciente
Taxa de Ocorrência 1ª
0 200 400 Taxa de Ocorrência
2ª
0 200 400 Taxa de Ocorrência
3ª
1ª 2ª 3ª 0 50 100 150 200 250 300 350
Taxa de Ocorrência
Etapa de Registro
a
b
c
d
Figura 11 – Taxa de ocorrência de espículas interictais nos canais ativos. (a-c) Taxa de ocorrência por etapa de registro. A barra sólida é a média de eventos e a barra de erro é o desvio-padrão. (a) 1a (b) 2a e (c) 3a etapa de registro. (d)
Boxplot da taxa de ocorrência por paciente das espículas interictais. Não houve diferença significativa entre as etapas de registro. Teste utilizado: Friedman.
Quando avaliamos a proporção de canais ativos, observamos que a primeira etapa de registro obteve em média uma área irritativa maior que as demais (Figura 12). A média nesta etapa foi de 53%, variando de 12 à 100%, contra 21 % nas duas outras etapas (variação de 0 à 85% na segunda e 0 à 81% na última).
54 Capítulo 6. Resultados
0 25 50 75 100
17 16 15 14 13 12 11 10 9 8 7 6 5 4 3 2 1
# do Paciente
Proporção de Ativos (%) 1ª
0 25 50 75 100
Proporção de Ativos (%) 2ª
0 25 50 75 100
Proporção de Ativos (%) 3ª
1ª 2ª 3ª
0 25 50 75 100
Etapa de registro
Proporção de
A
tivos (%)
a
b
c
d
*Figura 12 – Proporção de canais com espículas interictais. (a) 1a
, (b) 2a
e (c) 3a
etapa de registro. (d) Boxplot com a proporção de canais com espículas interictais. A primeira etapa de registro obteve proporcionalmente mais eletrodos ativos que as demais. * p < 0,05 no teste de Friedman.
tempos subsequentes), não houve diferença estatística na média da taxa de ocorrência e proporção de eletrodos ativos (Figura13).
1ª 2ª 3ª 0 50 100 150 200 250 300 350
Etapa de registro
Taxa de Ocorrência
1ª 2ª 3ª 0
25 50 75 100
Etapa de registro
Proporção de Canais Ativos
a
b
Figura 13 – Taxa de ocorrência e proporção de canais ativos das espículas interictais na região neocortical remanescente. (a) Taxa de ocorrência das espículas interictais na região neocortical remanescente. (b) Proporção de canais com espículas interictais. Não houve diferença estatística entre nenhum grupo. Teste utilizado: Friedman.
6.2. Espículas interictais 55
eletrodos basais. Na segunda etapa de registro, na região neocortical há uma distribuição mais uniforme com um predomínio nos canais médio-posteriores. No hipocampo, houve maior ativação nos eletrodos posteriores. Na terceira etapa de registro segue um padrão uniforme (Figura 14).
1ª
2ª
3ª
Neocortical
P A I SBasal
L MHipocampal
P A P Amax
min
I S I SFigura 14 – Distribuição espacial das espículas interictais. Mapas da análise de grupo com a taxa de ocorrência normalizada das espículas interictais em cada etapa de registro. Observe que na primeira etapa de registro, há maior quantidade de EI nos eletrodos anteriores da região neocortical e nos eletrodos mesiais dos eletrodos basais. Na segunda, destaca-se a presença de espículas em regiões posteriores do hipocampo. Caixa pontilhada: Região neocortical persistente nos 3 tempos de registro. S: Superior; M: Inferior; P: Posterior; A: Anterior; M: Médio; L: Lateral. Os mapas individuais por paciente encontram-se no Apêndice B.
56 Capítulo 6. Resultados
0 10 20 30 40 50 60 70 80 90 100 0 500 1000 1500 2000 2500 3000 3500 4000
p = 0,305 Pré
AUC (%)
p = 0,05
Pós
p = 0,252
p = 0,05
0 10 20 30 40 50 60 70 80 90 100 0 500 1000 1500 2000 2500 3000 3500 4000 AUC (%)
0 10 20 30 40 50 60 70 80 90 100 0 500 1000 1500 2000 2500 3000 3500 4000
p = 0,386 Delta
AUC (%)
p = 0,05
Figura 15 – Taxa de ocorrência das espículas interictais na predição do resultado cirúrgico. Observe que as EI não obtiveram previsão satisfatória acima da chance. Ponto vermelho − Área sob a curva utilizando todos os pacientes. Barra
de erro verde - Leave One Out, distribuição dos valores de AUC retirando um paciente da construção das curvas ROC. Barras azuis − Histograma
das 100.000 combinação aleatória dos valores da taxa de ocorrência entre os pacientes (bootstrap). Linha verde − Percentil 95 % da distribuição do
bootstrap. Valores à direita desta linha é estatisticamente significativos. Pré
− Utilizando a taxa de ocorrência da primeira etapa de registro, antes de
qualquer ressecção tecidual. Pós − Média da taxa de ocorrência da segunda e
terceira etapa (após a ressecção). Delta −Subtração da média das etapas pós
subtraídas pelo tempo pré.
6.3 Oscilações de alta frequência
O algoritmo foi eficaz na detecção de OAF identificando 1.756 eventos no total, em todos as etapas de registro. A média de tempo para realização da quantificação das OAF por etapa de registro foi de 16 segundos, sendo a validação visual a etapa limitante. Na Figura 16podemos observar exemplos de eventos identificados.
Pt=4; ch=1; N = 84
500uV
Pt=10; ch=5; N = 25
500uV
Pt=17; ch=29; N = 98
50ms 50uV 500uV
50uV 50uV
Figura 16 – Exemplos de Oscilações de Alta Frequência identificadas na primeira etapa de registro. Acima: Sinal original; Abaixo: Sinal filtrado entre 80-300Hz; Pt: Número do Pacientes; ch: Número do Canal; N: Número de eventos no canal. Linha preta: Média dos eventos. Área cinza: Desvio-padrão.
6.3. Oscilações de alta frequência 57
0 10 20 30
17 16 15 14 13 12 11 10 9 8 7 6 5 4 3 2 1
# do Paciente
Taxa de Ocorrência 0Taxa de Ocorrência10 20 30 0Taxa de Ocorrência10 20 30 1ª 2ª 3ª 0 5 10 15 20 25 30
Taxa de Ocorrência
1ª 2ª 3ª
a
b
c
d
Etapa de Registro *
Figura 17 – Taxa de ocorrência das oscilações de alta frequência nos canais ativos. (a-c) Taxa de ocorrência por etapa de registro. A barra sólida é a média de eventos e a barra de erro é o desvio-padrão. (a) 1a
(b) 2a
e (c) 3a
etapa de registro. (d) Boxplot da taxa de ocorrência por paciente das oscilações de alta frequência.* p < 0,05 no teste de Friedman.
De forma similar, a proporção de canais com OAF na primeira etapa de registro também foi maior que a da terceira (Figura 18). No primeiro registro, a proporção variou de 0 à 100% dos canais, a mesma variação da segunda etapa, diferindo apenas na média (26% e 11% respectivamente). A proporção média na última etapa foi de 7%, variando
entre 0 e 92%.
Na avaliação dos eletrodos persistentes, assim como nas EI, não houve diferença estatística entre as etapas, nem na média de OAF por canal, e nem na área irritativa (Figura ??).
Ao avaliar a distribuição espacial das OAF, observamos que na primeira etapa de registro há um leve predomínio dos eletrodos mesiais na região basal. Já na segunda etapa, há uma incidência maior na região posterior hipocampal. Na terceira etapa, há uma distribuição difusa dos eventos (Figura 20).
58 Capítulo 6. Resultados
0 25 50 75 100
17 16 15 14 13 12 11 10 9 8 7 6 5 4 3 2 1
# do Paciente
Proporção de Ativos (%) Proporção de Ativos (%)0 25 50 75 100 Proporção de Ativos (%)0 25 50 75 100 1ª 2ª 3ª
0 25 50 75 100
Etapa de registro
Proporção de
A
tivos (%)
1ª 2ª 3ª
a
b
c
d
*Figura 18 – Proporção de canais com oscilações de alta frequência. (a) 1a, (b) 2a e (c) 3a
etapa de registro. (d) Boxplot com a proporção de canais com oscilações de alta frequência. A primeira etapa de registro obteve proporcionalmente mais eletrodos ativos que a última. * p < 0,05 no teste de Friedman.
1ª 2ª 3ª
0 5 10 15 20 25
Etapa de registro
Taxa de Ocorrência
1ª 2ª 3ª
0 25 50 75 100
Etapa de registro
Proporção de
A
tivos
a
b
Figura 19 – Taxa de ocorrência e proporção de canais ativos das oscilações de alta frequên-cia na região neocortical remanescente. (a) Taxa de ocorrênfrequên-cia das espículas interictais na região neocortical remanescente. (b) Proporção de canais com espículas interictais. Não houve diferença estatística entre nenhum grupo. Teste utilizado: Friedman.
6.3. Oscilações de alta frequência 59
1ª
2ª
3ª
Neocortical
P A I SBasal
L MHipocampal
P A P Amax
min
I S I Ssem OAF
Figura 20 – Distribuição espacial das oscilações de alta frequência. Mapas da análise de grupo com a taxa de ocorrência normalizada das OAF em cada tempo cirúrgico. Caixa pontilhada: Região neocortical persistente nos 3 tempos de registro. S: Superior; M: Inferior; P: Posterior; A: Anterior; M: Médio; L: Lateral. Os mapas individuais por paciente encontram-se no Apêndice B.
0 10 20 30 40 50 60 70 80 90 100 0 500 1000 1500 2000 2500 3000 3500 4000
p = 0,026
Pré
AUC (%) p = 0,05
0 500 1000 1500 2000 2500 3000 3500 4000 4500
0 10 20 30 40 50 60 70 80 90 100
p = 0,355
Pós
AUC (%) p = 0,05
0 10 20 30 40 50 60 70 80 90 100 0 500 1000 1500 2000 2500 3000 3500 4000 Delta AUC (%) p = 0,05
p = 0,006
Figura 21 – Taxa de ocorrência das oscilações de alta frequência na predição do resultado cirúrgico. Ponto vermelho− Área sob a curva utilizando todos os pacientes.
Barra de erro verde - Leave One Out, distribuição dos valores de AUC retirando um paciente da construção das curvas ROC. Barras azuis − Histograma
das 100.000 combinação aleatória dos valores da taxa de ocorrência entre os pacientes (bootstrap). Linha verde − Percentil 95 % da distribuição do
bootstrap. Valores à direita desta linha é estatisticamente significativos. Pré
− Utilizando a taxa de ocorrência da primeira etapa de registro, antes de
qualquer ressecção tecidual. Pós −Média da taxa de ocorrência da segunda e
terceira etapa (após a ressecção). Delta −Subtração da média das etapas pós
subtraídas pelo tempo pré.
60 Capítulo 6. Resultados
A Figura22 apresenta o prognóstico determinado por paciente utilizando o valor de corte extraído da curva ROC. Com a taxa de ocorrência da pré-ressecção, todos os
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 0
5 10
1
A
1D 3A
1B 1 A 1 A 1C 1C 1 A 1 A 4 A 3 A 4 A 1
A 1A
3B
2B
Corte
pacientes
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17
í í í 0 5 1
A 1D 3A
1B
1
A
1
A 1C 1C
1 A 1 A 4 A 3 A 4 A 1 A 1 A 3B 2B pacientes Corte
30 Pré Delta
a b
Taxa de O
cor
r
ência
Bom Prognóstico Mau Prognóstico
Figura 22 – Prognóstico determinado pelas oscilações de alta frequência. (a) Taxa de ocorrência na etapa pré-ressecção, note que todos os pacientes Engel IA estão sinalizados com bom prognóstico. Entretanto, 3 pacientes de mau prognóstico (4, 13 e 17) também estão. (b) Delta da taxa de ocorrência entre o pós- e pré-ressecção, note que o paciente #13 muda de grupo. Bolas vermelhas: Mau prognóstico; Bolas azuis: Bom Prognóstico.
pacientes que ficaram livres de crise (Engel IA) estão acima do valor de corte, no grupo dos pacientes de bom prognóstico. Apenas os pacientes 4, 13 e 17, que deveriam estar sinalizados como mau prognóstico, encontram-se acima do valor de corte. Já utilizando o delta da taxa de ocorrência entre o pós- e pré-ressecção, o paciente de número 13 muda de grupo, aumentando a especificidade do método.
6.4 Características clínicas
Avaliando a relação das características clínicas pré-cirúrgicas com o controle das crises, observamos que apenas a presença de atividade interictal bilateral no EEG de escalpe obteve significância estatística na previsão dos pacientes que ficarão livres de crise 2 anos após a cirurgia (tabela 3).
Da mesma forma, ao se comparar as características clínicas discretas com a taxa de ocorrência das OAF, apenas a atividade ictal bilateral foi estatisticamente diferente (Figura 23). Também não houve correlação utilizando as características clínicas contínuas
6.5. O registro de eletrocorticografia crônico 61
Tabela 3 – Características clínicas, eletrofisiológicas e de imagem relacionadas com con-trole das crises. * Apenas atividade ictal bilateral no EEG de escalpe teve significância. n.s.= não significativo.
Característica Livre de CriseNão Sim Total (N=10) (N=7) (N=17)
Sexo MasculinoFeminino 82 34 116 (n.s)
Idade ≥ 30 anos 7 3 10
(n.s.)
< 30 anos 3 4 7
Idade ≥ 5 4 3 7
(n.s.)
de inicio < 5 6 4 10
Atividade ictal sim 5 0 5 (p < 0,05)
bilateral EEG não 5 7 12
Frequência ≥ 20/mês 2 1 3
(n.s)
de crises < 20/mês 8 6 14
Lateralização EsquerdaDireita 37 34 116 (n.s)
Insulto não 6 3 9 (n.s)
prévio sim 4 4 8
EH na RNM simnão 82 52 134 (n.s)
6.5 O registro de eletrocorticografia crônico
62 Capítulo 6. Resultados 0 10 20 Gênero M F −20 −15 −10 −5 0 EEG bilateral Não Sim
Lateralização Insulto Prévio EH na RMN
D E Não Sim Não Sim
Pré
Delta
a b c d e
f g * h i j
Figura 23 – Características clínicas discretas por taxa de ocorrência de oscilações de alta frequência. (a - e) Taxa de ocorrência na pré-ressecção. (f - j) Delta da taxa de ocorrência. (a / f) Gênero; (b / g) Atividade ictal bilateral no EEG; (c / h) Lateralização; (d / i) Insulto prévio; (e / j) Esclerose hipocampal na ressonância magnética nuclear. M Masculino; F Feminino; D Direita; E -Esquerda −10 0 10 20 30 Pre
R2 = 0.063059
0 20 40 60 −30
−20 −10 0 10
Idade na Cirurgia
Delta
R2 = 0.063396
0
R2 = 0.01376
data fitted curve
0 100 200 0
Frequência de Crises R2 = 0.013892 R2 = 0.0025707
0 20 40
Idade de Início R2 = 0.0025205
d
a
b
c
e
f
6.5. O registro de eletrocorticografia crônico 63
100 200 300 400 500 600 700 800 900 1000 1100 1200 1300 1400 1500 Time (s)
02 4 6 8 10 12
#
10 20 30 40 50 60 0
10 20 30 40 50 60 70
#
Canais
Parte V
67
7 Discussão
A EMLT é o tipo de epilepsia cirurgicamente tratável de maior prevalência (BA-NERJEE; FILIPPI; HAUSER, 2009), sendo a lobectomia temporal a cirurgia de epilepsia mais comumente realizada (VIVES et al., 2008). O uso de ECoG intra-operatório na ELT-M é controverso (HOLMES; CHATRIAN, 2008;NAIR; NAJM, 2008;SIMON; GER-RARD; ESKANDAR, 2010), apesar disso, o ECoG pode ter duas principais indicações: (1) Determinação das margens cirúrgicas; (2) Determinação de um prognóstico pós-cirúrgico (SIMON; GERRARD; ESKANDAR, 2010).
Em relação à primeira indicação, as cirurgias padronizadas por marcos anatômicos possuem resultados semelhantes àquelas sob medida (ENGEL, 2008; HOLMES; CHA-TRIAN, 2008; NAIR; NAJM, 2008; SIMON; GERRARD; ESKANDAR, 2010), sendo assim, o procedimento de escolha, por diminuir os custos e o tempo da cirurgia, bem como por exigir menos materiais e profissionais especializados (NAIR; NAJM, 2008). Quanto ao prognóstico, a literatura é divergente, existindo diversos estudos com resultados favoráveis e contrários à correlação da atividade epileptiforme com o resultado cirúrgico (HOLMES; CHATRIAN, 2008; NAIR; NAJM, 2008;SIMON; GERRARD; ESKANDAR,
2010). Entretanto, a maioria destes trabalhos utilizou apenas as EI como marcador da atividade epileptiforme. Contudo, as EI possuem uma distribuição espacial maior do que a área responsável pela geração das crises e a persistência ou aumento de sua atividade não tem relação com o prognóstico (ENGEL,2008;SIMON; GERRARD; ESKANDAR,2010).