UNIVERSIDADE ESTADUAL PAULISTA “JÚLIO DE MESQUITA FILHO”
FACULDADE DE CIÊNCIAS FARMACÊUTICAS CÂMPUS DE ARARAQUARA
Naiara Fachinetti
Avaliação do potencial de carreadores lipídicos nanoestruturados para a administração
cutânea de trans-resveratrol
Naiara Fachinetti
Avaliação do potencial de carreadores lipídicos nanoestruturados para a administração
cutânea de trans-resveratrol
Trabalho de Conclusão de Curso apresentado ao curso de Graduação em Farmácia-Bioquímica, da Faculdade de Ciências Farmacêuticas de Araraquara, da Universidade Estadual Paulista “Júlio de Mesquita Filho” – UNESP, para obtenção
do grau de Farmacêutica-Bioquímica.
Orientador: Prof. Dr. Marlus Chorilli
DEDICATÓRIA
AGRADECIMENTOS
À Deus, pai misericordioso que sempre está ao meu lado, iluminando e abençoando minha trajetória, não me deixando perder a fé nos momentos mais difíceis.
Aos meus familiares, especialmente minha mãe, meus avós e meu tio, que sempre me apoiaram, incentivaram e contribuíram para a realização desse sonho. Além de todo amor, carinho, compreensão, ensinamentos e conselhos em todos os momentos da minha vida.
Ao Prof. Marlus Chorilli, orientador dedicado que proporcionou-se essa oportunidade e com sabedoria soube dirigir-me os passos e os pensamentos para o alcance dos meus objetivos.
À Roberta B. Rigon pela amizade, paciência, compreensão, ensinamentos e dedicação. Esteve comigo desde o começo do projeto até o final, sempre me apoiando e não me deixando desistir nas horas difíceis.
Aos meus amigos, especialmente José Fernando e Aline, amigos verdadeiros que estiveram ao meu lado nesses cinco anos de faculdade, tanto nas horas boas quanto nas ruins. Família que Deus permitiu que eu escolhesse e que me proporcionaram momentos inesquecíveis. Obrigada pela paciência, pelo sorriso, pelo abraço, por me ouvir quando eu precisava e pelos conselhos, essa caminhada não seria a mesma sem vocês.
Ao Matheus por estar ao meu lado nos primeiros anos de Graduação, sempre me ouvindo, dando conselhos e me apoiando.
À todos os professores e funcionários da Faculdade de Ciências Farmacêuticas e do Instituto de Química por todo conhecimento e auxílios.
A FAPESP pelo apoio financeiro para o desenvolvimento deste trabalho, na forma de bolsa de iniciação científica no projeto 2011/19018-1.
SUMÁRIO
Resumo...7
Lista de Tabelas...11
Lista de Figuras...13
Lista de Abreviaturas, Siglas e Símbolos...14
Introdução...16
1. Objetivos...23
2. Material e Métodos...24
2.1. Soluções e Reagentes...24
2.2. Desenvolvimento dos CLN ...24
2.3. Caracterização físico-química dos CLN...25
2.3.1. Determinação do diâmetro médio dos CLN...25
2.3.2. Análise do potencial zeta...26
2.3.3. Análise microscópica...26
2.3.4. Calorimetria diferencial exploratória (DSC)...26
2.3.5. Validação de metodologia analítica para quantificação de RES por CLAE...27
2.3.5.1. Linearidade...28
2.3.5.2. Precisão...28
2.3.5.3. Exatidão...28
2.3.5.4. Limite de Detecção e Limite de Quantificação...29
2.3.5.5. Robustez...29
2.3.6. Validação de metodologia analítica para quantificação RES espectrofotometria UV/VIS...29
2.3.6.1. Linearidade...30
2.3.6.3. Exatidão...30
2.3.6.4. Limite de Detecção de Limite de Quantificação...30
2.3.7. Quantificação do RES presente nos CLN...31
2.3.8. Determinação do coeficiente de partição O/A do RES...31
2.3.9. Estudo de liberação do RES in vitro...32
2.3.10. Avaliação despigmentante in vitro do RES incorporado em CLN...32
2.3.10.1. Determinação da concentração correspondente à atividade inibitória 50% do RES e CLN-RES usando tirosinase com concentração de 480 U/mL...34
3. Forma de análise de resultados...34
4. Resultados & Discussão...35
5.1. Desenvolvimento dos CLN...35
5.2. Caracterização físico-química dos CLN...36
5.2.1. Determinação do diâmetro médio dos CLN...36
5.2.2. Análise do potencial zeta...39
5.2.3. Análise microscópica...40
5.2.4. Calorimetria diferencial exploratória (DSC)...42
5.2.5. Validação de metodologia analítica para quantificação de RES por CLAE...44
5.2.5.1. Linearidade...47
5.2.5.2. Precisão...49
5.2.5.3. Exatidão...51
5.2.5.4. Limite de Detecção e Limite de Quantificação...52
5.2.5.5. Robustez...53
5.2.6. Validação de metodologia analítica para quantificação RES espectrofotometria UV/VIS...53
5.2.6.2. Precisão...55
5.2.6.3. Exatidão...56
5.2.6.4. Limite de Detecção e Limite de Quantificação...57
5.2.7. Quantificação do RES presente nos CLN...58
5.2.8. Determinação do coeficiente de partição O/A do RES...59
5.2.9. Estudo de liberação do RES in vitro...60
5.2.10. Avaliação despigmentante in vitro do RES incorporado em CLN...64
5.2.10.1. Determinação da concentração correspondente à atividade inibitória 50% do RES e CLN-RES usando tirosinase com concentração de 480 U/mL...65
5. Conclusões...67
RESUMO
Validou-se um método analítico para quantificação do RES por cromatografia líquida de alta eficiência (CLAE-DAD) e o teor de RES nos CLNs foi verificado por ultracentrifugação, filtração por membrana de diálise e ultrafiltração. Foi ainda verificada a liberação do RES encapsulado nos CLN e verificada a atividade despigmentante in vitro das formulações. Os resultados mostraram que CLN obtidos com estearato de polioxietileno (40) apresentaram tamanho médio de 100 nm, ao passo que aqueles obtidos com behenato de glicerila apresentaram tamanho médio de 250 nm. As análises de MEV-FEG não se mostraram adequadas para análise da morfologia dos CLN e os ensaios de DSC evidenciaram redução dos picos cristalinos do estearato de polioxietileno (40) e do poloxamer 407 nos CLNs, sugerindo mudança de polimorfos. O método analítico desenvolvido para a quantificação do RES se mostrou satisfatório e pôde ser aplicado nos ensaios de liberação in vitro. Já as metodologias utilizadas para verificação do teor de RES nos CLN não se mostraram adequados para a quantificação do fármaco. Os ensaios de liberação in vitro de RES sugerem que as formulações seguem cinética de liberação segundo o modelo matemático Weilbull, promovendo a liberação controlada do fármaco. As análises de avaliação despigmentante in vitro evidenciaram potencial ação despigmentante do RES livre ou encapsulado nos CLN. Os resultados obtidos sugerem que as formulações desenvolvidas podem ser utilizadas para incorporação do RES, objetivando sua ação como agente despigmentante no tratamento do fotoenvelhecimento cutâneo.
ABSTRACT
LISTA DE TABELAS
Tabela 1. Composição das formulações desenvolvidas com estearato de polioxietileno (40)...35
Tabela 2. Composição das formulações desenvolvidas com behenato de glicerila...36
Tabela 3. Diâmetro médio (Z-Ave e Índice de Polidispersibilidade (Pdl) dos CLNs...37
Tabela 4. Diâmetro médio (Z-Ave) e Índice Polidispersibilidade (Pdl) dos CLNs acrescidos de RES...38
Tabela 5. Resultado da análise do potencial zeta das formulações sem fármaco...40
Tabela 6. Resultado da análise do potencial zeta das formulações acrescidas de fármaco...40
Tabela 7. Tempo de retenção, resolução dos picos e máximo para o trans- e cis-resveratrol...46
Tabela 8. Resultados das áreas dos picos para cada concentração analisada e coeficientes de correlação...48
Tabela 9. Resultados da avaliação da precisão para a repetibilidade (precisão intra-corrida)...49
Tabela 10. Resultados da avaliação da precisão intermediária (precisão inter-corridas)...50
Tabela 11. Resultados da avaliação da exatidão...51
Tabela 12. Resultados do limite de detecção e de quatificação do trans-resveratrol...52
Tabela 13. Resultados da robustez do método analítico cromatográfico para a quantificação do trans-resveratrol...53
Tabela 14. Resultados das curvas para cada concentração e coeficientes de correlação...54
Tabela 15. Resultados da avaliação da precisão para a repetibilidade (precisão intra-corrida)...55
Tabela 16. Resultados da avaliação da precisão intermediária (precisão inter-corridas)...56
Tabela 17. Resultados da avaliação da exatidão...56
Tabela 19. Validação do dispositivo com membranas de 10.000 NMWL (Millipore, Billerica, USA) para o ensaio de eficiência de encapsulação...58 Tabela 20. Análise do filtrado obtido por ultrafiltração para ensaio de eficiência de encapsulação...59 Tabela 21. Perfil de liberação de RES em nanopartículas após 24 horas de análise...61 Tabela 22. Percentual de RES liberado de carreadores lipídicos nanoestruturados (F4.RES e F1’.RES) após 24 horas de análise...62
Tabela 23. Coeficiente de liberação in vitro do RES obtidos através de diferentes modelos matemáticos para as formulações F4.RES e F1’.RES...64
LISTA DE FIGURAS
Figura 1. Estrutura química do RES...19
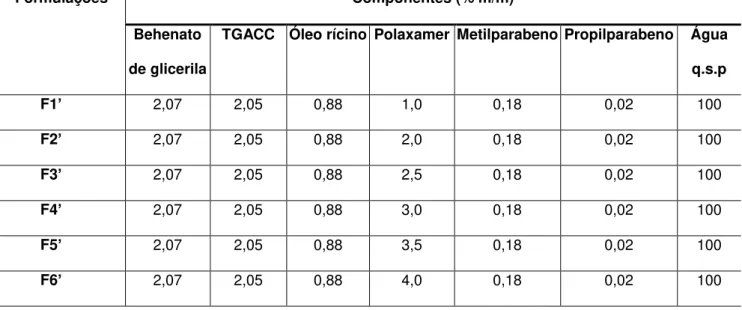
Figura 2. Imagem demonstrando a organização da matriz de NLS (esquerda) e as imperfeições da organização da matriz da partícula (direita) – CLN, distorcendo a formação de um cristal perfeito, o que permite maior capacidade de incorporação de substância ativa (MÜLLER et al., 2007)...22
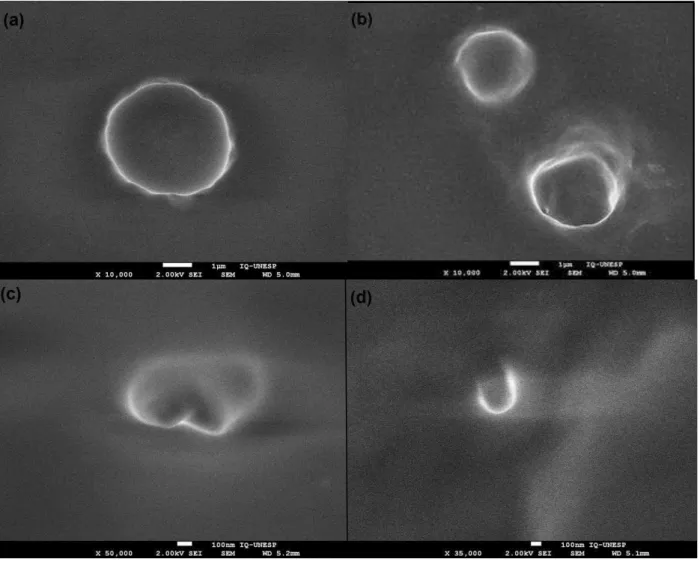
Figura 3. Fotomicrografias das nanopartículas por microscopia eletrônica de varredura com emissão de campo (MEV-FEG). (a) F4; (b) F4.RES; (c) F1’; (d) F1’.RES...41
Figura 4. Curva de DSC de aquecimento das matérias-primas utilizadas para no preparo dos CLNs...42
Figura 5. Curva da formulação F4...43
Figura 6. Curva da formulação F4.RES...43
Figura 7. Curva da formulação F1’...43
Figura 8. Curva da formulação F1’.RES......43
Figura 9. a) Separação cromatográfica obtida com monitoramento em 280-350 nm: calibrador 100% de trans-resveratrol após 1 hora de exposição ambiente a radiação ultravioleta (10 g/mL); b) espectro UV do pico com retenção em 7,194 min (trans-resveratrol); c) espectro UV do pico com retenção 7,847 min (cis-resveratrol) gerados pelo arranjo de diodos...46
Figura 10. Cromatograma obtido com injeção de uma diluição teórica de 30 µg/mL de trans-resveratrol...49
Figura 11. Curva analítica do trans-resveratrol por CLAE...49
Figura 12. Curva analítica do trans-resveratrol obtida por espectrofotometria UV/VIS...55
LISTA DE ABREVIATURAS, SIGLAS E SÍMBOLOS
ET-1 – endotelina-1 RES – trans-resveratrol
CLN – Carreadores Lipídicos Nanoestruturados
MEV-FEG – Microscopia Eletrônica de Varredura com Emissão de Campo DSC – Calorimetria Exploratória Diferencial
CLAE-DAD – Cromatografia Líquida de Alta Eficiência UV – Radiação Solar Ultravioleta
MMP – Metaloproteinases da Matriz ATP – Adenosina-Trifosfato
OXPHOS – Fosforilação Oxidativa ROS – Espécies Reativas de Oxigênio AP-1 – Proteína 1
NF-kB – Fator kB de Transcrição Nuclear MMP1, MMP3, MMP9 – Metaloproteínas IL-6 – Citocina
IL-8 – Citocina TNF-α – Citocina
TGF-β – Fator de Crescimento β
MITF – Fator de Transcrição Associado à Microftalmia MC1-R – Receptor de Melanocortina 1
NL – Nanopartículas Lipídicas
NLS – Nanopartículas Lipídicas Sólidas O/A – Óleo/Água
D – Coeficiente de Difusão das Partículas K – Constante de Boltzmann
T – Temperatura Absoluta η–Viscosidade
Rh – Raio Hidrodinâmico
F1’ RES –Formulação 1’ acrescidas de 0,1% trans-resveratrol
F4 RES – Formulação 4 acrescidas de 0,1% trans-resveratrol DP – Desvio Padrão
DPR – Desvio Padrão Relativo
CME – Concentração Média Experimental CT – Concentração Teórica
LD – Limite de Detecção LQ – Limite de Quantificação IC – Inclinação da Curva Analítica Kp – Coeficiente de Partição IA – Atividade Inibitória
C – Absorbância do Controle a 490nm S – Absorbância da Amostra
T0– Absorbância no tempo zero
TGACC – Triglicérides do Ácido Cáprico/Caprílico Z-Ave – Tamanho Médio
INTRODUÇÃO
A pele humana, assim como os outros órgãos, sofre do envelhecimento cronológico. Também, pelo fato de estar em contato direto com o meio ambiente, está exposta aos danos ambientais, provocados principalmente pela radiação solar (fotoenvelhecimento). Desta forma, o envelhecimento cutâneo surge a partir da combinação do envelhecimento intrínseco ou cronológico, que é dependente da passagem do tempo, e o envelhecimento extrínseco ou fotoenvelhecimento, que depende principalmente do grau da exposição solar (FISHER et al., 2002).
O fotoenvelhecimento promove uma série de efeitos na pele, como secura, aspereza, rugas, elastoses e telangiectasia (SHIMADA et al., 2011), além de levar ao aumento na síntese e no acúmulo de melanina, característica comum em alguns tipos de hiperpigmentação, como melasma, meloderma pós-inflamatório e lentígen solar (BRIGANTI et al., 2003). Tais desordens apresentam um impacto significativo nos aspectos psicológicos, dermatológicos, fisiológicos, sociais, culturais e econômicos do paciente, alterando sua qualidade de vida (HALDER & RICHARDS, 2004).
A exposição à radiação solar ultravioleta (UV) é um fator muito importante para a patogênese de várias doenças cutâneas, incluindo o envelhecimento cutâneo, as hiperpigmentações adquiridas e o câncer de pele (NDIAYE et al., 2011). Ela pode ser dividida em três espectros: UVA (320 a 400 nm), UVB (280 a 320 nm) e UVC (<280 nm), sendo que entre elas, o UVC, até o presente momento, é absorvida pela camada atmosférica de ozônio e não atinge a superfície da Terra (SKOBOWIAT et al., 2011).
alterações imunológicas e indução do estresse oxidativo, que quando associados, podem promover a formação do câncer de pele (WILLIAMS et al., 2011). Já a radiação UVA pode penetrar a epiderme, chegando até a derme, onde induz a formação de oxigênio singlete e radicais livres, que podem causar danos às macromoléculas celulares como proteínas, lipídios e DNA (KATIYAR, 2008).
As mitocôndrias são organelas presentes nas células, cuja principal função é a produção de adenosina-trifosfato (ATP), a qual é uma molécula energética obtida através da fosforilação oxidativa (OXPHOS) (KRUTMANN, 2001). Um dos produtos deste processo é as espécies reativas de oxigênio (reactive oxygen species: ROS) que podem danificar proteínas, lipídios e o próprio DNA (KEHRER, 1993).
A proximidade às ROS, a deficiência de histonas e a baixa capacidade de reparo provocam alta taxa de mutação no DNA mitocondrial (KOCH et al., 2000). Portanto, uma das causas do dano mitocondrial é o desequilíbrio entre o estresse oxidativo e as enzimas “varredoras” dos radicais livres (CHING-YOU et al., 1999).
A radiação contribui também na redução da síntese de colágeno. A formação de colágeno I na derme papilar é reduzida e isso se deve ao dano solar, o que acarreta na diminuição da expressão do gene dos protocolágenos tipos I e III. Os mecanismos que contribuem para tal efeito são a diminuição do receptor do fator de crescimento β (TGF-β) tipo II e a indução da transcrição do fator AP-1. O colágeno alterado diminui a síntese de colágeno novo (RITTIÉ & FISHER, 2002). Consequentemente, ocorre a diminuição da neocolagênese devido a pouca adesão dos fibroblastos ao colágeno alterado (VARANI et al., 2004).
Além dos efeitos na síntese de colágeno, a radiação, sobretudo a UVB, pode levar à hiperpigmentação cutânea, condição comum e geralmente inofensiva que pode ser do tipo adquirida, congênita ou hereditária, que se caracteriza pela presença de manchas de cor mais escura do que a pele normal circundante, sendo o escurecimento um excesso de melanina que forma depósitos na pele (JIMBOW & MINAMITSUJI, 2001; SANFILIPPO et al., 2003). Tal condição normalmente depende do aumento da atividade das enzimas melanogênicas (TOYODA & MOROHASHI, 1998; KANG et al., 2002). Além disso, alguns mediadores produzidos pelos queratinócitos após a exposição à radiação solar, como as interleucinas-1α e a endotelina-1 (ET-1), podem promover a melanogênese (BRIGANTI et al., 2003).
A inibição da tirosinase é a abordagem mais comum para se alcançar o clareamento da pele, pois esta é a grande responsável pela formação de melanina. Há ainda outros mecanismos de ação pelos quais os agentes despigmentantes podem atuar, como inibição de MITF (Fator de Transcrição Associado à Microftalmia); downregulation da atividade MC1-R, maturação e transferência dos melanossomas e aumento da renovação celular cutânea. (JIMBOW & MINAMITSUJI, 2001; BRIGANTI et al., 2003; SOLANO et al., 2006).
Estudos recentes têm demonstrado que o trans-resveratrol (RES) (Figura 1), devido às suas propriedades antioxidantes e anti-inflamatórias, pode ser um importante aliado na prevenção e no tratamento do envelhecimento cutâneo (NDIAYE et al., 2011). Além de ações relacionadas ao fotoenvelhecimento, este composto natural também apresenta ação cardioprotetora, inibição da agregação plaquetária e efeito vasorelaxante (AGGARWAL et al., 2004; VANG et al., 2011).
Figura 1. Estrutura química do RES.
No entanto, algumas de suas propriedades físico-químicas, como limitada solubilidade aquosa e, principalmente, sua alta capacidade de reagir com espécies reativas de oxigênio, dificultam sua eficiência terapêutica tópica, uma vez que possui baixa penetração na pele. Tal fato foi confirmado por Zhang, Flach and Mendelsohn (2007), que mencionam que o RES pode se tornar susceptível a reagir com espécies reativas de oxigênio, diminuindo sua eficácia quando exposto a calor e luz, resultando numa biodisponibilidade diminuída.
A atividade antioxidante é baseada na facilidade com que o oxigênio dos compostos fenólicos presentes no RES podem ser doados para neutralizar os radicais livres produzidos por eventos biologicamente mediados ou por processos oxidativos como a peroxidação de fosfolipídios, através da radiação UV (CHING-YOU et al., 1999). Zhang, Flach and Mendelsohn (2007) demonstraram que o RES pode servir tanto como um antioxidante primário, reagindo diretamente com os radicais livres e convertendo-os em produtos, quanto como um secundário, exercendo ação preventiva, por meio da diminuição da taxa de oxidação pela inibição da atividade da enzima.
Na literatura, observam-se alguns trabalhos que mencionam a utilização de RES por via tópica, incorporado em soluções e hidrogéis (ZHANG et al., 2007; HUNG et al., 2008). Todavia, os relatos acerca de estratégias tecnológicas que podem potencializar a sua ação tópica ainda são escassos.
Assim, sistemas que apresentem a capacidade de compartimentalizar, de maneira eficiente, diversos grupos de princípios ativos e de modificar suas propriedades e comportamento em meio biológico, são promissoras para carrear substâncias com tais propriedades (MAINARDES et al., 2006).
além de protegê-los da degradação térmica ou fotodegradação (MOHANRAJ & CHEN, 2006; GUTERRES et al. , 2007).
Segundo Schaffazick et al. (2003), as nanopartículas têm atraído maior atenção dos pesquisadores devido às suas potencialidades terapêuticas, à maior estabilidade nos fluídos biológicos e durante o seu armazenamento.
Dentre os sistemas nanoestruturados, um grande enfoque tem sido atualmente atribuído às nanopartículas lipídicas (NL) (GUTERRES et al., 2007; DOKTOROVOVA et al., 2009).
As NL de primeira geração são as nanopartículas lipídicas sólidas (NLS), as quais foram desenvolvidas no início da década de 1990, sendo obtidas utilizando apenas lipídios sólidos à temperatura ambiente. As NL de segunda geração são conhecidas como carreadores lipídicos nanoestruturados (CLN), que apresentam matriz composta por um lipídio líquido e um lipídio sólido à temperatura ambiente (MÜLLER et al., 2007).
Os CLN apresentam a vantagem de permitir a veiculação de maior quantidade de substância ativa em comparação com as NLS. Além disso, os CLN permitem maior tempo de permanência das substâncias ativas no interior da matriz durante o período de shelf life ou tempo de prateleira (recomendação do tempo que os produtos podem ser armazenados, durante o qual a qualidade definida continua a ser aceitável sob o esperado, ou especificado, mediante as condições de armazenamento, distribuição e exibição) (BROWN et al., 2011; HOMMOSS, 2011).
fazendo com que as moléculas sejam diferentemente estruturadas e consequentemente, não formem um cristal perfeito, proporcionando espaços para incorporação dos princípios ativos na forma molecular ou como clusters (aglomerados) amorfos, conforme demonstrado na Figura 2 (MÜLLER et al., 2002; MÜLLER et al., 2007).
Figura 2. Imagem demonstrando a organização da matriz de NLS (esquerda) e as imperfeições da organização da
matriz da partícula (direita) – CLN, distorcendo a formação de um cristal perfeito, o que permite maior capacidade de incorporação de substância ativa (MÜLLER et al., 2007).
Em um estudo recentemente publicado, Teskac e Kristl (2010) demonstraram que NLS contendo RES podem atravessar a membrana celular dos queratinócitos, aumentando o tempo de exposição das células a esta substância. Porém, não foram encontrados estudos utilizando CLN como sistema para administração cutânea de RES. Assim, a liberação mediada pelos CLN pode ser uma estratégia interessante no sentido de buscar uma otimização de sua ação por essa via.
1. OBJETIVOS
Este trabalho teve como objetivo desenvolver um sistema de liberação para o RES em nível nanoestrutural, de forma a otimizar a utilização deste princípio ativo no tratamento do fotoenvelhecimento cutâneo. Além disso, visa o desenvolvimento científico e tecnológico na Área de Nanotecnologia Farmacêutica e Cosmética e propõe:
Desenvolver CLN para a incorporação de RES;
Avaliar os sistemas obtidos com relação à incorporação do RES empregando ensaios de
determinação de diâmetro médio, potencial zeta, microscopia eletrônica de varredura com emissão de campo (MEV-FEG) e calorimetria diferencial exploratória (DSC);
Validar metodologia para quantificação de RES por Cromatografia Líquida de Alta
Eficiência (CLAE);
Verificar a quantificação de RES presente nos CLN e determinar o coeficiente de partição
O/A do RES;
Realizar ensaios de liberação in vitro utilizando células de Franz;
2. MATERIAL E MÉTODOS
2.1. Soluções e reagentes
Na preparação das formulações foram utilizados água (Milli-Q), estearato de polioxietileno (40) (Sigma Aldrich, EUA), behenato de glicerila (Compritol® 888 CG ATO, Brasquim),
triglicérides do ácido cáprico/caprílico (Via Farma, Brasil), óleo de rícino (Mapric, Brasil) e poloxamer 407 (Pluronic® F127, Sigma-Aldrich, USA), além de metilparabeno e propilparabeno.
2.2. Desenvolvimento dos CLN
Primeiramente pesou-se separadamente os componentes da fase lipídica (estearato de polioxietileno (40) ou behenato de glicerila, triglicérides do ácido cáprico/caprílico (TGACC) e o óleo de rícino) e da fase aquosa (polaxamer 407, nipagin e nipazol) em uma balança semi-analítica. Posteriormente aqueceu-se ambos os béqueres até 70 ºC, mantendo a fase aquosa sob agitação constante com o auxílio de um agitador magnético. Após a solubilização completa, verteu-se a fase aquosa sobre a fase oleosa formando uma pré-emulsão, a qual foi dispersa utilizando um homogeneizador de cisalhamento elevado (Ultra-Turrax) a 10.000 rpm durante 10 minutos. Em seguida resfriou-se a dispersão em banho de gelo (aproximadamente 0ºC), ocasionando a cristalização do lipídio e formação dos CLN. O trans-resveratrol incorporado em algumas formulações foi pesado e adicionado na fase lipídica, juntamente com as outras matérias primas, e então o procedimento decorreu como descrito.
2.3. Caracterização físico-química dos CLN
2.3.1. Determinação do diâmetro médio dos CLN
A determinação do diâmetro médio dos CLN foi realizada pela técnica de correlação de fótons, também conhecida como quase-elastic light scattering, usando o equipamento de dispersão dinâmica de luz (DLS, Zetasizer Nano NS, Malvern Instruments, Malvern, UK). Este equipamento é sensível para determinar pequenas mudanças no diâmetro médio, sendo essas mudanças causadas tanto por camadas adsorvidas na superfície da partícula quanto por pequenas variações no processo de manufatura. Quando um feixe de luz passa através de uma dispersão coloidal, as partículas ou gotas espalham a luz em todas as direções. Então, é possível observar flutuações tempo-dependentes na intensidade do espalhamento através de um detector que processa os dados e envia a um computador. A partir dessa técnica, calcula-se o raio hidrodinâmico das partículas coloidais da equação de Einstein-Stokes (equação 1), a qual foi realizada através do software incluído no sistema:
D = KT (Equação 1)
6πηRh
sendo: D = coeficiente de difusão das partículas; K = constante de Boltzmann (1,3807 x 10-23
NmK-1); T = temperatura absoluta (2λ3, 15 K); π = 3,1415λ2; η = viscosidade (1,002 x 10-3
N.s.m-2); Rh = raio hidrodinâmico.
foram realizadas no Departamento de Processos Biotecnológicos, da Universidade Estadual de Campinas (Unicamp), em colaboração com a Profa. Dra. Maria Helena Andrade Santana.
2.3.2. Análise do potencial zeta
A análise do potencial zeta foi realizada por determinação da mobilidade eletroforética das nanopartículas utilizando equipamento Zetasizer Nano NS, Malvern Instruments, Malvern, UK. O potencial zeta foi mensurado em água purificada, ajustando a condutividade (50 S/cm) com solução de cloreto de potássio (0,1%). O processamento foi realizado através do software incluído no sistema. As amostras foram previamente diluídas (10 µL/mL) com solução aquosa de KCl para manter uma constante de força iônica durante a análise, posteriormente colocadas na célula eletroforética e, por fim, para cada amostra, fez-se 3 determinações do potencial de superfície, calculando a média e o desvio padrão.
2.3.3. Análise microscópica
A determinação da forma geral dos CLN foi realizada por microscopia eletrônica de varredura (MEV – FEG) empregando microscópio JEOL JSM-7500F. Uma gota da dispersão de CLN foi distribuída sobre o suporte de amostra. Após a secagem, revestiu-se as amostras com fibras de carbono. As fotomicrografias foram obtidas utilizando feixe de elétrons de 10 e 20 kV.
2.3.4. Calorimetria exploratória diferencial (DSC)
As medidas de calorimetria diferencial exploratória (DSC) foram realizadas utilizando calorímetro, DSC Q10, TA Instruments, acoplado à um módulo de resfriamento por N2. Para a
foram aquecidas de -50 a 270 °C, numa razão de 10°C/min, e as curvas de DSC foram obtidas utilizando atmosfera de N2(g) num fluxo de 50 mL/min.
A disposição dos picos indicados no sentido ascendente foi adotado, convencionalmente, como exotérmico, enquanto que os picos com disposição descendentes como endotérmico. Neste estudo, a investigação do comportamento térmico das amostras seguiu o seguinte procedimento: aquecimento entre -50 °C a 270 °C, seguido de resfriamento até -50 °C e posterior reaquecimento até 270 °C.
As amostras analisadas por DSC foram as matérias-primas estearato de polioxietileno (40), behenato de glicerila (Compritol® 888 CG ATO), polaxamer 407, triglicérides do ácido
cáprico/caprílico, óleo de rícino, metilparabeno, propilparabeno e trans-resveratrol, bem como as formulações desenvolvidas acrescidas de RES ou não. F1’ a F4 (sem RES) e F1’.RES a F4.RES (acrescidas de 0,1% de RES).
2.3.5. Validação de metodologia analítica para quantificação de RES por CLAE
A análise por cromatografia líquida de alta eficiência (CLAE) para quantificação do RES nos ensaios de liberação in vitro foi realizada utilizando o equipamento Waters® Alliance,
Internacional de Harmonização (ICH, 2005) e Agência Nacional de Vigilância Sanitária (BRASIL, 2003), dentre eles: linearidade, precisão, especificidade, exatidão, limite de detecção e limite de quantificação, precisão e robustez.
2.3.5.1. Linearidade
Três curvas analíticas foram construídas com soluções padrão de RES em acetonitrila em diferentes concentrações (1 – 100 g/mL). As soluções foram injetadas no cromatógrafo. A curva de concentração do RES em função da área de pico foi construída e a linearidade do método na faixa de concentração testada foi avaliada pela análise da regressão linear (NEMEN; LEMOS-SENNA, 2011).
2.3.5.2. Precisão
A precisão foi avaliada através de ensaios de precisão instrumental, repetibilidade e precisão intermediária. No ensaio de precisão instrumental, foram feitas 3 injeções consecutivas da solução padrão de RES em 3 diferentes concentrações. Foram calculados a média, o desvio padrão (DP) e o desvio padrão relativo (DPR). A repetibilidade foi avaliada através da análise de 3 injeções consecutivas da solução padrão de RES em 3 diferentes concentrações em um mesmo dia. A precisão intermediária, por sua vez, foi determinada pela análise de 3 injeções consecutivas da solução padrão de RES em 3 diferentes concentrações em três dias distintos (BRASIL, 2003).
2.3.5.3. Exatidão
seja, 3 (três) concentrações, baixa, média e alta, todas em triplicata. A exatidão é expressa pela relação entre a concentração média determinada experimentalmente e a concentração teórica correspondente, sendo calculadas pela Equação 2 (BRASIL, 2003).
Exatidão = (CME/CT) x 100 (Equação 2)
sendo: CME = Concentração média experimental; CT = Concentração teórica.
2.3.5.4. Limite de detecção e Limite de quantificação
Calculou-se os limites de detecção (LD) e quantificação (LQ) utilizando valores de DP e inclinação das curvas analíticas obtidas. Os LD e LQ teóricos puderam ser calculados pelas Equações 3 e 4, respectivamente (BRASIL, 2003).
LD = (DP x 3,3)/IC (Equação 3)
LQ = (DP x 10)/IC (Equação 4)
em que DP = DP do intercepto com o eixo de Y e IC = inclinação da curva analítica.
2.3.5.5. Robustez
A robustez é a medida de sua capacidade em resistir a pequenas e deliberadas variações dos parâmetros analíticos. Indica sua confiança durante o uso normal. Para isso, foram realizados testes de variação de temperatura da coluna e do fluxo (BRASIL, 2003).
2.3.6. Validação de metodologia analítica para quantificação de RES por
espectrofotometria UV/VIS
2.3.6.1. Linearidade
Três curvas analíticas foram construídas com soluções padrão de RES em acetonitrila em diferentes concentrações (0,1 – 9 g/mL). Posteriormente os resultados foram analisados estatisticamente para definir o coeficiente de determinação, sendo o mínimo aceitável R2 = 0.99
(BARROS NETO et al., 2002; BRASIL, 2003).
2.3.6.2. Precisão
A precisão foi avaliada através de ensaios de precisão instrumental, repetibilidade e precisão intermediária. Foram calculados a média, o desvio padrão (DP) e o desvio padrão relativo (DPR). A repetibilidade foi avaliada através da análise de três amostras de CLN-RES em um mesmo dia. A precisão intermediária, por sua vez, foi determinada pela análise de três amostras na mesma concentração realizadas em três dias distintos (BRASIL,2003).
2.3.6.3. Exatidão
A exatidão de um método analítico é a proximidade dos resultados obtidos pelo método em estudo em relação ao valor verdadeiro. A exatidão do método deve ser verificada a partir de, no mínimo, 9 (nove) determinações contemplando o intervalo linear do procedimento, ou seja, 3 (três) concentrações, baixa, média e alta, todas em triplicata. A exatidão é expressa pela relação entre a concentração média determinada experimentalmente e a concentração teórica correspondente, sendo calculadas segundo equação descrita no item 3.3.5.3 (BRASIL,2003).
Calculou-se os limites de detecção (LD) e quantificação (LQ) utilizando valores de DP e inclinação das curvas analíticas obtidas. Os LD e LQ teóricos puderam ser calculados segundo equações descritas no item 3.3.5.4 (BRASIL, 2003).
3.3.7. Quantificação do RES presente nos CLN
Para a realização da quantificação do RES presente nos CLN foram testadas três metodologias diferentes, sendo estas as seguintes:
Ultracentrifugação: Propôs-se analisar o sobrenadante resultante do processo de
ultracentrifugação por CLAE. As formulações foram centrifugadas a 45.000 rpm, durante 1 hora, a 4 °C (SUNDARAM et al., 2009).
Filtração utilizando membrana de diálise: Para este método, utilizou-se dispositivos com membranas de 10.000 NMWL (Millipore, Billerica, USA). Primeiramente, para minimizar a retenção do RES na membrana, foi realizado um pré-tratamento utilizando uma solução de polisorbato 80 a 5,0% (LEE et al., 2003). Posteriormente, a membrana foi lavada com água MilliQ e aplicou-se quantidade conhecida de RES em solução. Posteriormente, foi realizada a centrifugação em diferentes velocidades e tempos, a fim de coletar, aproximadamente, 100% do RES, mostrando que o RES não ficou retido na membrana (GARDOUTH et al., 2013).
Ultrafiltração: Para a realização deste teste, as amostras foram filtradas à vácuo, utilizando membrana de 30,000 NMWL (Millipore, Billerica, USA). O separado foi analisado por espectrofotômetro a 306 nm (ROBYT; WHITE, 1990).
3.3.8. Determinação do coeficiente de partição O/A do RES
foram adicionados 2 mL de água MiliQ e 100,0 mg de RES. Posteriormente, foi adicionado 2 mL de octanol e o tubo foi levado ao vórtex durante 1 minuto e em seguida centrifugado por 15 minutos a 3000 rpm. Após a centrifugação, alíquotas de 100 L da fase aquosa e 100 L da fase oleosa foram coletadas e colocadas em balões de 10 mL, completando o volume final com acetonitrila. Em seguida, as amostras foram analisadas por CLAE. O coeficiente de partição (Kp) foi calculado como sendo a razão entre a concentração de RES na fase oleosa e na fase aquosa.
3.3.9. Estudo de liberação do RES in vitro
Os experimentos foram realizados utilizando células de difusão modificadas (células de Franz). Uma membrana de éster de celulose com poro de 0,45 µm foi colocada entre o compartimento doador e o receptor da célula de difusão. Posteriormente, 300 L das formulações foram adicionadas sobre a membrana e preencheu-se o compartimento receptor com solução receptora composta por solução aquosa de polissorbato 80 a 2,0%. A solução receptora foi agitada e mantida a 32 ± 2 °C por banho circulante. Utilizou-se seis células de difusão nos experimentos (DETONI et al., 2008). Amostras da solução receptora foram coletadas nos intervalos de 5, 15 e 30 min e 1, 2, 4, 6, 8, 12, 16, 20 e 24 horas para avaliar a cinética de liberação, sendo que o mesmo volume da solução receptora fresca foi reposto. A quantificação de RES presente na solução receptora foi realizada por CLAE, utilizando a curva analítica obtida na validação do método.
3.3.10. Avaliação despigmentante in vitro do RES incorporado em CLN
tirosinase (120 U/mL), 70 L de solução tampão pH 6,8 e 70 L de solução aquosa de tirosina (0,3 mg/mL). A estes poços, foram adicionados 60 L de água (controle) ou 60 L de CLN sem RES ou 60 L de dispersão de CLN-RES ou 60 µL de REs em solução ou 60 L de ácido
kójico em diferentes concentrações (5,0 g/mL; 4,0 g/mL; 3,0 g/mL; 2,5 g/mL; 1,25 g/mL). Dessa forma, o volume final foi de 210 L por poço. A absorbância foi medida a 490 nm em leitor espectrofotométrico de microplacas de 96 poços (Thermoplate) no início da reação (leitura no tempo zero). As microplacas foram incubadas a 30 ± 1°C, por 60 minutos. Os dados foram registrados em computador acoplado ao aparelho. A atividade inibitória foi obtida segundo equação 5:
IA (%) = [((C-T0)-(S-T0))/(C-T0)] x 100 (Equação 5)
sendo: IA = atividade inibitória; C = absorbância do controle a 490 nm; S = absorbância da amostra; T0 = absorbância no tempo zero.
Cada parâmetro teve 8 medidas. A porcentagem de atividade inibitória da tirosinase obtida para CLN sem RES, CLN-RES ou RES em solução foi comparada àquelas obtidas do ácido kójico.
Na segunda condição do ensaio, em cada poço das microplacas foram adicionados 10,0 L de solução aquosa de tirosinase (480 U/mL), 70 L de solução tampão pH 6,8 e 70 L de
solução aquosa de tirosina (0,3 mg/mL). A estes poços adicionou-se 60 L de água (controle) ou 60 L de ácido kójico em diferentes concentrações (10,0 g/mL; 5,0 g/mL; 2,5 g/mL; 1,25 g/mL e 0,625 g/mL). Dessa forma, o volume final foi de 210 L por poço. A absorbância foi
atividade inibitória de 50% (AI 50%) do ácido kójico foi calculada a partir da equação da reta, obtida da relação porcentagem de atividade inibitória pela concentração.
3.3.10.1. Determinação da concentração correspondente à atividade inibitória 50% do
RES e CLN-RES usando tirosinase com concentração de 480 U/mL
Em uma microplaca de 96 poços foram adicionados 10,0 L de solução aquosa de tirosina (480 U/mL), 70 L de solução tampão pH 6,8 e 70 L de solução aquosa de tirosina
(0,3 mg/mL). Posteriormente, foram adicionadas 60 L soluções de CLN sem RES, CLN-RES ou RES em solução em diferentes concentrações (80 g/mL; 40 g/mL; 20 g/mL; 10 g/mL; 5 g/mL). Dessa forma, o volume final foi de 210 L por poço. A absorbância foi medida a 490
nm em leitor espectrofotométrico de microplacas de 96 poços (Thermoplate) no início da reação (leitura no tempo zero). As microplacas foram incubadas a 30 ± 1° C, durante 120 minutos. Os dados foram registrados em um computador acoplado ao aparelho. A atividade inibitória foi obtida de acordo com a equação 5 e os valores serão comparados aos obtidos para o ácido kójico.
4. Forma de análise dos resultados
pelo resto dos pontos (FREUND; SIMON, 2000). A partir da verificação da normalidade, realizou-se análise de variância ANOVA, seguido de Teste de Tukey, para os dados paramétricos, pois permite a análise de amostras múltiplas, e o teste de Kruskal-Wallis, ou teste H, para os dados não-paramétricos (BOOCK, 2007; ANDRADE, 2008).
5. RESULTADOS E DISCUSSÃO
5.1. Desenvolvimento dos CLN
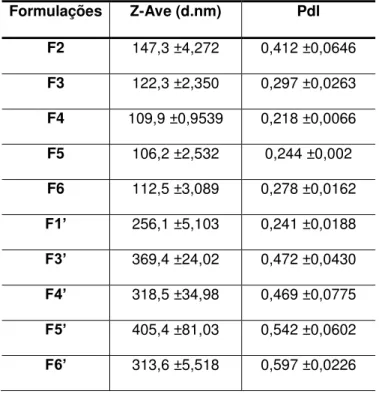
Foram desenvolvidas 6 formulações diferentes contendo estearato de polioxietileno (40) e 6 formulações diferentes contendo behenato de glicerila. As concentrações dos reagentes da fase lipídica foram mantidas, variando somente a concentração de polaxamer 407 presente na fase aquosa, como pode ser visualizado nas Tabelas 1 e 2.
Formulações Componentes (% m/m)
Estearato de
polioxietileno (40)
TGACC Óleo rícino Polaxamer Metilparabeno Propilparabeno Água
q.s.p
F1 2,07 2,05 0,88 1,0 0,18 0,02 100
F2 2,07 2,05 0,88 2,0 0,18 0,02 100
F3 2,07 2,05 0,88 2,5 0,18 0,02 100
F4 2,07 2,05 0,88 3,0 0,18 0,02 100
F5 2,07 2,05 0,88 3,5 0,18 0,02 100
F6 2,07 2,05 0,88 4,0 0,18 0,02 100
As formulações usadas nas análises seguintes foram a F2, F3, F4, F5 e F6. A formulação F1 não foi selecionada para as análises posteriores, pois, ao analisá-la visualmente, observou-se observou-separação de faobservou-ses.
Formulações Componentes (% m/m)
Behenato
de glicerila
TGACC Óleo rícino Polaxamer Metilparabeno Propilparabeno Água
q.s.p
F1’ 2,07 2,05 0,88 1,0 0,18 0,02 100
F2’ 2,07 2,05 0,88 2,0 0,18 0,02 100
F3’ 2,07 2,05 0,88 2,5 0,18 0,02 100
F4’ 2,07 2,05 0,88 3,0 0,18 0,02 100
F5’ 2,07 2,05 0,88 3,5 0,18 0,02 100
F6’ 2,07 2,05 0,88 4,0 0,18 0,02 100
Tabela 2. Composição das formulações desenvolvidas com behenato de glicerila.
As formulações usadas nas análises seguintes foram a F1’, F3’, F4’, F5’ e F6’. A formulação F2’ não foi selecionada para as análises posteriores pois, ao analisá-la visualmente, observou-se separação de fases.
5.2. Caracterização físico-química dos CLN
5.2.1. Determinação do diâmetro médio dos CLN
Como pode ser visualizado na Tabela 3, as formulações compostas por estearato de polioxietileno (40) possuem valor de tamanho médio de aproximadamente 100 nm, a intensidade variou entre 100-300nm, o número médio ficou abaixo de 100nm e o volume médio entre 100-300 nm. Para as formulações constituídas de behenato de glicerila, o valor do tamanho médio variou entre 200-400 nm, a intensidade variou entre 300-800 nm, o número médio variou entre 60-200 nm e, por fim, o volume médio variou entre 500-1300 nm. Portanto, os valores obtidos são compatíveis com os descritos na literatura, com exceção das formulações F5’ e F6’, em que o volume médio ultrapassou o valor descrito na literatura (1000 nm).
Formulações Z-Ave (d.nm) Pdl
F2 147,3 ±4,272 0,412 ±0,0646
F3 122,3 ±2,350 0,297 ±0,0263
F4 109,9 ±0,9539 0,218 ±0,0066
F5 106,2 ±2,532 0,244 ±0,002
F6 112,5 ±3,089 0,278 ±0,0162
F1’ 256,1 ±5,103 0,241 ±0,0188
F3’ 369,4 ±24,02 0,472 ±0,0430
F4’ 318,5 ±34,98 0,469 ±0,0775
F5’ 405,4 ±81,03 0,542 ±0,0602
F6’ 313,6 ±5,518 0,597 ±0,0226
Tabela 3. Diâmetro médio (Z-Ave) e Índice de Polidispersibilidade (Pdl) dos CLNs.
considera-se tamanhos de partículas mais homogêneos, enquanto que para um índice de 0,4 considera-se distribuição de tamanho de partícula heterogêneo e presença de aglomerados na dispersão (KRAUSE et al., 2010).
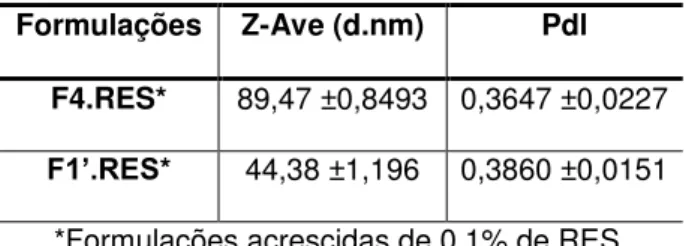
Os valores obtidos para as 10 formulações variaram entre 0,2-0,6 nm; no entanto, como foi dito anteriormente, quanto menor o índice de polidispersidade, mais homogênea é a distribuição de tamanho das partículas, diminuindo assim, a probabilidade de aglomerados na dispersão. Portanto, a partir das 10 formulações, escolheu-se duas para dar continuidade às análises, sendo as formulações F4 e F1’ as escolhidas. Ambas as formulações, além de apresentarem diâmetro médio dentro do valor descrito na literatura são as que possuem menor valor de polidispersidade.
Após a seleção das formulações com o menor índice de polidispersidade fez-se a incorporação do fármaco, analisando, assim, as formulações novamente. Com isso, pode-se observar que as partículas permaneceram com diâmetro médio dentro dos valores de referência descritos na literatura (50 a 1000 nm). Além disso, com a incorporação do RES, os valores obtidos nas formulações foram menores do que os encontrados nas formulações sem o fármaco. Segundo Üner (2006), o tamanho da partícula pode ser alterado por diversos fatores, sendo um deles a incorporação do fármaco na formulação.
Formulações Z-Ave (d.nm) Pdl
F4.RES* 89,47 ±0,8493 0,3647 ±0,0227
F1’.RES* 44,38 ±1,196 0,3860 ±0,0151
*Formulações acrescidas de 0,1% de RES.
5.2.2. Análise do potencial zeta
As partículas de uma dispersão coloidal podem adsorver íons ou conter agrupamentos que possuem a capacidade de conferir uma carga à superfície da partícula. Esta carga é fundamental, já que permite inferir propriedades diretamente relacionadas com a estabilidade físico-química da dispersão. Sendo assim, é desejável que um sistema nanoestruturado apresente uma carga de superfície elevada, pois grandes forças repulsivas tendem a evitar agregação em função das colisões ocasionais entre as nanopartículas adjacentes (REUS, 2006).
O potencial zeta reflete o potencial de superfície das partículas, sendo este influenciado pelas mudanças da interface com o meio dispersante, em razão da adsorção de espécies iônicas presentes no meio aquoso de dispersão ou da dissociação de grupos funcionais (Schaffazick et al., 2003). Portando, o potencial zeta é essencial para avaliar a estabilidade da dispersão coloidal (HU et al., 2005). As partículas, geralmente, estão estáveis quando o potencial é maior que +30mV ou menor do que -30mV (FREITAS & MÜLLER, 1998). Então, é menos provável acontecer à agregação das partículas que possuem um valor de potencial zeta como os descritos anteriormente, e isto ocorre devido à ocorrência da repulsão elétrica (HU et al., 2002).
Formulações Potencial zeta (mV)
F2 -2,01 ±0,265
F3 -1,21 ±0,116
F4 -1,49 ±0,282
F5 -1,84 ±0,195
F6 -1,65 ±0,402
F1’ -1,56 ±0,604
F3’ -1,79 ±0,144
F4’ -2,25 ±0,712
F5’ -1,89 ±0,740
F6’ -1,82 ±0,497
Tabela 5. Resultado da análise do potencial zeta das formulações sem fármaco.
Após a adição do fármaco não houve uma melhora do valor do potencial zeta (Tabela 6).
Formulações Potencial zeta (mV)
F4.RES -1,41 ±0,234
F1’.RES -1,55 ±0,786
Tabela 6. Resultado da análise do potencial zeta das formulações acrescidas de fármaco.
5.2.3. Análise microscópica
A microscopia eletrônica abrange um conjunto de técnicas que possibilitam a caracterização da composição química, morfologia e determinação da estrutura atômica (DEDAVID et al, 2007). Dependendo da formulação, pode-se observar diferentes tamanhos de partículas, conforme o método empregado na determinação, visto que a microscopia eletrônica fornece uma imagem de partícula isolada do meio (SCHAFFAZICK et al., 2003).
nm. No entanto, de acordo com a microscopia, esse valor foi maior. Isto pode ter ocorrido, pois as amostras foram analisadas depois de uma semana e, de acordo com Schaffazick et al. (2003), as nanopartículas possuem uma tendência à agregação e sedimentação em função do tempo. Além disso, por se tratar de um lipídio líquido, quando focava-se nas partículas estas se liquefaziam devido à alta temperatura do feixe de elétrons, impossibilitando as fotomicrografias.
Figura 3. Fotomicrografias das nanopartículas por microscopia eletrônica de varredura com emissão de campo
5.2.4. Calorimetria diferencial exploratória (DSC)
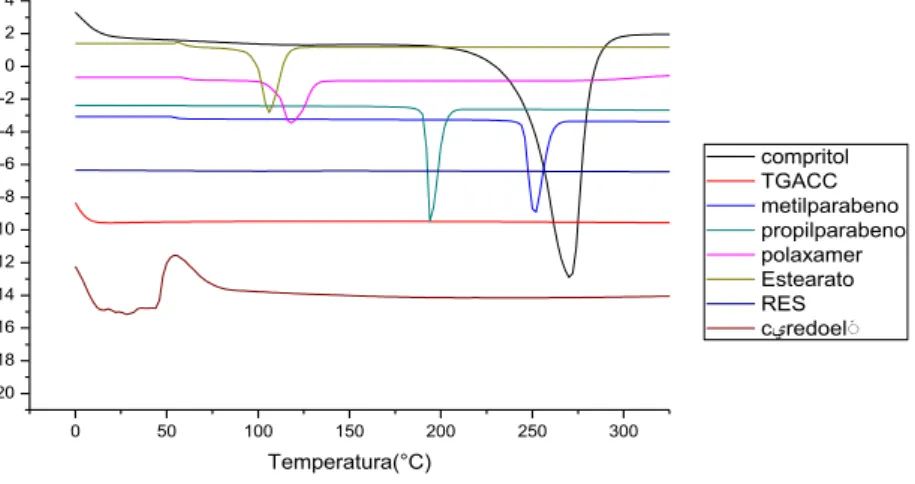
A calorimetria exploratória diferencial (DSC) é uma técnica analítica empregada para a caracterização detalhada de carreadores lipídicos nanoestruturados, por promover informações estruturais dos CLN úteis no entendimento da capacidade de incorporação do fármaco e perfil de liberação (BUNJES; UNRUH, 2007).
As Figura 4 a 8 apresentam as curvas de DSC das matérias-primas utilizadas para o preparo dos CLN, bem como a curva das formulações desenvolvidas. Tanto para as matérias primas, quanto para as formulações foram realizados apenas 1 ciclo, o qual está relacionado a verificação da fusão das amostras que foram liofilizadas.
0 50 100 150 200 250 300
-20 -18 -16 -14 -12 -10 -8 -6 -4 -2 0 2 4
Temperatura(°C)
compritol TGACC metilparabeno propilparabeno polaxamer Estearato RES
cيredoel َ
-200 0 200 400 600 800 1000 1200 1400 1600 1800 -5 -4 -3 -2 -1 0 F lu xo d e ca lo r (w /g )
Temperatura (oC)
ciclo 1
-200 0 200 400 600 800 1000 1200 1400 1600 1800 -12 -10 -8 -6 -4 -2 0 2 F lu xo d e ca lo r (w /g )
Temperatura (oC)
ciclo 1
Figura 5. Curva da formulação F4 Figura 6. Curva da formulação F4.RES
Figura 7. Curva da formulação F1' Figura 8.Curva da formulação F1'.RES
Como pode-se ver na Figura 4, a fusão do estearato polioxietileno (40) isolado ocorreu a 54°C; no entanto, este evento difere do descrito na literatura, que está em torno de 38°C (ROWE; SHESKEY; OWEN, 2006). O deslocamento do evento térmico para temperaturas maiores sugerem mudança da forma cristalina para o polimorfo A (ALMEIDA et al., 2010).
A fusão do behenato de glicerila - Compritol® 888 (Figura 4) ocorreu a 270°C; entretanto,
A curva do poloxamer 407 (Figura 4) apresentou evento de degradação próximo a 150°C e evento endotérmico de fusão bem definido em 59 °C. Um estudo relatou que o poloxamer 407 pode agir reduzindo picos endotérmicos de algumas substâncias, pois o mesmo pode solubilizá-las e o pico endotérmico deixa de existir na curva de DSC das formulações de dispersões sólidas (NEPAL; HAN; CHOI, 2010).
As curvas de DSC resultantes da análise do propil e metilparabenos, presentes na Figura 4, consistem de um único evento endotérmico atribuído ao processo de fusão. Os eventos endotérmicos exibiram um pico máximo a 97 °C e 129 °C, respectivamente, correspondentes ao propilparabeno e ao metilparabeno. Os eventos resultantes apresentados são consistentes com os valores dos pontos de fusão relatados na literatura de 97,8 °C e 124 °C para o propilparabeno e para o metilparabeno, respectivamente (LIRA et al., 2007; RUDYANTO et al., 2003).
Com a liofilização, os componentes estão livres para cristalizar e fundir. Na Figura 5 e na Figura 6, pode-se observar, comparando com a Figura 4, que o metilparabeno fundiu, enquanto que na Figura 7 e na Figura 8, quem fundiu foi o polaxamer 407. A formulação F4 é composta por estearato de polioxietileno (40) e a formulação F1’ por behenato de glicerila, além disso ambas as formulações possuem quantidades diferentes de matérias-primas. Portanto, talvez os componentes estejam modificando a formulação já ambas possuem matérias-primas diferentes e em quantidades diferentes.
5.2.5. Validação de metodologia analítica para quantificação de RES por CLAE
al., 2005). Este, assim como o trans-resveratrol, apresenta benefícios para a saúde; no entanto,
apresenta menor atividade biológica (BERTELLI et al., 1996). Portanto, a forma isomérica trans-resveratrol é a que apresenta maior atividade, necessitando assim o desenvolvimento de uma metodologia analítica que tem a capacidade de separar as duas formas isoméricas.
A identificação dos analitos seguiu o que foi proposto por Pragst, Herzler e Erxleben (2004) para análises cromatográficas por CLAE-DAD, associando os tempos de retenção à avaliação dos espectros de absorção na região do ultravioleta gerados pelo arranjo de diodos para cada pico. Devido à alta resolução, à sensibilidade e exatidão no comprimento de onda, a ampla faixa do espectro que vai de 200 a 400 nm e a comparação computacional com uma biblioteca, os espectros de UV gerados para o cis e o trans-resveratrol podem ser facilmente diferenciados (ORTIZ; ANTUNES; LINDEN, 2010).
A identificação de um espectro é feita mediante comparação matemática com espectros da biblioteca, calculando vetorialmente o índice de similaridade, que inclui todos os pares de dados na faixa de comprimentos de onda medidos, não somente mínimos e máximos, seguindo um procedimento que independe da concentração (PRAGST; HERZLER; ERXLEBEN, 2004; ORTIZ; ANTUNES; LINDEN, 2010).
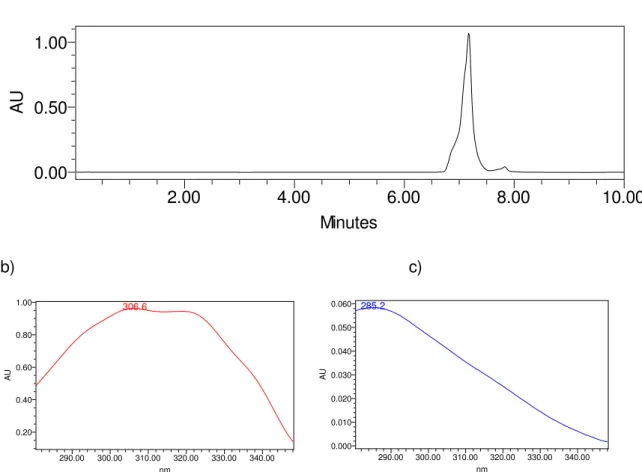
A Tabela 7 demonstra o tempo de retenção das amostras analisadas, a resolução dos picos e o lâmbda máximo para cada analito. A análise cromatográfica está demonstrada na Figura 9a, o espectro de absorção ultravioletra do trans-resveratrol está demonstrada na Figura 9b e o do cis-resveratrol na Figura 9c, respectivamente.
retenção (min.) Inicial Final
Trans-resveratrol 7,194 1,2 280 nm 350 nm 306,6 nm
Cis-resveratrol 7,847 1,2 280 nm 350 nm 285,2 nm
Tabela 7. Tempo de retenção, resolução dos picos e máximo para o trans- e cis-resveratrol.
a) AU 0.00 0.50 1.00 Minutes
2.00 4.00 6.00 8.00 10.00
b) c)
AU 0.20 0.40 0.60 0.80 1.00 nm
290.00 300.00 310.00 320.00 330.00 340.00
306.6 AU 0.000 0.010 0.020 0.030 0.040 0.050 0.060 nm
290.00 300.00 310.00 320.00 330.00 340.00
285.2
Figura 9. a) Separação cromatográfica obtida com monitoramento em 280-350 nm: calibrador 100% de trans
-resveratrol após 1 hora de exposição ambiente a radiação ultravioleta (10 g/mL); b) espectro UV do pico com
retenção em 7,194 min (trans-resveratrol); c) espectro UV do pico com retenção 7,847 min (cis-resveratrol)
gerados pelo arranjo de diodos.
et al., 2012). Como pode ser visualizado na Figura 9a, o trans-resveratrol apresenta máximo de absorção em 306,6 nm, enquanto que o espectro do cis-resveratrol, Figura 9c, exibe máximo em 285,2 nm. Portanto, os resultados estão de acordo com a literatura. Sendo assim, para a validação da metodologia analítica para a quantificação do trans-resveratrol foi fixado o comprimento de onda de 306,6 nm.
5.2.5.1. Linearidade
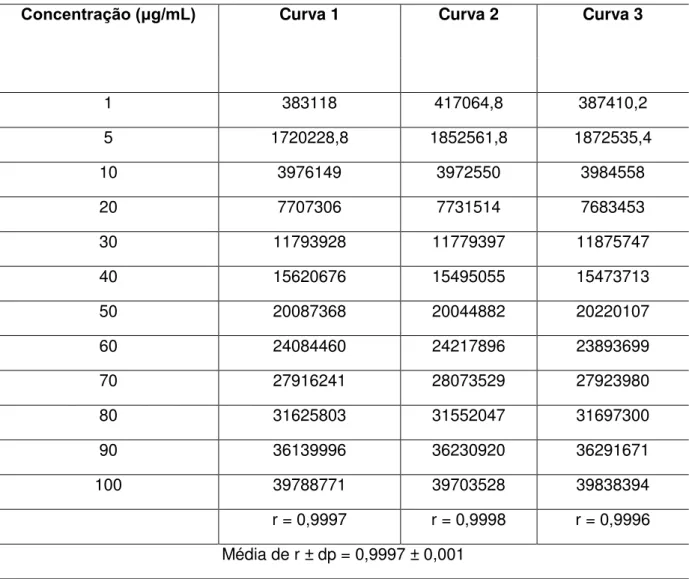
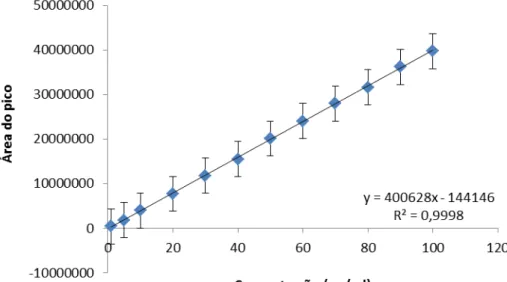
A linearidade é a capacidade de uma metodologia analítica de certificar que os resultados obtidos são diretamente proporcionais à concentração do analito presente na amostra (BRASIL 2003). A Figura 10 demonstra a curva analítica do trans-resveratrol.
Concentração (μg/mL) Curva 1 Curva 2 Curva 3
1 383118 417064,8 387410,2
5 1720228,8 1852561,8 1872535,4
10 3976149 3972550 3984558
20 7707306 7731514 7683453
30 11793928 11779397 11875747
40 15620676 15495055 15473713
50 20087368 20044882 20220107
60 24084460 24217896 23893699
70 27916241 28073529 27923980
80 31625803 31552047 31697300
90 36139996 36230920 36291671
100 39788771 39703528 39838394
r = 0,9997 r = 0,9998 r = 0,9996
Média de r ± dp = 0,9997 ± 0,001
(r) corresponde ao coeficiente de correlação da curva analítica e (dp) ao desvio padrão.
Tabela 8. Resultadosdas áreas dos picos para cada concentração analisada e coeficientes de correlação.
AU
0.00 0.20 0.40 0.60 0.80
Minutes
1.00 2.00 3.00 4.00 5.00 6.00 7.00 8.00 9.00 10.00
7.
24
5
Figura 10. Cromatograma obtido com injeção de uma diluição teórica de 30 µg/mL de trans-resveratrol.
A faixa de trabalho (concentração na alíquota de análise 1 a 100 g/mL) possibilitou detectar o trans-resveratrol dentro dos limites de interesse e a resposta do detector de ultravioleta conservou-se linear. A Figura 11 representa a curva analítica utilizada na conversão entre as áreas obtidas e a concentração do ativo.
Figura 11. Curva analítica do trans-resveratrol por CLAE.
5.2.5.2. Precisão
Tabela9 os resultados obtidos da repetitibilidade do método, a qual foi verificada através da análise de 3 concentrações (1, 50 e 100 g/mL) em triplicata (n=3) de cada concentração em 3 dias diferentes.
ÁREA DOS PICOS
Concentração
teórica
1° Dia 2° Dia 3° Dia
1 μg/mL 50 μg/mL 100μg/mL 1 μg/mL50 μg/mL100 μg/mL1 μg/mL50 μg/mL100μg/mL
N=1 370310 20970062 41786394 430628 20087368 39838394 389666 21768477 43019155
N=2 391908 20983577 41692736 414141 20044882 39788771 389952 21385194 43035381
N=3 378346 20988688 41821031 412993 20220107 39703528 388743 21704146 43172668
Média 380188 20980775 41766720 419254 20117452 39776897 389454 21619272 43075734
Desvio Padrão 10916 9623 66372 9867 91404 68212 632 205253 84338
DPR 2,87 0,05 0,16 2,35 0,45 0,17 0,16 0,95 0,19
Tabela 9. Resultados da avaliação da precisão para a repetibilidade (precisão intra-corrida).
Tabela 10 mostra os resultados obtidos da precisão intermediária do método, a qual foi verificada através da análise de 3 concentrações (1, 50 e 100 g/mL) em triplicata (n=3)
de cada concentração em 3 dias diferentes.
ÁREA DOS PICOS
Concentração teórica 1 μg/mL 50 μg/mL 100μg/mL
Média dia 1 380188 20980776 41766720
Média dia 2 419254 20117452 39776898
Média dia 3 389454 21619272 43075735
Média 396298 20905833 41539784
Desvio Padrão 19150 662346 1439947
DPR 4,83 3,17 3,47
O desvio padrão relativo (DPR) alcançado na avaliação da precisão do método é menor que 5,0%. Portanto é adequado, podendo então atribuir ao método analítico um grau de concordância entre os resultados quando realizados sob as mesmas condições experimentadas neste estudo.
5.2.5.3. Exatidão
A exatidão de um método analítico é a proximidade dos resultados alcançados pelo método em estudo em relação ao valor verdadeiro (BRASIL 2003). A Tabela 11 mostra os resultados obtidos da recuperação do método, a qual foi verificada através da análise de 3 concentrações (5, 50 e 100 g/mL) em triplicata (n=3) de cada concentração.
CONCENTRAÇÃO EXPERIEMNTAL
Concentração teórica 5 μg/mL 50 μg/mL 100μg/mL
N = 1 4,62 50,50 99,67
N = 2 4,63 50,39 99,46
N = 3 4,63 50,83 99,80
Média 4,626 50,57 99,64
Desvio Padrão 0,009 0,228 0,170
Exatidão 92,53 ± 0,19 101,15 ± 0,46 99,64 ± 0,170
* Através da equação da reta (y = 400651x – 145812) determinou-se a concentração experimental.
Tabela 11. Resultados da avaliação da exatidão.
5.2.5.4. Limite de detecção (LD) e limite de quantificação (LQ)
O limite de detecção é a menor quantidade do analito presente em uma amostra que pode ser detectado, porém não necessariamente quantificado, enquanto que o limite de quantificação é a menor quantidade do analito presente em uma amostra que pode ser determinada com precisão e exatidão aceitáveis (BRASIL 2003).
Os valores calculados para o limite de detecção e de quantificação demonstram alta sensibilidade e especificidade do método para a determinação do trans-resveratrol. Foram encontrados 1,29 g/mL para o limite de detecção e 4,2λ g/mL para o limite de quantificação como está demonstrado na Tabela 12.
Não foi preciso realizar testes experimentais para comprovar os resultados calculados, visto que o método desenvolvido não tem o objetivo de detectar concentrações mínimas. A finalidade principal do método consiste em analisar formulações farmacêuticas que apresentam quantidades terapêuticas de trans-resveratrol.
Equação da reta Inclinação (a) Intercepto (b)
Dia 1 y = 418390x - 422105 418390 422105
Dia 2 y = 395163x – 122243 395163 122243
Dia 3 y = 429356x - 106833 429356 106833
Média 414303 217060
Desvio Padrão 17459 177741
LD 1,2λ g/mL
LQ 4,2λ g/mL
5.2.5.5. Robustez
A robustez é a medida da capacidade do método analítico em resistir a pequenas e deliberadas variações dos parâmetros analíticos (BRASIL, 2003).Ela pode ser medida através da avaliação do efeito sobre o tempo de retenção do pico, valor de DPR e exatidão, obtidos após sofrer pequenas variações (SILVA et al., 2012). Os resultados obtidos estão demonstrados na Tabela 13.
Parâmetros Tempo de Retenção (min.) Exatidão DPR
Fluxo 0,8 mL/min 8,22 ± 0,007a 102,45 ± 0,617d 0,525g
1,0 mL/min 7,24 ± 0,009b 94,057 ± 0,598e 0,636h
1,2 mL/min 6,53 ± 0,015c 90,05 ± 0,469f 0,520i
Temperatura da coluna
25 °C 7,24 ± 0,009j 94,06 ± 0,598m 0,64o
30 °C 7,15 ± 0,100k 91,76 ± 0,235n 0,26p
35 °C 7,06 ± 0,006l 93,24 ± 0,648n 0,70p
Símbolos iguais indicam médias sem diferenças estatisticamente significativas (p<0,05).
Tabela 13. Resultados da robustez do método analítico cromatográfico para a quantificação do trans-resveratrol.
De acordo com a Tabela 13, observou-se alterações estatisticamente significativas após ter realizado pequenas variações nos parâmetros cromatográficos experimentais. Contudo, as variações encontram-se dentre os valores permitidos pela Agência Nacional de Vigilância Sanitária (BRASIL, 2003). Assim, o método pode ser considerado robusto.
5.2.6. Validação de metodologia analítica para quantificação de RES por
5.2.6.1. Linearidade
A determinação da linearidade e do intervalo foi executada em triplicata, através da elaboração de curvas de calibração. O critério mínimo aceitável do coeficiente de correlação (r) da curva de calibração é de 0,99, segundo a RDC 899/2003, sendo assim, foi obtido um valor médio de 0,9978 no experimento (Tabela 14).
Concentração (μg/mL) Curva 1 Curva 2 Curva 3
0,1 0,03655 0,009489 0,016419
0,5 0,0603 0,036937 0,036454
1 0,11773 0,122493 0,115107
2 0,202843 0,187073 0,174812
3 0,307787 0,30384 0,282627
4 0,458857 0,448813 0,430887
5 0,562917 0,544493 0,515667
6 0,669583 0,659163 0,639
7 0,779983 0,783197 0,76237
8 0,92249 0,889087 0,879237
9 1,031267 1,0252 1,00056
r = 0,9976 r = 0,998 r = 0,9967
Média de r ± dp = 0,9978 ± 0,001
Tabela 14. Resultados das curvas para cada concentração analisada e coeficientes de correlação.
Figura 12. Curva analítica do trans-resveratrol obtida por espectrofotometria UV/VIS.
5.2.6.2. Precisão
Pode-se observar na Tabela 15 os resultados obtidos da repetibilidade do método, a qual foi verificada através da análise de 3 concentrações (1, 4 e λ g/mL) em triplicata (n=3) de cada concentração em 3 dias diferentes.
Concentração
Teórica
1° Dia 2° Dia 3° Dia
1 μg/mL 4 μg/mL 9μg/mL 1 μg/mL 4 μg/mL 9 μg/mL 1 μg/mL 4 μg/Ml 9 μg/mL
N=1 0,1143 0,4579 1,021 0,1277 0,4521 1,016 0,1105 0,4244 0,9852 N=2 0,1173 0,4605 1,037 0,1204 0,4442 1,029 0,1197 0,4335 1,008 N=3 0,1216 0,4582 1,036 0,1194 0,4501 1,029 0,1152 0,4348 1,009 Média 0,1177 0,4589 1,031 0,1225 0,4488 1,025 0,1151 0,4309 1,001 Desvio Padrão 0,003662 0,001411 0,008896 0,004537 0,004075 0,007795 0,004586 0,005699 0,01332
DPR 3,110 0,3074 0,8627 3,704 0,9080 0,7603 3,984 1,323 1,331
Tabela 16 mostra os resultados obtidos da precisão intermediária do método, a qual foi verificada através da análise de 3 concentrações (1, 4 e λ g/mL) em triplicata (n=3) de cada
concentração em 3 dias diferentes.
Concentração teórica 1 μg/mL 4 μg/mL 9μg/mL
Média 0,118443 0,446186 1,019009
Desvio Padrão 0,004927 0,01278 0,016664
DPR 4,159441 2,864388 1,63534
Tabela 16. Resultados da avaliação da precisão intermediária (precisão inter-corridas).
O desvio padrão relativo (DPR) obtido na avaliação da precisão do método é adequado (menor que 5,0%), podendo atribuir ao método analítico um grau de concordância entre os resultados quando realizados sob as mesmas condições experimentadas neste estudo.
5.2.6.3. Exatidão
A Tabela 17 mostra os resultados obtidos da recuperação do método, a qual foi verificada pela análise de 3 concentrações (1, 4 e 9 g/mL) em triplicata (n=3) de cada concentração.
CONCENTRAÇÃO EXPERIEMNTAL*
Concentração teórica 1 μg/mL 4 μg/mL 9 μg/mL
N = 1 1,160 4,181 9,251
N = 2 1,113 4,092 9,198
N = 3 1,136 3,933 8,979
Média 1,136 4,069 9,143
Desvio Padrão 0,0232 0,126 0,144
Exatidão 113,6± 2,32 101,7 ± 3,14 101,6 ± 1,60
*Através da equação da reta (y = 1129x –0,0132) determinou-se a concentração experimental.