UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE
CENTRO DE BIOCIÊNCIAS
PÓS-GRADUAÇÃO EM CIÊNCIAS BIOLÓGICAS
MESTRADO EM CIÊNCIAS BIOLÓGICAS
TÁBATA LOÍSE CUNHA LIMA
Avaliação do potencial antiviral da Annona muricata (Graviola) e Spondias
mombin (Cajá) contra o vírus dengue-2 em cultura de células
TÁBATA LOÍSE CUNHA LIMA
Avaliação do potencial antiviral da Annona muricata (Graviola) e Spondias
mombin (Cajá) contra o vírus dengue-2 em cultura de células
Dissertação apresentada ao curso de Pós-Graduação em Ciências Biológicas - Centro de Biociências da Universidade Federal do Rio Grande do Norte (UFRN), como pré-requisito para obtenção do título de Mestre em Ciências Biológicas.
Orientador: Prof. Dr. Josélio Maria Galvão de Araújo.
Co-orientador: Dr. Kleber Juvenal Silva Farias.
Catalogação da Publicação na Fonte. UFRN / Biblioteca Setorial do Centro de Biociências
Lima, Tábata Loíse Cunha.
Avaliação do potencial antiviral da Annona muricata (Graviola) e Spondias mombin (Cajá) contra o vírus dengue-2 em cultura de células / Tábata Loíse Cunha Lima. – Natal, RN, 2015.
61 f.: il.
Orientador: Prof. Dr. Josélio Maria Galvão de Araújo. Coorientador: Dr. Kleber Juvenal Silva Farias.
Dissertação (Mestrado) – Universidade Federal do Rio Grande do Norte. Centro de Biociências. Pós-Graduação em Ciências Biológicas.
1. Annona muricata. – Dissertação. 2. Células C6/36 e Vero. – Dissertação. 3. DENV-2. – Dissertação. I. Araújo, Josélio Maria Galvão de. II. Farias, Kleber Juvenal Silva. III. Universidade Federal do Rio Grande do Norte. IV. Título.
TÁBATA LOÍSE CUNHA LIMA
Avaliação do potencial antiviral da Annona muricata (Graviola) Spondias
mombin (Cajá) contra o vírus dengue-2 em cultura de células
Dissertação apresentada ao curso de Pós-Graduação em Ciências Biológicas - Centro de Biociências da Universidade Federal do Rio Grande do Norte (UFRN), como pré-requisito para obtenção do título de Mestre em Ciências Biológicas.
Aprovado em ___/____/_____
____________________________ Prof. Dr. Josélio Maria Galvão de Araújo
Universidade Federal do Rio Grande do Norte
____________________________ Prof. Dr. Kleber Juvenal Silva Farias
Universidade Federal do Rio Grande do Norte
____________________________ Prof. Dra. Renata Antonaci Gama Universidade Federal do Rio Grande do Norte
____________________________ Prof. Dr. Francisco Fábio Marques da Silva
Universidade Federal de Campina Grande
"Os Covardes nunca tentam, os fracassados nunca terminam,
os vencedores nunca desistem."
Norman Vincent Peale
"O pensamento positivo pode vir naturalmente, mas também pode ser aprendido e cultivado, mude os seus pensamentos e mudará o seu mundo."
AGRADECIMENTOS
A Deus pelo dom da vida e por nunca me desamparar nos momentos mais difíceis.
A Nossa Senhora da Conceição pela proteção espiritual.
Aos meus pais Maria Bernardete e Antônio Serafim por toda dedicação, carinho, amor e
investimentos feitos ao longo de toda a minha vida.
Ao meu irmão Tácito Lima e todos familiares que de forma direta ou indireta contribuíram
para que esse momento pudesse se tornar realidade.
Ao meu namorado Lauro Costa por todo apoio, paciência, compreensão, cuidado... Muito
obrigada meu lindo.
Ao professor e orientador Dr. Josélio Araújo pelas orientações indispensáveis na minha vida
acadêmica e por se fazer presente sempre que necessário.
Ao professor e co-orientador Dr. Kleber Farias por compartilhar comigo seus conhecimentos
e experiências laboratoriais. Tudo o que sei hoje referente à cultura de células devo ao senhor,
aqui ficam os meus mais sinceros agradecimentos. Muito obrigada!
Aos professores Dra. Renata Antonaci Gama e Dr. Francisco Fábio Marques da Silva por
terem aceitado participar da banca de defesa do meu mestrado.
Aos colegas de laboratório Daíse Maria, Renato Ferreira, Yasmin Mesquita, professora
Fabiana Lima e toda equipe do Laboratório de Biologia Molecular de Doenças Infecciosas e
do Câncer (LADIC) pela colaboração nos experimentos e pela convivência diária.
Ao curso de Pós-Graduação em Ciências Biológicas e todos os seus professores que fizeram
parte dessa jornada.
Aos colegas de turma.
Aos funcionários do Departamento de Microbiologia e Parasitologia do Centro de
Biociências.
Ao Banco do Nordeste pelo apoio financeiro.
Aos amigos, em especial a amiga Michelle Bonifácio por enfatizar sempre que, de agora em
diante serei mestre...
RESUMO
A dengue é uma doença de notificação compulsória e cerca de 50 a 100 milhões de casos são
registrados anualmente. Possui amplo espectro clínico e é transmitida ao homem através da
picada dos mosquitos do gênero Aedes, tendo como principal vetor a espécie Aedes aegypti. O
agente etiológico da doença é o vírus dengue (DENV) pertencente ao gênero Flavivirus,
família Flaviviridae e são conhecidos quatro sorotipos antigenicamente distintos (DENV-1,
DENV-2, DENV-3 e DENV-4). Atualmente o tratamento da dengue é apenas de suporte, feito
através de intensa hidratação. Ainda não existe uma vacina comprovadamente eficaz ou
tratamento específico, o estudo de possíveis antivirais que possam diminuir a viremia no
paciente é de altíssima relevância, uma vez que a carga viral é um dos fatores associado ao
aparecimento das formas graves da doença (febre hemorrágica da dengue e síndrome do
choque da dengue). No presente estudo nós avaliamos o potencial antiviral de extratos brutos
obtidos a partir das folhas das plantas do Nordeste brasileiro Annona muricata (graviola) e
Spondias mombin (cajá) contra o DENV-2 em cultura de células C6/36 e Vero. A avaliação
da ação dos extratos brutos foi feita por meio da quantificação da carga viral através da PCR
em Tempo Real (qRT-PCR) e pela técnica de contagem de unidades formadoras de placa
(PFU). As concentrações dos extratos de ambas as plantas utilizadas foram: 0,01, 0,1 e
1mg/mL. As culturas de células infectadas foram submetidas ao tratamento com os extratos
durante os períodos de 24-168h horas (7 dias). Células Vero tratadas com o extrato da S.
mombin não apresentaram redução na carga viral. Em contrapartida, quando estas células
foram tratadas com o extrato da A. muricata, uma hora após infecção, observou-se uma
redução significativa na carga viral nas primeiras horas (24h), quando comparadas com as
células não tratadas utilizadas como controle positivo. Ao serem tratadas em intervalos de 24
horas apresentaram uma redução na carga viral nos dias subsequentes (até o sétimo dia). Não
foi observada redução na carga viral em células C6/36 tratadas com ambos os extratos. De
acordo com os nossos resultados, o extrato da planta A. muricata possui potencial antiviral
promissor contra a infecção pelo DENV-2 em cultura de células Vero.
Palavras-chave: DENV-2. Células C6/36 e Vero. Annona muricata. Spondias mombin.
ABSTRACT
Dengue is a reportable disease and about 50 to 100 million cases are reported annually. It has
a wide clinical spectrum and is transmitted to humans through the bite of Aedes mosquitos,
the main vector the Aedes aegypti species. The causative agent of disease is dengue virus
(DENV) belonging to the genus Flavivirus, family Flaviviridae and are known four
antigenically distinct serotypes (DENV-1, DENV-2, DENV-3 and DENV-4). Currently the
treatment of dengue is supportive, made by intense hydration. Although there is no proven
effective vaccine or specific treatment, the study of potential antiviral drugs that can reduce
viremia in patients is very high importance, since the viral load is one of the factors associated
with the development of severe forms of the disease (hemorrhagic fever dengue and dengue
shock syndrome). In the present study we evaluated the antiviral potential of crude extracts
obtained from the leaves of plants in Northeastern Brazil Annona muricata (soursop) and
Spondias mombin (caja) against DENV-2 in cultured C6/36 and Vero. The evaluation of the
activity of the crude extracts was performed by the quantification of viral load by RT-PCR
(qRT-PCR) and counting technique of plaque forming units (PFU). The concentrations of
extracts of both plants used were 0.01, 0.1 and 1 mg/mL. The infected cell cultures were
subjected to treatment with the extracts during periods of 24-168h hours (7 days). Vero cells
treated with the S. mombin extract showed no reduction in viral load. In contrast, when these
cells were treated with the extract of A. muricata, one hour after infection, significant
reductions in viral load in the first hour was observed (24 h) when compared to untreated cells
used as positive control. When they are treated at 24 hour intervals showed a reduction in
viral load in subsequent days (until day). There was no reduction in viral load in C6/36 cells
treated with both extracts. According to our results, the plant extract has antiviral A. muricata
promising potential against infection by DENV-2 in Vero cell culture.
Keywords: DENV-2. C6/36 cells and Vero. Annona muricata. Spondias mombin. qRT-PCR
LISTA DE ABREVIATURAS E SIGLAS
C Proteína do Capsídeo
DC Dengue clássico
DENV Vírus da dengue
DENV-1 Vírus da Dengue sorotipo 1
DENV-2 Vírus da Dengue sorotipo 2
DENV-3 Vírus da Dengue sorotipo 3
DENV-4 Vírus da Dengue sorotipo 4
DMSO Dimetilsulfóxido
E Proteína do envelope
FHD Febre hemorragíca da dengue
HSV-1 e 2 Vírus Herpes Simplex tipo 1 e 2
IFI Imunofluorência indireta
IgG Imunoglobulina G
IgM Imunoglobulina M
IL-2 Interleucina-2
IL-4 Interleucina-4
IL-6 Interleucina-6
INF- Interferon Gama
KDa Kilodaltons
MOI Multiplicidade de infecção
MTT 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide
NS1 Proteína não-estrutural 1
NS2B Proteína não-estrutural 2B
NS3 Proteína não-estrutural 3
NS4A Proteína não-estrutural 4ª
NS4B Proteína não-estrutural 4B
NS5 Proteína não-estrutural 5
ORF Janela aberta de leitura
PBS Solução tampão de fosfato
prM Proteína pré-membrana
qRT-PCR Quantificação por transcrição reversa seguida pela reação em cadeia da polimerase em tempo real
RE Retículo endoplasmático
RNA Ácido ribonucléico
RT-PCR Transcrição reversa seguida pela reação em cadeia da polimerase
SBF Soro fetal bovino
SCD Síndrome do choque da dengue
LISTA DE FIGURAS
Figura 1. Esquema da organização do genoma dos DENV.
Figura 2. Modelo de biossíntese do vírus da dengue.
Figura 3. Classificação sugerida pela Organização Mundial de Saúde (OMS)
remanejando os pacientes de dengue em dois grupos distintos.
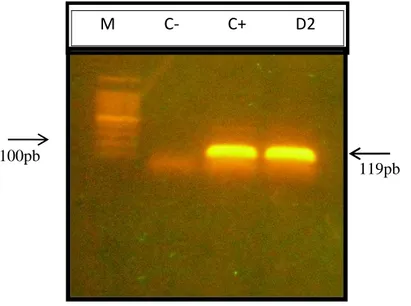
Figura 4. Resultado da reação da RT-PCR, revelada pela eletroforese em gel de agarose.
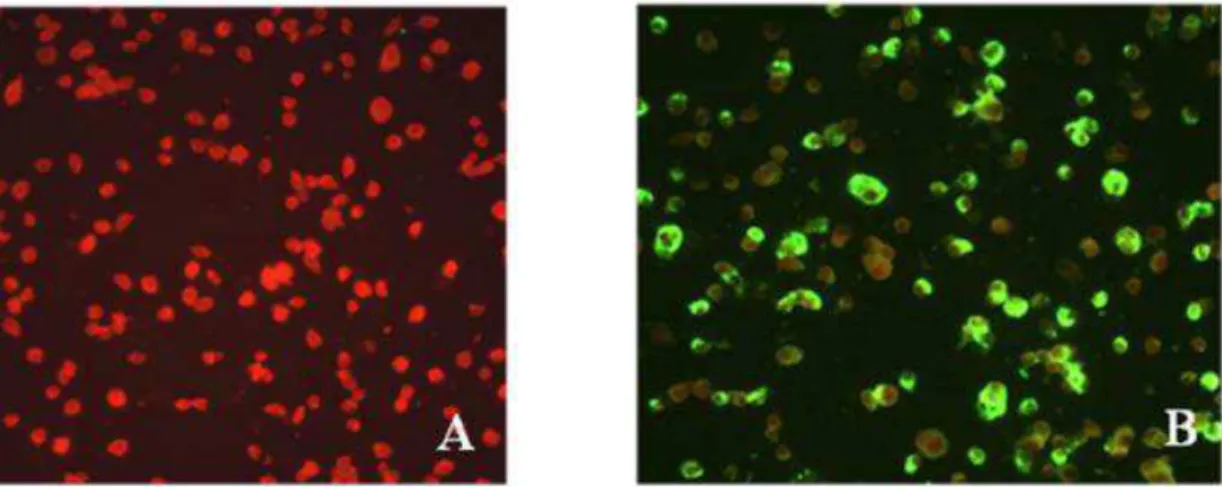
Figura 5. Lâminas da técnica de IFI em um aumento de 400X.
Figura 6. Ensaio de placa para titulação do DENV-2.
Figura 7. Viabilidade de células C6/36 e Vero submetidas ao tratamento com diferentes
concentrações do extrato da folha da Annona muricata.
Figura 8. Viabilidade de células C6/36 e Vero submetidas ao tratamento com diferentes
concentrações do extrato da folha da Spondias mombin.
Figura 9. Ação do extrato da folha da Annona muricata adicionada 1 hora após infecção
sobre a replicação do DENV-2 em células Vero.
Figura 10. Ação do extrato da folha da Annona muricata adicionado em intervalos de 24
horas sobre a replicação DENV-2 em células Vero.
Figura 11. Cinética de replicação viral em células Vero infectadas, tratadas ou não com o
extrato da A. muricata.
Figura 12. Ação do extrato da folha da Annona muricata adicionada em intervalos de 24
horas sobre a replicação do DENV-2 em células C6/36.
Figura 13. Ação do extrato da folha da Spondias mombin adicionada em intervalos de 24
horas sobre a replicação do DENV-2 em células Vero.
Figura 14. Ação do extrato da folha da Spondias mombin adicionado em intervalos de 24
SUMÁRIO
INTRODUÇÃO...15
1.1. Histórico da degue ...15
1.2. Vírus Dengue ...15
1.3. Patogênese ...19
1.4. O vetor ...21
1.5. A doença ...22
1.7. Vacina ...24
1.8. Epidemiologia ...25
1.9. Plantas Medicinais...26
1.9.1. Annona muricata ...27
1.9.2. Spondias mombin...28
2. OBJETIVOS ...29
2.1. Objetivos específicos: ...29
3. MATERIAS E MÉTODOS ...30
3.1. Cultura de células ...30
3.2. Linhagem viral ...30
3.3. Titulação do vírus dengue-2...30
3.4. Ensaio de imunofluorescência indireta ...31
3.5. Extração do RNA viral ...32
3.6. Transcrição reversa seguida da reação e cadeia da polimerase (RT-PCR) para confirmar infecção do estoque de DENV-2...32
3.7. Coleta do Material Vegetal ...33
3.8. Preparo dos Extratos ...33
3.9. Liofilização ...34
3.10. Preparo das Concentrações dos Extratos ...34
3.11. Testes de citotoxicidade ...34
3.12. Ensaio da atividade antiviral do extrato bruto da folha das plantas ...35
3.13. qRT-PCR em tempo real para quantificação da carga viral ...36
3.14. Titulação do vírus dengue-2 tratado com os extratos da Annona muricata e Spondias mombin ...37
3.15. Ação Virucida dos extratos ...37
4. RESULTADOS ...38
4.1. Confirmação da produção do estoque de DENV-2 a partir de cultura de células C6/36 infectadas ...38
4.1.1. Transcrição Reversa seguida da Reação em Cadeia da Polimerase (RT-PCR) ...38
4.1.2. Imunofluorescência indireta (IFI) ...38
4.1.3. Unidades formadoras de placa (PFU) ...39
4.2. Citotoxicidade dos extratos das folhas da Annona muricata e Spondias mombin ...40
4.3. Efeito dos extratos das folhas da Annona muricata e Spondias mombin sob a replicação do DENV-2 ...41
4.4. Teste virucida ...44
5. DISCUSSÃO ...45
6. CONCLUSÕES ...48
INTRODUÇÃO
1.1. Histórico da degue
A origem da palavra dengue não está bem esclarecida. Alguns autores relatam que o
nome tem origem espanhola e significa “melindre”, “manha”, que faz referencia ao estado de
moleza e prostração em que fica o indivíduo quando infectado pelo arbovírus (GUBLER,
1997 apud AZIN, 2010).
O registro mais antigo descrito até o momento encontra-se em uma enciclopédia
chinesa, publicado pela primeira vez em 265-420 d.C, na qual estão descritos os remédios e os
sintomas da doença, que foi chamada de “veneno das águas” pelos chineses, o que na época já
inferia uma conexão com insetos voadores associados à água (GUBLER, 1998).
Os primeiros registros da dengue no mundo foram feitos no fim do século XVIII, na
ilha de Java, no Sudoeste Asiático, e na Filadélfia, Estados Unidos. Somente no século
passado, a dengue foi reconhecida como doença pela Organização Mundial da Saúde
(MINISTÉRIO DA SAÚDE, 2009b).
O primeiro isolamento do vírus ocorreu no início da década de 1940, realizado por
Kimura, e Hotta, sendo a cepa isolada denominada Mochizuki. Posteriormente, Sabin e
Schlesinger, em 1945, isolaram a cepa Havaí e nesse mesmo ano Sabin identificou outro vírus
em Nova Guiné e constatou que essas cepas tinham características antigênicas diferentes e
propôs que se tratava de sorotipos do mesmo vírus. A primeira cepa ele denominou sorotipo 1
e à da Nova Guiné sorotipo 2. Em 1956, no curso de uma epidemia de dengue hemorrágico
no Sudeste Asiático, foram isolados os vírus 3 e 4, definindo-se, a partir daí, o complexo
dengue que é formado por quatro sorotipos: Dengue-1, Dengue-2 Dengue-3 e Dengue-4.
(TORRES, 1990 apud TEIXEIRA, BARRETO et al., 1999).
1.2. Vírus Dengue
O vírus Dengue (DENV) pertence família Flaviviridae e ao gênero Flavivirus, sendo
classificado como um arbovírus do grupo B (PINHEIRO e ROSA, 2004). Os Flavivirus
compreendem um grupo de mais de 70 vírus que são transmitidos por mosquitos e carrapatos
A partívula viral é pequena, mede cerca de 50 namômetros (nm) de diânmetro
(LINDENBACH e RICE, 2001). Apresenta um capsídeo de simetria icosaédrica, que junto
com o RNA formam um complexo chamado de nucleocapsídeo, o qual vai ser envolvido por
uma bicamada lipídica derivada das células do hospedeiro (RODENHUIS-ZYBERT et al.,
2010) na qual está inserida a glicoproteína viral E, conhecida como envelope viral
(LINDENBACH e RICE, 2001).
O genoma de todos os flavivírus se contitui de um RNA fita simples de polaridade
positiva, de aproximadamente 11.000 nucleotídeos e somente uma fase aberta de leitura
(ORF) (CHAMBERS et al., 1990), flanqueada por duas regiões não codificantes (NC)
conhecidas como 5’NC e 3’NC (LINDENBACH E RICE, 2001). A ORF codifica uma
poliproteína, posteriormente clivada em três proteínas estruturais e sete não estruturais
(CHAMBERS et al., 1990) (Figura1).
As três proteínas estruturais são derivadas da clivagem de 1/3 da região
amino-terminal da poliproteína e as mesmas são denominadas de: a proteína do capsídeo (C), da
pré-membrana (prM) e do envelope (E). A clivagem dos 2/3 da região carboxi-terminal dá origem
a sete proteínas não-estruturais (NS) conhecidas como NS1, NS2A, NS2B, NS3, NS4A,
NS4B e NS5(WHO, 2011).
A proteína C está destinada a formar o capsídeo viral. É caracterizada por ser
altamente básica e ter peso molecular de aproximadamente 11 kDa. O Capsídeo é formado a
partir de dobras proteícas constituíndo-se de um dímero compacto e simétrico
(LINDENBACH e RICE, 2001).
A proteína M, que esta localizada logo abaixo do envelope, pesa aproximadamente 8
kDa (RODENHUIS-ZYBERT et al., 2010) e é originária de um fragmento proteolítico formado a partir da clivagem do peptídeo “pr” (PERERA e KUHN, 2008) da proteína prM durante o processo de maturação das particulas virais (LINDENBACH e RICE, 2001).
A proteína E é composta por um complexo dimérico com duas subunidades idênticas
e é subdividida em três regiões distintas (DA SILVA e RICHTMANN, 2006). Pesa cerca de
dos virions, ligação ao receptor celular, além de promover a fusão entre o envelope viral e a
membrana da vesícula endossômica, formada a partir da membrana citoplasmática da célula
hospedeira durante o processo de internalização da partícula viral (CHAMBERS et al., 1990).
Dentre todas as proteínas do DENV, a glicoproteína E é considera a mais importante do ponto
de vista imunológico (MACKENZIE et al., 2004), por induzir a produção de anticorpos
neutralizantes do vírus (CHAMBERS et al., 1990). O mecanismo de neutralização esta
relacionado com a dissociação do dímero ocasionado pela presença do anticorpo (DA
SILVA e RICHTMANN, 2006).
A proteína NS1 é uma glicoproteína de 45 kDa que que está envolvida com o processo
de replicação viral, bem como na proteção do vírus, impossibilitando a ativação do
complemento (PERERA e KUHN, 2008). Apresenta um comportamento incomum para uma
glicoproteína viral, pois apesar de ser uma proteína não estrutural ela é direcionada para a
superfície das células infectadas, (YOUNG et al., 2000) podendo ser encontrada em níveis
elevados no soro de pacientes acometedidos pelo vírus, já a partir dos primeiros dias das
infeções primárias e secundárias (ALCON et al., 2002).
De acordo com Perera e Kuhn, (2008), a NS2A é uma proteína de aproximadamente
22 kDa que faz parte do complexo de replicação viral, provavelmente estando envolvida em
coordenar a mudança entre o empacotamento do RNA e a sua replicação. NS2B é uma
proteína hidrofóbica altamente conservada entre os flavivírus. Forma um complexo estável
com NS3 desempenhando papel de cofator para que a clivagem da poliproteína seja efetivada.
Conservada entre os flavivírus, NS3 é uma proteína multifuncional com 618
aminoácidos. É resposável por desempenhar o papel de uma serino protease como também de
helicase. O domínio de protease é o N-terminal e tem por função clivar a poliproteina viral em
vários sítios (PERERA e KUHN, 2008).
Propõe-se que NS4A induza alterações de membrana importantes para a replicação do
vírus e NS4B auxilia na replicação do RNA viral por meio de sua interação direta com NS3
(PERERA e KUHN, 2008).
NS5 é a maior (~104 kDa) e mais bem conservada proteína dos DENV. O gene que
codifica esta proteína esta situado na região C-terminal da extremidade 3´do genoma viral e
representa a RNA polimerase do vírus. Na célula infectada a proteína NS5 é pricipalmente
encontrada no núcleo celular, porém o verdadeiro motivo disso ocorrer ainda não é conhecido,
uma vez que a real função da enzima é desempenhada no citoplasma celular a fim de
Indivíduos infectados pelos DENV têm suas células fagocitárias como sendo os alvos
principais para a replicação viral (JESSIE et al., 2004). Contudo trabalhos como o de Araújo
et al., (2009) detectaram partículas virais em tecidos do baço, cérebro, coração, fígado,
pulmão, rim e medula óssea.
O vírus invade a célula hospedeira por meio de endocitose mediada por receptor e é
através da fusão do envelope viral com a membrana do endossoma que o vírus direciona o
nucleocapsídeo para o citoplasma celular (LINDENBACH e RICE, 2001). Dentro do
endossoma a partícula viral vai ser submetida a um meio ácido que provoca uma mudança
conformacional na glicoproteína E do envelpoe viral e subsequentemente ocorre a fusão entre
o envelope viral e a membrana do endossoma e liberação do genoma viral no citoplasma da
célula (CHU e NG, 2004).
É no citoplasma celular, na luz do retículo endoplasmático que os DENV replicam seu
genoma, (PERERA e KUHN, 2008) em ciclos que duram de 8-12 horas (DENISON, 2008).
O genoma viral corresponde a um RNA mensageiro policistrônico que é traduzido
inicialmente em uma poliproteína que é posteriormente processada nas diferentes proteínas
virais, seguido pelo processo de replicação viral. Dando sequência ao processo, vírions
imaturos são montados no lúmen do retículo endoplasmático (RE) brotando em seguida da
membrana do RE levando consigo as proteínas E e prM que estavam depositadas na
membrana. Os vírions imaturos vão amadurecer durante sua passagem pelo complexo de
golgi, onde a proteína prM vai ser clivada tornando-se M, por uma proteína tipo furina,
resultando na liberação de partículas virais maduras através do processo de exocitose (VAN
DER SCHAAR et al., 2007) (Figura 2).
1.3. Patogênese
A patogenia da dengue tem início com a transmissão do vírus através da picada do
mosquito vetor infectado (FIGUEIREDO, 1999). Após a picada do mosquito infectado o
período médio de incubação do vírus é de 4 a 7 dias (variação de 3 a 14 dias), após os quais o
paciente pode ou não apresentar sintomas (SINGHI et al., 2007).
Ao ser inoculado, o DENV realiza a primeira replicação em células musculares,
fibroblastos, em monócito e macrófagos nos linfonodos locais. Depois desse episódio
primário de replicação tem-se início a viremia, processo pelo qual o vírus se dissemina por
todo o organismo do indivíduo, podendo ser carreado no sangue livremente ou dentro de
células do sistema imune, especialmente os monócitos (FIGUEIREDO, 1999).
Sabe-se que os vírus da dengue tem tropismo por células fagocitárias (FONSECA e
FIGUEIREDO, 2004) e que ao serem infectadas produzem inúmeras citocinas, sendo
perceptível um aumento nas concentrações de TNF-α, IL-2, IL-6 e interferon (INF)- nos três
primeiros dias de doença (PESARO et al., 2007). De acordo com Lupi et al., (2007) a
produção dessas citocinas é diretamente estimulada pela replicação viral e provavelmente o
TNF-α e a IL-6 estão relacionados com o desenvolvimento do quadro febril da doença.
A infecção no organismo vai ser controlada pela resposta imune do hospedeiro,
mediada tanto pela ação de anticorpos específicos como pela ação das células CD8+(LUPI et
al., 2007). A infecção causada por um sorotipo confere imunidade futura contra ele próprio,
mas não contra outros sorotipos do vírus dengue (MALAVIGE et al., 2004).
Em relação à resposta imune, são conhecidas duas formas opostas. A primeira controla
a replicação viral promovendo a recuperação do indivíduo, devido à ação da imunidade
humoral, resultante da ação de linfócitos B ativados secretores de anticorpos (plasmócitos).
Nesse primeiro contato com o vírus, anticorpos IgM são produzidos após o 4º dia do início
dos sintomas, sendo possível a detecção dos maiores picos por volta do 7º dia declinando logo
após isso e não sendo mais detectáveis em alguns meses. As IgG específicas são observadas,
em níveis baixos, a partir do 4º dia após o início dos sintomas, elevam-se gradualmente,
atingindo altos títulos em duas semanas e mantêm-se detectáveis por vários anos, conferindo
imunidade tipo específica que permanece por toda a vida. A segunda forma refere-se à
imunopatologia da FHD/SCD e pode ser observada em mais de 90% dos casos em que
indivíduos apresentam reinfecção por outro sorotipo do vírus (FONSECA e FIGUEIREDO,
As citocinas desempenham papel fundamental na imunopatogênese da infecção pelo
Dengue. Níveis mais elevados de várias citocinas, especialmente aquelas produzidas por
linfócitos T, monócitos, macrófagos e células endoteliais têm sido encontrados no soro de
pacientes com FHD/SCD em relação aos encontrados em pacientes com a forma clássica da
doença (FD) (CHATURVEDI et al., 2000; GREEN e ROTHMAN, 2006). Dentre as citocinas
mais comumente encontradas em altos níveis no soro de pacientes com FHD /SCD incluem:
fator de necrose tumoral alfa (TNF-α), várias interleucinas (2, 6, 8, 10, 12, IL-1 ) e o interferon gama (IFN - ) (DEWI et al., 2004; KURANE, 2007; PANG et al., 2007). O TNF - α foi a primeira citocina a ser implicada na patogênese da FHD (CHATURVEDI et al.,
2006) . Essa pode atuar localmente na ativação de macrófagos ou sistemicamente podendo
levar ao aumento da permeabilidade vascular, entretanto esse mecanismo ainda não foi bem
elucidado (CLYDE et al., 2006; KURANE, 2007).
Até o presente momento não se sabe o porquê de somente alguns indivíduos
desenvolverem a forma sintomática de Dengue (DHF/SCD) (MALAVIGE et al., 2004), e a
falta de um modelo animal adequado impossibilita o avanços em pesquisas no que diz
respeito à patogênese viral (RODENHUIS-ZYBERT et al., 2010). Teorias relacionadas à
maior virulência da cepa, exposições sucessivas aos diferentes sorotipos do vírus e fatores
individuis do hospedeiro tentam explicar essa problemática (TAUIL, 2002). Dentre as teorias
mais aceitas para a patogenia de casos graves de dengue, estão as postuladas por Rosen, em
1977, Halstead, em 1988, e Kouri et al., em 1987.
De acordo com Rosen (1977), o aparecimento da FHD da dengue se deve à virulência
da cepa infectante, ou seja, o aparecimento de casos mais graves está relacionado à infecção
causada por cepas mais virulentas. Já Halstead (1988), defende que o aparecimento de formas
mais graves da doença esta relacionada á presença de anticorpos IgG heterotípicos que
promovem a amplificação da replicação viral, uma vez que facilitam a endocitose, por
macrófagos e monócitos via receptor para FC de IgG presente em suas superfícies, das
partículas virais que se encontram recoberta por esses anticorpos. Enquanto Rosen defende
que o aparecimento da FHD está relacionada com a virulência da cepa viral e Hasltead
defende que isso estaria ligado a fatores individuais, Kouri et al., (1989) propõem que o
aparecimento de formas graves da doença estaria interligado com fatores individuais, virais e
1.4. O vetor
Originário provavelmente da região etiópica do Velho mundo, o Aedes aegypti é
considerado um mosquito cosmopolita (CONSOLI e OLIVEIRA, 1994). É mundialmente
conhecido como o principal transmissor da dengue. Chegou à América, trazido da África
durante a colonização e a escravidão, sendo bastante combatido durante a década de 40 e 50
(EIRAS, 2004). Foi erradicado no nosso país em 1955, sendo reintroduzido em 1960
(MONCAYO et al., 2004).
São mosquitos que apresentam coloração preta e listras e manchas brancas (TAVEIRA
et al., 2001), possuem hábitos diurnos e vivem cerca 30 dias (EIRAS, 2004). A fêmea é quem
realiza o hematofagismo, uma vez que necessita de sangue para que ocorra a maturação dos
seus ovos (CURSINO et al., 2008). Apesar dos hábitos diurnos as fêmeas atacam o homem
em todos os momentos do dia, atingindo seus maiores picos de atividade ao amanhecer e no
entardecer do dia (CONSOLI e OLIVEIRA, 1994).
Ao exercerem a hematofagia, inoculam com a saliva as partículas virais (MINISTÉRIO
DA SAÚDE, 2009a), uma vez que, são nas glândulas salivares do mosquito que o vírus se
replica e permanece durante toda a vida do inseto (CURSINO et al., 2008).
Os ovos são colocados em recipientes contendo água, como caixa d’águas, tonéis e
potes feitos dos mais diversos materiais (MARTINS et al., 2010).
Um segundo vetor de grande importância, envolvido na transmissão dos DENV, é o A.
albopictus (LÓPEZ-VÉLEZ e MOLINA MORENO, 2005), também conhecido como tigre
asiático, ele é originário do sudeste da Ásia, sendo caracterizado por ter coloração escura e
apresentar uma faixa e pintas bancas no dorso e nas pernas, respectivamente (BOTARGUES,
2007).
Este mosquito foi introduzido no Brasil nos anos 80, provavelmente oriundo do Japão,
trazido através de navios que ancoravam no porto de Vitória-ES (EIRAS, 2005) sendo
notificado pela primeira vez em maio de 1986 (CONSOLI e OLIVEIRA, 1994).
Seu habitat natural eram buracos em árvores nas selvas do sudeste da Ásia
(BOTARGUES, 2007) e por isso é considerado como sendo um mosquito de hábitos
silvestres, encontrado com facilidade na zona rural (CONSOLI e OLIVEIRA, 1994). O A.
albopictus é capaz de se reproduzir em recipientes que acumulem pequenas quantidades de
água, como é o caso de vasos de flores, recipientes plásticos abandonados, especialmente
O crescimento desordenado das áreas urbanas e da associação dos vetores (A. aegypit
e A. albopictus) com o peridomicílio forneceu a adaptação das espécies resultando assim no
aumento de casos de dengue nas áreas urbanas (MONCAYO et al., 2004).
1.5. A doença
A dengue apresenta um amplo espectro clínico, variando desde casos assintomáticos
ou oligossintomáticos até formas mais graves podendo evoluir para óbito. A ocorrência de
formas mais graves diz respeito ao desenvolvimento da febre hemorrágica da dengue (FHD)
e da síndrome do choque da dengue (SCD) (MINISTÉRIO DA SAÚDE, 2008).
A forma assintomática ou oligossintomática é conhecida como dengue clássica (DC) e
corresponde a forma mais branda da doença, uma vez que na maioria dos casos evolui para a
cura, em até 7 dias, de forma autolimitada (SEVERO, 2006). Os primeiros sintomas se
constituem do aparecimento, de forma abrupta, de febre alta (39-40°C) associada à cefaléia,
mialgias, artralgias, náuses, vômitos, prurido cutâneo e enxatema, (GUBLER, 1998). Dor
atrás dos olhos, fraqueza extrema (TAVEIRA et al., 2001) e rubor , também foram relatados
como sintomas característicos (SINGHI et al., 2007). Pequenas manchas avermelhadas
(petéquias) podem aparecer de forma dispersa ou confluentes no final da fase febril
(GUBLER, 1998). A febre tende a diminuir em até 6 dias, iniciando-se a convalesceça, que
pode durar semanas (FIGUEIREDO e FONSECA, 2004).
A dengue hemorrágica apresenta sintomatologia clínica semelhante ao da DC,
podendo ocorrer hepatomegalia, fortes dores abdominais e prova do laço positiva (SEVERO,
2006). A prova do laço é parte do exame físico do paciente com suspeita de dengue
(MINISTÉRIO DA SAÚDE, 2005).
O agravamento do DC ocorre por volta do terceiro ou quarto dia de evolução dos
sintomas, ocorrendo episódios hemorrágicos, colapso circulatório e (MINISTÉRIO DA
SAÚDE, 2009a) estado febril alto acima de 39°C, caindo para níveis normais ou abaixo do
normal, carcacterizando a recuperação do paciente ou, em alguns casos, o avança para fase de
choque(GURUGAMA et al., 2010).
O choque é de curta duração e se não tratado adequadamente pode levar o invivíduo a
óbito em 12 a 24 horas. O mesmo é decorrente do aumento da permeabilidade vascular
decorrente de lesões no endotélio e redução drástica do número de plaquetas o que resulta em
maioria dos pacientes ocorre de forma espontânea após intensa hidratação, (GURUGAMA et
al., 2010).
A síndrome do choque da dengue é responsável por aproximadade 50% dos casos
fatais de dengue(TAVODOVAA MD, 2007). Se não tratada, leva o indivíduo a um quadro de
acidose metabólica, hemorragia grave do trato gastrintestinal e de outros órgãos (SINGHi et
al., 2007), como também coagulação intravenosa disseminada.
São considerados sinais de alerta da dengue hemorrágica: dor abdominal intensa e
contínua, vômitos persistentes, queda da pressão arterial, dimunuição da diurese,
desorientação ou confusão mental. Os sinais clínicos do choque são: taquicardia, hipotensão,
sudorese, iquietação e extremidades frias. Relatos de cianose também são observados
(GURUGAMA et al., 2010).
A fim de simplificar a classifiação dos casos de dengue, bem como melhorar o
tratamento dos casos graves, a Organização Mundial de Saúde (OMS) sugeriu uma nova
classificação e triagem para os casos da doença (Figura 3).
1.6. Diagnóstico
Por apresentar um amplo espectro clínico, faz-se necessário o diagnostico diferencial
da dengue (MINISTÉRIO DA SAÚDE, 2009a) através de testes laboratoriais (MINISTÉRIO
DA SAÚDE, 2005).
Dentre os prováveis testes laboratoriais utilizados estão: o isolamento viral, pesquisa
do antígeno NS1 e técnicas moleculares (MALAVIGE et al., 2004).
O isolamento viral objetiva detectar o vírus e identificar o sorotipo o que é feito pela
inoculação de amostra do soro do paciente em cultura de células C6/36, sendo possível a
confirmação da infecção viral através da técnica de imunofluorescência indireta (TAVEIRA
et al., 2001). Além da linhagem C6/36, outras linhagens de células de mosquito, como
também de mamífero (tais como Aedes pseudoscutellaris , células Vero e células LLC-MK2)
são utilizadas nessa técnica (GUPTA e BALLANI, 2014).
A técnica da RT-PCR é tida como um método de diagnóstico rápido, na qual é
possível detectar a presença do genoma viral na amostra (FONSECA e FIGUEIREDO, 2004).
Do mesmo modo, podemos nos referir a qRT-PCR em tempo real. Pois, de acordo
com Mackay, (2004) essa é uma técnica muito rápida que apresenta altos níveis de
sensibilidade, uma vez que é capaz de identificar a presença de material genético mesmo em
baixíssimos níveis.
A detecção da proteína NS1 do vírus no soro do paciente pela técnica de ELISA se
constitui um método de diagnóstico rápido, uma vez que esta proteína viral é produzida no
início da replicação viral e torna-se detectável no soro do paciente a partir do segundo dia de
infecção. Este representa uma alternativa aos métodos moleculares, especialmente nas regiões
mais pobres, em virtude de sua maior simplicidade e do menor custo.
1.7. Vacina
No momento atual, nenhuma droga para o tratamento específico da dengue está
disponível (FIGUEIREDO, 1999). O tratamento existente é apenas de suporte, feito com
hidratação e administração de medicamento que aliviam os sintomas no paciente (LUPI et al.,
2007).
Quanto a utilização de vacina para prevenção da doença está também ainda
encontra-se indisponível, uma vez que não existe nehuma vacina licenciada para uso e nem que encontra-seja
comprovadamente eficaz. Para ser eficaz é importante que a vacina contra a dengue confira
imunidade para os quatro sorotipos do vírus (GUY et al., 2010), uma vez que a imunização
com um sorotipo do vírus, induz imunidade apenas homóloga (conferindo proteção apenas
contra aquele tipo, mas não contra os outros sorotipos) (BRICKS, 2004). Caso a vacina não
seja validada nesses moldes, aumentará o risco da forma gravade da doença se o indivíuo
vacinado contra um determinado sorotipo, vier a se infectar posteriormento com outro
sorotipo do vírus.
Dentre as vacinas candidatas em estágio de desenvolvimento tem-se: a de vírus
atenuado, de vírus completo inativado, contendo subunidades da proteína E e prM, como
também vacinas de DNA, quiméricas e vetoriais (THISYAKORN e THISYAKORN, 2014).
A vacina de vírus atenuado tem despertado maior enfoque dentre as demais, estando
Entre as vacinas de vírus atenuado, um conjunto quimérico do vírus da febre amarela
17D, que carregam os genes estruturais do envelope e da pré-membrana de cada um dos
quatro sorotipos de DENV tem progredido para ensaios clínicos de fase III. A vacina
tetravalente LAV da Sanofi-Pasteur está em fase mais avançada de estudos de
desenvolvimento e eficácia (GALLER et al., 2011).
Apesar de resultados promissores, ainda não econtra-se disponível uma vacina
licenciada para a dengue (THISYAKORN e THISYAKORN, 2014).
1.8. Epidemiologia
A dengue é uma doença que afeta populações de todas as idades e de todos os níveis
socioeconômicos, com estimativa de 2,5 bilhões de pessoas vivendo em áreas endêmicas com
a ocorrência de 50 a 100 milhões de casos por ano. Nas Américas nos últimos 50 anos os
números de casos de dengue aumentaram em torno de 30 vezes e foi no ano de 2013 que ficou
registrada a maior epidemia nesse continente. Esta é uma doença de impacto
social-econômico elevado e a estimativa de seus gastos é de cerca de 2,1 bilhões de dólares por ano
(PAHO, 2014).
Está presente em vários países do mundo, localizados no Sudeste Asiático, na África e
nas Américas, atingindo a toda a América Latina (MINISTÉRIO DA SAÚDE, 2009b). Em
nosso país, esta é uma doença de notificação compulsória, presente de forma autóctone, em
praticamente todos os Estados (SEVERO, 2006).
No Brasil a primeira epidemia registrada, confirmada em laboratório, ocorreu no final
de 1981 e início 1982 na região de Boa vista, no então território federal de Roraima, com
isolamento dos sorotipos 1 e 4 (OSANAI et al., 1983).
A circulação do sorotipo DENV-1, inicialmente no Estado do Rio de Janeiro, foi
identificada no ano de 1986, a partir daí, espalhando-se para outros seis Estados até 1990,
(MINISTÉRIO DA SAÚDE, 2009a) quando ocorreu a introdução do sorotipo 2 do vírus e
foram registrados os primeiros casos FHD no Brasil, alertando para a ocorrência de epidemias
com casos mais graves da doença (PIMENTA e SILVA, 2001).
No Rio Grande do Norte o vírus chegou em 1994, sendo notificado pela primeira vez
no município de Assu-RN, e em 1996, diversos municípios do RN notificaram a ocorrência da
relata que o DENV-3 foi reintroduzido nas Américas, após 15 anos de ausência, e em
Dezembro de 2000 foi encontrado no Brasil.
No ano de 2010, foi notificado o isolamento do DENV-4 no Estado de Roraima,
confirmando a reintrodução desse sorotipo no Brasil (SESAP/ RN, 2010).
De acordo com a Secretaria de Vigilância em Saúde do Ministério da Saúde (2014),
até Outubro de 2014 foram notificados um total de 547.612 casos prováveis de dengue no
País. Em análise comparativa com 2013, observa-se redução de 61,5% dos casos. Dos
547.612 casos registrados um total de 644 foi classificado como dengue grave e 7.779 como
dengue com sinais de alerta.
Em relação aos sorotipos circulantes no país, foi constatada a co-circulação dos DENV
(1, 2, 3, 4), sendo o DENV-2 responsável por uma pequena parcela dos casos (1,5%). No Rio
Grande do Norte o mesmo foi responsável por 4,5 % dos casos confirmados (MINISTÉRIO
DA SAÚDE, 2014).
1.9. Plantas Medicinais
Pode-se considerar como medicinal toda planta administrada sob qualquer forma e por
alguma via ao homem, exercendo algum tipo de ação farmacológica (FOGLIO et al., 2006).
Antes mesmo de a humanidade descobrir a existência dos micro-organismos, a ideia
de que certas plantas tinham de fato um potencial de cura, e que nele continha o que
atualmente é chamado de princípios antimicrobianos, foi bem aceita. (RÍOS E RECIO, 2005).
Até meados do século XX, as plantas medicinais e seus derivados constituíam a base
da terapêutica medicamentosa humana, e mesmo com o desenvolvimento acelerado das
drogas sintéticas, atualmente tem-se que 25% dos medicamentos utilizados são de origem
vegetal (FOGLIO et al., 2006).
Nas últimas décadas, registrou-se um aumento expressivo no interesse em substâncias
derivadas de espécies vegetais, uma vez que se pode acompanhar o crescente aumento no
número de publicações de estudos científicos destinados a este fim (FOGLIO et al., 2006).
O interesse em produtos naturais aumentou em países desenvolvidos, mas
principalmente em países industrializados. E no Brasil, devido a sua imensa flora, aspectos
culturais e vasta utilização de ervas medicinais, esse campo de estudo encontra-se em
1.9.1. Annona muricata
A Annona muricata Linn. integrante da família Annonaceae, é conhecida
popularmente como graviola, guanabara, araticum, coração-de-rainha, fruta-do-conde,
jaca-do-pará, pinha, coração-de-boi, condessa, jaca-de-pobre, araticum-manso, entre outros
(NUNES et al., 2012). Aárvore chega a medir até 8 metros, apresenta folhas verde escuras,
grandes e brilhantes, com fruto comestível (NAWWAR et al., 2012). A planta encontra-se
presente em quase todos os países da América tropical, embora não seja nativa do Brasil, é
cultivada praticamente em todos os estados do norte e nordeste (SOUZA et al., 2003).
Muitas espécies do gênero Annona são utilizadas na medicina tradicional para o
tratamento de varias doenças (SANTOS e SANT'ANA, 2001). No que diz respeito à Annona
muricata todas às partes da planta são utilizadas como fitoterápicos (SILVA e GARCIA,
1999). Geralmente, a fruta e o suco são tomados para elucidar problemas com parasitas, para
melhorar os sintomas de febre, diarreia e disenteria. As sementes são usadas também contra
parasitas. A casca, folhas e raízes são consideradas antiespasmódico, hipotensor, sedativo e
podendo ser empregadas também no controle da diabetes. Nos dias atuais a graviola está
sendo amplamente comercializada como um popular adjuvante natural na terapia contra o
câncer (TAYLOR, 2002), fato esse que pôde ser comprovado cientificamente(RIESER et al.,
1996; LIAW et al.,2002; MELO et al., 2010; TORRES et al., 2012; PIEME et al., 2014).
Foram relatadas as presenças de propriedades antivirais e antibacterianas, advindas da
gravioleira (RAGASA et al., 2012), como também antimaláricas (RAZAK et al., 2014)
anti-inflamatórias (ISHOLA, et al., 2014), antidiabéticas (NGUEGUIM, et al., 2014). Isso muito
provavelmente se justifica graças à descoberta das acetogeninas (SANTOS e SANT'ANA,
2001), como também outras classes químicas, o que é o caso de alcalóides, como a "anonina",
"muricina" e a "muricinina", oriundos da casca do tronco e das sementes da planta (SILVA e
GARCIA, 1999).
Dentre os compostos naturais isolados a partir do extrato bruto da gravioleira têm-se
destaque as acetogeninas por apresentarem uma ampla atuação biológica, tais como:
imunossupressoras, antiparasitária, citotóxica, antimicrobiana, pesticida e antitumoral
1.9.2. Spondias mombin
Spondias mombin L. é uma árvore frutífera, comumente conhecida como cajazeira,
que mede cerca de 20 a 25 metros de altura. Pertencente à família Anacardiaceae, essa espécie
é facilmente encontrada em toda a região neotropical, com maior diversidade no oeste
Amazônico e em florestas do Atlântico (RODRIGUES e SAMUELS, 1999).
Assim como a gravioleira, na medicina popular a planta também é utilizada para o
tratamento de várias enfermidades, como é o caso de dores de estômago, fígado, uretrites,
cistite e inflamações da garganta e dos olhos (OLUGBUYIRO e MOODY, 2013). No campo
da pesquisa científica a cajazeira foi empregada como agente antiviral (CORTHOUT et al.,
1991; SILVA et al., 2011) e agente microbicida no geral, apresentando propriedades
antibacterianas, antiparasitária e antiprotozoária (ABO et al., 1999; GBOLADE e
ADEYEMI, 2008; ACCIOLY et al., 2012; OLUGBUYIRO e MOODY, 2013; TRAORE, et
al., 2014).
A gravioleira e a cajazeira são exemplares que compõem o vasto repertorio de recursos
naturais brasileiros, sendo as plantas atualmente consideradas fontes valiosas de produtos
naturais representando verdadeiros laboratórios químicos na busca de novas moléculas
bioativas.
Nesse sentido, levando-se em consideração o grande interesse no aproveitamento da
nossa vegetação, resolvemos investigar o potencial antiviral dos extratos brutos das folhas das
plantas Annona muricata (Graviola) e Spondias mombin (Cajá) sobre a replicação do
DENV-2 em cultura de células C6/36 e Vero, uma vez que, com o passar dos anos a problemática da
dengue está em constante agravamento e nenhum antiviral e/ou vacina eficaz foram validados
2. OBJETIVOS
Avaliar o potencial antiviral dos extratos brutos obtidos das folhas das plantas Annona
muricata e Spondias mombin em linhagens de células Vero e C6/36 infectadas com DENV-2.
2.1. Objetivos específicos:
(i) Avaliar a atividade antiviral do extrato das plantas Annona muricata e Spondias
mombin sobre a replicação do DENV-2 em células Vero e C6/36, tomando como parâmetro a
quantificação de placas produzidas pelo vírus nessas células tratadas e não tratadas pela
técnica de unidades formadoras de placa (PFU);
(ii) Avaliar a atividade antiviral do extrato das folhas das plantas Annona muricata e
Spondias mombin sobre a replicação do DENV-2 em células Vero e C6/36, tratadas e não
tratadas, tomando como parâmetro o número de cópias do genoma viral determinado por PCR
em tempo real (qRT-PCR);
(iii) Avaliar a ação virucida do extrato das plantas Annona muricata e Spondias mombin sobre
a infecção do DENV-2 em células Vero e C6/36.
3. MATERIAS E MÉTODOS
3.1. Cultura de células
Foram utilizadas células C6/36 e Vero. As células C6/36 (linhagem contínua
proveniente do mosquito Aedes albopictus) foram mantidas em meio de cultura Leibovitz-15
(L-15) (Invitrogen, New York, USA) suplementado com 10% Soro Fetal Bovino inativado
(SBF), L-glutamina, 1% antibiótico e 10% triptose fosfato, mantidas em estufa a 28ºC. As
células Vero (linhagem contínua proveniente de rim de macaco verde africano) foram
cultivadas em meio Leibovitz-15 (L-15) (Invitrogen, New York, USA), suplementado como
descrito anteriormente, e mantidas em estufa de CO2 (5%) a 37ºC.
3.2. Linhagem viral
O vírus utilizado nos experimentos foi o DENV-2 (New Guinea C). O estoque viral foi
preparado por inoculação em células C6/36 cultivadas em garrafas de cultura de 75 cm2 com
monocamada de 90% de confluência e mantidos sob agitação por 1 hora para a adsorção viral.
Após a infecção foi adicionado 15 mL de meio [L-15 suplementado com 2% de SBF, 0,29g/L
de L-glutamina, 1% de antibiótico (penicilina 100U/mL, estreptomicina 1mg/mL) e 10%
triptose fosfato (Invitrogen, New York, USA)] na cultura celular e a mesma foi mantida a
28ºC por 7 dias para a replicação do vírus. Após este período foi adicionado ao sobrenadante
20% de SBF e em seguida esse foi aliquotado em criotubos e armazenado a -70°C, para
posterior confirmação da infecção viral, através das técnicas de imunofluorescência indireta
(IFI) e RT-PCR.
3.3. Titulação do vírus dengue-2
Após a propagação do vírus em cultura de células C6/36 foi realizada a titulação viral
através da técnica de unidade formadora de placa (PFU). Para isso, células Vero foram
cultivadas em garrafas 75 cm2 (Corning Incorporated, Corning, NY, USA) até atingir uma
monocamada confluente de células. Após ser atingida a confluência de 90% ou mais, as
células foram soltas ao serem incubadas com 2 mL de tripsina (Invitrogen, New York, USA).
O conteúdo da garrafa foi ressuspendido em 23 mL de meio L-15 (Invitrogen, New York,
USA) suplementado com SBF (10%), triptose fosfato (10%) e antibióticos (penicilina
foi adicionada em placas de 12 poços (Corning Incorporated, Corning, NY, USA) em um
número aproximado de 6 x105 células/poço e incubadas por 2 dias em estufa de 37°C em 5%
de CO2, para formar uma monocamada confluente. Após 48h a suspensão viral, proveniente
da cultura de células C6/36, foi descongelada lentamente em gelo e realizada diluições
seriadas decimais até a diluição de 10-5. Em seguida foi removido o meio de cultura da placa
de 12 poços e adicionados 100 µL da diluição em cada poço em duplicata, e meio L-15 sem
suplemento como controle negativo. A placa foi incubada por 1 hora a 37°C em 5% de CO2,
sendo agitada lentamente de 15 em 15 minutos, para otimizar o processo de adsorção viral.
Após este tempo foi retirado o inoculo viral e foi adicionada 1mL/poço de Overlay (meio
L-15 2% SBF sem vermelho fenol e carboximetilcelulose a 3% estéril) (Sigma, Munich,
Germany). A placa foi incubada em estufa por 7 dias a 37°C em 5% de CO2. No sétimo dia, a
camada viscosa foi removida e os poços foram lavados com PBS. Para que pudéssemos
observar as placas virais, foram adicionados 400µL do corante preto de naftaleno (Sigma®) e
a placa foi incubada por 40 minutos a temperatura ambiente. O cálculo foi realizado
observando a maior diluição dos títulos viras onde foi possível visualizar as placas de lise,
levou-se em consideração a diluição e o volume total do inoculo. Os valores foram expressos
em PFU/mL.
3.4. Ensaio de imunofluorescência indireta
O teste de imunofluorescência indireta (IFI) foi realizado para determinar a presença
da infecção viral com DENV-2 na cultura de células C6/36. Na preparação das lâminas para
imunofluorescência, a suspensão celular foi centrifugada a 1000 rpm por 5 minutos, onde o
sedimento celular foi lavado três vezes com 1mL de PBS, e a concentração de células foi
observada em microscópio óptico comum (aumento de 100X) em aproximadamente 100
células por campo. Em cada poço da lâmina de imunofluorescência foram aplicados 10μL da
suspensão celular. Em seguida, as células aderidas às lâminas foram fixadas com acetona PA
gelada por 15 minutos. Feito as lâminas, foram adicionados em cada poço 20µL de MIAF
purificado (fluído ascítico de camundongos imunizados contra o DENV-2) diluído 1:100 em
PBS contendo 3% de SBF nas demarcações. As lâminas foram incubadas em câmara úmida a
37ºC por 30 minutos. Em seguida foram lavadas três vezes com PBS por 5 minutos e secas à
temperatura ambiente. Posteriormente, as lâminas foram incubadas com 20µ L do conjugado
anti-IgG de camundongo marcada com isotiocianato de fluoresceína (FITC) (Sigma, USA),
em câmara úmida. Após três lavagens com PBS as lâminas foram montadas com glicerina
tamponada e observadas em microscópico de imunofluorescência para se determinar a
presença ou não de fluorescência característica, indicando positividade da amostra.
3.5. Extração do RNA viral
A extração do RNA viral foi conduzida de acordo com protocolo descrito pelo
fabricante, utilizando o QIAmp Viral Mini Kit (QIAGEN, Inc., Valencia, EUA). De forma
breve a mesma pode ser resumida da seguinte forma: 140 µL de cada amostra biológica foram
incubados com tampão de lise AVL e RNA carrier por 10 minutos, em seguida foram
misturadas com etanol absoluto e aplicadas em uma coluna contendo um pequeno filtro de
sílica fornecida pelo kit. Posteriormente, as amostras foram centrifugadas e lavadas com os
tampões AW1 e AW2. Por fim, o RNA viral foi eluído dos filtros de sílica pela ação do
tampão AVE. Após ser extraído o RNA viral, o mesmo foi armazenado à -20ºC para
utilizações futuras.
3.6. Transcrição reversa seguida da reação e cadeia da polimerase (RT-PCR) para confirmar infecção do estoque de DENV-2
Os oligonucleotídeos utilizados na técnica de RT-PCR foram descritos por
(LANCIOTTI et al., 1992). A RT-PCR foi realizada através de um procedimento de duas
etapas, conhecido como semi-nestd. Na primeira foram utilizados 0,75L de iniciadores
consensuais a 10M (D1 e D2), para os quatro sorotipos da dengue, complementares as
sequências dos genes que codificam as proteínas C e prM. No procedimento semi-nested,
foram utilizados por amostra 0,75L de iniciadores específicos TS1, TS2, TS3 e TS4,
Oligonucleotídeo indicador (Sentido) Sequência (5´-3´) Posição no genoma Tamanho do amplicon (em pares de bases
[pb]) D1 (+) 5´-TCA ATA TGC TGA AAC GCG CAG AAA CCG- 134-161 511
D2 (-) 5´-TTG CAC CAA CAG TCA ATG TCT TCA GGT TC- 616-644 511
TS1 (-) 5´-CGT CTC AGT GAT CCG GGG G- 568-586 482 (D1+ TS1)
TS2 (-) 5´-CGC CAG AAG GGC CAT GAA CAG- 232-252 119 (D1+ TS2)
TS3 (-) 5´-TAA CAT CAT CAT CAT GAC ACA GAG C- 400-421 290 (D1+ TS3)
TS4 (-) 5´-CTC TGT TGT CTT AAA CAA GAG A- 506-527 392 (D1+ TS4)
Como componentes da RT-PCR ainda foram usados os seguintes reagentes: Água
livre de nucleases (IDT, Iowa, USA), sendo utilizado um volume de 8L na primeira etapa e
de 6,25L na segunda etapa; PCR Master Mix 2x (Promega, Madison, USA) sendo 12,5L
em ambas as etapas e 0,5L da enzima AMV-RT 5 U/µL (Promega, Madison, USA), apenas
na primeira etapa do ensaio.
Na etapa de transcrição reversa, seguida de amplificação, correspondente a primeira
etapa do ensaio, foi realizado o seguinte procedimento: 2,5L do RNA extraído, previamente
acondicionados em tubo tipo eppendorfde 0,2 mL,foram adicionados a 22,5L da mistura
da RT-PCR. Logo em seguida os tubos foram colocados no bloco aquecido do termociclador.
Após a transcrição reversa, que ocorreu a 45ºC e teve duração de 45 minutos, as amostras
foram submetidas a 30 ciclos subsequentes de desnaturação (94ºC por 35 segundos),
anelamento (56ºC por 1 minuto), extensão (72ºC por 2 minutos) e um tempo final de extensão
equivalente a 10 minutos em uma temperatura de 72ºC.
Para a análise dos produtos amplificados, foi realizada eletroforese horizontal à 100V
por aproximadamente 60 minutos. Nesse procedimento foram utilizados 10L do produto
amplificado, misturados a 5L de azul de bromofenol (Amresco, Ohio, USA) aplicados em
um gel de agarose (BioAmerica, Inc., Miami,USA) a 1% em Tris-Ácido Bórico-EDTA 0,5X,
acrescido de Gel Red® 0,1% (Invitrogen).
3.7. Coleta do Material Vegetal
Foram coletadas folhas de, Annona muricata (UFRN-14110) e Spondias mombin
da UFRN para que fosse realizada a identificação das espécies. Em seguida o material foi
submetido à secagem em estufa de ar circulante, por três dias sob temperatura não superior a
45°C e moído em um liquidificador.
3.8. Preparo dos Extratos
As folhas moídas foram submetidas à maceração e decocção. A maceração foi
realizada com o extrato e com mistura hidroetanólica (70:30, v/v), na proporção 1g:10mL, em
contato por 7 dias com agitação ocasional. Em seguida o extrato bruto foi filtrado e teve o
volume de etanol diminuído com o auxilio de um evaporador rotatório. A decocção foi
realizada utilizando o extrato e água destilada, na proporção 1g:10mL em aquecimento até 15
minutos após fervura. Os decoctos foram então submetidos à filtração a vácuo.
3.9. Liofilização
Os rotaevaporados dos macerados hidroetanólicos e os decoctos das folhas foram
submetidos à refrigeração sob temperatura de -20°C por duas semanas. Após este período,
foram liofilizados (Liotop - Modelo L202; Série 06510) obtendo-se por fim um pó cristalino.
Os liofilizados foram armazenados em dessecadores.
3.10. Preparo das Concentrações dos Extratos
As soluções estoques foram preparadas dentro da capela de fluxo laminar, sendo
utilizados os extratos das folhas das plantas com 2% de DMSO (diluição 1:40) e meio L-15
(2%) na concentração de 100mg/mL (1g em 10mL).
Em seguida as soluções foram homogeneizadas em um agitador mecânico para
completar sua diluição. Foram utilizadas as seguintes concentrações dos extratos de ambas as
plantas: 100, 10, 1, 0,1, 0,01 mg/mL. Essas concentrações foram obtidas por diluições
seriadas decimais a partir das soluções estoques.
3.11. Testes de citotoxicidade
Para que fossem utilizados os extratos das folhas, testes de citotoxicidade foram
realizados, a fim de determinar as concentrações ideais de trabalho. Transcorridos períodos de
1, 6, 12, 24, 48, 72 e 96 horas de contato com os extratos, foi avaliada a viabilidade celular
pela técnica do MTT e pelo método de exclusão do azul de Trypan a 0,4% (Invitrogen, New
Para o ensaio do MTT culturas de células Vero e C6/36 foram preparadas em placas
de 96 poços (Corning Incorporated, Corning, New York, USA), com aproximadamente 1 x
104 células/poço . As células foram mantidas em estufa de CO2 a 37º C e de 28ºC,
respectivamente, por 24 horas e depois disso o meio de cultura foi removido e as células
foram expostas as diferentes concentrações dos extratos. Os experimentos foram feitos em
triplicada e em cada poço foi adicionado 200 µL das diferentes concentrações dos extratos.
Células não tratadas foram utilizadas como controle e nesses poços foram adicionados 200 µL
de meio L-15 2%. Passado o período de incubação, os extratos foram removidos e 50 µL da
solução de MTT (1mg/mL) foram adicionados. As placas foram reincubadas por 4 horas e
após isso o MTT foi removido e foram adicionados 100 µL de DMSO, responsável por
solubilizar os cristais de formazan. As placas foram levemente homogeneizadas, por 10
minutos, para que os cristais fossem completamente dissolvidos e ao final, a leitura foi
realizada em espectrofotômetro a 540nm.
No método de exclusão do azul de Trypan a 0,4% (Invitrogen, New York, USA),
foram também utilizadas células Vero e C6/36 provenientes de frascos de 75cm2. As duas
linhagens celulares foram semeadas em placas de cultivos de 24 poços (Corning Incorporated,
Corning, New York, USA) com aproximadamente 1x104 células/poço e acondicionadas em
estufas. Após o período de 48 horas, as células foram carenciadas de SBF, onde o meio de
cada poço foi trocado pela solução trabalho (meio L-15 contendo 2% de SBF com cada um
dos dois extratos diluídos na concentração descrita anteriormente). A diluição dos extratos foi
preparada no momento do experimento. Após os períodos citados a cima, uma solução de
células com o corante azul de Trypan (diluição 1:1) foi preparada e em seguida uma pequena
alíquota desta, foi retirada para proceder à contagem das células na câmara de Neubauer.
Os experimentos foram realizados avaliando o efeito das concentrações dos extratos,
ou seja, realizando uma curva dose resposta.
3.12. Ensaio da atividade antiviral do extrato bruto da folha das plantas
Nesta etapa do experimento foram utilizadas placas de cultura celular de 24 poços
(Corning Incorporated, Corning, New York, USA) onde foram semeadas com células Vero
com aproximadamente 1 x104 células/poço e mantidas em estufa de CO2 (5%) a 37ºC. As
células foram cultivadas em meio de cultura L-15 modificado, suplementado com SBF (10%),
triptose fosfato (10%) e antibióticos (penicilina 100U/mL, estreptomicina 1mg/mL). Após 72
inoculado 100μl do vírus DENV-2 na proporção de MOI=1, seguido de incubação por 1h a
37ºC. Após este período de adsorção do vírus, foi retirado o inoculo viral e a monocamada foi
lavada 2 vezes com PBS pH7,4. O meio L-15 suplementado com SBF (2%), juntamente com
os extratos, foi adicionado nos seguintes tempos de três experimentos independentes e nas
mesmas condições: (i) 1h após infecção; (ii) em intervalos de 24 horas; (iii) em intervalos de
12 horas. Em seguida as células foram incubadas em estufa de CO2 (5%) a 37ºC por 7 dias.
Foram admitidas três condições: células Vero e C6/36 infectadas com DENV-2 e não tratadas
com os extratos; células Vero e C6/36 infectadas com DENV-2 e tratadas com os extratos
[Annona muricata (1mg/mL) e Spondias mombin (1mg/mL)] e células Vero e C6/36 não
infectadas e não tratadas com os extratos. As células infectadas e não infectadas sem a adição
dos extratos foram usadas como controles. Os sobrenadantes das culturas foram coletados em
duplicatas e clarificados por centrifugação em períodos de 24, 48, 72, 96, 120, 144 e 168
horas para a realização da qRT-PCR em tempo real e PFU. O experimento foi repetido três
vezes.
3.13. qRT-PCR em tempo real para quantificação da carga viral
Foi preparada uma curva padrão a partir da extração do RNA do estoque do DENV-2
proveniente do sobrenadante de cultura das células C6/36 previamente quantificado através do
ensaio de placa (PFU). As amostras de RNA do padrão juntamente com as do sobrenadante da
cultura celular infectada com o DENV-2 tratadas ou não com o extrato das plantas, foram
analisados através de reações de PCR em Tempo Real, utilizando o sistema QuantiFast SYBR
Green PCR (QIAGEN, USA) em um aparelho 7500 Fast Real-Time PCR System (Applied Biosystems). Nas reações foram utilizados 12,5μL do reagente 2x QuantiFast SYBR Green RT-PCR Master Mix, 0,25μL QuantiFast RT Mix, 0,5μL dos primers (20nM) DV2U (5'
-AAGGTGAGATGAAGCTGTAGTCTC-3') e DVL1
(5'-CATTCCATTTTCTGGCGTTCT-3') específicos para o vírus, que amplifica um fragmento de DNA localizado na região 3'
não-codificadora (HOUNG et al., 2011), 6,25μL água livre de RNase, e 5μL de RNA, totalizando um volume final de 25 μl. As condições de amplificação foram: 48°C por 30 minutos para a transcrição reversa, seguido de 95°C por 10 min, e 40 ciclos de 95°C por 15 segundos e 60°C