UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE PÓS-GRADUAÇÃO EM PATOLOGIA ORAL
MARCELO ANDERSON BARBOSA NASCIMENTO
AVALIAÇÃO IMUNO-HISTOQUÍMICA DA BMP-2, BMP-4 E SEUS RECEPTORES (BMPRIA E BMPRII) EM AMELOBLASTOMAS E TUMOR ODONTOGÊNICO
ADENOMATÓIDE
MARCELO ANDERSON BARBOSA NASCIMENTO
AVALIAÇÃO IMUNO-HISTOQUÍMICA DA BMP-2, BMP-4 E SEUS RECEPTORES BMPRIA E BMPRII EM AMELOBLASTOMAS E TUMOR ODONTOGÊNICO
ADENOMATÓIDE
Natal/RN 2014
Dissertação apresentada ao Programa de Pós-Graduação em Patologia Oral da Universidade Federal do Rio Grande
do Norte (UFRN), como parte dos requisitos para obtenção do grau de mestre em Patologia Oral.
Catalogação da Publicação na Fonte
Universidade Federal do Rio Grande do Norte - UFRN
Nascimento, Marcelo Anderson Barbosa.
Avaliação imuno-histoquímica da BMP-2, BMP-4 e seus receptores BMPRIA e BMPRII em ameloblastomas e tumor odontogênico
adenomatóide / Marcelo Anderson Barbosa Nascimento. - Natal, 2014. 108f: il.
Orientadora: Profª. Drª. Lélia Batista de Souza.
Dissertação (Mestrado em Patologia Oral) - Universidade Federal do Rio Grande do Norte. Centro de Ciências da Saúde. Programa de Pós-Graduação em Patologia Oral.
1. Ameloblastoma - Dissertação. 2. Tumor odontogênico
adenomatóide - Dissertação. 3. Proteínas morfogenéticas ósseas - Dissertação. 4. Imuno-histoquímica - Dissertação. I. Souza, Lélia Batista de. II. Título.
DEDICATÓRIA
Aos meus pais, Luiza e Marcelino, meus primeiros
mestres, toda gratidão e atos de amor não seriam suficientes
para retribuir a vida e a educação que me deram.
Aos meus professores, os de ontem, de hoje e os de
amanhã, que sempre me inspiraram a assumir a mesma
vocação, por dedicar amor, tempo e esforço de suas vidas na
construção e educação de novos homens e novos profissionais,
empenhando-se na construção de uma sociedade com mais
AGRADECIMENTOS
Sem dúvida alguma este trabalho é a construção de esforços conjuntos para o entendimento de uma pequena parte da ciência. Agradecer a companhia e o empenho de pessoas que contribuíram para esta realização é o mínimo.
À minha orientadora Profª. Drª. Lélia Batista de Souza, por me adotar como orientando, por seus preciosos ensinamentos como pessoa e pela transmissão do saber como professora. Obrigado por me impulsionar a querer buscar o conhecimento, por me fazer dar meus
próprios passos na caminhada científica, obrigado pelas “chamadas de atenção” que muito me educam e me fazem despertar para o quanto
preciso melhorar e me dedicar para honrar sua “filiação patológica”.
Aos professores: Prof. Dr. Leão Pereira Pinto por nos atentar para os mínimos detalhes. Profª. Drª. Roseana de Almeida Freitas por nos ensinar que a excelência pode ser alcançada com esforço e leveza. Profª Drª. Hébel Cavalcante Galvão e Prof. Dr. Antônio de Lisboa Lopes Costa que alegram nossos dias e nos distraem em meio a seriedade das pesquisas. Profª. Drª. Lelia Maria Guedes Queiroz pelas conversas descontraídas em meio aos dias de estudo. Profª. Drª. Márcia Cristina da Costa Miguel e Profª. Drª. Érika Janine Dantas da Silveira que exigem o nosso melhor, pois vocês dão o melhor para nosso crescimento. Profª. Drª. Ana Miryan Costa de Medeiros e Profª. Drª. Patrícia Texeira de Oliveira pela dedicação e confiança durante a clínica de estomatologia e pela amizade que excede o espaço acadêmico. Ao Prof. Dr. Cassiano Nonaka que diante de tantas responsabilidades, empenhou seu tempo na construção desta pesquisa. Prof. Dr. Manoel Antonio Gordon Nunez pelos ensinamentos e pelo exemplo de docente.
Ao meu colega de casa, de clínica, do dia-a-dia Tiago João pela
amizade, conversas, “dicas”, cumplicidade e confiança durante esses anos na “Patox”.
À Thaís e Thâmara, serei eternamente agradecido a Deus pela amizade gratuita e verdadeira de vocês.
À Maluzita Diniz, Luiz Juliasse, Andréia, Vivi, Luciana, Alice e Tamires, vocês foram a melhor companhia na busca por aprender, nos dias difíceis, nas conquistas e claro na cumplicidade.
À Gracinha, Hévio, Sandrinha, Lourdinha e Ricardo pelo empenho e pela dedicação para conosco.
À minha família e amigos que torcem pelo meu sucesso.
À Kleyber Câmara e Marcieudo que pacientemente assistiam e avaliavam meus seminários e aulas antes de todos.
À Universidade Federal do Rio Grande do Norte (UFRN).
RESUMO
As BMPs são componentes da superfamília de ligantes do fator transformador de crescimento-β (TGF-β), secretados no meio extracelular, com mecanismos de comunicação intercelular por meio de ligantes e receptores específicos em diversas células-alvo, sendo reconhecidas por sua influência na indução osteogênica, também desempenhando importante papel na homeostase tecidual, proliferação celular, no controle de diferenciação, além de estar presente no desenvolvimento de diversas neoplasias. O objetivo deste estudo foi comparar a expressão imuno-histoquímica da BMP-2, BMP-4 e seus receptores BMPRIA e BMPRII em casos de Ameloblastoma e Tumor odontogênico adenomatóide. A amostra foi constituída de 20 casos de Ameloblastoma sólido (AS), 10 casos de Ameloblastoma unicístico (AU) e 16 casos de Tumor odontogênico adenomatóide (TOA). A expressão das BMPs e seus receptores foi avaliada no parênquima e estroma das lesões, estabelecendo-se o percentual de células imunopositivas (0 – negativo; 1 - 1% a 10% das células positivas; 2 - 11% a 25% das células positivas; 3 - 26% a 50% das células positivas; 4 - 51% a 75% das células positivas; 5 - mais 75% de células positivas). A análise da expressão de BMP-2 não revelou diferenças estatisticamente significativas no componente parênquimatoso (p = 0,925) e estromal (p = 0,345) entre as lesões estudadas, assim como a BMP-4 (p = 0,873 / p = 0,131). No parênquima, o AS e TOA apresentaram maior frequência do escore 5. Por sua vez, todos os casos de AU foram classificados como escore 5. A análise do componente estromal revelou não haver diferença estatisticamente significativa entre os grupos em relação às medianas dos escores de positividade para BMPRIA (p = 0,768) e BMPRII (p = 0,779). No parênquima do AS e do AU, não foram observadas correlações estatisticamente significativas entre as imunoexpressões das proteínas analisadas. Por sua vez, no grupo dos TOAs, foram constatadas correlações positivas, estatisticamente significativas, entre os escores de expressão de todas as proteínas avaliadas. No componente estromal, foram constatadas correlações positivas, estatisticamente significativas, apenas no grupo do AS em BMP-4 e BMPRII (r = 0,476; p = 0,034) e do AU em BMP-4 e BMPRIA (r = 0,709; p = 0,022). Os resultados do presente estudo sugerem que as BMPs e seus receptores estão envolvidos no processo de desenvolvimento de tumores odontogênicos. A BMP-4, por sua vez, além de estar presente em tumores odontogênicos possui a capacidade de formação de material mineralizado.
ABSTRACT
BMPs are components superfamily ligands transformation growth fator-β (TGF-β) secreted into the extracellular environment, with mechanisms of intercellular communication through specific ligands and receptors in various target cells, being recognized for its influence in osteogenic induction, also play an important role in tissue homeostasis, cell proliferation, differentiation control , in addition to being present in the development of various malignancies. The aim of this study was to compare the immunohistochemical expression of BMP-2, BMP-4 and its receptors BMPRIA and BMPRII in cases of ameloblastoma and adenomatoid odontogenic tumor. The sample consisted of 20 cases of solid ameloblastoma (SA), 10 cases of ameloblastoma unicystic (UA) and 16 cases of adenomatoid odontogenic tumor (AOT). The expression of BMPs and their receptors was evaluated in the parenchyma and stroma of lesions, establishing the percentage of immunopositive cells (0 - negative; 1-1 % to 10 % of cells positive; 2 - 11% to 25% of positive cells; 3 - 26% to 50% of cells positive; 4 - 51% to 75 % of positive cells; 5 - more than 75% positive cells). Analysis of the expression of BMP-2 revealed no statistically significant differences in parenchymal (p = 0.925) and stromal component (p = 0.345) between the groups, as well as BMP-4 (p = 0.873 / p = 0.131). In the epithelial component, SA and AOT had a higher frequency of score 5. In turn, all cases of UA were classified as score 5. The analysis of the stromal component showed no statistically significant difference between groups with respect to median scores BMPRIA positivity (p = 0.768) and BMPRII (p = 0.779). In the epithelial component of SA and UA, no statistically significant correlations between imunoexpression proteins analyzed were observed. In turn, the group of AOT, statistically significant positive correlations between the scores of expression of all studied proteins were found. In the stromal component, statistically significant positive correlations were found only in the SA group in BMP -4 and BMPRII (r = 0.476; p = .034), in the UA in BMP-4 and BMPRIA (r = 0.709; p = 0.022). The results of this study suggest that the BMPs and their receptors are involved in the development process odontogenic tumors. BMP-4, in turn, besides being present in odontogenic tumors have the capacity to form mineralized material.
LISTA DE ILUSTRAÇÕES
Figura 01. Ligação de monômeros de BMP...14
Figura 02. Via de sinalização da proteína óssea morfogenética (BMP)...16
Figura 03. Expressão imuno-histoquímica de BMP-2 em Ameloblastoma sólido (ADVANCE- Panoramic Viewer-20x)...48
Figura 04. Expressão imuno-histoquímica de BMP-4 em Ameloblastoma sólido (ADVANCE- Panoramic Viewer-20x)...48
Figura 05. Expressão imuno-histoquímica de BMPRIA em Ameloblastoma sólido (ADVANCE- Panoramic Viewer-20x)...49 Figura 06. Expressão imuno-histoquímica de BMPRII em Ameloblastoma sólido (ADVANCE- Panoramic Viewer-20x)...49
Figura 07. Expressão imuno-histoquímica de BMP-2 em Ameloblastoma unicístico (ADVANCE- Panoramic Viewer-20x)...50
Figura 08. Expressão imuno-histoquímica de BMP-4 em Ameloblastoma unicístico (ADVANCE- Panoramic Viewer-20x)...50
Figura 09. Expressão imuno-histoquímica de BMPRIA em Ameloblastoma unicístico (ADVANCE- Panoramic Viewer-20x)...51
Figura 10. Expressão imuno-histoquímica de BMPRII em Ameloblastoma unicístico (ADVANCE- Panoramic Viewer-20x)...51 Figura 11. Expressão imuno-histoquímica de BMP-2 em Tumor odontogênico adenomatóide (ADVANCE- Panoramic Viewer-20x)...52
Figura 11. Expressão imuno-histoquímica de BMP-4 em Tumor odontogênico adenomatóide (ADVANCE- Panoramic Viewer-20x)...52
Figura 11. Expressão imuno-histoquímica de BMPRIA em Tumor odontogênico adenomatóide (ADVANCE- Panoramic Viewer-20x)...53
Figura 11. Expressão imuno-histoquímica de BMPRII em Tumor odontogênico adenomatóide (ADVANCE- Panoramic Viewer-20x)...53
Gráfico 02. Box-plot relativo aos escores de positividade para BMP-2 no componente conjuntivo de acordo com os grupos. Natal – RN, 2014...38
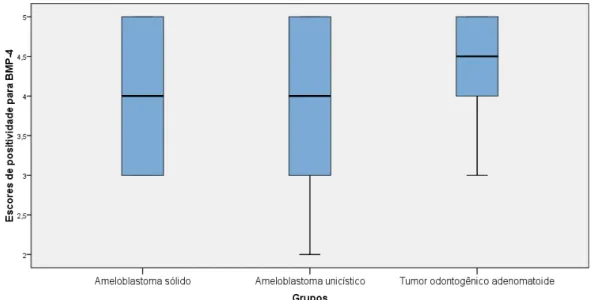
Gráfico 03. Box-plot relativo aos escores de positividade para BMP-4 no componente epitelial, de acordo com os grupos. Natal – RN, 2014...40
Gráfico 04. Box-plot relativo aos escores de positividade para BMP-4 no componente conjuntivo, de acordo com os grupos. Natal – RN, 2014...41
Gráfico 05. Box-plot relativo aos escores de positividade para BMPRIA no componente conjuntivo, de acordo com os grupos. Natal – RN, 2014...43
Gráfico 06. Box-plot relativo aos escores de positividade para BMPRII no componente conjuntivo, de acordo com os grupos. Natal – RN, 2014...45
LISTA DE TABELAS
Tabela 01. Distribuição absoluta e relativa dos casos acordo com os escores de positividade para BMP-2 no parênquima e no estroma das lesões odontogênicas estudadas. Natal – RN, 2014...37
Tabela 02. Tamanho da amostra, mediana, quartis 25 e 75, média dos postos, estatística KW e significância estatística (p) para os escores de positividade para BMP-2 em relação ao grupos de lesões odontogênicas estudadas. Natal – RN, 2014...37
Tabela 03. Distribuição absoluta e relativa dos casos acordo com os escores de positividade para BMP-4 no parênquima e no estroma das lesões odontogênicas estudadas. Natal – RN, 2014...39
Tabela 04. Tamanho da amostra, mediana, quartis 25 e 75, média dos postos, estatística KW e significância estatística (p) para os escores de positividade para BMP-4 em relação ao grupos de lesões odontogênicas estudadas. Natal – RN, 2014...40
Tabela 05. Distribuição absoluta e relativa dos casos acordo com os escores de positividade para BMPRIA no parênquima e no estroma das lesões odontogênicas estudadas. Natal – RN, 2014...42
Tabela 06. Tamanho da amostra, mediana, quartis 25 e 75, média dos postos, estatística KW e significância estatística (p) para os escores de positividade para BMPRIA em relação ao grupos de lesões odontogênicas estudadas. Natal – RN, 2014...42
Tabela 08. Tamanho da amostra, mediana, quartis 25 e 75, média dos postos, soma dos postos, estatística KW e significância estatística (p) para os escores de positividade para BMPRII em relação ao grupos de lesões odontogênicas estudadas. Natal – RN, 2014...44
Tabela 09. Tamanho da amostra, valor estatístico para o coeficiente de correlação de Spearman (r) e significância estatística (p) para os escores de positividade para BMP-2, BMP-4, BMPRIA e BMPRII no componente epitelial, de acordo com os grupos. Natal, RN – 2014...46
LISTA DE SIGLAS
ActR-II Do inglês type II activin receptor Acvr2a, traduzido como receptor activina tipo II.
ActR-IIB Do inglês type II activin receptor Acvr2b, traduzido como receptor activina tipo IIB.
AD Abreviatura para ameloblastoma desmoplásico.
ALK Do inglês activin like kinase, traduzido como activina como quinase.
AP Abreviatura para ameloblastoma periférico.
ASF Abreviatura para ameloblastoma sólido folicular.
AU Abreviatura para ameloblastoma unicístico.
BAMBI Do inglês Bmp and activin receptor membrane bound inhibitor, traduzido como inibidor de ligação membranar para BMP e activina.
BMP Do inglês bone morphogenetic protein, traduzido como proteína óssea morfogenética.
BMP-2 Do inglês bone morphogenetic protein-2, traduzido como proteína óssea morfogenética tipo 2.
BMP-4 Do inglês bone morphogenetic protein-4, traduzido como proteína óssea morfogenética tipo 4.
BMPRIA Do inglês type Ia Bmp receptor, traduzido como receptor de BMP tipo 1A.
BMPRII Do inglês type II Bmp receptor, traduzido como receptor de BMP tipo 2.
CCE Abreviatura para carcinoma de células escamosas.
CDMP Do inglês cartilage-derived morphogenetic protein, traduzido como proteínas morfogenéticas derivadas de cartilagem
Co-Smad Do inglês common-mediator Smad, traduzido como Smads mediadores comuns.
CNS Sigla do Conselho Nacional de Saúde.
COCC Abreviatura para carcinoma odontogênico de células claras.
Cys-103 Do inglês Cysteine-103, traduzido como cisteína 103.
DNA Do inglês Deoxyribonucleic acid, traduzido como ácido desoxirribonucleico.
ERK-1/2 Do inglês Extracellular-signal-regulated kinases, traduzido como quinase regulada pela sinalização extracelular.
FGF Do inglês Fibroblast growth factors, traduzido como fator de crescimento de fibroblasto.
GDF Do inglês Growth and Differentiation Factor, traduzido como fator de diferenciação e crescimento.
Hox Abreviatura para Homeobox.
Hox-C8 Do inglês Homeobox protein Hox-C8, traduzido como proteína homeobox C8.
I-Smad Do inglês Inhibitory-Smad, traduzido como Smad inibitória.
ID1 Do inglês inhibitor of DNA binding 1, traduzido como inibidor de ligação de DNA 1.
Mad Drosofila mãe do encontro decapentaplégico
OP Do inglês osteogenic protein, traduzido como proteínas osteogênicas.
PAX9 Do inglês Paired box gene 9, traduzido como caixa pareado 9.
Pebp2 Do inglês polyomavirus enhancer binding protein 2, traduzido como proteína 2 de aumento de ligação poliomavirus.
PDP Do inglês pyruvate dehydrogenase phosphatase, traduzido como desidrogenase piruvato fosfatase.
R-Smad Do inglês regulatory Smad, traduzido como Smad regulatória.
RNA Do inglês ribonucleic acid, traduzido como ácido ribonucleico.
Ror2 Do inglês receptor tyrosine kinase-like orphan receptor 2, traduzido como receptor órfão 2 semelhante ao receptor de tirosina quinase.
RT-PCR Do inglês polymerase chain reaction in real time, traduzido como reação em cadeia da polimerase em tempo real.
Runx Do inglês runt-related transcription fator, traduzido como Fator de Transcrição Relacionado à Runt.
SHH Do inglês Sonic hedgehog, sem tradução para o português.
Smad Do inglês Sma and Mad related proteins, traduzido como proteínas relacionadas à Sma e Mad.
Smurf Do inglês Smad ubiquitin regulatory factors, traduzido como fatores regulatórios de ubiquitinação de Smad.
TβR-II Do inglês TGF-β receptors, traduzido como receptor de TGF-β.
TGF-β Do inglês transforming growth factor beta, traduzido como fator transformador de crescimento beta.
TO Abreviatura para tumores odontogênicos
TOA Abreviatura para tumor odontogênico adenomatóide
USAG1 Do inglês uterine sensitization-associated gene-1, traduzido como gene 1 associado à sensibilização uterina.
SUMÁRIO DEDICATÓRIA
AGRADECIMENTOS RESUMO
ABSTRACT
LISTA DE ILUSTRAÇÕES LISTA DE TABELAS LISTA DE SIGLAS
1. INTRODUÇÃO...1 2. REVISÃO DE LITERATURA ... ...4
2.1 AMELOBLASTOMA ... 5 2.2 TUMOR ODONTOGÊNICO ADENOMATÓIDE ... 10 2.3 PROTEÍNAS ÓSSEAS MORFOGENÉTICAS ... 13 2.3.1 Função e Estrutura... 13 2.3.2 Receptores ... 15 2.3.3 Mediadores intracelulares ... 17 2.3.4 Mecanismos de regulação das BMPs ... 18 2.3.5 BMPs no desenvolvimento dentário ... 20 2.3.6 BMP no desenvolvimento de tumores. ... 22 3. PROPOSIÇÃO ... 25 4. MATERIAL E MÉTODOS ... 27
4.7.2 Análise do perfil imuno-histoquímico ... 31 4.8 ANÁLISE ESTATÍSTICA ... 32 5. RESULTADOS ... 33
1. INTRODUÇÃO
Dentre os tumores que acometem os maxilares, os tumores odontogênicos possuem uma prevalência considerável. Originariamente, estes tumores provêm de tecidos dentários por proliferação de tecido epitelial e/ou mesenquimal, sendo neoplasias que se desenvolvem exclusivamente nos ossos gnáticos. Biologicamente, estas lesões podem ter naturezas distintas, sendo caracterizadas como alterações no desenvolvimento tecidual (hamartomas), tumores benignos não agressivos ou agressivos e tumores malignos (AVELAR et al., 2008; HENRIQUES et al., 2009; RODRIGUES et al., 2009).
Ao longo de décadas, várias classificações surgiram com o propósito de tipificar os tumores odontogênicos, determinar sua natureza e comportamento biológico. Porém, os padrões e comportamento biológico destas lesões são bastante variados e, em alguns casos, sua patogênese ainda é desconhecida. Os tumores que se originam do epitélio odontogênico apresentam consideráveis variações quanto sua apresentação histopatológica, comportamento biológico, agressividade, fatores determinantes para a classificação (AVELAR et al., 2008; HENRIQUES et al., 2009; NEVILLE et al., 2009).
Estudos baseados na análise imuno-histoquímica e genética destes tumores têm contribuído para sua classificação, permitindo identificar alterações genéticas, moleculares e celulares nestes casos, na tentativa de esclarecer sua patogênese e progressão (HENRIQUES et al., 2009). Diante disso, a Organização Mundial de Saúde (OMS) publicou no ano de 2005 a atual classificação histopatológica dos tumores odontogênicos, onde o Ameloblastoma e o Tumor Odontogênico Adenomatóide foram classificados como tumores originados do epitélio odontogênico com estroma fibroso maduro sem ectomesênquima odontogênico (BARNES et al., 2005).
comportamento clínico e biológico indolente (SILVA et al., 2004), representando de 2% a 7% dos tumores odontogênicos (BARNES et al., 2005; NEVILLE et al., 2009).
Diversas moléculas, denominadas fatores de crescimento, participam da comunicação celular durante o desenvolvimento dentário; dentre estas destaca-se a Proteína Óssea Morfogenética (bone morphogenetic protein – BMP) pertencente à família TGF-β (SOARES, 2008). Esta proteína é de grande valia para o estudo de lesões de natureza odontogênica (AVELAR et al., 2008), pois possui um importante papel na formação de tecidos dentários calcificados evidenciados em tumores odontogênicos como por exemplo o TOA e o Tumor Odontogênico Epitelial Calcificante (GAO; YANG; YAMAGUCHI, 1997). Além disso, esta mesma proteína pode estar envolvida também no desenvolvimento de outros tumores, por já ter sido evidenciada sua presença na angiogênese em tumores no pulmão (LANGENFELD; LANGENFELD, 2004).
2. REVISÃO DE LITERATURA
2.1 AMELOBLASTOMA
O Ameloblastoma é o tumor de epitélio odontogênico benigno que pode originar-se a partir de restos da lâmina dentária, órgão do esmalte em desenvolvimento, revestimento epitelial de um cisto odontogênico ou de células basais da mucosa oral (NEVILLE et al., 2009).
A Organização Mundial da Saúde (OMS) afirma que a etiologia deste tumor odontogênico (TO) é desconhecida, porém uma desregulação de genes durante o desenvolvimento dentário pode desempenhar um papel importante na sua histogênese (BARNES et al., 2005). DeVillers et al. (2011) afirmam que genes e proteínas, como SHH e Wnt, que estão envolvidos na odontogênese, apresentam-se altamente expressos em Ameloblastomas.
Avelar et al. (2008) avaliaram 238 casos de tumores odontogênicos em um estudo clínico-patológico no período de 1997 a 2007 e constataram que o Tumor odontogênico ceratocístico é o que apresenta maior prevalência seguido pelo Ameloblastoma. Costa et al. (2012) em estudo retrospectivo de TOs em quatro centros de diagnóstico patológico brasileiros, verificaram que o Tumor odontogênico adenomatóide foi o mais prevalente na pesquisa (32,3%), seguido pelo Ameloblastoma como mais frequente (29,8%).
O ameloblastoma representa um dos tumores odontogênicos mais frequentes e compreende de 10 a 50% dos tumores odontogênicos. Mesmo apresentando características biológicas de benignidade, como crescimento lento, localmente invasivo, com altas taxas de recidiva após o tratamento (KRUSCHEWSKY et al., 2010).
Clinicamente, o Ameloblastoma pode apresentar-se como uma tumefação extra-oral, com notável assimetria facial. Em exame intra-oral mostra-se como um aumento de volume, não ulcerado, assintomático, podendo causar deslocamento dentário e, consequentemente, alteração na oclusão. A maioria dos casos ocorre em mandíbula, numa proporção que pode chegar a 4:1 em relação à maxila em alguns estudos. Quando ocorre em maxila apresenta comportamento mais agressivo (JING et al., 2007; KRUSCHEWSKY et al., 2010).
Ameloblastoma central pode apresentar-se nas variantes sólido multicístico, unicístico e desmoplásico, considerando-se que os tumores de apresentação multicística são mais invasivos e tendem a recidivar com maior frequência (FULCO et al., 2010; KRUSCHEWSKY et al., 2010).
O Ameloblastoma sólido, também chamado de convencional ou multicístico, é a variante intraóssea mais comum de Ameloblastoma, ocorrendo mais em indivíduos entre a terceira e sexta décadas de vida, raramente em crianças com menos de 10 anos de idade, sem predileção por gênero. Alguns estudos mostram uma leve predileção pelo gênero feminino. A região posterior de mandíbula é a localização mais acometida com proporção de 17,4:1 em relação à maxila. Diferenças estatísticas na distribuição deste tumor em relação a etnia e localização geográfica podem ser vistas em diversos estudos (FULCO et al., 2010; BLACK; ADDANTE; MOHILA, 2010; SIAR; LAU; NG, 2012).
Ameloblastomas sólidos de diâmetros maiores apresentam-se clinicamente como aumento de volume tumoral, assintomático e, raros casos, relatam parestesia. O processo de diagnóstico se dá inicialmente por meio da avaliação radiográfica de rotina, principalmente em lesões menores, onde não há expansão óssea (BARNES et al., 2005).
Radiograficamente, exibe aspecto multilocular, com loculações de formas e tamanhos variáveis, descrito na literatura semelhante a “bolhas de sabão” ou “favos de mel”. Observa-se esclerose óssea e cortical irregular, com margens festonadas, geralmente bem definidas. Perda da lâmina dura, reabsorção radicular e deslocamento dentário podem ser observados (SILVA et al., 2004; ROCHA, 2008). Em muitos casos o Ameloblastoma pode estar associado a dentes impactados, frequentemente o terceiro molar (STATHOPOULOS et al., 2011).
A avaliação por meio de tomografia computadorizada mostra que o termo multicístico pode ser erroneamente utilizado, pois os espaços observados em radiografias convencionais podem representar, na verdade, depressões causadas por reabsorção na cortical, dando a aparência de espaços císticos. Além disso, os defeitos multiloculares podem estar presentes em diversas lesões odontogênicas (Tumor odontogênico ceratocístico, Tumor odontogênico epitelial calcificante e Mixoma) e não odontogênicas (Carcinoma mucoepidermóide intraósseo e Displasia fibrosa) (BARNES et al., 2005; BLACK; ADDANTE; MOHILA, 2010).
adjacentes, o que pode requerer um tratamento radical (BLACK; ADDANTE; MOHILA, 2010).
O Ameloblastoma sólido pode apresentar diversos padrões histológicos, sendo os padrões folicular e plexiforme os mais frequentes. Outros padrões que podem ser observados são o acantomatoso, de células basais e de células granulares. (BARNES et al., 2005). Pereira et al. (2010), ao estudarem 70 casos de Ameloblastomas, observaram que este tumor acometeu indivíduos entre a 3ª e 4ª décadas de vida, sem predileção por gênero, com região posterior de mandíbula como o sítio mais comum, na proporção de 18,6:1 em relação a maxila. Vinte e dois casos foram classificados como Ameloblastoma sólido; destes, 14 organizavam-se histopatologicamente como o padrão folicular (63,6%), três como plexiforme (15%) e em cinco casos havia associação dos dois padrões (22,7%).
Comumente, o Ameloblastoma folicular e plexiforme são os padrões do tipo sólido que ocorrem com maior frequência. Os demais padrões são também observados, podendo haver associação de padrões histológicos em um mesmo tumor, porém esses diferentes padrões de Ameloblastomas sólidos não apresentam relevância clínica (SILVA et al., 2004; MARTINS et al., 2007).
O padrão folicular é caracterizado por ilhas de epitélio, com células da camada basal alongadas ou colunares, porém em algumas áreas podem exibir morfologia cuboidal, com núcleo hipercromático, com polaridade invertida e voltado para o interior das ilhas e ninhos de epitélio odontogênico neoplásica. As células centrais assemelham-se ao retículo estrelado primitivo; degeneração cística é comum no interior das ilhas (SILVA et al., 2004; NEVILLE et al., 2009).
O padrão plexiforme organiza-se em cordões de epitélio odontogênico neoplásico que se anastomosam. As células dispostas na periferia dos cordões são semelhantes a ameloblastos e as porção interna dos cordões e ilhas organizam-se frouxamente, semelhante ao retículo estrelado, este padrão exibe menor frequência que o padrão folicular (SILVA et al., 2004; BARNES et al., 2005; BLACK; ADDANTE; MOHILA, 2010).
são delimitadas por células epiteliais semelhantes a ameloblastos com núcleo com polaridade invertida. O estroma circundante é do tipo colagenoso maduro (LAPTHANASUPKUL; POOMSAWAT; CHINDASOMBATJAROEN, 2012; BANSAL; BHATNAGAR; SAXENA, 2012).
Dentre os vários padrões histopatológicos, o Ameloblastoma de células basais é o mais raro. Neste tipo de tumor as células proliferam em ninhos ou faixas estreitas, as células centrais exibem um padrão cubóide ou basalóide, com ausência de células colunares ou semelhantes ao retículo estrelado. A presença de degeneração cística pode ser observada (GIL et al., 2005).
Adebiyi et al. (2006) analisaram 77 casos de Ameloblastomas em um período de 15 anos e ao classificarem os casos de acordo com os diferentes padrões histopatológicos, o Ameloblastoma folicular foi o tipo mais comum (64,9%), seguido pelo plexiforme (13%). O Ameloblastoma acantomatoso foi representado por 3 casos (3,9%) e o de células basais somente por 2 casos (2,6%), 7 casos (9,1%) possuíam mais de um tipo de padrão histopatológico. O ameloblastoma desmoplásico, considerado atualmente como uma variante histológica distinta representou 5,2% neste estudo.
Outra apresentação radiográfica deste tumor odontogênico é o Ameloblastoma unicístico (AU), que representa 5% a 15% de todos os Ameloblastomas, ocorrendo em pacientes jovens, entre a 2ª e 3ª décadas de vida, com uma média de idade de 22 anos. Frequentemente, ocorre em região posterior de mandíbula e pode estar associado a um 3º molar incluso. Clinicamente, é assintomático mas, em alguns casos, pode haver aumento de volume dos ossos gnáticos. Radiograficamente, apresenta-se como uma lesão radiolúcida unilocular circunscrita, podendo exibir margens festonadas; no caso onde há associação com dente incluso é comumente confundido com Cisto Dentígero (BARNES et al., 2005; BLACK; ADDANTE; MOHILA, 2010; PEREIRA et al., 2010; COSTA et al., 2012; SIAR; LAU; NG, 2012).
As células epiteliais da camada basal são colunares com núcleo exibindo polaridade invertida e hipercromáticos e as células das camadas voltadas para o interior da cavidade exibem uma morfologia cuboidal ou semelhantes ao retículo estrelado. Em áreas onde há inflamação secundária, pode haver descamação ou descontinuidade epitelial, o que pode confundir os patologistas, sendo necessário cortes histológicos adicionais onde não ocorram tais alterações para que se evite termos e diagnósticos errôneos (BLACK; ADDANTE; MOHILA, 2010; GUPTA et al., 2012).
O AU luminal é usualmente tratado com enucleação e segue-se com o acompanhamento do paciente, com baixas taxas de recidiva (MARTINS et al., 2007). Porém, Lau e Samman (2006) observaram em seu estudo taxa de recidiva de 30,5% em relação a recorrência do AU luminal, sendo necessário a associação com outras terapêuticas, sugerindo que esta lesão pode ser considerada invasiva. O AU mural é tratado com ressecção cirúrgica, com margem de segurança de 1 a 2 cm (KRUSCHEWSKY et al., 2010).
Por apresentar características clínicas, radiográficas e histopatológicas distintas dos demais padrões de Ameloblastomas, a OMS em sua última classificação dos tumores odontogênicos, considerou o Ameloblastoma Desmoplásico (AD) como uma variante distinta e não mais um subtipo de Ameloblastoma sólido multicístico. Clinicamente o AD não difere dos demais padrões com relação a distribuição, faixa etária de acometimento e predileção por gênero. O sítio de localização mais comum é a região anterior de maxila e mandíbula (BARNES et al., 2005). Histopatologicamente, é caracterizado por uma desmoplasia, ou seja, por um abundante tecido conjuntivo fibroso densamente colagenizado, com cordões de epitélio odontogênico neoplásico de diferentes tamanhos e formas, com células periféricas cuboidais e a região central dos cordões é hipercelularizada com células fusiformes ou poligonais, organizam-se semelhante ao retículo estrelado e raramente exibe metaplasia escamosa, áreas focais de AD podem ser observadas em Ameloblastomas sólidos (SANTOS et al., 2006; FULCO et al., 2010; SHEIKH et al., 2011). Radiograficamente, apresenta-se como uma lesão unilocular ou multilocular, com margens difusas, áreas radiolúcida e radiopacas semelhantes às lesões fibro-ósseas, reabsorção radicular e formação de material mineralizado podem ser observados (BLACK; ADDANTE; MOHILA, 2010).
gênero feminino, ocorrendo duas vezes mais em mandíbula do que em maxila (BEENA et al., 2012; KATO et al., 2012).
Clinicamente, apresenta-se como uma lesão nodular de crescimento exofítico, assintomática, de superfície lisa, granular, verrucosa ou papilar; podendo ser confundida clinicamente com um Fibroma ou Granuloma Piogênico. Na maioria dos casos não ocorre envolvimento ósseo, porém, radiograficamente pode exibir pequeno grau de radiolucidez devido uma erosão óssea superficial (BARNES et al., 2005).
As características histopatológicas dos diversos padrões de Ameloblastoma estão presentes no Ameloblastoma periférico, com ilhas, ninhos ou cordões de epitélio ameloblástico. Há uma discussão sobre a origem do AP, considerando que este surge de restos da lâmina dentária ou de células basais do epitélio de revestimento oral, que acredita-se ter potencial odontogênico (KATO et al., 2012). Devido ao crescimento expansivo dos ninhos pode haver fusão das células tumorais com as do epitélio de revestimento oral. A continuidade entre os ninhos e ilhas de epitélio ameloblástico e o epitélio de mucosa oral ocorre em 50% dos casos, sugerindo a origem do tumor como sendo das células da camada basal do epitélio oral. (TJIOE; DAMANTE; OLIVEIRA, 2012). A ressecção cirúrgica e o acompanhamento é o tratamento de escolha e o índice de recidiva é baixo (KRUSCHEWSKY et al., 2010).
A contraparte maligna do Ameloblastoma é rara e diversos autores a descrevem como Ameloblastoma maligno, que prolifera-se como uma transformação maligna espontânea, mesmo não precedida por um Ameloblastoma benigno, apresentando metástase frequentemente em pulmões, podendo exibir características histopatológicas de benignidade. Porém, quando ocorre uma transformação maligna de um Ameloblastoma benigno, este é descrito como Carcinoma ameloblástico, com características histológicas de malignidade, apresentando ou não metástase (SILVA et al., 2004; HORVÁTH; HORVÁTH; POPŞOR, 2012).
2.2 TUMOR ODONTOGÊNICO ADENOMATÓIDE
seu comportamento biológico, este tumor foi considerado como uma entidade distinta do Ameloblastoma. O termo TOA foi sugerido por Stafne em 1948 e posteriormente adotado pela OMS em sua primeira classificação dos tumores odontogênico (HARNET et al., 2013)
O TOA é um tumor benigno de crescimento lento, com origem do aparato odontogênico com histogênese bastante discutida. Acredita-se que origina-se do epitélio do órgão do esmalte; outras hipóteses sugerem origem do epitélio de revestimento de um cisto dentígero, restos epiteliais de Malassez de dente decíduo ou permanente ou ainda de remanescentes da lâmina dentária (JIVAN et al., 2007; IDE et al., 2011).
Marx et al. (2003) afirmaram que 2/3 dos casos de TOA ocorrem em maxila, 2/3 dos casos afetam pacientes do gênero feminino, 2/3 dos casos estão associados com um dente não irrompido e 2/3 dos dentes que estão associados ao TOA é o canino.
Grande parte dos TOAs são lesões pequenas e assintomáticas, sendo diagnosticadas por meio de radiografias de rotina ou devido a investigações para dentes que tardam em erupcionar. Porém, lesões maiores ocasionalmente ocorrem, e assimetria facial pode ser notada. O exame intra-oral evidencia um aumento de volume firme a palpação (GARG et al., 2009).
O TOA ocorre mais frequentemente no interior dos maxilares, sendo considerado folicular ou pericoronário quando está associado a um dente não erupcionado; extra-folicular ou extra-coronário quando não associa-se a um dente. Poucos casos apresentam-se extra ósseos ou periféricos (PHILIPSEN et al., 2007).
Friedrich; Scheuer; Zustin, (2009) subclassificam o tipo extra-folicular em: E1 quando
não há associação do tumor com o dente; E2, quando está localizado interradicular, podendo causar afastamento divergente das raízes devido ao crescimento tumoral expansivo; E3, quando há superposição com ápice radicular e E4 quando está superposto no terço médio de raízes dentárias.
Philipsen et al. (2007) analisaram 1082 casos de TOAs e distribuíram os casos em três variantes clínicas, sendo a mais frequente a variante pericoronária, representando 70,8% dos casos, seguido pelas variantes extra-coronária (26,9%) e a periférica (2,3%).
envolvimento com a coroa de um dente não erupcionado. Em muitos casos de TOA, a imagem radiográfica estende-se além da junção amelocementária em direção apical (IDE et al., 2011). Invariavelmente, o TOA apresenta-se como uma lesão radiolúcida bem circunscrita, com focos de radiopacidade, que o difere de outras lesões fibro-ósseas ou associadas a coroa de um dente (GARG et al., 2009).
Histopatologicamente, o TOA é composto por um parênquima altamente celular e escasso estroma, delimitado por uma cápsula de tecido conjuntivo fibroso. As células tumorais estão arranjadas em ninhos, cordões ou lençóis; por vezes as células tumorais formam estruturas espiraladas semelhantes a rosetas, ou ainda estruturas semelhantes a ductos, que podem estar vazios em sua porção central ou podem exibir material amorfo eosinofílico ou debris no interior destas estruturas. Este material amorfo pode se apresentar em quantidade variável e são chamados de “gotas eosinofílicas” (SEMPERE et al., 2006; HARNET et al., 2013).
O TOA exibe um padrão celular diverso, áreas com nódulos constituídos de células poliédricas, eosinofílicas de aparência escamosa com limites celulares distintos e pontes intercelulares proeminentes (BARNES et al., 2005). As células do epitélio odontogênico apresentam morfologia fusiforme, cuboidal ou colunar. As células de revestimento das estruturas semelhantes a ductos são colunares com núcleos polarizados contrariamente ao espaço central, este espaço é formado pela atividade secretora das células que o revestem, estas estruturas semelhantes a ductos denominam o TOA, porém em alguns casos podem não estar presentes (BARNES et al., 2005; NEVILLE et al., 2009).
Comumente pode ser observada presença de material hialino, displásico ou osteodentina calcificada, que em alguns casos podem apresentar túbulos dentinários. Estas estruturas são interpretadas como uma formação de dentina abortiva, resultado de um processo metaplásico e não deve ser interpretado como um fenômeno de indução pois o ectomesênquima não se faz presente. Este achado é o que confere os diversos graus de radiopacidade desta lesão. Áreas focais podem organizar-se semelhantes a outros tumores odontogênicos, como por exemplo, o Tumor odontogênico epitelial calcificante, principalmente nos casos onde há a formação de material amilóide eosinofílico (SEMPERE et al., 2006).
O conhecimento das características clínicas, radiográficas, histopatológicas são significantes para a determinação do tratamento a ser realizado. Com o avanço de técnicas, a identificação de alterações proteicas e genéticas em tumores odontogênicos torna-se fundamental para a compreensão do comportamento biológico destas lesões e para o desenvolvimento de tratamentos eficazes (PREMALATHA et al., 2013).
2.3 PROTEÍNAS ÓSSEAS MORFOGENÉTICAS (BMP)
2.3.1 Função e Estrutura
Os primeiros estudos sobre a Proteína Óssea Morfogenética (BMP) advêm de 1960, pela observação da capacidade de formação óssea intramuscular e subcutânea em roedores, após o uso de matriz óssea desmineralizada (GRANJEIRO et al., 2005). Destaca-se o estudo de Urist, em 1965, que implantou osso desvitalizado em defeitos ósseos em animais e humanos e observou a neoformação óssea após algumas semanas. Sabendo da importância da aplicabilidade clínica desta descoberta, diversos estudos foram realizados para identificar especificamente qual substância seria responsável pela formação óssea (SOARES, 2008; DIMITRIOU; TSIRIDIS; GIANNOUDIS, 2005).
As BMPs são componentes da superfamília de ligantes do fator transformador de crescimento-β (TGF-β), secretados no meio extracelular, com mecanismos de comunicação intercelular por meio de ligantes e receptores específicos em diversas células alvo como células mesenquimais, epiteliais, neurais e monócitos (CALVO et al., 2009; SOARES, 2008).
Dentre as diversas funções do TGF-β estão a capacidade de promover o reparo de tecidos após a diminuição da inflamação e de reações imunológicas, estimular a síntese de colágeno, induzir macrófagos e fibroblastos a produzirem enzimas modificadoras de matrizes e promover a angiogênese (ABBAS; LICHTMAN; PILLAI, 2011).
Os membros da família TGF-β são caracterizados pela presença de sete cisteínas conservadas na dobragem terciária e quaternária, porém as BMPs diferenciam-se desta superfamília por possuírem uma estrutura principal 40 a 50% semelhante à do TGF-β assim como alguns segmentos alinhados de sequências comuns e exibem duas cisteínas conservadas extras. Além da família de ligantes relacionados às BMPs, que representam fatores de diferenciação de crescimento (GDFs), outros ligantes estão inclusos nesta superfamília como as ativinas, inibinas, homônio anti-mülleriano e nodal. (GRANJEIRO et al., 2005; CALVO et al., 2009).
As BMPs consistem de dímeros cujas cadeias de monômeros estão unidas por ligações dissulfeto. Cada monômero é constituído de três ligações dissulfeto que configuram sua estrutura e unem grupamentos de cisteína que caracterizam o monômero e variam em cada BMP. Possuem uma α-hélice localizada perpendicularmente oposta às quatro lâminas-β anti -paralelas que se conformam em duas projeções semelhantes a dedos. BMPs são proteínas compostas por um peptídeo sinalizador, um pré-domínio e um domínio maduro. Após a secreção e eliminação do peptídeo sinalizador, esses monômeros ou pré-proteínas, sofrem dimerização e são clivadas por enzimas proteolíticas específicas para gerar o ligante maduro ativo (GRANJEIRO et al., 2005; CALVO et al., 2009).
Após a dimerização (Figura 01), observa-se uma única ligação dissulfeto intermolecular, ligando Cys-103 da lâmina-β5, de cada monômero. Esta dimerização é um pré-requisito para que estas proteínas se apresentem em sua forma ativa, tanto como moléculas homodímericas (duas cadeias idênticas) e heterodímericas (duas cadeias diferentes) (GRIFFITH et al., 1996; CALVO et al., 2009).
Fonte: Mueller e Neckel, 2012.
Entre os diversos ligantes que compõem esta subfamília destacam-se a BMP2, BMP3, BMP4, BMP5, BMP6, BMP7, BMP8a, BMP8b, BMP9, BMP10, BMP11, BMP12, BMP13, BMP14 e BMP15. Deve-se enfatizar que a BMP1, apesar de ser chamada de BMP, não deve se relacionada como BMP, pois na verdade esta é uma proteinase que age na clivagem de fibrilas pró-colágeno e chordin, ou seja, apresentando ação antagonista (CALVO et al., 2009).
Inicialmente, a BMP foi relacionada apenas à formação de cartilagem e osso porém, sabe-se que estas proteínas estão envolvidas em diversos processos biológicos, como proliferação, diferenciação, quimiotaxia e apoptose durante processos de desenvolvimento, e/ou patológicos devido à presença de BMPs ou seus receptores em diversos neoplasmas, levando-se a crer que estas proteínas participam também do desenvolvimento e progressão de tumores (KUMAMOTO; OOYA, 2006).
Além disso, estão envolvidas na formação de diversos órgãos como rins, olhos, cérebro, fígado, pulmões, dentes, pele e anexos cutâneos (MIYAZONO; KUSANAGI; INOUE, 2001; SOARES, 2008). Esta subfamília é reconhecida por sua influência na indução osteogênica. Porém, estas também desempenham um importante papel na homeostase tecidual, proliferação celular e no controle de diferenciação (CALVO et al., 2009).
2.3.2 Receptores
Assim como na superfamília TGF-β, a transdução de sinais das BMPs é realizada pela ligação de um dímero ativo a dois tipos diferentes de receptores transmembranares (BMPRs) que são quinases tipo treonina/serina, que de acordo com sua homologia de sequências e propriedades funcionais, podem ser classificados como receptor tipo I e tipo II (GRANJEIRO et al., 2005).
intracelular de quinase tipo treonina/serina carboxi-terminal (CALVO et al., 2009; HARTH, 2010). De acordo com Hsu et al. (2005), somente três receptores tipo I possuem interações com BMPs (ALK-2, ALK-3 e ALK-6), assim como apenas três receptores tipo II (BMPRII, ActR-II e ActR-ActR-IIB).
O domínio extracelular destes receptores é responsável pela ligação com as diversas BPMs de acordo com sua especificidade. Os receptores tipo II estão presentes constitutivamente ativos e facilmente se ligam a proteínas do meio extracelular e possuem baixa afinidade para proteínas intracelulares, somente estes não são capazes de iniciar a transdução de sinais, sendo necessária formação de um complexo com o receptor tipo I de alta afinidade. Este processo de recrutamento do segundo receptor é chamado de oligomerização (NOHE et al., 2002;SIMIC; VUKICEVIC, 2007; SOARES, 2008; HARTH, 2010).
Calvo et al. (2009) afirmam que moléculas de BMPs heterodiméricas possuem um poder de ação potente, quando comparados com moléculas homodiméricas. Quanto aos heterodímeros de BMPs, Harth (2010) sugere que dois receptores tipo I e dois receptores tipo II podem ser teoricamente requeridos para ligarem-se as distintas interfaces de um ligante heterodimérico.
Após a formação deste complexo BMP - receptor II – receptor I, o receptor tipo II torna-se responsável pela fosforilação do domínio Gly-Ser (GS) no receptor tipo I, ativando as quinases deste último receptor, que por sua vez ativa e determina o modo de sinalização pela fosforilação de componentes intracelulares chamados Smads (Figura 02) (MIYAZONO; MAEDA; IMAMURA, 2005; HSU et al., 2005; CALVO et al., 2009).
Fonte: Simic e Vukicevic, 2007.
2.3.3 Mediadores intracelulares
Smads são uma família de mediadores de sinalização de receptores de BMP em vertebrados homólogo de Mad (Drosofila mãe do encontro decapentaplégico) e Sma (relacionada com a Mad em C. elegans). As proteínas Smads são responsáveis, nos mamíferos, pela transmissão e modulação da transdução de sinais da membrana plasmática ao núcleo, tanto pela ativação de BMPs como de outros ligantes da família TGF-β. Atualmente são reconhecidas oito diferentes Smads, que são classificadas em três grupos de acordo com sua função (GRANJEIRO et al., 2005):
O primeiro grupo são Smads receptor-regulado (R-Smads) que interagem diretamente com os receptores transmembranares, sendo a responsável direta pela transdução de sinais. O tipo de R-Smads que se ligará ao receptor depende do tipo de ligante que iniciou o processo de ativação. Smad1, Smad5 e Smad8 são os transdutores de sinal específicos para ligantes BMPs e GDFs, porém observa-se que em células endoteliais o TGF-β possui a capacidade de ativar estes mesmos ligantes por meio de um receptor tecidual específico tipo I chamado ALK-1 (CALVO et al., 2009).
O segundo grupo compreende a Smad4 que são Smads mediadores comuns (Co-Smads) e facilitam a realização das funções das R-Smads e com estas formam um complexo que é translocado para o núcleo para ativar ou regular a transcrição de genes-alvo, de acordo com o co-modulador transcricional requerido (HSU et al., 2005; HARTH, 2010). Este complexo pode ser constituído de uma R-Smad ligada a uma Co-Smad, assim como de duas R-Smads ativadas a uma Co-Smad, dependendo do gene alvo ou de outros fatores recrutados para o complexo (CALVO et al., 2009).
Por último, as Smad6 e Smad7 são chamadas de Smads inibidoras (I-Smads), responsáveis por modular a sinalização, competindo com as R-Smads pelo receptor ou até mesmo ligando-se à própria R-Smad. Ressalta-se que as Smad2 e Smad3 são transdutores de sinais apenas para ligantes TGF-β, nodal ou activina (GRANJEIRO et al., 2005; SOARES, 2008).
receptor ALK-2, que ativa somente Smad1 e Smad5. Desta forma, as proteínas são determinantes para a via de sinalização das BMPs porém, estudos sugerem que podem existir vias que são independentes de Smads (HSU et al., 2005). A incorporação do termo “morfogenético” na nomenclatura da BMP, explica-se devido esta proteína ser capaz de induzir o genoma a iniciar a formação de uma área morfogenética (GRANJEIRO et al., 2005).
2.3.4 Mecanismos de regulação das BMPs
A regulação da via de sinalização das BMPs é realizada a nível extracelular, na membrana plasmática, citoplasma e no interior do núcleo celular. Os antagonistas das BMPs exibem distintas afinidades de acordo com os diferentes tipos de proteínas. Qualquer alteração na relação entre agonistas, antagonistas e seus receptores podem resultar desordens relacionadas às BMPs. Os antagonistas são sintetizados juntamente com as BMPs e sua expressão é controlada também por estas mesmas proteínas, promovendo um circuito de auto-regulação. Quando secretados no meio extracelular, estes antagonistas podem agir sobre diferentes BMPs de forma que impedem a interação destes ligantes ao seu respectivo receptor (SOARES, 2008; CALVO et al., 2009).
Estruturalmente os antagonistas extracelulares são semelhantes às BMPs e apresentam domínios ricos em cisteínas. Dependendo da localização destes resíduos de cisteínas, os antagonistas podem ser classificados como: Noggin, Chordin, Twisted Gastrulation e família Dan (Gremlin, Sclerostin, Dan, USAG1, Cerberus, Dante e proteína relacionada a Dan e Cerberus). Em situações patológicas onde há superexpressão de BMP e formação excessiva de osso, estes antagonistas constituem uma proposta terapêutica (SOARES, 2008; CALVO et al., 2009; HARTH, 2010).
O receptor órfão 2 (Ror2) semelhante ao receptor de tirosina quinase pertence à família Ror de receptores de superfície celular, e estão estreitamente relacionados com a família de receptores do tipo quinase treonina/serina. Especificamente, Ror2 interage com o receptor de BMP do tipo Ib (BRIb) que leva a sua inibição, impedindo a sinalização por não ser possível a ativação das Smad1 e Smad5 (SIEBER, 2009; SAMMAR; SIEBER; KNAUS, 2009; FENG; DERYNCK, 2005).
proteína semelhante ao receptor tipo I, competindo com este mesmo receptor, a fim de impedir a formação do complexo receptor tipo I e tipo II (SHI; MASSAGUÉ, 2003; CALVO et al., 2009; YAN et al., 2009).
Receptores solúveis que são secretados para o meio extracelular também estão envolvidos no controle de sinalização das BMPs, ligando-se a estas proteínas com a mesma intensidade que os receptores transmembranares porém, sem a capacidade de transmitir a sinalização devido à perda de conexão com a membrana e o citoplasma das células alvo (DEL RE et al., 2004; LIN et al., 2006).
No meio intracelular, a regulação pode ser realizada através das proteínas Smurfs (Smad ubiquitination regulatory factors), que são ligases ubiquitinas E3. Há dois tipos de Smurfs: Smurf1 e Smurf2. O primeiro tipo é responsável pela ubiquitinação e degradação tanto de receptores BMP como de R-Smads (Smad1 e Smad5). Além disso, Smurf1 exporta I-Smads do núcleo para o citoplasma, aumentando a interação de I-Smads com receptores tipo I e inibindo a sinalização, ou degradando o próprio receptor. Smurf1 pode ter uma ação regulatória positiva devido a capacidade de degradar também as proteínas I-Smads. O Smurf2 interage diretamente com a Smad7 aumentando sua ubiquitinação, assim como a Smad7 interage com Smurf2 aumentando seu poder de degradação por estabilizar complexos protéicos de enzimas responsáveis pela ubiquitinação. Smurfs não possuem a capacidade de agir sobre Smad4, devido esta proteína não possuir sítio específico para sua degradação. Porém, os Smurfs agem indiretamente com Smad4 quando estas ligam-se a I-Smads ou R-Smads (FENG; DERYNCK, 2005; ITOH; DIJKE, 2007; CALVO et al., 2009).
As I-Smads (Smad6 e Smad7), presentes no citoplasma, estão relacionadas com a regulação por interagirem com receptores BMP tipo II, levando a inibição do receptor tipo I, impedindo estes de ligarem-se e realizarem a fosforilação das Smads. Porém, a Smad7 é um inibidor menos seletivo agindo também sobre receptores TGF-β. Proteínas Smad6 formam complexos com Smad1, impedindo a sua ligação com Smad4, bloqueando a via de sinalização pela diminuição de complexos Smad1:Smad4 (MASSAGUÉ; SEOANE; WOTTON, 2005; ITOH; DIJKE, 2007).
R-Smads:Co-Smad pode ligar-se diretamente a sequências específicas de DNA, conhecidas como elementos responsivos de BMP porém, estas ligações podem ser fracas, sendo necessários fatores transcricionais para realizar uma melhor afinidade e mais especificidade. Estes fatores possuem naturezas e funções diversas e são recrutados pelas R-Smads (ITOH; DIJKE, 2007; SIMIC; VUKIAVIC, 2007; SIEBER, 2009).
O fator Schnurri de Drosophila age como co-fator de R-Smads e Co-Smads na ativação e repressão de genes alvo. Outro co-fator relacionado às R-Smads é a proteína 2 de aumento de ligação poliomavirus (Pebp2), composta de duas subunidades, com a subunidade β variando entre proteínas Runx, Runx1, 2 ou 3. A Runx2 é o mediador mais importante relacionado a Smads 1 e 5 dependente de BMP, por induzir a diferenciação de osteoblastos e regular a transcrição de genes ósseos específicos que induzem a osteogênese (WAN; CAO, 2005; CALVO et al., 2009).
Ski é uma oncoproteína única que induz tanto a transformação oncogênica como a diferenciação terminal, age como um co-fator inibitório que interage com Smads reguladas por TGF-β e BMP e inibe a sinalização pela estabilização dos complexos R-Smads:DNA, que pode impedir as ligações de novas R-Smads ativadas aos fatores nucleares e atraindo co-repressores para o complexo R-Smads:DNA (WAN; CAO, 2005).
A associação de Smad1 com proteínas contendo um domínio homeobox (Hox) realiza funções fundamentais para o desenvolvimento normal, diferenciação osteoblástica e formação óssea. A Smad4 e Smad1 interagem com Hox-C8 em seu homodomínio no DNA e ativam a transcrição de genes de osteopotina e osteoprotegerina, estimula precursores osteoblásticos a expressar genes relacionados a diferenciação osteoblástica e induz a formação de matriz óssea mineralizada (WAN; CAO, 2005; FENG; DERYNCK, 2005; CALVO et al., 2009).
2.3.5 BMPs no desenvolvimento dentário
de necrose tumoral (TNF) (NAKASHIMA; AKAMINE, 2005; ZHANG et al., 2005; SOARES et al., 2007).
As BMPs, FGF e Activinas provenientes de centros de sinalização no ectoderma iniciam a indução do mesênquima odontogênico, ativando fatores de transcrição necessários para a continuidade do desenvolvimento dentário. Estas mesmas moléculas agem no próprio epitélio e regulam a formação de placóides dentárias que é responsável pela regulação do espessamento epitelial e condensação das células mesenquimais, sendo considerados os FGFs e Wnts como ativadores e as BMPs como inibidores da formação de placóides dentárias, onde a presença simultânea de BMP-2 e BMP-4 no ambiente de desenvolvimento dentário inibe a expressão de PAX9, impedindo a formação dos dentes (JUNG et al., 1998; KOUSSOULAKOU; MARGARITIS; KOUSSOULAKOS, 2009).
Os sinais provenientes da placa dentária mantêm a expressão de fatores de transcrição no mesênquima e induzem a expressão de novos genes, como o fator de transcrição Runx2 e o sinal FGF3, que regulam a morfogênese epitelial da fase de botão para a fase de capuz. Se ocorrer ausência de BMP-4 no mesênquima, genes específicos, como Msx1 e PAX9, não são expressos e o desenvolvimento dos dentes é interrompido na fase de botão (VAAHTOKARI et al., 1996; KOUSSOULAKOU; MARGARITIS; KOUSSOULAKOS, 2009).
Posteriormente, BMP-4 presente no mesênquima é requerida para que haja agregação de algumas células no epitélio, dando origem ao nó de esmalte, onde caracteristicamente não há divisão celular, e que determinarão os sítios onde se inicia o desenvolvimento das cúspides. Estas células passam a expressar moléculas sinalizadoras como sonic Hedgehog (SHH), BMP-2, BMP-4, BMP-7, Fgf3, Fgf4, Fgf9, Fgf20, Wnt3, Wnt10a e Wnt10b que influenciam nas interações entre as células epiteliais e mesenquimais. O sinal SHH é necessário para o crescimento de alças epiteliais cervicais que direcionam os nós de esmalte (THESLEFF, 2003).
As vias de sinalização da morfogênese dentária são bastante complexas e ultrapassam estas últimas descrições, pois há diversas variações nas respostas celulares aos mesmos sinais em tecidos diferentes e em momentos diferentes (TRESLEFF, 2003; YAMASHIRO; TUMMERS; THESLEFF, 2003; ZHANG et al., 2005).
2.3.6 BMP no desenvolvimento de tumores.
Gao; Yang; Yamaguchi, (1997) descreveram a expressão e distribuição da BMP (BMPMcAb) em 8 tipos de tumores odontogênicos e observaram a marcação imuno-histoquímica positiva nos seguintes tumores: Cementoblastoma, Dentinoma, Odontoma composto e Fibroma odontogênico. Porém, não foi evidenciada marcação em Ameloblastomas, TOAs e Tumor Odontogênico Epitelial Calcificante (TOEC). Estes resultados indicam que a BMP possui um importante papel na formação de tecidos dentais calcificados em tumores odontogênicos. O mecanismo de formação de áreas de calcificação em TOAs e TOECs é possivelmente diferente dos outros tumores avaliados. Ao analisar a expressão em germes dentários foi verificado que os ameloblastos exibiram marcação positiva para BMP embora não tenha sido observado positividade em Ameloblastomas.
Jin et al. (2001) avaliaram a imunomarcação de BMP-2/4/5 e do receptor BMPR-IA em fragmentos de mucosa oral normal, papiloma escamoso oral, inflamação crônica inespecífica, hiperceratose, carcinoma de células escamosas (CCE) e fragmentos de epitélio adjacente ao CCE. Houve fraca ou reação não consistente em tecidos normais ou em crescimentos benignos. Contrariamente, todos os casos de CCE tiveram forte marcação para as BMPs estudadas, sugerindo que estas proteínas participam não somente da formação de osso e cartilagem, mas também na carcinogênese de tumores epiteliais.
O estudo de Langenfeld e Langenfeld (2004) demonstrou que a BMP-2 induz a angiogênese por aumentar a expressão do gene antiapoptótico ID1, e pela fosforilação de R-Smads 1/5/8 e ERK-1/2, que ativa células endoteliais e aumenta a vascularização no processo de desenvolvimento de tumores localizados em pulmão, indicando que esta mesma proteína pode estar relacionada também com a formação de diversos tumores.
como em epitélio odontogênico neoplásico, por meio de interações epitélio-mesênquima. A BMP-4 e BMP-7 foram observadas em muitas células dos casos de Ameloblastomas enquanto a BMP-2 apenas em algumas células. A BMP-4 foi detectada amplamente quando comparada à BMP-2 nos casos de TOA, enquanto a BMP-7 foi observada difusamente.
Stolf; Karim; Banerjee, (2007) ao observarem a associação de proteínas e moléculas que participavam ativamente do processo de odontogênese (SHH, BMPs, FGFs e proteínas Wingless) no desenvolvimento de Ameloblastomas, concluiram que a ativação aberrante destes genes pode desempenhar importante papel na oncogênese.
Ruhin-Poncet et al. (2009) avaliaram a expressão de fatores de transcrição Msx e Dlx, que são modulados pela expressão de BMPs, em 12 Ameloblastomas recorrentes e em um caso de Carcinoma odontogênico de células claras (COCC). Por meio de hibridização in situ (ISH) foi evidenciado o fator de transcrição Dlx3 em Ameloblastomas e foi detectado de forma inconstante o Msx2 em células epiteliais. Nos casos de COCC foi detectada a perda de Dlx3 e Msx2 mas, identificou-se Msx1, semelhante ao que ocorre durante a odontogênese na fase de capuz. A BMP-2 por meio de RT-PCR estava inativada no COCC e irregularmente em Ameloblastomas, enquanto a BMP-4 estava presente nos tumores estudados. Os autores concluíram que a expressão alterada de fatores de transcrição é um caminho para elucidar a origem e o desenvolvimento de tumores odontogênicos.
3. PROPOSIÇÃO
4. MATERIAL E MÉTODOS
4.1 CONSIDERAÇÕES ÉTICAS
A pesquisa foi realizada obedecendo as Diretrizes e Normas Regulamentadoras de Pesquisa Envolvendo Seres Humanos, de acordo com a resolução 466/12 do Conselho Nacional de Saúde, e a Resolução que regulamenta o armazenamento e a utilização de material biológico humano no âmbito de projetos de pesquisa (Resolução CNS 347/2005). O projeto foi encaminhado ao Comitê de Ética em Pesquisa da Universidade Federal do Rio Grande do Norte (CEP/UFRN) para avaliação, sendo aprovado sob o parecer nº 479.089 (ver anexos).
4.2 CARACTERIZAÇÃO DO ESTUDO
Esta pesquisa consistiu em uma análise descritiva, semi-quantitativa e comparativa da expressão imuno-histoquímica de BMP-2 e BMP-4 e seus receptores BMPRIA e BMPRII em espécimes de Ameloblastoma sólido, Ameloblastoma unicístico e Tumor odontogênico adenomatóide.
4.3 VARIÁVEIS
Dependentes: presença ou ausência de imunomarcação para BMP-2, BMP-4, BMPRIA, BMPRII.
Independentes: sexo, idade, raça, localização anatômica e tipo histológico do tumor.
4.4 POPULAÇÃO
4.5 AMOSTRA
A amostra foi intencional sendo constituída por 20 casos de Ameloblastoma sólido, 10 casos de Ameloblastoma unicístico e 16 casos de Tumor odontogênico adenomatóide, todos emblocados em parafina, diagnosticados no Serviço de Anatomia Patológica da Disciplina de Patologia Oral do Departamento de Odontologia da Universidade Federal do Rio Grande do Norte.
4.5.1 Critérios de seleção da amostra
Critérios de inclusão: foram incluídos na amostra casos que receberam diagnóstico histopatológico de Ameloblastoma sólido ou unicístico e Tumor odontogênico adenomatóide, cujos blocos em parafina apresentavam quantidade suficiente de material e com boa qualidade para realização do estudo imuno-histoquímico, casos cujos prontuários apresentavam os dados necessários para a realização do estudo clínico.
Critérios de exclusão: foram excluídos da amostra casos que não satisfizeram os critérios de inclusão acima mencionados e casos de Ameloblastoma submetidos a marsupialização prévia.
4.5.2 Caracterização clínica dos Ameloblastomas e TOAs
Os dados clínicos de Ameloblastomas sólidos e unicístico e Tumor odontogênico adenomatóide selecionados foram obtidos das fichas clínicas dos pacientes e descridos de acordo com a idade, sexo, raça, localização e tempo de evolução (APÊNDICE A, B e C).
4.6 ESTUDO MORFOLÓGICO
Foi realizada uma análise descritiva dos aspectos histológicos observados nas lesões objeto da presente pesquisa.
4.7 ESTUDO IMUNO-HISTOQUÍMICO
4.7.1 Técnica Imuno-histoquímica
Do material emblocado em parafina foram obtidos cortes histológicos de 3µm de espessura e estendidos em lâmina de vidro previamente limpas e preparadas com adesivo à base de organosilano (3-aminopropyltrietoxi-silano, Sigma Chemical CO, USA). Posteriormente, os espécimes foram submetidos a técnica da estreptoavidina-biotina (SABC, streptoavidin-biotin complex) utilizando anticorpos monoclonais BMP2, BMP4, BMPRIA e
anti-BMPRII conforme descrito no Quadro 01.
Clone Especificidade Diluição Recuperação antigênica Incubação
ab6285
BMP2 1:100 Tris/EDTA, pH 9.0 panela pascal, 10 minutos
Overnight a 4ºC
ab81194
BMP4 1:100 Tris/EDTA, pH 9.0 panela pascal, 10 minutos
Overnight a 4ºC
ab166707
BMPRIA 1:200 Tris/EDTA, pH 9.0 panela pascal, 10 minutos
Overnight a 4ºC
ab78422
BMPRII 1:200 Tris/EDTA, pH 9.0 panela pascal, 10 minutos
Overnight a 4ºC Quadro 01. Clone, especificidade, diluição, recuperação antigênica e tempo de incubação dos
anticorpos utilizados (Fabricante: Abcam, Cambridge, USA).
Na realização do controle positivo foram obedecidas as especificações dos fabricantes para cada anticorpo utilizado na pesquisa sendo utilizado pulmão para BMP-2 e BMP-4, tecido muscular esquelético para BMPRIA e fígado para BMPRII. O controle negativo consistiu na substituição do anticorpo primário por albumina de soro bovino a 1% (BSA – Bovine Serum Albumin) em solução tampão.
Desparafinização: realizada com 2 banhos em xilol, sendo o primeiro banho à temperatura de 60°C, durante 30 minutos e, o segundo, à temperatura ambiente por 20 minutos;
Re-hidratação em cadeia descendente de etanóis: Álcool etílico absoluto I (5 minutos); Álcool etílico absoluto II (5 minutos); Álcool etílico absoluto III (5 minutos); Álcool etílico absoluto IV (5 minutos); Álcool etílico 95°GL (5 minutos); Álcool etílico 80°GL (5 minutos);
Imersão em solução de Hidróxido de Amônia a 10% durante 10 minutos, à temperatura ambiente, para remoção do pigmento formólico;
Lavagem do material em água corrente por 10 minutos e duas passagens por água destilada deionizada (5 minutos cada);
Recuperação antigênica (Quadro 01); Lavagem em água corrente (10 minutos);
Duas imersões rápidas em água destilada, com tempo de 5 minutos cada;
Duas incubações dos cortes, pelo período de 15 minutos cada, em solução de peróxido de hidrogênio 10 volumes em uma proporção de 1/1 para o bloqueio da peroxidase endógena tecidual;
Lavagem em água corrente durante 10 minutos;
Imersão em água destilada duas vezes, com tempo de 5 minutos cada;
Duas imersões em solução de Tween 20 a 1% em TRIS-HCl pH 7,4 durante 5 minutos cada; Incubação dos cortes com anticorpos primários diluídos em solução BSA a 1% em TRIS-HCl pH 7,4;
Duas passagens em solução de Tween 20 a 1% em TRIS-HCl pH 7,4 por 5 minutos cada; Incubação com anticorpo secundário com ADVANCETM HRP enzime (Dako North America Inc., Carpinteria, CA, USA), à temperatura ambiente (30 minutos);
Duas passagens em solução de Tween 20 a 1% em TRIS-HCl pH 7,4 por 5 minutos cada; Incubação com o complexo estreptoavidina-biotina (DAKO, A/S, Glostrp, Denmark) na diluição de 1/100, durante 30 minutos à temperatura ambiente;
Duas incubações em TRIS-HCl por 5 minutos cada;