UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE INSTITUTO DO CÉREBRO
PROGRAMA DE PÓS-GRADUAÇÃO EM NEUROCIÊNCIAS
JÉSSICA ALVES DE MEDEIROS ARAÚJO
REPROGRAMAÇÃO DE CÉLULAS-TRONCO MESENQUIMAIS EM NEURÔNIOS UTILIZANDO GENES PRÓ-NEURAIS
"REPROGRAMAÇÃO DE CÉLULAS-TRONCO MESENQUIMAIS EM NEURÔNIOS UTILIZANDO GENES PRÓ-NEURAIS"
JÉSSICA ALVES DE MEDEIROS ARAÚJO
ORIENTADOR: PROF. DR. MARCOS ROMUALDO COSTA
NATAL MARÇO DE 2015
Dissertação de mestrado
apresentado ao Programa de
Pós-graduação em
Neurociências da Universidade Federal do Rio Grande do Norte, como requisito para obtenção do
título de mestre em
RESUMO
A possibilidade de repor células perdidas em doenças neurodegenerativas através de transplantes com células-troncos das mais diversas fontes vem sendo amplamente estudada. As células-tronco adultas (CTA) podem ser facilmente isoladas e sua utilização na pesquisa não envolve questões éticas e religiosas. Além disso, estas células são menos propícias à transformação tumoral do que células-tronco embrionárias, outra importante fonte de células para terapias celulares. No entanto, as CTA são, em estados fisiológicos, restritas a geração de células dos seus tecidos de origem, o que poderia limitar a sua utilização. Porém, nos últimos anos, uma série de técnicas vem sendo descritas com o objetivo de reverter tais limitações. Neste trabalho, nós investigamos a capacidade das células-tronco mesenquimais adultas, isoladas de camundongos ou do cordão umbilical humano, serem induzidas a adquirir um fenótipo neuronal de forma direta, sem passar por um estágio de célula progenitora ou pluripotente, através da reprogramação genética com genes pró-neurais. Nossos resultados indicam que tanto células-tronco mesenquimais adultas murinas quanto humanas podem ser reprogramadas em neurônios após a expressão combinada de Sox2 e Ascl1 ou Sox2 e Neurog2. As células reprogramadas exibem morfologias compatíveis com o fenótipo neuronal, expressam proteínas típicas de neurônios maduros, apresentam a capacidade de gerar potenciais de ação repetitivos e formam conexões sinápticas com outros neurônios presentes no cultivo. Portanto, nosso trabalho apresenta a primeira evidência de reprogramação direta de células-tronco mesenquimais humanas em neurônios funcionais.
LISTA DE ILUSTRAÇÕES
Figura 1 Técnicas de reprogramação nuclear... 10 Figura 2 Representação esquemática das três possíveis maneiras de
obtenção de neurônios a partir das CTM ... 15 Figura 3 Representação esquemática da estrutura de um dímero da família
bHLH complexado ao DNA... 21 Figura 4 Representação esquemática temporal dos métodos experimentais
utilizados (dias)... 24 Figura 5 Mapa esquemático do plasmídeo pCAG-Neurog2-IRES-DsRed,
mostrando algumas de suas características... 28 Figura 6 Formação de adipócitos nas mCTM 30 dias após o tratamento com
indutores de diferenciação adipogênica... 32 Figura 7 Formação de osteócitos nas mCTM 30 dias após o tratamento com
indutores de diferenciação osteogênica... 33 Figura 8 Expressão das proteínas repórteres nas mCTM 2 dias após a
nucleofecção... 34 Figura 9 Eficiência média da nucleofecção nas mCTM 10 dias após a
transfecção... 34 Figura 10 Na ausência do co-cultivo, a expressão de Sox2 ou Sox2 mais
Ascl1 nas mCTM não altera morfologia nem expressão de β-III tubulina... 35 Figura 11 Na presença de co-cultivo com células hipocampais, a expressão
de Sox2 ou Sox2 e Ascl1 nas mCTM induz aquisição de morfologia neuronal e expressão de β-III tubulina... 36 Figura 12 Expressão das proteínas repórteres nas hCTM do cordão umbilical
após um dia da transfecção química... 38 Figura 13 Expressão de genes pró-neurais nas hCTM induz alterações
morfológicas, na presença de co-cultivo com hipocampo... 39 Figura 14 Expressão combinada de Sox2 com Ascl1 ou Neurog2 nas hCTM,
Figura 15 Expressão de genes pró-neurais nas hCTM induz alterações morfológicas e expressão de marcadores neuronais maduros, na presença de co-cultivo com células hipocampais... 41 Figura 16 Eficiência média da reprogramação das hCTM em neurônios, na
presença de co-cultivo com células hipocampais... 42 Figura 17 Expressão de genes pró-neurais nas hCTM induz alterações
morfológicas, na presença de co-cultivo com astrócitos... 43 Figura 18 Expressão de genes pró-neurais nas hCTM induz alterações
morfológicas, na presença de co-cultivo com astrócitos... 44 Figura 19 Expressão de vGAT e vGLUT1 nas hCTM reprogramadas... 46 Figura 20 hCTM do cordão umbilical reprogramadas com genes pró-neurais
se conectam com neurônios hipocampais... 47 Figura 21 hCTM transfectadas com plasmídeos controles não se conectam
com neurônios hipocampais... 48 Figura 22 hCTM reprogramadas com Ascl1 e Sox2 se conectam com
neurônios hipocampais... 49 Figura 23 hCTM reprogramadas com Sox2 e Neurog2 se conectam com
neurônios hipocampais... 50 Figura 24 Influxo de cálcio das hCTM reprogramadas com genes pró-neurais
se assemelha ao observado em neurônios hipocampais in vitro... 51 Figura 25 Propriedades eletrofisiológicas de uma hCTM reprogramada em
neurônio mediante expressão de Sox2 e Ascl1... 52 Figura 26 Propriedades eletrofisiológicas das hCTM reprogramadas em
neurônio mediante expressão de Sox2 e Ascl1... 53 Figura 27 Propriedades eletrofisiológicas das hCTM reprogramadas em
neurônio mediante expressão de Sox2 e Neurog2... 54 Figura 28 Propriedades eletrofisiológicas das hCTM reprogramadas em
LISTA DE TABELAS
Tabela 1 Resumo dos trabalhos com reprogramação direta de fibroblastos em neurônios... 18 Tabela 2 Propriedades eletrofisiológicas das hCTM reprogramadas em
neurônio mediante expressão de genes pró-neurais... 56 Tabela 3 Resumo dos trabalhos com reprogramação direta de células
SUMÁRIO
I. INTRODUÇÃO ... 9
1. Células-tronco e reprogramação celular ... 9
2. Células-tronco mesenquimais ... 13
3. Cordão umbilical humano como fonte de CTM ... 14
4. Diferenciação neuronal ... 14
4.1 Obtenção de neurônio a partir de célula-tronco pluripotente... 15
4.2 Obtenção de neurônio indiretamente, passando por estágio intermediário... ... 16
4.3 Reprogramação direta em neurônio ... 17
5. Genes mestres ... 20
II. OBJETIVOS ... 22
1. Gerais ... 22
2. Específicos ... 22
III. METODOLOGIA ... 23
1. Coleta e isolamento das CTM do cordão umbilical ... 23
2. Manutenção do cultivo das CTM do cordão umbilical ... 24
3. Coleta e isolamento das CTM murinas da medula óssea ... 25
4. Caracterização das CTM murinas da medula óssea ... 25
5. Reprogramação neuronal ... 26
6. Registro eletrofisiológico intracelular ... 28
7. Imageamento de cálcio ... 29
8. Fixação e imunocitoquímica ... 29
9. Análise estatística e representação gráfica ... 30
IV. RESULTADOS ... 31
1. Diferenciação das células da medula óssea de camundongos em tecidos mesenquimais ... 31
2. Expressão de genes pró-neurais induz reprogramação das CTM murinas em neurônios ... 32
3. Expressão de genes pró-neurais induz reprogramação das CTM humanas em neurônios ... 36
4. Conectividade entre os neurônios induzidos e hipocampais ... 45
V. DISCUSSÃO ... 57 1. Diferenciação das células da medula óssea de camundongos em tecidos mesenquimais ... 57 2. Expressão de genes pró-neurais induz reprogramação das CTM murinas em neurônios ... 58 3. Expressão de genes pró-neurais induz reprogramação das CTM humanas em neurônios ... 59 4. Conectividade entre os neurônios induzidos e hipocampais ... 61 5. Propriedades eletrofisiológicas dos neurônios induzidos ... 62 6. Comparação dos trabalhos de reprogramação direta em neurônios com o nosso ... 62
VI. CONCLUSÃO ... 67
I. INTRODUÇÃO
1. Células-tronco e reprogramação celular
As células-tronco (CT) são células indiferenciadas capazes de proliferar e gerar células progenitoras que podem se diferenciar em um ou mais tipos de células de determinado tecido (Yu e Thomson, 2008). Elas podem ser classificadas de acordo com seu local de origem ou seu potencial de diferenciação. As CT encontradas nas primeiras fases de divisão celular após a formação do Zigoto são chamadas de totipotentes, pois apresentam a capacidade de originar quaisquer células do embrião, placenta e anexos embrionários. Após a separação dos polos vegetal e animal, as células-tronco embrionárias (CTE) são encontradas na massa celular interna do blastocisto e são capazes de gerar todas as células do embrião, mas não possuem mais a capacidade de formar os anexos embrionários. Progressivamente, ainda no período embrionário, células-tronco multipotentes são geradas nos diferentes tecidos em desenvolvimento. Estas CT multipotentes estão, geralmente, restritas à geração de células de um determinado tecido, como por exemplo, as células-tronco neurais, gerando neurônios e células gliais.
Após o nascimento e na vida adulta, algumas CT multipotentes podem persistir em nichos específicos, sendo denominadas células-tronco adultas (CTA). Estas CTA apresentam potencial de diferenciação em tipos celulares da sua linhagem de origem, tais como as células-tronco mesenquimais gerando osteócitos, condrócitos e adipócitos. Essa restrição no potencial das CTA reflete, em grande parte, o nível de especialização que ocorreu durante o desenvolvimento (Morrison e Spradling, 2008; Morrison et al., 1997), mas também pode ser um efeito do nicho no qual estas células se encontram no organismo adulto.
Em geral, CTA apresentam menor potencial para gerar diferentes tipos celulares do que as CTE. Por outro lado, as CTA apresentam uma série de vantagens, tais como a maior facilidade de isolamento, ausência de questões éticas ou religiosas envolvendo sua utilização na pesquisa, grande capacidade de propagação em cultura, e baixa imunogenicidade, podendo ser, teoricamente, empregadas em transplantes alogênicos (Ding et al., 2011; Keating, 2012). Além disso, uma série de técnicas vem sendo descritas nos últimos anos com o
10
objetivo de reverter às limitações de potenciais de diferenciação das CTA e até mesmo o destino das células somáticas adultas.
Atualmente, três diferentes técnicas de reprogramação nuclear – transferência nuclear, fusão celular e expressão de fatores transcricionais (esquematizado na figura 1) – tem demonstrado que células diferenciadas podem ter seu destino reespecificado, retornando a um estado de célula-tronco embrionária, com capacidade de gerar células dos três folhetos embrionários ou mesmo um ser vivo completo (Vierbuchen e Wernig, 2012; Yamanaka e Blau, 2010). Isto é possível inclusive a partir de células com alto grau de especialização como neurônios (Kim et al., 2011a).
Figura 1: Técnicas de reprogramação nuclear. A, Transferência nuclear. Nesta técnica, o núcleo de uma célula somática (2n) é transplantado para um oócito enucleado, que é capaz de gerar um blastocisto. B, Fusão celular. Nesta técnica, duas células diferentes se unem e formam uma única célula, híbrido (quando a célula fusionada sofre divisão) ou heterocário (quando não ocorre divisão celular). C, Expressão de fatores transcricionais. Esta técnica pode ser usada para induzir a formação de uma célula-tronco embrionária. As setas pontilhadas indicam processos mais lentos (envolvendo múltiplas divisões celulares) do que as setas sólidas (sem divisão celular). Adaptado de Yamanaka e Blau (2010).
Gurdon et al., 1958). Gurdon e colaboradores transferiram o núcleo de uma célula embrionária de Xenopus para um oócito anucleado, e este foi capaz de
gerar novos girinos (Gurdon et al., 1958). Mais tarde, outros trabalhos demonstraram que a transferência nuclear de células adultas também era capaz de gerar larvas de Xenopus, porém com eficiência reduzida se comparada à
transferência nuclear de células embrionárias (Gurdon, 2006; Pasque et al., 2011). Estes trabalhos demonstraram que o estado diferenciado das células não é resultado de mudanças irreversíveis no genoma, adquiridas ao longo do desenvolvimento, e indicaram que o oócito contém “fatores de reprogramação” que causam modificações epigenéticas no núcleo de células diferenciadas que permitem a aquisição de um estágio de pluripotência.
Posteriormente, o trabalho de Blau e colaboradores mostrou através de fusão celular que a reprogramação celular não se limitava aos oócitos. Neste trabalho, miotubos multinucleados, após fusão celular e formação de heterocários (célula multinucleada que contem núcleos geneticamente diferentes), induziram a expressão de genes específicos de células musculares em outros tipos celulares (Blau et al., 1983).
A terceira técnica capaz de alterar o fenótipo celular a ser descrita foi a reprogramação através da expressão forçada de genes mestres. O primeiro trabalho a identificar um fator transcricional mestre capaz de regular genes específicos de um tecido foi publicado em 1987. Eles mostraram que a expressão forçada de MyoD em fibroblastos de camundongos era suficiente para convertê-los em mioblastos (Davis et al., 1987). Além deste trabalho, em 1995 foi demonstrado que a expressão ectópica de um fator transcricional eyeless
(conhecido como Pax6 em mamíferos), um gene mestre do desenvolvimento do olho, induzia a formação de olhos em diversas partes do corpo da Drosophila
(Halder et al., 1995). Esses dados evidenciaram que um fator transcricional pode ser suficiente para iniciar e controlar a diferenciação em um tipo celular específico.
Alguns anos mais tarde, alguns trabalhos propuseram que células-tronco adultas, mesenquimais e neurais, poderiam contribuir para a formação de camundongos quimeras e apresentavam capacidade de gerar células de todas as linhagens germinativas quando injetadas em blastocistos em fases iniciais (Clarke et al., 2000; Jiang et al., 2002). Porém, estes resultados foram
contestados por outros trabalhos, que demonstraram que as células-tronco adultas transplantadas fusionavam com as células do receptor e formavam células multinucleadas, comprovando que as células-tronco adultas não apresentavam potencial para gerar células de outras linhagens, como neurônios, hepatócitos e cardiomiócitos (Alvarez-Dolado et al., 2003; Terada et al., 2002; Vassilopoulos et al., 2003; Wang et al., 2003; Ying et al., 2002).
Estimulados por esses trabalhos de transferência nuclear, fusão celular e reprogramação através da expressão de um fator transcricional, Yamanaka e colaboradores investigaram os genes responsáveis por induzir a reprogramação de fibroblastos em células pluripotentes. Neste trabalho eles identificaram genes expressos especificamente em células-tronco embrionárias e verificaram que a expressão combinada de 24 destes genes em fibroblastos de camundongos induzia a aquisição de propriedades de pluripotência nestas células. Após sistemática eliminação, apenas quatro desses fatores (Oct4, Sox2, Klf4 e c-myc) foram suficientes para induzir a reprogramação dos fibroblastos em células pluripotentes, chamadas de “induced pluripotent stem cell (iPS)”. Estas iPSs
expressam proteínas específicas de células-tronco embrionárias e apresentam capacidade de gerar células de todas as linhagens germinativas (Takahashi e Yamanaka, 2006). Em resumo, este trabalho demonstrou que células-tronco pluripotentes podem ser geradas diretamente, a partir de fibroblastos, através da expressão de genes definidos.
Desde então, outras evidências tem demonstrado que as CTA são mais propícias à reprogramação do que outras células somáticas, com a necessidade de um número menor de fatores, provavelmente como resultado de seu estado “mais indiferenciado” e maior plasticidade (Giorgetti et al., 2009; Kim et al., 2009). O trabalho de Giorgetti e colaboradores demonstrou a formação de iPS a partir das células do sangue do cordão umbilical utilizando apenas dois dos quatro fatores de transcrição utilizados por Yamanaka (Takahashi e Yamanaka, 2006), OCT4 e SOX2. As células reprogramadas apresentaram morfologia característica de CTE, expressão dos marcadores de pluripotência, capacidade de formação de corpos embrionários e diferenciação nos derivados das três linhagens germinativas, inclusive neurônios (Giorgetti et al., 2009).
Atualmente, diversos tipos celulares foram convertidos em iPS com frequências de reprogramação e combinações de fatores transcricionais
variados, indicando que a reprogramação nuclear depende do “contexto” celular, ou seja, do estado de enovelamento da cromatina, seu padrão de acetilação e metilação, assim como do padrão inicial de expressão gênica da célula. Diante disso, a identificação dos genes necessários para induzir a reprogramação celular nos mais diversos tecidos, bem como a escolha da célula a ser reprogramada tem incitado um número crescente de pesquisas nesta área.
Neste sentido, no presente trabalho nós avaliamos a possibilidade de reprogramação genética de células-tronco mesenquimais adultas em neurônios.
2. Células-tronco mesenquimais
As células-tronco mesenquimais (CTM) foram inicialmente isoladas da medula óssea por Friedenstein e colaboradores em 1968. Esta população de células aderentes foi descrita como “colony forming unit-fibroblast” (CFU-F), com morfologia fibroblastóide, alta capacidade proliferativa e potencial para se diferenciar in vitro em tecido ósseo, adiposo e cartilaginoso, dependendo do
estímulo e condições de cultivo (Afanasyev et al., 2010). Caplan, em 1991, propôs a denominação de “células-tronco mesenquimais” para estas células, por apresentarem a capacidade de gerar todas as células da linhagem mesodérmica (Caplan, 1991; Keating, 2012).
Nas décadas seguintes, o potencial terapêutico das CTM gerou um crescente interesse na comunidade científica (Ding et al., 2011; Keating, 2012). No entanto, os pesquisadores utilizavam diferentes métodos de isolamento, expansão e caracterização destas células, o que dificultava a comparação entre os resultados desses estudos. Este panorama levou a criação de uma nova terminologia e critérios de caracterização por parte da Sociedade Internacional de Terapia Celular (Dominici et al., 2006; Horwitz, 2005). Os critérios mínimos que devem ser preenchidos, atualmente, para que uma célula seja considerada CTM incluem: i) a aderência ao plástico de cultura; ii) a expressão dos marcadores de superfície CD105, CD73 e CD90; iii) a ausência de expressão dos marcadores hematopoiéticos – CD45, CD34, CD14 ou CD11b, CD79a ou CD19 e HLA-DR – ao longo do cultivo; e iv) a capacidade de diferenciação em osteoblastos, adipócitos e condroblastos sob determinadas condições in vitro
(Dominici et al., 2006).
Além da medula óssea, as CTM podem ser isoladas a partir de uma variedade de tecidos, incluindo placenta, pele, poupa dentária, líquido amniótico, células perivasculares e geleia de Wharton do cordão umbilical (Ding et al., 2011). As CTM provenientes de diferentes tecidos não apenas exibem diferenças na expressão de alguns antígenos de superfície, mas variam também quanto a sua capacidade de diferenciação (Harichandan e Bühring, 2011). Tem sido sugerido que CTM isoladas de tecido extraembrionários (como partes da placenta e do cordão umbilical) apresentam maior capacidade proliferativa e potencial de diferenciação do que as CTM adultas – medula óssea e tecido adiposo (Hass et al., 2011; Petsa et al., 2009). Outra vantagem importante das CTM de tecidos extraembrionários é a facilidade de extração dessas células através de procedimentos não invasivos, sem riscos para a mãe e o bebê.
3. Cordão umbilical humano como fonte de CTM
As CTM podem ser isoladas de diferentes partes do cordão umbilical. O cordão umbilical é um tecido extraembrionário constituído por duas artérias e uma veia, envolvidas por um tecido conjuntivo, conhecido como geleia de Wharton. Esta consiste em um tecido conetivo mucoso, rico em glicosaminoglicanos, com a função de prevenir a compressão e torção dos vasos (Can e Karahuseyinoglu, 2007). Em especial, as CTM podem ser extraídas do cordão umbilical a partir do sangue, da geleia do Wharton, ao redor dos vasos e da camada subendotelial da veia (Romanov et al.; Troyer and Weiss, 2008).
Como as CTM do cordão umbilical são originadas de tecido mesodérmico, a sua capacidade de diferenciação nas linhagens osteogênica, adipogênica e condrogênica tem sido extensivamente estudada (Karahuseyinoglu, 2007; Schneider et al., 2010; Wang et al., 2004). Além da diferenciação nas linhagens mesenquimais clássicas, o potencial dessas células em originar hepatócitos, cardiomiócitos, músculo esquelético e até mesmo tecido neural vem sendo investigado (Fan et al., 2011).
4. Diferenciação neuronal
O processo de diferenciação neuronal a partir de CT (e, em alguns casos, a partir de células somáticas) pode ser induzido por três diferentes caminhos: (1) a reprogramação em células-tronco pluripotentes induzidas (iPS – “induced
pluripotent stem cell”) seguida da indução neuronal; (2) a passagem por um
estágio intermediário de células progenitoras neurais; e (3) a diferenciação direta em neurônios. Estes diferentes caminhos são ilustrados para as CTM na figura 2 e discutidos individualmente.
Figura 2: Representação esquemática das três possíveis maneiras de obtenção de neurônios a partir das CTM. (1) As CTM são induzidas a um estágio de pluripotência (iPS) antes de formarem neurônios; (2) As CTM são induzidas a um estágio de progenitor neuronal antes de diferenciarem em neurônios; e (3) CTM são reprogramadas diretamente em neurônios, sem passar por estágios intermediários.
4.1 Obtenção de neurônio a partir de célula-tronco pluripotente:
A primeira demonstração de diferenciação das células-tronco embrionárias (CTE) em neurônios funcionais foi publicada independentemente por três grupos (Bain et al., 1995; Fraichard et al., 1995; Strübing et al., 1995) e desde então tem sido significativamente melhorada por uma série de estratégias (Bibel et al., 2007; Rohwedel et al., 1999). Cada um dos três principais tipos de células do sistema nervoso central – neurônios, astrócitos e oligodendrócitos – pode ser gerado e populações relativamente puras podem ser isoladas a partir das CT pluripotentes, quando cultivadas em condições adequadas (Aubert et al., 2002; Noisa et al., 2012).
Os protocolos para a diferenciação de subtipos específicos de neurônios têm incluído a combinação sequencial de moléculas reconhecidas por desempenhar um papel no estabelecimento destas linhagens durante o desenvolvimento do embrião (Hansen et al., 2011; Lee et al., 2000; Peljto e Wichterle, 2011; Shi et al., 2012).
A possibilidade de gerar diferentes tipos de neurônios a partir das CTE tem estimulado o interesse dos pesquisadores na terapia celular de doenças neurodegenerativas e na modelagem de doenças in vitro (Colman e Dreesen,
2009; Sterneckert et al., 2014).
Assim como para CTE, o potencial de diferenciação neuronal das iPS tem sido extensivamente estudado. O trabalho de SHI et al., 2012 demonstrou
resultados semelhantes de diferenciação em neurônios corticais a partir de CTE e iPS combinando o tratamento com ácido retinoico e inibição da sinalização por SMAD para promover a indução neural. Neste trabalho foi demonstrado a formação de neurônios com propriedades eletrofisiológicas maduras e sinapses glutamatérgicas. Além disso, a diferenciação em subtipos neuronais, caracterizados pela expressão de proteínas expressas por neurônios de diferentes camadas corticais, ocorreu de forma sequencial, semelhante ao desenvolvimento das camadas do córtex in vivo (Shi et al., 2012).
4.2 Obtenção de neurônio indiretamente, passando por estágio
intermediário:
O trabalho de Giorgetti e colaboradores (2012) mostrou a conversão de células do sangue do cordão umbilical humano em células da linhagem neuronal através da expressão ectópica de SOX2 e c-Myc. Após a reprogramação, as células apresentaram elevada taxa proliferativa, expressão dos marcadores de progenitores neurais Nestin e SOX2, e ausência de marcadores neuronais pós-mitóticos – como NeuN, VGlut1, GABA e Synapsin1 – o que indica que a diferenciação neuronal ocorreu por meio de um estágio intermediário, provavelmente através de uma população de células progenitoras. Estas células, na presença de meio de diferenciação neuronal, após 4-6 semanas, adquiriram morfologia de neurônios maduros e expressaram vários marcadores neuronais. Além disso, mostraram a capacidade de gerar potenciais de ação, após a maturação in vitro, bem como in vivo após o transplante no hipocampo de
camundongos (Giorgetti et al., 2012).
Apesar da relevância deste estudo, o uso de c-Myc na reprogramação dessas células dificulta futuras aplicações clínicas, pois este fator de transcrição é um proto-oncogene, envolvido nos processos de regulação da proliferação celular, diferenciação e apoptose, o que implica um grande risco de formação de
tumor (Wernig et al., 2008). Como evidência disso, já foi mostrado que a omissão do retrovírus c-Myc na reprogramação de fibroblastos em iPS reduziu significativamente o risco de tumorigênese nos camundongos quimeras (Nakagawa et al., 2008).
4.3 Reprogramação direta em neurônio:
Vários trabalhos relataram a expressão de alguns marcadores neurais – como βIII-tubulina, neurofilamento-M, “Glial fibrillary acidic protein” (GFAP), NEUROD1, OLIG2 e WNT1 – e alterações morfológicas das CTM como sendo consistentes com a indução de um fenótipo neural, quando expostas aos mais diversos tratamentos e condições de cultivo, como tratamento com “butylated
hydroxyanisole” e “dimethylsulphoxide” (DMSO) (Mitchell, 2003; Woodbury et al.,
2000), ácido retinoico e fatores neurotróficos (Buzanska et al., 2002; Jang et al., 2004; Sanchez-ramos et al., 2001), “dibutyryl-cAMP” (db-cAMP) e “ 3-isobutyl-1-methylxanthine” (IBMX) (Fallahi-Sichani et al., 2007; Greschat et al., 2008;
Kögler et al., 2004; Tio et al., 2010; Wang et al., 2007). Porém, outros estudos reavaliaram o efeito dessa mesma abordagem química nas CTM e mostraram que as alterações morfológicas relatadas, como aquisição de um fenótipo neuronal, foram resultado de uma retração citoplasmática causada por despolimerização dos filamentos de actina e perda da adesão celular e, portanto, não representava crescimentos de neuritos. Além disso, essas alterações morfológicas podem ser reproduzidas em fibroblastos com o mesmo tratamento, bem como podem ser mimetizadas por agentes estressores, como detergentes por exemplo. Além das análises morfológicas em tempo real, a análise de marcadores revelou que as CTM da medula óssea constitutivamente expressam marcadores relacionados com outras linhagens, incluindo várias pertencentes à linhagem neural, e estes não foram modulados após aplicação dos protocolos de “indução neural” (Bertani et al., 2005; Krabbe et al., 2005; Lu et al., 2004; Neuhuber et al., 2004).
Por outro lado, a reprogramação genética de células somáticas de forma direta apresenta resultados mais contundentes como, por exemplo, a conversão de fibroblastos de camundongos em neurônios funcionais por fatores transcricionais definidos (Vierbuchen et al., 2010; Wernig et al., 2008). Inicialmente, 19 genes especificamente expressos em tecidos neurais ou
implicados no desenvolvimento neural foram rastreados, dos quais apenas três fatores (ASCL1, BRN2 e MYT1L) foram suficientes para converter fibroblastos em neurônios funcionais.
Desde então, novos fatores transcricionais ou diferentes combinações dos mesmos, pequenas moléculas, reguladores epigenéticos e microRNAs tem sido descritos por converterem fibroblastos em diferentes subtipos de neurônios funcionais, em células camundongos e humanos – resumido na tabela 1, atualizada de Xu e colaboradores (2015).
Fenótipo adquirido Fatores de reprogramação Referência
Neurônio Repressão de PTB (Xue et al., 2013)
Neurônio (dopaminérgico) Ascl1, Pitx3, Lmx1a, Nurr1, Foxa2, EN1 (Kim et al., 2011b) Neurônio (dopaminérgico) Lmx1a, Foxa2, Ascl1, Brn2 ou Lmx1b, Otx2, Nurr1, Ascl1, Brn2 (Sheng et al., 2012)
Neurônio (glutamatérgico) Ascl1, Brn2, Myt1l (Vierbuchen et al., 2010)
Neurônio ASCL1, NGN2, CHIR99021, SB431542 (Ladewig et al., 2012)
Neurônio (glutamatérgico) NGN2, Forskolin, Dorsomorphin (Liu et al., 2013) Neurônio (dopaminérgico) ASCL1, BRN2, MYT1L, LMX1A, FOXA2 (Pfisterer et al., 2011) Neurônio (dopaminérgico) MASH1, NGN2, SOX2, NURR1, PITX3 (Liu et al., 2012) Neurônio (glutamatérgico) ASCL1, BRN2, MYT1L, NEUROD1 (Pang et al., 2011) Neurônio (glutamatérgico) BRN2, MYT1L, miR-124 (Ambasudhan et al., 2011) Neurônio (glutamatérgico,
GABAérgico)
ASCL1, MYT1L, NEUROD2, miR-9/9*,
miR-124 (Yoo et al., 2011)
Neurônio (dopaminérgico) Ascl1, Lmx1a, Nurrl (Caiazzo et al., 2011)
Neurônio Ascl1 (Chanda et al., 2014)
Neurônio (motor) Brn2, Ascl1, Myt1l, Lhx3, Hb9, Isl1, Ngn2 (Son et al., 2011)
Neurônio (sensorial) Brn2 e Ngn2 ou Ngn1 (Blanchard et al., 2015)
Tabela 2:Resumo dos trabalhos com reprogramação direta de fibroblastos em neurônios. Na parte superior (verde) estão os trabalhos que utilizaram células de camundongos, na parte medial (azul) trabalhos com células de humanos e na parte inferior (cinza) resultados obtidos com células de ambos. Tabela atualizada de Xu e colaboradores (2015).
Outra forma de reprogramação direta em neurônios tem sido relatada a partir de astrócitos corticais de roedores pós-natais, estes são altamente suscetíveis à reprogramação neuronal através da expressão forçada de determinado fator de transcrição, tais como Neurogenin2 (Neurog2), Distal-less homeobox 2 (Dlx2), ou Mammalian Achaete-scute homolog 1 (Mash1, também
conhecido como Ascl1) (Berninger et al., 2007; Blum et al., 2011; Heinrich et al.,
2010). A expressão de Neurog2 induz um fenótipo glutamatérgico, enquanto que
a expressão de Ascl1 e Dlx2 induz um fenótipo GABAérgico, assemelhando-se
aos papéis desses fatores transcricionais durante o desenvolvimento (Guillemot, 2005). Os astrócitos reprogramados em neurônios de subtipos específicos adquirirem propriedades elétricas compatíveis com um fenótipo neuronal maduro, tais como a capacidade de gerar potenciais de ação e de formar contatos sinápticos (Berninger et al., 2007; Heinrich et al., 2010). Astrócitos corticais pós-natais também podem ser reprogramados em neurônios dopaminérgicos, através da expressão combinada de Ascl1, LIM homeobox TF
1 (Lmx1) e nuclear receptor related 1 protein (Nurr1) (Addis et al., 2011).
Além destas células, o trabalho de Karow e colaboradores (2012) demonstrou que pericitos isolados do córtex cerebral adulto humano podem ser reprogramados em células neuronais através da expressão dos fatores de transcrição Sox2 e Ascl1, mediada por retrovírus. As células reprogramadas
adquiriram a capacidade de gerar potencial de ação e foram alvos sinápticos para outros neurônios, indicando sua capacidade de integrar em redes neurais. No entanto, as células transfectadas com Neurog2 utilizando vetores retrovirais,
não sofreram diferenciação em neurônios (Karow et al., 2012). Esses resultados indicam que a ação sinérgica de Sox2 e Ascl1, mas não de Sox2 e Neurog2, é necessária para a reprogramação neuronal de células de origem mesodérmica.
Existe certa discussão sobre a origem e identidade dos pericitos, alguns estudos defendem que pericitos são, provavelmente, células-tronco mesenquimais ou progenitoras, capazes de dar origem a adipócitos, cartilagem, ossos e músculos (Armulik et al., 2011). Considerando que os pericitos apresentam uma origem embrionária mais próxima às CTM e, portanto, características semelhantes quanto ao “estado genético” dessas células talvez seja possível a reprogramação das CTM em neurônios utilizando Sox2 e Ascl1,
como foi descrito para os pericitos (Karow et al., 2012).
Tendo em vista este cenário, no presente trabalho nós investigamos a capacidade das CTM serem induzidas a adquirir um fenótipo neuronal de forma direta, sem passar por um estágio de célula progenitora ou pluripotente, através da reprogramação genética com genes pró-neurais. Especificamente, nós analisamos se a expressão de diferentes combinações de fatores transcricionais,
Sox2 combinada a Neurog2 ou Ascl1, é suficiente para reprogramar células
tronco mesenquimais em neurônios funcionais.
5. Genes mestres
Genes regulatórios mestres são expressos nos primórdios do desenvolvimento de uma linhagem ou tipo celular, participam especificação dos mesmos e são capazes de reespecificar o fenótipo de uma célula destinada a formar uma linhagem específica (Chan e Kyba, 2013). Eles atuam controlando a expressão de outros genes, reprimindo ou ativando-os, e são necessários e suficientes para a formação de determinada linhagem ou tipo celular. E, por isso, estes genes têm sido utilizados na reprogramação, com o intuito de converter um tipo celular ou linhagem em outra (Xu et al., 2015).
Neste trabalho, nós abordaremos genes mestres implicados no desenvolvimento de células neurais: os genes pró-neurais Neurogenin2, Ascl1, e Sox2.
Os genes pró-neurais codificam fatores transcricionais da família basic
helix–loop–helix (bHLH), um motivo estrutural caracterizado por duas hélices
separadas por uma volta (figura 3). Essas proteínas ligam em regiões específicas no DNA, região conhecida como E-box, e ativam a transcrição de genes alvos (Bertrand et al., 2002). No sistema nervoso central e periférico esses fatores transcricionais atuam promovendo a proliferação de progenitores neurais e a diferenciação em determinado tipo celular, glias e neurônios (Bertrand et al., 2002; Kageyama et al., 2005; Ross et al., 2003). Mais recentemente foi demonstrado que diferentes combinações e padrões de expressão dos genes da família bHLH em progenitores neurais de camundongos podem especificar a diversidade de fenótipos celulares no sistema nervoso: neurônio, glia e oligodendrócito (Imayoshi et al., 2013).
Neurogenin2 e Ascl1 (também conhecido como Mash1 – Mammalian
achaete-scute homolog 1) são membros dessa família, eles são responsáveis
por promoverem a determinação do destino neuronal e reprimirem a expressão de genes gliais (Nieto et al., 2001; Tomita et al., 2000). Estes fatores transcricionais podem apresentar funções distintas quanto à especificação neuronal. Por exemplo, Neurogenin2 é expresso no telencéfalo dorsal e está envolvido com a formação de neurônios glutamatérgicos, enquanto Ascl1 é expresso no telencéfalo ventral e está envolvido com a geração de neurônios gabaérgicos (Fode et al., 2000; Parras et al., 2002).
Figura 3: Representação esquemática da estrutura de um dímero da família bHLH complexado ao DNA. O domínio básico se liga ao DNA, onde vários resíduos desta região fazem contato direto com sequências E-box. (Bertrand et al., 2002).
Sox2 é um fator de transcrição pertence à família Sox, também conhecida como SRY (sex determining region Y), que apresentam um domínio de ligação
altamente conservado, chamado HMG (High-mobility group). Sox2 é um gene
mestre que juntamente com outros fatores transcricionais, como Oct3/4, controla um conjunto de genes que orquestra a embriogênese em mamíferos (Avilion et al., 2003; Nichols et al., 1998).
Esse fator é expresso durante o desenvolvimento do sistema nervoso de camundongos, inicialmente, nas células do tubo neural e, posteriormente, em progenitores neurais e é responsável por manter estas células com características de progenitor (Graham et al., 2003). Em humanos, mutações no gene que codifica o Sox2 parecem estar associadas com desordens no olho, como glaucoma e catarata (Mihelec et al., 2008; Wang et al., 2008).
Considerando o papel central dos fatores de transcrição Sox2, Neurog2 e Ascl1 no processo de especificação neuronal durante o desenvolvimento, nossa hipótese é de que a expressão destes fatores, de forma individual ou conjunta, poderia ser suficiente para induzir o fenótipo neuronal nas CTM. Além disso, é possível que a combinação de genes utilizada contribua para especificação do fenótipo neuronal gerado, considerando, por exemplo, a função de Neurogenin2 e Ascl1 durante o desenvolvimento do córtex seria possível induzir a formação de neurônios glutamatérgicos e gabaérgicos, respectivamente.
II. OBJETIVOS
1. Gerais
Induzir células-tronco mesenquimais de duas fontes, isoladas da medula óssea de roedores e da geleia de Wharton do cordão umbilical de humanos, a adquirirem uma identidade neuronal, através da reprogramação genética utilizando fatores de transcrição pró-neurais.
2. Específicos
Isolar e caracterizar as células-tronco mesenquimais da medula óssea de camundongos;
Identificar quais são os fatores necessários para induzir a reprogramação das CTM em neurônios funcionais;
Avaliar alterações morfológicas e de marcadores característicos de células neuronais nas CTM após induzir expressão de Neurog2, Sox2 e Ascl1;
Verificar atividade eletrofisiológica dos neurônios induzidos através de registro eletrofisiológico intracelular (patch clamp) e imageamento de
cálcio.
III. METODOLOGIA
Os métodos experimentais utilizados neste projeto estão descritos abaixo. Em resumo, eles consistem na coleta, isolamento e manutenção das células-tronco mesenquimais, seguido da reprogramação neuronal através da transfecção destas células com plasmídeos de DNA, contendo o gene codificador para fatores de transcrição pró-neurais, e por fim, métodos imunocitoquímicos e funcionais (imageamento de cálcio e registro eletrofisiológico intracelular) utilizados para análise das células reprogramadas (figura 4).
Figura 4: Representação esquemática temporal dos métodos experimentais utilizados (em dias).
1. Coleta e isolamento das CTM do cordão umbilical
O material utilizado no presente trabalho foi obtido de doações com o consentimento livre e esclarecido de mães parturientes na Maternidade Januário Cicco, pertencente à Universidade Federal do Rio Grande do Norte (UFRN), Natal-RN. Após o parto, os cordões foram retirados de acordo com a metodologia proposta pela Agência Nacional de Vigilância Sanitária (ANVISA). As amostras foram coletadas em um frasco estéril contendo uma solução tampão –
Phosphate buffered saline (PBS) acrescido de 3% de solução de antibióticos e
antimicótico (10000 U/mL de penicilina sódica, 10 mg/mL de estreptomicina e 25 μg/mL de anfotericina B, GIBCO) – e encaminhadas para o Laboratório de Biologia Molecular e Genômica (LBMG) na UFRN.
As células foram isoladas da geleia de Wharton do cordão umbilical e criopreservadas para manutenção das linhagens celulares primárias (Cornélio, 2012; Duarte et al., 2012). Com o intuito de analisar se as células obtidas do
Reprogramação neuronal
0 1° ou 2° 15° ao 24°
Isolamento e manutenção
das CTM
Co-cultivo com hipocampo ou
astrócitos Transfecção
química ou elétrica
Imunofluorescência; Imageamento de cálcio; Registro eletrofisiológico intracelular.
Tempo (dias)
cordão umbilical são realmente CTM (seguindo determinações de Dominici et al., 2006), a expressão de proteínas marcadoras de superfície foi analisada utilizando citometria de fluxo (FACS) e verificada a capacidade de diferenciação
in vitro das CTM em osteoblastos, adipócitos e condroblastos (Cornélio, 2012;
Duarte et al., 2012). Estas etapas foram realizadas no LBMG e posteriormente, as células criopreservadas foram cedidas para execução do presente trabalho no Instituto do Cérebro, na UFRN.
2. Manutenção do cultivo das CTM do cordão umbilical
Para recuperação, as células foram descongeladas rapidamente, para isso os tubos foram levados diretamente do nitrogênio líquido para o banho-maria a 37ºC. Depois de descongeladas, elas foram transferidas para um tubo de centrífuga de 15 mL com alfa-MEM + 20% soro fetal bovino (SFB) + 1% antibióticos, centrifugadas e lavadas para retirar o DMSO. Uma alíquota da suspensão celular foi diluída com azul de tripan (Gibco), para análise da viabilidade celular, as células foram contadas na Câmara de Neubauer através de um microscópio invertido e distribuídas em garrafas T25 (TPP) na densidade de 6000 células/cm2.
Após as 48 horas de cultivo inicial, todo o meio de cultura e as células que não aderiram ao frasco foram removidos, e adicionados 3 mL de meio alfa-MEM com 10% SFB (Hyclone) e 1% de antibióticos. A troca do meio foi realizada a cada 72 horas ou quando o meio apresentava-se amarelado, indicativo de mudança de pH. O crescimento celular foi observado diariamente através de um microscópio invertido (CKX 41, OLYMPUS) e quando a cultura atingia cerca de 60% de confluência realizava-se a passagem das células para novas garrafas. Para tal procedimento, utilizava-se 1 mL de solução de 0,25% de tripsina/EDTA (INVITROGEN) em cada T25 por 3 minutos a 37ºC. A ação enzimática foi interrompida com SBF, as células em suspenção foram então transferidas para tubos de 15 mL (TPP). A suspensão celular foi centrifugada, o sobrenadante descartado e o sedimento celular homogeneizado em alfa-MEM com 10% SBF (Hyclone) e 1% de antibióticos. As células foram distribuídas em novos frascos na densidade de 4000 células/cm2. O número da passagem celular foi marcado
a cada tratamento com Tripsina (P1, P2, P3, P4 e assim por diante). Nos
experimentos de reprogramação neuronal nós utilizamos células a partir da sexta passagem celular até a décima segunda.
3. Coleta e isolamento das CTM murinas da medula óssea
Todos os procedimentos experimentais com camundongos utilizados neste projeto foram aprovados pela Comissão de ética no uso de animais (CEUA) da UFRN sob protocolo n° 008/2014. A medula óssea foi retirada de camundongos com 6 semanas de idade. Após o sacrifício dos animais, o fêmur e a tíbia foram removidos, e dissecado todo o tecido conjuntivo em torno dos ossos. As amostras foram coletadas em um frasco estéril contendo Hank's
Balanced Salt Solution (HBSS - Gibco) e 1% de antibióticos. As epífises foram
cortadas, coletadas em tubo cônico com alfa-MEM (Gibco) enriquecido com 10% SBF (Gibco) e 1% de antibióticos, estas foram maceradas e o conteúdo filtrado (BD Falcon™ cell strainers - BD Biosciences). Utilizando uma seringa de 5 mL
com alfa-MEM + 10% SFB + 1% antibióticos, inseria-se a agulha em uma das extremidades do osso e todo o conteúdo foi coletado em tubo cônico. A suspensão de células foi centrifugada a 400g por 5 minutos, o sobrenadante descartado e as células ressuspendidas em 10 mL de alfa-MEM + 10% SFB. As células foram distribuídas em garrafas T25 (TPP) na densidade de 5x105
células/T25.
4. Caracterização das CTM murinas da medula óssea
Com o propósito de averiguar se as células obtidas da medula óssea são CTM foi analisada a capacidade de diferenciação in vitro em osteoblastos e
adipócitos.
4.1 Protocolo de diferenciação osteogênica
A diferenciação osteogência foi induzida nas CTM após 30 dias de tratamento com B-glicerofosfato (10 mM), Dexametasona (1 x 10-8 M) e ácido ascórbico 2-fosfato (5 µg/ml) em alfa-MEM suplementado com 10% SFB e antibióticos (Meirelles e Nardi, 2003; Phinney et al., 1999). Para observar a formação de depósitos de cálcio nas CTM após este tratamento as células foram fixadas com PFA 4% durante 20 minutos e coradas com Alizarin vermelho S durante 5 minutos à temperatura ambiente. Alizarin vermelho S é um corante
que forma complexos com o cálcio e é utilizado como indicador da diferenciação osteogênica.
4.2 Protocolo de diferenciação adipogênica
A diferenciação adipogência foi induzida nas CTM após o tratamento com Dexametasona (1x10-8M), insulina de pâncreas bovino (2,5 µg/ml), indometacina
(100 µM) e rosiglitazona (5 µM) em alfa-MEM com 10% SFB e antibióticos (Meirelles e Nardi, 2003; Phinney et al., 1999). Para confirmar a formação de adipócitos a partir das células isoladas da medula óssea, as CTM foram fixadas com PFA 4% durante 60 minutos e coradas com Óleo vermelho O durante 1 hora à temperatura ambiente, 30 dias após tratamento. Óleo vermelho O é um corante altamente solúvel em lipídeos e, por isso, é utilizado para verificar a indução em tecido adiposo.
5. Reprogramação neuronal
5.1 Plasmídeos
Os plasmídeos utilizados neste estudo já foram descritos previamente (Costa et al., 2009; Heinrich et al., 2010). Basicamente, eles apresentam um promotor ubíquo CAG e o gene do fator transcricional Neurog2, Sox2 ou Ascl1,
seguido de uma região IRES (do inglês “Internal Ribosomal Entry Site”) e o gene
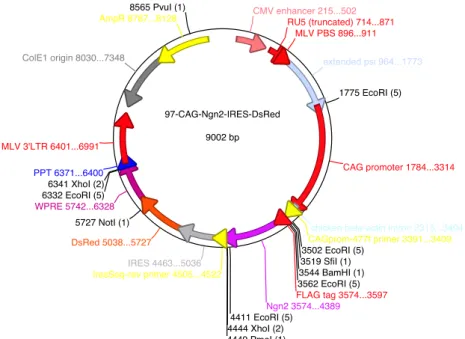
da proteína fluorescente vermelha (Dsred) ou proteína fluorescente verde (GFP). Os plasmídeos utilizados como controle apresentam um promotor ubíquo CAG e o gene da proteína fluorescente vermelha (Dsred) ou proteína fluorescente verde (GFP). Afim de simplificar a nomenclatura desses plasmídeos, nós adotamos a seguinte denominação: Sox2-GFP, Ascl1-Dsred, Neurog2-Dsred, Controle-Dsred e Controle-GFP. O mapa do plasmídeo contendo Neurog2-DsRed é mostrado na figura 4, para exemplificar a estrutura gênica dos constructos.
Os plasmídeos foram amplificados em Escherichia coli através de transfecção química e purificados utilizando kits livres de endotoxinas Maxiprep (Invitrogen). A concentração e pureza dos vetores amplificados foram mensuradas no espectrofotômetro. Soluções a 1μg/μL foram preparadas em tampão TE e armazenadas a -20°C.
Figura 5:Mapa esquemático do plasmídeo Neurog2-DsRed, mostrando algumas de suas características.
5.2 Reprogramação genética
Na transfecção elétrica utilizamos o 4D-Nucleofector (Lonza), seguindo o protocolo recomendado para CTM, "P3 Primary Cell 4D-Nucleofector X Kit"
(Lonza). Após a nucleofecção as células foram plaqueadas com alfa-MEM + 10% SFB na densidade de 1x105 células/cm2 em lamínulas de vidro previamente
tratadas com Poli-D-lisina (SIGMA) e laminina.
Na transfecção química utilizamos Lipofectamine 2000 (Invitrogen). Para
este procedimento as células foram plaqueadas na densidade de 30.000 células/poço na placa de 24 poços (Corning) previamente tratada com Poli-D-lisina (SIGMA) e lamina (SIGMA). Após 24-72h de cultivo, quando as células apresentam 60-70% de confluência foi feita a transfecção química. Para cada reação 1 μL de cada plasmídeo (1 μg/μL) e 2 μL do reagente de Lipofectamine 2000 (Invitrogen) foram diluídos separadamente em 50 μL de Opti-MEM
(GIBCO), estas soluções incubaram por 5 minutos à temperatura ambiente. Em seguida estas soluções foram misturadas e deixadas em repouso durante 20 minutos a temperatura ambiente. Os complexos foram então adicionados às células (100 μL em cada poço), contendo 500μL de Opti-MEM em cada poço, a cultura foi incubada por 10-12 horas a 37ºC com atmosfera umidificada a 5% de CO2. Passado o período de incubação, a solução de transfecção foi retirada e
500 μL de meio de cultura adicionado em cada poço (alfa-MEM + 10% SBF + 1% antibióticos).
Após 24-72 horas da transfecção as células foram cultivadas com astrócitos corticais ou neurônios hipocampais e foi acrescido o meio de diferenciação neuronal DMEM/F12 + 2% B27 (50% do volume total). As células permaneceram em cultivo entre 15-25 dias, e foram monitoradas através do microscópio invertido (Axio Observer, ZEISS).
5.3 Cultura primária de hipocampo ou astrócitos
Com o objetivo de promover a sobrevivência e a maturação neuronal, as células transfectadas foram co-cultivadas com células hipocampais ou astrócitos corticais.
Astrócitos corticais foram isolados a partir de camundongos recém-nascidos (entre os dias pós-natais 2 e 5). O córtex foi dissecado e cortado em pequenos pedaços que foram plaqueados em garrafas 25cm2 e mantidos a 37°C
e 5% CO2 por uma semana em meio de manutenção de astrócitos: DMEM/F12
acrescido de 2% B27, 10% SFB, 5% soro de cavalo, 1% de antibióticos, EGF e FGF (10ng/µL). Após atingirem a confluência, as células foram tripsinizadas e distribuídas na densidade de 5x104 células/poço sobre as CTM.
Hipocampos de camundongos recém-nascidos (entre os dias pós-natais 0 e 4) foram dissecados e dissociados em 1mL de solução de 0,25% de tripsina/EDTA, durante 15 minutos a 37°C. A ação enzimática foi interrompida com SFB, a suspensão celular centrifugada, o sobrenadante descartado e o sedimento celular homogeneizado em DMEM/F12 com 2% B27. As células foram distribuídas sobre as CTM na densidade de 5x104 células/cm2.
6. Registro eletrofisiológico intracelular
Para registro eletrofisiológico intracelular as lamínulas foram mantidas a 37°C sobre perfusão de fluido cérebro espinhal artificial com tampão de pH (ACSF/HEPES) contendo (em mM) 140 NaCl, 5 KCl, 2 MgCl2, 2 CaCl2, 10 HEPES, 10 glicose e 6 sacarose, pH 7.35. As pipetas de vidro foram preenchidas com uma solução interna contendo (em mM) 17.5 KCl, 122.5 K-gluconato, 9 NaCl, 1 MgCl2, 3 Mg-ATP, 0.3 GTP-Tris, 1 HEPES e 0.2 EGTA. Os dados foram adquiridos usando um amplificador de patch clamp (Axopatch 200B, Molecular
Devices, USA) e analisados usando Matlab (Mathworks, USA) (Leão et al., 2010).
7. Imageamento de cálcio
Para imageamento intracelular de cálcio, o indicador de cálcio Oregon
green BAPTA-1 AM (Invitrogen) foi diluído em Ácido Plurônico F-127 (Invitrogen)
na concentração de 2,5mM. Imediatamente antes do imageamento, esta solução foi diluída na concentração de 10μM em uma solução salina a 0,9%. As células foram incubadas nesta solução durante 1 hora, em seguida as células foram lavadas com salina 0,9% e mantidas a 37ºC com atmosfera umidificada a 5% de CO2 durante 1 hora. Durante o imageamento de cálcio, as células foram
mantidas a 37°C sobre perfusão de uma solução salina 0,9% no microscópio de fluorescência (Zeiss). As imagens foram adquiridas com objetiva de imersão de 20X, utilizando o Micro-Manager juntamente com o processador de imagens ImageJ. Mudanças na intensidade da fluorescência foram mensuradas utilizando o ImageJ e definidas como ΔF/F=(F1-F0)/F0, sendo F0 a média dos dez valores
iniciais de cada campo analisado.
8. Fixação e imunocitoquímica
Ao final de cada experimento foi realizada imunocitoquímica com o intuito de amplificar o sinal fluorescente das células transfectadas e caracterizar as células diferenciadas de acordo com a expressão de marcadores neuronais. As células foram fixadas com 4% paraformaldeído em solução tampão (PB), por 10 minutos, seguido de três lavagens com PBS 10 mM. Para imunocitoquímica as células foram incubadas por 12h com os anticorpos primários em solução de PBS 10 mM + 0,5% Triton-X100 + 10% soro normal de cabra (NGS) a 4oC em
câmara úmida. Os anticorpos primários utilizados neste estudo foram o anti-βIII -tubulina (SIGMA) e anti-major microtubule associated protein (anti-Map2; Sigma)
para identificar neurônios, anti-Vesicular GABA Amino Acid Transporter
(anti-vGAT) e anti-vesicular glutamate transporter 1 (anti-vGLUT 1) para identificar o subtipo neuronal gerado, e anti-GFP (anti-Green Fluorescent Protein, Aves Labs, Inc.) e anti-RFP (anti-Red fluorescent protein, Rockland) para marcação das
células transfectadas. Após três lavagens de 10 minutos em PBS 10mM, o material foi incubado com os anticorpos secundários por 2 horas a temperatura ambiente protegido da luz, os anticorpos secundários utilizados foram
mouse IgG, anti-rabbit IgG, anti-guinea pig e anti-Chicken IgG (Invitrogen),
conjugados a diferentes fluoróforos. Findo este período, foram feitas mais três lavagens com PBS e os núcleos das células corados com DAPI (4’-6’-diamidino-2-fenil-indol) 0,02 mg/ml em PBS por 5 minutos (o DAPI forma complexos fluorescentes com o DNA, através da sua ligação a regiões ricas em AT, que são excitados com comprimento de onda de 350 nm). Os espécimes foram montados em Aqua Poly/Mount (Polysciences) e analisados por microscopia de fluorescência (Axio Observer, ZEISS) e confocal (LSM 710, ZEISS).
9. Análise estatística e representação gráfica
Todos as análises estatísticas utilizadas neste trabalho foram realizadas utilizando o GraphPad Prism 5, com exceção dos dados do registro eletrofisiológico que foram analisados através do Matlab. Os dados representados em gráficos de barra mostram a média mais o erro padrão. Testes estatísticos utilizados são indicados ao longo da seção de resultados. Para este estudo, adotamos como intervalo de confiança 95%.
IV. RESULTADOS
1. Diferenciação das células da medula óssea de camundongos em tecidos
mesenquimais
CTM são capazes de originar tecidos ósseo, cartilaginoso e adiposo (Soleimani e Nadri, 2009; Zhu et al., 2010). Com a finalidade de verificar a natureza das células isoladas da medula óssea de camundongos e utilizadas em nossos experimentos de reprogramação celular, nós utilizamos diferentes protocolos de indução para avaliar a capacidade das células diferenciarem em tecidos adiposo e ósseo.
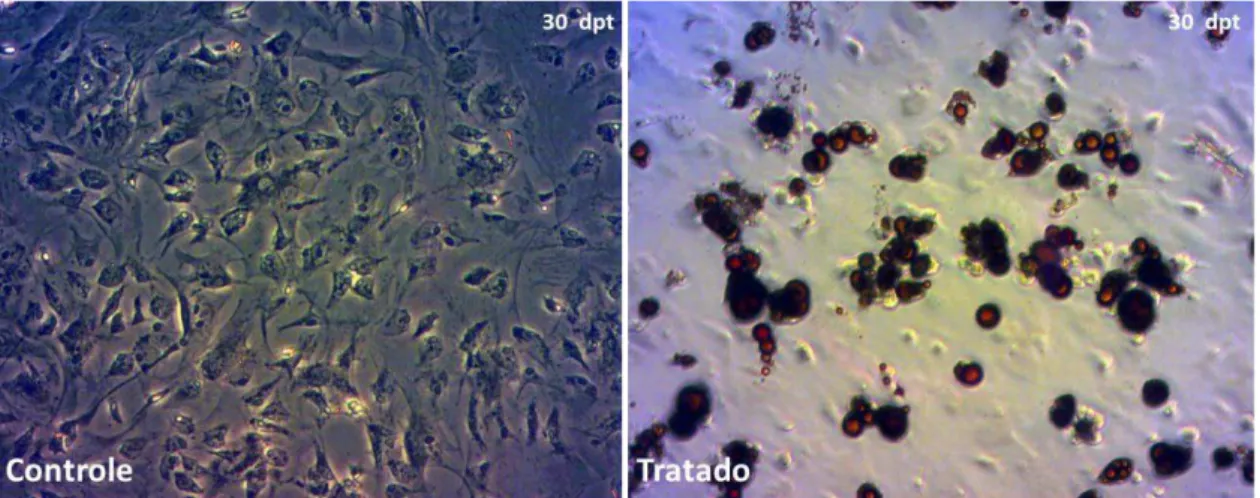
Para avaliar o potencial de diferenciação das células isoladas da medula óssea de camundongos em adipócitos, nós expusemos as CTM murinas a 30 dias de tratamento com dexametasona, insulina, indometacina e rosiglitazona, e ao final deste período, as células foram coradas com óleo vermelho O (figura 6). O tratamento com indutores adipogênicos ocasionou a formação de acúmulos de gordura nas células isoladas da medula óssea a partir de diferentes doadores (n=3 experimentos independentes), indicando que as células cultivadas tinham potencial osteogênico (figura 6).
Figura 6:Formação de adipócitos nas mCTM 30 dias após o tratamento com indutores de diferenciação adipogênica. Coloração com óleo vermelho O nas mCTM 30 dias pós-tratamento (dpt) com dexametasona, insulina, indometacina e rosiglitazona. A, Condição controle B, Células tratadas com protocolo de diferenciação adipogênica. Note a formação de vacúolos de gordura nesta condição (coloração vermelha) e ausência dos mesmos na condição controle.
De maneira similar, quando expostas a condições de cultivo com indutores osteogênicos as CTM murinas formaram uma matriz extracelular rica em cálcio, como evidenciado pela coloração com Alizarina vermelho (figura 7), indicando a diferenciação em células ósseas.
Figura 7:Formação de osteócitos nas mCTM 30 dias após o tratamento com indutores de diferenciação osteogênica. Coloração com Alizarina vermelho S nas mCTM 30 dias pós-tratamento (dpt) com β-glicerofosfato, dexametasona e ácido ascórbico. A, Condição controle B, Células tratadas com protocolo de diferenciação osteogênica. Note a formação de acúmulos de cálcio nesta condição (coloração vermelha) e ausência dos mesmos na condição controle.
Por fim, as CTM isoladas da medula óssea de camundongos puderam ser mantidas em estado proliferativo através de sucessivas passagens. Em conjunto, estes resultados indicam que as células isoladas da medula óssea de camundongos apresentam capacidade de auto renovação e multipotência, podendo se diferenciar em células de distintos tecidos mesenquimais, como tecido ósseo e adiposo, sob determinadas condições in vitro.
2. Expressão de genes pró-neurais induz reprogramação das CTM murinas
em neurônios
Para investigar se a expressão de genes pró-neurais é capaz de reprogramar células-tronco mesenquimais em neurônios, nós realizamos a transfecção elétrica nas células isoladas da medula óssea de camundongos com os plasmídeos contendo Sox2-GFP e Ascl1-DsRed, ou apenas controles (GFP e DsRed). Após dois dias de cultivo (figura 8A e B), observamos a expressão das proteínas repórteres, que se manteve por até 3 semanas (figuras 8 e 9). Virtualmente, todas as células transfectadas receberam os dois plasmídeos, indicando que o método de nucleofecção é adequado para os experimentos de reprogramação das CTM murinas mediante a expressão sinérgica de genes pró-neurais, como por exemplo, Sox2 e Ascl1.
Figura 8:Expressão das proteínas repórteres nas mCTM 2 dias após a nucleofecção. GFP (verde), Dsred (vermelho). A, Células transfretadas com Sox2-GFP e Controle-Dsred. B, Células transfretadas com Sox2-GFP e Ascl1-Dsred. Observe que a maioria das células apresentam ambas as fluorescências (amarelo).
A análise do número de células transfectadas 10 dias após a nucleofecção revelou uma eficiência média de 26% para ambas as condições (figura 9): Sox2-GFP mais Controle-Dsred (26,6% células Sox2-GFP e Dsred positivas, desvio padrão=5,71, um experimento independente feito em triplicata, n=164 células transfectadas) e Sox2-GFP mais Ascl1-Dsred (26,6% células GFP e Dsred positivas, desvio padrão=10,45, um experimento independente feito em triplicata, n=332 células transfectadas).
0 10 20 30 40
C
él
u
las t
ran
sf
ect
ad
as/
to
tal
(%
)
Figura 9:Eficiência média da nucleofecção nas mCTM 10 dias após a transfecção. O gráfico mostra a proporção de células transfectadas com Sox2-GFP e Controle-Dsred (barra branca), e Sox2-GFP e Ascl1-Dsred (barra preta), na terceira passagem, n=1 experimento em triplicata. Média + erro padrão, teste T para medidas não pareadas.
Para avaliarmos alterações morfológicas e a expressão de marcadores neuronais nas células transfectadas, as culturas foram processadas por imunocitoquímica 20 dias após a transfecção utilizando anticorpos para as proteínas GFP, RFP e β-III tubulina.
A B
Sox2+Dsred Sox2+Ascl1
Na ausência do co-cultivo com hipocampo não foram encontradas células transfectadas com Sox2-GFP e Controle-Dsred (figura 10A), tampouco com Sox2-GFP e Ascl1-Dsred (figura 10B), apresentando morfologias indicativas de aquisição de um fenótipo neuronal, também não foi observada expressão do marcador neuronal β-III tubulina nestas células (figura 10A’’’ e 10B’’’).
Figura 10:Na ausência do co-cultivo, a expressão de Sox2 ou Sox2 mais Ascl1 nas mCTM não altera morfologia nem induz expressão de β-III tubulina. Imunofluorescência das mCTM após 20 dias da Nucleofecção (na terceira passagem) na ausência de co-cultivo. Dsred
(vermelho), GFP (verde), β-III tubulina (branco) e DAPI (azul). A, células transfectadas com Sox2-GFP e Controle-Dsred; e B, células transfectadas com Sox2-GFP e Ascl1-Dsred.
Por outro lado, quando co-cultivadas com células hipocampais, 44% das células que receberam os plasmídeos Sox2-GFP e Ascl1-Dsred apresentaram mudanças na sua morfologia (figura 11C, n=227 células; 1 experimento em triplicata), caracterizadas pela redução do corpo celular e extensão de vários processos (figura 11B). Além disso, estas células passaram a expressar o marcador neuronal β-III tubulina após 20 dias da transfecção (figura 11B’’’). Apenas 7% das células transfectadas com Sox2-GFP e Controle-Dsred exibiram esse tipo de alteração morfológica e expressaram β-III tubulina (figura 11C, n=215 células; 1 experimento em triplicada), enquanto nenhuma célula transfectada apenas com Controle-GFP e Controle-Dsred apresentou estas alterações.
0 20 40 60 80
Figura 11:Na presença de co-cultivo com células hipocampais, a expressão de Sox2 ou Sox2 mais Ascl1 nas mCTM induz aquisição de morfologia neuronal e expressão de β-III tubulina. Imunofluorescência das mCTM 20 dias após a nucleofecção e co-cultivadas com células hipocampais. GFP (verde), Dsred (vermelho), β-III tubulina (branco) e DAPI (azul). A, células transfectadas com Sox2-GFP e Controle-Dsred, a seta indica célula transfectada com morfologia ovóide (GFP+/Dsred+/β-III tubulina-). B, células transfectadas com Sox2-GFP e Ascl1-Dsred (GFP+/Dsred+/β-III tubulina+), a seta indica célula com morfologia neuronal. C, Proporção de células transfectadas que que adquiriram morfologia neuronal e expressão de β -III tubulina (“reprogramadas”). Células transfectadas com Sox2 e Ascl1 (barra preta), e Sox2 e Dsred (barra branca), n=1 experimento em triplicata. Média + erro padrão, teste T para medidas não pareadas.
A ausência de células reprogramadas após a expressão de Sox2 e Ascl1 sem co-cultivo com hipocampo pode indicar que o co-cultivo com células do hipocampo é necessário para induzir a reprogramação das CTM em neurônios. Outra possibilidade é que a presença das células do hipocampo auxilia na sobrevivência e na maturação dos neurônios induzidos.
Estes dados preliminares sugerem que as CTMs murinas podem ser reprogramadas em neurônios, através da expressão simultânea de Sox2 e Ascl1
C
Sox2+Dsred Sox2+Ascl1
C
él
u
la
s
β
-III
+
/t
ran
sf
ect
ad
as
*
na presença de células hipocampais. Contudo, faz-se necessário a realização de novos experimentos a fim de confirmar as alterações observadas e a avaliação eletrofisiológica das células reprogramadas.
3. Expressão de genes pró-neurais induz reprogramação das CTM
humanas em neurônios
Para analisar se a expressão de genes pró-neurais é capaz de induzir a reprogramação das CTM isoladas a partir do cordão umbilical humano (doravante, denominadas hCTM) em neurônios, nós introduzimos plasmídeos de DNA contendo a sequência codificante dos fatores transcricionais Sox2, Ascl1 ou Neurog2 através de transfecção química com lipofectamina. Um dia após a transfecção nós observamos a expressão das proteínas repórteres em cerca de 7% de todas as células cultivadas (figura 12). Dentre estas células que identificamos a expressão das proteínas repórteres, aproximadamente 95% foram co-transfectadas, ou seja, receberam os dois plasmídeos utilizados em cada condição (Sox2-GFP e Ascl1-Dsred; Sox2-GFP e Neurog2-Dsred; Controle-GFP e Controle-DsRed). Desta forma, o método de transfecção química é útil para avaliarmos a reprogramação celular induzida através da expressão de vários genes exógenos na mesma célula.
Figura 12: Expressão das proteínas repórteres nas hCTM do cordão umbilical após um dia da transfecção química (entre a 6ª e a 11ª passagens). Imagens em contraste de fase, GFP (verde) e Dsred (vermelho). A, Células transfectadas com os plasmídeos controles. B, Células transfectadas com Sox2-GFP e Ascl1-Dsred. C, Células transfectadas com Sox2-GFP e Neurog2-Dsred. D, Proporção de células co-transfectadas com controle (barra branca), Sox2 e Ascl1 (barra cinza) e Sox2 e Neurog2 (barra preta). Média + erro padrão, n=3 experimentos independentes, teste de Kruskal-Wallis.
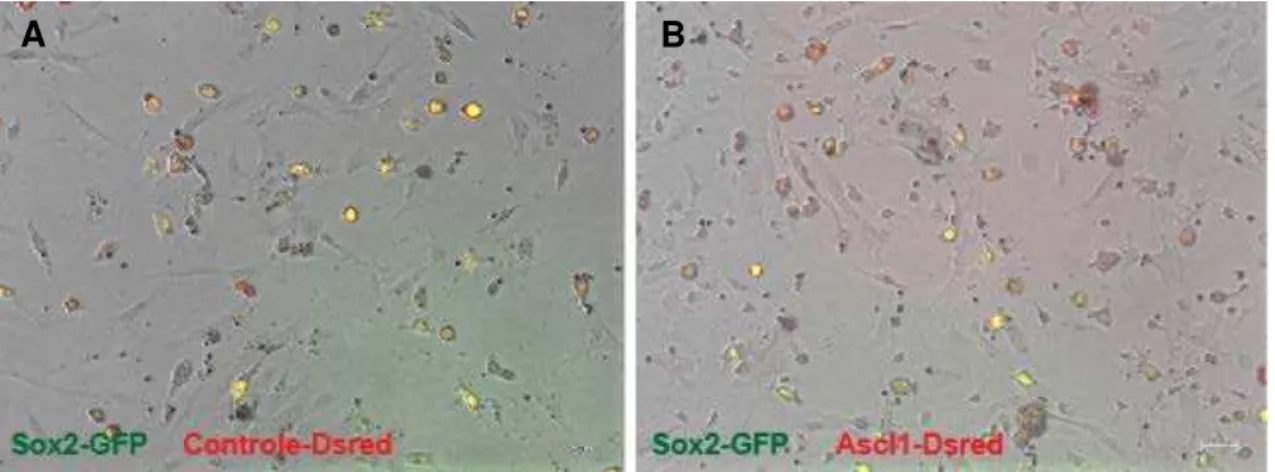
Para investigarmos se a expressão de genes pró-neurais induzia a aquisição de fenótipo neuronal nós observamos as CTM durante o cultivo celular através de um microscópio de fluorescência invertido. As células transfectadas com Sox2+Ascl1 e Sox2+Neurog2 co-cultivadas com células hipocampais
D
A’ A’’
B’ B’’
C’
C
él
ul
as t
rans
fect
adas
/t
ot
al
(
%
)
GFP+Dsred Sox2+Ascl1 Sox2+Neurog2
C’’
hipocampais apresentaram diversas alterações morfológicas, caracterizadas
por diminuição do corpo celular e extensão de processos longos e finos,
consistentes com a aquisição de um fenótipo neuronal (figura 13B e C),
enquanto as células transfectadas com plasmídeos contendo apenas os genes
que codificam as proteínas repórteres, GFP ou DsRed, não adquiriram este tipo
de alteração morfológica (figura 13A).
Figura 13: Expressão de genes pró-neurais nas hCTM induz alterações morfológicas, na presença de co-cultivo com hipocampo. hCTM do cordão umbilical após 11 dias da transfecção química na presença de co-cultivo com células hipocampais. Imagens em contraste de fase, Dsred (vermelho) e GFP (verde) A, Exemplo de célula transfectada com plasmídeos codificando as proteínas repórteres GFP e Dsred. B-C, Exemplos de hCTM reprogramadas pela expressão de Sox2 e Ascl1 (B) ou Sox2 e Neurog2 (C). As setas amarelas indicam células transfectadas com morfologia neuronal.
Com o intuito de confirmar a reprogramação das CTM em neurônios, nós
avaliamos a expressão de proteínas neuronais e alterações morfológicas nas
hCTM 15 dias após a transfecção com genes pró-neurais, utilizando métodos
imunocitoquímicos. Nós observamos que a expressão combinada de Sox2 com
Ascl1 ou com Neurog2 nas hCTM, na ausência do co-cultivo com células
hipocampais, não foi suficiente para induzir a formação de células com
fenótipos indicativos de uma reprogramação em neurônios (figura 14). De fato,
as hCTM co-transfectadas com genes pró-neurais mantinham uma morfologia
ovóide e achatada (figura 14B e C), mantendo-se semelhantes à condição
controle (figura 14A), e não expressavam a proteína neuronal Map2 (figura
14B’’’ e C’’’).
Figura 14: Expressão combinada de Sox2 com Ascl1 ou Neurog2 nas hCTM, na ausência de co-cultivo, não altera morfologia das células e expressão de Map2. Imunofluorescência das hCTM após 15 dias da transfecção com lipofectamina na ausência de co-cultivo. Dsred (vermelho), GFP (verde), Map2 (branco) e DAPI (azul). A, células transfectadas com controle-GFP e controle-Dsred; B, células transfectadas com Sox2-GFP e Ascl1-Dsred. C, células transfectadas com Sox2-GFP e Neurog2-Dsred.
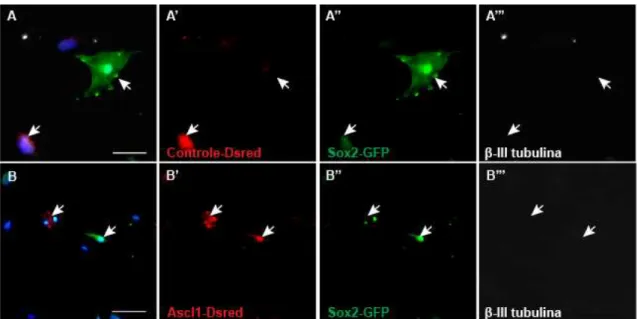
Por outro lado, quando co-cultivadas na presença de células
hipocampais após 15 dias da transfecção com fatores pró-neurais as hCTM
adquiriram uma morfologia neuronal típica, caracterizada por corpo celular
pequeno e extensão de processos longos e finos (figura 15B e C). Além disso,
as hCTM passaram a expressar Map2 após 15 dias da transfecção
concomitante de Sox2 e Ascl1 (figura 15B’’’) ou Sox2 e Neurog2 (figura 15C’’’).
Em contraste, na condição controle, as células permaneceram com morfologia
ovóide e alongada (figura 15A, célula GFP e RFP positiva) e não expressaram
Map2 (figura 15A’’’), mesmo quando co-cultivadas com neurônios hipocampais
(figura 15A’’’, seta branca indica neurônio do hipocampo, identificado pela
ausência das proteínas repórteres e expressão de Map2).
Figura 15: Expressão de genes pró-neurais nas hCTM induz alterações morfológicas e expressão de marcadores neuronais maduros, na presença de co-cultivo com hipocampo. Imunofluorescência das hCTM após 15 dias da transfecção química na presença de co-cultivo com células hipocampais. Dsred (vermelho), GFP (verde), Map2 (branco) e DAPI (azul). A, Exemplo de célula transfectada com plasmídeos codificando as proteínas repórteres GFP e Dsred. B-C, Exemplos de hCTM reprogramadas pela expressão de Sox2 e Ascl1 (B) ou Sox2 e Neurog2 (C). As setas amarelas indicam células transfectadas com morfologia neuronal