YVETTE MAY COULSON-THOMAS
Estudo da regeneração de lesões no sistema
nervoso central por terapia celular
combinada à terapia gênica
Tese preparada no Departamento de Bioquímica
durante o curso de Pós-Graduação em Biologia
Molecular e apresentada à Universidade Federal de São
Paulo – Escola Paulista de Medicina, para obtenção do
título de Doutor em Ciências
Orientadora: Profa. Dra. Marimélia A. Porcionatto
YVETTE MAY COULSON-THOMAS
Estudo da regeneração de lesões no sistema nervoso
central por terapia celular combinada à
terapia gênica
Tese preparada no Departamento de Bioquímica durante
o curso de Pós-Graduação em Biologia Molecular e
apresentada à Universidade Federal de São Paulo –
Escola Paulista de Medicina, para obtenção do título de
Doutor em Ciências
Orientadora: Profa. Dra. Marimélia A. Porcionatto
Coulson-Thomas, Yvette May
Estudo da regeneração de lesões no sistema nervoso
central por terapia celular combinada à terapia gênica.
São Paulo, 2008.
211p
Tese (Doutorado) – Universidade Federal de São Paulo,
Escola Paulista de Medicina.
AGRADECIMENTOS
À minha orientadora, Profa. Dra. Marimélia Porcionatto, pelos ensinamentos adquiridos, conduta científica exemplar e amizade.
À Profa. Dra. Helena Bonciani Nader e ao Prof. Dr. Carl Peter von Dietrich (“in memoriam”) pela oportunidade para a realização deste trabalho e exemplo de conduta profissional e dedicação à pesquisa.
À minha mãe, Margaret, pelo amor, amizade, dedicação e apoio na minha carreira profissional. Você é muito especial.
À minha irmã, Vivien, pelo amor, amizade e constante disposição em me ajudar. Você é muito querida.
Ao meu pai, Colin, pelo amor, confiança depositada em mim e interesse constante no meu trabalho.
Ao meu irmão, Trystan, por seu amor e amizade.
Aos meus tios, Christine e Valter, e meus primos, Heidi e Bill, pelo amor, carinho e apoio.
(“In memoriam”) Aos meus avós, Temple, Delcie, Coulson e Elsie, pelo carinho que tenho por eles.
Aos meus amigos Aline, Amanda, Carol Bessa, James, Juliana Dreyfuss, Rafael, Tarsis, Theo e Vinício pelo carinho e amizade.
A todos os amigos da Biologia Molecular, pelo convívio agradável: Ângela, Arnaldo, Bruno, Camila, Carol Córdula, Carol Bonaldi, Cilene, Clarice, Cris, Daniela, Duda, Eloah, Fábio, Gabriel, Giovani, Itatiana, Juliana Dominato, Keila, Nelson, Pamela, Renan, Ricardo, Rodrigo, Sarah, Tábata, Thais Jarrouge, Thais Peretti, Thérèse, Valquíria.
À Ana Paula, Azuléia, Carol Ariza, Carol Meloni, Carol Moreira, Daniela Suzuki, Flávia, Gui Mi Ko, Maria Emília, Michelle, Ritchelli, Thais Filippo, Valderez e Vladimir pelo companheirismo.
À Elsa e Isabel pela disposição em ajudar e dedicação ao trabalho.
Às secretárias, Patrícia, Juliana, Ana Maria, Sônia, Márcia e Bete, pelo convívio alegre e disposição a ajudar.
Ao Paulo Michelacci pela simpatia.
Aos funcionários Felipe e José Airton, pela dedicação ao trabalho.
À Dona Ju e à Dona Vera, pelo convívio alegre e por proporcionar as condições ideais para o nosso trabalho diário.
À Dona Hilda pela ajuda técnica e alegria.
À Caroline, Elizabeth e Fernanda pela ajuda técnica e convívio alegre.
Ao Prof. Dr. Edvaldo Trindade pelos ensinamentos.
Ao CNPq pela bolsa de estudos e pelos recursos oferecidos para elaboração deste trabalho de tese (inclusive os recursos financeiros do projeto de células tronco #552178/05-5, MCT/CNPq, DECIT/MS, Fundo Setorial de Biotecnologia/CT-BIOTECNOLOGIA).
Índice
Índice
1 Introdução... 1
1.1 Injúria ao sistema nervoso central... 1
1.2 Estrutura, classificação e localização dos glicosaminoglicanos e proteoglicanos... 5
1.2.1 Glicosaminoglicanos... 5
1.2.2 Estrutura e propriedades do glicosaminoglicano condroitim sulfato... 8
1.2.3 Estrutura, classificação e localização dos proteoglicanos... 10
1.3 Proteoglicanos de condroitim sulfato no sistema nervoso central... 14
1.4 Condroitinases... 18
1.5 Inibição da regeneração neuronal por proteoglicanos de condroitim sulfato.... 22
1.6 Outros componentes da matriz extracelular que podem participar na inibição da regeneração neuronal... 22
1.7 Regeneração do sistema nervoso central após terapia celular... 24
2 Objetivos... 27
3 Material e Métodos... 28
3.1 Reagentes... 28
3.2 Desenho dos primers para amplificação do gene que codifica para a condroitinase AC a partir do DNA genômico de Flavobacterium heparinum... 28
3.3 Reação em cadeia da DNA polimerase (PCR)... 29
3.4 Clonagem do produto de PCR no plasmídeo de expressão pcDNA3.1(+)... 30
3.5 Seqüenciamento do segmento de DNA que codifica para a condroitinase AC clonado no plasmídeo pcDNA3.1(+)... 30
Índice
3.7 Obtenção e cultivo de células mononucleadas derivadas da medula óssea de
camundongo adulto... 33
3.8 Cultivo de células ovarianas de hamster chinês... 34
3.9 Cultivo de células de gliosarcoma de rato... 34
3.10 Transfecção... 35
3.11 Análise da expressão da condroitinase AC... 36
3.12 Marcação metabólica de condroitim sulfato com [35S]-sulfato de sódio... 36
3.13 Obtenção do extrato celular e meio condicionado de células CHO e 9L, contendo glicosaminoglicanos metabolicamente marcados com [35S]-sulfato de sódio... 37
3.14 Análise da secreção e atividade enzimática da condroitinase AC... 37
3.15 Marcação de proteoglicanos e glicosaminoglicanos de células mononucleadas derivadas da medula óssea de camundongo adulto... 38
3.16 Degradação in vitro de glicosaminoglicanos de células mononucleadas derivadas da medula óssea adulta, utilizando as enzimas condroitinase AC, condroitinase ABC, heparitinase I e heparitinase II, ou extrato bruto... 38
3.17 Produção de lesões no SNC de camundongos C57Bl/6 e transplante de células mononucleadas derivadas da medula óssea de camundongo GFP+ adulto.. 39
3.18 Imunofluorescência... 41
3.19 Coloração por cresil violeta e hematoxilina/eosina... 42
3.20 Análise funcional (teste da marcha)... 43
4 Resultados... 45
4.1 Construção de um vetor para expressão eucariótica contendo o gene da condroitinase AC bacteriana... 45
Índice
eucarióticas... 54
4.4 Células eucarióticas transfectadas com o vetor contendo o gene para condroitinase AC secretam a enzima ativa in vitro... 56
4.5 Células mononucleadas derivadas da medula óssea adulta não sintetizam condroitim sulfato... 59
4.6 Clonagem do gene da condroitinase AC no vetor de expressão pEGFP-N1... 62
4.7 Secreção de condroitinase AC ativa em lesão no SNC murino... 66
4.8 Efeitos da secreção de condroitinase AC sobre a distribuição de glia reativa na região próxima à lesão... 70
4.9 Efeitos do transplante de células mononucleadas derivadas da medula óssea secretando condroitinase AC sobre a organização tissular do SNC na região próxima à lesão... 79
4.10 Avaliação funcional dos animais submetidos à combinação de terapia celular e terapia gênica... 80
5 Discussão... 96
6 Conclusão... 104
7 Referências Bibliográficas... 105
8 Resumo... 127
9 Abstract... 128
10 Abreviaturas... 129
Índice
12 Anexo 1... 138
Índice
Índice de Figuras
Figura 1. Representação esquemática de uma lesão por corte, na medula espinhal... 2
Figura 2. Proteoglicanos de condroitim sulfato inibem a regeneração axonal e induzem a formação de terminais distróficos nos axônios... 3
Figura 3. Unidades estruturais dos glicosaminoglicanos... 7
Figura 4. Região de ligação da cadeia de glicosaminoglicano ao esqueleto protéico... 11
Figura 5. Estrutura dos proteoglicanos de condroitim sulfato do sistema nervoso central... 14
Figura 6. Esquema hipotético da composição das redes perineuronais... 18
Figura 7. Especificidade das condroitinases ABC, AC e C... 21
Figura 8. Vetor de expressão pcDNA3.1(+)... 29
Figura 9. Vetor de expressão pEGFP-N1... 33
Figura 10. Coordenadas das lesões... 41
Figura 11. Teste de marcha... 44
Figura 12. Clonagem do gene da condroitinase AC no vetor pcDNA3.1(+)... 47
Figura 13. Verificação da inserção do gene da condroitinase AC no vetor pcDNA3.1(+)... 47
Figura 14. Seqüenciamento do gene da condroitinase AC clonado no vetor pcDNA3.1(+)... 50
Figura 15. Teste do protocolo de transfecção: determinação da quantidade de lipofectamina... 52
Figura 16. Teste do protocolo de transfecção para a linhagem celular de gliosarcoma e para células mononucleadas derivadas da medula óssea... 53
Figura 17. Teste do tempo de expressão de GFP por células mononucleadas derivadas da medula óssea transfectadas com plasmídeo pEGFP-N1... 54
Figura 18. Células de gliosarcoma de rato transfectadas com o vetor pcDNA3.1(+)-condroitinase AC expressam RNAm da enzima... 55
Figura 19. Células mononucleadas derivadas da medula óssea de camundongos transfectadas com o vetor pcDNA3.1(+)-condroitinase AC expressam RNAm da enzima... 55
Índice
Figura 21. Células de gliosarcoma e CHO transfectadas com o vetor contendo o gene da condroitinase AC secretam a enzima recombinante na forma ativa... 58 Figura 22. Células mononucleadas derivadas da medula óssea expressam
glicosaminoglicanos com migração diferente dos glicosaminoglicanos padrões... 59 Figura 23. Glicosaminoglicanos expressos por células mononucleadas da medula
óssea não são degradados por condroitinases bacterianas... 61 Figura 24. Clonagem do gene da condroitinase AC no vetor de expressão pEGFP-N1. 63 Figura 25. Células CHO transfectadas com o vetor pEGFP-condroitinase AC
secretam a enzima com baixa atividade... 64 Figura 26. A expressão da quimera condroitinase AC-GFP diminui com o tempo... 65 Figura 27. Células mononucleadas derivadas da medula óssea expressam
condroitinase AC ativa quando transfectadas com o vetor pcDNA3.1(+)-condroitinase AC... 67 Figura 28. Células mononucleadas derivadas da medula óssea transplantadas no local da lesão migram para regiões internas do córtex cerebral... 69 Figura 29. Células mononucleadas derivadas da medula óssea podem migrar para
longe do local de transplante... 69 Figura 30. Células mononucleadas derivadas da medula óssea expressando
condroitinase AC promovem aumento da glia reativa em torno da lesão... 71 Figura 31. A resposta inflamatória a células derivadas da medula óssea expressando condroitinase AC persiste duas semanas após transplante... 72 Figura 32. Células mononucleadas derivadas da medula óssea expressando
condroitinase AC mantêm o aumento da glia reativa em torno da lesão após 4
semanas... 73 Figura 33. Neurônios presentes em lesão tratada com transplante de células derivadas da medula óssea expressando condroitinase AC expressam GAP-43... 75 Figura 34. Neurônios presentes em lesão tratada com transplante de células derivadas da medula óssea expressando condroitinase AC expressam sinaptofisina... 76 Figura 35. Co-localização de sinaptofisina e β-tubulinaIII em neurônios presentes em lesão tratada com transplante de células derivadas da medula óssea expressando
Índice
Figura 36. Em regiões sem lesão axônios apresentam orientação que é perdida em
regiões próximas à lesão... 78
Figura 37. Transplante de células mononucleadas derivadas da medula óssea expressando condroitinase AC causam piora da lesão, com desorganização do tecido... 80
Figura 38. Medida do ângulo da inclinação formada entre a pata dianteira e a pata traseira em cada passo... 81
Figura 39. Impressão das patas de animais controle e animais submetidos a transplante de células mononucleadas derivadas da medula óssea transfectadas com pcDNA3.1(+)-condroitinase AC... 82
Figura 40. Distribuição dos ângulos formados entre a pata dianteira e a pata traseira em cada passo de animais controle e animais submetidos a transplante de células mononucleadas derivadas da medula óssea transfectadas com pcDNA3.1(+)-condroitinase AC... 83
Figura 41. Avaliação funcional acessada pela quantificação de passos apresentando angulação anormal entre as patas dianteira e traseira de um mesmo lado durante o teste de marcha... 86
Figura 42. Avaliação da ocorrência de passos com angulação normal oito semanas após a lesão... 91
Índice de Tabelas
Tabela 1. Características estruturais dos glicosaminoglicanos... 6Tabela 2. Proteínas que se ligam ao condroitim sulfato... 9
Tabela 3. Características estruturais e localização de alguns proteoglicanos... 12
Introdução
1
1 Introdução
1.1 Injúria ao sistema nervoso central
Dados da literatura mostram que a incidência anual de traumatismo
crânio-encefálico (TCE) fatal e não fatal é de 200/100.000 habitantes nos EUA (Kraus, 1993),
281/100.000 habitantes em Aquitaine, França (Tiret e col., 1990), 100/100.000 habitantes
na Austrália (Tate e col., 1998) e 341/100.000 habitantes em Brasília (Masini, 1994).
Koizumi e col. (2000) mostraram que a taxa de internação por TCE na rede hospitalar do
município de São Paulo em 1997 foi de 0,36/1000 habitantes, com um tempo de internação
predominante de até 7 dias e uma taxa de mortalidade hospitalar de 10,2%. Estima-se que a
mortalidade por TCE, em nível populacional, seja de 26 a 39/100.000 habitantes. As
seqüelas neurológicas resultantes do TCE incluem distúrbio cognitivo, seqüela motora em
hemicorpo, paralisia facial periférica, monoparesia, tetraparesia, distúrbio visual, afasia,
estrabismo e ataxia da marcha. O tratamento baseia-se em fisioterapia e obtêm-se ligeira
melhora dos pacientes. Entretanto, não existem drogas disponíveis para reparar injúria à
medula espinhal ou ao encéfalo. Assim, o estudo de injúria e regeneração do sistema
nervoso é importante para o desenvolvimento de futuros tratamentos.
Do ponto de vista celular e molecular, lesões no sistema nervoso central (SNC),
ocasionadas por traumas ou condições patológicas, resultam em reação glial, levando
eventualmente à formação de uma cicatriz glial (Fawcett e Asher, 1999; Silver e Miller,
2004). A resposta glial à lesão recruta precursores de oligodendrócitos, astrócitos, células
meningiais e micróglia que irão constituir a cicatriz glial. As primeiras células a chegarem
ao local lesado são os macrófagos vindos da corrente sanguínea e micróglia migrando do
tecido circundando a lesão. Após três a cinco dias, precursores de oligodendrócitos são
recrutados à região da injúria, vindos do tecido circundante. Se a lesão rompe as meninges,
células meningiais e fibroblastos também migram para a região para cobrirem a superfície
exposta do SNC. Finalmente, os astrócitos migram para a região lesada e se dividem para
preencher o espaço resultante da lesão (Fawcett e Asher, 1999; Silver e Miller, 2004)
Introdução
2
Figura 1. Representação esquemática de uma lesão por corte na medula espinhal.
Devido ao rompimento das meninges, fibroblastos invadem a lesão. Cavitação ocorre no centro da lesão que é preenchida por macrófagos vindos da corrente sanguínea. O alinhamento dos astrócitos é alterado na região da lesão e estas células sofrem hipertrofia se tornando astrócitos reativos. Os astrócitos reativos produzem proteoglicanos de condroitim sulfato, que inibem o crescimento axonal e induzem a formação de axônios distróficos. MEC: Matriz extracelular. Figura modificada de Silver e Miller, 2004.
No local lesado, as células secretam fatores inibitórios da extensão axonal
impedindo a regeneração neuronal. Até o momento temos o conhecimento de quatro
moléculas inibitórias secretadas por oligodendrócitos que apresentam atividade inibitória
do crescimento axonal: PGCS (proteoglicanos de condroitim sulfato), MAG (
myelin-associated glycoprotein), OMgp (oligodendrocyte myelin glycoprotein) e Nogo. Estas
últimas três são proteínas de superfície celular que interagem com o complexo NgR (Nogo
receptor)/p75 (p75 neurotrophin receptor)/LINGO-1 (leucine rich repeat transmembrane
protein). Os PGCS além de inibirem o crescimento axonal induzem a formação de cones de crescimento distróficos (Davies e col., 1999; Tom e col., 2004; Silver e Miller, 2004)
(Figura 2). Estes terminais distróficos foram primeiro descritos por Ramón y Cajal (1928) e
são dinâmicos (Kerschensteiner e col., 2005), reciclando a membrana na extremidade guia
e alterando o repertório de integrinas (Tom e col., 2004). Assim, o crescimento axonal é
Introdução
3 influência inibitória dos PGCS pode ser eliminada pela administração de condroitinase
ABC, uma enzima que degrada a porção açúcar desses proteoglicanos sem alterar a cadeia
protéica (McKeon e col., 1995; Zuo e col., 1998; Yu and Bellamkonda, 2001; Grimpe e
col., 2005). Já foi demonstrado que o tratamento do SNC com condroitinase ABC após
injúria promove recuperação funcional (Moon e col., 2001; Bradbury e col., 2002; Yick e
col., 2003, 2004; Caggiano e col., 2005; Fouad e col., 2005; Steinmetz e col., 2005; Houle
e col., 2006; Yang e col., 2006; Cafferty e col., 2007).
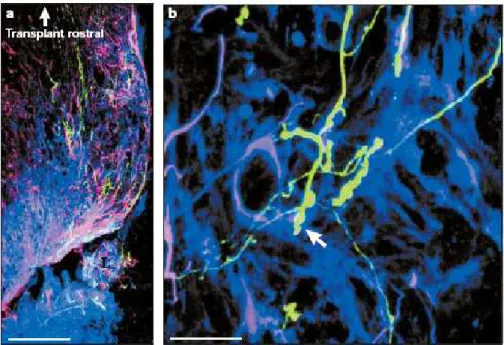
Figura 2. Proteoglicanos de condroitim sulfato inibem a regeneração axonal e induzem a formação de terminais distróficos nos axônios. Em (a), neurônios do gânglio da raiz dorsal (verde) foram transplantados rostralmente a uma lesão e estenderam axônios que alcançaram a periferia da lesão, mas não o centro devido aos PGCS (azul). A seta em (b) mostra um cone de crescimento distrófico. L: Lesão por corte na medula espinhal. Barras de escala 250μm em (a) e 25μm em (b). Figura modificada de Silver e Miller, 2004.
Dados da literatura mostram que todos os tipos de células da glia produzem PGCS
em resposta à injúria neuronal. Por exemplo, as células precursoras de oligodendrócitos
produzem NG2 (Asher e col., 2001) e versicam (Asher e col., 2002), os oligodendrócitos
produzem NG2, DSD-1/fosfacam e versicam (Asher e col., 2002), os astrócitos produzem
brevicam e neurocam (Matsui e col., 2002) e as células meningiais produzem NG2
Introdução
4 O local lesado também contém restos de oligodendrócitos e mielina. Diferente do
sistema nervoso periférico (SNP), no SNC ocorre uma ativação insuficiente da micróglia e
o aparecimento de fagócitos pode levar semanas (Perry e col., 1987; Stoll e col., 1989;
George e Griffin, 1994). Assim, a produção por oligodendrócitos das proteínas associadas à
mielina citadas acima persiste por mais tempo do que no SNP (Kidd e col., 1990).
A injúria axonal inicia um processo de degeneração no local lesado, denominado de
degeneração walleriana (Waller, 1850). A incapacidade das fibras nervosas regenerarem
leva à morte do corpo celular correspondente. Além disso, fibras não danificadas, mas
próximas aos axônios danificados, são afetadas pelo espalhamento lateral da injúria (Yoles
e Schwartz, 1998a) e sofrem degeneração secundária (Yoles e Schwartz, 1998a; Faden,
1993; McIntosh, 1993; Hovda e col., 1991; Zivin e Choi, 1991). A degeneração secundária
parece ser mediada por agentes como glutamato (Yoles e Schwartz, 1998b), radicais livres
ou mediadores de toxicidade, alguns dos quais relacionados exclusivamente com injúria
axonal do SNC e não injúria direta a corpos celulares (Yoles e Schwartz, 1998b; Yoshino e
col., 1991; Liu e col., 1994; Bazan e col., 1995; Ransom e col., 1990).
Quando a glia reativa é seletivamente removida a degeneração secundária é
exacerbada (Bush e col., 1999; Faulkner e col., 2004). Estes autores observaram que a
cicatriz glial serve para reparar a barreira hematocerebral, prevenir infiltração de leucócitos
e estabelecer uma barreira entre a região da lesão e o resto do SNC, ainda não danificado,
impedindo maiores danos. Assim, embora as células da cicatriz glial produzam moléculas
inibitórias da regeneração do SNC, a formação da cicatriz glial pode ser encarada como um
Introdução
5
1.2 Estrutura, classificação e localização dos glicosaminoglicanos e proteoglicanos
1.2.1 Glicosaminoglicanos
Glicosaminoglicanos receberam esta denominação de acordo com a nomenclatura
proposta por Jeanloz (1960), mas foram inicialmente denominados de mucopolissacarídeos
por Meyer (1938). São heteropolissacarídeos longos, não-ramificados, formados por
unidades repetidas de dissacarídeos constituídos por um ácido urônico (D-glucurônico ou
L-idurônico) ou açúcar neutro (galactose no queratam sulfato) e uma hexosamina
(D-glucosamina ou D-galactosamina). Além da carboxila, esses compostos apresentam
grupamentos sulfato (exceto ácido hialurônico), o que lhes atribui carga negativa elevada.
Isto atrai cátions e com isso água, explicando a alta hidrofilia desses compostos.
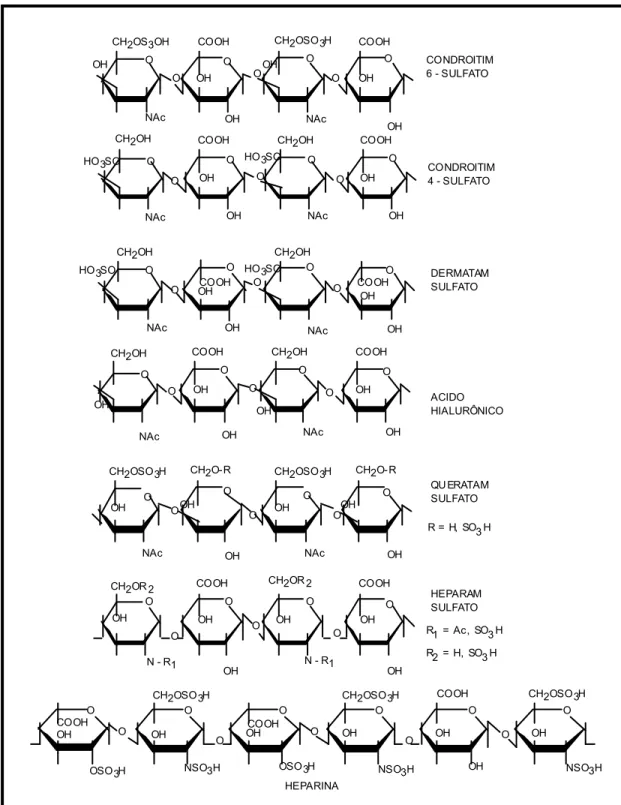
Os glicosaminoglicanos são classificados em seis tipos de acordo com suas
composições monoméricas, tipo de ligações glicosídicas intra- e inter-dissacarídicas, grau e
posição da sulfatação (Figura 3). Os tipos são: condroitim 4- e 6- sulfato (C4S, C6S),
queratam sulfato (KS), ácido hialurônico (AH), dermatam sulfato (DS), heparina e heparam
sulfato (HS) (Tabela 1).
Os glicosaminoglicanos sulfatados aparecem amplamente distribuídos na escala
filogenética, desde espongiários até mamíferos superiores (Dietrich e col., 1989; Medeiros
e col., 2000). HS, condroitim sulfato (CS) e DS apresentam uma distribuição específica em
cada tecido, independente da espécie estudada. A heparina apresenta uma distribuição
Introdução
6
Tabela 1. Características estruturais dos glicosaminoglicanos
Glicosaminoglicano (Jeanloz, 1960)
Açúcares* Posição do Sulfato
Ligação Glicosídica
Ácido hialurônico N-acetilglucosamina ácido glucurônico
- -
β(1→4) α(1→3)
Condroitim 4-sulfato N-acetilgalactosamina ácido glucurônico
4 -
β(1→4) α(1→3)
Condroitim 6-sulfato N-acetilgalactosamina ácido glucurônico
6 -
β(1→4) α(1→3)
Dermatam sulfato N-acetilgalactosamina ácido idurônico ácido glucurônico 4 - - β(1→4) α(1→3) β(1→3)
Queratam sulfato N-acetilglucosamina galactose
6 -/6
β(1→3) β(1→4)
Heparam sulfato glucosamina N-acetilglucosamina ácido glucurônico ácido idurônico 2/6 6 - - α(1→4) α(1→4) β(1→4) α(1→4) Heparina glucosamina ácido glucurônico ácido idurônico 2/6 - 2 α(1→4) β(1→4) β(1→4) *
Introdução
7
HO3SO
OH
NAc NAc OH
O O
COOH
OH O OH
O O
COOH
OH
OH O OH
O O COOH OH OH O HEPARINA CH2OSO3H CH2OSO3H OSO3H OSO3H CH2OSO3H NSO3H NSO3H NSO3H O O OH O COOH OH OH O O O COOH OH OH O O OH
R2 = H, SO3 H R1 = Ac, SO3 H O
CH2OR 2
CH2OR 2 HEPARAM
SULFATO
N - R1 N - R1
O OH OH OH O NAc O O OH OH OH O O NAc O CH2OSO3H
CH2OSO3H CH2O-R CH2O-R
R = H, SO3 H QU ERATAM SULFATO OH
NAc NAc OH
ACIDO HIALURÔNICO O OH OH O O O COOH OH O O O COOH CH2OH CH2OH OH O COOH OH O O O COOH OH O O O CH2OH HO3SO DERMATAM SULFATO O COOH OH OH O NAc O O COOH OH OH O O NAc O O COOH OH OH OH O NAc O O COOH OH OH OH O O NAc O CH2OS3OH CH2OH CH2OH HO3SO CH2OSO3H HO3SO CONDROITIM
4 - SULFATO CONDROITIM 6 - SULFATO
CH2OH
Introdução
8
1.2.2 Estrutura e propriedades do glicosaminoglicano condroitim sulfato
O CS é formado pela polimerização de uma unidade dissacarídica repetida
constituída de um ácido glucurônico (GluA) e uma N-acetil-galactosamina (GalNAc)
(Figura 3) (revisado em Sugahara e Kitagawa, 2000). Estes heterodímeros podem ser
sulfatados em diferentes posições por enzimas denominadas CS sulfotransferases (CSSTs)
(revisado em Properzi e col., 2003). As CSSTs conhecidas até o momento são três
isoformas de condroitim 4 sulfotransferase (EC 2.8.2.5), duas isoformas de condroitim 6
sulfotransferase (EC 2.8.2.17), uronil 2-sulfotransferase (EC 2.8.2.-) e
N-acetilgalactosamina 4-sulfato 6-O-sulfotransferase (EC 2.8.2.33) (Habuchi, 2000). O CS
pode ser sulfatado no carbono (C) 4 da GalNAc (conhecido como CS-A ou C4S), no C6 de
GalNAc (CS-C ou C6S), no C6 de GalNAc e C2 de GluA (CS-D), ou no C4 e C6 de
GalNAc (CS-E). Esta sulfatação torna o glicosaminoglicano polianiônico, e o padrão de
sulfatação fornece uma estrutura carregada que define suas propriedades de ligar proteínas
Introdução
9
Tabela 2. Proteínas que se ligam ao condroitim sulfato
Proteína Tipo de
CS Referências
Pleiotrofina/Midkine CS-D, CS-E
Zou e col., 2000, 2003; Maeda e col., 2003; Deepa e col., 2004; Umehara e col., 2004
FGF (fibroblast growth factor) -2, -7, -10, -16, -18 CS-B, CS-E
Penc e col., 1998; Deepa e col., 2002;
Trowbridge e col., 2002 HGF/SF (hepatocyte growth factor/scatter factor) CS-B Lyon e col., 1998
HB-EGF (heparin-binding EGF-like growth factor) CS-E Deepa e col., 2002
BDNF (brain-derived neurotrophic factor) CS
Nandini e col., 2004 GDNF (glial cell line-derived neurotrophic factor) CS Nandini e col., 2004
SLC (quimocina secondary lymphoid-tissue), IP-10 (quimocina
chemokine interferon-gamma-inducible protein-10), SDF-1b
(quimocina Stromal cell-derived factor 1)
CS-E Hirose e col., 2001; Kawashima e col., 2002
MCP-1 (monocyte chemotactic protein-1) CS-A Distler e col., 2006
TNF-α (tumor necrosis factor-α) CS-E Tully e col., 2006
ADAMTS5 (aggrecanase-2) CS Zeng e col., 2006
MT3-MMP (membrane-type 3 matrix metalloproteinase) CS Iida e col., 2007
Pro-MMP-2 (pro-matrix metalloproteinase-2) CS Iida e col., 2007
Co-fator de heparina II CS-B Tollefsen e col., 1986
Fator plaquetário 4 CS-B, CS-E
Petersen e col., 1999; Kawashima e col.,
2002
CD44 CS Kawashima e col.,
2002 TSG-6 (necrosis factor-α stimulated gene-6) CS Wisniewski e col.,
2005
L-, P-selectina CS-B, CS-E
Kawashima e col., 2002
Opticin CS-A,
CS-B Hindson e col., 2005
WISP-1 (wnt-1 induced secreted protein 1) CS-B Desnoyers e col., 2001
Anexina VI CS Takagi e col., 2002
Semaforina 5A CS Kantor e col., 2004
Introdução
10
1.2.3 Estrutura, classificação e localização dos proteoglicanos
Com exceção do ácido hialurônico, os glicosaminoglicanos são encontrados nas
células sob a forma de proteoglicanos. Proteoglicanos de HS, DS, C4S e C6S são
componentes ubíquos de células de mamífero e de suas superfícies (Dietrich, 1984). São
importantes componentes constituintes da matriz extracelular e da membrana basal,
podendo se localizar também na superfície das células ou em grânulos citoplasmáticos.
Os proteoglicanos são macromoléculas constituídas por uma ou mais cadeias de
glicosaminoglicanos, covalentemente ligados a diferentes esqueletos protéicos, originando
estruturas de alto peso molecular, com diferentes combinações (Kjellén e Lindhall, 1991).
As cadeias de glicosaminoglicanos, com exceção do KS, são covalentemente ligadas a um
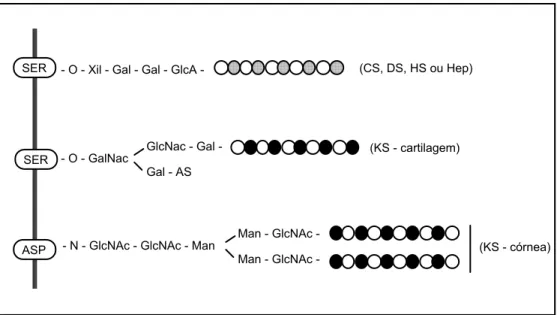
resíduo de serina do esqueleto protéico através do tetrassacarídeo:
xilose-galactose-galactose-ácido urônico (Figura 4). A xilose é a extremidade redutora, envolvida na ligação
O-glicosídica com o grupo hidroxila, proveniente do aminoácido serina. A porção não
redutora corresponde ao ácido glucurônico, e está envolvida na continuidade da cadeia do
glicosaminoglicano. A síntese da cadeia do glicosaminoglicano é iniciada após a adição do
tetrassacarídeo, e os monossacarídeos da cadeia são adicionados alternadamente (revisado
por Sugahara e Kitagawa, 2000).
Apenas o KS não se liga ao esqueleto protéico de modo convencional. Sua ligação
pode ocorrer de duas formas, sendo estas responsáveis pela distinção entre eles. O KS do
tipo I se liga por ligação N-glicosídica entre uma N-acetilglucosamina e a amida da cadeia
lateral da asparagina (Baker e col., 1975). O KS do tipo II se liga por ligação O-glicosídica
Introdução
11
SER
ASP
SER - O - GalNac
GlcNac Gal
-Gal - AS
- N - GlcNAc - GlcNAc - Man
Man - GlcNAc -
Man - GlcNAc -
- O - Xil - Gal - Gal - GlcA - (CS, DS, HS ou Hep)
(KS - cartilagem)
(KS - córnea)
Figura 4. Região de ligação da cadeia de glicosaminoglicano ao esqueleto protéico.CS: condroitim sulfato; DS: dermatam sulfato; HS: heparam sulfato; Hep: heparina; KS: queratam sulfato; Xil: xilose; Gal: galactose; GlcA: ácido glucurônico; GalNAc: N-acetilgalactosamina; GlcNAc: N-acetilglucosamina; Man: manose; AS: ácido siálico; SER: serina; ASP: asparagina.
Os proteoglicanos são compostos de alta heterogeneidade quanto ao tamanho e
natureza de seu esqueleto protéico e ao número e tipo de cadeias de glicosaminoglicanos
ligados. A atividade biológica de cada proteoglicano depende das propriedades do seu
esqueleto protéico, da estrutura química do(s) glicosaminoglicano(s) ligados e também de
sua localização. Assim, as funções biológicas dos proteoglicanos são muito variadas e não
existe um denominador comum.
A nomenclatura dos proteoglicanos está intimamente atrelada ao seu papel biológico,
ou ao aminoácido predominante, como por exemplo, o agrecam, que facilita a agregação
dos componentes da matriz da cartilagem e o serglicim, que apresenta um esqueleto com
repetições dos aminoácidos serina e glicina.
Atualmente, são conhecidos mais de 30 tipos diferentes de proteoglicanos. A Tabela 3
mostra a classificação de alguns proteoglicanos quanto à composição e localização em
Introdução
12
Tabela 3.Características estruturais e localização de alguns proteoglicanos
Nome Tamanho do esqueleto protéico (kD) Tipo de GAG N° de cadeias Localização Ref.
Família Hialectans ou lecticans
Agrecam ~220 CS, KS 20-30 Cartilagem, SNC e vasos sangüíneos
MEC Esko, 1991; Iozzo, 1998 Brevicam ~100 CS 1-3 SNC MEC Iozzo e Murdoch,
1996; Iozzo, 1998 GPI-brevicam 64 CS 0-5 SNC SC Seidenbecher e col.,
1998 Neurocam ~136 CS 3-7 SNC e cartilagem MEC Iozzo e Murdoch,
1996; Iozzo, 1998 Versicam 5/26-360 CS, DS 10-30 SNC e tecidos
embrionários
MEC Landolt e col., 1995; Iozzo, 1998
Família dos proteoglicanos pequenos ricos em leucina
Biglicam 38 CS, DS 1-2 Tecido conjuntivo, SNC
MEC Fisher e col., 1989; Esko, 1991; Stichel e col., 1995; Iozzo,
1998, 1999 Decorim 36 CS, DS 1 Tecido conjuntivo,
SNC, ossos e dentes
MEC Stichel e col., 1995
Epificam 35 CS, DS 2-3 Cartilagem epifisária
MEC Shinomura e Kimata, 1992; Iozzo, 1998, 1999 Fibromodulina 42 KS 2-3 Adesão celular e
fibrinogênese
MEC Oldberg e col., 1989; Esko, 1991; Iozzo, 1998, 1999 Lumicam 38 KS 3-4 Córnea, intestino,
fígado, músculo e cartilagem
MEC Esko, 1991; Blochberger e col.,
1992; Iozzo e Murdoch, 1996; Iozzo, 1998, 1999 Mimecam ou
osteoglicina
35 KS 2-3 Córnea e tecidos conjuntivos
MEC Funderburgh e col., 1997; Iozzo, 1998,
1999 Osteoaderina 42 KS 2-3 Ossos MEC Sommarin e col.,
1998; Iozzo, 1998, 1999 PRELP 44 KS 2-3 Tecido conjuntivo MEC Bengtsson e col.,
1995; Iozzo, 1998, 1999
Família do fosfacam/RPTP
Fosfacam 173 CS, KS 3-4 SNC MEC Maurel e col., 1994; Grumet e col., 1996; Garwood e
col., 2003 RPTPβ 253 CS 3-4 SNC SC Maurel e col., 1994;
Garwood e col., 2003
Introdução
13
sindecans fibroblasto,
endotélio, sistema nervoso e células
musculares lisas
1987; Nader, 1991; Bernfield e col.,
1992, 1999
Família dos glipicans
62 HS 2-4 Epitélio,
fibroblasto e SNC
SC Esko, 1991, Bernfield e col.,
1999
Proteoglicanos facultativos
Colágeno a2 (IX) 68 CS, DS 1 Cartilagem e humor vítreo
MEC Esko, 1991
Apicam 75-83 CS 1 SNC SC Shioi e col., 1995 Integrina α5β1 nd CS, HS nd Célula de
melanoma humano (Mel-85) e células
CHO
SC Veiga e col., 1997
Betaglicano 110 CS, HS 0-4 Fibroblastos SC Ruoslahti e Yamaguchi, 1991; Wang e col., 1991 CD44 32-38/49 CS, HS 0-4 Linfócitos e
epitélio
SC Stamenkovic e col., 1989; Iozzo e Murdoch, 1996 Neuroglicam-C 56 CS 3-5 SNC SC Oohira e col., 2004
Receptor de transferrina
2-90 HS 4-6 Fibroblastos SC Fransson e col., 1984
Trombomodulina 58-60 CS 0-1 Endotélio SC Esko, 1991
Outros proteoglicanos
Testicam 44 CS, HS 1-2 Testículos e cérebro
MEC Alliel e col., 1993; Iozzo e Murdoch,
1996
Agrim 250 HS 3 Junções
neuromusculares, MB renal e de
pulmão
MB Tsen e col., 1995; Iozzo, 1998; Cotman e col., 1999
Bamacam ~138 CS 3 Praticamente todas as MBs, exceto dos
glomérulos
MB Wu e Couchman, 1997; Iozzo, 1998
Leprecam ~220 CS nd MBs dos vasos sangüíneos e
musculatura lisa
MB Wassenhove-Mccarthy e Mccarthy,1999 Perlecam 400-467 HS, CS 3 MB e cartilagem MB Hassel e col., 1980;
Iozzo, 1998 NG2 300 CS 2-3 Células neurais e
mesenquimais
SC Esko, 1991, Stallcup, 2002
Introdução
14
1.3 Proteoglicanos de condroitim sulfato no sistema nervoso central
Os quatro maiores grupos de PGCS no SNC estão apresentados na Figura 5 e são:
1) lecticans ou hialectans (uma família que inclui agrecam, versicam, neurocam e brevicam); 2) fosfacam/RPTPβ (receptor-type protein-tyrosine phosphatase β); 3)
proteoglicanos pequenos e ricos em leucina (por exemplo, decorim e biglicam); 4) outros
PGCS incluindo neuroglicam-C e NG2.
Introdução
15 Os PGCS são secretados para a matriz extracelular por diferentes tipos celulares,
neurônios e células da glia (Tabela 4). Alguns PGCS são inseridos na membrana plasmática
dessas células e são conhecidos como proteoglicanos de superfície celular. PGCS da matriz
extracelularincluem os hialectans, fosfacam e os proteoglicanos pequenos ricos em leucina
enquanto que os proteoglicanos de superfície possuem um domínio transmembrânico, por
exemplo, NG2 e neuroglicam-C, ou uma âncora de glicosilfosfatidilinositol (GPI), por
exemplo, brevicam.
Os hialectans ou lecticans são a maior família de PGCS no SNC. Se ligam a AH
pelo domínio N-terminal (Hascall e Heinegard, 1974a,b; LeBaron e col., 1992; Rauch e
col., 1992; Day e Prestwich, 2002) e a tenascinas pelo domínio C-terminal (Aspberg e col.,
1995, 1997; Day e col., 2004). As tenascinas fazem ligações cruzadas entre complexos
PGCS-AH, formando estruturas complexas na matriz extracelular (Lundell e col., 2004).
Durante o desenvolvimento, os hialectans regulam a migração celular e o direcionamento
Introdução
16
Tabela 4. Proteoglicanos de condroitim sulfato do sistema nervoso central
Nome Tipo de
GAG Célula Referências
Matriz
extracelular
Agrecam CS Neurônios Hockfield e McKay, 1983; Asher e
col., 1995
Brevicam CS Neurônios, astrócitos e glia Yamada e col., 1997; Seidenbecher
e col., 1998; Thon e col., 2000
Neurocam CS Neurônios, astrócitos e OPC
Oohira e col., 1994; Engel e col.,
1996; Haas e col., 1999; McKeon e
col., 1999; Asher e col., 2000
Versicam CS OPC Asher e col., 2002; Beggah e col.,
2005
Fosfacam CS/KS Neurônios, astrócitos e glia
Maeda e col., 1995; Engel e col.,
1996;Snyder e col., 1996; Hayashi
e col., 2005; Heck e col., 2005
Biglicam CS/DS Astrócitos e glia Stichel e col., 1995
Decorim CS/DS Astrócitos e glia Stichel e col., 1995
Membrana
GPI-brevicam CS Glia da substância branca Seidenbecher e col., 1998
NG2 CS OPC Levine, 1994; Horner e col., 2002
RPTPβ CS Neurônios, astrócitos e glia Canoll e col., 1993; Snyder e col.,
1996; Hayashi e col., 2005
Neuroglicam-C CS Neurônios Watanabe e col., 1995
Apicam CS Astrócitos Shioi e col., 1995
CS: condroitim sulfato; KS: queratam sulfato; DS: dermatam sulfato; OPC: células precursoras de oligodendrócitos. Tabela modificada de Crespo e col., 2007.
PGCS são componentes de redes perineuronais, no SNC (Fujita e col., 1989;
Zaremba e col., 1989; Atoji e col., 1990; Bertolotto e col., 1991). Estas redes encapsulam
as sinapses no parênquima do SNC e foram descritas primeiro por Golgi (1893). A rede
perineuronal é formada por matriz extracelular condensada e especializada, que previne
Introdução
17 (Hartig e col., 1999) e fornece neuroproteção (Bruckner e col., 1999; Morawski e col.,
2004). Os principais componentes da matriz extracelular da rede perineuronal são
proteoglicanos, AH, proteínas fibrosas (por exemplo, colágeno e elastina), glicoproteínas
adesivas (por exemplo, fibronectina, laminina e tenascina) e fatores de crescimento. A
matriz extracelular do SNC é única na sua composição no sentido de que possui baixas
quantidades de proteínas fibrosas e altas quantidades de proteoglicanos e AH (Novak e
Kaye, 2000) (Figura 6).
Redes perineuronais em diferentes regiões do cérebro contêm diferentes PGCS. Por
exemplo, agrecam está ausente nas redes perineuronais na substância branca enquanto
versicam é encontrado principalmente na substância branca (Asher e col., 1995). Neste
exemplo, a distribuição é influenciada pela localização das células produtoras de agrecam
(neurônios) e de versicam (células precursoras de oligodendrócitos) (Tabela 4).
A administração de condroitinase ABC no SNC induz a plasticidade no cérebro
adulto de ratos (Pizzorusso e col., 2002; Tropea e col., 2003; Rhodes e Fawcett, 2004;
Corvetti e Rossi, 2005; Barritt e col., 2006) e, portanto, a regeneração do SNC poderia ser
devida à degradação das redes perineuronais. Além disso, como alguns PGCS (hialectans)
são ancorados nas redes perineuronais através de AH (Bignami e Asher, 1992; Bignami e
col., 1992) (Figura 6), e sendo a condroitinase ABC capaz de degradar este
glicosaminoglicano, alguns autores acreditam que parte da regeneração axonal observada
pela administração dessa enzima se deve à degradação do AH e não somente à degradação
Introdução
18
Figura 6. Esquema hipotético da composição das redes perineuronais. O AH é retido na superfície celular dos neurônios por meio da enzima AH sintase, por meio de receptores (por exemplo, layilin) ou de proteoglicanos de superfície celular (por exemplo RPTPβ). Os
hialectans ligam o AH pelo domínio N-terminal G1 e estas interações são estabilizadas por proteínas de ligação. Os hialectans ligam tenascina-R pelo domínio C-terminal G3 formando as redes. O hialectan agrecam tem papel importante na formação das redes perineuronais e embora outros hialectans, por exemplo, neurocam, versicam e brevicam, estejam presentes, não são críticos. Fosfacam também é um componente das redes perineuronais por meio da sua interação com tenascina-R, mas não é capaz de ligar o AH. AH: ácido hialurônico; PL: proteína de ligação. Figura modificada de Galtrey e Fawcett, 2007.
1.4 Condroitinases
Enzimas que degradam CS já foram purificadas de várias espécies de bactéria entre
elas, Flavobacterium heparinum, Proteus vulgaris, Arthrobacter aurescens e Bacteroides
stercoris (Hoffman e col., 1957; Linker e col., 1960; Yamagata e col., 1968; Hiyama e
Okada, 1975; Michelacci e Dietrich, 1974 e 1975; Michelacci e col., 1987; Hong e col.,
2002). Algumas destas enzimas são expressas constitutivamente enquanto outras devem ser
Introdução
19
lyase; EC 4.2.2.4) foi purificada de Proteus vulgaris e caracterizada por Yamagata e col.
(1968). Posteriormente, Hamai e col. (1997) isolaram duas condroitinases ABC de Proteus
vulgaris; uma endoeliminase capaz de despolimerizar o CS, produzindo uma mistura de
tetra e dissacarídeos contendo uma insaturação entre os carbonos 4 e 5 do ácido urônico e
uma exoeliminase que age preferencialmente em tetra e hexassacarídeos para formar
dissacarídeos. Estes autores sugerem que a enzima convencionalmente denominada de
condroitinase ABC, que despolimeriza completamente CS produzindo dissacarídeos
insaturados é, na verdade, uma combinação da endoeliminase (condroitim-sulfato-ABC
endolase, EC 4.2.2.20) e da exoeliminase (condroitim-sulfato-ABC exolase, EC 4.2.2.21).
A condroitinase ABC disponível comercialmente (Seikagaku Corp., Tokyo, Japan) e
utilizada em estudos sobre regeneração no SNC, não possui a atividade exoeliminase e seus
produtos finais são, portanto, tetra e dissacarídeos (Sugahara e col., 1994; Hamai e col.,
1997). Assim, seu uso in vivo, condição em que a concentração da enzima diminui
rapidamente, provavelmente não resulta em despolimerização completa do CS.
As condroitinases AC-I (chondroitin AC lyase; EC 4.2.2.5) de Flavobacterium
heparinum (Yamagata e col., 1968) e AC-II de Arthrobacter aurescens (chondroitinase AC
II; Hiyama e Okada, 1975) clivam a ligação entre acetilgalactosamina e ácido glucurônico.
A condroitinase AC-II é uma exoeliminase (Hiyama e Okada, 1975) e por isso não
consegue degradar glicosaminoglicanos híbridos de CS/DS (Figura 7). A condroitinase
AC-I por sua vez, possui atividade endoeliminase e, portanto, consegue clivar em qualquer
ponto da cadeia de C4S ou C6S.
Condroitinase B (chondroitin B lyase, EC 4.2.2.19) também foi isolada de F.
heparinum e é induzida pela adição de um dos CS (C4S ou C6S) ou DS ao meio de cultura
desta bactéria (Michelacci e Dietrich, 1974 e 1975). A condroitinase B cliva a ligação entre
N-acetilgalactosamina e ácido idurônico, e os produtos da clivagem são oligo- e
tetrassacarídeos, e um dissacarídeo 4-sulfatado insaturado. Os oligossacarídeos, por sua
vez, são suscetíveis à condroitinase AC e os produtos são principalmente dissacarídeos
4-sulfatados. Os produtos de degradação do DS também são capazes de induzir a expressão
da enzima por F. heparinum.
A condroitinase C de F. heparinum (EC 4.2.2.-) também é induzida pela adição de
Introdução
20 1976). A condroitinase C degrada CS, produzindo dissacarídeos insaturados sulfatados
apenas na posição 6, e AH, produzindo dissacarídeos não-sulfatados. Esta enzima cliva a
ligação β(1→4) entre a hexosamina não-sulfatada ou 6-sulfatada e o ácido glucurônico,
portanto não degrada C4S.
Dada a especificidade dos substratos (Figura 7), a condroitinase AC-I seria,
teoricamente, tão efetiva quando a condroitinase ABC na degradação de CS em ensaios in
vivo para criar um ambiente permissivo à regeneração do SNC. Estas enzimas também são
capazes de degradar AH. O AH é estruturalmente similar ao CS, consistindo de um
dissacarídeo repetido de ácido glucurônico e N-acetilglucosamina (Tabela 1 e Figura 3).
Entretanto difere por não existir covalentemente ligado a um esqueleto protéico e por não
ser sulfatado. Como já mencionado, alguns autores acreditam que a regeneração axonal
observada pela administração de condroitinase ABC deva-se, em parte, à degradação do
Introdução
21
Introdução
22
1.5 Inibição da regeneração neuronal por proteoglicanos de condroitim sulfato
A expressão de NG2 e neurocam (Asher e col., 2000); brevicam, decorim e biglicam
(Asher e col., 2001); e versicam (Asher e col., 2002) aumenta no tecido nervoso após
injúria. Além do aumento da quantidade de PGCS expressos, a injúria neuronal também
parece alterar a estrutura da cadeia de CS. A expressãodas enzimas CS sulfotransferases,
envolvidas na diversidade estrutural desses glicosaminoglicanos, aumenta após injúria na
região da cicatriz glial, sugerindo a implicação de diferenças nos padrões de sulfatação na
atividade inibitória de PGCS (Properzi e col., 2003). Gilbert e col. (2005) documentaram
que no córtex não lesado de ratos adultos, o principal CS presente é o C4S (91%), seguido
de condroitim não sulfatado (5%) e C6S (4%). Após uma lesão no córtex, o principal CS na
região lesada, ou seja, na cicatriz glial, se torna o C6S (50%), seguido do C4S (25%) e
aparecem dois CS; o condroitim 4,6-sulfato (17%) e um condroitim 2-sulfato (8%).
Properzi e col. (2005) observaram a expressão de C6S em células inibitórias da regeneração
axonal, mas não em células permissivas, realçando o possível papel da sulfatação na
posição 6 da galactosamina na inibição. O C6S é particularmente inibitório (Snow e col.,
1990), enquanto condroitim 2,6-sulfato e condroitim 4,6-sulfato promovem elongação in
vitro de axônios de precursores neuronais embrionários (Clement e col., 1998, 1999).
Entretanto, Gilbert e col. (2005) mostraram que o condroitim 4,6-sulfato é o GAG sulfatado
mais inibitório em um sistema de cultura em 3D.
1.6 Outros componentes da matriz extracelular que podem participar na inibição da
regeneração neuronal
A expressão de outros componentes da matriz extracelular também aumenta após
injúria no SNC e pode contribuir para os efeitos inibitórios da cicatriz glial (revisado por
Busch e Silver, 2007). Semaforina 3A (Sema 3A) é expressa por fibroblastos meningiais e
se liga a neuropilina 1, cuja expressão é aumentada em neurônios projetando axônios para a
região da lesão, causando colapso do cone de crescimento (Sandvig e col., 2004). Sema 3A
também é expressa na superfície de neurônios e interage com proteoglicanos podendo
contribuir para a atividade inibitória da matriz extracelular e também pode estar envolvida
no controle da invasão do SNC por células de Schwann (De Wit e col., 2005). As
Introdução
23 glicosaminoglicanos de PGCS e modificam seus efeitos em axônios em crescimento
(Kantor e col., 2004).
O receptor de efrina e seu ligante, efrina, são mediadores de migração celular,
direcionamento axonal e distribuição tecidual durante o desenvolvimento, e sua expressão
aumenta após injúria no SNC. A expressão de efrina-B2 e de seu receptor estão
correlacionados com a segregação de astrócitos reativos e fibroblastos meningiais na lesão
(Bundesen e col., 2003). Além disso, foi demonstrado que efrina-B3, que é expressa em
oligodendrócitos pós-natais na medula espinal, é inibitório para neurônios expressando o
receptor para efrina-4A, sugerindo que pode participar na falência de regeneração após
injúria (Benson e col., 2005).
As proteínas Slit regulam o direcionamento de axônios e migração celular (Brose e
Tessier-Lavigne, 2000). A expressão destas proteínas e de seu receptor glipicam-1 aumenta
em astrócitos reativos após injúria, indicando que podem participar na falência de
regeneração (Hagino e col., 2003).
Tenascina-R é uma proteína de adesão celular, cuja expressão está aumentada no
SNC após injúria e pode agir como barreira à regeneração (Deckner e col., 2000).
Camundongos deficientes em tenascina-R mostram uma recuperação funcional maior do
que animais normais após injúria à medula espinhal (Apostolova e col., 2006). Estes
autores sugerem que a falta de tenascina-R nas redes perineuronais permite a remodelação
de sinapses após injúria explicando a recuperação funcional observada.
A expressão de proteoglicanos de queratam sulfato (PGKS) aumenta após injúria ao
SNC (Krautstrunk e col., 2002) e foi visto que KS inibe crescimento axonal in vitro (Dou e
Levine, 1995). Aparentemente, o único PGKS do SNC é o fosfacam, que possui cadeias de
KS e CS (Tabela 4) sendo considerado um proteoglicano híbrido. Butler e col. (2004)
trataram culturas organotípicas de hipocampo com condroitinase ABC ou queratanase e
observaram que apenas o tratamento resultando na degradação de cadeias de KS promoveu
regeneração de fibras musgosas. KS consiste de dissacarídeos de galactose e
N-acetilglucosamina, com grupamentos sulfato na posição 6 da galactose e da GlcNAc
(Tabela 1 e Figura 3). A enzima N-acetilglucosamina 6-O-sulfotransferase (GlcNAc6ST) é
crítica para a síntese de KS. Camundongos deficientes em GlcNAc6ST apresentam uma
Introdução
24 glia reativa em lesões no SNC, comparado aos animais sem deficiência (Zhang e col.,
2006). Assim, enquanto os PGCS formam uma barreira física para a regeneração axonal e
participam das redes perineuronais, os PGKS induzem o acúmulo de astrócitos reativos na
cicatriz glial. PGKS são expressos, após injúria à medula espinal, por macrófagos,
micróglia reativa e células progenitoras de oligodendrócitos, mas não por astrócitos, e sua
expressão antecede a de PGCS (Jones e Tuszynski, 2002).
1.7 Regeneração do sistema nervoso central após terapia celular
O SNC de adulto é capaz de incorporar células-tronco ou progenitoras durante a
regeneração. Estas células podem ser originárias de embrião (Brüstle e col., 1999;
Lundberg e col., 1997) ou de tecido adulto (Gage e col., 1995). Além disso, o transplante
dessas células pode promover recuperação funcional (McDonald e col., 1999; Yoshihara e
col., 2007).
Existem diversos relatos na literatura sobre a incorporação de células-tronco no
SNC. Brüstle e col. (1999) cultivaram células-tronco embrionárias na presença de FGF2 e
PDGF e transplantaram essas células na medula espinhal de ratos de 1 semana de idade,
deficientes em mielina, modelo animal para a doença humana hereditária Palizaeus-
Merzbacher. Duas semanas após a realização do transplante, foi observada a presença de
bainha de mielina. Além disso, os precursores gliais derivados de células-tronco
embrionárias haviam se diferenciado em oligodendrócitos e astrócitos. Esses autores
também transplantaram as células intraventricularmente. Após 3 semanas, observaram a
presença de bainha de mielina no córtex, corpo caloso, comissura anterior, hipocampo, teto
mesencefálico, tálamo e hipotálamo. Lundberg e col., (1997) injetaram células-tronco
imortalizadas derivadas do estriado primordial e hipocampo de embrião de rato, em
neoestriado de rato adulto e observaram que as células sobreviveram, migraram e
integraram-se ao neoestriado. Nesse estudo, a grande maioria das células se diferenciou em
células da glia (6-14% apresentaram marcação para GFAP, glial acidic fibrillary protein), e
uma proporção pequena diferenciou-se em neurônios (1-3% expressaram MAP-2).
McDonald e col. (1999) cultivaram células-tronco de embrião de camundongo na presença
de ácido retinóico e transplantaram estas células na medula espinal de rato, 9 dias após
Introdução
25 diferenciaram em astrócitos, oligodendrócitos e neurônios e migraram 8mm a partir da
lesão. Além disso, os animais recuperaram parte da coordenação motora e capacidade de
apoiar o peso do corpo sobre as pernas. Chiba e col. (2004) também cultivaram
células-tronco de embrião de camundongo na presença de ácido retinóico. Estes autores
transplantaram as células tratadas no córtex motor uma semana após a injúria e observaram
recuperação funcional evidente 4 dias após o transplante.
Células progenitoras isoladas do hipocampo de rato adulto, uma região sabidamente
neurogênica, cultivadas em meio contendo FGF-2 e transplantadas em hipocampo de rato
adulto migram para o giro denteado, onde se diferenciam em neurônios da camada granular
(Gage e col., 1995). Webber e col. (2007) expandiram células progenitoras neurais obtidas
da medula espinhal em cultura e, a seguir transplantaram as células na medula espinhal
lesada. Observaram que as células ficaram principalmente na região lesada e 40% das
células se diferenciaram em glia e 8% em neurônios. Entretanto, não observaram
regeneração axonal ou recuperação funcional e sugerem que terapias com células-tronco
devem ser associadas a outras terapias.
Células-tronco implantadas em um hemisfério cerebral controle, sem injúria, são
capazes de migrar em direção à lesão no hemisfério contralateral. Hoehn e col. (2002)
observaram a migração de células-tronco embrionárias em cérebro adulto por um
mecanismo não invasivo. Células tronco embrionárias marcadas com GFP foram
lipotransfectadas com um agente de contraste para MRI e implantadas no hemisfério não
lesado em cérebro de rato, 2 semanas após isquemia. Após 3 semanas, as células migraram
ao longo do corpo caloso para as paredes ventriculares e povoaram o tecido cerebral lesado
no hemisfério contralateral.
Embora ainda seja controverso, alguns autores demonstraram que células
progenitoras originárias da medula óssea podem se diferenciar em células neurais em
cultura e in vivo. Sanchez-Ramos e col. (2000) cultivaram células-tronco estromais
humanas e de camundongo na presença de EGF ou BDNF. Os autores verificaram que,
após o tratamento, essas células expressaram tanto a proteína quanto o RNAm de nestina,
marcador para precursor neuronal, além de GFAP, marcador de células da glia e NeuN
(neuron-specific nuclear protein) marcador de neurônio. Mezey e col. (2000) cultivaram
Introdução
26 que após algumas semanas, 18% das células marcavam para nestina (marcador de células
progenitoras do SNC). Essas células, derivadas da medula óssea de camundongos
selvagens machos, foram injetadas intraperitonealmente, em fêmeas homozigotas para uma
mutação no gene PU.1 (deficientes em células mielóides e linfóides). Após 4 meses, os
autores observaram que 2,3-4,6% das células do SNC eram positivas para o cromossomo Y
e estavam distribuídas regularmente em diferentes regiões do cérebro tanto na substância
negra quanto na branca. Destas células, 0,3-2,3% haviam se diferenciado em células
expressando antígenos neurais (NeuN), e estavam presentes no córtex, hipotálamo,
hipocampo, amígdala, periaqueduto cinza e neoestriado. Brazelton e col. (2000) injetaram
células derivadas da medula óssea de camundongo adulto transgênico expressando GFP,
intravascularmente, em camundongos adultos irradiados. Após 2-3 meses, células
expressando GFP estavam presentes no SNC; no bulbo olfatório, no hipocampo, córtex
cerebral e cerebelo. Na medula óssea, todas as células que expressavam GFP também
expressavam CD45, marcador para células sanguíneas. Entretanto, uma subpopulação de
células expressando GFP, no SNC, não expressava CD45 e sim produtos gênicos típicos de neurônio (NeuN, neurofilamento 200kDa e β-tubulina III) além de serem capazes de ativar
o fator de transcrição CREB (cAMP response element binding protein). CREB em
neurônios é ativado em resposta a fatores extracelulares, tais como glutamato,
neurotrofinas, trauma e estresse. Dois a três meses após a injeção das células derivadas da
medula óssea GFP positivas, 0,2-0,3% do número total de neurônios no SNC eram células
expressando GFP. Yoshihara e col. (2007) injetaram células mononucleadas derivadas da
medula óssea no quarto ventrículo de ratos 1 hora após lesão na medula espinhal.
Observaram que as células secretaram HGF (hepatocyte growth factor), que teve um efeito
antiapoptótico, impediram a cavitação progressiva que ocorre após uma lesão, e
Objetivos
2 Objetivos
Objetivos Gerais
Combinar a utilização de terapia celular com a degradação de condroitim sulfato por condroitinase AC na regeneração de lesões no sistema nervoso central, através do transplante de células mononucleadas derivadas de medula óssea de camundongos adultos transfectadas com vetor contendo o gene que codifica para a condroitinase AC.
Objetivos específicos
1. Produzir um vetor de expressão contendo o gene que codifica para a enzima condroitinase AC de Flavobacterium heparinum.
2. Verificar a expressão e secreção de condroitinase AC ativa in vitro pela transfecção de células em cultura.
3. Transplantar células mononucleadas derivadas de medula óssea expressando condroitinase AC no local da injúria no SNC e verificar a secreção e atividade da enzima in vivo.
4. Analisar a regeneração neuronal e resposta inflamatória na região lesada após o transplante de células mononucleadas derivadas de medula óssea expressando condroitinase AC.
5. Avaliar a recuperação funcional de animais após receberem transplante de células mononucleadas derivadas de medula óssea expressando condroitinase AC.
Material e métodos
3 Material e métodos
3.1 Reagentes
Tris, uréia e glicina foram obtidos da GibcoBRL (Grand Island, NY, EUA) e
brometo de etídio da GE Healthcare Life Sciences (Piscataway, NJ, EUA). Agarose e
EDTA foram obtidos da USB (Cleveland, OH, EUA). Os componentes para o meio de
cultura para o crescimento das bactérias, tais como peptona, extrato de levedura e triptona
foram adquiridos da BD (Sparks, MD, EUA). Ácido ε-amino capróico, benzamidina,
iodoacetamida e fenil-metil-sulfonil fluoreto (PMSF) foram obtidos da Sigma (St. Louis,
MO, EUA). Os demais reagentes químicos, tais como sais, ácidos, bases e solventes
orgânicos foram todos adquiridos da Merck (Darmstadt, Alemanha). Todos os primers
utilizados foram sintetizados pela IDT (Coralville, IA, EUA), exceto o primer antisense
para amplificação do gene da condroitinase AC a partir de DNA genômico de
Flavobacterium heparinum (item 3.2), adquirido da Invitrogen (Carlsbad, CA, EUA).
3.2 Desenho dos primers para amplificação do gene que codifica para a condroitinase
AC a partir do DNA genômico de Flavobacterium heparinum
O gene que codifica para a condroitinase AC foi obtido a partir de amplificação por
PCR utilizando como molde DNA genômico de Flavobacterium heparinum ressuspenso em água deionizada purificada em sistema Milli-Q (Millipore Corporation, Billerica, MA,
EUA) estéril. No primer sense foi incluído o sítio para a enzima de restrição KpnI e no
antisense foi incluído o sítio para a enzima de restrição EcoRI, para posterior clonagem do segmento de DNA no plasmídeo de expressão pcDNA3.1(+) (Figura 8, Invitrogen,
Carlsbad, CA, EUA). A seqüência de DNA que codifica para a condroitinase AC já se
inicia com o códon ATG e termina com o códon TAG, portanto não foi necessário
incorporar códons de início e término nos primers. Entretanto, no primer sense foi incluída uma seqüência inicial de tradução Kozak (1987, 1990, 1991) de acordo com as
considerações de clonagem que vêm com o manual dos plasmídeos pcDNA3.1(+). Assim,
os primers utilizados para clonagem no plasmídeo pcDNA3.1(+) foram:
sense 5´GGG GTA CCA TGG GGA AAT TAT TTG TAA CCT3´
antisense 5´GGA ATT CCT ATT TCA GTT CAA CCG TTG C3´
Material e métodos
Figura 8. Vetor de expressão pcDNA3.1(+). Este plasmídeo possui o promotor CMV, resistência a ampicilina para selecionar E. coli transfectadas com o vetor e resistência a neomicina para selecionar células de mamífero.
3.3 Reação em cadeia da DNA polimerase (PCR)
As condições da reação de PCR para amplificação do gene da condroitinase AC
foram 30 ciclos de 95ºC por 30 segundos, 50ºC por 30 segundos e 72ºC por 4 minutos e 30
segundos, na presença da enzima Pfu DNA polimerase (Fermentas, Glen Burnie, MD,
EUA). Fragmentos com sítios de restrição compatíveis aos do plasmídeo foram gerados
pela degradação do produto de PCR com as enzimas KpnI e EcoRI (item 3.4). O molde de
DNA utilizado na reação de amplificação foi obtido a partir de Flavobacterium heparinum
ressuspendida em água deionizada purificada em sistema Milli-Q estéril. Para a obtenção
do DNA genômico, F. heparinum foi coletada de uma cultura em meio sólido (tryptic soy broth without dextrose, com ágar), utilizando-se uma alça de inoculação e as bactérias foram ressuspendidas em 250μl de água deionizada purificada em sistema Milli-Q estéril.
Desta suspensão, 1μl foi utilizado nas reações de PCR. Os produtos obtidos pelas reações
de PCR foram analisados por eletroforese em gel de agarose para DNA (1% de agarose em tampão TAE [Tris-acetato 40mM; EDTA 1mM], contendo brometo de etídio 0,5μg/ml).
Material e métodos
3.4 Clonagem do produto de PCR no plasmídeo de expressão pcDNA3.1(+)
O inserto e o plasmídeo foram digeridos pelas enzimas de restrição KpnI
(Fermentas, Glen Burnie, MD, EUA) e EcoRI (Fermentas, Glen Burnie, MD, EUA), a
37°C por 16 horas. A reação de ligação foi realizada na proporção 1:13 (vetor: inserto), a
16°C por 16 horas com a enzima T4 DNA ligase (Fermentas, Glen Burnie, MD, EUA). A
reação de ligação foi utilizada na transformação de bactérias E.coli DH5α quimicamente competentes, de acordo com o protocolo proposto por Inoue e col., (1990) (30 minutos no
gelo, 1 minuto a 42°C e 2 minutos no gelo). A seleção dos transformantes foi feita em LB
ágar contendo ampicilina (USB, Cleveland, OH, EUA) 100μg/ml e a identificação dos
clones com inserto foi feita por PCR de DNA obtido de cada colônia, utilizando os primers
descritos em 3.2 (Sambrook e Russel, 2001). O plasmídeo de uma das colônias positivas foi
purificado por mini-preparação (miniprep, Qiagen, Valencia, CA, EUA; Promega, Madison, WI, EUA)e a incorporação do gene foi confirmada por análise de restrição. Para
a análise de restrição, o plasmídeo purificado por miniprep foi incubado a 37°C por 2 horas com as enzimas de restrição utilizadas na digestão prévia à ligação e os produtos foram
analisados por eletroforese em gel de agarose para DNA.
3.5 Seqüenciamento do segmento de DNA que codifica para a condroitinase AC
clonado no plasmídeo pcDNA3.1(+)
Para verificar se ocorreu a ligação correta do inserto no plasmídeo pcDNA3.1(+), os
primers sense e antisense utilizados na reação de PCR foram utilizados nas reações de seqüenciamento. Como a reação de seqüenciamento amplifica até aproximadamente 600pb
sem erros, o gene foi seqüenciado em 5 partes e as seqüências obtidas foram comparadas à
seqüência descrita por Tkalec e col. (2000), utilizando o aplicativo SeqMan Pro da
DNAstar (Madison, WI, EUA). Assim, desenhamos primers para regiões internas na seqüência da condroitinase AC:
sense 5’CTG GTG GCG AAG ATG ATC3’ (equivale aos pares de base 905-922 do gene da condroitinase AC)
Material e métodos
antisense 5’CAT CAG CCC ATT CTT CAG3’ (equivale aos pares de base 947-964 do gene da condroitinase AC)
antisense 5’CAT CGT GCA ACA ACC AGA AC3’ (equivale aos pares de base 1551-1570 do gene da condroitinase AC)
Em primeiro lugar, foi realizada uma reação de PCR utilizando como molde 1μl de
plasmídeo recombinante diluído 1:10. As condições da reação de PCR e os primers
utilizados foram os mesmos descritos no item 3.2. A banda correspondente ao tamanho
esperado para o produto do gene da condroitinase AC foi purificada utilizando kit de
extração de gel (Promega, Madison, WI, EUA). Na reação de PCR de seqüenciamento, os
primers foram utilizados numa concentração final de 0,5μM. Foram utilizados 2μl do reagente DyeNamic (Amersham Biosciences, Buckinghamshire, Reino Unido), 2μl do
tampão 2,5x (Tris-HCl, pH8,0, 200mM e MgCl2 5mM), 1,6μl da banda eluída (105ng) e
água milli-Q para um volume final de 10μl. As condições da reação de PCR foram 30
ciclos de 95ºC por 20 segundos, 50ºC (primers para a região interna da seqüência) ou 55ºC (primers para as extremidades) por 20 segundos e 60ºC por 1 minuto. Os produtos da reação de PCR foram transferidos para tubos de microcentrífuga de 1,5ml e precipitados
com 1μl de acetato de sódio 1,5M contendo EDTA 0,25mM, pH8,5, e com 25μl de etanol
100% a temperatura ambiente por 15 minutos. Os tubos foram centrifugados a 12000rpm
por 20 minutos à temperatura ambiente e o sobrenadante desprezado. O precipitado foi
lavado com 200μl de etanol 70% e seco em estufa a 60ºC por 15 minutos. O precipitado foi
ressuspenso em tampão de amostra contendo formamida e corante (formamide loading dye, Amersham Biosciences, Buckinghamshire, Reino Unido) e aplicado ao gel de
poliacrilamida para seqüenciamento no seqüenciador ABI Prism 377 (Applied Biosystems,
Warrington, Reino Unido).
3.6 Clonagem do gene da condroitinase AC no vetor de expressão pEGFP-N1
O primer sense foi o mesmo desenhado para a clonagem do gene da condroitinase AC de F. heparinum no plasmídeo de expressão pcDNA3.1(+), e foi descrito no item 3.2. No primer antisense foi incluído o sítio para a enzima de restrição BamHI, para posterior clonagem do segmento de DNA no pEGFP-N1 (Figura 9, Clontech, Mountain View, CA,
EUA). Além disso, o primer antisense foi construído sem um códon de término, pois o