(Salesópolis, São Paulo, Brasil)
Viviane Gianluppi Ferro1,3 & Ivone Rezende Diniz2
Biota Neotropica v7 (n3) – http://www.biotaneotropica.org.br/v7n3/pt/abstract?inventory+bn03107032007
Recebido em 20/06/07 Versão reformulada recebida em 13/09/07
Publicado em 16/10/07
1Programa de Pós-Graduação em Ecologia, Instituto de Ciências Biológicas, Universidade de Brasília – UnB, CP 04457, CEP 70919-970, Brasília, DF, Brasil 2Departamento de Zoologia, Instituto de Ciências Biológicas, Universidade de Brasília – UnB,
CEP 70910-900, Brasília, DF, Brasil, e-mail: irdiniz@unb.br
3Autor para correspondência: Viviane Gianluppi Ferro, e-mail: vgferro@yahoo.com
Abstract
Ferro, VG. & Diniz, IR. Arctiidae (Insecta: Lepidoptera) of the Boracéia Biological Station (Salesópolis, São Paulo, Brazil). Biota Neotrop. Sep/Dez 2007 vol. 7, no. 3 http://www.biotaneotropica.org.br/v7n3/pt/abstra ct?inventory+bn03107032007. ISSN 1676-0603.
A checklist of the Arctiidae moth species with occurrence in the Boracéia Biological Station (EBB) is presented. The list was obtained from specimens deposited in four Brazilian scientific collections. A total of 237 arctiid species were recorded. The EBB is among the species-richest locations recorded in Brazil.
Keywords: Boracéia Biological Station, checklist, moths, species richness.
Resumo
Ferro, VG. & Diniz, IR. Arctiidae (Insecta: Lepidoptera) da Estação Biológica de Boracéia (Salesópolis, São Paulo, Brasil). Biota Neotrop. Sep/Dez 2007 vol. 7, no. 3 http://www.biotaneotropica.org.br/v7n3/pt/abstr act?inventory+bn03107032007. ISSN 1676-0603.
Uma lista das espécies de mariposas Arctiidae com registro de ocorrência para a Estação Biológica de Boracéia (EBB) é apresentada. Esta listagem foi obtida através da observação de material depositado em quatro coleções científicas brasileiras. Um total de 237 espécies foi registrado. A EBB está entre as localidades mais ricas em espécies de Arctiidae do Brasil.
A Estação Biológica de Boracéia (EBB), com área de aproxi-madamente 96 ha, está localizada a 110 km da cidade de São Paulo, no município de Salesópolis (23° 37’ 59’’ S e 45° 31’ 59” W). A EBB encontra-se inserida em uma reserva de 16.450 ha (Adutora do Rio Claro, SABESP), criada para proteger as bacias dos rios Claro e Guaratuba. Localiza-se em uma área de Mata Atlântica, bioma brasileiro considerado um “hotspot” mundial por apresentar mais de 70% da sua cobertura vegetal original destruída e com altas porcentagens de espécies endêmicas (Myers et al. 2000).
A EBB sempre atraiu, mesmo antes de sua implementação, a atenção de inúmeros pesquisadores, tanto da área zoológica quanto da botânica. Um histórico das atividades ali realizadas, até o ano de 1957, pode ser encontrado em Travassos-Filho & Camargo (1958). Os autores enfocam as coletas noturnas de insetos, especialmente de Diptera e Lepidoptera. Dentre os Lepidoptera, as mariposas Arctiidae foram intensamente coletadas por um dos principais pesquisadores do grupo no Brasil, Lauro Travassos Filho, pesquisador do Museu de Zoologia da USP.
A família Arctiidae compreende cerca de 11 mil espécies de mariposas de tamanho pequeno a médio, sendo distribuída por todo o mundo (Scoble 1995). Ocorrem cerca de seis mil espécies na Região Neotropical (Heppner 1991) e há uma estimativa de duas mil espécies para o Brasil (Brown Jr & Freitas 1999). Segundo Jacobson & Weller (2002), essas mariposas estão divididas em três subfamílias: Arctiinae, Lithosiinae e Syntominae, sendo que a última não ocorre nas Américas. Este trabalho tem como objetivo apresentar uma lista das espécies de mariposas Arctiidae com registro de ocorrência para a EBB, gerada a partir da compilação de aproximadamente 4.800 indivíduos depositados em coleções científicas do Brasil e coletados por vários pesquisadores desde a década de 1930.
Material e Métodos
A lista das espécies de Arctiidae da EBB foi obtida através da observação de todos os exemplares da família depositados em quatro coleções científicas brasileiras: Coleção Entomológica Padre Jesus Santiago Moure da Universidade Federal do Paraná (UFPC), Fundação Instituto Oswaldo Cruz (FIOC), Museu Nacional da Universidade Federal do Rio de Janeiro (MNRJ) e Museu de Zoologia
cies foi feita através da comparação dos espécimes com registros fotográficos dos exemplares da Coleção Becker (cujos exemplares foram comparados com os tipos).
Resultados e Discussão
Nas quatro coleções visitadas, foi registrado um total de 4.465 indivíduos de Arctiidae identificados, pertencentes a 117 gê-neros e a 237 espécies. A lista das espécies identificadas encontra-se na Tabela 1. Outros 324 indivíduos de 19 morfoespécies que apre-sentaram registro de ocorrência para a EBB não foram identificados. A riqueza de espécies encontrada na EBB representa 17,1% da fauna de Arctiidae registrada para o país (V.G. Ferro, dados não publica-dos), 24,7% da fauna registrada para a Mata Atlântica (V.G. Ferro, dados não publicados) e 4% das espécies dos neotrópicos (Heppner 1991). Além disso, a riqueza de Arctiidae da EBB está entre as maiores já encontradas em um único sítio de coleta brasileiro. Apenas as localidades de Itatiaia (RJ) (Zikán & Zikán, 1968), Petrópolis (RJ), Angra dos Reis (RJ) e Joinville (SC) (V.G. Ferro, dados não publicados) apresentaram riquezas de Arctiidae superio-res à registrada na EBB (306, 305, 304, e 262, superio-respectivamente). Riqueza semelhante de Arctiidae (287 espécies) foi obtida por Hilt & Fiedler (2006), em uma mata úmida do Equador. Uma única espécie, Phaegoptera fusca Travassos, 1955, apresentou registro de ocorrência apenas para a EBB, sendo considerada endêmica desta unidade de conservação. Cerca de 50% (n = 118) das espécies que ocorreram na EBB também estiveram presentes em Itatiaia, sítio geograficamente próximo e também intensamente coletado (durante 36 anos) (Zikán & Zikán, 1968).
Praticamente todas as espécies (99,6%) coletadas na EBB per-tenceram à subfamília Arctiinae (Tabela 1). Seis tribos de Arctiinae (Arctiini, Callimorphini, Ctenuchini, Euchromiini, Pericopini e Phaegopterini) e uma de Lithosiinae (Lithosiini) ocorreram na EBB. Uma das explicações para esse resultado é que três dos principais pesquisadores que coletaram Arctiidae na EBB (Lauro Travassos, Lauro Travassos Filho e Alfredo R. do Rego Barros), tinham como objeto de estudo as espécies de Arctiinae. Cerca de 80% dos gê-neros foram representados por menos de três espécies. Os gêgê-neros com maior número de espécies foram Cosmosoma Hübner, 1827 (com 13 espécies), Phaegoptera Herrich-Schäffer, 1855 (com 12) e Eucereon Hübner, 1826 (com 11) (Tabela 1).
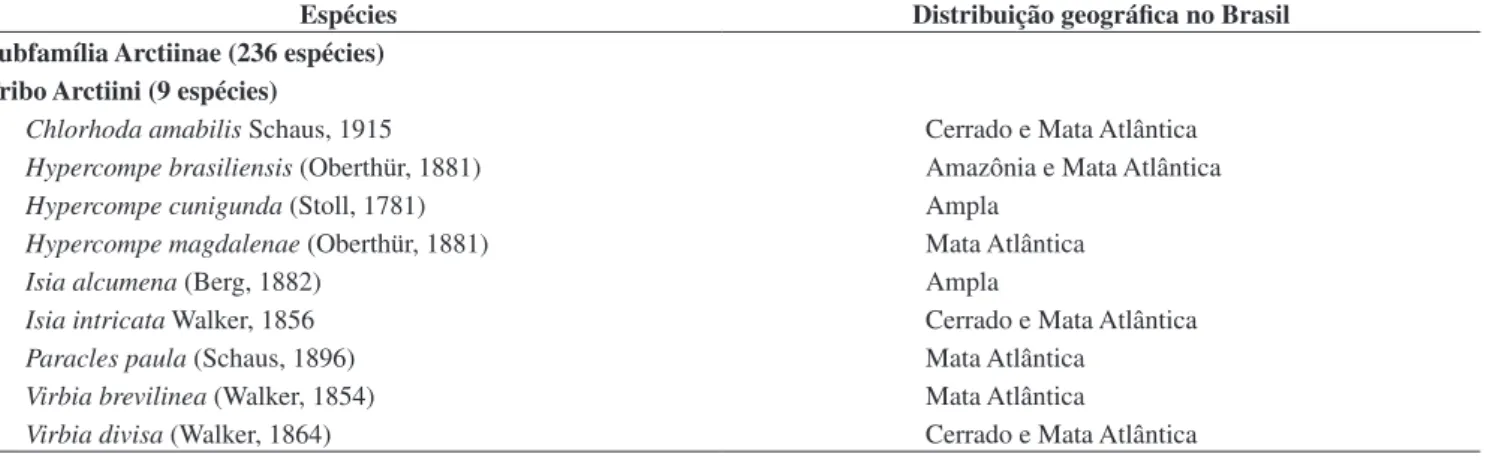
Tabela 1. Lista das 237 espécies de Arctiidae com registro de ocorrência para a Estação Biológica de Boracéia (EBB) (Salesópolis, São Paulo, Brasil) e suas distribuições geográficas no Brasil. Distribuição ampla significa que a espécie ocorre em quatro ou mais biomas brasileiros. Os dados apresentados são base-ados em espécimes depositbase-ados em quatro coleções brasileiras.
Table 1. List of the 237 Arctiidae species with occurrence records for the Estação Biológica de Boracéia (EBB) (Salesópolis, São Paulo, Brazil) and their geographic distributions in Brazil. Wide distribution means that the species occurs in four or more Brazilian biomes. The data were obtained for specimens deposited in four Brazilian collections.
Espécies Distribuição geográfica no Brasil
Subfamília Arctiinae (236 espécies) Tribo Arctiini (9 espécies)
Chlorhoda amabilis Schaus, 1915 Cerrado e Mata Atlântica
Hypercompe brasiliensis (Oberthür, 1881) Amazônia e Mata Atlântica
Hypercompe cunigunda (Stoll, 1781) Ampla
Hypercompe magdalenae (Oberthür, 1881) Mata Atlântica
Isia alcumena (Berg, 1882) Ampla
Isia intricata Walker, 1856 Cerrado e Mata Atlântica
Paracles paula (Schaus, 1896) Mata Atlântica
Virbia brevilinea (Walker, 1854) Mata Atlântica
Espécies Distribuição geográfica no Brasil Tribo Callimorphini (1 espécie)
Utetheisa ornatrix (Linnaeus, 1758) Ampla
Tribo Ctenuchini (42 espécies)
Aclytia heber (Cramer, 1780) Ampla
Aclytia terra Schaus, 1896 Ampla
Aethria andromacha (Fabricius, 1775) Amazônia, Cerrado e Mata Atlântica
Agyrta albisparsa Hampson, 1898 Mata Atlântica
Agyrta micilia (Cramer, 1780) Amazônia, Cerrado e Mata Atlântica
Antichloris eriphia (Fabricius, 1777) Amazônia, Cerrado e Mata Atlântica
Argyroeides ophion (Walker, 1854) Amazônia e Mata Atlântica
Argyroeides sanguinea Schaus, 1896 Campo Sulino, Cerrado e Mata Atlântica
Atyphopsis roseiceps Druce, 1898 Mata Atlântica
Callopepla inachia (Schaus, 1892) Cerrado e Mata Atlântica
Chrysostola dycladioides (Heylaerts, 1890) Caatinga, Cerrado e Mata Atlântica
Correbidia joinvillea Schaus Mata Atlântica
Ctenucha jonesi Rothschild, 1912 Campo Sulino e Mata Atlântica
Cyanopepla jucunda (Walker, 1854) Campo Sulino, Cerrado e Mata Atlântica
Cyanopepla oruba Mata Atlântica
Delphyre brunnea (Druce, 1898) Campo Sulino, Cerrado e Mata Atlântica
Dinia eagrus (Cramer, 1779) Amazônia, Cerrado e Mata Atlântica
Episcepsis endodasia Hampson, 1898 Amazônia, Cerrado e Mata Atlântica
Euagra azurea (Walker, 1854) Mata Atlântica
Eucereon apicalis (Walker, 1856) Cerrado e Mata Atlântica
Eucereon aroa Schaus, 1894 Mata Atlântica
Eucereon chalcodon Druce, 1893 Cerrado e Mata Atlântica
Eucereon confinis (Herrich-Schäffer, 1855) Cerrado e Mata Atlântica
Eucereon discolor Walker, 1856 Mata Atlântica
Eucereon ladas Schaus, 1892 Cerrado e Mata Atlântica
Eucereon leucophaeum (Walker, 1855) Mata Atlântica
Eucereon pseudarchias Hampson, 1898 Ampla
Eucereon quadricolor (Walker, 1855) Ampla
Eucereon setosum Sepp, 1848 Amazônia, Cerrado e Mata Atlântica
Eucereon xanthura Schaus, 1910 Amazônia e Mata Atlântica
Euceriodes wernickei Draudt, 1917 Caatinga, Cerrado e Mata Atlântica
Galethalea pica (Walker, 1855) Cerrado e Mata Atlântica
Gaugamela saturata Walker, 1865 Mata Atlântica
Heliura hecale (Schaus, 1892) Mata Atlântica
Napata splendida (Herrich-Schäffer, 1854) Amazônia, Cerrado e Mata Atlântica
Philoros rubriceps (Walker, 1854) Ampla
Pionia elongata (Dognin, 1890) Amazônia, Cerrado e Mata Atlântica
Pionia lycoides (Walker, 1854) Amazônia, Cerrado e Mata Atlântica
Pseudohyaleucerea vulnerata (Butler, 1875) Ampla
Pseudosphex ichneumonea Herrich-Schäffer (1854) Amazônia, Cerrado e Mata Atlântica Pseudosphex rubripalpus Hampson, 1901 Amazônia, Cerrado e Mata Atlântica
Tipulodes ima Boisduval, 1832 Amazônia, Cerrado e Mata Atlântica
Tribo Euchromiini (47 espécies)
Aristodaema hanga (Herrich-Schäffer, 1854) Campo Sulino, Cerrado e Mata Atlântica
Belemnia inaurata (Sulzer, 1776) Amazônia, Cerrado e Mata Atlântica
Cosmosoma auge (Linnaeus, 1767) Ampla
Cosmosoma centralis (Walker, 1854) Ampla
Cosmosoma chrysis (Hübner, 1827) Amazônia, Cerrado e Mata Atlântica
Espécies Distribuição geográfica no Brasil
Cosmosoma durca Schaus, 1896 Amazônia, Cerrado e Mata Atlântica
Cosmosoma elegans Butler, 1876 Cerrado e Mata Atlântica
Cosmosoma leuconotum Hampson, 1898 Campo Sulino e Mata Atlântica
Cosmosoma pheres (Cramer, 1782) Amazônia, Cerrado e Mata Atlântica
Cosmosoma rasera (Jones, 1914) Ampla
Cosmosoma remotum (Walker, 1854) Amazônia, Cerrado e Mata Atlântica
Cosmosoma restrictum Butler, 1876 Ampla
Cosmosoma subflamma (Walker, 1854) Amazônia, Cerrado e Mata Atlântica
Cosmosoma telephus (Walker, 1854) Ampla
Cosmosoma teuthras (Walker, 1854) Ampla
Dasysphinx torquata (Druce, 1883) Mata Atlântica
Desmidocnemis hypochryseis Hampson, 1898 Mata Atlântica
Dycladia correbioides Felder, 1869 Cerrado e Mata Atlântica
Dycladia lucetius (Cramer, 1782) Ampla
Dycladia melaena Hampson, 1898 Cerrado e Mata Atlântica
Ichoria tricincta (Herrich-Schäffer, 1855) Cerrado e Mata Atlântica
Ilipa tengyra (Walker, 1854) Amazônia, Cerrado e Mata Atlântica
Isanthrene ustrina Hübner, 1827 Mata Atlântica
Lepidoneiva erubescens (Butler, 1876) Ampla
Leucotmemis nexa (Herrich-Schäffer, 1854) Ampla
Loxophlebia geminata Schaus, 1905 Cerrado e Mata Atlântica
Macrocneme indistincta Butler, 1876 Amazônia, Cerrado e Mata Atlântica
Mallodeta clavata (Walker, 1854) Cerrado e Mata Atlântica
Mallodeta consors (Walker, 1854) Cerrado e Mata Atlântica
Mirandisca harpalyce (Schaus, 1892) Cerrado e Mata Atlântica
Neotrichura nigripes Heylaerts, 1890 Ampla
Nyridela acroxantha (Perty, 1834) Ampla
Pheia albisigna (Walker, 1854) Ampla
Pheia catherina (Schaus, 1892) Mata Atlântica
Pheia elegans (Druce, 1884) Amazônia e Mata Atlântica
Phoenicoprocta teda (Walker, 1854) Cerrado e Mata Atlântica
Phoenicoprocta vacillans (Walker, 1856) Amazônia, Cerrado e Mata Atlântica
Poliopastea plumbea Hampson, 1898 Cerrado, Mata Atlântica e Pantanal
Pseudomya tipulina (Hübner, 1812) Amazônia, Cerrado e Mata Atlântica
Ptychotrichos elongatus Schaus, 1905 Mata Atlântica
Rezia cardinale (Hampson, 1898) Cerrado e Mata Atlântica
Rezia erythrarchos (Walker, 1854) Cerrado e Mata Atlântica
Rezia sanguipuncta (Druce, 1898) Mata Atlântica
Rhynchopyga meisteri (Berg, 1883) Campo Sulino, Cerrado e Mata Atlântica
Saurita erythrogyia Hampson, 1898 Mata Atlântica
Saurita sericea (Herrich-Schäffer, 1854) Ampla
Sphecosoma melissa Schaus, 1896 Amazônia, Cerrado e Mata Atlântica
Tribo Pericopini (16 espécies)
Calodesma amica (Stoll, 1781) Ampla
Calodesma phoenicides (Druce, 1884) Mata Atlântica
Dysschema amphissa (Geyer, 1832) Campo Sulino, Cerrado e Mata Atlântica
Dysschema boisduvalii (van der Hoeven e de Vriese, 1840) Cerrado e Mata Atlântica
Dysschema fantasma (Butler, 1873) Mata Atlântica
Dysschema lucifer (Butler, 1873) Amazônia, Cerrado e Mata Atlântica
Dysschema marginata (Guérin-Méneville, 1844) Cerrado e Mata Atlântica
Espécies Distribuição geográfica no Brasil Dysschema picta (Guérin-Méneville, 1844) Cerrado e Mata Atlântica
Dysschema sacrifica (Hübner, 1831) Ampla
Episcea extravagans Warren, 1901 Cerrado e Mata Atlântica
Hyalurga fenestrata (Walker, 1855) Cerrado e Mata Atlântica
Hyalurga syma (Walker, 1854) Cerrado e Mata Atlântica
Phaloe cruenta (Hübner, 1823) Ampla
Sermyla transversa (Walker, 1854) Cerrado e Mata Atlântica
Sthenognatha gentilis Felder, 1874 Mata Atlântica
Tribo Phaegopterini (121 espécies)
Amaxia chaon (Druce, 1883) Amazônia, Cerrado e Mata Atlântica
Amaxia collaris Jones, 1912 Mata Atlântica
Amaxia dyuna Schaus, 1896 Cerrado e Mata Atlântica
Amaxia flavipuncta Hampson, 1904 Mata Atlântica
Amaxia hebe Schaus, 1892 Ampla
Amaxia kennedyi (Rothschild, 1909) Amazônia, Cerrado e Mata Atlântica
Amaxia pardalis Walker, 1855 Cerrado e Mata Atlântica
Amaxia punctata (Rothschild, 1909) Cerrado e Mata Atlântica
Ammalo helops (Cramer, 1775) Ampla
Ammalo travassosi Rego-Barros, 1974 Mata Atlântica
Bernathonomus minuta Fragoso, 1953 Mata Atlântica
Bernathonomus piperita (Herrich-Schäffer, 1855) Mata Atlântica
Bertholdia almeidai Travassos, 1950 Cerrado e Mata Atlântica
Bertholdia pseudofumida Travassos, 1950 Mata Atlântica
Bertholdia specularis (Herrich-Schäffer, 1853) Cerrado e Mata Atlântica
Carales astur (Cramer, 1777) Ampla
Carales maculicollis Walker, 1855 Amazônia, Cerrado e Mata Atlântica
Cissura decora Walker, 1854 Cerrado e Mata Atlântica
Cratoplastis catherinae (Rothschild, 1916) Amazônia, Cerrado e Mata Atlântica
Cresera annulata Schaus, 1894 Amazônia, Cerrado e Mata Atlântica
Cresera ilus (Cramer, 1776) Amazônia, Cerrado e Mata Atlântica
Demolis albitegula (Rothschild, 1935) Cerrado e Mata Atlântica
Echeta divisa (Herrich-Schäffer, 1855) Mata Atlântica
Echeta juno (Schaus, 1892) Mata Atlântica
Echeta minerva (Schaus, 1915) Cerrado e Mata Atlântica
Elysius cingulata (Walker, 1856) Cerrado e Mata Atlântica
Elysius conjunctus Rothschild, 1910 Amazônia, Cerrado e Mata Atlântica
Elysius conspersus Walker, 1855 Amazônia e Mata Atlântica
Elysius meridionalis Rothschild, 19107 Amazônia, Cerrado e Mata Atlântica
Elysius pyrosticta Hampson, 1905 Amazônia, Cerrado e Mata Atlântica
Elysius systron Schaus, 1904 Cerrado e Mata Atlântica
Emurena luridoides (Rothschild, 1910) Amazônia, Cerrado e Mata Atlântica
Euchaetes rizoma (Schaus, 1896) Cerrado e Mata Atlântica
Eupseudosoma grandis Rothschild, 1909 Amazônia, Cerrado e Mata Atlântica Glaucostola guttipalpis (Walker, 1856) Amazônia, Cerrado e Mata Atlântica
Gorgonidia garleppi (Druce, 1898) Amazônia e Mata Atlântica
Haemaphlebiella strigata (Jones, 1914) Amazônia, Cerrado e Mata Atlântica
Halysidota cyclozonata Hampson, 1901 Amazônia, Cerrado e Mata Atlântica
Halysidota interlineata Walker, 1855 Amazônia, Cerrado e Mata Atlântica
Hemihyalea diminuta (Walker, 1855) Amazônia, Campo Sulino e Mata Atlântica
Hyperthaema caroei Jörgensen, 1935 Cerrado e Mata Atlântica
Hypidalia enervis Schaus, 1894 Caatinga, Campo Sulino e Mata Atlântica
Espécies Distribuição geográfica no Brasil
Hyponerita pinon (Druce, 1911) Mata Atlântica
Idalus agastus Dyar, 1910 Ampla
Idalus carinosa (Schaus, 1905) Amazônia, Cerrado e Mata Atlântica
Idalus flavicostalis (Rothschild, 1935) Cerrado e Mata Atlântica
Idalus herois Schaus, 1889 Amazônia, Cerrado e Mata Atlântica
Idalus idalia (Hampson, 1901) Mata Atlântica
Idalus lineosus Walker, 1869 Ampla
Idalus metacrinis (Rothschild, 1909) Amazônia e Mata Atlântica
Ischnocampa lugubris (Schaus, 1892) Mata Atlântica
Ischnocampa styx Jones, 1914 Mata Atlântica
Ischnognatha semiopalina Felder, 1874 Amazônia, Cerrado e Mata Atlântica
Lepidokirbyia vittipes (Walker, 1855) Ampla
Lepidozikania cinerascens (Walker, 1855) Cerrado e Mata Atlântica
Leucanopsis acuta (Hampson, 1901) Mata Atlântica
Leucanopsis athor (Schaus, 1933) Mata Atlântica
Leucanopsis fuscosa (Jones, 1908) Cerrado e Mata Atlântica
Leucanopsis leucanina (Felder e Rogenhofer, 1874) Campo Sulino, Cerrado e Mata Atlântica
Leucanopsis oruba (Schaus, 1892) Cerrado e Mata Atlântica
Leucanopsis valentina (Schaus, 1924) Mata Atlântica
Machadoia xanthosticta (Hampson, 1901) Campo Sulino e Mata Atlântica
Mazaeras conferta Walker, 1855 Amazônia e Mata Atlântica
Mazaeras francki Schaus, 1896 Ampla
Mazaeras janeira (Schaus, 1892) Cerrado e Mata Atlântica
Melese amastris (Druce, 1884) Mata Atlântica
Melese babosa (Dognin, 1894) Ampla
Melese chozeba (Druce, 1884) Amazônia e Mata Atlântica
Melese dorothea (Stoll, 1782) Amazônia e Mata Atlântica
Melese hebetis Rothschild, 1909 Amazônia, Cerrado e Mata Atlântica
Melese peruviana Rothschild, 1909 Cerrado e Mata Atlântica
Opharus basalis Walker, 1856 Campo Sulino, Cerrado e Mata Atlântica
Opharus flavimaculata Hampson, 1901 Campo Sulino e Mata Atlântica
Opharus notata (Schaus, 1892) Mata Atlântica
Opharus procroides Walker, 1855 Campo Sulino, Cerrado e Mata Atlântica
Opharus rema (Dognin, 1891) Cerrado e Mata Atlântica
Ormetica chrysomelas (Walker, 1856) Cerrado e Mata Atlântica
Ormetica fulgurata (Butler, 1876) Mata Atlântica
Ormetica neira (Schaus, 1905) Amazônia e Mata Atlântica
Pachydota affinis Rothschild, 1909 Mata Atlântica
Pachydota albiceps (Walker, 1856) Amazônia e Mata Atlântica
Pachydota ducasa Schaus, 1905 Cerrado e Mata Atlântica
Pachydota saduca (Druce, 1895) Amazônia e Mata Atlântica
Pareuchaetes aurata (Butler, 1875) Ampla
Pareuchaetes insulata (Walker, 1855) Amazônia, Cerrado e Mata Atlântica
Parevia vulmaria Schaus, 1924 Cerrado e Mata Atlântica
Pelochyta cinerea (Walker, 1855) Campo Sulino, Cerrado e Mata Atlântica
Pelochyta pallida (Schaus, 1901) Mata Atlântica
Phaegoptera albimacula (Jones, 1908) Mata Atlântica
Phaegoptera chorima Schaus, 1896 Mata Atlântica
Phaegoptera depicta Herrich-Schäffer, (1855) Cerrado e Mata Atlântica Phaegoptera flavopunctata Herrich-Schäffer, (1855) Cerrado e Mata Atlântica
Espécies Distribuição geográfica no Brasil
Phaegoptera granifera Schaus, 1892 Cerrado e Mata Atlântica
Phaegoptera histrionica Herrich-Schäffer, (1853) Cerrado e Mata Atlântica
Phaegoptera nexa (Herrich-Schäffer, 1855) Mata Atlântica
Phaegoptera pseudocatenata Travassos, 1955 Mata Atlântica
Phaegoptera punctularis Herrich-Schäffer, (1855) Cerrado e Mata Atlântica
Phaegoptera schaefferi Schaus, 1892 Mata Atlântica
Phaegoptera superba (Druce, 1911) Mata Atlântica
Pseudotessellarctia brunneitincta (Hampson, 1901) Mata Atlântica
Psychophasma erosa (Herrich-Schäffer, (1858)) Amazônia, Cerrado e Mata Atlântica Rhipha subflammans (Rothschild, 1909) Amazônia, Campo Sulino e Mata Atlântica
Robinsonia spitzi (Rothschild, 1933) Mata Atlântica
Selenarctia flavidorsata Watson, 1975 Amazônia e Mata Atlântica
Sutonocrea reducta (Walker, 1956) Amazônia, Cerrado e Mata Atlântica
Sychesia dryas (Cramer, 1775) Campo Sulino e Mata Atlântica
Sychesia erubescens Jordan, 1916 Amazônia, Caatinga e Mata Atlântica
Symphlebia abdominalis (Herrich-Schäffer, 1855) Caatinga, Cerrado e Mata Atlântica
Symphlebia catenata (Schaus, 1905) Campo Sulino, Cerrado e Mata Atlântica
Symphlebia indistincta (Rothschild, 1909) Mata Atlântica
Symphlebia lophocampoides Felder, 1874 Amazônia, Cerrado e Mata Atlântica
Symphlebia perflua (Walker, 1869) Mata Atlântica
Tessellarctia semivaria (Walker, 1856) Campo Sulino e Mata Atlântica
Thysanoprymna pyrrhopyga (Walker, 1855) Cerrado e Mata Atlântica
Viviennea ardesiaca (Rothschild, 1909) Mata Atlântica
Viviennea dolens (Druce, 1904) Amazônia, Cerrado e Mata Atlântica
Viviennea flavicincta (Herrich-Schäffer, 1855) Mata Atlântica
Viviennea moma (Schaus, 1905) Amazônia, Cerrado e Mata Atlântica
Viviennea zonana (Schaus, 1905) Amazônia e Mata Atlântica
Xanthophaeina levis (Druce, 1899) Mata Atlântica
Subfamília Lithosiinae (1 espécie) Tribo Lithosiini (1 espécie)
Agylla argentea (Felder, 1874) Caatinga e Mata Atlântica
O esforço amostral total dos coletores na EBB foi de 410 noites e as coletas abrangeram todos os meses do ano. O primeiro registro de coleta na EBB, de acordo com os exemplares examinados nas coleções, ocorreu em setembro de 1930 e o último em julho de 2002. As coletas foram mais intensas nas décadas de 1940 e 1960, totalizando 188 e 114 noites de coleta, respectivamente. Apenas uma coleta foi realizada depois de 1984, em 2002. Vários pesquisadores coletaram mariposas Arctiidae na EBB: Lauro Travassos, Lauro Travassos Filho, Ernesto Rabello, Henry Pearson, Paulo Vanzolini, Augusto Santos, Mário Ventel, Romualdo D’Almeida, Mauro Barreto, Benedito Soares, Arnaldo Macedo, Carlos Gaeta, Clemente Pereira, Messias Carrera, José Oiticica, John Lane, Donias Braz, Eduardo Navajas, Werner Bockermann, Hélio Camargo, Emílio Dente, Moysés Kuhlmann, Milton Peña, Lindolfo Guimarães, John Hood, Ludwig Buckup, entre outros (ordem de citação em função da contribuição de coletas), contribuindo com o conhecimento dos arctiídeos da EBB e com o aumento da coleção de Lepidoptera do Museu de Zoologia da USP. Várias espécies novas de Arctiidae foram descritas a partir de exemplares coletados na EBB (Travassos 1949, 1950, 1955; Rego
Barros, 1974). Ademais, existe ainda a possibilidade de algumas das 19 morfoespécies não identificadas nas coleções serem espécies ainda não descritas. A alta biodiversidade, os endemismos e o grande número de espécies novas de Arctiidae reforçam a importância de se preservar a EBB e a área do seu entorno. Futuramente, seria interes-sante investigar, por exemplo, se as outras famílias de lepidópteros noturnos também apresentam alta riqueza na EBB, quando comparada a outros locais de área preservada.
Agradecimentos
Ao Dr. Vitor O. Becker pelo empréstimo de bibliografia, pelo acesso à sua coleção, pela permissão do registro fotográfico e pelo auxílio nas identificações das espécies de Arctiidae. Aos responsáveis pelas coleções visitadas, Dr. Olaf Mielke (UFPC), Dr. Marcelo Duarte (MZUSP), Dra. Jane Costa (FIOC) e Alexandre Soares (MNRJ) por permitir o acesso às coleções, pelo apoio logístico e pela atenção dispensada. A dois revisores anônimos pela leitura crítica do ma-nuscrito. À CAPES e ao CNPq (141715/2005-7; 303992/2004-2; 472211/2003-0) pelo financiamento deste trabalho.
BROWN JR, K.S. & FREITAS, A.V.L. 1999. Lepidoptera. In Biodiversidade do Estado de São Paulo: síntese do conhecimento ao final do século XX. Volume 5. Invertebrados terrestres (C.R.F. Brandão & Cancello E.M., eds.). Fapesp, São Paulo, p. 225-243.
HEPPNER, J.B. 1991. Faunal regions and the diversity of Lepidoptera. Trop. Lepid. 2:1-85.
HILT, N. & FIEDLER, K. 2005. Diversity and composition of Arctiidae moth ensembles along a successional gradient in the Ecuadorian Andes. Diversity Distrib. 11:387-398.
JACOBSON, N.L. & WELLER, S.J. 2002. A cladistic study of the Arctiidae (Lepidoptera) by using characters of immatures and adults. Thomas Say Publication in Entomology: Monographs. Entomological Society of America, Lanham.
MYERS, N., MITTERMEIER, R.A., MITTERMEIER, C.G., FONSECA, G.A.B. & KENT, J. 2000. Biodiversity hotspots for conservation priori-ties. Nature 403:853-858.
Duas novas espécies do gênero Ammalo Walker, 1855
(Lepidoptera-Heterocera). Rev. Brasil. Biol. 34: 195-202.
SCOBLE, M.J. 1995. The Lepidoptera: form, function and diversity. Oxford University Press, New York.
TRAVASSOS, L. 1949. Contribuição ao conhecimento dos “Arctiidae”. XIX. (Lepidoptera, Heterocera). Rev. Brasil. Biol. 9:443-462.
TRAVASSOS, L. 1950. Contribuição ao conhecimento dos “Arctiidae”. XXII. Ainda sôbre as espécies do gênero “Bertholdia” Schaus, 1896. Rev. Brasil. Biol. 10:447-464.
TRAVASSOS, L. 1955. Contribuição ao conhecimento dos Arctiidae XXXI. Sôbre as espécies do gênero Phaegoptera (Lepidoptera, Heterocera). Arq.
Mus. Nac. XLII:621-682.
TRAVASSOS-FILHO, L. & CAMARGO, H.F.A. 1958. A Estação Biológica de Boracéia. Arq. Zool. S. Paulo 11:1-21.