UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE BIOCIÊNCIAS
DEPARTAMENTO DE ECOLOGIA
PROGRAMA DE PÓS-GRADUAÇÃO EM ECOLOGIA
Adição de policloreto de alumínio e remoção de
peixes bentívoros como técnicas de restauração
de lagos rasos do semiárido brasileiro
Fabiana Oliveira de Araújo Silva
Orientador: Prof. Dr. José Luiz Attayde, UFRN Co-orientadora: Profa. Dra. Vanessa Becker, UFRN
Adição de policloreto de alumínio e remoção de
peixes bentívoros como técnica de restauração de
lagos rasos do semiárido brasileiro
Fabiana Oliveira de Araújo Silva
Tese apresentada ao Programa de Pós-graduação em Ecologia da Universidade Federal do Rio Grande do Norte como parte integrante dos requisitos para obtenção do grau de Doutora em Ecologia.
Orientador: Prof. Dr. José Luiz Attayde Co-orientadora: Profa. Dra. Vanessa Becker
Catalogação da Publicação na Fonte. UFRN / Biblioteca Setorial do Centro de Biociências
Silva, Fabiana Oliveira de Araújo.
Adição de policloreto de alumínio e remoção de peixes bentívoros como técnicas de restauração de lagos rasos do semiárido brasileiro / Fabiana Oliveira de Araújo Silva.–Natal, RN, 2015.
88 f.: il.
Orientador: Prof. Dr. José Luiz Attayde. Coorientadora: Profa. Dra. Vanessa Becker.
Tese (Doutorado) – Universidade Federal do Rio Grande do Norte. Centro de Biociências. Programa de Pós-Graduação em Ecologia.
1. Biomanipulação. – Tese. 2. Fósforo. – Tese. 3. Restauração. –
Adição de policloreto de alumínio e remoção de peixes bentívoros como técnica de restauração de lagos rasos do semiárido brasileiro
Fabiana Oliveira de Araújo Silva
Orientadores: Dr. José Luiz Attayde & Dra. Vanessa Becker
Tese apresentada ao Programa de Pós-graduação em Ecologia da Universidade Federal do Rio Grande do Norte como parte integrante dos requisitos para obtenção do grau de Doutora em Ecologia.
Aprovada por:
________________________ Presidente Prof. Dr. José Luiz Attayde, UFRN
________________________ Profa. Dra. Vanessa Becker, UFRN
_______________________ Prof. Dr. André Megali Amado, UFRN
________________________ Profa. Dra. Renata Panosso, UFRN
_______________________ Prof. Dr.José Etham de Lucena Barbosa, UEPB
Agradecimentos
Primeiramente gostaria de agradecer ao meu amigo e orientador Coca (Prof. José Luiz Attayde) pela oportunidade e aprendizado ao longo dos últimos oito anos. Agradeço imensamente pelo carinho, pela confiança, conselhos, amizade, por tudo!
Agradeço também à Profa. Vanessa Becker, uma amiga e orientadora que tive a oportunidade de conhecer pouco antes de ingressar no doutorado, que sempre me incentivou e acreditou em mim. Obrigada pelo carinho, atenção, cuidado e ensinamentos. Sua força e determinação me inspiram.
Agradeço ao Programa de Pós-Graduação em Ecologia, ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) pelo financiamento da pesquisa e à Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) pela concessão de bolsa de doutorado e ao Projeto CAPES-Universidade de Wageningen pela concessão da bolsa de estágio de doutorado no exterior.
Agradeço ao Prof. Miquel Lurling, orientador na Universidade de Wageningen, pelos ensinamentos e oportunidade concedida. Agradeço também ao amigo Frank pela imensa ajuda e orientação com os experimentos em laboratório, sem esquecer da ajuda e do carinho da Wendy e do John. Muito obrigada!
Agradeço aos amigos brasileiros que fiz na Holanda: Marina, Felipe, Thadeu e, em especial, a Luciana Rangel. A amizade de vocês fez toda a diferença nesse período que morei longe da minha família e amigos. Muito obrigada pela companhia, passeios, risadas, conselhos e amizade. Lu, agradeço imensamente a Deus por ter colocado você em minha vida num momento tão difícil pra mim. Obrigada pelo seu carinho e amizade! Muito obrigada aos meus queridos amigos Mariana, Marcolina, Gabi, Pablo e Danyhelton – muito obrigada pela ajuda com os experimentos, com a tese, conselhos, pelo apoio, por sempre me incentivarem, pelas reuniões na universidade ou na mesa do bar... Muito obrigada pela amizade de vocês! A batalha é grande, mas juntos somos mais fortes!
Agradeço também aos amigos do LEA (Laboratório de Ecologia Aquática): Elinez, Rosemberg, Leonardo, Alex, Bárbara, e aos amigos do LARHISA (Laboratório de Recursos Hídricos e Saneamento Ambiental): Jurandir, Ângela, Aline, Laíssa, pela ajuda nos experimentos ou com a tese, e pela amizade.
Agradeço aos meu queridos amigos (ex)biólogos e afins: Cabeça, Ricardo, Tiego, Pan, Débora, Kívia, Mary, Fernanda e Nara. Muito obrigada pela amizade de vocês!
Agradeço a minha querida amiga Esther, um anjo que Deus colocou em minha vida, pela sua amizade, carinho, cuidados, apoio, incentivo, conselhos, por me ouvir e compartilhar bons momentos. Você é muito especial pra mim! Muito obrigada!
Agradeço também ao Professor Hélio Rodrigues pela parceria em um dos capítulos desta tese. Muito obrigada pelas contribuições e por compartilhar seu conhecimento.
Sumário
Resumo ... 8
Abstract... 9
Introdução ... 10
Dinâmica do Fósforo em Lagos... 11
Restauração de Lagos Eutrofizados através de Métodos Físicos ... 12
Restauração de Lagos Eutrofizados através de Métodos Químicos ... 13
Restauração de Lagos Eutrofizados através da Biomanipulação ... 17
O semiárido e a Problemática da Qualidade da Água ... 18
Objetivos... 20
CAPÍTULO I. Effects of polyaluminium chloride and lanthanum modified bentonite on the growth rates of three Cylindrospermopsis raciborskii strains... 22
Abstract... 22
1. Introduction ... 23
2. Materials and methods... 25
3. Results ... 28
4. Discussion... 29
5. Conclusions ... 32
References ... 33
CAPÍTULO II. Shallow lake restoration by the combined effects of polyaluminium chloride addition and benthivorous fish removal: a field mesocosm experiment. ... 43
Abstract... 43
1. Introduction ... 44
2. Material and methods ... 46
3. Results ... 47
4. Discussion... 48
Rerences... 49
CAPÍTULO III. The use of polyaluminium chloride as a restoration measure to improve water quality in tropical shallow lakes ... 58
Abstract... 58
1. Introduction ... 59
2. Material and methods ... 60
3. Results ... 62
4. Discussion... 63
References ... 65
Considerações Finais ... 73
Resumo
A eutrofização cultural é a causa mais comum de deterioração da qualidade da água no mundo. Este processo se dá pela entrada excessiva de nutrientes, especialmente nitrogênio e fósforo, nos corpos aquáticos causando florações de algas e cianobactérias. Em lagos rasos esses efeitos são mais acentuados devido a uma maior interação do corpo aquático com o entorno, com o ar e o sedimento. Existem várias técnicas de restauração de lagos eutrofizados, com uma vasta gama de resultados bem sucedidos, mas no Brasil há apenas um único caso de restauração bem sucedida: o lago Paranoá em Brasília. A região semiárida brasileira possui milhares de lagos artificiais, regionalmente chamados de açudes, em sua maioria rasos e eutróficos. A eutrofização desses corpos aquáticos é documentada e o fitoplâncton desses ambientes é frequentemente dominado por cianobactérias potencialmente produtoras de toxinas. O principal objetivo deste trabalho é testar diferentes técnicas de restauração da qualidade da água que possam ser facilmente aplicadas em lagos rasos do semiárido brasileiro. Resultados de um experimento em laboratório sugerem que a aplicação de argila adsorvente de fósforo associada a um coagulante à base de alumínio é uma técnica efetiva na remoção do fósforo solúvel reativo e na diminuição da taxa de crescimento da Cylindrospermopsis raciborskii, cianobactéria potencialmente tóxica que domina nos
Abstract
Introdução
Ao longo dos anos, o crescimento da população humana, o consequente desenvolvimento industrial e a expansão da agricultura, têm gerado uma forte tensão sobre os ecossistemas de água doce disponíveis no mundo. O uso de fertilizantes pela agricultura, a produção intensiva de animais e outros usos inadequados da terra têm alterado os ciclos biogeoquímicos e acelerado a entrada de nutrientes para os sistemas aquáticos (Vitousek et al., 1997). Além disso, os sistemas aquáticos funcionam como receptores de água não tratada (esgotos domésticos e industriais) em muitos lugares no mundo (Carpenter et al., 1998). A eutrofização, processo natural de enriquecimento do sistema aquático pela entrada de nutrientes, principalmente o nitrogênio (N) e o fósforo (P), têm sido acelerada pelas atividades antropogênicas, levando à deterioração da qualidade das águas superficiais. A eutrofização é considerada o problema de qualidade da água mais importante no mundo (Smith & Schindler, 2009).
Lagos eutrofizados experimentam diversos problemas que inviabilizam o seu uso múltiplo. O enriquecimento por nitrogênio e fósforo resulta no aumento da biomassa fitoplanctônica, levando à redução da transparência da água (Smith, 1998). A decomposição dessa grande quantidade de matéria orgânica resulta em baixos níveis de oxigênio dissolvido, o que pode levar à morte de peixes. Muitas vezes a eutrofização está associada ao desenvolvimento de florações de cianobactérias potencialmente produtoras de toxinas que são nocivas a muitos animais, inclusive ao homem (Chorus & Bartram, 1999), representando assim uma ameaça aos recursos aquáticos e a saúde pública (Smith & Schindler, 2009; Paerl et al., 2011). Além disso, essas florações liberam outras substâncias químicas que causam gosto e odor na água (Chorus & Bartram, 1999) aumentando assim os custos com o tratamento. A eutrofização resulta na degradação da qualidade da água e na perda dos serviços que este recurso provém (Smith, 2003), podendo esta ser a principal causa de escassez de água no mundo (UN-Water, 2007).
oferecidos (Postel & Carpenter, 1997), tem levado a criação de diversas estratégias de restauração de lagos eutrofizados ao longo dos últimos anos.
Dinâmica do Fósforo em Lagos
A principal medida para controle da eutrofização e as consequentes florações de cianobactérias é a redução da carga externa de nutrientes, principalmente o fósforo, a níveis que possam limitar a produção primária (Cooke et al., 2005; Carpenter, 2008; Schindler et al., 2008; Schindler, 2012). As fontes pontuais de poluição, representadas pelas descargas diretas de efluentes domésticos e industriais, são facilmente controladas quando comparadas com as fontes difusas (Carpenter et al., 1998). Estas, por sua vez, referem-se ao escoamento de nutrientes oriundos da agricultura, do pasto e de outros locais na bacia de drenagem, através da lixiviação do solo e consequente destino final no corpo aquático, e representam um desafio no que diz respeito ao monitoramento e redução das cargas. Em muitos casos a redução da entrada externa de nutrientes para os sistemas aquáticos resultam na redução do estado trófico e produção primária, e aumento na transparência da água (Marsden, 1989; Jeppesen et al., 2005). No entanto, muitos lagos rasos apresentam retardo ou falha no processo de restauração após a redução da entrada externa de nutrientes (Marsden, 1989; Jeppesen et al., 1991; Van der Molen & Boers, 1994; Søndergaard et al., 2000), fato que tem sido atribuído principalmente à carga interna de fósforo (Søndergaard et al., 1999, 2003; Cooke et al., 2005).
varia entre lagos e é determinado principalmente pelo histórico do lago, a composição e a capacidade do sedimento de reter o fósforo (Pettersson, 1998). Lagos que receberam por muito tempo uma alta carga externa de fósforo possuem sedimentos ricos em fósforo o que permite sustentar a eutrofização por muito tempo, mesmo quando cessam as entradas externas, o que explica o atraso na recuperação (Marsden, 1989; Jeppesen et al., 1991; Van der Molen & Boers, 1994; Søndergaard et al., 2000).
Lagos eutrofizados que experimentam processos de estratificação tem a liberação de fósforo do sedimento relacionada às condições de anoxia na superfície do sedimento. Na ausência de oxigênio na interface água-sedimento, o ferro e o alumínio tornam-se solúveis liberando assim o fosfato. Lagos rasos geralmente são bem misturados e possuem a coluna de água bem oxigenada, e a liberação de fósforo do sedimento ocorre em condições aeróbicas (Boström et al., 1988; Jensen & Andersen, 1992; Jeppesen et al., 1997). Neste caso, outros fatores são determinantes na liberação do fósforo do sedimento: pH, disponibilidade de nitrato, atividade de bactérias, processos de mineralização, ressuspensão e mistura do sedimento por eventos físicos ou organismos bioturbadores (Søndergaard et al., 2001; Hupfer & Lewandowski, 2008). Em lagos rasos, a liberação do P do sedimento é particularmente importante uma vez que há uma maior interação sedimento-água quando comparados com lagos profundos (Søndergaard et al., 2003), podendo constituir uma fonte significante deste nutriente e ainda exceder a carga externa de P (Boers et al., 1998; Søndergaard et al., 1999). Portanto, na restauração de lagos rasos eutrofizados é extremamente importante levar em consideração a carga interna de fósforo. Durante as últimas décadas, estratégias adicionais à redução da carga externa de fósforo vêm sendo desenvolvidas e testadas na restauração de lagos rasos eutrofizados. Essas estratégias envolvem métodos físicos, químicos e biológicos, apresentados a seguir.
Restauração de Lagos Eutrofizados através de Métodos Físicos
concentração de nutrientes para que seja possível a diluição ou a troca pela água eutrofizada, para que o nível da água do lago permaneça relativamente constante. A adição/remoção de água está associada à entrada de água com baixas concentrações de nutrientes para a manutenção do nível de água do lago, sendo inviável e de elevado custo em regiões que apresentam a escassez desse recurso. Além disso, essa técnica apresenta problemas quanto ao descarte da água de má qualidade (baixas concentrações de oxigênio e altas concentrações de nutrientes e metais) removida (Kumar, 2008) e altos custos com o tratamento desta água para uso.
Outra estratégia de restauração envolve a oxigenação mecânica da camada hipolimnética anóxica, em lagos estratificados, ou a circulação de toda camada de água (Cooke et al., 2005), o que permite a retenção de fósforo no sedimento (Nurnberg, 1987b) e boas condições para os peixes. Ambas as técnicas tem sido empregadas com sucesso em muito lagos (Cooke et al., 2005), mas há casos em que o aumento da concentração de oxigênio não apresentou efeito significante na carga interna de fósforo (Gächter & Wehrli, 1998).
A remoção do sedimento rico em nutrientes pode ser uma alternativa em lagos que sofrem com a contínua liberação de fósforo do sedimento. Embora efetiva em reduzir a liberação de fósforo do sedimento, esta técnica é pouco aplicada por ser cara e apresentar problemas com a ressuspensão de partículas e matéria orgânica que promovem aumento da turbidez e depleção de oxigênio, respectivamente (Jeppesen et al., 2007), remoção de alimento para peixes bentívoros e habitat para organismos bentônicos, além dos problemas com a disposição adequada para o sedimento removido (Cooke et al., 2005). Além disso, a nova superfície do sedimento pode apresentar baixa capacidade de retenção do fósforo (Søndergaard et al., 2007).
Restauração de Lagos Eutrofizados através de Métodos Químicos
Os métodos químicos para a restauração de lagos eutrofizados envolvem a melhoria ou o aumento da capacidade do sistema em reter fósforo e a diminuição da carga interna desse nutriente no lago. Este objetivo pode ser alcançado pela precipitação de fósforo presente na água do lago e inativação do fósforo no sedimento (Cooke et al., 2005), ou indiretamente através dos processos envolvidos na retenção do fósforo no sedimento.
da depleção de oxigênio no sedimento (Foy, 1986; Søndergaard, 2007; Jiang et al., 2008). Foi observado que adição de nitrato pode inibir a liberação do fósforo de sedimentos anóxicos e óxicos (Andersen, 1982). Contudo, tais medidas devem ser consideradas em situações onde a liberação do fósforo do sedimento está associada às condições de anoxia.
A adição de sais de metais (alumínio e o ferro) e outros compostos (argilas naturais ou modificadas) adsorventes de fosfato ao lago promovem a precipitação do fósforo presente na água e a inativação deste no sedimento. Coagulantes à base de ferro e alumínio são comumente utilizadas no tratamento de água e efluentes (Jiang & Graham, 1998a) e tem sido utilizada como medida de restauração de lagos eutrofizados através da precipitação do fósforo (Cooke et al., 2005). Ao serem adicionados à água, o ferro e alumínio reagem com o fosfato formando precipitados, pelo processo de coagulação e floculação, que então são removidos da coluna de água pelo processo de sedimentação. Além da remoção do fósforo dissolvido, a coagulação/floculação pelo ferro e alumínio remove a matéria orgânica e inorgânica (Jiang et al., 1993; Jiang & Graham, 1998b; Drikas et al., 2001; Hullebusch et al., 2002), e reduzem a concentração de fósforo total presente nas partículas suspensas após a sedimentação dos flocos (Reitzel et al., 2003; Auvray et al., 2006).
Coagulantes à base de ferro (sulfato férrico [Fe2(SO4)3] ou cloreto férrico [FeCl3]) tem sido utilizado para a remoção de fósforo (Yamada et al., 1986; Deppe & Benndorf, 2002) ou para a remoção da biomassa de cianobactérias (Chow et al., 1998) pela precipitação dos flocos formados. Para a inativação do fósforo sedimentado, o sedimento precisa manter-se oxidado para evitar a redução do ferro e a consequente liberação do fósforo (Nurnberg, 1994).
Coagulantes à base de alumínio apresentam vantagem sobre os coagulantes à base de ferro, pois a efetividade não é dependente das condições redox. Em virtude disso, o alumínio tem sido amplamente usado na restauração de lagos (Cooke et al., 2005). Dentre os coagulantes à base de alumínio, o sulfato de alumínio (Al2(SO4)3) é o mais comumente utilizado e sua efetividade em remover fósforo tem sido reportada baseada em experimentos em laboratório e em aplicações em lago inteiro (Welch & Schrieve, 1994; Hullebusch et al., 2002; Lewandowski et al., 2003; Reitzel et al., 2003, 2005).
consequentemente, ao declínio do pH da água. Em baixos valores de pH, o alumínio apresenta toxicidade a peixes (Baker & Schofield, 1982; Poléo et al., 1997), macroinvertebrados (Havens, 1993) e anfíbios (Freda, 1991), o que limita a quantidade de coagulante que pode ser adicionada. Baseado nisso, a dose de alumínio a ser aplicada no lago pode ser determinada levando em consideração a alcalinidade da água (Cooke et al., 2005), ou seja, quanto pode ser adicionado sem que se atinja o pH onde o alumínio apresenta toxicidade. Contudo, essa abordagem não leva em consideração o pool de fósforo no sedimento que poderá ser mobilizado e fazer parte da carga interna. Em lagos com baixa ou moderada alcalinidade, este problema pode ser resolvido adicionando-se um tampão (hidróxido de sódio, hidróxido de cálcio ou carbonato de sódio) durante a aplicação do coagulante.
A fim de solucionar problemas com a acidificação da água após a aplicação de coagulantes à base de alumínio, compostos pré-hidrolizados foram desenvolvidos, como o policloreto de alumínio (PAC). Coagulantes pré-hidrolizados são feitos a partir da hidrólise parcial do ácido em condições controladas, o que permite o não consumo de hidroxilas (OH-), não reduzindo o pH da água após a aplicação. O policloreto de alumínio tem recebido atenção especial por possuir uma desempenho de coagulação superior devido a sua atuação em um amplo espectro de pH, menor sensitividade a baixas temperaturas, necessidade de menor dose e menores concentrações de alumínio residual (Jiang & Graham, 1998b), e vem sendo usado como uma alternativa para o sulfato de alumínio. Estudos em laboratório e em lagos tem mostrado o desempenho do PAC em remover fósforo e turbidez da água (Reitzel et al., 2003, 2005; Gao et al., 2005; Lopata & Gawrońska, 2008; Chen & Luan, 2010; Julio et al., 2010; Yang et al., 2010; Egemose et al., 2011; Jancula & Maršálek, 2012). Contudo, uma vez que coagulação/floculação é diretamente afetada pela presença de partículas e matéria orgânica dissolvida presentes na água (Edzwald, 1993) e também pela química da água – pH e alcalinidade (Pernitsky & Edzwald, 2006), a performance do PAC pode depender da turbidez e do estado trófico da água, variando de acordo com as características da água.
liberação do fósforo presente no sedimento para a água após a precipitação. O objetivo é cobrir o sedimento e atuar como uma barreira química ativa (Jacobs & Förstner, 1999) que inibe a liberação de fósforo do sedimento. As argilas apresentam vantagem na aplicação em lagos, pois não levam a acidificação da água, não necessitando do uso de tampões em lagos com baixa alcalinidade. Além disso, tem sido relatada a eficiência de argilas na remoção por sedimentação de florações cianobactérias potencialmente produtoras de toxinas (Pan et al., 2006a, 2006b; Verspagen et al., 2006).
Dentre esses compostos, a argila bentonita modificada com adição de lântanio (Phoslock®) se destaca por ser bem testada com sucesso em lagos para controle do fósforo e florações (Spears et al., 2013). O lantânio adicionado a bentonita possui uma extrema afinidade ao fosfato dissolvido na água (Johannesson & Lyons, 1994; Liu & Byrne, 1997) e tem sido considerado um método promissor para mitigar a eutrofização em lagos onde a maior parte do fósforo se encontra em sua forma dissolvida (e.g. Douglas et al., 1999; 2004; Robb et al., 2003; Ross et al., 2008; Haghseresht et al., 2009, van Oosterhout and Lurling 2013).
Em lagos eutrofizados com elevada biomassa de algas, boa parte do fósforo encontra-se presente nos organismos, principalmente na biomassa fitoplanctônica. Cianobactérias como a Cylindrospermopsis raciborskii, por exemplo, possuem uma alta capacidade de estocar fósforo (Padisák, 1997), podendo ser uma importante fonte deste nutriente para o sistema. Esse fósforo pode então ser removido através de coagulação-floculação. Em seguida, argilas adsorventes de fósforo podem ser aplicadas para auxiliar no processo de sedimentação, aumentando o peso dos flocos, e capturando o fósforo dissolvido da água. Ao atingir o fundo do lago, a argila cobre todo o sedimento e a matéria sedimentada pelo coagulante. A combinação desses compostos tem sido bem testada apresentando resultados positivos (Sengco & Anderson, 2004; Beaulieu et al., 2005; Hagström & Granéli, 2005; Sengco et al., 2005; Pan et al., 2006a, 2006b, 2012; Zou et al., 2006; Wang et al., 2012)e recentemente denominada de técnica ‘Flock and Lock’(Lürling & van Oosterhout, 2013).
momento da aplicação da técnica. Tem sido sugerido que a concentração celular afeta a eficiência de remoção pelo complexo coagulante-argila uma vez que o aumento na quantidade de partículas no sistema aumenta a taxa de floculação (Hagström & Granéli, 2005; Sengco et al., 2005).
Restauração de Lagos Eutrofizados através da Biomanipulação
A biomanipulação de peixes é uma técnica bastante utilizada na recuperação de lagos eutrofizados (Meijer et al., 1994; Perrow et al., 1997; Hansson et al., 1998; Drenner and Hambright, 1999; Meijer et al., 1999; Mehner et al., 2002; Jeppensen et al., 2007; Jeppensen et al., 2012). O objetivo desta técnica é a redução da biomassa algal e o aumento da transparência da água do lago. Peixes planctívoros diminuem a abundância do zooplâncton de maior porte devido a predação sobre esses organismos, o que resulta no aumento da biomassa de fitoplâncton (Carpenter et al., 1985). Logo, a redução da biomassa de peixes planctívoros, através da remoção seletiva dessas espécies ou pela introdução de espécies piscívoras, se apresenta como estratégia de restauração. Contudo, esta teoria não aplica a lagos e reservatórios tropicais como nas regiões temperadas devido a diferenças nas interações biológicas (Jeppesen et al., 2007). Lagos tropicais apresentam mais onivoria (Lazzaro, 1997), com peixes pequenos e de reprodução contínua ao longo do ano e uma comunidade zooplanctônica geralmente dominada por organismos de pequeno tamanho (Fernando, 1994), o que dificulta a manipulação da estrutura da teia trófica.
associados com a remoção de curimatã (P. brevis), ressaltando a importância dessa espécie em manter a eutrofização nesses ambientes (Dantas, 2015).
O semiárido e a Problemática da Qualidade da Água
Os açudes do semiárido brasileiro são lagos rasos artificiais construídos para o armazenamento de água para abastecimento público, como alternativa para solução de problemas com a escassez deste recurso na região e estima-se a existência de 70.000 açudes de mais de 1.000 m² nesta região (Molle, 1994). Devido à escassez de água, os reservatórios no semiárido apresentam vazões reduzidas e consequentemente um elevado tempo de retenção da água, além de um balanço hídrico negativo durante a maior parte do ano devido às altas taxas de evapotranspiração, contribuindo assim, para o acúmulo e concentração de sais e nutrientes, tornando esses ambientes mais vulneráveis à eutrofização (Barbosa et al., 2012). As previsões para os próximos anos apontam o agravamento dos períodos secos (Marengo et al., 2009; Roland et al., 2012). Muitos desses reservatórios recebem ainda uma elevada carga externa de nutrientes em função da alta susceptibilidade dos solos à erosão, da falta de saneamento básico e de padrões inadequados de uso e ocupação do solo. Como consequência, muito deles sofrem com a eutrofização e as persistentes florações de cianobactérias, sendo a Cylindrospermopsis raciborskii uma espécie importante nas florações do semiárido
brasileiro(Bouvy et al., 1999; Lazzaro et al., 2003; da Costa et al., 2006; Sant’Anna et al., 2006; Panosso et al., 2007; Costa et al., 2009; Soares et al., 2013). A cianobactéria C. raciborskii tem recebido uma atenção especial devido a sua potencial toxicidade e a
problemáticas florações de alta densidade em lagos e reservatórios tropicais (Bouvy et al., 2000; McGregor & Fabbro, 2000; Soares et al., 2013). O seu sucesso tem sido atribuído principalmente a sua capacidade de captar e estocar fósforo (Padisák, 1997; Isvánovics et al., 2000; Posselt et al., 2009), representando assim uma importante fonte deste nutriente para o sistema. Além disso, esta cianobactéria filamentosa possui a habilidade de regular sua posição na coluna de água através de vacúolos de gás (Walsby, 1994), oferecendo assim vantagens sobre as outras espécies (Reynolds et al., 1987; Dokulil & Teubner, 2000; Burford & Davis, 2011).
drenagem. A principal fonte de nutrientes relatada para sete reservatórios inseridos em diferentes bacias hidrográficas no semiárido potiguar é a pecuária, seguido de agricultura (Vasconcelos, 2011). Logo, o controle da entrada de nutrientes envolve uma complexidade de medidas sociais e econômicas que muitas vezes podem ser consideradas inexequíveis, como por exemplo, a redução da criação de animais no entorno dos reservatórios. Portanto, esforços devem ser voltados para estratégias de restauração in situ.
No Brasil, um único caso de restauração de lago é reportado para o Lago Paranoá, em Brasília/DF, onde uma massiva mortandade natural de peixes levou a redução da biomassa fitoplanctônica e a melhoria da transparência da água (Starling et al., 2002). As diferenças entre lagos temperados e tropicais dificultam a aplicação em lagos tropicais de métodos de restauração que apresentam resultados positivos em lagos temperados. Em lagos tropicais o aporte interno de nutrientes parece ser mais importante do que em lagos temperados, onde a carga interna é relevante apenas durante alguns meses do ano (verão) (Søndergaard et al., 2013). Além disso, a entrada difusa de nutrientes para os lagos tropicais representa uma menor contribuição em regiões que sofrem com a escassez de chuvas. Logo, o manejo da carga interna de nutrientes e o controle ascendente da produção primária deve ser o foco da restauração de lagos rasos eutrofizados em regiões tropicais (Jeppesen et al., 2007; Beklioglu et al., 2011). Diante disto, este estudo preenche a lacuna existente sobre a eficiência de métodos de controle da carga interna de nutrientes e de florações de cianobactérias no semiárido brasileiro. Tem sido relatada a eficiência de argilas na remoção por sedimentação de florações de Microcystis (Pan et al., 2006a, 2006b), e que a cepa pode afetar a eficiência da
coagulação (Verspagen et al., 2006). O caráter inovador deste trabalho se dá pela investigação da eficiência de coagulantes e argilas em remover florações de C. raciborskii, cianobactéria dominante na região em questão. A sedimentação de
filamentos de C. raciborskii pode ser afetada pela presença de vacúolos de gás e, até o momento, não se sabe se a eficácia da técnica em reduzir o crescimento de C. raciborskii é afetada pela cepa ou pela biomassa de algas no lago momento da
aplicação.
bentívoros podem dificultar a consolidação do sedimento (Scheffer et al., 2003) e reduzir a efetividade da cobertura do sedimento com compostos que adsorvem o fósforo (Lewandowski et al., 2003). Como consequência, o fósforo ligado a estes compostos pode retornar a coluna de água e tornar-se disponível para o fitoplâncton (Jeppesen et al., 2007). Em lagos em que o sedimento representa uma importante fonte de fósforo e que a comunidade de peixes é dominada por espécies que possuem o hábito de ressuspender o sedimento, contribuindo assim para aumentar a carga interna de fósforo, verifica-se a necessidade de se investigar a combinação de técnicas de biomanipulação e remoção de fósforo.
Objetivos
Diante deste contexto, o objetivo geral desta tese é testar diferentes técnicas de restauração da qualidade da água que possam ser facilmente aplicadas nos açudes do semiárido brasileiro, visando à recuperação desses corpos aquáticos em uma região que sofre com a escassez de água de boa qualidade.
No primeiro capítulo dessa tese, objetivou-se avaliar o efeito da técnica “Flock and Lock” na sedimentação e crescimento da cianobactéria C. raciborskii, em testes de laboratório. Neste capítulo foi testada a hipótese de que a combinação do floculante policloreto de alumínio (PAC) e da argila bentonita modificada com lantânio (LMB) irá sedimentar efetivamente a C. raciborskii em tubos testes, independente da cepa utilizada. Em seguida, foi testada a hipótese que a combinação de uma baixa dose de PAC com a dose recomendada pelo fabricante de LMB irá inibir o crescimento da C. raciborskii independente da biomassa e da cepa.
remoção de peixe bentívoro sobre a qualidade da água de um lago raso tropical em escala de mesocosmo.
CAPÍTULO I. Effects of polyaluminium chloride and
lanthanum modified bentonite on the growth rates of three
Cylindrospermopsis raciborskii strains.
Araújo, F.a, van Oosterhout, F.b, Becker, V.c, Attayde, J. L.d, Lürling, M.b,f
a Programa de Pós-Graduação em Ecologia. Universidade Federal do Rio Grande do Norte, 59078970
Natal, RN, Brazil.
b Aquatic Ecology and Water Quality Management Group, Department of Environmental Sciences,
Wageningen University, P.O. Box 47, 6700 AA Wageningen, The Netherlands.
cLaboratório de Recursos Hídricos e Saneamento Ambiental, Departamento de Engenharia Civil, Centro
de Tecnologia. Universidade Federal do Rio Grande do Norte, 59078970 Natal, RN, Brazil.
d Departamento de Ecologia, Centro de Biociências. Universidade Federal do Rio Grande do Norte,
59078970 Natal, RN, Brazil.
fDepartment of Aquatic Ecology, Netherlands Institute of Ecology (NIOO-KNAW), P.O. Box 50, 6700 AB
Wageningen, The Netherlands.
Abstract
In tropical and subtropical lakes, eutrophication often leads to nuisance blooms of the filamentous cyanobacteria Cylindrospermopsis raciborskii. In this study, we tested the combined effects of the coagulant polyaluminium chloride (PAC) and the lanthanum modified bentonite (LMB, Phoslock®) on the sinking and growth rates of three C. raciborskii strains in laboratory experiments. We tested the hypothesis that the combination of PAC and LMB would (1) effectively sink C. raciborskii in a test tube experiment and (2) impair C. raciborskii growth irrespective of the inoculum (bloom) biomass and the strain in a 5 days growth experiment. For the test tube experiment the strains were incubated at the biomass of 100 µg L-1 and the isolated and combined addition of 1 mg L-1 PAC and 0.1g L-1LMB for 20-24h. In the growth experiment each one of the strains were incubated at four different initial biomass (40 µg L-1, 80 µg L-1, 180 µg L-1and 380 µg L-1) in WC culture medium with and without addition of 1 mg L -1
strains independently of the biomass and strain. We conclude that the addition of a low dose of PAC in combination with the recommended dose of LMB reduces C. raciborskii blooms and that the efficiency of the technique is dependent on the bloom
biomass and intraspecific composition. Finally, a higher dose of LMB is needed to have a more efficient control of C. raciborskii blooms.
Keywords: cyanobacteria; bloom control; Phosphorus removal; coagulant; Phoslock®.
1. Introduction
Eutrophication of lakes and reservoirs often leads to blooms of cyanobacteria and is considered the most important water quality problem worldwide (Smith and Schindler, 2009; Paerl et al., 2011). Due to its potential toxicity, cyanobacteria blooms and associated surface scums render water from eutrophic freshwater ecosystems unfit for human use (Chorus and Bartram, 1999). The filamentous cyanobacteria Cylindrospermopsis raciborskii has received great attention because of its potential
toxicity and problematic high densities in many eutrophic warm-water lakes and reservoirs (Bouvy et al. 2000; McGregor and Fabbro, 2000; Soares et al., 2013). The success of C. raciborskii has been attributed to its high uptake and storage capacity of phosphorus (Padisák, 1997, Isvánovics et al., 2000; Posselt et al., 2009; Wu et al., 2009) among others factors. Many reservoirs in Brazil used for water supply suffer persistent blooms of C. raciborskii (Bouvy et al., 1999, 2003; Costa et al., 2006, 2009; Panosso et al., 2007; Soares et al., 2013). Such blooms pose a health risk to both human and life stock for which mitigating methods are highly wanted.
reduced by removal of P rich sediments - dredging (Peterson, 1982), or by applying a P-fixative as an in-lake treatment which is often a far cheaper option than dredging (Cooke et al., 2005; Welch and Cooke, 2005). Aluminium-, calcium- and iron salts have long been applied as P-fixative in lakes (Cooke et al., 2005). Recently, solid phase P sorbents (SPB) have gained interest (Spears et al., 2013), among which are modified clays– i.e. clays enriched with Aluminium (Gibbs et al., 2011), iron (Zamparas et al., 2012) and lanthanum (Douglas, 2002). Among these SPB, the lanthanum modified bentonite (LMB; Phoslock®) is the most widely used and tested (Spears et al., 2013). The LMB is reported to remove dissolved P from the water column and block P release from the sediment after settling onto the lake bottom (Spears et al., 2013). The LMB contains 5% lanthanum (Haghseresht, 2005) and has extreme affinity to bind P (Johanneson and Lyons, 1994; Liu and Byrne, 1997). Thus, whole-lake application of the LMB is considered a promising method to mitigate eutrophication (e.g. Douglas et al., 1999; 2004; Robb et al., 2003; Ross et al., 2008; Haghseresht et al., 2009, van Oosterhout and Lurling 2013).
Because the LMB only targets phosphates, it does not directly affect the phosphorus present in biota. As cyanobacteria such as C. raciborskii have a high P uptake and storage capacity (Padisák, 1997), a bloom may prevail after the application of the LMB. Lurling and Van Oosterhout (2013) combined the LMB with a low dose of flocculent (polyaluminium chloride, PAC) to instantaneously achieve a durable mitigation of persistent blooms of cyanobacteria in a Dutch lake. This ‘Flock and Lock’ treatment removes total P from the water column through flocculation, using the LMB as both sinking weight and sediment capping P fixative (Lurling and Van Oosterhout, 2013). Cyanobacteria contain gas vesicles which provide positive buoyancy allowing them to accumulate at the water surface (Walsby, 1994). Therefore, the added sinking weight is quite essential as with a low dose of flocculent to effectively sink buoyancy controlled cyanobacteria. The ‘Flock and Lock’ method yielded good flocculation and sinking of cyanobacteria in a short term (2 hours) laboratory experiment and a whole lake application in a 15 m deep lake (Lurling and Van Oosterhout, 2013). Although the ‘Flock and Lock’ technique seems promising in removing and controlling cyanobacteria through P limitation there is no report on the efficacy of this method to control C. raciborskii blooms. It has been suggested that cell concentration seems to affect the
However, it is unknown if the efficacy of the method to reduce growth is affected by the amount of cyanobacterial biomass present at the moment of application. Here, we first tested the hypothesis that the combination of PAC and LMB would effectively sink the positive buoyant C. raciborskii to the bottom of test tubes regardless of the strain used. We then tested the hypothesis that the combination of a low PAC dose and the recommended LMB dose by Phoslock manufacturer would impair C. raciborskii growth irrespective of the inoculum (bloom) biomass and the strain in a 5 days growth experiment.
2. Materials and methods
2.1 Chemicals
The flocculent PAC (polyaluminium chloride, with the general formula Aln(OH)mCl3n-m; Ekofix) was provided by Sachtleben Wasserchemie GmbH (Germany). The lanthanum-modified bentonite (LMB) - Phoslock (5% La) was supplied by Phoslock Europe GmbH (Ottersberg, Germany).
The manufacturers recommend a LMB dose of LMB (g): P (g) =100: 1. In the growth experiment described below, the LMB is applied at one (LMB1) and three (LMB3) times the recommended dose– as based on the filterable reactive phosphorus (FRP) concentrations measured at the start of each experiment.
2.2 Organisms
Three clonal non-axenic strains of the cyanobacterium Cylindrospermopsis raciborskii (Woloszynska) Seenaya and Subba Raju were used. Two originated from a
The strains were cultured in slightly modified WC medium (Lürling and Beekman, 1999), in an incubator at 27°C, under constant orbital shaking of 60 rpm and a photoperiod of 14:10 h light:dark. Day-night transitions were simulated through gradual increase (or decrease) of the light intensity from complete darkness up to an approximate 130 µmol photons m-2 s-1. Stock cultures were transferred to fresh sterile medium every three-four weeks.
2.3 Sinking experiment
The experiment was done according to a complete 2 x 2 factorial design with PAC and LMB concentrations as factors and 3 replicates per cell. Factor PAC had two levels: no addition (control) and addition of 1 mg Al l-1. Factor LMB had two levels: no addition (control) and addition of 0.1 g l-1 LMB. Aliquots of stock cultures of each C. raciborskii strain were diluted in freshly prepared WC medium. This dilution aimed at
an approximate 100 µg L-1 chlorophyll-a per strain. From each of the diluted C. raciborskii suspensions, 125 mL aliquots were distributed over 18 glass tubes. PAC was
first added in a solution to achieve the final concentrations of 1 mg Al l-1in treatments with PAC and then the suspensions were mixed. After this, the LMB was added by making slurry with 5 mL water from the tube, which was then sprayed on the top of the tube using a pipette. All tubes were incubated at room temperature (around 20° C) and no shaking during one day (24h for CYRF and 20h for G75 and PMC124.12).
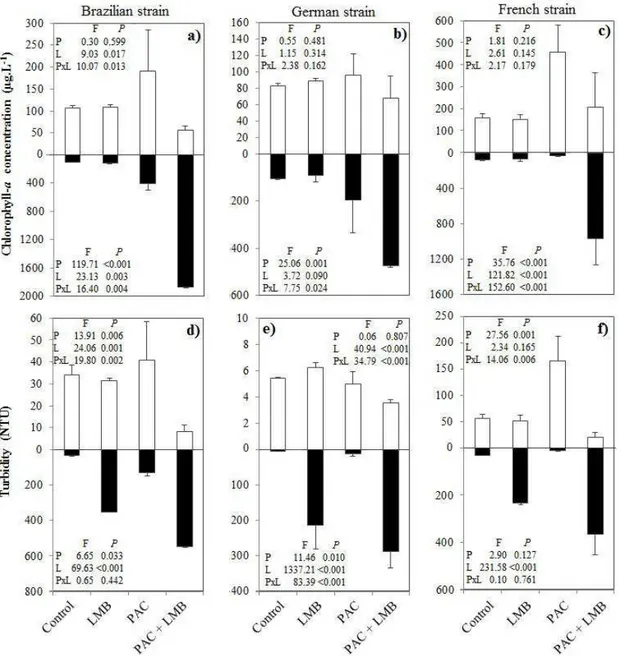
As C. raciborskii is a buoyancy controlled cyanobacteria, this experiment may result in accumulation (e.g. scum formation) in the top of the tubes rather than in their bottom as a result of sinking. Hence, at the end of the incubation periods chlorophyll-a (CHL-a) concentrations and turbidity were measured in the top 10 mL and in the bottom 10 mL samples from each tube. CHL-a was measured with the PHYTO-PAM phytoplankton analyzer and the turbidity was determined using a Hach 2100P turbidity meter.
2.4 Growth experiment
conditions measured as the CHL-a concentrations (µg L-1) at the beginning of the experiment–this factor had levels CHL-a: B1≈ 40 µg L-1, B2≈ 80 µg L-1, B3≈ 180 µg L-1, and B4≈ 380 µg L-1. Samples were taken from each diluted cultures to assess the FRP concentration in the medium and to determine the quantity of LMB to be applied. The levels of the factor ‘treatment’ were: control (no addition), combined addition of 1 mg L-1PAC and 100g LMB: 1g FRP (LMB1) and combined addition of 1 mg L-1PAC and 300g LMB: 1g FRP (LMB3). Initial biomasses were achieved through appropriate dilution of the stock cultures using WC medium. When applying the treatments, each experimental unit first received the PAC in order to achieve the final concentration of 1 mg Al L-1. Then to improve flock formation, the pH was adjusted to 6.5 (±0.2) using Hydrochloric acid (HCl 0.01N) or Sodium hydroxide (NaOH 0.01N) after the experimental units were mixed. Finally the LMB was added by making slurry with 5 mL water from the experimental units and the experimental units were mixed again. The experiments were done in 100 mL erlenmeyers with 100 mL of the diluted cyanobacteria cultures. The incubation was done under the same conditions described for the stock cultures used in the experiment.
2.5 Statistics
To evaluate the isolated and combined effects of PAC and LMB on CHL-a concentration and turbidity in the first experiment we performed a two-way ANOVA. Likewise, we used a two-way ANOVA to evaluate the isolated and combined effects of biomass and ‘Flock and Lock’ treatments on FRP concentration and C. raciborskii biomass and growth rates in the second experiment. The Tukey post-hoc test was performed when ANOVA showed significant effects of the ‘Flock and Lock’ treatments in the second experiment. The tests were done for each strain separately.
3. Results
3.1 Sinking experiment
3.2 Growth experiment
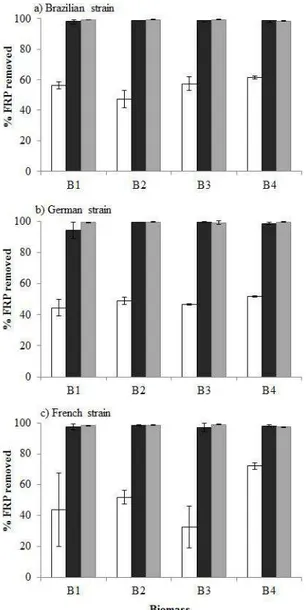
During the experiment, we observed a reduction of 16-74% the initial FRP concentrations in the control treatment and a reduction of more than 90% the initial FRP concentrations in the two flock and lock treatments (Figure 2). The two-way ANOVA results showed that PAC + LMB addition had significant effect on FRP reduction (Table 1) and that this effect does not depend on C. raciborskii biomass. The growth curves revealed an exponential growth of C. raciborskii in the control and LMB1 treatments during the 5 days of the experiment (Figure 3). In the LMB3 treatment, C. raciborskii did not sustain an exponential growth until the end of the experiment (Figure
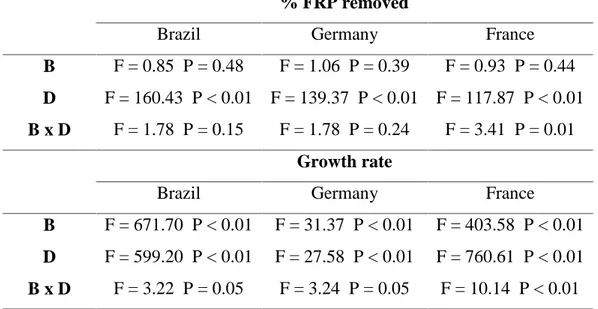
3). Therefore, the growth rate was only estimated for the control and LMB1 treatments. The growth rates were higher in the control than in the treatment with PAC + LMB addition, decreasing with increasing the initial biomass (Figure 4). We observed a reduction of 22-29% for biomass B1, 30-39% for biomass B2 in all strains and 40-44% for biomass B3 and 40-49% for biomass B4 in Brazilian and German strains. The two-way ANOVA results showed that the initial biomass and PAC + LMB addition had significant effects on the growth rates of all strains, and that there was a significant interaction between these effects (Table 1). No significant difference was found in growth rate between treatments in biomass 3 and 4 for French strain.
The LMB1 dose reduced up to 61% of biomass while LMB3 dose reduced up to 94% of biomass for all strains (Figure 5). In general, the reduction decreased with the increasing in biomass.
4. Discussion
Our results from laboratory experiments show that the combined application of PAC and LMB is an efficient technique to effectively sink the buoyant cyanobacteria Cylindrospermopsis raciborskii. The clay ability in removing cells can be enhanced by
We did not found the same result for C. raciborskii. LMB alone did not result in a decrease of CHL-a concentration at the top of our experimental tubes. The increasing turbidity at the bottom of the tubes in the LMB treatment is explained by the clay settling to the bottom, because there was no reduction in CHL-a at the top of the tubes or increase in CHL-a at the bottom of the tubes in the LMB treatment. This reveals the low aggregation efficiency of C. raciborskii filaments with LMB. Aggregation with clay may depend on the cyanobacteria used due to variability in extracellular polysaccharide (EPS) composition, as has been found for Microcystis (Verspagen et al., 2006). In fact the colonies of Microcystis are embedded in mucilage, as a strategy for avoid sedimentation, which is formed mainly by polysaccharide (Reynolds, 2006). It was found the production of EPS by Raphidiopsis brookii, closely related genera to C. raciborskii (Yunes et al., 2009), but we are not conscious of studies about EPS
production by C. raciborskii. Conversely, we observed that the addition of PAC resulted in good flock formation as we could see by the increasing in CHL-a concentration at the top of the tubes of PAC treatment but we did not observe sedimentation of those flocks. Therefore our results shows that the addition of sinking weight in combination with a low dose of flocculent is fundamental to effectively sink the filaments of the buoyancy controlled cyanobacteria C. raciborskii.
In the growth experiment, the application of PAC in combination with the
recommended or a 3 times higher dose of LMBequally resulted in a strong reduction of FRP concentrations as expected. However, the inhibition of C. raciborskii growth was stronger at the LMB3 than at the LMB1 dose. As cell removal efficiency by flocculation process increases with increasing clay concentration (Sengco et al., 2001; Pan et al., 2006b), the higher flocculation in the LMB3 could also have contributed to the faster growth inhibition of C. raciborskii strains in this treatment when compared to the LMB1 treatment.
LMB addition removed more than 90% the initial FRP concentrations, we expected growth would dramatically decrease due to P limitation. However, growth persisted but at lower rates. This may be explained by the fact that under conditions of P limitation, C. raciborskii can regulate its physiological response to this stress by reducing growth
rate and photosynthetic activity and an increase of extracellular phosphatase activity (Wu et al., 2012). Moreover it is known that C. raciborskii is a P storage specialist and it has a rapid phosphate uptake rate (Padisák, 1997, Isvánovics et al., 2000; Posselt et al., 2009; Wu et al., 2009). Under ideal circumstances they are able to uptake phosphorus more than is needed (Istvanovics et al., 2000) and store it. This luxury uptake allows growth of two or three generations before this element become a limiting factor (Reynolds, 2006). As the cultures were not submitted to P starvation before the treatment, P might have been stored by the cells before the experiment, allowing them to grow even at lower rates with the intracellular P after the combined addition of LMB + PAC. Indeed, light limitation due to increasing turbidity in water and flocculation of filaments caused by PAC and LMB addition can also explains the reduction in growth rate (Van Oosterhout and Lurling, 2013).
The efficacy of the method to reduce P was not affected by the biomass of C. raciborskii present at the moment of application or the C. raciborskii strain used.
Our findings have significant implications for restoration of lakes and reservoirs dominated by C. raciborskii. The combined application of PAC with the recommended dose of LMB can be a good management strategy to sinking and to reduce the growth of C. raciborskii population as result of phosphorus limitation, leading to the control of
bloom in a long-term perspective, but the technique tend to be dependent of the bloom stage and the strain. However, to have a more efficient and faster control of C. raciborskii blooms may be necessary the use of a combined dose of PAC with a higher
dose of LMB than the recommended by the manufacturers.
5. Conclusions
The flocculent PAC or the lanthanum modified bentonite (LMB) Phoslock® alone could not effectively sink filaments of different strains of the positive buoyant cyanobacteria C. raciborskii;
PAC combined with LMB effectively sank the filaments of C. raciborskii strains;
PAC combined with the recommended LMB dose reduced FRP and growth rates of C. raciborskii strains tested;
The efficacy of PAC combined with the recommended LMB dose in reduce growth rate depends on the cyanobacteria biomass and strain.
Acknowledgements
References
Anderson, D. M., 1997. Turning back the harmful red tide. Nature 388(6642), 513-514.
Bouvy, M., Molica, R., De Oliveira, S., Marinho, M., and Beker, B., 1999. Dynamics of a toxic cyanobacterial bloom (Cylindrospermopsis raciborskii) in a shallow reservoir in the semi-arid region of northeast Brazil. Aquatic Microbial Ecology 20(3), 285-297.
Bouvy, M., Falcão, D., Marinho, M., Pagano, M., and Moura, A., 2000. Occurrence of Cylindrospermopsis (Cyanobacteria) in 39 Brazilian tropical reservoirs during the 1998 drought. Aquatic Microbial Ecology 23(1), 13-27.
Bouvy, M., Nascimento, S. M., Molica, R. J., Ferreira, A., Huszar, V., and Azevedo, S. M., 2003. Limnological features in Tapacurá reservoir (northeast Brazil) during a severe drought. Hydrobiologia 493(1-3), 115-130.
Briand, E., Escoffier, N., Straub, C., Sabart, M., Quiblier, C., & Humbert, J. F. (2008). Spatiotemporal changes in the genetic diversity of a bloom-forming Microcystis aeruginosa (cyanobacteria) population. ISME Journal 3(4), 419-429.
Briand, J. F., Leboulanger, C., Humbert, J. F., Bernard, C., & Dufour, P., 2004.
Cylindrospermopsis raciborskii (cyanobacteria) invasion at mid‐latitudes: selection, wide physiological tolerance, or global warming? Journal of Phycology, 40(2), 231-238.
Chen, J. and Luan, Z., 2010. Enhancing phosphate removal by coagulation using polyelectrolytes and red mud. Fresenius Environmental Bulletin 19(10), 2200-2204.
Chonudomkul, D., Yongmanitchai, W., Theeragool, G., Kawachi, M., Kasai, F., Kaya, K., & Watanabe, M. M. (2004). Morphology, genetic diversity, temperature tolerance and toxicity of Cylindrospermopsis raciborskii (Nostocales, Cyanobacteria) strains from Thailand and Japan. FEMS Microbiology Ecology 48(3), 345-355.
Cooke, G. D., Welch, E. B., Peterson, S., and Nichols, S. A., 2005. Restoration and management of lakes and reservoirs. CRC press.
Costa, I. A. S., Azevedo, S. M. F., Senna, P. A. C., Bernardo, R. R., Costa, S. M., & Chellappa, N. T., 2006. Occurrence of toxin-producing cyanobacteria blooms in a Brazilian semiarid reservoir. Brazilian Journal of Biology 66(1B), 211-219.
Costa, I.A.S., Cunha, S.R.S., Panosso, R., Araújo, M.F.F., Melo, J.L.S., Eskinazi-Sant’anna, E.M., 2009.Dinâmica de cianobactérias em reservatórios eutróficos do semi-árido do Rio Grande do Norte.Oecologia Brasiliensis13(2), 382-401.
Douglas, G.B., 2002. US Patent 6350383: Remediation Material and Remediation Process for Sediments.
Douglas, G. B., Adeney, J. A. and Robb, M.S., 1999. A novel technique for reducing bioavailable phosphorus in water and sediments. International Association Water Quality Conference on Diffuse Pollution, 517–523.
Douglas, G.B., Robb, M.S., Coad, D.N., Ford, P.W., 2004. A review of solid phase adsorbents for the removal of phosphorus from natural and waste waters. In: Valsami-Jones, E. (Ed.), Phosphorus in Environmental Technology e Removal, Recovery, Applications. IWA Publishing, pp. 291 - 320 (Chapter 13).
Gibbs, M. M., Hickey, C. W., and Özkundakci, D., 2011. Sustainability assessment and comparison of efficacy of four P-inactivation agents for managing internal phosphorus loads in lakes: sediment incubations. Hydrobiologia 658(1), 253-275.
Haghseresht, F., 2005. A Revolution in Phosphorous Removal. Phoslock Water Solutions Ltd., p. 21. http://www.phoslock.com.au
Hagstrom, J.A., Graneli, E., 2005. Removal of Prymnesium parvum (Haptophyceae) cells under different nutrient conditions by clay. Harmful Algae 4 (2), 249-260.
Hilt, S., Gross, E. M., Hupfer, M., Morscheid, H., Mählmann, J., Melzer, A., ... and Van de Weyer, K., 2006. Restoration of submerged vegetation in shallow eutrophic lakes–A guideline and state of the art in Germany. Limnologica-Ecology and Management of Inland Waters 36(3), 155-171.
Isvánovics, V., Shafik, H. M., Présing, M., and Juhos, S., 2000. Growth and phosphate uptake kinetics of the cyanobacterium, Cylindrospermopsis raciborskii (Cyanophyceae) in throughflow cultures. Freshwater Biology 43(2), 257-275.
Jiang, J. Q., & Graham, N. J., 1998. Pre-polymerized inorganic coagulants and phosphorus removal by coagulation- a review. Water Sa 24(3), 237-244.
Johannesson, K. H., & Lyons, W. B., 1994. The rare earth element geochemistry of Mono Lake water and the importance of carbonate complexing. Limnology and Oceanography 39(5), 1141-1154.
Kardinaal, W. E. A., Tonk, L., Janse, I., Hol, S., Slot, P., Huisman, J., & Visser, P. M., 2007. Competition for light between toxic and nontoxic strains of the harmful cyanobacterium Microcystis. Applied and Environmental Microbiology 73(9), 2939-2946.
Liu, X., & Byrne, R. H., 1997. Rare earth and yttrium phosphate solubilities in aqueous solution. Geochimica et Cosmochimica Acta 61(8), 1625-1633.
Marinho, M. M., Souza, M. B. G., & Lurling, M., 2013. Light and phosphate competition between Cylindrospermopsis raciborskii and Microcystis aeruginosa is strain dependent. Microbial Ecology 66(3), 479-488.
McGregor, G. B., and Fabbro, L. D., 2000. Dominance of Cylindrospermopsis raciborskii (Nostocales, Cyanoprokaryota) in Queensland tropical and subtropical reservoirs: Implications for monitoring and management. Lakes and Reservoirs: Research and Management, 5(3), 195-205.
Murphy, J. A. M. E. S., & Riley, J. P., 1962. A modified single solution method for the determination of phosphate in natural waters. Analytica Chimica Acta 27, 31-36.
Padisák, J., 1997. Cylindrospermopsis raciborskii (Woloszynska) Seenayya et Subba Raju, an expanding, highly adaptive cyanobacterium: worldwide distribution and review of its ecology. Archiv Für Hydrobiologie Supplementband Monographische Beitrage, 107(4), 563-593.
Paerl, H. W., Hall, N. S., and Calandrino, E. S., 2011. Controlling harmful cyanobacterial blooms in a world experiencing anthropogenic and climatic-induced change. Science of the Total Environment 409(10), 1739-1745.
Pan, G., Zhang, M. M., Chen, H., Zou, H., & Yan, H., 2006. Removal of cyanobacterial blooms in Taihu Lake using local soils. I. Equilibrium and kinetic screening on the flocculation of Microcystis aeruginosa using commercially available clays and minerals. Environmental Pollution 141(2), 195-200.
Pan, G., Zou, H., Chen, H., & Yuan, X., 2006. Removal of harmful cyanobacterial blooms in Taihu Lake using local soils III. Factors affecting the removal efficiency and an in situ field experiment using chitosan-modified local soils. Environmental Pollution 141(2), 206-212.
Panosso, R., Costa, I. S., de Souza, N. R., de Attayde, J. L., de Souza Cunha, S. R., Costa, F., and Gomes, F., 2007. Cianobactérias e cianotoxinas em reservatórios do estado do Rio Grande do Norte e o potencial controle das florações pela tilápia do Nilo (Oreochromis niloticus). Oecologia Brasiliensis 11(3), 433-449.
Peterson, S.A. (1982). Lake restoration by sediment removal. Water Res. Bull. 18, 423–
435.
Piccini, C., Aubriot, L., Fabre, A., Amaral, V., González-Piana, M., Giani, A., Figueredo, C., Vidal, L., Kruk, C and Bonilla, S. (2011). Genetic and eco-physiological differences of South American Cylindrospermopsis raciborskii isolates support the hypothesis of multiple ecotypes. Harmful Algae 10(6), 644-653.
Posselt, A. J., Burford, M. A., and Shaw, G. (2009). Pulses of phosphate promote dominance of the toxic cyanophyte Cylindrospermopsis raciborskii in a subtropical water reservoir. Journal of phycology 45(3), 540-546.
Reynolds, C.S., 2006. The Ecology of Phytoplankton (Ecology, Biodiversity and Conservation). Cambridge University Press, Cambridge.
Robb, M., Greenop, B., Goss, Z., Douglas, G., & Adeney, J., 2003. Application of PhoslockTM, an innovative phosphorus binding clay, to two Western Australian waterways: preliminary findings. In The Interactions between Sediments and Water (pp. 237-243). Springer Netherlands.
Ross, G., Haghseresht, F., Cloete, T.M., 2008. The effect of pH and anoxia on the performance of Phoslock_, a phosphorus binding clay. Harmful Algae 7, 545-550.
Sengco, M.R., Anderson, D.M., 2004. Controlling harmful algal blooms through clay flocculation. J. Eukaryot. Microbiol. 51 (2), 169-172.
Sengco, M. R., Hagström, J. A., Granéli, E., & Anderson, D. M., 2005. Removal of
Prymnesium parvum (Haptophyceae) and its toxins using clay minerals. Harmful
Algae 4(2), 261-274.
Sengco, M. R., Li, A., Tugend, K., Kulis, D., & Anderson, D. M., 2001. Removal of red-and brown-tide cells using clay flocculation. I. Laboratory culture experiments with Gymnodinium breve and Aureococcus anophagefferens. Marine Ecology Progress Series 210, 41-53.
Smith, V. H. and Schindler, D. W., 2009. Eutrophication science: where do we go from here? Trends in Ecology and Evolution 24(4), 201-207.
Soares, M. C. S., Huszar, V. L., Miranda, M. N., Mello, M. M., Roland, F., and Lürling, M., 2013. Cyanobacterial dominance in Brazil: distribution and environmental preferences. Hydrobiologia 717(1), 1-12.
Søndergaard, M., Jensen, J. P., and Jeppesen, E., 1999. Internal phosphorus loading in shallow Danish lakes. InShallow Lakes’ 98(pp. 145-152). Springer Netherlands.
Søndergaard, M., Jensen, P. J., and Jeppesen, E., 2001. Retention and internal loading of phosphorus in shallow, eutrophic lakes. The Scientific World Journal, 1, 427-442.
Spears, B. M., Meis, S., Anderson, A., and Kellou, M., 2013. Comparison of phosphorus (P) removal properties of materials proposed for the control of sediment p release in UK lakes. Science of the Total Environment 442, 103-110.
Verspagen, J.M.H., Visser, P.M., Huisman, J., 2006. Aggregation with clay causes sedimentation of the buoyant cyanobacterium Microcystis. Aquat. Microb. Ecol. 44, 165-174.
Walsby, A. E., 1994. Gas vesicles. Microbiological reviews, 58(1), 94.
Welch, E. B., and Cooke, G. D., 2005. Internal phosphorus loading in shallow lakes: importance and control. Lake and reservoir management 21(2), 209-217.
Wilson, A. E., Sarnelle, O., Neilan, B. A., Salmon, T. P., Gehringer, M. M., & Hay, M. E., 2005. Genetic variation of the bloom-forming cyanobacterium Microcystis
aeruginosa within and among lakes: implications for harmful algal blooms. Applied and
Environmental Microbiology 71(10), 6126-6133.
Wu, Z., Shi, J., and Li, R., 2009. Comparative studies on photosynthesis and phosphate metabolism of Cylindrospermopsis raciborskii with Microcystis aeruginosa and
Aphanizomenon flos-aquae. Harmful Algae 8(6), 910-915.
Wu, Z., Zeng, B., Li, R., and Song, L., 2012. Physiological regulation of
Cylindrospermopsis raciborskii (Nostocales, Cyanobacteria) in response to inorganic
phosphorus limitation. Harmful Algae 15, 53-58.
Yunes, J. S., De La Rocha, S., Giroldo, D., Silveira, S. B. D., Comin, R., Bicho, M. D. S., Melcher, S. S., Sant’anna, C. L., and Vieira, A. A. H., 2009. Release of carbohydrates and proteins by a subtropical strain of raphidiopsis brookii (cyanobacteria) able to produce saxitoxin at three nitrate concentrations. Journal of Phycology, 45(3), 585-591.
Tables and Figures
Table 1–F-ratios and P-values of two-way ANOVA to test for the effects of the initial biomass (B), PAC+LMB addition (D) and their interactions (B x D) on % FRP removed from cultures and growth rates of
Cylindrospermopsis raciborskii strains. Values were considered significant
assuming P≤ 0.05.
% FRP removed
Brazil Germany France
B F = 0.85 P = 0.48 F = 1.06 P = 0.39 F = 0.93 P = 0.44 D F = 160.43 P < 0.01 F = 139.37 P < 0.01 F = 117.87 P < 0.01 B x D F = 1.78 P = 0.15 F = 1.78 P = 0.24 F = 3.41 P = 0.01
Growth rate
Brazil Germany France
CAPÍTULO II. Shallow lake restoration by the combined
effects of polyaluminium chloride addition and benthivorous
fish removal: a field mesocosm experiment.
Araújo, F.1, Becker, V.2and Attayde, J. L.3
1
Programa de Pós-Graduação em Ecologia. Universidade Federal do Rio Grande do Norte (UFRN), Natal–RN–Brazil.
2Departamento de Engenharia Civil, Centro de Tecnologia. Universidade Federal do Rio Grande do
Norte (UFRN), Natal–RN–Brazil.
3Departamento de Ecologia, Centro de Biociências. Universidade Federal do Rio Grande do Norte
(UFRN), Natal–RN–Brazil.
Abstract
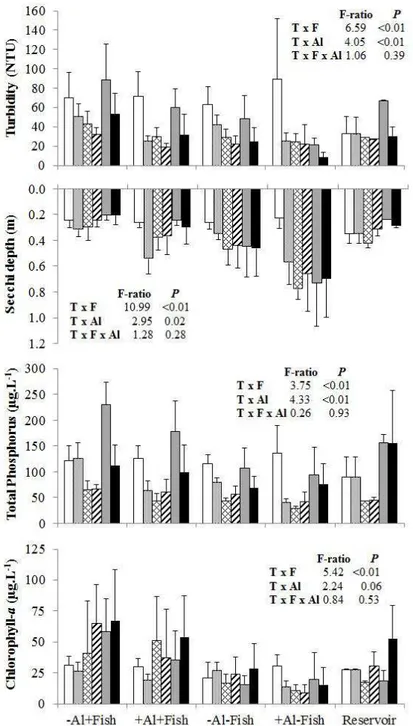
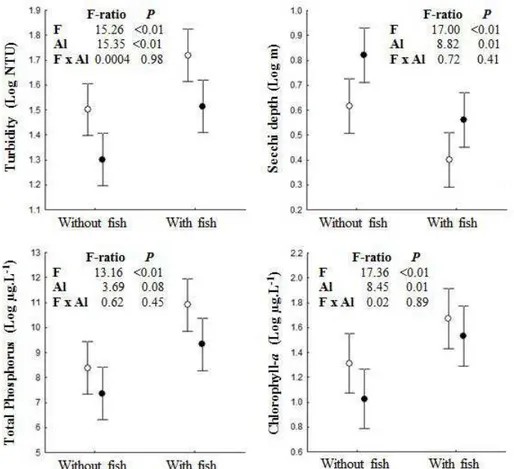
phosphorus and chlorophyll a concentrations and increased water transparency. No significant interaction was observed between the effects of PAC addition and fish removal. In conclusion, our results suggest that the effects of PAC addition and benthivorous fish removal are additive and that lake restoration can be better achieved by the combination of both techniques.
Keywords: P-sorption agent; coagulant; biomanipulation; tropical lake.
1. Introduction
Eutrophication is a serious environmental problem related to degradation of water quality worldwide. The main measure to restore eutrophic lakes is to reduce the input of nutrients to water bodies. Although some lakes have recovered after decreasing in the external input of nutrients, a delay or fail in recovery has been observed in many shallow lakes (Marsden, 1989; Jeppesen et al., 1991; Van der Molen & Boers, 1994; Søndergaard et al., 2000) and it has been attributed mainly to the phosphorus (P) internal loading from P-rich sediments (Søndergaard et al., 1999, 2003; Cooke et al., 2005).
Polyaluminium chloride (PAC) has been used as an alternative for alum because it has a higher efficiency of turbidity reduction based on the same equivalent alum dose and has a wider working pH range aside from lower coagulant cost to achieve the same efficiency (Jiang and Graham, 1998).
Other commonly used technique for lake restoration is the removal of planktivorous and/or benthivorous fishes (Meijer et al., 1994; Perrow et al., 1997; Hansson et al., 1998; Drenner and Hambright, 1999; Meijer et al., 1999; Mehner et al., 2002; Jeppensen et al., 2007; Jeppensen et al., 2012). The ultimate goal of such biomanipulation is the reduction of algal biomass and the increasing of water transparency. The removal of planktivorous fish increases the abundance of large zooplankton which in turn is able to suppress phytoplankton biomass (Carpenter et al., 1985; Meijer et al., 1994). Conversely, fish with benthic-feeding habit play an important role in shallow lakes by disturbing the sediment, increasing turbidity and translocating P from the sediment to the water column (Andersson et al., 1978; Meijer et al., 1990; Breukelaar et al., 1994; Cline et al., 1994; Lougheed et al., 1998; Schaus & Vanni, 2000; Volta et al., 2013). Although attractive, the long-term effectiveness of fish manipulation is uncertain (Jeppensen et al., 2007). Besides the resuspension of the sediment by fishes, release of phosphorus from P-rich sediments can be affected by temperature, pH, iron:phosphorus ratio and mineralization processes in the sediment (Jensen & Andersen, 1992; Olila & Reddy, 1997; Pettersson, 1998; Søndergaard et al., 1999, 2003; Jeppesen et al., 2005) and contribute with phytoplankton growth, showing the need for additional measures in combination with biomanipulation to reduce P internal loading (Jeppensen et al., 2012).
benthivorous fish (Prochilodus brevis) removal on the water quality of a tropical shallow lake.
2. Material and methods
2.1 Study Area and experimental design
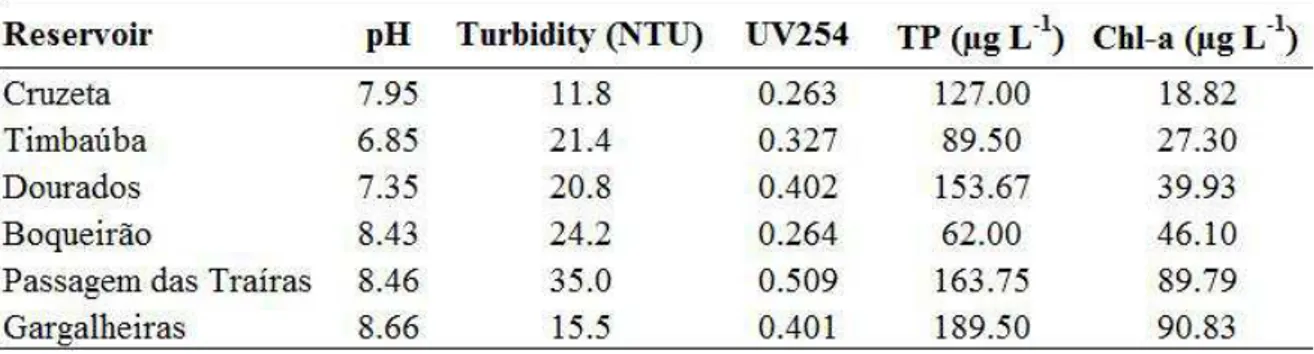
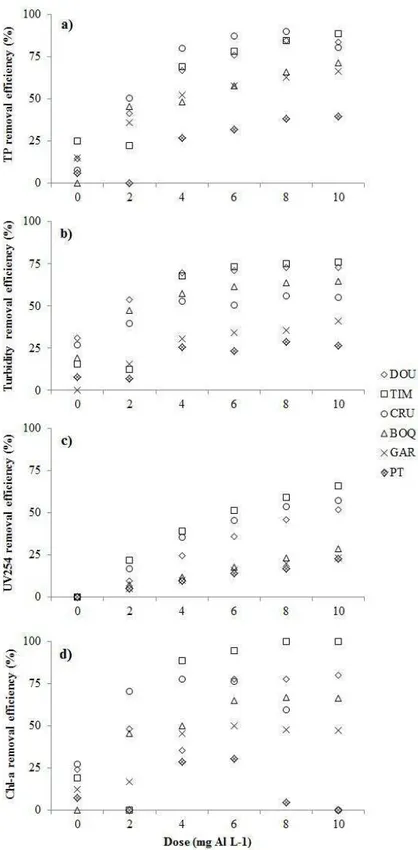
The experiment was performed in an eutrophic shallow man-made lake located at Seridó Ecological Station, Serra Negra do Norte, Rio Grande do Norte, Brazil (6º34’49,3”S; 37º15´20” W). The experiment was carried out in 20 mesocosm of 6 m³ (4 m² x 1.5m) placed side by side in the littoral zone of the reservoir. The mesocosms were open to the atmosphere at the top and to the sediment at the bottom, but were isolated from the adjacent lake water by a film of transparent plastic.
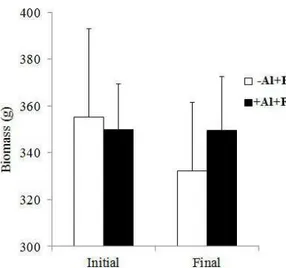
The experiment consisted of a 2 x 2 factorial design where four treatments with five replicates were randomly allocated to the 20 mesocosms. The treatments were: presence of fish with (+Al+Fish) or without Al addition (-Al+Fish) and absence of fish with (+Al-Fish) or without Al addition (-Al-Fish). The fish used in the experiment, curimatã (Prochilodus brevis), is a common benthivorous fish in the Brazilian semi-arid region (Chellappa et al., 2009; Nascimento et al., 2014) and the most abundant fish in the studied lake. Four fishes 352.6g (± 65.7) were collected from the studied lake and added to each mesocosm of the two fish treatments just after initial sampling resulting in a density of 0.67 fish m-3. This is within the range of natural densities found in the lakes of the region. Aluminium as polyalumnium chloride (PAC; PANFLOC TE1018– Pan-Americana S/A) was the coagulant used at dose 2 mg Al.L-1and was added one day after fish stocking. The chosen dose was based on an experimental jar test in the laboratory using the water from the lake (data not shown).
2.2 Sampling and samples analysis