UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE TECNOLOGIA
PROGRAMA DE PÓS-GRADUAÇÃO EM ENGENHARIA ELÉTRICA
Contribuições para a Análise de
Sinais Neuronais e Biomédicos
Vítor Lopes dos Santos
Orientador: Gláucio Brandão
Co-orientador: Sidarta Ribeiro
Dissertação de Mestrado apresentada ao
Programa de Pós-Graduação em Engenharia Elétrica e de Computação da UFRN (área de concentração: Engenharia de Computação) como parte dos requisitos para obtenção do título de Mestre em Ciências.
Contribuições Para a Análise de
Sinais Neuronais e Biomédicos
Vítor Lopes dos Santos
Dissertação de Mestrado aprovada em 3 de março de 2011 pela banca examinadora composta pelos seguintes membros:
______________________________________________________________________ Prof. Dr. Gláucio Bezerra Brandão (orientador) . . . /UFRN
______________________________________________________________________ Prof. PhD. Sidarta Tollendal Gomes Ribeiro (co-orientador) . . . /UFRN
Agradecimentos
A minha vontade de ser pesquisador nasceu muito provavelmente no início dos anos 90, no terraço de Cotovelo depois do jantar. Aos poucos, sem explicações, Edmilson me fez compreender porque ele gostava de passar tanto tempo observando solitariamente as estrelas. A obsessão pelo entendimento de certos mistérios é tão inexplicável como a paixão de um torcedor de futebol. Não se pode mostrar a beleza da fórmula de Euler para alguém que simplesmente não a vê.
É curioso que, quase 20 anos depois, eu tenha voltado as atenções para uma imensidão tão diferente. Pelo menos para nossa percepção, o universo dentro do cérebro humano parece ser tão vasto quanto o cosmos, e seus mistérios são igualmente dignos de nossa obsessão.
É muito arriscado elaborar uma lista completa de agradecimentos, dando créditos a todos que merecem. Sinto-me extremamente priveligado por toda a ajuda que eu tive desde muito cedo. Por esse motivo, me limito a nominar aqueles que tiveram participação mais crucial na minha vida e na minha formação.
Em primeiro lugar, tenho que agradecer a minha mãe, a Sinval, e principalmente a Enilson por acreditarem genuinamente, com motivos ou não, que eu realmente posso dar uma boa contribuição no trabalho que escolhi. As contribuições dadas por essas pessoas são incalculáveis e imprescindíveis para qualquer mérito que eu venha a ter como profissional e ser humano.
Também queria agradecer aos meus amigos mais antigos que continuam muito próximos: Natalinha, Lara, Clara, Vitão, Verme e Ryan. Aos meus amigos de turma de graduação: Rodrigo, Fernanda, Tripa, Vitão, Gian, Xupeta de Baleia, Calo de Coxa, Bruno, Isac e outros. E especialmente a Natalia, que me acompanhou durante quase todo o mestrado de perto, me mantendo sempre motivado.
Também queria agradecer a meus orientadores mais importantes.
Resumo
Seguindo a nova tendência de interdisciplinaridade da ciência atual, a neuroengenharia vem crescendo nas últimas décadas. A partir do ano 2000, foram criados periódicos científicos e conferências em todo o mundo dedicados ao tema. Esse trabalho envolve três subáreas da neuroengenharia relacionadas com engenharia elétrica e de computação: controle neural; neurociência teórica e computacional; e processamento de sinais neurais; assim como da engenharia biomédica.
A pesquisa compreendeu três partes: (i) Uma técnica de fotoestimulação neural foi desenvolvida baseada no uso de compostos enjaulados. Usando o neurotransmissor inibitório GABA preso a um complexo de rutênio, foi possível provocar inibição quase instantânea da atividade cortical de camundongos com um pulso de laser. Os resultados foram obtidos por análise Wavelet de potenciais de campo e testados com estatística não-paramétrica. (ii) Um método matemático foi desenvolvido para identificação de assembléias neurais. Assembléias neurais foram primeiramente propostas por Donald Hebb (1949) como base do aprendizado, e atualmente constituem o modelo mais bem aceito para representação de informação no sistema nervoso. Usando a lei de Marcenko-Pastur da distribuição de autovalores de matrizes aleatórias foi possível detectar assembléias neurais, identificá-las e calcular a força de ativação com alta resolução temporal. Aplicação do método em dados eletrofisiológicos reais revelou que neurônios do neocórtex e do hipocampo de ratos participam em uma mesma assembleia, e que neurônios podem participar em múltiplas assembleias. (iii) Um novo método de classificação automática de batimentos de eletrocardiograma foi desenvolvido, que não depende de um banco de dados para treinamento, e que não é especializado em patologias específicas. O método envolve decomposição Wavelet e medidas de normalidade de variáveis aleatórias.
Abstract
Following the new tendency of interdisciplinarity of modern science, a new field called neuroengineering has come to light in the last decades. After 2000, scientific journals and conferences all around the world have been created on this theme. The present work comprises three different subareas related to neuroengineering and electrical engineering: neural stimulation; theoretical and computational neuroscience; and neuronal signal processing; as well as biomedical engineering.
The research can be divided in three parts: (i) A new method of neuronal photostimulation was developed based on the use of caged compounds. Using the inhibitory neurotransmitter GABA caged by a ruthenium complex it was possible to block neuronal population activity using a laser pulse. The obtained results were evaluated by Wavelet analysis and tested by non-parametric statistics. (ii) A mathematical method was created to identify neuronal assemblies. Neuronal assemblies were proposed as the basis of learning by Donald Hebb remain the most accepted theory for neuronal representation of external stimuli. Using the Marcenko-Pastur law of eigenvalue distribution it was possible to detect neuronal assemblies and to compute their activity with high temporal resolution. The application of the method in real electrophysiological data revealed that neurons from the neocortex and hippocampus can be part of the same assembly, and that neurons can participate in multiple assemblies. (iii) A new method of automatic classification of heart beats was developed, which does not rely on a data base for training and is not specialized in specific pathologies. The method is based on Wavelet decomposition and “normality” measures of random variables.
Sumário
Agradecimentos ... 3
Resumo ... 4
Abstract ... 5
Sumário ... 6
1. Introdução geral ... 7
2. Fotoliberação in vivo de GABA no córtex de camundongos ... 9
2.1. Introdução ... 9
2.2. Materiais e Métodos ... 10
2.3 Resultados ... 12
2.4 Discussão ... 13
3. Detecção de assembleias neurais ... 17
3.1. Introdução ... 17
3.2. Método atual ... 19
3.3. A distribuição de Mar enko-Pastur e a hipótese nula ... 21
3.4. Detectando número de assembleias e de neurônios em assembleias ... 22
3.5. Identificando as assembleias e sua ativação com precisão temporal ... 25
3.6. Aplicações em dados reais ... 29
3.7. Discussão ... 30
3.8. Fundamentação teórica ... 32
4. Diagnóstico não supervisionado de ECG ... 36
4.1. Introdução ... 36
4.2. Materiais e Métodos ... 37
4.3. Resultados ... 39
1. Introdução geral
“I’m astounded by people who want to ‘know’ the universe when it’s hard enough to find your way around Chinatown”
Woody Allen
O desenvolvimento dessa dissertação no Programa de Pós-graduação em Engenharia Elétrica e de Computação (PPgECC) causou uma curiosidade saudável em algumas pessoas; mas, infelizmente, despertou desconfiança e menosprezo em outras. Aparentemente, para algumas pessoas, inclusive professores, neurociências e engenharia são duas disciplinas independentes e essa dissertação se trata de um trabalho exótico, sem ligação com a realidade. Essa posição é de fato ingênua e imprópria para um professor universitário, mas talvez possa ser atribuída a uma herança cultural na comunidade acadêmica, herança para a qual diferentes campos de pesquisa são entendidos como incompatíveis, e a interdisciplinaridade é nada mais que um devaneio de filósofo.
Não obstante, alguns pesquisadores têm proposto índices objetivos a fim de calcular o grau de interdisciplinaridade em publicações científicas e de avaliar sua evolução. Embora esse crescimento pareça ter sido significativamente lento - 5% entre 1975 e 2005 [1] - a neurociência é apontada como um dos principais centros de convergência de diferentes campos científicos [1]. Nas ciências biológicas em geral, altos graus de interdisciplinaridade estão positivamente correlacionados com taxas de citação, indicando a relevância acadêmico-científica desses trabalhos [2].
De fato, a necessidade do rompimento das barreiras imaginárias entre áreas de conhecimento está cada vez mais reconhecida para a superação dos desafios científicos nesse século [3, 4], e a engenharia biomédica tem sido apontada como a principal representante desse novo paradigma [4]. Em particular, um novo campo chamado neuroengenharia, vem emergindo principalmente na última década, com a criação de cursos de graduação, congressos internacionais e periódicos científicos específicos [5]. Curiosamente, alguns autores o consideram uma subárea da neurociência, e outros da engenharia biomédica.
Segundo o editorial do Journal of Neural Engineering: “A neuroengenharia é
uma emergente área de pesquisa interdisciplinar que promove a união das neurociências e das engenharias a fim de analisar funções neurológicas, e também para projetar soluções para problemas associados com limitações e disfunções neurológicas.”. O
IEEE Engineering in Medicine and Biology Society em sua página oficial: “A
neuroengenharia envolve a convergência de conhecimento e metodologias de diversas disciplinas, tais como neurociências, matemática, engenharia, biofísica, ciência da computação e psicologia.”. Tomando como base essas definições, creio que posso
abordados, como pretendo deixar claro no decorrer do texto, três das subáreas reconhecidas desse campo [5]: controle neural, processamento de sinais neurais e neurociência computacional e teórica. Para finalizar, na última seção é apresentado um estudo de classificação não supervisionada que usa sinais de eletrocardiograma como estudo de caso. O autor pede encarecidamente que qualquer estudo detalhado ao trabalho descrito nessa dissertação seja feito diretamente em suas publicações referentes, referenciadas ao longo do texto.
Por esse trabalho abranger projetos independentes, ele está organizado em quatro seções da seguinte forma:
1. Introdução geral;
2. Fotoliberação in vivo de GABA no córtex de camundongos – uma
técnica de inibição de atividade cortical in vivo foi desenvolvida baseada
no uso do neurotransmissor inibitório GABA quimicamente “enjaulado”;
3. Detecção de assembleias neurais – um método matemático foi
desenvolvido para o estudo de assembleias neurais em registros eletrofisiológicos;
4. Diagnóstico não supervisionado de eletrocardiograma.
Todos os trabalhos descritos nesse trabalho estão publicados ou submetidos para publicação [6-10] e eles são os que devem ser citados em publicações. Outros trabalhos publicados durante o período de mestrado não relacionados aos temas supracitados não serão abordados aqui [11, 12]. Embora esse trabalho esteja atribuído ao PPgECC, é importante ressaltar que ele só foi possível por meio de acordos de cooperação entre
diferentes instituições. A parte experimental da seção 2 foi totalmente desenvolvida no
laboratório de Dispositivos Moleculares do Instituto de Quimica Física de los Materiales, Medio Ambiente y Energía (INQUIMAE) na Universidade de Buenos Aires (UBA), por meio de um acordo de colaboração entre este laboratório e o Instituto
Internacional de Neurociências de Natal – Edmond y Lily Safra (IINN-ELS). A seção 3
foi totalmente desenvolvida no IINN-ELS com a colaboração da pós-graduação de Neurociências (PgNeuro) da Universidade Federal do Rio Grande do Norte (UFRN). E
finalmente, a seção 4 foi feita em parceria com o recém criado Departamento de
Engenharia Biomédica (DEB) da UFRN. As interações entre o PPgECC, o INQUIMAE, o IINN-ELS, o PgNeuro e o Departamento de Engenharia Biomédica representam a união de instituições de diferentes áreas (engenharias, neurociências e química).
A participação de diversos colaboradores nesses trabalhos foi imprescindível
para sua realização, e é minha obrigação dar-lhes os créditos aqui. O trabalho da seção 2
teve participação direta dos alunos Julieta Campi (UBA) e Oscar Filevich (UBA), e dos
professores Roberto Etchenique (UBA) e Sidarta Ribeiro (UFRN); da seção 3 do aluno
Sergio Conde (UFRN) e dos professores Adriano Tort (UFRN) e Sidarta Ribeiro
(UFRN); e da seção 4 dos alunos Oscar Filevich (UBA) e Rafael Nunes (UFRN) e do
2. Fotoliberação in vivo de GABA no
córtex de camundongos
“If you are out to describe the truth, leave elegance to the tailor”
Albert Einstein
2.1. Introdução
Desde que, ainda no século XVIII, Luigi Galvani descobriu acidentalmente que eletricidade estática descarregada em nervos poderia provocar contrações musculares, a bioeletricidade impôs-se como uma das principais disciplinas nas ciências biológicas e, mais tarde, nas neurociências. Atualmente, acredita-se que grande parte dos processos responsáveis pela emergência da mente são fenômenos eletroquímicos. Diversos estudos no século passado demonstraram como células nervosas trocam informação na forma de correntes iônicas e processos bioquímicos [13-15] e a busca por um melhor entendimento desses fenômenos tem feito uso extensivo de técnicas de estimulação cerebral.
A estimulação elétrica, por exemplo, possibilitou descobertas fundamentais em relação ao funcionamento da percepção, da atividade motora, da consolidação de memória e do tratamento de doenças cerebrais [16-23]. Embora tenha dado origem a tão valiosas contribuições, a estimulação elétrica tem sido criticada pelo fato de que esse tipo de corrente elétrica não é um fenômeno natural no sistema nervoso. Além disso, a resolução espacial é muito difícil de ser controlada, pois dendritos, soma e axônio são todos sensíveis a essa forma de estimulação, tornando impossível estabelecer precisamente que neurônios são afetados.
Zemelman et al. [24] baseados na bioquímica de fototransdutores da retina,
desenvolveram um método capaz de controlar in vitro a taxa de disparo de neurônios
designados geneticamente usando luz branca. Dessa forma, foi possível controlar populações funcionais em vez de locais anatômicos [25-28]. Apesar de suas vantagens, tais métodos optogenéticos ainda não estão disponíveis para os pesquisadores em geral. Uma alternativa simples e mais acessível para a fotoestimulação neural seria o uso de compostos enjaulados.
Um composto enjaulado é a união de um composto de interesse com uma jaula
química que o deixa ineficaz. O termo “caging” foi usado pela primeira vez por Kaplan
enjaulados pode contemplar as vantagens da optogenética, sendo ainda uma técnica mais barata.
Os primeiros agonistas enjaulados foram ativadores de receptores de acetilcolina sensíveis a radiação UV [30]. Alguns anos mais tarde, o primeiro glutamato enjaulado foi desenvolvido, e sua aplicação em fatias de cérebro levou a um melhor entendimento dos padrões de conexão em circuitos neurais do córtex visual [31, 32]. A resolução espacial ainda era um problema, devido às propriedades de espalhamento da luz UV. Outra solução veio com o desenvolvimento de compostos que poderiam ser ativados por luz visível, proporcionando maior penetração no tecido, menos espalhamento, melhor resolução temporal e espacial, e ainda assim sendo mais simples e mais barata [33].
Jaulas para GABA também foram introduzidas, sendo aplicadas na supressão de atividade epiléptica em fatias de cérebro [34] e para investigar receptores de GABA em fatias de hipocampo de ratos [35]. Jaulas inorgânicas sensíveis a luz visível, usando rutênio [36, 37] como fotossensor, foram recentemente desenvolvidas para GABA [38] e glutamato [36]. Essas jaulas não exibiram toxicidade e possuem uma dinâmica mais rápida que as jaulas orgânicas [39].
Neste trabalho, nós demonstramos pela primeira vez a fotoliberação de
RuBiGABA-PMe3, uma versão modificada de RuBiGABA, por pulsos de luz visível no
córtex cerebral de camundongos anestesiados. Todas as figuras desse capítulo foram retiradas de manuscritos publicados e submetidos por mim e por meus colaboradores [6, 7].
2.2. Materiais e Métodos
Animais e procedimento cirúrgico: Cinco camundongos fêmeas adultas CF1, com 60 a
70 dias de idade, e com 25 a 30 gramas, foram anestesiadas com 100 mg/kg de ketamina e 8,0 mg/kg de xilazina IP. Uma craniotomia de área circular com aproximadamente 3 mm² foi feita acima do córtex somatossensorial primário de cada camundongo (coordenadas estereotáxicas: ML = 1,7 mm, AP = - 0,3 mm). Os experimentos foram conduzidos de acordo com o National Institutes of Health (NIH) Guide for the Care and Use of Laboratory Animals (NIH Publication 80-23/96) e regulações argentinas, uma vez que foram realizados em laboratórios da Universidad de Buenos Aires. Dados de dois animais foram descartados das análises devido a problemas no registro.
Sintése de RuBiGABA-PMe3: A síntese do complexo enjaulado foi feita pelo
Laboratório de Dispositivos Moleculares no Instituto de Química Física de los Materiales, Medio Ambiente y Energía, Universidad de Buenos Aires. Detalhes do procedimento serão publicados brevemente [33].
Procedimentos experimentais: Depois da cirurgia, cada camundongo foi colocado em
conversor A/D operando em uma frequência de amostragem de 250 Hz, em um
software de aquisição de dados programado em QBasic. Durante todo o experimento,
imagens amplificadas do local de aplicação do composto foram continuamente registradas por uma câmera com foco infravermelho, como mostrado na Figura 2.1.
Pulsos de laser azul foram aplicados por uma caneta laser DPSS (diode-pumped
solid-state) de 4mW; comprimento de onda 473nm. As durações dos pulsos foram
controladas por computador. Uma lente fixa em um motor remotamente controlado permitia ao experimentador posicionar os pulsos de laser com precisão. Os registros foram divididos em três sessões de aproximadamente 30 minutos cada: i) basal, com solução salina aplicada na área exposta, e três pulsos de 1 segundo de laser aleatoriamente distribuídos no período de duração da sessão; ii) basal, com composto aplicado, mas sem uso de pulsos de laser; iii) um pulso de luz de 1 segundo foi dado na região banhada pelo composto para fotoliberação do GABA.
Análise dos sinais: Para avaliar como a infusão do composto e os pulsos de luz afetaram
a potência dos potenciais de campo, os sinais foram decompostos por bandas de
freqüência pela convolução com wavelets ortogonais - biorthogonalspline wavelets [40,
41]. Essa decomposição garante componentes não redundantes e sem perda de informação, separados pelas seguintes bandas de freqüência: delta (0,5 to 3,9 Hz), theta (3,9 to 7,8 Hz), alpha (7,8 to 15,6 Hz) e beta (15,6 to 31,25 Hz).
Para avaliar mudanças bruscas de potência no sinal, o cálculo da envoltória de amplitude dos sinais de cada componente foi calculado usando a Transformada de Hilbert, como se mostra na Figura 2.2A. O cálculo de potência RMS faria necessário calcular a integral dos sinais em janelas temporais, o que não seria conveniente para avaliar mudanças com precisão temporal.
Para cálculo do espectograma do sinal, o sinal foi convoluído com wavelets de
Morlet [42, 43] e, novamente, a envoltória de amplitude foi calculada como medida de
energia instantânea. Depois dos cálculos de energia instantânea, os dados foram testados com estatística não paramétrica (Kruskal-Wallis seguido por correção de Dunn-Sidák para número de comparações).
Figura 2.2 A fotoliberação de GABA enjaulado atenua potência de potencias de campo. A) Energia instantânea calculada a partir da envoltória de amplitude da representação analítica (RA) dos potencias de campo em quatro bandas de freqüência. A RA do sinal pode ser computada usando a transformada de Hilbert e dá grande resolução temporal para análise de transitórios. A linha vertical mostra o exato momento do pulso de laser que causou a inibição de
atividade cortical. B) Espectograma wavelet mostra inibição de atividade neural no momento
do pulso de laser.
2.3 Resultados
A Figura 2.2B mostra o espectograma wavelet do camundongo #1, que é o
melhor caso. A primeira linha vertical indica o momento de aplicação de
RuBiGABA-PMe3, e a segunda o pulso de laser. Um decaimento de atividade neural abrupta é
notável depois do estímulo luminoso.
Mudanças na estacionaridade estatística da energia instantânea dos potenciais de campo nas quatro bandas de frequência citadas em Materiais e Métodos foram calculadas nos limites dos momentos de aplicação do composto e do pulso de laser.
Para avaliar efeito de curto prazo (Figura 2.3A), períodos de um segundo da envoltória de amplitude pré e pós transições das quatro bandas de freqüência foram comparadas. A energia dos potenciais de campo mudou significativamente em todas as transições (Teste Mann-Whitney; p < 0,000001). O resultado de grupo foi calculado somando os resultados individuais após normalização individual por variância e média (z-score).
O camundongo #1 mostrou uma tendência não significativa a aumentar a potência dos sinais depois da aplicação do composto (delta: p = 0,065; theta: p = 0,065, alpha: p = 0,442; e beta: p = 0,130). Porém, no momento do pulso de luz, uma queda significante na energia do sinal foi observada (p = 0,0001 para todas as bandas de frequência). O camundongo #2 apresentou uma queda de potência dos potenciais de campo para quase todas as frequências, para aplicação do composto (delta: p = 0,0019; theta: p = 0,0002, alpha: p = 0,0002; e beta: p = 0,0002) e pulso de luz (delta: p = 0,0011; theta: p = 0,0006, alpha: p = 0,0011; e beta: p = 0,0019). No camundongo #3, a energia caiu significativamente na aplicação do composto (delta: p = 0,0022; theta: p = 0,0022, alpha: p = 0,0022; e beta: p = 0,0022), mas não depois do estímulo luminoso (delta: p = 0,8182; theta: p = 0,6991, alpha: p = 0,6991; e beta: p = 0,9372), indicando que maior parte do GABA já havia sido liberado antes que o pulso fosse aplicado. Resultados de grupo apresentaram diferenças estatisticamente significantes para ambas as transições (p = 0,0022 em todas as bandas).
2.4 Discussão
Nesse estudo foram apresentados resultados pioneiros no uso de compostos
enjaulados em aplicações in vivo. Em nenhum momento ele foi apresentado como um
trabalho definitivo de um método de controle neural. A intenção de produzir um trabalho elegante, com variação de intensidade de estímulos infalíveis não foi concretizada; mas, apesar disso, creio que são resultados preliminares legítimos nunca antes publicados, uma pequena pedra, talvez um grão de areia, mas que representa um avanço científico. Nesse sentido, talvez a maior contribuição desse trabalho seja a coleção de algumas observações nas limitações dessa técnica de estimulação para
aplicações in vivo.
Primeiro, há uma preocupação óbvia em relação à sensitividade do composto enjaulado à luz visível. Como uma concentração relativamente alta foi usada para tentar uma inibição completa da atividade cortical, é muito difícil evitar fotoliberação residual pela luz ambiente. Todo composto foi estocado em estado sólido e foi dissolvido em solução salina poucos minutos antes da sua aplicação para evitar esse problema. A diminuição de potência dos potenciais de campo nos camundongos #2 e #3 pode ser explicada por essa liberação indesejada. Por outro lado, no camundongo #1, a potência do sinal aumentou em todas as bandas de frequência depois da aplicação do composto. Isso pode ser explicado a partir de observações em trabalhos publicados [37] que mostram que a jaula usada funciona como antagonista de GABA.
Esses problemas devem ser superados com maior refinamento do método,
incluindo a determinação de uma concentração conveniente para aplicações in vivo.
Além disso, como RuBiGABA não é tóxico [37], em princípio é possível injetar baixas concentrações do complexo na corrente sanguínea dos animais, embora não haja estudos comprovando que ele possa atravessar a barreira hematoencefálica. Uma alternativa seria injetar o complexo nos ventrículos cerebrais.
Figura 2.3 Efeitos de curto e longo prazo da infusão e fotoliberação de GABA
enjaulado. A) Boxplots mostram os efeitos de curto prazo da aplicação do composto e
Mouse 1
C
ompound
A
pplica
tion
Blue Laser
S
timulus
Pre 1 second Nor maliz ed V olts
Mouse 2
Mouse 3
Group result
Nor maliz ed V olts Nor maliz ed V olts Nor maliz ed V olts DEL TA THE TA ALPHA BE TA DEL TA THE TA ALPHA BE TA Nor maliz ed V olts Nor maliz ed V olts Nor maliz ed V olts Nor maliz ed V olts 5.18 5.19 5.20 0.7650 0.7652 0.176 0.177 0.0654 0.0662 1.55 1.6 0.22 0.23 0.043 0.044 0.0134 0.0136 5.1 5.2 x0.1 4.2 4.3 1.67 1.69 1.71 x0.01 x0.01 1.64 1.66 1.68 x0.01 3.6 3.7 x0.1 2.6 2.3 x0.01 8.4 8.5 x0.001 9 9.1 x0.001 2.4 2.5 x0.1 6.2 6.4x0.01 3.3 3.4 x0.01 2.5 2.6 x0.01 7.1 7.2 9.6 9.7 5.3 5.4 5.40 5.45 x0.01 x0.001 x0.001 x0.001 −1 0 1 −1 0 1 2 −1 0 1 −1 0 1 −1 0 1 −1 0 1 −1 0 1 −1 0 1 Post 1 second Pre 1 second Post 1 second Pre 1 second Post 1 second Pre 1 second Post 1 second A. U . A. U . A. U . A. U . A. U . A. U . A. U . A. U .
A
20 25 30 35 10 15 20 6 8 10 12 1.5 2.0 2.5 5 15 25 5 10 15 5 10 1.2 1.6 2.0Mouse 1
5 10 3 5 7 4 6 8 1 2 5 10 2 4 2 4 1.0 1.4 1.8C
ompound
A
pplica
tion
Blue Laser
S
timulus
Pre 25 minutes Post 25 minutes 2 3 4 2 6 10 5 10 2 3 2 3 0.06 0.08 0.1 0.1 0.2 0.3 5 10 15 −2 0 2 4 −2 0 2 4 −2 0 2 −2 0 2 −2 0 2 −2 0 2 −2 0 2 −2 0 2 Nor maliz ed V olts
Mouse 2
Mouse 3
Group result
estímulo de luz em três camundongos. Observe-se que o cálculo da envoltória de
amplitude em bandas de freqüências filtradas com wavelets permite obter alta resolução
temporal. Todas as transições de curto prazo são estatisticamente significantes (Teste
Mann-Whitney p < 0.000001, fundo cinza). B)Boxplots mostram efeitos de longo prazo
na voltagem dos potenciais de campo em quatro bandas de frequência em três
camundongos. Cada boxplot representa níveis de tensão dentro de quatro bandas de
3. Detecção de assembleias neurais
“If in other sciences we should arrive at certainty without a doubt and truth without error, it behooves us to place the foundations of
knowledge in mathematics”
Rober Bacon
3.1. Introdução
Entender a nós mesmos é o mais antigo e, provavelmente, mais difícil problema da ciência. Não sabemos se um sistema complexo pode entender a si próprio, mas nossa única chance é através do acúmulo de gerado por uma imensa comunidade, bloco a bloco. Não é um problema de por quais materiais somos feitos, e sim de como eles se organizaram a partir do caos no decorrer de milhões de anos de evolução. A emergência
do eu e dos qualia nos confunde desde a Grécia Antiga, mas foi só no século XX, que
as chamadas neurociências se propuseram a criar métodos objetivos para estudar tais fenômenos. Resultados experimentais extraordinários têm aparecido nas últimas décadas, mas apesar das diversas teorias que vêm sendo propostas ainda não há um modelo claro e definitivo que descreva como células neurais interagem entre si e com o
corpo para sentir, aprender e ser. Vários grupos de pesquisa publicaram experimentos
que lidam diretamente com o estudo da consciência; mas enquanto lacunas mais básicas
não forem preenchidas, os resultados desse trabalho são apenas relatos de interpretação subjetiva.
A primeira e, provavelmente, a mais bem sucedida teoria para explicar com rigor científico o funcionamento do sistema nervoso puramente por processos mecanísticos
foi elaborada por Donald Hebb em 1949 [45], a partir de seu famoso postulado: Se o
neurônio A repetidamente provoca disparos em um neurônio B, algum processo metabólico ou processo de crescimento anatômico tornaria a sinapse que liga A e B mais eficiente. Uma das consequências fundamentais de seu axioma é que a unidade
elementar de processamento de informação do sistema nervoso não é um único
neurônio, mas sim uma assembleia neuronal. Uma assembleia seria um grupo de
neurônios, fortemente conectados, de tal forma que o estímulo de uma fração de seus membros, provocaria a ativação de todo o grupo. Assembleias que disparassem sequencialmente, também formariam ligações entre elas. Pelo mesmo princípio, a
ativação de uma assembleia provocaria cadeias de ativações, chamadas de phase
sequences, que seriam responsáveis por computações mais complexas.
Seria 1949 o Annus Mirabilis da neurociência moderna? Embora tenha
fenômenos de mais baixa ordem vêm sido experimentalmente confirmadas [20, 46-48], Hebb não viveu numa época que a maioria de suas teorias pudesse ser testada. De fato, a tecnologia para o registro de populações neuronais vêm crescendo em ritmo acelerado [49], mas ainda somos limitados a observar uma parcela ínfima das células do cérebro. Além disso, as ferramentas matemáticas e estatísticas desenvolvidas para a análise de atividade neuronal não são capazes de trabalhar com grandes populações de neurônios [50, 51].
Em 1995, um método baseado em Análise de Componentes Principais (Principal
Component Analysis – PCA) para extração de padrões de co-ativação foi proposto.
Essas representações vetoriais foram usadas para computar séries temporais que descrevem o comportamento desses padrões como função do tempo [52]. Mais recentemente esse
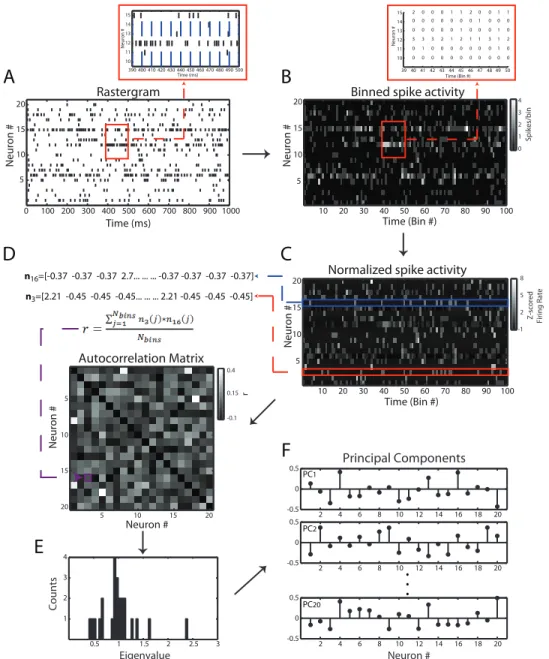
Figura 3.1. Fundamentação básica do método original. 0 100 200 300 400 500 600 700 800 900 1000
5 10 15 20 Time (ms) Neuron # Rastergram
Time (Bin #)
Neuron #
Binned spike activity
10 20 30 40 50 60 70 80 90 100 5
10 15 20
39 40 41 42 43 44 45 46 47 48 49 50 10 11 12 13 14 15
Time (Bin #)
Neuron #
2 0 1
3
0 0 1 2 0 0 1 1 0 0 0 0 0 0 0 0 0
0 0 0 3
0 0 0 0 0 0 0 0 0 1
0 0 0 0 0 1 0 0 0 1 0 3 2 1 2 1 1 3 1 2 0 1 0 0 0 0 0 0 0 1 0
390 400 410 420 430 440 450 460 470 480 490 500 10 11 12 13 14 15 Time (ms) Neuron #
Time (Bin #)
Neuron #
Normalized spike activity
10 20 30 40 50 60 70 80 90 100 5 10 15 20 0 1 2 3 Spikes/bin -1 2 5 8
Z-scored Firing Rate
4 Neuron # Neuron # Autocorrelation Matrix -0.1 0.15 0.4 r
5 10 15 20
A
B
D
C
F
Principal Components2 4 6 8 10 12 14 16 18 20 -0.5
0 0.5
2 4 6 8 10 12 14 16 18 20 -0.5
0 0.5
2 4 6 8 10 12 14 16 18 20 -0.5 0 0.5 PC20 PC1 PC2
.
.
.
n16=[-0.37 -0.37 -0.37 2.7... ... ... -0.37 -0.37 -0.37 -0.37]n3=[2.21 -0.45 -0.45 -0.45... ... ... 2.21 -0.45 -0.45 -0.45]
método foi reformulado com mais rigor estatístico [53], sendo possível determinar que componentes principais poderiam ser consideradas significantes. Isso é feito através da análise da distribuição dos autovalores da matriz de autocorrelação computada para a atividade de uma população neuronal simultaneamente registrada.
Apesar dos resultados obtidos por essa reformulação [54, 55], ela ainda apresenta algumas limitações importantes. Primeiro, apesar de detectar a presença de subgrupos de células correlacionados, ele é incapaz de identificar que neurônios fazem parte das assembleias na rede. Além disso, uma análise cuidadosa revela que as séries temporais geradas por esse método não necessariamente representam a atividade de assembleias individuais.
Nesse trabalho um estudo detalhado das propriedades gerais do método atual como descrito em [53] é apresentado. Mostramos por meio de simulações que é possível dar um significado mais preciso aos autovalores da matriz de correlação e dos seus autovetores (componentes principais) associados. Por fim, propomos modificações para
que o método seja capaz de: (i) identificar a quantidade exata de assembleias
independentes e neurônios envolvidos em assembleias na rede, de (ii) especificar que
neurônios participam em cada assembleia, e de (iii) projetar séries temporais que
representem a atividade de cada assembleia individualmente. Após a validação do método por estudos paramétricos e simulações, o aplicamos em registros eletrofisiológicos reais de roedores durante livre exploração de objetos e durante o sono. Os resultados dessas análises sugerem que assembleias podem possuir neurônios de diversas regiões cerebrais e que neurônios podem participar em múltiplas assembleias. Acreditamos, portanto, que o método esteja validado e pronto para ser usado com mais rigor em mais análises, para então gerar resultados conclusivos na formação e dinâmica das assembleias Hebbianas. Todas as figuras presentes nessa seção foram extraídas de publicações e apresentações [8, 9].
3.2. Método atual
Nessa seção, o método atual como apresentado em [53] é descrito brevemente. Na Figura 3.1A, é mostrada a atividade de uma população neuronal simulada. Cada
traço na figura representa um potencial de ação de um neurônio (eixo vertical) em
função do tempo (eixo horizontal). O primeiro passo do processo é construir uma matriz
A que integre os potenciais de ação de cada neurônio em janelas de tempo sem
interseção entre si (bins). Mais especificamente, o elemento aij de A determina a
quantidade de disparos do neurônio i no bin j (Figura 3.1B); aqui definido como taxa de
disparo. Em seguida, cada linha de A é normalizada para média e variância (Figura
3.1C; ver apêndice – z-score). Depois, a matriz de autocorrelação (MAC) de A é
computada – cada elemento cij da MAC representa a correlação linear entre os
neurônios i e j de A (Figura 3.1D). Todas as MACs mostradas em figuras nessa seção
Componentes Principais (Principal Components – PCs). Finalmente, os PCs podem ser
usados para computar a força dos padrões de co-ativação neuronal como função do
tempo com a resolução de um bin (ver Fundamentação Teórica para mais detalhes). Duas questões importantes são: (i) saber quando os coeficientes de correlação de dois neurônios podem ser considerados estatisticamente significantes; e (ii) reconhecer correlação de alta ordem, i.e., subgrupos de três ou mais neurônios correlacionados entre si (definição dada em [51, 56, 57]). Peyrache e seus colaboradores [53-55] elegantemente atacaram esses problemas analisando a distribuição dos autovalores da MAC. Da teoria de matrizes aleatórias [58], pode ser demonstrado que os autovalores de uma MAC computada de uma matriz com linhas estatisticamente independentes (em nosso caso neurônios em atividade independente) seguem a chamada distribuição de Mar enko-Pastur [59]. Dessa forma, se algum autovalor for maior que o limiar superior da distribuição teórica, é esperado que haja atividade correlacionada na rede. Além disso, os PCs associados aos autovalores significantes podem ser usados como assinaturas para computar a atividade dessa atividade correlacionada como função do tempo.
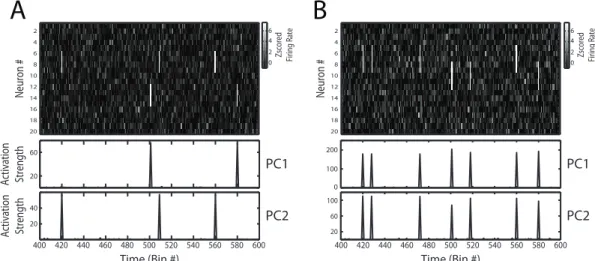
Figura 3.2. Computação da série temporal através dos componentes principais.
A Figura 3.2 mostra dois exemplos de matriz de atividade neuronal simulada. A Figura 3.2A mostra uma população de 20 neurônios modelados como processos de Poisson (média de disparo = 1/bin). As simulações têm 8000 bins de duração, mas só 200 são mostrados na figura para melhor visualização. Para simular assembleias, subgrupos de neurônios foram programados a disparem acima de sua média juntamente em 0.5% dos bins de toda a matriz. A co-ativação transiente dos membros de uma
assembleia em um bin é chamada aqui de ativação da assembleia. Os painéis inferiores
da Figura 3.2 mostram a série temporal computada para cada PC. Note que nesse exemplo cada um dos componentes principais representam a atividade de uma
assembleia. Isso pode ser constatado observando que os picos da função correspondem
aos bins em que a assembleia está ativa no painel superior. Já no exemplo mostrado na Figura 3.2B, os componentes principais não conseguem isolar a atividade das duas
Time (Bin #)
Neuron #
2 4 6 8 10 12
14
16 18 20
0 2 4 6
20 60
400 420 440 460 480 500 520 540 560 580 600
20 40
0 100 200
20 60 100
14
Activation Strength
Activation Strength
Time (Bin #)
400 420 440 460 480 500 520 540 560 580 600
Zscored Firing Rate
0 2 4 6
Zscored Firing Rate
Neuron #
2 4 6 8 10 12
16 18 20 14
PC1
PC2
PC1
PC2
assembleias. Isso acontece porque existem neurônios que participam em duas assembleias.
O método descrito aqui não só resolve o problema de encontrar a identidade de cada neurônio nas assembleias detectadas, mas também usará essa informação para isolar a atividade de cada assembleia quando a série temporal for computada.
3.3. A distribuição de Mar enko-Pastur e a hipótese nula
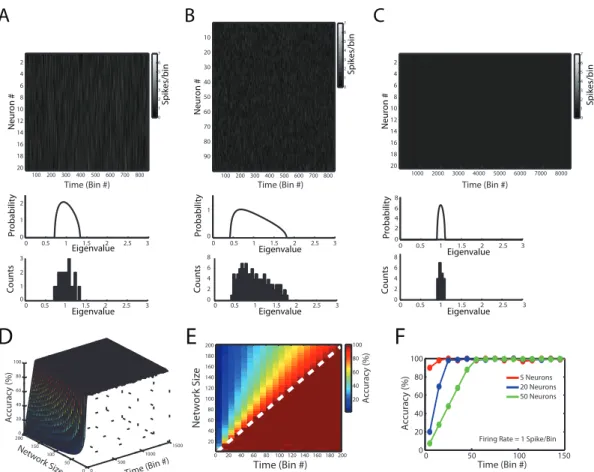
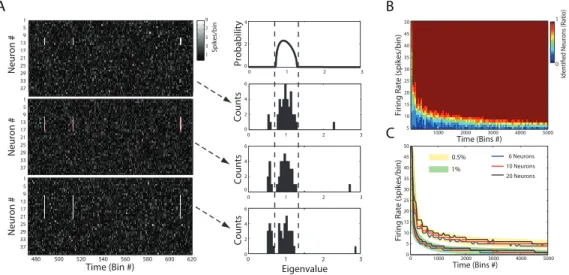
Para começar, a distribuição de Mar enko-Pastur será explorada através de simulações computacionais. Aqui nos focaremos em análises computacoinais, mas detalhes analíticos dessa distribuição serão discutidos na seção Fundamentação Teórica. Os paineis superiores das Figuras 3.3A-C mostram três exemplos de matriz de atividade com diferentes número de neurônios e de bins. O painel intermediário mostra a Mar enko-Pastur computada para a matriz de atividade, e o painel inferior mostra o histograma empírico dos autovalores da matriz de autocorrelação das matrizes de atividade. Note que a distribuição empírica dos autovalores segue fielmente a distribuição teórica nos três exemplos.
Figura 3.3. Distribuição Mar enko-Pastur como hipótese nula.
Simulações foram feitas exaustivamente para testar essa propriedade. A Figura 3.3D mostra a porcentagem de autovalores empíricos dentro dos limiares teóricos em
Time (Bin #)
100 200300 400 500 600 700800
2 4 6 8 10 12 14 16 18 20 0 1 2 3 4 5 6 7
0 0.5 1 1.5 2 2.5 3
0 1 2
0 0.5 1 1.5 2 2.5 3
0 1 2 3 Neur on # P robabilit y C oun ts
100 200 300 400 500 600 700 800 10 20 30 40 50 60 70 80 90
0 0.5 1 1.5 2 2.5 3
0 0.5 1 1.5 2 2.5 3
0 2 4 6 8
Time (Bin #)
0 1
1000 2000 3000 4000 5000 6000 7000 8000
2 4 6 8 10 12 14 16 18 20
0.5 1 1.5 2 2.5 3
0 2 4 6 8
0 0.5 1 1.5 2 2.5 3
P robabilit y C oun ts P robabili ty C oun ts Neur on #
A
B
C
Eigenvalue Eigenvalue Eigenvalue Eigenvalue Spikes/bin 0 1 2 3 4 5 6 7 Spikes/bin 0 1 2 3 4 5 6 7 Spikes/bin Eigenvalue Eigenvalue Time (Bin #)
Neur on # 0 2 4 6 8 0 0 500 1000 1500 0 50 100 150 2000 20 40 60 80 100 20 40 60 80 100
Time (Bin #)
Network Size
0 20 40 60 80100 120 140 160 180 200 20 40 60 80 100 120 140 160 180 200
D
E
Network SizeTime (Bin #)
Accuracy (%)
Accuracy (%)
0 50 100 150
0 20 40 60 80 100
Time (Bin #)
Accuracy (%)
Firing Rate = 1 Spike/Bin 5 Neurons 20 Neurons 50 Neurons
função do número de bins e do número de neurônios na rede (Network Size). Cada
ponto no gráfico foi a média de vinte simulações. A Figura 3.3E destaca o limiar que separa virtuais 100% de classificação de valores inferiores nos resultados mostrados na Figura 3.3D. Observe que se o número de bins da matriz de atividade é maior que o número de neurônios (ou seja, o número de colunas é maior que o número de linhas), todos os autovalores ficam dentro dos limiares previstos pela distribuição teórica. A Figura 3.3F mostra três cortes (com número de neurônios fixos) da superfície mostrada em Figura 3.3D. Observe que o número de autovalores acima do limiar tende a 100% quando a número de bins é aumentado. Em resumo, é possível concluir que os limiares teóricos previstos pela distribuição de Mar enko-Pastur podem ser usados como hipótese nula para testar estatisticamente se há atividade correlacionada entre subgrupos de neurônios. Na próxima seção, é mostrado que os autovalores fora dos limites da distribuição não só indicam presença de assembleias, mas podem ser usados para estimar o número de neurônios envolvidos em atividade correlacionada e o número de assembleias em uma matriz de atividade neuronal
.
3.4. Detectando número de assembleias e de neurônios em assembleias
Até aqui foi mostrado que autovalores da matriz de autocorrelação de uma matriz de atividade com neurônios com atividade independente ficam nos limiares teóricos. Agora podemos ir adiante para mostrar que o número de autovalores acima do limiar superior teórico não só indica a presença de atividade correlacionada, mas o número de assembleias na rede.
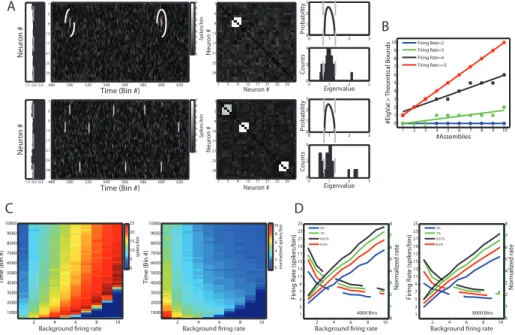
Na Figura 3.4A dois exemplos de atividade de rede neuronal são mostrados. Neurônios são modelados como na Figura 3.3. As assembleias são simuladas como nos exemplos da Figura 3.2. Os membros de uma dada assembleia são programados para estarem entre 5 e 9 vezes acima de sua média de disparo durante a ativação da assembleia correspondente. Aqui definimos a quantidade de ativações da assembleia
pelo número total de bins como frequência de avitação. Nos exemplos da Figura 3.4A,
Primeiro estudamos como a taxa de disparo dos neurônios no momento da ativação da assembleia influencia nos resultados. Redes com 40 neurônios (média de 1 disparo por bin) e com 8000 bins foram simuladas e os autovetores da MAC foram calculados. As assembleias foram compostas sempre por 4 neurônios e programadas para ter frequência de ativação igual a 1/200 bins. Mostramos na Figura 3.4B a relação entre número de assembleias e número de autovalores acima do limiar teórico. Cada ponto no gráfico representa uma simulação e as diferentes cores mostram casos com diferentes taxas de disparos dos neurônios na ativação das assembleias. Para medir a
eficiência de detecção de assembleias, regressões lineares (y = α + βx) foram feitas
separadamente para cada taxa de disparo. Como desejamos que o número de
assembleias seja igual ao número de autovalores acima do limiar, β = 1 significa
detecção perfeita. Como mostrado na Figura 3.4B, forças de ativação 5 vezes maior que a média de disparos da rede já proporciona β = 1.
Figura 3.4. Encontrando o número de assembleias.
Simulações exaustivas foram feitas para estudar mais profundamente os requisitos para detecção perfeita. A Figura 3.4C mostra a taxa de disparo mínima na ativação da assembleia necessária para que esse critério seja alcançado em função da média de disparo da rede e número de bins analisados. No painel esquerdo, a taxa de disparo é mostrada em valores absolutos, enquanto no esquerdo é mostrada é relativizada pela média de disparos da rede. Observe que menores taxas são necessárias se um número de bins maior for analisado. Mais especificamente, quanto maior a relação entre número de bins e número de neurônios, melhor será a eficiência do método. Cada valor nos gráficos representa a média de 20 simulações. Na Figura 3.4D matrizes de atividade com 4000 (painel esquerdo) e 8000 (direito) bins são estudadas para quatro diferentes frequências de ativação das assembleias (número de bins relativo ao total que a assembleia estava ativa). É mostrada a taxa de disparo mínima para β = 1
C
1 2 3 4 5 6 7 8 9 10
0 1 2 3 4 5 6 7 8 9 10 #Assemblies
#EigVal > Theoretical Bounds
Firing Rate=2 Firing Rate=3 Firing Rate=4 Firing Rate>=5 0 5 10 15 20 25 D
4000 Bins 8000 Bins
spikes/bin
Time (Bin #)
)
2 4 6 8 10
1000 2000 3000 4000 5000 6000 7000 8000 9000 10000
Time (Bin #)
2 4 6 8 10
1000 2000 3000 4000 5000 6000 7000 8000 9000 10000 0 2 4 6 8 10 1 3 5 7 9 11 13 15 17 19 21 23 25
Firing Rate (spikes/bin)
2 4 6 8 100
1 2 3 4 5 6 7 8 Normalized rate 1 3 5 7 9 11 13 15 17 19 21 23 25
Firing Rate (spikes/bin)
2 4 6 8 100
1 2 3 4 5 6 7 8 Normalized rate
480 500 520 540 560 580 600 620 0 1 2 3 4 5 6 7 8 9
1.5 0.9 0.3
0 1 2 3
0 1 2 3
Probability
0 1 2 3
0 2 4 Eigenvalue Counts Neuron # Neuron # 1 5 9 13 17 21 25 29
1.5 0.9 0.3 1 5 9 13 17 21 25 29 Neuron # Neuron #
Time (Bin #)
480 500 520 540 560 580 600 620
0 1 2 3
0 1 2 3
Probability
0 1 2 3
0 2 4 Eigenvalue Counts Neuron # Neuron # B A 2% 1% 0.67% 0.5% 2% 1% 0.67% 0.5% normalized spikes/bin 1 5 9 13 17 21 25 29 1 5 9 13 17 21 25 29
1 5 9 13 17 21 25 29
1 5 9 13 17 21 25 29
Spikes/bin 0 1 2 3 4 5 6 7 8 9
Background firing rate Background firing rate Background firing rate Background firing rate Time (Bin #)
em função da taxa de disparo média. Em síntese, as simulações mostram que o número de autovalores acima do limiar superior teórico é fortemente relacionado com o número de assembleias presente na rede. Em síntese, a eficiência do critério depende da quantidade de bins em que os neurônios estão sincronizados e quão alta é sua correlação nesses bins.
A seguir, damos atenção aos autovalores abaixo do limiar inferior teórico. Inspeção visual da Figura 3.4A sugere que o número de autovalores abaixo dos limiares inferiores aumenta quando mais assembleias são adicionadas na rede. Na Figura 3.5 mostramos que o número de autovalores fora da distribuição (valores abaixo e acima) é uma boa estimativa do número total de neurônios envolvidos em assembleias. Mais especificamente, na Figura 3.5A, três exemplos de rede com 40 neurônios e 8000 bins são mostrados. Cada rede possui uma assembleia ativa em 0,5% dos bins e seu número de membros é variado (4, 8 e 12; respectivamente). Observe nos histogramas correspondentes que o número de autovalores fora dos limiares da distribuição corresponde perfeitamente ao número de neurônios nas assembleias.
As Figuras 3.5B-C mostram resultados de mais simulações feitas para medir a
robustez de tal observação. Na Figura 3.5B mostramos a razão r (# autovalores fora da
distribução/# neurônios na assembleia) como função da força de ativação da assembleia
e número de bins analisados. Observe que → 1 quando é aumentado o número de bins
analisados ou a força de ativação da assembleia (taxa de disparo dos membros da
Assembleia em suas ativações). A Figura 3.5C mostra o limiar para = 1 para três
diferentes tamanhos de assembleia para duas freqüências de ativação (1/200 bins e 1/100 bins) da assembleia. Observe que a detecção perfeita não depende significativamente do número de neurônios na assembleia, mas sim de sua frequência e força de ativação e número total de bins analisados. Resultados equivalentes foram observados em redes compostas com mais assembleias, mesmo quando elas dividem neurônios. Por exemplo, um neurônio em várias assembleias provoca apenas a saída de
um autovalor da distribuição.
Figura 3.5. Encontrando o número de neurônios em assembleia. 1 5 9 13 17 21 25 29 33 37 0 Counts A B C 1 3 5 7 9 Probability0 2 4 2 6 1 5 9 13 17 21 25 29 33 37 4
480 500 520 540 560 580 600 620
1 5 9 13 17 21 25 29 33 37 Counts
0 1 2 3
0 2 4 6
Time (Bin #) Eigenvalue
0 1 2 3
0 1 2 3
Firing Rate (spikes/
bin)
1000 2000 3000 4000 5000 5 10 15 20 25 30 35 40 45 50
0 1000 2000 3000 4000 5000 0 5 10 15 20 25 30 35 40 45 50
Time (Bins #)
Firing Rate (spikes/
bin) 6 Neurons 10 Neurons 20 Neurons 1% 0.5% Neuron # Neuron # Neuron #
0 1 2 3
0 Counts2 6 4 Spikes/bin 0 1
Identified Neurons (Rat
io)
Análise detalhada com simulações amplia a observação de Peyrache e seus colegas para uma interpretação clara do significado dos autovalores. Na próxima seção mostramos como essas informações podem ser usadas para finalmente identificar que neurônios participam em cada uma das assembleias.
3.5. Identificando as assembleias e sua ativação com precisão temporal
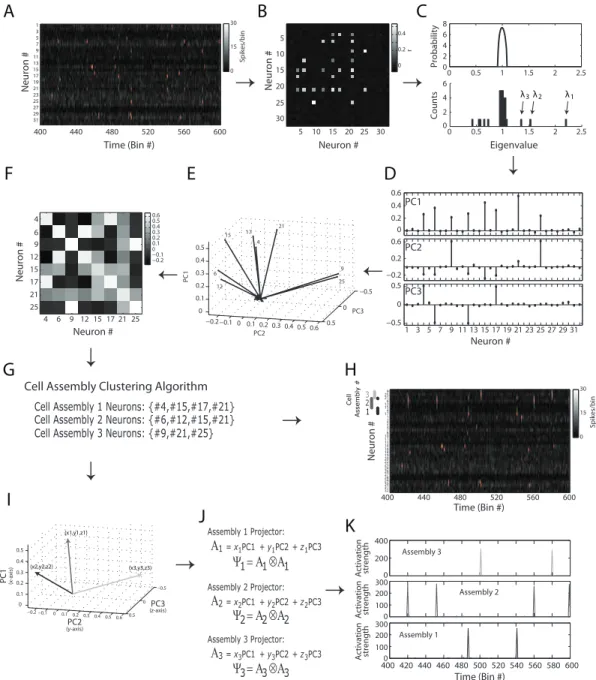
Até aqui foi mostrado como a relação entre os autovalores da MAC e a distribuição de Mar enko-Pastur pode ser usada para determinar o número de assembleias e de seus neurônios numa rede neuronal. Os autovalores significativos estão por definição associados com autovetores, nesse contexto chamados de componentes principais. Agora será mostrado como esses componentes principais significantes podem ser usados para identificar que neurônios participam em cada assembleia. Para tal, uma matriz de atividade foi simulada com 25 neurônios e 8000 bins como exemplo ilustrativo (Figura 3.6).
Figura 3.6. Aplicação do método proposto em dados simulados 1.
0 10 20 30
Time (Bin #)
400 440 480 520 560 600
Neuron #
Neuron #
5 10 15 20 25 0 0.1 0.2 5 10 15 20 25
0 0.5 1 1.5 2
0 1 2 3 4 Counts Eigenvalue 0 2 4 6 Probability
0 0.5 1 1.5 2
1 3 5 7 9 11 13 15 17 19 21 23 25
0 0.2 0.4 0.6 0 0.2 0.4 0.6
−0.1 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8
−0.1 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 Neuron # Neuron #
5 12 15 21 23
5 12 15 21 23 0 0.1 0.2 0.3 0.4 0.5 0.6
Time (Bin #)
Neuron #
400 440 480 520 560 600
12 23 5 15 21 1 2 3 4 6 7 8 9 10 11 13 14 16 17 18 19 20 22 24 25 0 40 80 0 50 100
Time (Bin #) Activation strength
Activation strength
400 420 440 460 480 500 520 540 560 580 600
−0.2 0 0.2 0.4 0.6 0.8 1 1.2
0 0.2 0.4 0.6 0.8
1 Assembly 1 Vector = (x1,y1)
15
21 5
23
12
1 3 5 7 9 11 13 15 17 19 21 23 25
Neuron # 23 5 15 21 1 3 7 9 11 13 17 19 25 Spikes/bin r
λ2λ1
PC1
PC2
PC2
PC1
Neuron #
Cell Assembly Clustering Algorithm
Cell Assembly 1 Neurons: {#5,#15,#21} Cell Assembly 2 Neurons: {#12,#23}
PC1 0 10 20 30 Spikes/bin 2 1 C el l A sse m bl y #
Assembly 1 Projector:
Α1 = x1PC1 + y1PC2
Assembly 2 Projector:
Α2 = x2PC1 + y2PC2 Assembly 2 Vector = (x2,y2)
A
B
C
D
E
F
H
K
G
I
J
(x-axis) PC2 (y-axis) Assembly 2 Assembly 1Ψ = Α ⊗Α1 1 1
Neurônios foram novamente modelados como processos de Poisson, mas com diferentes médias de disparo (uniformemente distribuídas entre os neurônios entre 1 e 5 disparos por bin). Para simular assembleias, dois grupos de neurônios (grupo 1: neurônios #5, #15, #21; grupo 2: neurônios #12 e #23) foram programados para dispararem seis vezes acima de sua média em 0,5% dos bins de ativação de suas respectivas assembleias. Além disso, o restante dos neurônios foram programados para estarem também seis vezes acima de sua média em 0,5% dos bins aleatoriamente escolhidos e independentes entre si.
A Figura 3.6A mostra um intervalo de 200 bins na rede simulada; a MAC associada é mostrada na Figura 3.6B. Como esperado, dois autovalores dessa matriz caem acima do limiar superior, enquanto três deles caem abaixo do limiar inferior (Figura 3.6C). Já que esses autovalores acima do limiar estatístico representam atividade correlacionada na rede, nós usamos os PCs associados a eles (Figura 3.6D) para buscar a identidade das assembleias. A MAC pode ser visualizada como 25 vetores
(um para cada neurônio, aqui chamados de vetores neuronais) em um espaço vetorial
com 25 dimensões. Nesse caso, PCA indica que a atividade significativamente
correlacionada é mais bem descrita em um subespaço vetorial (chamado aqui Subespaço
das Assembleias - SA). Desconsiderar os autovetores não significativos da análise é
equivalente a uma filtragem espacial da MAC.
A Figura 3.6E mostra a projeção de cada vetor neuronal (VN) no subespaço da assembleias. Observe que os cinco neurônios com maior projeção (vetores rotulados) têm uma projeção muito maior nesse subespaço que os demais. Dessa forma, se existem autovalores fora da distribuição teórica, os neurônios com maior projeção no SA serão os que participam em assembleia. Observe também que dois agrupamentos são formados nesse subespaço, e que os neurônios pertencentes a um agrupamento são praticamente ortogonais aos de outro. Tomando essa observação em consideração, e dado que a amplitude do VN nesse subespaço indica a participação do neurônio correspondente na atividade correlacionada detectada; uma nova matriz é criada,
chamada de Matriz de Interação ( ), em que cada elemento yij corresponde ao produto
interno do neurônio i e j no SA. Como os neurônios participando em assembleias já
foram identificados, mostramos a apenas para eles (Figura 3.6F). A partir dessa
matriz, um algoritmo que desenvolvemos, e é descrito em [61], agrupa neurônios nas assembleias (Ver Fundamentação Teórica).
Agora que sabemos a identidade de cada assembleia, é necessária a construção
de um projetor que possa ser usado para computar sua atividade com resolução
temporal. A Figura 3.6J mostra a mesma matriz de atividade da Figura 3.6A, porém com as linhas reordenadas em respeito à identidade das assembleias. Note que os neurônios da mesma assembleia têm de fato picos de disparo nos mesmos bins. O
método atual usa essas componentes principais individuais para criar os projetores e
computar a atividade das assembleias [53-55]. Porém, os componentes principais não isolam a atividade de assembleias diferentes, como mostrado nas seções anteriores. Para atacar esse problema, propomos a criação de vetores de assembleia baseados nos VNs correspondentes de cada uma delas. Em primeiro lugar, o vetor médio de cada assembleia é calculado e sua amplitude é normalizada, como mostrado na equação
sendo ai (i = 1, 2...) os vetores neuronais exclusivos a uma assembleia A. Em seguida,
usamos o vetor médio para levar os vetores das assembleias de volta ao espaço vetorial da MAC como descrito na equação
= ( ∙ )
onde pi é a componente principal i e n é o número de componentes principais
significantes. Depois, usamos αααα para construir o projetor da assembleia calculando seu
produto tensorial
= ⊗
Finalmente usamos o projetor para medir similaridade com o padrão de ativação
da assembleia com padrões instantâneos da matriz da Figura 3.6A normalizada Z, como
mostrado na equação abaixo.
( ) = Ψ
, ,
onde RA é a série temporal da ativação da assembleia A, Zib é o elemento
correspondente ao neurônio i e ao bin b da matriz de atividade normalizada Z (Figura
3.6A). Note que RAtem a resolução de um bin. Observe também que os termos i = j são
excluídos da operação, pois eles só levam em consideração a atividade de um neurônio. As séries temporais computadas para esse exemplo são mostradas na Figura 3.6K. Note que os picos de ativação das assembleias correspondem perfeitamente aos picos de ativação computados nas séries temporais.
Um leitor atento perceberia que uma simples inspeção visual na Figura 3.6F levaria a identificação das assembleias. Por exemplo, o primeiro componente principal tem pesos maiores nas dimensões 5, 15 e 21; o que corresponde a uma assembleia programada. É também claro na Figura 3.6H que os vetores das assembleias são virtualmente os próprios componentes principais, e dessa forma o método atual conseguiria isolar a atividade das assembleias e calcular suas séries temporais de ativação. Porém, esse nem sempre é o caso. Mais especificamente, esse método não funciona se existem neurônios participando em mais de uma assembleia, como mostrado na Figura 3.2B.
ele ainda será relativamente alta. Por exemplo, o VN do neurônio #15 fica no mesmo plano que os neurônios das assembleias 1 e 2. Repetindo o processo baseado na matriz de interação, são detectadas as identidades das assembleias perfeitamente. Os vetores médios das assembleias não mais correspondem aos componentes principais como
mostrado na Figura 3.7I; e consequentemente o cálculo dos projetores baseado apenas
neles não serve para o cálculo projeção temporal das atividades das assembleias. No entanto, usando o método proposto nesse trabalho, as séries temporais correspondem perfeitamente à atividade das assembleias (compare Figura 3.7H com a Figura 3.7K).
Figura 3.7. Aplicação do método proposto em dados simulados 2.
A Figura 3.8 mostra como seriam as séries temporais computadas pelo método original para os exemplos mostrados na Figura 3.6 e 3.7. Apesar do método não identificar que neurônios fazem parte de cada assembleia, as séries temporais computadas para o primeiro exemplo equivalem às séries temporais encontradas pelo
método aqui proposto. Como já comentado, a computação da série temporal é
Time (Bin #)
400 440 480 520 560 600
Neuron #
Neuron #
5 10 15 20 25
0 0.2 0.4 0 Counts Eigenvalue Probability Neuron # Neuron #
Time (Bin #)
Neuron #
400 440 480 520 560 600
Time (Bin #)
Activation strength
Activation strength
400 420 440 460 480 500 520 540 560 580 600
Neuron #
Spikes/bin
r
λ2 λ1
Neuron #
Cell Assembly Clustering Algorithm
Cell Assembly 2 Neurons: {#6,#12,#15,#21}
Cell Assembly 3 Neurons: {#9,#21,#25} Spikes/bin
3 2 C e ll A sse m bl y #
Assembly 1 Projector: Α1 = x1PC1 + y1PC2
Assembly 2 Projector:
A
B
C
D
E
F
H
K
G
I
J
5 10 15 20 25 30 300 0.5 1 1.5 2 2.5
0 2 4 6 8 2 4 6 λ3 0 0.2 0.4 0.6 −0.2 0.2 0.6 −0.5 0 0.5 PC1
1 3 5 7 9 11 13 15 17 19 21 23 25 27 29 31
PC2 PC3 PC2 −0.5 0 0.5 −0.2−0.1 0 0.1 0.2 0.3 0.4 0.50.6 0 0.1 0.2 0.3 0.4 0.5 PC3 PC1 21 15 25 9 12 6 17 4
4 6 9 12 15 17 21 25 4 6 9 12 15 17 21 25 −0.2 −0.1 0 0.1 0.2 0.3 0.4 0.5 0.6
Cell Assembly 1 Neurons: {#4,#15,#17,#21}
+ z1PC3
Α2 = x2PC1 + y2PC2 + z2PC3
Assembly 3 Projector: Α3 = x3PC1 + y3PC2 + z3PC3
PC2
−0.5
0
0.5
−0.2 −0.1 00.10.20.30.40.50.6
PC3 9 25 21 6 12 15 4 17 1 2 3 5 7 8 10 11 13 14 16 18 19 20 22 23 24 26 27 28 29 30 31 32 1 0 200 400 0 100 200 300
Activation strength 0 100 200 300 Assembly 3 0 30 15 0 0.1 0.2 0.3 0.4 0.5 PC1 1 3 5 7 9 11 13 15 17 19 21 23 25 27 29 31 0 30 15
0 0.5 1 1.5 2 2.5
Assembly 2 Assembly 1 (x1,y1,z1) (x2,y2,z2) (x3,y3,z3) (x-axis) (y-axis) (z-axis)
Ψ = Α ⊗Α1 1 1
Ψ = Α ⊗Α
2 2 2
Ψ = Α ⊗Α
equivalente nos dois métodos se não existem neurônios participando de mais de uma assembleia. Contudo, está clado que para a matriz do segundo exemplo (Figura 3.8B), as séries temporais computadas pelo método original confudem assembleias diferentes.
Figura 3.8. Séries temporais dos exemplos passados usando PC’s individuais
3.6. Aplicações em dados reais
Usando dados simulados, acima validamos um método para detecção de assembleias neuronais e para a computação de sua atividade com alta resolução temporal. Agora o método é finalmente aplicado em matrizes de atividade neuronal real.
Nós analisamos a atividade de disparo registrada em ratos com implantes crônicos de matrizes de eletrodos. No primeiro exemplo (Figura 3.9A), atividade neuronal foi obtida simultaneamente do hipocampo (HP) e córtex somatossensorial primário (S1) de um rato enquanto explorava livremente objetos [62]. Os resultados mostrados são de apenas um objeto específico. Estudos mais detalhados e resultados conclusivos serão feitos e publicados posteriormente. Na Figura 8Ai, mostramos um período de 200 bins de 30 ms cada. A Figura 3.8Aii mostra a comparação entre a distribuição teórica e o histograma empírico dos autovalores. Note que três assembleias foram detectadas. Na Figura 3.8Aiii é mostrada a mesma matriz da Figura 8Ai, mas reordenada em respeito às identidades das assembleias reveladas. A Figura 8Aiv mostra a série temporal correspondente a cada uma das assembleias (perceba a correspondência dos picos da projeção temporal e as ativações dos neurônios destacadas por circunferências pontilhadas). Finalmente, mostramos na Figura 8Av as identidades das assembleias. Os pequenos círculos representam neurônios, e suas cores suas respectivas regiões (HP e S1). Os neurônios pertencentes à mesma assembleia são conectados por linhas. Observe que a aplicação do nosso método revela que assembleias surgem durante exploração de objetos e que uma delas é formada por neurônios do HP e S1.
No segundo exemplo (Figura 3.9B), neurônios do HP, S1 e córtex visual primário (V1) foram simultaneamente registrados durante o sono de ondas lentas em outro rato. Análise da distribuição dos autovalores revela que quatro assembleias estão presentes na rede. Nós novamente aplicamos nosso método para identificar os neurônios pertencentes a cada assembleia, como mostrado na Figura 3.9Bi. Observe que uma das
100 200 100 200 50 100
Time (Bin #)
Neuron #
400 440 480 520 560 600
Reordered Rastergram Spikes/bin 3 2 C e ll A sse m bl y # 9 25 21 6 12 15 4 17 1 2 3 5 7 8 10 11 13 14 16 18 19 20 22 23 24 26 27 28 29 30 31 32 1 0 40 20
Time (Bin #)
400 440 480 520 560 600
PC1
PC2
PC3
Time (Bin #)
Neuron #
400 440 480 520 560 600
12 23 5 15 21 1 2 3 4 6 7 8 9 10 11 13 14 16 17 18 19 20 22 24 25 0 40 80 0 50 100
Time (Bin #) Activation strength
Activation strength
Reordered Rastergram
Projection time-course
assembleias contém neurônios de três áreas distintas. Note também que existem neurônios participando em mais de uma assembleia. Na Figura 3.9Bii é comparada a projeção temporal da rede calculada através do método PCA com o método proposto.
Figura 3.9. Aplicação do método em dados reais
3.7. Discussão
Nessa seção foi apresentado um método matemático para a identificação de assembleias neuronais e para computar suas atividades com alta resolução temporal. O algoritmo pode ser dividido em três partes: (1) Detecção do número de assembleias e neurônios participando em assembleias; (2) Identificação de assembleias; e (3) Computação de sua atividade em função do tempo.
Com respeito à parte (1), Peyrache et al já haviam introduzido o uso da distribuição de Mar enko-Pastur como hipótese nula para determinar a presença de atividade significativamente correlacionada. Esse é um importante resultado em termos do custo computacional já que métodos passados necessitavam de geração de dados surrogados para determinar significância [63-66]. Além de serem computacionalmente caros, outro problema intrínseco dos métodos surrogados é que não existe consenso sobre qual propriedade estatística deve ser mantida nos dados de controle [67, 68]. Por essas dificuldades computacionais, esses métodos só são aplicáveis para um pequeno
120 140 160 180 200 220 240 260 280 300 320 120 140 160 180 200 220 240 260 280 300 320
120 140 160 180 200 220 240 260 280 300 320
0 20 40 60 80 100
Time (Bin #)
Neuron #
Reordered Neuron #
Activation Strength
Cell Assembly 1 Cell Assembly 2 Cell Assembly 3
A
0 1 2 3 Probability0 0.5 1 1.5 2 2.5 3 3.5 4 4.5 5 5.5
0 0.5 1 1.5 2 2.5 3 3.5 4 4.5 5 5.5 Eigenvalues 0 1 2 3 4 5 6 Coun ts λ1 λ2 λ3 HP S1
3800 3820 3840 3860 3880 3900 3920 3940 3960 3980 4000
PC 1 * * * * * * * * * * * * * Assembly 1 Assembly 2 Assembly 3 Assembly 4
3800 3820 3840 3860 3880 3900 3920 3940 3960 3980 4000
Time (Bin #)
B
i
ii
iv
ii
iii
Time (Bin #)
v
PC 2 PC 3 PC 4 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33343536 373839404142 43 44 45 46 47 48 49 50 51 HP S1 V1