André Luiz Bezerra de Pontes
ANÁLISE IMUNOISTOQUÍMICA DA DISTRIBUIÇÃO DE
SEROTONINA, TRANSPORTADOR DE SEROTONINA E
RECEPTORES DE SEROTONINA NO HIPOTÁLAMO DO SAGUI
(Callithrix jacchus)
Dissertação apresentada a Universidade Federal do Rio Grande do Norte para obtenção de título de Mestre em Psicobiologia.
André Luiz Bezerra de Pontes
ANÁLISE IMUNOISTOQUÍMICA DA DISTRIBUIÇÃO DE
SEROTONINA, TRANSPORTADOR DE SEROTONINA E
RECEPTORES DE SEROTONINA NO HIPOTÁLAMO DO SAGUI
(Callithrix jacchus)
Dissertação apresentada a Universidade Federal do Rio Grande do Norte para obtenção de título de Mestre em Psicobiologia.
Orientador: Prof. Dr. Jeferson de Souza Cavalcante
Catalogação da Publicação na Fonte. UFRN / Biblioteca Setorial do Centro de Biociências
Pontes, André Luiz Bezerra de.
Análise imunoistoquimica distribuição de serotonina, transportador de serotonina e receptores de serotonina no hipotálamo do sagüi (Callithrix
jacchus) / André Luiz Bezerra de Pontes. – Natal, RN, 2011.
123 f. : Il.
Orientador: Prof. Dr. Jeferson de Souza Cavalcante.
Dissertação (Mestrado) – Universidade Federal do Rio Grande do Norte. Centro de Biociências. Programa de Pós-Graduação em Psicobiologia.
1. Callithrix jacchus – Dissertação 2. Serotonina – Dissertação. 3. Hipotálamo – Dissertação. I. Cavalcante, Jeferson de Souza.. II. Universidade Federal do Rio Grande do Norte. III. Título.
T€TULO: Análise imunoistoquímica da distribuição de serotonina, transportador de serotonina e receptores de serotonina no hipotálamo do sagui (Callithrix jacchus).
AUTOR: André Luiz Bezerra de Pontes
DATA DA DEFESA:11 de abril de 2011
BANCA EXAMINADORA:
________________________________________________________________
Prof. Dr. Luiz Fernando Takase
Universidade Federal de S•o Carlos
________________________________________________________________
Prof. Dr. Expedito Silva do Nascimento Junior
Universidade Federal do Rio Grande do Norte
________________________________________________________________
Prof. Dr. Jeferson de Souza Cavalcante – Orientador
AGRADECIMENTOS
Ninguém chega ao fim de uma jornada sozinho, sem amparo ou sem ajuda.
Sinto-me afortunado por ter uma longa lista de pessoas a quem agradecer por me
acompanhar nesse período, e só isso já é motivo de sobra pra eu agradecer.
Agradeço imensamente à minha família, pelo incentivo, apoio e compreensão.
Aos meus pais, Lúcia e Antonio, por acreditar em mim e me apoiar sempre; aos meus
avós, Eulália e Solino, pelo exemplo que são para mim; a minha bisavó, Maria (in
memoriam), pela garra e pela força que sempre me mostrou e queria que eu também
tivesse; meus irmãos pela torcida, e pelo apoio, sobretudo, num momento crucial desta
jornada; aos meus tios, Ivo e Alice, pelos incentivos que sempre me deram.
Agradeço à equipe do Laboratório de Neuranatomia, pelos momentos de
crescimento mútuo, pelas trocas de idéias. Aos professores Judney e Expedito pelas
dúvidas esclarecidas, pelas dicas e pela disponibilidade. Gilberto e Fausto, convivência
sempre agradável e iguais fontes de idéias; Regina, pela manutenção do nosso ambiente
de trabalho e convivência, e pela alegria que sempre traz pro ambiente; Kátia e
Rayane, sempre quietas e caladas, mas lutadoras pelos seus objetivos, e, por isso,
exemplos; Ruthnaldo e Leandro, duas figuras ilustres do nosso laboratório,
trabalhadores, mas nem por isso menos animados; aos alunos de iniciação cientifica que
direta e/ou indiretamente estiveram relacionados a esse trabalho: Raysa, Nayra, Kayo,
Vinicius e Péricles; Twyla, além da ajuda no trabalho, agradeço a torcida extra no X
LASC e no Congresso da SBNeC (risos), espero não a ter desapontado! Alane, Paulo,
Melquisedec, Adriana, Ana Carla, Renata, Francimar, Marcia, Franco, pessoal que
chegou recentemente, ou que já deixou a equipe, mas que mesmo assim fazem parte
desse trabalho, porque é em equipe que nós trabalhamos nesse laboratório.
Do ambiente de trabalho no laboratório eles passaram a fazer parte do meu
convívio fora do laboratório também: Rovena e Janaina, que me adotaram como irmão
(ou teria sido o oposto?), e com quem divido mais do que momentos de trabalho no
laboratório, agradeço a torcida e a disponibilidade de sempre querer me ajudar, e peço
que apesar de gaiato, € um cara gente boa, e mesmo com a anima•‚o exacerbada dele € extremamente capaz, e prestativo (valeu, Jƒƒƒƒƒ!). Rodolfo, o enrugado, ainda bem que tem voc„ pra contrabalancear a gaiatice do Jƒ, e pra me tirar d…vidas, ou pra me fazer aprender mais quando me faz alguma pergunta (valeu, ZeroBoy!).
Agrade•o a professora Miriam, a quem eu me descobri com a imensa liberdade de trat†-la simplesmente por “Miriam”. Acho que isso se deve ‰ maneira como a vejo tratando as pessoas, e comigo n‚o foi diferente, sempre disponŠvel (at€ mesmo quando ocupada), prestativa, sorridente e dona de uma humildade que surpreende. Agrade•o por ter sido t‚o prestativa desde a minha inicia•‚o cientifica, e pelas in…meras dicas que recebi pra esse trabalho. Certa vez me pediu desculpas por estar “se metendo” no assunto; n‚o havia necessidade, eu era quem devia pedir desculpas por incomodar tantas vezes, e agradecer pelas sugest‹es e corre•‹es.
Aos amigos: Breno, pela gentileza peculiar, apoio e ajuda fundamentais! Ao “Team Deco”: Flavio(Dec‚o), o irm‚o Cortez; Carlos André(Dequinho), o afilhado; Clayton (Dekote), o irm‚o “AparŠcio”. Amigos de longa data! Ana Paula (Paulinha), pela do•ura e delicadeza. Wallace, amigo que me ensinou a rir das “desventuras” da vida acad„mica. Ronaldo, acredite que seus conselhos foram dos melhores que eu recebi nestes dois …ltimos anos, muito obrigado. Pablo (meu filho), sŒ saiba que eu agrade•o muito.
Aos amigos distantes, mas que sempre estiveram na torcida: Felipe Beijamini, Lucas Alves, André Reynaldo, Rodolfo Lira, Renata Pereira,e os nem t‚o distantes assim, AdrianoeCristiano.
Suzanny Lays, Lucas Filgueira, Luana Santana, Pedro Saler, Lidiane, Marília, Kellyn, Augusto, Cintía, Álister e Wivison, que se tornaram especiais pra mim, pela amizade, cumplicidade, torcida e conselhos.
E aos professores e funcionários do Departamento de Morfologia do Centro de
Biociências, a quem agradeço nominalmente ao Prof. Celcimar e Edilson.
Ao professor Claudio Toledo, da UNICID, pela partilha dos anticorpos
utilizados.
“N•o h‚ receitas m‚gicas que nos faƒam vencer os obst‚culos. Mas ouso dizer que h‚ um jeito interessante de olhar para as quedas que sofremos. „ s… n•o permitir que elas
LISTA DE TABELAS E FIGURAS
TABELA 1: Famílias e subtipos de receptores 5-HT.
TABELA 2: Lista de anticorpos e soros normais.
FIGURA 1: esquema de localização de neurônios serotonérgicos.
FIGURA 2: Categorias de neurotransmissores.
FIGURA 3: Fotomicrografias de secções do hipotálamo do sagui corados pela técnica de
Nissl.
FIGURA 4: Fotomicrografias de secções do hipotálamo submetidas à imunoistoquímica
para revelar a presença de NeuN.
FIGURA 5: Fotomicrografias de secções do hipotálamo submetidas à imunoistoquímica
para revelar a presença de serotonina.
FIGURA 6: Fotomicrografias de secções do hipotálamo submetidas à imunoistoquímica
para revelar a presença de transportador de serotonina.
FIGURA 7: Fotomicrografias de secções do hipotálamo submetidas à imunoistoquímica
para revelar a presença do receptor 5-HT1A, e desenhos esquemáticos ilustrando a
distribuição deste receptor.
FIGURA 8: Fotomicrografias de secções do hipotálamo submetidas à imunoistoquímica
para revelar a presença do receptor 5-HT1B, e desenhos esquemáticos ilustrando a
LISTA DE ABREVIATURAS
3V Terceiro Ventrículo
5-HT Serotonina
5-HTT Transportador de Serotonina
AHA Área Hipotalâmica Anterior
AHD Área Hipotalâmica Dorsal
AHL Área Hipotalâmica Lateral
APO Área Pré Óptica
APOl Área Pré Óptica Lateral
APOm Área Pré Óptica Medial
ARQ Núcleo Arqueado
ca Comissura Anterior
ET Estria Terminal
fx Fórnix
-IR Imunorreativo (a)
NDH Nucleo Dorsal Hipotalâmico
NDM Núcleo Dorsomedial
NDR Núcleo Dorsal da Rafe
NLC Núcleo Linear Caudal
NMaR Núcleo Magno da Rafe
NMI Núcleo mamilar Intermédio
NML Núcleo Mamilar Lateral
NMM Núcleo Mamilar Medial
NMnR Núcleo Mediano da Rafe
NObR Núcleo Obscuro da Rafe
NPaR Núcleo Pálido da Rafe
NPOm Núcleo Pré Óptico Medial
NPOpv Núcleo Pré Óptico Periventricular
NPoR Núcleo Pontino da Rafe
NSO Núcleo Supra Óptico
NSQ Núcleo Supraquiasmático
NTL Núcleo Tuberal Lateral
NTM Núcleo Tuberal Medial
NVM Núcleo Ventromedial
PMD Núcleo Pré Mamilar Dorsal
PML Núcleo Pré Mamilar Lateral
PMM Núcleo Pré Mamilar Medial
qo Quiasma Óptico
SUMƒRIO
Pg.
RESUMO 13
ABSTRACT 14
1. 1. INTRODU„…O 15
1.1 – O Hipot†lamo 15
1.2 – A Rafe e a Serotonina 21
1.3 – Os Receptores de 5-HT 25
1.3.1 – Fam‡lia 5-HT1 27
1.3.1.1 – 5-HT1A 27
1.3.1.2 – 5-HT1B 28
1.3.1.3 – 5-HT1D 29
1.3.1.4 – 5-HT1E 29
1.3.1.5 – 5-HT1F 30
1.3.2 – Fam‡lia 5-HT2 30
1.3.2.1 – 5-HT2A 31
1.3.2.2 – 5-HT2B 31
1.3.2.3 – 5-HT2C 32
1.3.3 – Fam‡lia 5-HT3 32
1.3.4 – Fam‡lia 5-HT4 32
1.3.5 – Fam‡lia 5-HT5 33
1.3.6 – Fam‡lia 5-HT6 33
1.3.7 – Fam‡lia 5-HT7 34
2. JUSTIFICATIVA 35
3. OBJETIVOS 36
4. METODOLOGIA 37
4.1 Procedimentos Experimentais 38
5. RESULTADOS 43
5.1 – Coloraˆ•o Citoarquitet‰nica de Nissl 43
5.3 – Imunorreatividade a 5-HT 44
5.4 – Imunorreatividade a 5-HTT 45
5.5 – Imunorreatividade a 5-HT1A 46
5.6 – Imunorreatividade a 5-HT1B 47
5.7 – Imunorreatividade a 5-HT2A, 5-HT2B, 5-HT2C, 5-HT3 e 5-HT7 48
6. DISCUSS…O 72
6.1 – Citoarquitetura HipotalŠmica 72
6.2 – 5-HT 73
6.3 – 5-HTT 74
6.4 – 5-HT1A 75
6.5 – 5-HT1B 76
6.6 - 5-HT2A, 5-HT2B, 5-HT2C, 5-HT3 e 5-HT7 77
7. CONCLUS…O 78
REFERENCIAS
RESUMO
O hipotálamo é uma porção diencefálica localizada ao redor do terceiro ventrículo, abaixo
do sulco hipotalâmico, ventralmente vemos seu limite anterior feito pelo quiasma óptico e
posterior pelos corpos mamilares. Atuando como centro que integra funções homeostáticas
e comportamentais. A serotonina é um neurotransmissor produzido em sítios restritos ao
mesencéfalo e tronco encefálico, mas que é distribuído por todo o sistema nervoso central
e tem inúmeras funções, atuando através de receptores específicos que também estão
distribuídos por todo o sistema nervoso. Utilizando técnicas imunoistoquímicas o objetivo
desse trabalho foi delimitar os núcleos hipotalâmicos do sagui (Callithrix jacchus), bem
como estudar a distribuição de serotonina, transportador e receptores de serotonina no
hipotálamo dessa espécie. Utilizamos o método de nissl para determinar a citoarquitetura
dos núcleos hipotalâmicos, e a imunoistoquímica para revelar a presença de NeuN como
método auxiliar para determinar os contornos dos núcleos hipotalâmicos. Como resultados,
encontramos fibras e terminais contendo serotonina por toda a extensão rostro-caudal do
hipotálamo, sendo mais concentrados em alguns núcleos, e até mesmo ausente em alguns;
assim como a serotonina, o transportador de serotonina foi observado entre a área pré
óptica e a região tuberal do hipotálamo, com densidades e distribuição semelhantes às da
serotonina. Os receptores 5-HT1A e 5-HT1B foram encontrados com diferenças mínimas,
entre si, quanto a disposição e intensidade de marcação.
ABSTRACT:
The hypothalamus is a diencephalic portion located around the third ventricle below the
hypothalamic sulcus, limited by the optic chiasm, and by the mammillary bodies, acting as
a center that integrates behavioral and homeostatic functions. Serotonin is a
neurotransmitter produced in limited sites in the midbrain and brain stem, but is distributed
throughout the central nervous system and has many functions, acting through specific
receptors that are also distributed throughout the nervous system. Using
immunohistochemical techniques, the aim of this study was to delineate the hypothalamic
nuclei of the marmoset (Callithrix jacchus) and study the distribution of serotonin
transporter and serotonin receptors in the hypothalamus of this species. We used the Nissl
method to determine the cytoarchitecture of the hypothalamic nuclei, and
immunohistochemistry to reveal the presence of NeuN as a method to determine the
contours of the hypothalamic nuclei. As a result, we found serotonin containing fibers and
terminals throughout the rostrocaudal extent of the hypothalamus, more concentrated in
some nuclei, and even absent in some. Like serotonin, serotonin transporter was observed
between pre-optic area and tuberal region of the hypothalamus, in densities and
distribution similar to serotonin. The 5-HT1Aand 5-HT1B receptors were found with minor
differences among itselves regarding the disposition and intensity of staining.
1. INTRODU„…O
1.1 – O Hipot†lamo
Manipulações experimentais no hipotálamo resultam em alterações na expressão
de comportamentos de alimentação, sexual, defesa, ritmos biológicos e na atividade
endócrina. Essas observações levaram à conclusão de que o hipotálamo participa do
controle de inúmeras funções que garantem a sobrevivência de indivíduos atuando como
centro que integra informações endócrinas, autonômicas e respostas comportamentais que
permitem a manutenção da homeostase e reprodução (Swanson, 1987). Ramón Y Cajal
propôs que os núcleos hipotalâmicos compõem circuitos neurais que atuam na integração
de respostas somatomotoras e visceromotoras importantes para a manutenção da
homeostase (1894). Em 1954 Stellar propôs que cada um dos núcleos hipotalâmicos seria
responsável por um comportamento como a ingestão hídrica, a ingestão alimentar, por
exemplo. Já a teoria proposta por Morgane, em 1979, diz que as alterações
comportamentais observadas após manipulações no hipotálamo são decorrentes da
alteração nas fibras ascendentes ou descendentes que passam pelo hipotálamo. Hoje
sabe-se que todas essas teorias são verdadeiras e nenhuma das teorias exclui as demais. O
hipotálamo é uma porção diencefálica localizada abaixo do sulco hipotalâmico ao redor
do terceiro ventrículo. Uma projeção localizada posterior ao quiasma óptico, o
infundíbulo, faz a conexão entre o hipotálamo e a glândula hipófise. Os corpos mamilares
são duas protuberâncias arredondadas encontradas no limite ventroposterior do
hipotálamo. Os limites laterais são compostos pelos tractos ópticos. Em posição
dorso-caudal ao hipotálamo está o tálamo, e em posição latero-dorso-caudal encontra-se a região
subtalâmica (Swanson, 1987). A organização dos grupamentos neuronais e tractos
isso em vista, faz-se clara a importância de estudos hodológicos e histológicos para a
compreensão do funcionamento do hipotálamo.
Anatomicamente podemos dividir o hipotálamo em regiões no sentido
rostro-caudal: Região pré-óptica, região supra-óptica, região tuberal e região mamilar; ou em
áreas no sentido médio-lateral: área hipotalâmica periventricular; área hipotalâmica
medial e área hipotalâmica lateral. A área hipotalâmica lateral localiza-se lateralmente
ao tracto mamilo-talâmico e ao fórnix e é limitada lateralmente pela cápsula interna,
anteriormente pelo núcleo pré-óptico lateral e posteriormente pelo tegmento
mesencefálico. Nessa área identificamos o núcleo hipotalâmico lateral. O tracto
mamilo-talâmico e o fórnix fazem o limite lateral da área hipotalâmica medial que localiza-se
caudal à região pré-óptica e circunda o terceiro ventrículo e se estende desde a região
supra-óptica até a região mamilar. A área periventricular, localizada medialmente em
relação à área hipotalâmica medial, encontra-se aderida à parede do terceiro ventrículo
(Carpenter, 1991). Imediatamente anterior ao quiasma óptico está a região pré-óptica, a
porção mais anterior do hipotálamo. Nessa região, ao redor do terceiro ventrículo
encontra-se o núcleo pré-óptico periventricular, e o núcleo pré-óptico medial localizado
lateralmente ao núcleo pré-óptico periventricular, estendendo-se ventralmente até o
quiasma óptico. O núcleo mais posterior dessa região faz limite com área hipotalâmica
anterior e é chamado núcleo pré-óptico lateral. (Carpenter, 1991; Swanson, 1987)
A região supra-óptica está localizada acima do quiasma óptico e nela
encontram-se os encontram-seguintes núcleos: núcleo paraventricular justaposto ao terceiro ventrículo, tendo
sua porção mais dorsal se estendendo lateralmente até o fórnix; o núcleo
supraquiasmático localizado sobre o quiasma óptico, lateral ao terceiro ventrículo; o
núcleo supra-óptico sobre a porção mais lateral do quiasma óptico, e continua
medial no nível mais caudal do tracto óptico; e o núcleo hipotalâmico anterior,
posicionado posteriormente à área pré-óptica (Carpenter, 1991; Swanson, 1987).
A região tuberal é dividida pelo fórnix em: área hipotalâmica lateral e área
hipotalâmica medial. A porção medial está ao redor do terceiro ventrículo e podemos
encontrar nela o núcleo arqueado, localizado abaixo da extremidade ventral do terceiro
ventrículo próximo ao recesso infundibular; o núcleo ventromedial um núcleo de forma
oval dorsal ao núcleo arqueado e lateral ao terceiro ventrículo; e o núcleo dorsomedial,
que assim como os outros núcleos da área hipotalâmica medial está justaposto ao terceiro
ventrículo, dorsal ao núcleo ventromedial (Carpenter, 1991; Swanson, 1987).
A região mamilar é a porção mais posterior do hipotálamo e abriga os núcleos
mamilares e o núcleo posterior do hipotálamo. Os núcleos mamilares fazem
protuberância arredondada na face ventral do hipotálamo e podem ser divididos em três
sub-núcleos: o núcleo mamilar medial abaixo do núcleo hipotalâmico posterior; núcleo
mamilar intermédio lateral ao núcleo mamilar medial; e o núcleo mamilar lateral
margeando lateralmente o núcleo mamilar intermédio. O núcleo hipotalâmico posterior
localiza-se sobre corpo mamilar e é um contínuo da porção posterior do núcleo
ventromedial (Carpenter, 1991; Swanson, 1987).
As principais fibras que chegam ao hipotálamo são o fascículo prosencefálico
medial, o tracto hipocampo-hipotalâmico, o tracto amigdalo-hipotalâmico, fibras do
tronco encefálico, o tracto retino-hipotalâmico, fibras córtico-hipotalâmicas e aferências
do prosencéfalo (Swanson, 1987). O feixe prosencefálico medial conduz informações de
regiões olfativas, área septal e subiculum. Esse feixe cruza o hipotálamo passando pelas
áreas pré-óptica e lateral. O tracto hipocampo-hipotalâmico se origina em células da área
CA1 do hipocampo e subiculum, formando o fórnix, o feixe mielinizado mais
pré-comissural e um pós-pré-comissural. As fibras pré comissurais se espalham pelos núcleos
septais, área pré-óptica e área hipotalâmica dorsal. As fibras pós comissurais se projetam
para o núcleo mamilar medial. As fibras do tracto amigdalo-hipotalâmico seguem duas
vias diferentes: uma composta pela estria terminal, e, uma mais direta, composta pela via
amigdalofugal. A estria terminal tem como alvos a área pré-óptica medial, a área anterior
e os núcleos ventromedial e arqueado; já a via amigdalofugal tem como alvos a área
hipotalâmica lateral. As aferências do tronco encefálico tem origem nos núcleos
mesencefálicos da rafe, locus coeruleus e núcleo parabraquial. As fibras serotonérgicas
que chegam ao hipotálamo ascendem principalmente dos núcleos mediano e dorsal da
rafe, passando pela área hipotalâmica lateral e atingindo seus principais alvos: área
pré-óptica, área hipotalâmica lateral, núcleo paraventricular e núcleo supraquiasmático. As
projeções noradrenérgicas do locus coeruleus ascendem até os núcleos dorsomedial,
paraventricular e supra-óptico. O tracto retino-hipotalâmico origina-se nas células
ganglionares da retina e se projeta para o núcleo supraquiasmático (Moore, 1972; Costa
et al., 1999; Cavalcante et al., 2006). As fibras córtico-hipotalâmicas originam-se
principalmente nos córtices frontal, parietal e occipital, e chegam até a área lateral e
núcleo mamilar lateral (Swanson, 1987).
O hipotálamo emite projeções para diversas áreas do sistema nervoso. Dos
núcleos paraventricular, dorsomedial, ventromedial e posterior emerge o tracto
hipotalamoespinal que termina sobre neurônios do tronco encefálico e da medula espinal.
Essa via de comunicação é pouco mielinizada e de pequeno diâmetro. O fascículo
mamilar, um feixe mielinizado se origina nos núcleos mamilares e se projeta para a
porção dorsal do tálamo. Também se origina nos núcleos mamilares o tracto
mamilointerpeduncular, que se projeta até o núcleo interpeduncular no mesencéfalo. Já o
formação reticular mesencefálica, passando dorsalmente ao tracto mamilopeduncular. O
feixe periventricular se origina nos núcleos da zona periventricular, fazendo a conexão
entre esses núcleos, e se projeta para o córtex frontal e para o tronco encefálico, passando
pela substância cinzenta periaquedutal. Na região tuberal o núcleo arqueado emite
projeções através do tracto tuberoinfundibular para o pedículo infudibular (Parent, 1996;
Swanson, 1987).
O hipotálamo é caracteristicamente conhecido como o centro integrativo de
sistemas neurais responsáveis pela manutenção de funções homeostáticas como o
equilíbrio eletrolítico, controle de ingestão alimentar, consumo hídrico, metabolismo
energético, reprodução, regulação térmica e controle de estados emocionais, regulação do
ciclo sono vigília e controle de secreção hormonal pela glândula hipófise. O hipotálamo
atua também como centro integrador entre as vias simpáticas e parassimpáticas (Parent,
1996; Swanson, 1987).
As regiões lateral e medial do hipotálamo mediam respostas simpáticas tais como
o estresse emocional, reações de luta ou fuga; em contrapartida lesões no hipotálamo
posterior levam à letargia, sonolência, queda da temperatura e redução da taxa metabólica
(Parent, 1996). O hipotálamo anterior está relacionado ao controle da temperatura
corporal, sendo esta região sensível ao aumento de temperatura do sangue. Esta região
hipotalâmica atua na vasodilatação de veias e artérias, controlando assim a dissipação do
calor. A região hipotalâmica sensível à redução da temperatura sanguínea é o hipotálamo
posterior, e atua através da vasoconstricção de veias e artérias, fazendo o organismo reter
calor (Parent, 1996). O balanço hídrico é regulado pelos núcleos supra-óptico e
paraventricular. Lesões nesses núcleos levam à gênese da diabetes insípido, condição na
qual aumenta a excreção de urina com baixa concentração de glicose; uma vez que as
condições normais a produção de vasopressina responde à variação da pressão osmótica
do sangue. A ingestão hídrica, no entanto, é regulada também pelo hipotálamo anterior
(Carpenter, 1991; Swanson, 1987). O comportamento alimentar apresenta diversos
componentes de controle. O núcleo paraventricular do hipotálamo é uma dessas peças.
Lesões nesse núcleo levam animais experimentais a se tornar hiperfágicos. Lesões na área
hipotalâmica lateral resultam em hipofagia (Swanson, 1987)
A diversidade de funções desempenhadas pelo hipotálamo gera o interesse em
estudar a distribuição de neurotransmissores nessa região, incluindo a serotonina, um
neurotransmissor de inúmeras funções já relatadas, entre as quais muitas são relacionadas
às funções hipotalâmicas. Estudos histológicos mostram inervação serotonérgica no
hipotálamo de espécies como o rato (Beaudet e Descarries, 1979; Descarries e Beaudet,
1978; Frankfurt et al., 1981; Frankfurt e Azmitia, 1983; Frankfurt e Azmitia, 1984;
Steinbusch e Nieuwenhuys, 1981), o gato (Ueda et al., 1983), e primatas não humanos e
humanos (Kawata et al., 1984; Kuikka et al., 1995). O hipotálamo recebe projeções dos
núcleos do grupamento rostral da rafe, principalmente do núcleo dorsal da rafe e núcleo
mediano da rafe. Essas projeções são mais densas no núcleo supraquiasmático, área
pré-óptica medial e núcleos pré-mamilares. Áreas como a região perifornical e estruturas
periventriculares também são densamente inervadas por neurônios serotonérgicos de
núcleos mesencefálicos da rafe. Neurônios histaminérgicos no hipotálamo também
recebem projeções serotonérgicas da rafe (Ericson et al., 1989; Vertes, 1991; Vertes e
Martin, 1988; Törk, 1985).
1.2 – A Rafe e a Serotonina (5-HT)
Estendendo-se rostrocaudalmente entre o nível do núcleo interpeduncular no
grupamentos neuronais ocupando a linha média do tronco encefálico: o complexo da rafe.
Grande proporção dos neurônios do sistema da rafe é produtora de serotonina que pode
estar co-localizada com outros neurotransmissores produzidos nestes grupamentos. Este
complexo neuronal apresenta uma extensa rede de eferências, por isso podemos encontrar
terminais serotonérgicos em quase todo o sistema nervoso, muito embora essa
distribuição varie em proporção para cada área (Figura 01) (Törk, 1985).
Os núcleos deste complexo podem ser agrupados em duas divisões. Um
grupamento rostral, ou anterior, que inclui os núcleos: Núcleo Linear Caudal (NLC),
Núcleo Dorsal da Rafe (NDR) e o Núcleo Mediano da Rafe (NMnR). E o grupamento
caudal, ou posterior, inclui os núcleos: Núcleo Pontino da Rafe (NPoR), Núcleo Magno
da Rafe (NMaR), Núcleo Obscuro da Rafe (NObR) e o Núcleo Pálido da Rafe (NPaR)
(Jacobs e Azmitia, 1992).
O complexo da rafe emite uma extensa rede de projeções para diversas áreas do
sistema nervoso central. Os núcleos de maior densidade serotonérgica e com a maior
quantidade de projeções identificadas são o NDR e NMnR. Do NDR destacam-se, por
sua magnitude, as projeções para o colículo superior e corpo geniculado lateral. A
projeção para o corpo geniculado lateral é originada na porção lateral do NDR (Pasquier
e Villar, 1982; Woolf e Butcher, 1985; Shibata et al., 1986; Villar et al., 1988; Vertes,
1991). Vertes (1991) demonstrou que o NDR se projeta para inúmeras estruturas do
telencéfalo, diencéfalo e mesencéfalo. O NDR também apresenta uma densa projeção
para o NMnR em hamsteres (Tischler e Morin, 2003). O NMnR, assim como o NDR, se
projeta para várias estruturas corticais e do diencéfalo (Vertes e Martin, 1988). Em 1999,
um estudo mais detalhado empregando traçadores mais sensíveis, mostra as projeções do
NMnR para: formação reticular pontina, tegmento pontino dorsolateral, NDR, núcleo
cuneiforme, núcleo interpeduncular, formação reticular mesencéfalica, NLC, núcleo
retrorrubral, substância negra, área tegmental ventral, núcleo supramamilar, corpo
mamilar, núcleo parafascicular do tálamo, zona incerta, NSQ, córtex perirrinal, corpo
cauloso, cíngulo e hipocampo (Vertes et al., 1999). No hipotálamo há uma densa projeção
sobre o NSQ, em hamsteres e ratos (Meyer-Bernstein e Morin, 1996; Pickard e Rea,
1997; Hay-Schmidt et al., 2003; Pontes et al., 2010).
A serotonina tem diversos efeitos no sistema nervoso central e nos sistemas
periféricos, agindo como hormônio ou neurotransmissor. Primeiramente foi denominada
enteramina, por ter sido isolada em células enterocromafins do trato gastrointestinal
(Ersparmer e Asero, 1952). Ersparmer observou que a enteramina era responsável pela
contração muscular. Na década de 40 Rapport e colaboradores reportaram a existência de
uma substância vasoconstritora contida nas plaquetas. Essa substância foi isolada e
1948a-c). Seu nome é um acrônimo de Serum (pois é encontrada no soro) e vaso-tonic
(devido às suas propriedades vasotônicas). Com o desenvolvimento de técnicas de estudo
a 5-HT foi rapidamente identificada em diversos tecidos, tais como o cérebro, pulmões,
sangue, sistema endócrino, sistema sensorial, sistema cardiovascular e trato
gastrintestinal. A função da 5-HT como neurotransmissor foi proposta por Brodie e Shore
(1957) que se basearam em estudos que mostravam receptores de 5-HT em regiões
especificas do cérebro (Twarog e Page, 1953; Amin et al., 1954). O mapeamento de
núcleos neuronais que continham 5-HT foi feito por Dahlström e Fuxe (1964), esses
núcleos passaram então a ser conhecidos como sistema serotonérgico.
Uma vez produzida, a 5-HT é armazenada em vesículas sinápticas até ser liberada
por um mecanismo de exocitose cálcio-dependente. Nestas vesículas ela pode estar
associada a outros transmissores como a acetilcolina, noradrenalina, dopamina,
substância P, encefalina, Hormônio Liberador da Tireotropina e prostaglandinas (Halbach
e Dermietzel, 2006). Após ser liberada na fenda sináptica a 5-HT pode se ligar a
receptores pós- sinápticos ou autorreceptores localizados na membrana pré-sináptica
(Cerrito e Raiteri, 1979). Esse mecanismo de auto-recepção promove uma alça de
retroalimentação que impede a liberação excessiva deste neurotransmissor na fenda
sináptica. Na membrana pré-sináptica encontra-se o transportador de serotonina (5-HTT)
que é responsável por remover a 5-HT da fenda sináptica. As moléculas transportadas
pelo 5-HTT serão recicladas nas vesículas sinápticas do neurônio pré-sináptico, evitando
assim que sejam metabolizadas no citoplasma (Halbach e Dermietzel, 2006).
Enquanto neurotransmissor a 5-HT é classificada como amina biogênica, e integra
o grupo das monoaminas (Figura 02). Como qualquer neurotransmissor, esta amina
possui algumas características básicas: é produzida em neurônios e acumulada em
células pós-sinápticas, mediada por seus receptores específicos; e pode ser inativada ou
metabolizada através de mecanismos de recaptação. Aplicações experimentais de 5-HT
sintética produzem efeitos semelhantes àqueles induzidos pela 5-HT produzida no
sistema nervoso (Halbach e Dermietzel, 2006).
Os neurônios serotonérgicos projetam-se virtualmente para todas as áreas do
cérebro, e por isso a 5-HT tem uma variedade de funções no sistema nervoso central
muito ampla. Projeções dos núcleos rostrais do sistema serotonérgico ajudam a regular
temperatura, apetite, sono, comportamento sexual, ritmos biológicos circadianos (Gaspar
et al, 2003; Jouvet, 1999; Matsumoto et al 1981); enquanto as projeções dos núcleos mais
caudais participam da regulação da nocicepção e tônus motor (Jacobs e Fornal, 1999;
Rebsam et al 2002; Takase et al, 2004). Além disso a 5-HT participa de mecanismos de
desenvolvimento do sistema nervoso, incluindo divisão celular, migração neuronal,
diferenciação e sinaptogênese (Bonnin et al, 2007; Lebrand et al, 1996;
Whitaker-Azmitia, 2001; Persico et al, 2006). O mal funcionamento da transmissão serotonérgica
está relacionado à gênese de desordens neurológicas tais como a depressão, ansiedade e
agressividade (Handley et al, 1995; Olivier et al, 1995; Lucki, 2001; Blier e de Montigny, 1999; Gingrich e Hen, 2001 ).
A 5-HT tamb€m est† envolvida no controle do eixo hipot†lamo hipofis†rio, participando da estimula•‚o da secre•‚o da prolactina e do hormƒnio adeno corticotrŒpico, e do controle hipotal•mico de outros hormƒnios como o hormƒnio luteinizante, tireotropina e hormƒnio do crescimento (Antoni, 1986). O 5-HTP (precursor da 5-HT) e a fenfluramina, um agonista seroton€rgico, estimulam a secre•‚o de ACTH (Heninger et al, 1984; Siever et al, 1984; O’Keane e Dinan, 1991; Grossman e Costa, 1993). A ritanserina, um antagonista seroton€rgico, por sua vez atenua a resposta estimulada pelo 5-HTP sobre a secre•‚o de ACTH (Lee et al 1991). C€lulas da hipŒfise anterior se mostraram imunorreativas ‰ 5-HT (Piezzi e Wurtman, 1970). Essas c€lulas, quando tratadas, in vitro, em solu•‚o contendo 5-HT aumentam a secre•‚o de ACTH, mostrando um efeito dose-dependente para a express‚o dessa resposta. Quando a metergolina, um antagonista seroton€rgico, € empregada nessa cultura esse efeito € atenuado (Spinedi e Negro-Vilar, 1983).
1.3 - Os Receptores de 5-HT
A estrutura de cada receptor é formada por três constituintes: um transportador, um canal
iônico e a proteína G acoplada ao canal iônico. E a maior parte dos receptores 5-HT faz
parte da superfamília G, formada por aqueles receptores acoplados à proteína G (Vergé e
Callas, 2000; Halbach e Dermietzel, 2006).
Os receptores de cada família também podem apresentar funções diferentes
entre si. Por exemplo, 5-HT1Be 5-HT1Dsão auto-receptores, portanto inibem a liberação
adicional de neurotransmissor e a ativação de adenilciclase. Enquanto os receptores
5-HT1C e 5-HT2 ativam fosfolipase C, e assim estimulam o funcionamento do mecanismo
de segundo mensageiro do fosfatidil-inusitol. Quando ativados, os receptores 5-HT4
ativam a adenilciclase na célula pós-sináptica, por outro lado, os receptores 5-HT1A
inibem essa enzima. Por se tratar de um canal iônico não acoplado à proteína G, o
receptor 5-HT3 tem tempo de ação mais rápido que os demais receptores 5-HT (Vergé e
Callas, 2000).
A ampla distribuição de terminais serotonérgicos sugere que a ação da 5-HT é
complexa, associado a esse fato temos a distribuição diferencial de receptores 5-HT, nos
permitindo concluir que a ação desempenhada por este neurotransmissor depende da
natureza do seu receptor pós-sináptico.
Receptores 5-HT
Receptores acoplados à proteína G
Família 5-HT1 5-HT1A, 5-HT1B, 5-HT1D, 5-HT1E, 5-HT1F
Família 5-HT2 5-HT2A, 5-HT2B, 5-HT2C
Outros Receptores 5-HT4, 5-HT5, 5-HT6, 5-HT7
Canais Iônicos 5-HT3
1.3.1 – Fam•lia 5-HT1
Peroutka e Snyder fizeram a primeira descrição dos receptores 5-HT1 em 1979
utilizando técnicas radioligantes. Posteriormente Pedigo e colaboradores, em 1981,
demonstraram a existência de um receptor do tipo 5-HT1A e do tipo 5-HT1B. Depois
foram caracterizados os receptores: 5-HT1C, 5-HT1D, 5-HT1Ee 5-HT1F(Pazos et al, 1984;
Hoyer et al, 1985 a-b; Leonhardt et al 1989; Amlaiky et al, 1992). Estes receptores foram
agrupados na mesma família por terem uma alta homologia na sequência de aminoácidos,
e todos são acoplados à proteína G. Após uma revisão da nomenclatura destes receptores
o receptor 5-HT1Cfoi movido para a família 5-HT2 e as propriedades de 5-HT1Be 5-HT1D
foram revisadas (Humphrey et al 1993; Hoyer et al, 1994; Hartig et al, 1996).
1.3.1.1 – 5-HT1A
Em 1982 Hjort e colaboradores apresentaram um composto com propriedade de
agonista do receptor 5-HT1A, o 8-OH-DPAT. A utilização deste composto permitiu o
reconhecimento dos sítios de ligação de 5-HT1A (Gozlan et al, 1983). Outros
componentes com estrutura semelhante à de 5-HT1A foram apontados como ansiolíticos
ou antidepressivos (Traber e Glaser, 1987; Robinson et al, 1990). A distribuição deste
receptor no sistema nervoso central foi amplamente estudada através de técnicas
auto-radiográficas. Em humanos, mais recentemente a técnica de PET tem sido empregada
para visualizar os sítios de 5-HT1A in vivo. Técnicas moleculares também estão sendo
empregadas no estudo da distribuição destes receptores (Pazos e Palacios, 1985;
Weissman-Nanopoulus et al., 1985; Hoyer et al, 1986; Vergé et al, 1986; Laporte et al,
1994; Pike et al, 1995). As técnicas auto-radiográficas revelam que existe uma grande
densidade desse receptor no hipocampo, área septal, córtices (com destaque para os
moleculares mostram uma distribuição de RNAm-5-HT1A quase idêntica à distribuição
apontada pela auto-radiografia (Chalmers e Watson, 1991; Burnet et al, 1995). Técnicas
de hibridização in situ e imunoistoquímicas mostram este receptor em neurônios
piramidais do córtex (Pompeiano et al, 1992; Burnet et al, 1995). 5-HT1A também é
visualizado em neurônios serotonérgicos na rafe e em neurônios colinérgicos (Francis et
al, 1992; Kia et al, 1996). Azmitia e colaboradores (1996) reportaram a presença de
5-HT1Aem células da glia, mas outros estudos não comprovam esse dado.
1.3.1.2 – 5-HT1B
Primeiramente foi caracterizado por sua baixa afinidade com o 8-OH-DPAT no
cérebro de ratos, o que indicava que se tratava de um receptor com propriedades
diferentes do subtipo 5-HT1A (Pedigo et al, 1981; Middlemiss e Fozard, 1983). Este
receptor apresenta propriedades farmacológicas diferentes em ratos e humanos e por isso
recebe uma nomenclatura diferenciada: r5-HT1B para ratos, h5HT1B para humanos
(Vanhoutte et al, 1996). Estudos auto-radiográficos mostram uma grande concentração de
5-HT1Bem sítios como a substância negra e globo pálido (Pazos et al, 1985; Vergé et al,
1986). Hibridização in situ mostra a presença de RNAm para 5-HT1B no NDR e NMnR
(Voigt et al, 1991; Doucet et al, 1995). Por auto-radiografia o 5-HT1B é encontrado no
striatum. Essa visualização também é possível através de hibridização in situ. Entretanto
outras regiões como o globo pálido e a substância negra mostram baixa expressão de
RNAm para 5-HT1B(Jin et al, 1992). Em nível celular esse receptor pode ser encontrado
em terminais não serotonérgicos (Boschert et al, 1994; Bruinvels et al, 1994a-b). Outras
evidências suportam a idéia de que este é um receptor que pode atuar como auto-receptor,
quando localizado em terminais serotonérgicos, atua no controle da liberação do
1.3.1.3 – 5-HT1D
Em 1987 Heuring e Peroutka reportaram um novo receptor que bloqueava o
sítio de ligação para 5-HT1A e, o até então, 5-HT1C com propriedades farmacológicas
distintas de 5-HT1B esse receptor também foi encontrado em ratos, e sítios similares
foram reconhecidos em outras espécies (Waeber et al 1988). Esse receptor foi então
nomeado como 5-HT1D. O estudo da distribuição deste receptor por auto-radiografia foi
dificultado pela baixa afinidade com os radioligantes disponíveis. Relatos baseados em
auto-radiografia, apontam a presença de 5-HT1D no globo pálido, substancia negra,
putamen, hipocampo, córtex (Bruinvels et al, 1993), substancia cinzenta periaquedutal e
medula espinal (Castro et al, 1997). Através de hibridização in situ podemos observar
RNAm para 5-HT1D no putamen, núcleo accumbens, córtex olfatório, NDR e locus
coeruleus (Hamblin et al, 1992; Bruinvels et al, 1994a-b). Em ratos a detecção de níveis
de RNAm para 5-HT1Bé muito baixa, mas em áreas como o globo pálido e a substância
negra estes níveis não são detectáveis. Assim como o 5-HT1B, esse é um receptor que
pode atuar como hetero-receptor (Maura e Raiteri, 1996; Feuerstein et al, 1996), ou como
auto-receptor (Starkey e Skingle, 1994; Davidson e Stamford, 1995; Trillat et al, 1997).
1.3.1.4 – 5-HT1E
A primeira descrição deste receptor também foi feita por meio de
auto-radiografia (Waeber et al, 1988; Leonhardt et al, 1989), entretanto não existe um
radioligante específico para 5-HT1E, por isso a descrição desse receptor se baseia em
resultados negativos para 5-HT1A-1B-1D-2C e no estudo de sua distribuição no encéfalo
(Miller e Teitler, 1992; Barone et al, 1993). Ainda assim, por meio de auto-radiografia,
esse receptor aparece no córtex, com destaque para o córtex entorrinal, putamen,
corticais, e baixos nŠveis s‚o detectados na amŠgdala e em †reas hipotal•micas (Bruinvels et al, 1994a-b).
1.3.1.5 – 5-HT1F
Caracterizado pela primeira vez com base na homologia com 5-HT1B-1D, tendo sido denominado 5-HT1Eβ, devido a semelhan•as farmacolŒgicas com o 5-HT1E(Amlaiky et al, 1992). O estudo da distribui•‚o desse receptor foi iniciado utilizando-se hibridiza•‚o in situ tendo como resultado uma densa distribui•‚o de RNAm-5-HT1F no hipocampo, cingulado, cŒrtex entorrinal e NDR (Adham et al, 1993, Bruinvels et al, 1994a-b). Na subst•ncia negra a presen•a de 5-HT1F€ pouco detect†vel por hibridiza•‚o in situ(Waeber e Moskowitz, 1995a-b).
1.3.2 – Fam•lia 5-HT2
Essa famŠlia € composta por tr„s receptores: 5-HT2A, 5-HT2B e 5-HT2C. Eles apresentam semelhan•as com rela•‚o ‰ estrutura molecular, propriedades farmacolŒgicas e transmiss‚o do sinal. Vale ressaltar que o receptor 5-HT1Cfoi introduzido nesta famŠlia, recebendo a nomenclatura de 5-HT2C (Humphrey et al, 1993; Hoyer et al, 1994). As caracterŠsticas estruturais s‚o estreitamente semelhantes entre os receptores dessa famŠlia, apresentando sete domŠnios transmembrana. (Baxter et al, 1995). Uma caracterŠstica dos receptores dessa famŠlia € o acoplamento ‰ fosfolipase C e sua atua•‚o na mobiliza•‚o do c†lcio intracelular (Halbach e Dermietzel, 2006).
1.3.2.1 – 5-HT2A
(Peroutka e Snyder, 1979). Estudos auto-radiográficos, de hibridização e
imunoistoquímicos têm sido desempenhados com o intuito de mapear a distribuição deste
receptor no sistema nervoso central. A auto-radiografia mostra a presença de 5-HT2A no
neocortex, córtex entorrinal, córtex piriforme, claustrum, núcleo caudado, núcleo
accumbens, tubérculo olfatório e hipocampo (Pazos et al, 1985, López-Gimenéz et al,
1997). Estudos de hibridização e imunoistoquímica confirmam as descrições feitas pelos
estudos de auto-radiografia. Com relação à localização celular, estudos de hibridização
mostram que este receptor está localizado em células pós sinápticas, e são expressos
também em astrócitos em cultura (Mengod et al, 1990; Morilak et al, 1993, 1994;
Pompeiano et al, 1994; Burnet et al, 1995; Meller et al, 1997).
1.3.2.2 – 5-HT2B
Reconhecido por sua propriedade mediadora da contração muscular estomacal,
esse receptor foi primeiramente descrito como um receptor do tipo 5-HT1 (Bradley et al,
1986). A distribuição deste receptor no sistema nervoso ainda não é totalmente
estabelecida, entretanto estudos de hibridização mostram uma distribuição muito restrita
(Kursar et al, 1994; Bonhaus et al, 1995). Análises imunoistoquímicas permitem
identificar a presença deste receptor em neurônios do cerebelo, área septal lateral,
hipotálamo dorsal e amígdala (Duxon et al, 1997).
1.3.2.3 – 5-HT2C
Esse receptor foi visualizado no plexo coróide em diversas espécies através de
auto-radiografia e foi originalmente denominado 5-HT1C. Após estudos mais detalhados
esse receptor foi reordenando na família 5-HT2 (Pazos et al, 1984). A análise
córtex piriforme, cingulado, núcleo accumbens, hipocampo, amígdala, núcleo caudado e
substancia negra (Palacios et al, 1991). Análises por hibridização in situ da distribuição
de 5-HT2C confirmam os dados de análise auto-radiográfica, e acrescentam o núcleo
habenular, NDR e substancia cinzenta periaquedutal, confirmadas por imunoistoquímica
(Mengod et al, 1990; Abramowisk et al, 1995).
1.3.3 – 5-HT3
5-HT3 é um receptor do tipo canal iônico, composto por subunidades (Derkach
et, 1989; Maricq et al, 1991). O primeiro relato descritivo deste receptor baseia-se em
estudos moleculares utilizando um banco de cDNA (Maricq et al, 1991). A distribuição
desse receptor, revelada por auto-radiografia, concentra-se no núcleo do trato solitário,
área postrema, núcleo dorsal do vago, hipocampo, amígdala e córtex cerebral (Pratt et al,
1990). A distribuição apontada por estudos auto-radiográficos é confirmada por estudos
que empregam a técnica de hibridização (Tecott et al, 1993). Por meio de
imunoistoquímica, o 5-HT3 pode ser visualizado em neurônios GABA-érgicos do córtex
cerebral e hipocampo (Morales e Bloom, 1997).
1.3.4 – 5-HT4
Enquanto estudavam a atividade de adenilato ciclase em células do colículo em
cultura Bockaert e colaboradores (1990) visualizaram pela primeira vez o receptor 5-HT4.
Estudando a distribuição de 5-HT4 por meio de auto-radiografia é possível encontrá-lo
predominantemente nos sistemas nigro-estriatal e mesolímbico (Grossman et al, 1993;
Waeber et al, 1993; Doménech et al, 1994; Mengod et al, 1996). A análise de transcritos
1.3.5 - 5-HT5
Plassat e colaboradores (1992a-b) identificaram a sequência de cDNA a partir de
uma biblioteca gerada a partir de tecido nervoso de camundongos. Pouco tempo depois
foram identificadas duas variações nesse receptor, baseando-se também em técnicas
moleculares, as quais foram denominadas 5-HT5A e 5-HT5B (Matthes et al, 1993;
Erlander et al, 1993). Um estudo empregando northern blot encontrou 5-HT5A no
cerebelo, hipocampo, hipotálamo, córtex, tálamo, ponte, striatum e medula (Erlander et
al, 1993). Aplicando a mesma técnica no estudo da distribuição de 5-HT5B foi possível
encontrá-lo no hipocampo (Erlander et al, 1993). Analisando a distribuição de 5-HT5B
através de hibridização in situ foi possível encontrá-lo no núcleo supra-óptico,
hipocampo, subiculum, habenula, NDR, bulbo olfatório e córtex entorrinal (Erlander et
al, 1993).
1.3.6 - 5-HT6
À exemplo do 5-HT5, o receptor 5-HT6 também foi descrito baseando-se em
técnicas moleculares de seqüenciamento de cDNA (Monsma et al, 1993). É possível
encontrar RNAm de 5-HT6 no núcleo caudado através de hibridização in situ. Técnicas
de northern blot também permitem delinear a sua distribuição no tubérculo olfatório,
núcleo acumbens e hipocampo (Monsma et al, 1993; Ward et al, 1995; Kohen et al,
1996). Por imunocitoquímica foi possível visualizar que no hipocampo e striatum este
receptor está associado a processos dendríticos, indicando sua presença em neurônios
1.3.7 – 5-HT7
O último dos receptores serotonérgicos a ser descrito, 5-HT7 tem sido
identificado em diversas espécies utilizando técnicas de seqüenciamento de cDNA (Bard
et al, 1993; Ruat et al, 1993a-b; Tsou et al, 1994; Nelson et al, 1950). O RNAm de 5-HT7
é expresso em regiões do tálamo, hipotálamo, córtex cerebral, amígdala e hipocampo (To
2. JUSTIFICATIVA
O hipotálamo é um centro integrador de funções homeostáticas e
comportamentais, participando até mesmo no controle de alguns processos cognitivos.
Esta região do sistema nervoso tem sido bastante estudada em diversas espécies de
mamíferos. Contudo estudos que abordam essa estrutura em espécies de primatas ainda
são escassos.
5-HT é um neurotransmissor distribuído por todo o sistema nervoso central, que
exerce as mais diversas funções, muitas delas de grande importância na área clinica. As
ações desse neurotransmissor dependem de seu alvo principal, os seus receptores que
estão distribuídos por todo o sistema nervoso, e apresentam uma ampla diversidade de
representantes.
Estudar a distribuição de elementos do sistema serotonérgico no hipotálamo do
sagui abre caminho para o desenvolvimento de mais trabalhos que busquem esclarecer a
função da 5-HT no hipotálamo de primatas. O desenvolvimento, por exemplo, de estudos
farmacológicos, uma vez considerada a importância clínica da serotonina; ou avaliações
neurobiológicas. Abrindo um leque ainda maior de informações sobre as funções
serotonérgicas em espécies primatas. Além disso esta espécie já é um modelo
experimental para estudos neurais consolidada no meio cientifico, e desenvolvendo
3. OBJETIVOS
3.1 – Objetivo Geral
Fazer a delimitação citoarquitetônica de núcleos hipotalâmicos, identificar a
presença de terminais e fibras serotonérgicas, do transportador de serotonina, e receptores
serotonérgicos, através de análises imunoistoquímicas no hipotálamo do primata
Callithrix jacchus.
3.2 – Objetivos espec‡ficos
Comparar a citoarquitetura dos núcleos hipotalâmicos
utilizando coloração de Nissl e imunoistoquímica para NeuN;
Descrever a distribuição de fibras e terminais serotonérgicos
em diferentes núcleos hipotalâmicos;
Descrever a distribuição do transportador de serotonina em
diferentes núcleos hipotalâmicos;
Descrever a distribuição de receptores (5-HT7, 5-HT3,
5-HT2C, 5-HT2B, 5-HT2A, 5-HT1B, 5-HT1A) em diferentes núcleos
4. METODOLOGIA
Neste estudo utilizamos saguis adultos jovens obtidos atrav€s N…cleo de Primatologia da UFRN (Licen•a do IBAMA No 1/24/92/0039-0). Estes animais, enquanto estiveram em cativeiro, antes da realiza•‚o de nossos experimentos, foram monitorados por um veterin†rio, portanto todos os animais utilizados em condi•‹es saud†veis. Na colƒnia esses animais se encontravam em ambiente semi-natural, em gaiolas medindo 2,0 x 1,0 x 1,00m. Nessas gaiolas os animais estavam expostos ‰s varia•‹es ambientais de temperatura, ilumina•‚o e umidade. Sua alimenta•‚o era fornecida duas vezes ao dia, e era composta por uma mistura balanceada contendo ra•‚o para primatas e suplementos vitamŠnicos, e frutas regionais, as quais os animais encontrariam em ambiente natural. A †gua estava disponŠvel continuamente em bebedouros.
4.1 – Procedimentos experimentais
No Núcleo de Primatologia, no dia anterior ao dia experimental, os animais foram
isolados em gaiolas individuais que mediam 0,90m x 0,60 x 0,75m. No dia seguinte, pela
manhã, antes que a alimentação fosse oferecida, os animais foram transportados para o
Laboratório de Neuroanatomia do Centro de Biociências da UFRN, onde foram
realizados todos os procedimentos experimentais.
Os animais foram anestesiados por meio de um procedimento anestésico em duas
etapas. Na primeira etapa os animais recebiam uma medicação pré-anestésica composta
por sulfato de atropina na dosagem de 0,04 mg/Kg, via subcutânea, e 2 mg/Kg de
Tramadol, via intramuscular. Na segunda etapa do procedimento anestésico os animais
recebiam Quetamina e Xilazina, administradas em uma mistura na mesma seringa, na
dosagem de 20 mg/Kg e 2 mg/Kg respectivamente. Uma vez atingido o plano anestésico,
a sua manutenção era feita por meio de ventilação de Isoflurano através de máscara de
oxigênio.
Uma vez estabelecido o plano anestésico prosseguimos com a perfusão
transcardíaca. Nesta etapa o animal foi posicionado em decúbito dorsal sobre uma tela de
arame instalada dentro de uma capela de exaustão com ponto de água. Abrimos acesso à
cavidade torácica, com auxílio de material cirúrgico adequado à remoção da musculatura
e gradil costal, expondo a cavidade abdominal e rebatendo o músculo diafragma para ter
acesso ao coração. Uma agulha (1,6 x 17mm) conectada a uma bomba peristáltica
(Cole-Parmer) foi inserida na músculo cardíaco de maneira a posicioná-la no terceiro ventrículo
com orientação à artéria aorta, e o átrio direito foi seccionado. Com auxílio da bomba
impulsionamos, pelo leito vascular do animal, 500ml de solução salina (0,9%, em tampão
fosfato 0,1M, pH 7,4) acrescida de heparina (2ml/1000ml), e em seguida bombeamos
da perfusão a calota craniana foi fraturada para a remoção do encéfalo. Uma vez retirados
da cavidade craniana os encéfalos foram submetidos a pós fixação, por 04 horas, no
mesmo fixador utilizado na perfusão, acrescido de sacarose a 30%. Depois da pós fixação
os encéfalos foram armazenados em solução de sacarose (30%, em tampão fosfato 0,1M,
pH 7,4) até que fossem submetidos à microtomia.
A microtomia foi feita por congelamento em micrótomo de deslizamento manual.
As secções foram obtidas em plano frontal, com a espessura de 30µm. Estas secções
foram distribuídas serialmente em um recipiente dividido em seis compartimentos, cada
um contendo tampão fosfato (0,1M, pH 7,4). Em cada um dos compartimentos continha
uma das secções de uma série de seis cortes, de maneira que a distância entre as secções
de cada compartimento era de 180µm. As secções foram armazenadas sob resfriamento
(4 °C) até o processamento imunoistoquímico.
Em cada compartimento selecionamos as secções que representam o hipotálamo e
as submetemos ao processamento de coloração de Nissl para identificar a citoarquitetura,
ou a processos imunoistoquímicos para visualizar NeuN, receptores serotonérgicos,
5-HT, ou o transportador de serotonina. Para as secções submetidas a imunoistoquímica o
primeiro passo foi o tratamento para recuperação da antigenicidade. As secções foram
lavadas tampão fosfato (0,1M, pH 7,4), por 25 minutos, sendo o tampão trocado a cada 5
minutos. Essas lavagens foram feitas em cubas de vidro, posicionadas sobre um agitador
orbital. Para a eliminação de artefatos e recuperação da antigenicidade os cortes eram
incubados, por 20 minutos, em solução contendo peróxido de hidrogênio a 0,03% em
tampão fosfato (0,1M, pH 7,4). Após essa etapa e mais 05 lavagens em tampão fosfato,
contendo o anticorpo prim†rio1diluŠdo em tamp‚o fosfato contendo Triton X-100 0,3%, e soro normal do animal correspondente ‰ obten•‚o do anticorpo secund†rio. Os cortes permaneciam nessa solu•‚o por um perŠodo de 18 a 24 horas, em rotor com rota•‚o lenta, e eixo de inclina•‚o de 30‘. Passado esse tempo, os cortes eram incubados em solu•‚o contendo o anticorpo secund†rio diluŠdo em tamp‚o fosfato contendo Triton X-100 0,3%, por 02 horas. Seguindo-se ent‚o ‰ incuba•‚o no complexo avidina-biotina-HRP, diluŠdo em tamp‚o fosfato contendo Triton X-100 0,3% acrescido de cloreto de sŒdio, por 02 horas. A rea•‚o final, a revela•‚o, ocorria em meio lŠquido contendo: tamp‚o fosfato, perŒxido de hidrog„nio e 3,3’,4,4’ tetrahidrocloreto-diaminobenzidina (DAB) para as rea•‹es de NeuN e 5-HT, j† para as rea•‹es que buscavam o transportador de serotonina e os receptores seroton€rgicos acrescentou-se, nessa etapa, 1ml de solu•‚o de sulfato de amƒnia e nŠquel (NAS) a 0,3%. Os cortes foram imersos nessa solu•‚o por aproximadamente 10 minutos. Entre cada etapa, e ao final, os cortes foram lavados em tamp‚o fosfato (0,1M, pH 7,4) por 25 minutos, sendo trocado o tamp‚o a cada 5 minutos.
As sec•‹es foram montadas em l•minas de vidro para microscopia, previamente gelatinizadas, e secaram em temperatura ambiente. Seguindo-se ent‚o a intensifica•‚o da rea•‚o em solu•‚o de tetrŒxido de Œsmio a 0,05%, e desidrata•‚o e diafaniza•‚o em uma bateria de alcoŒis. As laminas foram ent‚o cobertas com uma lamŠnula. Uma das s€ries coletadas serviu para a colora•‚o citoarquitetƒnica de Nissl. Neste caso os cortes foram montados em l•minas de vidro para micrsocopia, e submetidos ‰ t€cnica de colora•‚o de Nissl, com tionina como corante, para melhor demarcar os n…cleos e formato das c€lulas. Durante o processo de colora•‚o os cortes, montados em l•minas de vidro para microscopia, foram mergulhados em uma bateria de alcoŒis para desidrata•‚o e diafaniza•‚o.
1
A visualização das laminas foi feita em campo claro, e quando necessário em
campo escuro, em um microscópio óptico (Olympus BX41). As imagens foram captadas
através de um sistema de imagem acoplado ao mesmo microscópio. Esse sistema é
formado por uma câmera digital (Nikon DXM1200) com saída para uma placa de captura
de vídeo em um computador. O software utilizado pela captura das imagens foi o ACT1.
As imagens capturadas foram tratadas para ajuste de brilho e contraste no software Adobe
Photoshop CS4®, e os desenhos esquemáticos foram montados no software Adobe
Tabela 2: Lista de Anticorpos e Soros Normais
Antígeno Anticorpo
Primário
Anticorpo
Secundário Soro Normal
NeuN Mouse [1:1000] (Chemicon) Cabra [1:1000] (Jackson Labs)
Soro Normal de Cabra (2% do volume total)
5-HT Coelho [1:5000] (Sigma) Cabra [1:1000] (Jackson Labs)
Soro Normal de Cabra (2% do volume total)
5-HTT Coelho [1:1000] ImmunoStar Cabra [1:1000] (Jackson Labs)
Soro Normal de Cabra (2% do volume total)
5-HT1A Coelho [1:500] (DiaSorin) Cabra [1:1000] (Jackson Labs)
Soro Normal de Cabra (2% do volume total)
5-HT1B Coelho [1:500] (DiaSorin) Cabra [1:1000] (Jackson Labs)
Soro Normal de Cabra (2% do volume total)
5-HT2A Camundongo [1:1000] (Pharmingen) Asno [1:1000] (Jackson Labs)
Soro Normal de Asno (2% do volume total)
5-HT2B Camundongo [1:1000] (Pharmingen) Asno [1:1000] (Jackson Labs)
Soro Normal de Asno (2% do volume total)
5-HT2C Coelho [1:1000] (ImmunoStar) Cabra [1:1000] (Jackson Labs)
Soro Normal de Cabra (2% do volume total)
5-HT3 Coelho [1:1000] (Sigma) Cabra [1:1000] (Jackson Labs)
Soro Normal de Cabra (2% do volume total)
5-HT7 Coelho [1:1000] (DiaSorin) Cabra [1:1000] (Jackson Labs)
5. RESULTADOS
5.1 – Coloraˆ•o citoarquitet‰nica de Nissl
Através da coloração citoarquitetônica de Nissl pudemos observar o padrão de
organização dos núcleos hipotalâmicos do sagui (Figura 3). Os núcleos observados
mais rostralmente são os núcleos da área pré-óptica: NPOpv, APOm, APOl e NPOm,
na zona periventricular, localizados ao redor do terceiro ventrículo, e na porção mais
lateral o DB (Figura 3 A-C). Ainda no nível rostral é possível identificar núcleos da
região supra-óptica, o NSQ em posição lateral ao terceiro ventrículo sobre o quiasma
óptico, o NSO sobre a extremidade lateral do quiasma óptico, ventral à APOl e
ventrolateral à APOm (Figura 3 B-C). No nível intermédio identificamos a porção
caudal da região Supra Óptica pela presença do NSO, dividido em duas porções, lateral
e medial, pelo tracto óptico; e pela presença da porção mais anterior do NPV localizado
justaposto à porção mais dorsal da parede do terceiro ventrículo (Figura 3 D-E). Nesse
nível também são identificados: a AHD, em posição dorso-lateral ao núcleo
paraventricular; a AHA ventral ao NPV e medial ao tracto óptico; e a AHL, dorsal ao
tracto óptico e lateral às áreas hipotalâmicas anterior e dorsal (Figura 3 D-E). Nesse
nível aparecem também os núcleos da Região Tuberal: NDM, NVM e, de delimitação
mais imprecisa através da coloração de Nissl, o ARQ. NDM e NVM são limitados
lateralmente pelo fórnix e medialmente pelo terceiro ventrículo. Dorsalmente o NDM é
limitado pelo NPV e ventralmente pelo NVM. O NVM é limitado ventrolateralmente
pelo ARQ (Figura 3 F-H). No nível mais posterior observamos os núcleos: NTM e NTL
localizados lateralmente aos núcleos pré mamilares (Figura 3 I). Os núcleos mais
posteriores observados no hipotálamo formam os corpos mamilares, formados pelos
5.2 – Imunorreatividade a NeuN
A presença da proteína NeuN foi observada em toda a extensão do hipotálamo do
sagui (Figura 4), sendo útil na identificação de alguns núcleos dessa região diencefálica.
Contudo a expressão dessa proteína não foi detectada em alguns núcleos, como o NPOpv,
e na porção caudal da AHD, nesses núcleos nota-se uma ausência de imunorreatividade,
em contraste com os núcleos adjacentes a eles. Núcleos como o NSQ e o NSO expressam
essa proteína apenas na porção dorsal (Figura 4 A-C). Contudo observamos um padrão
citoarquitetônico muito semelhante ao observado através da coloração de Nissl, com a
mesma organização dos núcleos nas diferentes regiões hipotalâmicas.
5.3 – Imunorreatividade a 5-HT
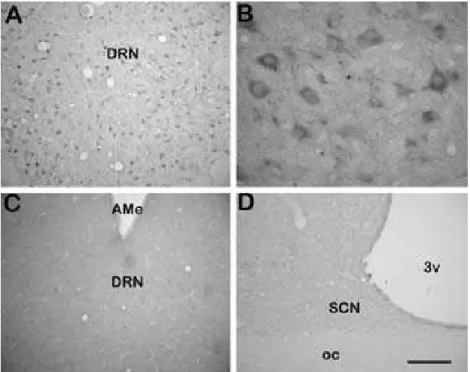
A imunorreatividade à 5-HT foi observada em toda a extensão rostro-caudal do
hipotálamo do sagüi (Figura 5). A distribuição de fibras serotonérgicas apresenta-se mais
densamente em determinados núcleos. Na APO (Figura 5.1) observamos uma grande
concentração de fibras na APOm, sobretudo no NPOpv (Figura 5.1 B-C), essas fibras
contem muitas varicosidades (Figura 5.1 C). A APOl recebe uma projeção menos densa
que a APOm (Figura 5.1 D-E), entretanto podemos observar uma maior concentração de
fibras na sua porção medial (Figura 5.1 E). Notamos também um menor número de
varicosidades na APOl que na APOm. A projeção serotonérgica para o NPOm se
restringe à sua periferia (Figura 5.1 F).
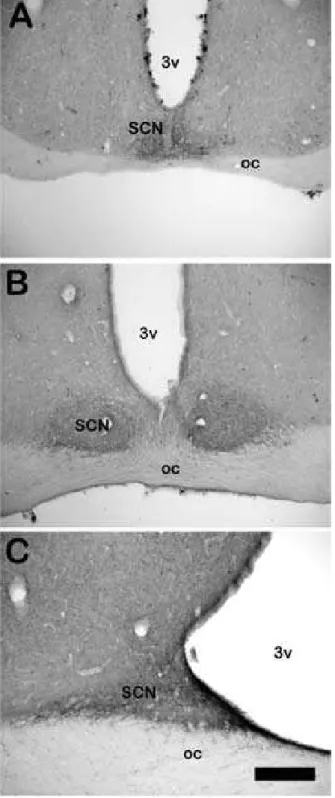
Na região supra-óptica (Figura 5.2) observamos que o NSQ recebe uma densa
projeção serotonérgica (Figura 5.2 B-C), composta por fibras e muitas varicosidades.
Essa projeção sobre o NSQ é maior na porção dorsal do núcleo, na sua porção ventral