UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE BIOCIÊNCIAS
DEPARTAMENTO DE OCEANOGRAFIA E LIMNOLOGIA PROGRAMA DE PÓS-GRADUAÇÃO EM ECOLOGIA
Avaliação da cobertura e monitoramento do
branqueamento de corais nos recifes de
Maracajaú/RN
IZABEL MARIA MATOS DE SOUZA
IZABEL MARIA MATOS DE SOUZA
Avaliação da cobertura e monitoramento do
branqueamento de corais nos recifes de
Maracajaú/RN
Dissertação de Mestrado apresentada ao
Programa de Pós-Graduação em Ecologia do Departamento de Oceanografia e Limnologia da Universidade Federal do Rio Grande do Norte como requisito parcial do grau de Mestre em Ecologia.
Orientadora: Dra. Liana de Figueiredo Mendes
UFRN / Biblioteca Central Zila Mamede Catalogação da Publicação na Fonte Souza, Izabel Maria Matos de.
Avaliação da cobertura e monitoramento do branqueamento de corais nos recifes de Maracajaú/RN. / Izabel Maria Matos de Souza. – Natal, RN, 2013.
61 f.; il.
Orientador: Prof. Liana de Figueiredo Mendes.
Dissertação (Mestrado) – Universidade Federal do Rio Grande do Norte. Centro de Biociências. Departamento de Oceanografia e Limnologia. Programa de Pós-Graduação em Ecologia.
1. Cobertura de corais - Dissertação. 2. Dinâmica de branqueamento - Dissertação. 3. Parâmetros abióticos - Dissertação. 4. Recifes de Maracajaú - Dissertação. I. Mendes, Liana de Figueiredo. II. Universidade Federal do Rio Grande do Norte. III. Título.
Aos meus pais Manoel e Emília...
Na sequência dos meus agradecimentos não existe hierarquia. Existe, no entanto, um sentimento único por cada pessoa.
Obrigada à Professora Liana pela coragem de aceitar alguém de fora como parte do seu time de orientados mesmo diante das adversidades. Obrigada pela atenção, amizade, compreensão, conselhos e, especialmente, pelos momentos de incentivo, motivação e encorajamento (É difícil conversar meia hora com você e não sair pensando que o nosso trabalho é o mais importante do mundo).
Obrigada ao Professor Coca (J. L. Attayde) pelo apoio ao me aceitar como orientada temporária.
Obrigada ao Programa de Pós-graduação em Ecologia pela oportunidade de formação com um time de professores sem igual.
Obrigada ao Professor André Megali pela atenção especial nos momentos cruciais.
Obrigada a CAPES pela concessão da bolsa.
Obrigada ao Instituto de Desenvolvimento Econômico e Meio Ambiente (IDEMA) pelo licenciamento de coleta de dados APARC;
Obrigada ao Programa de Monitoramento Ambiental do Parracho de Maracajaú (PROMAR) que viabilizou parte da logística de campo.
Obrigada à ONG Oceânica e ao Laboratório do Oceano pelo apoio com material de coleta de dados, referências e espaço de estudo.
Obrigada à operadora de mergulho Maracajaú diver pelo apoio imprescindível em grande parte do período de estudo. César, Ziggy e Fernando, vocês foram muito importantes na realização deste trabalho. Rapazes e moças da operação de mergulho, vocês foram extraordinários e não menos importantes!
Obrigada aos monitores do PROMAR que mergulharam comigo na marcação e busca de colônias, especialmente ao Edson. Sem você Edson, definitivamente essa pesquisa não teria acontecido. Muitíssimo obrigada!
Obrigada aos nativos de Maracajaú que operam no turismo, especialmente aos comandantes das jangalanchas Sol e Mar, Rosa de Saron e Pai & Filho. Obrigada ao Rizadinha e ao Zé Maria pelas caronas divertidíssimas!
a porta de sua casa com amizade, apoio e confiança sem par.
Obrigada à minha amiga Luisa (Luli) pela companhia e incentivo em campo, além da amizade que nasceu entre os dentes batendo em águas de 24◦C.
Obrigada aos meus colegas do LOC Roberto e Aline por terem participado do campo, ao Tiego e a Thais pelo apoio incial, e também ao Cadu pela ajuda nas análises estatísticas (Você é demais, Cadu!!!).
Obrigada a minha banca de qualificação (Liana, Tatiana, Fulvio e Gislene) pelo incremento de ideias, bem como aos Professores Carlos Fonseca e Gilberto Corso, e especialmente à Professora Gislene pelos auxílios extras e extras e extras.
Obrigada aos meus colegas de pós pelas horas de discussões científicas, especialmente aquelas que improdutivamente se tornaram produtivas. Sei que vocês entendem!
Obrigada aos Professores de outros departamentos e instituições que me ajudaram na compreensão dos ambientes recifais através de informações e bibliografias (Clóvis Castro, Débora Pires, Alvaro Migotto, Claude Santos, Beatrice P. Ferreira e, em especial, Tatiana Leite e Bárbara Segal por participar da banca examinadora).
Não poderia esquecer também da querida Professora Maísa Mendonça (UERN), através de quem uma nova fase da minha vida teve início (e isso significa roupa cheirando a peixe e gônada, além de ossos da mão doloridos, mas acima de tudo, muito aprendizado e amizade. No fim, tudo é crescimento , foi o que mais ouvi). Meu muito obrigada, primeira chefinha!!!
Por fim e com a chave de ouro, agradeço aos meus queridos irmãos Hidalyn e Nyladih pelo exemplo, apoio insubstituível em todos os momentos, e...neste ponto as palavras se perdem. Mas, incluo aqui também a minha nova irmã (cunhada) Eliângela por ter sido minha melhor amiga em todos os sentidos nos últimos três anos. É por vocês que, antes de todos, sou muito grata a meu amado Pai Celestial por tudo isto. Vocês são a maior prova de que Ele existe.
A mente que se abre a uma nova ideia jamais volta ao seu tamanho original.
branqueamento de corais nos recifes de Maracajaú/RN.
por
Izabel Maria Matos de Souza
Submetido ao Departamento de Oceanografia e Limnologia em 18 de Julho de 2012, como requisito parcial à obtenção do grau de Mestra em Ecologia.
RESUMO
O branqueamento de corais tem sido o foco de um número crescente de estudos desde a década de 1980 quando foi verificado o aumento na frequência, intensidade e número de áreas atingidas. No Brasil o fenômeno tem sido registrado desde 1993, associado à elevação da temperatura das águas superficiais do mar decorrente de eventos de El-Niños e anomalias térmicas, conforme a maioria dos relatos em todo o mundo. No litoral do Rio Grande do Norte registrou-se branqueamento em massa de corais nos recifes da Área de Proteção Ambiental dos Recifes de Corais (APARC) em
Março e Abril de 2010, quando a temperatura da água atingiu valor de 34◦C
durante vários dias. Cerca de 80% dos corais do complexo recifal de Maracajaú exibiram branqueamento parcial ou total. Os objetivos deste trabalho foram verificar qual a representatividade do recobrimento de corais no Parracho de Maracajaú e como a dinâmica de branqueamento se desenvolve entre as espécies. A cobertura de corais foi estimada de acordo com o protocolo Reef Check Brasil associado ao método de quadrado, e o branqueamento foi avaliado a partir de censos visuais quinzenais em 80 colônias de Favia gravida, Porites astreoides, Siderastrea stellata e Millepora alcicornis. Ao mesmo tempo foram monitorados a temperatura da água, pH, salinidade e transparência horizontal, e a ocorrência de mortalidade e sintomas de doenças. Foram utilizadas a Análise de Variância e a Regressão
Múltipla sob a perspectiva do conceito do time lag para avaliar a dinâmica de
branqueamento entre as espécies e a relação da variação das médias com a variação dos fatores abióticos, respectivamente. As espécies apresentaram diferença significativa entre si quanto à variação das médias de branqueamento ao longo do tempo, mas a dinâmica de variação exibiu padrões semelhantes.
in Maracajaú/RN reefs.
by
Izabel Maria Matos de Souza
Submitted to the Department of Oceanography and Limnologyon June 18, 2012,
in partial fulfillment of the requirements for the degree of Master in Ecology
ABSTRACT
Coral bleaching has been increasingly the focus of research around the world since the early 1980s, when it was verified to be increasing in frequency, intensity and amount of areas affected. The phenomenon has been recorded since 1993, associated with elevation of the sea surface temperature due to El Niños and water thermal anomalies, according to most reports around the world. On the coast of Rio Grande do Norte, Brazil, a mass coral bleaching event was recorded in the Environmental Protection Area of Coral Reefs (APARC) during March and April 2010, when the water temperature reached 34°C for several days. About 80% of the corals in Maracajaú reef-complex exhibited partial or total bleaching. The aims of this study were to verify representativeness of coral coverage and how the bleaching dynamic has developed among different species. Coral coverage was estimated according to Reef Check Brazil protocol associated with quadrant method, and bleaching was evaluated from biweekly visual surveys in 80 colonies of Favia gravida, Porites astreoides, Siderastrea stellata and Millepora alcicornis. At the same time temperature, pH, salinity and horizontal transparency, as well as mortality and disease occurrence were monitored. Analysis of variance and Multiple Regression from the perspective of time lag concept were used to evaluate the bleaching dynamics among species and the relationship between variation of means of bleaching and variations of abiotic parameters, respectively. Species showed significant differences among themselves as to variation of means of bleaching over time, but the dynamic of variation exhibited similar patterns.
Key words: Bleaching dynamic; abiotic parameters; coral coverage;
Figura 2. 1: Localização geográfica da área de estudo. ... 8
Figura 2. 2: Estrutura do complexo recifal de Maracajaú/RN. ... 9
Figura 2. 3: Ilustração esquemática do método de transectos de pontos associado ao registro de cobertura por quadrantes. ... 10
Figura 2. 4: Espécies de corais monitoradas. ... 11
Figura 2. 5: Metodologia de marcação de colônias. ... 12
Figura 2. 6: Estágios de branqueamento em colônias de Siderastrea stellata. ... 13
Figura 2. 7: Paleta de cores da CoralWath e padrões de cores utilizados na avaliação dos estágios de branqueamento. ... 14
Figura 2. 8: Técnica de avaliação da porcentagem de branqueamento das colônias. ... 14
Figura 3. 1: Porcentagem de ocorrência das categorias de substrato na AUTI nos recifes de Maracajaú... 17
Figura 3. 2: Variação quinzenal dos fatores ambientais entre Novembro de 2010 e Dezembro de 2011 nos recifes de Maracajaú. ... 19
Figura 3. 3: Dinâmica de branqueamento das quatro espécies de corais pétreos mais representativas nos recifes de Maracajaú. ... 20
Figura 3. 4: Média geral de branqueamento para as espécies de corais pétreos nos recifes de Maracajaú... 21
Figura 3. 5: Diferenças entre as médias quinzenais de branqueamento de Favia gravida nos recifes de Maracajaú. ... 22
Figura 3. 6: Dinâmica de branqueamento de Favia gravida nos recifes de Maracajaú entre Dezembro de 2010 e Dezembro de 2011. ... 22
Figura 3. 8: : Dinâmica de branqueamento de Porites astreoides nos recifes de Maracajaú entre Dezembro de 2010 e Dezembro de 2011. ... 24
Figura 3. 9: Diferenças entre as médias quinzenais de branqueamento de Siderastrea stellata
nos recifes de Maracajaú. ... 25
Figura 3. 10: Dinâmica de branqueamento de Siderastrea stellata nos recifes de Maracajaú entre Dezembro de 2010 e Dezembro de 2011. ... 25
Figura 3. 11: Diferenças entre as médias quinzenais de branqueamento de Millepora alcicornis
nos recifes de Maracajaú. ... 26
Figura 3. 12: : Dinâmica de branqueamento de Millepora alcicornis nos recifes de Maracajaú entre Dezembro de 2010 e Dezembro de 2011. ... 26
Figura 3. 13: Frequência de ocorrência de mortalidade parcial das colônias de Favia gravida. 27
Figura 3. 14: Colônias de Favia gravida monitoradas. ... 28
Figura 3. 15: Frequência de ocorrência de mortalidade de colônias de Porites astreoides
monitoradas.. ... 28
Figura 3. 16: Colônias de Porites astreoides monitoradas. ... 29
Figura 3. 17: Frequência de ocorrência de mortalidade de colônias de Siderastrea stellata
monitoradas. ... 29
Figura 3. 18: Colônias de Siderastrea stellata monitoradas. ... 30
Figura 3. 19: Frequência de ocorrência de infecções nas colônias de Siderastrea stellata
monitoradas. ... 30
Figura 3. 20: Colônias de Siderastrea stellata infectadas. ... 31
Figura 3. 21: Frequência de ocorrência de mortalidade de colônias de Millepora alcicornis
monitoradas. ... 32
Tabela 3. 1: Porcentagem de ocorrência das subcategorias de substrato na região da AUTI nos recifes de Maracajaú através dos métodos de pontos e quadrantes. ... 18
Tabela 3. 2: Comparação entre os resultados da avaliação do recobrimento do substrato para o método de pontos de transecção e quadrante (teste T). ... 18
Tabela 3. 3: Dinâmica de branqueamento para corais nos recifes de Maracajaú. ... 20
1. Introdução ... 1
1.1 Objetivos ... 6
2. Material e Métodos ... 8
2.1 Área de estudo ... 8
2.2 Coleta de dados ... 9
2.3 Variáveis ambientais ... 15
2.4 Análise dos dados ... 16
3. Resultados ... 17
3.1 Avaliação da representatividade de corais na AUTI do Parracho de Maracajaú ... 17
3.2 Variação dos fatores ambientais ... 19
3.3 Dinâmica de branqueamento e recuperação ... 20
3.4 Ocorrência de doenças e mortalidade ... 27
4. Discussão ... 33
4.1 Branqueamento de corais no Parracho de Maracajaú ... 35
Considerações finais ... 41
Referências ... 42
Ambientes recifais são caracterizados por sua alta diversidade (Paulay, 1997) e complexidade (Birkeland, 1997). Destes, os recifes de corais são apontados como os ecossistemas marinhos biologicamente mais diversos e produtivos do planeta, comparados somente às florestas tropicais (Connel, 1978).
A comunidade bentônica desses ecossistemas inclui animais incrustantes, sésseis e vágeis com representantes de filos diversos que constroem e modificam a superfície recifal criando uma alta variedade de habitats (Glynn, 1997). Isso favorece o desenvolvimento de uma grande diversidade de organismos associados desempenhando funções múltiplas e interligadas (Paulay, 1997). Dentre os organismos do Filo Cnidaria, os corais escleractíneos juntamente com as algas calcárias desempenham funções imprescindíveis na construção da estrutura recifal influenciando na dinâmica da composição bentônica e, consequentemente, na estrutura de toda a comunidade (Diaz-Pulido et al. 2012).
As formações recifais coralíneas estão presentes em aproximadamente 100 países e ocorrem em uma faixa estrita de condições abióticas (Birkeland, 1997; Hoegh-Guldberg, 1999). Os recursos oriundos desses complexos biogeológicos conferem bens e serviços de importância múltipla tanto de ordem ecológica como econômica (Moberg & Folke, 1999), tornando-os alvo de grande pressão antropogênica e, em contrapartida, de políticas de gestão ambiental e pesquisas científicas. Por centenas de anos as atividades humanas têm impactado esses ecossistemas e muitos fatores decorrentes do desenvolvimento urbano costeiro e das mudanças climáticas são apontados como ameaças à integridade desses ambientes em todo o mundo limitando cada vez mais a distribuição dos corais (Segal & Castro, 2011; Birkeland, 1997; Brown, 1997; Glynn, 1997; Lough & van Oppen, 2009).
Parte
1
Dentre as respostas às ameaças mencionadas acima se destaca o fenômeno mundialmente conhecido como branqueamento de corais, caracterizado pela interrupção da simbiose entre corais e algas dinoflageladas do gênero
Simbiodinium mediante perturbações ambientais (Douglas, 2003). Essa associação
mutualística é crucial para o desenvolvimento e sobrevivência de corais escleractíneos (Muller-Parker & D’Elia, 1997), pois as zooxantelas fornecem produtos fotossintetizados que suprem as necessidades nutricionais do hospedeiro, bem como aminoácidos essenciais para o incremento da calcificação e à proteção contra a radiação ultravioleta (Trapido-Rosenthal, 2005). Além disso, essas algas possuem pigmentos extras que conferem a cor marrom característica exibida pelos corais (Douglas, 2003).
De acordo com Birkeland (1997) e Lough & van Oppen & (2009) o coral vivo é uma camada de tecido translúcido com diâmetro milimétrico. Caso o tecido do hospedeiro não apresente alta densidade de zooxantelas, sua coloração varia do pálido ao translúcido e nestas condições é possível visualizar o esqueleto de carbonato de cálcio que é branco (Douglas, 2003). O termo branqueamento de coral, portanto, denota a perda parcial ou total de algas simbiontes ou dos pigmentos fotossintéticos destas (Lough & van Oppen, 2009) implicando prejuízos diversos no desenvolvimento do animal (McClanaham et al. 2009; McClanaham et al. 2008 a, b e c). Além disso, muitos eventos de doenças são identificados durante ou após episódios de branqueamento (Bruno et al, 2007), uma vez que colônias branqueadas são mais susceptíveis a infecções por terem as propriedades antibióticas do muco reduzidas (Ritchie, 2006).
A morte da colônia disponibiliza espaço para colonização de outros organismos bentônicos em pouco tempo, e em meses novas larvas ou propágulos de corais poderão assentar (McManus & Polsenberg, 2005). No entanto, macroalgas frondosas podem inibir o estabelecimento de novos recrutas promovendo o fenômeno conhecido como phase-shift, nesse caso caracterizado
pela substituição gradativa da coberturade corais por algas, e consequentemente, mudanças significativas na comunidade bentônica.
zooxantelas compromete a função reprodutiva do animal (MacClhanaham et al. 2009). Nesse sentido, a magnitude do branqueamento pode instabilizar o ecossistema conduzindo-o a uma mudança de fase que pode causar modificações consistentes na dinâmica populacional e estrutura da comunidade bentônica (Loya et al. 2001; Glynn et al. 2001), promovendo transformações profundas e deletérias (McClanaham et al. 2009).
De fato, o branqueamento fragiliza o ambiente e, a menos que este esteja íntegro em seus diversos níveis, a recuperação fica comprometida conduzindo à mudança de dominância por coral à dominância por algas (Done, 1992). A substituição de corais por algas e o desaparecimento gradativo de níveis importantes de biodiversidade, fragiliza o recife ao longo do tempo o tornando cada vez mais susceptível às consequências dos eventos de branqueamento (Hughes et al. 1994), culminando muitas vezes com o colapso do ecossistema. A literatura científica tem apontado várias circunstâncias que provocam a interrupção dessa delicada simbiose (Brown, 1997). Dentre estas o aumento da temperatura das águas superficiais é citada como um dos principais fatores responsáveis pelo branqueamento em massa de corais em diversos recifes do mundo (Stone et al. 1999). Os eventos de anomalias térmicas que culminaram em alta mortalidade caracterizaram-se pela longa duração do fenômeno, como durante os períodos de El Niños mais severos (Eakin et al. 2010; Baker et al. 2008; Fitt et al. 2001).
água doce decorrente do desmatamento de florestas e do desenvolvimento da agricultura em áreas de alta precipitação Muller & D’Elia, 1997 .
De acordo com Oliver et al. (2009) os registros mais antigos de mortalidade em massa de corais antecedem 1876 (Goreau & Hayes, 1994). Segundo os autores, o primeiro relato associado a estresse térmico reporta o branqueamento em massa e grande mortalidade de corais na Grande Barreira de Corais australiana no verão de 1929, que foi marcado por altas medidas de temperatura (Younge & Nicholls, 1931 apud Oliver et al. 2009). No entanto, a primeira publicação específica provavelmente corresponde ao evento reportado na Jamaica após a ocorrência do Furacão Flora (1963), quando fortes chuvas de inundação promoveram a diminuição na salinidade do ambiente marinho, causando branqueamento dos corais (Goreau, 1964).
Os trabalhos de Glynn (1983, 1984) surgem como o primeiro registro bem documentado reconhecendo o branqueamento como evento de grande impacto para a saúde dos corais em escalas regional e global. Brown (1997) também menciona a ocorrência de branqueamento em 1986-87 em vários locais no Caribe e Mar Vermelho, e em 1991, quando o evento culminou na alta mortalidade dos corais em recifes da Tailândia e Polinésia Francesa. Fitt et al. (2001) citam que o evento mais amplo aconteceu em 1997-1998, um período de forte El Niño quando foi relatada ocorrência de branqueamento em de 48 países. Desde então tem aumentado o número de relatos em todo o mundo, especialmente relacionados a episódios de anomalias térmicas (Bruno et al. 2007; Jones, 2008; Hoegh-Guldberg et al. 2007; Aronson & Precht, 2006; Hughes et al. 2003; Hoegh-Guldberg, 1999 e outros).
O branqueamento do coral não implica necessariamente na morte do animal. Corais branqueados podem sobreviver e adquirir novas populações de simbiontes à medida que as condições ambientais tornam-se favoráveis (Douglas, 2003). Por outro lado, o branqueamento pode gerar morte por insuficiência nutricional (Glynn, 1993) ou infecções (Lesser et al. 2007).
As microalgas do gênero Simbiodinium exibem ampla variedade genética
branqueamento adaptativo prevê que em ambientes submetidos a estresses constantes o branqueamento fornece ao hospedeiro a oportunidade de adquirir novas populações de simbiontes com possibilidade de formar uma associação mais resistente a eventos futuros (Buddemeier & Fautin, 1993). De modo geral é sugerido que um regime constante de estresses promove a condição ideal para a formação de populações cada vez mais resilientes. De fato, estudos indicam que existe diferença entre as espécies quando à susceptibilidade ao branqueamento e que a dinâmica de branqueamento pode ser diferente para uma mesma espécie em ambientes distintos (Leão et al. 2008). Existem também evidências de que essa susceptibilidade ao branqueamento é proporcional ao grau de deterioração do ambiente (Wilkinson, 2004). Este quadro reflete a realidade dos recifes brasileiros que tem sofrido considerável declínio em decorrência do desenvolvimento das zonas costeiras (Kikuchi et al. 2008; Ferreira & Maida, 2006).
No Brasil a literatura acerca de branqueamento corresponde aos relatos de eventos ocorridos na costa de São Paulo no verão de 1993/94 (Migotto, 1997); no litoral norte da Bahia no verão de 1997/98 (Dutra, 2000; Dutra et al. 2000); duas ocorrências em Abrolhos - uma no verão de 1993/94 (Castro & Pires, 1999) e outra no verão de 1997/1998 (Leão et al. 2003; Oliveira et al. 2004); duas ocorrências na costa Nordeste – uma em 1996 (Costa et al. 2001; Costa & Amaral, 2002; Costa et al. 2004) e outra em 2003, no Atol das Rocas, Fernando de Noronha e em recifes costeiros de Pernambuco (Ferreira & Maida, 2006); e em vários recifes da Bahia de 1998 a 2005 (Leão et al. 2008). Todos os eventos mencionados foram relacionados ao aumento da temperatura das águas superficiais em decorrência de anomalias térmicas ou eventos de El Niño.
endêmicas (Nunes et al. 2011; Amaral et al. 2008; Ferreira & Maida, 2006; Castro & Pires, 2001; Maida & Padovani, 1996).
Na costa do estado do Rio Grande do Norte, extremo nordeste brasileiro, foi criada em 2001 a Unidade de Conservação da Área de Proteção Ambiental dos Recifes de Corais (APARC), que exibe verificar essas informações novamente construções inorgânicas (bancos areníticos) e recifais, dentre os quais o maior complexo recifal é o local conhecido regionalmente como Parracho de Maracajaú (Santos, 2007), área onde foi conduzida a presente pesquisa. Bárbara falou muito sobre o conceito de recife.
No início do ano de 2010 (Março e Abril) foi registrado severo branqueamento de corais concomitantemente à grande mortalidade de peixes em praias da APARC. A temperatura da água no Parracho de Maracajaú atingiu 34°C durante todo o mês de Março, representando um aumento de 5ºC sobre a média usual registrada para este período (29°C), de acordo com dados do INPE (Instituto Nacional de Pesquisas espaciais). Nesta ocasião foi elaborado um relatório técnico que avaliou a saúde dos corais e mostrou que cerca de 80% desses organismos apresentaram-se parcial ou totalmente branqueados cerca de 20 dias após o registro inicial da elevação da temperatura (ONG Oceânica, 2010).
O presente estudo foi elaborado e iniciado a partir de Dezembro de 2010 com a finalidade de monitorar o branqueamento de corais nos recifes de Maracajaú, verificando a taxa de mortalidade e também descrevendo a dinâmica entre branqueamento e recuperação destes organismos frente às variações dos parâmetros abióticos.colocar mais sobre este evento.
1.1
Objetivos
Gerais
Específicos
Avaliar a percentagem da cobertura e distribuição de corais no Parracho de Maracajaú;
Comparar a frequência e abundância dos componentes bentônicos entre os métodos de amostragem utilizados.
Verificar qual a dinâmica de branqueamento para as espécies: Favia gravidaPorites astreoides, Siderastrea stellata e Millepora alcicornis.
2.1 Área de estudo
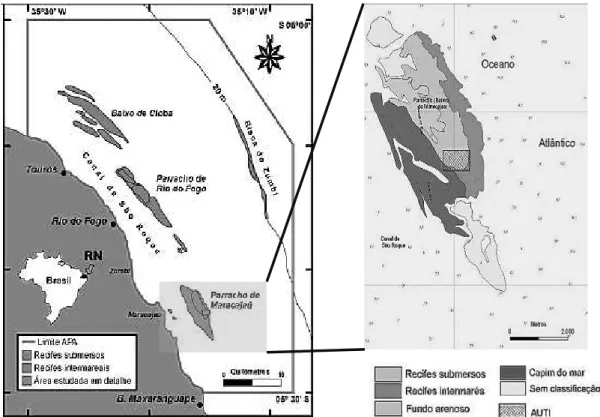
O estudo foi realizado no complexo recifal de Maracajaú localizado no litoral norte-oriental do Estado do Rio Grande do Norte, entre as coordenadas
° ’ ’’ e ° ’ ’’S e ° ’ ’’e ° 7’ ’’O (Santos et al. 2007). Estes recifes estão localizados na Área de Proteção Ambiental dos Recifes de Corais (APARC) que corresponde à faixa costeira dos municípios de Maxaranguape, Rio do Fogo e Touros (Amaral et al. 2005) (Figura 2.1).
Figura 2.1: (A) Mapa da costa norte-oriental do Rio Grande do Norte com destaque para a APARC. (B) Complexo recifal de Maracajaú com diferentes tipos de fundo e Área de Uso Turístico Intensivo (AUTI) (Fonte: Amaral et al. 2005).
Os recifes de Maracajaú constituem o maior complexo da APARC com 9 Km de extensão e 3 Km de largura com forma de elipse e orientação NO/SE, estando
Parte
2
paralelo a linha costeira (Santos et al. 2007). Dista cerca de 7 Km da Praia de Maracajaú, no município de Maxaranguape, que está localizado a cerca de 60 km da capital do estado do Rio Grande do Norte, Natal. De acordo com Amaral et al. (2005), os corpos recifais neste local são compostos por manchas de corais e algas calcárias que se desenvolvem a partir de uma base arenítica sobre o fundo arenoso e atingem até 3 metros de altura. Entre os corpos recifais existem corredores de dimensões variadas conferindo o aspecto de labirinto com a formação de piscinas naturais em alguns locais (Santos et al. 2007) (Figura 2.2).
Figura 2.2: (A) Corpos recifais espaçados por corredores arenosos com aspecto labiríntico. (B) Corpo recifal com até 3 metros de altura.
O clima característico na região é seco (Setembro a Março) e chuvoso (Abril a Agosto) com temperatura média de 28 °C e turbidez da água associada à ação dos ventos entre Agosto a Setembro. A salinidade média é de 36 ppm sem muita variação ao longo do ano (Marcelino & Amaral, 2003), entretanto, de acordo com Mayal et al (2009) pode ocorrer grande aporte de água doce proveniente do Rio Maxaranguape durante a estação chuvosa.
2.2 Coleta de dados
A coleta de dados foi realizada através de mergulho livre snorkelling
durante as marés baixas entre 0.0 e 0.4, quando a água exibe as melhores condições de visibilidade. Os dados foram registrados em pranchetas de PVC com grafite.
B A
Foto:
Lia
n
a
M
en
d
es
Foto:
Sa
n
d
ra
A cobertura percentual dos diferentes tipos de substratos, incluindo os corais, foi estimada através do método transecção de pontos de 20 metros de extensão, de acordo com o protocolo do Reef Check Brasil (http://www.recifescosteiros.org.br/), associado ao método de avaliação em quadrantes de 0,5 m2 dispostos a cada dois metros em lados alternados da trena(Bianchi et al. 2004), conforme mostra a Figura 2.3:
Figura 2.3: Ilustração esquemática do método de transectos de pontos associado ao registro de cobertura por quadrantes de 0,5m2 área.
Foram efetuadas 27 transecções na área da AUTI (Área de Uso Turístico Intensivo), sendo 41 pontos e 11 quadrantes por fita. A amostragem foi realizada apenas nessa área devido à logística de transporte proporcionada pela atividade turística.
O substrato recifal foi avaliado a partir da adaptação das categorias propostas pelo protocolo definido pelo programa Reef Check Brasil e são apresentadas a seguir:
Coral duro (CD) –Todas as espécies de coral duro, incluindo o coral de fogo (Millepora alcicornis). Adaptação: os organismos foram identificados em nível de espécie (F. gravida, P. astreoides, etc.).
Coral mole (CM) – Somente zooantídeos.Adaptação: os organismos foram identificados em nível de espécie;
Coral recentemente morto (CRM) –Esqueleto exposto com tecidos mortos e com reconhecíveis estruturas de coralitos;
Rocha dura (RD) - Qualquer substrato duro, como rocha nua ou coberto
esparsamente por algas filamentosas, cracas, ostras, etc. Adaptação: essa
categoria foi desmembrada em duas sub-categorias:
Tapete de algas (TA) - algas formadoras de tapetes.
Rocha nua – rocha exposta sem nenhum tipo de recobrimento. Esponja (SP) – todas as espécies de esponjas;
Cascalho (CC) – rochas com diâmetro entre 0,5 e 15 cm;
Areia (AR) - Sedimento com diâmetro menor que 0,5 cm. Na água o sedimento afunda rapidamente até o substrato.
Alga calcária (AC) - Algas incrustantes.
Para avaliar a dinâmica de branqueamento e recuperação dos corais em Maracajaú foram selecionadas as quatro espécies mais comuns na área da AUTI:
Favia gravida, Porites astreoides, Siderastrea stellata e Millepora alcicornis (Figura
2.4).
Figura 2.4: Espécies de corais monitoradas. (A) F. gravida, (B) P. astroides, (C) S. stellata e (D) M. alcicornis.
Foram marcadas aleatoriamente na área da AUTI 20 colônias de cada espécie, 10 destas situadas próximas à superfície (profundidade máxima de 1m na baixa-mar) e as outras 10 próximas ao fundo (profundidade entre 1,5m e 3m na
A B
baixa-mar). A marcação foi feita com boias de isopor enumeradas com etiquetas de PVC e ancoradas ao recife com cordas de polipropileno (Figura 2.5). As colônias selecionadas apresentaram o mínimo de lesão (sintoma de doença ou mortalidade) possível.
Figura 2. 5: (A) Colônias marcadas com boias de isopor (a) enumeradas com etiquetas de PVC (b) e (B) ancoradas ao recife por cordas de polipropileno (C).
Os registros de branqueamentos foram efetuados através de censos visuais das colônias marcadas a cada quinze dias de Dezembro de 2010 a Dezembro de 2011. Cada registro consistiu da atribuição do nível de branqueamento (em percentagem) exibido por cada colônia. Para tanto foi considerado que os corais em processo de branqueamento exibem dois tipos de sintomas (Figura 2.6), não mutuamente exclusivos: (1) Manchas branqueadas, representadas por áreas visivelmente mais empalidecidas que o restante da colônia, e (2) perda da vivacidade da coloração, caracterizada por empalidecimento da colônia de acordo com um gradiente de tonalidades. A palidez da colônia baseada na vivacidade da coloração da colônia foi quantificada a partir da paleta de cores proposta pela CoralWatch (http://www.coralwatch.org), que exibe um gradiente de seis tonalidades abrangendo do totalmente saudável ao totalmente branco. Para cada tom de cor foi atribuído previamente um valor percentual para o nível de branqueamento que ela representaria que, a partir do totalmente saudável, seriam: 0%, 25%, 50%, 75%, 90% e 100% para o totalmente branco (Figura 2.7). Para captar variações de coloração em uma mesma colônia, o protocolo utilizado consistiu dos seguintes passos:
a
b
c
a) Com o auxílio de um quadrante de 25 cm2, subdividido em 25 unidades de 5 cm2, foi registrado a percentagem de branqueamento para cada sub-quadrante (Figura 2.8), conforme a paleta de cores.
b) A percentagem total de branqueamento foi calculada como a média do branqueamento exibido pelos sub-quadrantes conforme a fórmula a seguir, onde Bc é o branqueamento total da colônia em percentagem, bq é a percentagem de branqueamento no sub-quadrante correspondente, e n é o número total de sub-quadrantes amostrados:
Bc =
𝑏𝑞 +𝑏𝑞 +⋯+𝑏𝑞𝑛𝑛Figura 2.6: Colônias de Siderastrea stellata em diferentes estágios de branqueamento no Rio Grande do Norte: (A) Colônia totalmente saudável (Parracho de Maracajaú). (B) Colônia empalidecida em mais de 50% (Parracho de Maracajaú). (C) Colônia parcialmente branqueada com mancha em mais de 50% da superfície (Parracho de Pirangi). (D) Colônia totalmente branqueada (Parracho e Pirangi).
Fot
o:
Iz
ab
el M
at
os
Fot
o:
And
re
Bast
os
Fot
o:
Iz
ab
el
M
at
os
Fot
o:
Iaci
ra S
hier
A B
Figura 2.7: Paleta de cores da CoralWath e padrões de cores utilizados na avaliação dos estágios de branqueamento. Os valores de porcentagem são atribuídos a cada quadro de avaliação quantitativa do fenômeno. Os quadros numerados com 1, 2, 3, 4, 5 e 6 correspondem a 100%, 90%, 75%, 25% e 0% de branqueamento, respectivamente, cada faixa de cor.
Figura 2.8: Técnica de avaliação da porcentagem de branqueamento das colônias. (A) A mancha representa 100% de branqueamento pontual em contraste com o restante saudável da superfície da colônia, e em (B) a mancha representa 75% de branqueamento pontual contraste com o restante saudável da superfície da colônia. O branqueamento total (Bc) consistiu da média de branqueamento em todas as subunidades do quadrante.
Simultaneamente às medidas tomadas de branqueamento foi registrada a ocorrência de possíveis sintomas de doenças e mortalidade em cada colônia.
C1
C4 C3 C2
C5 C6
0 % 25 % 50% 75% 90 % 100%
O registro de doenças foi feito de acordo com o protocolo do Global Coral Disease Database (http://coraldisease.org) que dispõe de um banco mundial de dados sobre a saúde de corais, segundo o qual a medida do grau de branqueamento ou doença é feita através da atribuição de níveis ou categorias que reflitam a percentagem de área afetada. Neste trabalho foram determinadas as seguintes categorias para descrever a saúde e a mortalidade dos corais independente do estágio de branqueamento:
S (saudável) – para 100% do diâmetro saudável.
P. D (parcialmente doente) – doença em menos de 50% da colônia. D (Doente) – doença em mais de 50% da colônia está doente;
PM 1(parcialmente morta nível 1) – morte em até 25% do diâmetro da colônia);
PM 2 (parcialmente morta nível 2) - morte entre 25% a 50% do diâmetro da colônia.
PM 3 (parcialmente morta nível 3) – morte em mais de 50% do diâmetro da colônia;
M (morta) – 100% da colônia.
Para o registro de doenças foram consideradas manchas sintomáticas ou lesões de acordo com Rosenberg et al. (2007) e Francine-Filho et al. (2008).
2.3 Variáveis ambientais
2.4 Análise dos dados
Para avaliar a representatividade da cobertura de substrato foi feita análise percentual dos dados amostrados sob a perspectiva dos métodos de pontos e quadrante. Posteriormente os resultados obtidos a partir das duas metodologias foram comparados através do teste-T para amostras independentes.
Para avaliar se o diâmetro e a profundidade das colônias interferem na dinâmica de branqueamento os dados foram submetidos à análise multivariada com performance de medidas repetidas (Análise de variância multivariada-MANOVA). A diferença entre as espécies quanto média geral de branqueamento exibido no período foi feita através de teste-T.
A relação entre o branqueamento e os parâmetros físicos mensurados foi verificada através da análise de regressão múltipla, considerando o modelo mais apropriado aquele de maior coeficiente de correlação (r2) e menores valores de AIC (Critério de Informação de Akaike).
Considerando que o branqueamento clássico perceptível visualmente ocorre dias depois da incidência do estresse que desencadeou o fenômeno, neste estudo foi utilizado o conceito de time lag que prevê as interações que possam ser
associadas a intervalos de tempo (Depradine & Lovell, 2004). Esse procedimento foi adotado para investigar correlações que fossem enfraquecidas pela simultaneidade da análise. Desta forma, quatro time lags foram pré-determinados:
Time lag 0 (zero) – correlação simultânea;
Time lag de 15,30 e 45 dias – correlação com dados abióticos de 15,30 e
45 dias de defasagem.
A incidência de doenças e mortalidade foi avaliada pela regressão múltipla dos seguintes fatores: temperatura, salinidade, transparência horizontal e média branqueamento, sendo considerados os melhores modelos aqueles com maiores coeficientes de correlação (r2) e menores AICs.
3.1 Avaliação da representatividade de corais na AUTI do
Parracho de Maracajaú
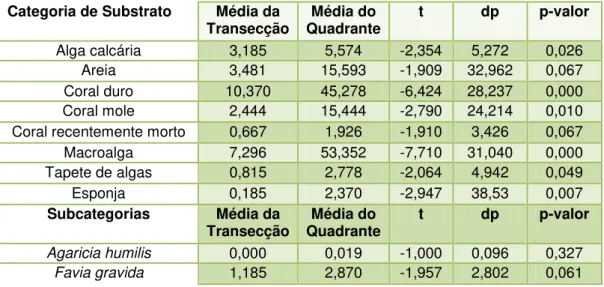
A categoria de substrato mais representativa obtida através do método de
transecção de pontos foi a de algas formadoras de tapetes com 34% (Figura 3.1A),
seguida de corais pétreos e macroalgas. Dentre as espécies de corais pétreos, S.
stellata foi a mais representativa, com 14%, e dentre as macroalgas Dyctiopteris sp.
com 16% Observou-se ainda uma pequena expressividade de zoantídeos e algas
incrustantes, e pequena representatividade de esponjas e corais recentemente
mortos (Tabela 3.1).
De acordo com a amostragem em quadrantes observou-se que 49% do
recobrimento do substrato referem-se à cobertura de algas formadoras de tapetes,
com corais pétreos representando 15% e as macroalgas contribuindo com 20%
(Figura 3.1B). Dentre as espécies de corais S. stellata foi a mais representativa com
7%, e dentre as macroalgas Dictypteris sp. com 20% (Tabela 3.1).
Figura 3.1: Porcentagem de ocorrência das categorias de substrato na AUTI do Parracho de Maracajaú segundo os métodos de transecção de pontos (A) e quadrantes (B). CRM – Coral recentemente morto; AC - Alga calcária; AR - Areia.
CORAL DURO 25%
CORAL MOLE 8%
CRM 1% AC 7%
SP 0% AR 8% MACROALGA
17% TAPETE DE
ALGAS 34%
CORAL DURO
15% CORAL MOLE 6% CRM
1% AC 2%
SP 1% AR
6%
MACROALGA 20% TAPETE DE ALGAS
49%
A B
Parte
3
A comparação dos resultados de cobertura obtidos entre os métodos de
pontos e de quadrantes indicou diferença em todas as categorias de substrato na
avaliação do recobrimento de acordo com os resultados do teste T (Tabela 3.2).
Dentro das subcategorias houve diferença significativa ou marginalmente
significativa para as espécies de corais F. gravida, S. stellata e M. alcicornis, para o
zoantídeo Palythoa caribaeorum e para as macroalgas Caulerpa racemosa e
Dictyopteris sp.
Tabela 3.1: Porcentagem de ocorrência das subcategorias de substrato na região da AUTI nos recifes de Maracajaú através dos métodos de pontos e quadrantes. CRM – Coral recentemente morto; AC – Alga calcária; SP – Esponja; AR – Areia.
Tabela 3.2: Comparação entre os resultados da avaliação do recobrimento do substrato para o método de pontos de transecção e quadrante (teste T). dp – Desvio padrão.
CATEGORIA Subcategoria Transecção Quadrante
CORAL DURO
A. humilis 0% 0%
F.gravida 4% 1%
M.decactis 0% 0%
P.astreoides 3% 2%
S.stellata 14% 7%
M.alcicornis 3% 5%
CORAL MOLE Palythoa caribaeorum 7% 6%
Zoanthus sociatus 1% 0%
CRM CRM 1% 1%
AC AC 7% 2%
SP SP 1% 1%
AR AR 8% 6%
MACROALGA
Caulerpa racemosa 1% 1%
Dyctiopteris sp. 16% 19%
Sargassum sp. 0% 0%
TAPETE DE ALGAS Algas formadoras de
tapetes 34% 49%
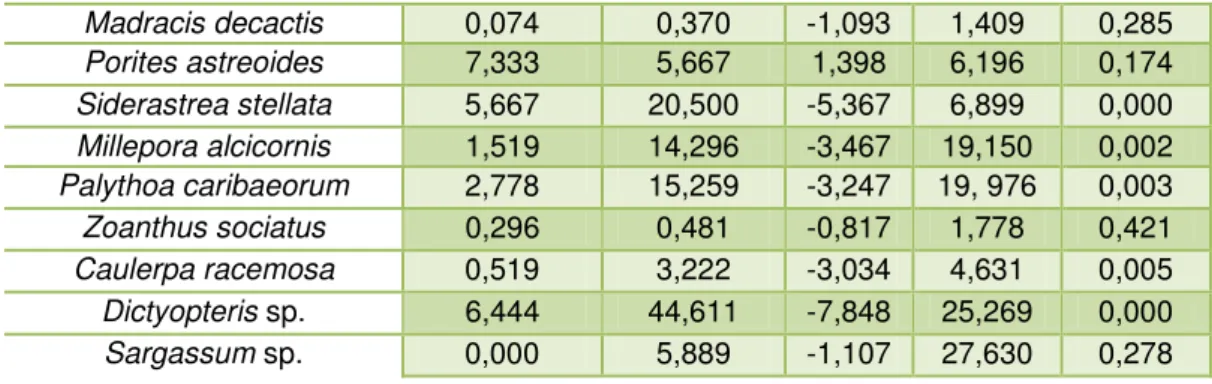
Categoria de Substrato Média da Transecção
Média do Quadrante
t dp p-valor
Alga calcária 3,185 5,574 -2,354 5,272 0,026 Areia 3,481 15,593 -1,909 32,962 0,067 Coral duro 10,370 45,278 -6,424 28,237 0,000 Coral mole 2,444 15,444 -2,790 24,214 0,010 Coral recentemente morto 0,667 1,926 -1,910 3,426 0,067 Macroalga 7,296 53,352 -7,710 31,040 0,000 Tapete de algas 0,815 2,778 -2,064 4,942 0,049 Esponja 0,185 2,370 -2,947 38,53 0,007
Subcategorias Média da Transecção
Média do Quadrante
t dp p-valor
Agaricia humilis 0,000 0,019 -1,000 0,096 0,327
F.gravida, M. alcicornis e P. astreoides foram as espécies de corais mais
representativas após S. stellata, embora com baixo percentual de cobertura. Já as
espécies A. humilis e M. decactis, embora registradas ao longo da avaliação em
Maracajaú, não foram expressivas em termos de porcentagem.
3.2 Variação dos Fatores Ambientais
O valor médio de temperatura da água entre Dezembro de 2010 e
Dezembro de 2011 foi de 28°C, com valor máximo de 32° C em Março de 2011 e
mínimo de 25°C em Junho de 2011 (Figura 3.2):
Figura 3.2: Variação quinzenal dos fatores ambientais entre Novembro de 2010 e Dezembro de 2011 nos recifes de Maracajaú.
A salinidade apresentou valor máximo de 38 ppm em Dezembro de 2010 e
mínimo de 32 ppm em Abril, Julho e Agosto de 2011 e com valor médio anual de 34
ppm. A transparência horizontal superficial da água variou entre 5 e 10 metros
durante a maior parte do estudo, com valores máximo de 12 metros em Julho de
1 3 5 7 9 11 13 15 17 19 21 23 25 27 29 31 33 35 37 39 N ov .1 N o v .2 De z. 1 De z. 2 Jan .1 Jan .2 Fe v .1 Fe v .2 Ma r.1 Ma r.2 Ab r.1 Ab r.2 Mai .1 Ma i.2 Ju n .1 Ju n .2 Ju l.1 Ju l.2 Ag o.1 Ago.2 Se t. 1 Se t. 2 Ou t. 1 Ou t. 2 N ov .1 N o v .2 De z. 1 Temperatura (°C) Salinidade (ppm) Transparência horizontal (metro)
Madracis decactis 0,074 0,370 -1,093 1,409 0,285
Porites astreoides 7,333 5,667 1,398 6,196 0,174
Siderastrea stellata 5,667 20,500 -5,367 6,899 0,000
Millepora alcicornis 1,519 14,296 -3,467 19,150 0,002
Palythoacaribaeorum 2,778 15,259 -3,247 19, 976 0,003
Zoanthus sociatus 0,296 0,481 -0,817 1,778 0,421
Caulerpa racemosa 0,519 3,222 -3,034 4,631 0,005
Dictyopteris sp. 6,444 44,611 -7,848 25,269 0,000
2011 e mínimo de 1 metro em Setembro de 2011. O valor do pH manteve-se
constante ao longo do período de estudo (8,4).
3.3 Dinâmica de branqueamento e recuperação
As médias mensais de branqueamento para as 20 colônias de cada uma das
quatro espécies monitoradas variaram ao longo do tempo (Figura 3.3). A dinâmica
do fenômeno diferiu significativamente entre as espécies, e a variação das médias
de branqueamento não expressou relação com o diâmetro e a profundidade das
colônias (Tabelas 3.3).
Figura 3.3: Dinâmica de branqueamento das quatro espécies de corais pétreos mais representativas nos recifes de Maracajaú.
Tabela 3.3: Dinâmica de branqueamento para corais nos recifes de Maracajaú (MANOVA de medidas repetidas).
Fonte SS gl Média dos
quadrados
F-razão
p-valor
Tempo 5,307 23 0,231 14,361 0,000 Tempo*espécie 17,109 66 0,248 15,431 0,000 Tempo*diâmetro 0,124 23 0,005 0,335 0,999 Tempo*Profundidade 0,381 23 0,017 1,032 0,419 Erro 27,348 1.702 0,016
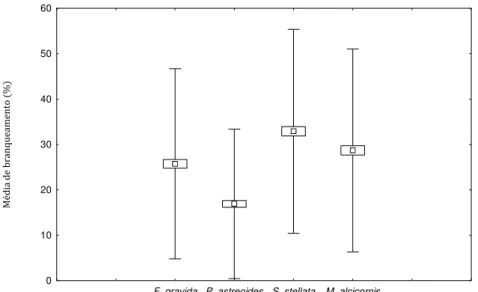
A média geral de branqueamento para o período de estudo indicou que P.
astreoides foi a espécie que exibiu as menores médias de branqueamento (cerca de
15%), enquanto S. stellata exibiu as maiores médias (cerca de 35%), seguida de M.
alcicornis e F.gravida (cerca de 25% ambas) (Figura 3.4).
F. gravida P. astreoides S. stellata M. alcicornis 0
10 20 30 40 50 60
M
éd
ia d
e bran
qu
ea
m
en
to
(%)
Figura 3.4: Média geral de branqueamento para as espécies de corais pétreos nos recifes de Maracajaú entre Dezembro de 2010 e dezembro de 2011. Barra vertical: desvio padrão; retângulo: média erro; quadro: média.
A seguir é apresentado o resultado referente à dinâmica de branqueamento
e recuperação para cada uma das quatro espécies de coral avaliadas e a relação
com os fatores ambientais mensurados ao longo do período da pesquisa.
Favia gravida
F. gravida exibiu dois momentos de branqueamento ao longo do ano
(Figura 3.5): O primeiro entre Dezembro de 2010 e Abril de 2011, quando a média
se elevou de 10% para 60% seguido por período de recuperação até Agosto, ou
seja, quatro meses de branqueamento e quatro meses de recuperação (Figura 3.6).
O segundo momento ocorreu entre Setembro e Novembro com elevação da média
Figura 3.5: Diferenças entre as médias quinzenais de branqueamento de F. gravida nos recifes de Maracajaú. Cada ponto indica a diferença entre a média de branqueamento da quinzena correspondente e a média de branqueamento da quinzena anterior. Diferenças positivas indicam aumento da média de branqueamento (branqueamento) em relação à quinzena anterior. Diferenças negativas indicam diminuição da média de branqueamento (recuperação) em relação à quinzena anterior. Os valores do eixo vertical indicam a porcentagem de branqueamento ou recuperação da quinzena em relação à quinzena anterior.
Figura 3.6: Dinâmica de branqueamento de F. gravida nos recifes de Maracajaú entre Dezembro de 2010 e Dezembro de 2011 (Barras verticais representam o desvio padrão).
O time lag 0 apresentou o modelo que melhor explica o branqueamento
observado para F. gravida, indicando que esta espécie exibiu resposta rápida ao
estímulo abiótico. Cerca de 40% (r2=0,395) do branqueamento foi relacionado à
variação de temperatura, salinidade e transparência horizontal, com correlação
positiva para temperatura e transparência horizontal e negativa para salinidade,
ou seja, o aumento na média de branqueamento foi influenciado pelo aumento dos
-20 -15 -10 -5 0 5 10 15 De z. 2 Jan .1 Jan .2 Fe v .1 Fe v .2 Ma r.1 Ma r.2 Ab ri .1 Ab r.2 Ma i.1 Ma i.2 Ju n .1 Ju n .2 Ju l.1 Ju l.2
Ago.1 Ago.2 Se
t. 1 Se t. 2 Out .1 Ou t. 2 N o v .1 N o v .2 De z. 1 R e cu p e raç ão B ran q u e am e n to 0 10 20 30 40 50 60 70 80 90 100 De z.2 Jan .1 Jan .2 Fe v .1 Fe v .2 Ma r.1 Ma r.2 Ab ri .1 Ab r.2 Ma i.1 Ma i.2 Ju n .1 Ju n .2 Ju l.1 Ju l.2
Ago.1 Ago.2 Se
valores de temperatura e transparência horizontal e diminuição dos valores de
salinidade, de acordo com o modelo de regressão: -0,893 + 0,062*temperatura +
(-0,022)*salinidade + 0,020*transparência. A temperatura foi o parâmetro que mais
contribuiu para a elevação da média de branqueamento desta espécie explicando
cerca de 30% da variação (r2 = 0,315). Em seguida, a transparência horizontal
explicou 17% dessa variação (r2 = 0,167).
Porites astreoides
P. astreoides exibiu dois períodos bem definidos de branqueamento ao
longo do ano (Figura 3.7). O primeiro ocorreu entre Fevereiro e Abril de 2011,
quando a média elevou-se de 10% para aproximadamente 50% seguido por um
período de recuperação que se estendeu até o fim de Julho, ou seja, cerca de três
meses de branqueamento e três meses de recuperação (Figura 3.8). Verificou-se
também, uma discreta elevação da média de 10% para 20% entre Julho e
Novembro, ou seja, em quatro meses a média aumentou em 10% seguida de
recuperação.
Figura 3.7: Diferenças entre as médias quinzenais de branqueamento de P. astreoides nos recifes de Maracajaú. Cada ponto indica a diferença entre a média de branqueamento da quinzena correspondente e a média de branqueamento da quinzena anterior. Diferenças positivas indicam aumento da média de branqueamento (branqueamento) em relação à quinzena anterior. Diferenças negativas indicam diminuição da média de branqueamento (recuperação) em relação à quinzena anterior. Os valores do eixo vertical indicam a porcentagem de branqueamento ou recuperação da quinzena em relação à quinzena anterior.
-15 -10 -5 0 5 10 15 20 De z. 2 Jan .1 Jan .2 Fe v .1 Fe v .2 Ma r.1 Ma r.2 Ab ri .1 Ab r.2 Ma i.1 Ma i.2 Ju n .1 Ju n .2 Ju l.1 Ju l.2
Ago.1 Ago.2 Se
Figura 3.8: Dinâmica de branqueamento de P. astreoides nos recifes de Maracajaú entre Dezembro de 2010 e Dezembro de 2011(Barras verticais representam o desvio padrão).
O time lag de 30 dias apresentou o modelo mais apropriado para explicar o
branqueamento observado para P. astreoides (valores de AIC). Este resultado
indica que esta espécie exibiu retardo na resposta ao estímulo abiótico.
Aproximadamente 32% (r2 =0,324) do branqueamento foi relacionado à variação
de temperatura, salinidade e transparência horizontal, com correlação positiva
para temperatura e transparência horizontal e negativa para salinidade, de acordo
com o modelo de regressão: 0,520 + 0,025 * temperatura + (-0,033)*salinidade +0,
009*visibilidade. A temperatura foi o parâmetro de maior influência na elevação
da média de branqueamento explicando 22% da variação (r2=0,220), e a interação
entre temperatura e salinidade explica 32% dessa variação (r2=0,316), com valor
de AIC muito semelhante aquele do modelo que inclui os três parâmetros.
Salinidade e transparência horizontal exibiram baixo coeficiente de correlação
quando avaliados individualmente.
Siderastrea stellata
S. stellata exibiu dois eventos de branqueamento durante o ano (Figura 3.9).
O primeiro entre Janeiro e Março de 2011, com elevação da média de 20% para
70% seguida por período de recuperação até Agosto, ou seja, cerca de três meses
de branqueamento e cinco meses de recuperação (Figura 3.10). O segundo
-10 0 10 20 30 40 50 60 70 80 De z. 2 Jan .1 Jan .2 Fe v .1 Fe v .2 Ma r.1 Ma r.2 Ab ri .1 Ab r.2 Ma i.1 Ma i.2 Ju n .1 Ju n .2 Ju l.1 Ju l.2
Ago.1 Ago.2 Se
ocorreu entre Setembro e Outubro com elevação da média de 15% para cerca de
30%).
Figura 3.9: Diferenças entre as médias quinzenais de branqueamento de S.stellata nos recifes de Maracajaú. Cada ponto indica a diferença entre a média de branqueamento da quinzena correspondente e a média de branqueamento da quinzena anterior. Diferenças positivas indicam aumento da média de branqueamento (branqueamento) em relação à quinzena anterior. Diferenças negativas indicam diminuição da média de branqueamento (recuperação) em relação à quinzena anterior. Os valores do eixo vertical indicam a porcentagem de branqueamento ou recuperação da quinzena em relação à quinzena anterior.
Figura 3.10: Dinâmica de branqueamento de S. stellata nos recifes de Maracajaú entre Dezembro de 2010 e Dezembro de 2011(Barras verticais representam o desvio padrão).
O time lag 0 apresentou o modelo que melhor explicou o branqueamento
observado para S. stellata, indicando que esta espécie exibiu resposta rápida ao
estímulo abiótico. Cerca de 40% (r2=0,390) do branqueamento foi correlacionado
positivamente à temperatura, ou seja, o aumento da média de branqueamento
-15 -10 -5 0 5 10 15 20 De z. 2 Jan .1 Jan .2 Fe v .1 Fe v .2 Ma r.1 Ma r.2 Ab ri .1 Ab r.2 Ma i.1 Ma i.2 Ju n .1 Ju n .2 Ju l.1 Ju l.2
Ago.1 Ago.2 Se
t. 1 Se t. 2 Ou t. 1 Ou t. 2 N o v .1 N o v .2 De z. 1 R e cu p e raç ão B ran q u e am e n to 0 10 20 30 40 50 60 70 80 90 100 De z. 2 Jan .1 Jan .2 Fe v .1 Fe v .2 Ma r.1 Ma r.2 Ab ri .1 Ab r.2 Ma i.1 Ma i.2 Ju n .1 Ju n .2 Ju l.1 Ju l.2
Ago.1 Ago.2 Se
ocorreu em função do aumento de temperatura, de acordo com o modelo de
regressão: -196,316 + 8,168*temperatura.
Millepora alcicornis
M. alcicornis exibiu dois momentos de branqueamento durante o período
(Figura 3.11). O primeiro ocorreu entre Janeiro e Março de 2011, quando a média
se elevou de 15% para cerca de 70% no início de Março recuperando até Junho, ou
seja, dois meses de branqueamento e três meses de recuperação (Figura 3.12). O
segundo momento consistiu de oscilações a partir de Julho com elevação da média
de cerca de 10%, atingindo 50% em Dezembro.
Figura 3.11: Diferenças entre as médias quinzenais de branqueamento de M. alcicornis nos recifes de Maracajaú. Cada ponto indica a diferença entre a média de branqueamento da quinzena correspondente e a média de branqueamento da quinzena anterior. Diferenças positivas indicam aumento da média de branqueamento (branqueamento) em relação à quinzena anterior. Diferenças negativas indicam diminuição da média de branqueamento (recuperação) em relação à quinzena anterior. Os valores do eixo vertical indicam a porcentagem de branqueamento ou recuperação da quinzena em relação à quinzena anterior.
Figura 3.12: Dinâmica de branqueamento de M. alcicornis nos recifes de Maracajaú entre Dezembro de 2010 e Dezembro de 2011 (Barras verticais representam o desvio padrão).
-25 -20 -15 -10 -5 0 5 10 15 20 25
1 3 5 7 9 11 13 15 17 19 21 23 25
R e cu p e raç ão B ran q u e am e n to 0 10 20 30 40 50 60 70 80 90 100 De z. 2 Jan .1 Jan .2 Fe v .1 Fe v .2 Ma r.1 Ma r.2 Ab ri .1 Ab r.2 Ma i.1 Ma i.2 Ju n .1 Ju n .2 Ju l.1 Ju l.2
Ago.1 Ago.2 Se
O time lag 0 apresentou o modelo que melhor explicou o branqueamento
observado por M. alcicornis, indicando que esta espécie exibiu resposta rápida ao
estímulo abiótico. Aproximadamente 36% (r2 =0,363) do branqueamento
observado foram relacionados à variação de temperatura, salinidade e
transparência horizontal, com correlação positiva para temperatura e
transparência horizontal e negativa para a salinidade, de acordo com o modelo de
regressão: -1, 256 + (0,068 * temperatura) + (- 0,015 * salinidade] + (0,016 *
transparência horizontal. A temperatura foi o parâmetro de maior influência na
elevação da média de branqueamento explicando 32% da variação (r2=0,325).
3.4 Ocorrência de Doenças e Mortalidade
Registrou-se mortalidade parcial de menos de 25% do diâmetro em 10 das
20 colônias de F. gravida monitoradas, o que foi relacionado com a diminuição da
temperatura e da salinidade (r2= 0,614; F= 16,710; p=0,000) em time lag 0 (Figura
3.13).
Figura 3.13: Frequência de ocorrência de mortalidade parcial das colônias de F. gravida. S (Saudável) - Colônias 100% saudáveis; PM1 (Parcialmente morta nível 1) – mortalidade em menos de 25% do diâmetro da colônia. 0 5 10 15 20 25 De z. 2 Jan .1 Jan .2 Fe v .1 Fe v .2 Ma r.1 Ma r.2 Ab r.1 Ab r.2 Ma i.1 Ma i.2 Ju n .1 Ju n .2 Ju l.1 Ju l.2
Ago.1 Ago.2 Se
As porções da colônia caracterizadas como mortas exibiram uma tênue
cobertura de areia com diminutos filamentos de algas (Figura 3.14).
Figura 3.14: Colônias de F. gravida monitoradas. (A-D) Mortalidade nível 1 (menos de 25% do diâmetro).
Cinco colônias de P. astreoides exibiram morte parcial em seu diâmetro até
o final do estudo: uma delas em mais de 50% do diâmetro (Figuras 3.14 e 3.15).
Não houve correlação entre a ocorrência entre mortalidade ou entre os fatores
abióticos mensurados e nem entre mortalidade e branqueamento em nenhum time
lag.
Figura 3.15: Frequência de ocorrência de mortalidade de colônias de P. astreoides monitoradas. S (Saudável) - Colônias 100% saudáveis; PM1 (Parcialmente morta nível 1); PM2 (Parcialmente morta nível 2); PM3 (Parcialmente morta nível 3).
0 2 4 6 8 10 12 14 16 18 20 De z. 2 Jan .1 Jan .2 Fe v .1 Fe v .2 Ma r.1 Ma r.2 Ab r.1 Ab r.2 Ma i.1 Ma i.2 Ju n .1 Ju n .2 Ju l.1 Ju l.2
Ago.1 Ago.2 Se
t.1 Se t. 2 Ou t. 1 Out .2 N o v .1 N o v .2 De z. 1 N ° d e c o lôn ias ( % ) Meses S PM1 PM2 PM3
A B
Figura 3.16: Colônias de P. astreoides monitoradas. (A) Colônia com mortalidade parcial nível 1 (menos de 25% da colônia afetada). (B) Colônia com mortalidade parcial nível 2 (de 25% a 50% afetada).
A incidência de infecções foi observada somente para S. stellata.
Registrou-se mortalidade nível 1 em cerca de 10 colônias (Figuras 3.17 e 3.18).
Figura 3.17: Frequência de ocorrência de mortalidade de colônias de S. stellata monitoradas. S (Saudável) - Colônias 100% saudáveis; PD (Parcialmente doente); D (Doente); PM1 (Parcialmente morta nível 1); PM3 (Parcialmente morta nível 3).
Uma colônia exibiu mortalidade nível 3 (mais de 50% do diâmetro), a qual
exibiu doença durante cerca de seis meses. A área doente foi gradativamente
substitída por cobertura de areia e filamentos de algas (Figura 3.18 B).
0 2 4 6 8 10 12 14 16 De z.2 Jan .1 Jan .2 Fe v .1 Fe v .2 Ma r.1 Ma r.2 Ab r.1 Ab r.2 Ma i.1 Mai .2 Ju n .1 Ju n .2 Ju l.1 Ju l.2
Ago.1 Ago.2 Se
t. 1 Se t. 2 Ou t. 1 Out .2 N o v .1 N o v .2 De z. 1 N º d e c o lô n ias Meses S PD D PM1 PM3
Figura 3.18: Colônias de S. stellata monitoradas. (A) Colônia com mortalidade parcial nível 1 (menos de
25% da colônia afetada). (B) Colônia com mortalidade parcial nível 3 ( mais de 50% afetada).
A incidência de doenças aumentou a partir de Junho (Figura 3.19). Dois
tipos de possíveis infecções foram registrados: o primeiro caracterizado por
manchas com coloração entre o roxo e o rosa, e o segundo caracterizado por
pontos pretos (Figura 3.20 A e B, respectivamente). A doença rósea ocorreu em
praticamente todo o perído de estudo apresentando maior incidência entre Março
e Maio (Figura 3.19). A ocorrênia de pontos pretos foi observada a partir de Junho.
Figura 3.19: Frequência de ocorrência de infecções nas colônias de S. stellata monitoradas. DR – Doença das manchas rosas; PP – Doença dos pontos pretos.
Figura 3.20: Colônias de S. stellata com dois tipos de infecção: (A) Doença rósea e (B) Doença dos pontos pretos.
O aumento da incidência de infecções foi correlacionado negativamente à
temperatura (r2=0,675; F=44,760; p=0,0000) em time lag 0, ou seja, a medida que
o valor da temperatura diminuiu a incidência de doenças aumentou. A análise
individual de doença indicou o aumento da ocorrência de ambas com a diminuição
dos valores de temperatura e salinidade (doença rósea: r2= 0,447; doença dos
pontos pretos: r2 = 0,575). O aumento da mortalidade parcial das colônias foi
relacionado ao aumento da incidência de doenças (r2= 0,720; F= 56, 934; p=0,000)
em time lag 0.
Registrou-se mortalidade parcial em 6 colônias de M. alcicornis. Uma delas
sofreu mortalidade nível 3 (mais de 50% do diâmetro) (Figuras 3.21 e 3.22). A
porcentagem de mortalidade registrada foi correlacionada negativamente com a
temperatura e a salinidade (r2 =0, 685; F= 22,785; P=0,000) em time lag 0. A
Foto:
L
ian
a
M
e
n
d
e
s
B
Foto:
I
z
a
b
e
l
S
o
u
z
Figura 3.21: Frequência de ocorrência de mortalidade de colônias de M. alcicornis monitoradas. S (Saudável) - Colônias 100% saudáveis; PM1 (Parcialmente morta nível 1); PM2 (Parcialmente morta nível 2.
Figura 3.22: Colônias de M. alcicornis monitoradas. (A) Mortalidade nível 1 (até 25 % do diâmetro) e (B) mortalidade nível 3 (mais de 50% do diâmetro).
De modo geral, P. astreoides foi a espécie com menor número de colônias
exibindo algum nível de mortalidade, seguida de M. alcicornis e S. stellata. No
entanto, observou-se que, em termos de percentagem da colônia afetada, F. gravida
exibiu mortalidade menor que as demais espécies uma vez que as colônias
apresentaram mortalidade em menos de 25%.
0 2 4 6 8 10 12 14 16 18 20 De z. 2 Jan .1 Jan .2 Fe v .1 Fe v .2 Ma r.1 Ma r.2 Ab r.1 Ab r.2 Ma i.1 Ma i.2 Ju n .1 Ju n .2 Ju l.1 Ju l.2
Ago.1 Ago.2 Se
t. 1 Se t. 2 Ou t. 1 Ou t. 2 N o v .1 N o v .2 De z. 1 N ° d e c o lô n ias Meses/Quinzena S PM1 PM2
A abundância de corais pétreos relatada neste estudo para os recifes de Maracajaú confere com o descrito por Ferreira & Maida (2006) a partir de amostragens realizadas em 2002 e 2003 pelo programa de monitoramento Reef Check Brasil. Rodríguez-Ramírez et al. (2008) mencionam que a cobertura de corais em recifes do nordeste brasileiro é de 1 a 29%, faixa que inclui a avaliação de cobertura de corais efetuada neste estudo. A principal espécie de coral construtor é Sideastra stellata que representou a maior parte da cobertura de corais duros na área, cenário descrito por Laborel (1970). Conclui-se que nos últimos dez anos a representatividade de corais no Parracho de Maracajaú não sofreu alterações significativas.
Entretanto, a representatividade de macroalgas e algas formadoras de tapetes alerta para as implicações ecológicas sugerindo a necessidade de monitoramento, uma vez que a proliferação desses organismos é apontada como uma tendência impactante para recifes de todo o mundo (Hughes, 1994). Algas da família Dictyotacea, por exemplo, competem com os corais pelo espaço (Beach et al. 2006) frequentemente crescendo como epífitas, além de dificultar o assentamento das larvas e o desenvolvimento dos recrutas (McCooket et al. 2001; Maypa et al. 2000).
Duas situações são apontadas como eventos chave no aumento da densidade de algas em recifes costeiros, a diminuição da herbivoria em decorrência da pressão de pesca (McCooket et al. 2001) e o aumento do input de nutrientes no ambiente marinho (Bouiadjra et al. 2010). Mesmo não havendo pesquisas recentes que mostrem declínio na ictiofauna de Maracajaú nas últimas décadas, os impactos identificados na área são relacionados à pesca e à atividade turística (Ferreira &
Parte
4
Maida, 2006). Sobre isto, o recente plano de manejo elaborado aponta a crescente pressão de pesca sobre peixes escarídeos na área da APARC ressaltando a urgência de manejo e monitoramento da pesca, uma vez que os escarídeos são a chave do controle sobre o crescimento das algas (ONG Oceânica, 2012). O aumento do input de nutrientes em épocas chuvosas, nesse caso pela proximidade com o rio Maxanguape (Marcelino & Amaral, 2003), também é um parâmetro carente de monitoramento na área.
A alta representatividade de cobertura de algas formadoras de tapetes é desfavorável ao crescimento dos corais, entre outras razões, por esse agrupamento aprisionar quantidades significativas de sedimento (Purcell, 2000), constituindo uma capa sufocante que recobre os corais (Fabricius, 2005), além de ser inapropriada para o assentamento de larvas e o desenvolvimento de recrutas (Birrel et al, 2008). Apesar disso, a percentagem da cobertura de corais apresentada neste estudo (entre 15% e 25%, conforme os métodos) é consideravelmente alta dentro da faixa mencionada por Rodríguez-Ramirez et al. (2008). Leujak & Ormond (2007) também mostraram que o método de quadrante (1m2) registrou uma percentagem
de corais cerca de 10% menor quando comparado ao método de transecção linear de pontos para amostragens realizadas em recifes do Mar Vermelho.