ESTUDO DA EXTRAÇÃO DE CROMO HEXAVALENTE, PELA
TÉCNICA DE MEMBRANAS LÍQUIDAS SURFATANTES,
VISANDO O TRATAMENTO DE EFLUENTES LÍQUIDOS DE
CURTUMES
72° Dissertação de Mestrado apresentada ao Programa de Pós-Graduação em Engenharia Química da
Universidade Federal de Minas Gerais
Orientadora: Profª. Drª. Tânia Lúcia Santos Miranda
U
NIVERSIDADEF
EDERALD
EM
INASG
ERAISC
URSOD
EP
ÓS-G
RADUAÇÃOE
ME
NGENHARIAQ
UÍMICAESTUDO DA EXTRAÇÃO DE CROMO HEXAVALENTE, PELA
TÉCNICA DE MEMBRANAS LÍQUIDAS SURFATANTES, VISANDO
O TRATAMENTO DE EFLUENTES LÍQUIDOS DE CURTUMES
Autor: Vinicius Bayer
Orientadora: Profª. Drª. Tânia Lúcia Santos Miranda
72° Dissertação de Mestrado apresentada ao Programa de Pós-Graduação em Engenharia Química como parte dos
Requisitos exigidos para a obtenção do título de MESTRE EM ENGENHARIA QUÍMICA
Nada neste mundo pode substituir a persistência:
! Nem o talento - pois nada é mais
comum do que talentos fracassados;
! Nem a genialidade - pois o gênio
AGRADECIMENTOS
Agradeço a todos que tornaram este trabalho possível, que me apoiaram e incentivaram, e especialmente:
# Aos meus pais, Walmir Fernando Bayer e Carmem Regina Cavalheiro, aos quais
amo muito, pelo amor e por nunca medirem esforços para possibilitar o meu acesso a educação e ao conhecimento;
# À todos meus familiares, pelo apoio e incentivo constante em todas as etapas desse
trabalho;
# À minha namorada, Lisiane da Cruz Luz, pelo amor, carinho, companheirismo,
incentivo e paciência durante todos estes anos;
# À minha orientadora, Profª. Tânia Lúcia Santos Miranda, pela experiência,
dedicação, paciência, compreensão e amizade;
# À Profª. Adriane Salum, pelo grande apoio e sugestões ao longo do trabalho; # À Cibele Konzen, pelas sugestões valiosas sempre oferecidas tão prontamente;
# Aos professores do DEQ/UFMG que ministraram as disciplinas da Pós-Graduação
que, de uma maneira ou de outra, contribuíram para a realização desta pesquisa;
# Aos meus colegas de Mestrado, verdadeiros amigos que me incentivaram e tornaram
# Aos técnicos do laboratório de análises químicas, Alexandre e Fabiano, pela
disponibilidade nas análises de espectrofotometria de absorção atômica;
# Ao aluno de iniciação científica Leandro, pela ajuda e pela vontade na parte
experimental desse trabalho;
# À CAPES e ao CNPq, pelo apoio financeiro na concessão das bolsas;
# À Deus, pelo dom da vida e por ter me dado forças para superar os desafios na hora
em que precisei;
# À todas as pessoas que não foram citadas, mas que direta ou indiretamente
RESUMO
ABSTRACT
SUMÁRIO
LISTA DE FIGURAS...VI
LISTA DE TABELAS... ...IX
NOMENCLATURA...X
1. INTRODUÇÃO... 1
2. OBJETIVOS... 5
2.1 OBJETIVO GERAL...5
2.1.1 OBJETIVOS ESPECÍFICOS...5
3. REVISÃO BIBLIOGRÁFICA... 6
3.1 O COURO...6
3.2 CROMO...10
3.3 INDÚSTRIA DO COURO...13
3.4 SITUAÇÃO ATUAL DO MERCADO COUREIRO NO BRASIL...15
3.5 PROCESSO PRODUTIVO DE COURO...20
3.5.1 OPERAÇÕES DE RIBEIRA...23
3.5.2 OPERAÇÕES DE CURTIMENTO...25
3.6 CARACTERIZAÇÃO DOS RESÍDUOS LÍQUIDOS GERADOS NO PROCESSO INDUSTRIAL..27
3.7 PROCESSOS DE SEPARAÇÃO UTILIZADOS PARA TRATAMENTO DE EFLUENTES INDUSTRIAIS...32
3.7.1 PRECIPITAÇÃO...32
3.7.2 EXTRAÇÃO LÍQUIDO – LÍQUIDO...34
3.7.3 PROCESSOS DE SEPARAÇÃO POR MEMBRANAS...36
3.7.4 MEMBRANAS LÍQUIDAS SURFATANTES (M.L.S)...38
3.9 ETAPAS DO PROCESSO DE SEPARAÇÃO POR M.L.S...41
3.9.1 EMULSIFICAÇÃO...41
3.9.2 PERMEAÇÃO...44
3.9.3 SEDIMENTAÇÃO...45
3.9.4 DESEMULSIFICAÇÃO...45
3.10 MECANISMOS DE PERMEAÇÃO...47
3.11 PROBLEMAS ASSOCIADOS À TÉCNICA M.L.S...54
3.12 TIPOS DE EXTRATANTES USADOS NA EXTRAÇÃO DE METAIS...56
3.13 SELEÇÃO DO EXTRATANTE...59
4. METODOLOGIA... 65
4.1 DEFINIÇÃO DA FASE MEMBRANA...65
4.2 PROCEDIMENTO EXPERIMENTAL...66
4.3 PARÂMETROS INVESTIGADOS...70
4.3.1 ENSAIOS PRELIMINARES...70
4.3.2 ENSAIOS DEFINITIVOS...74
4.4 MATERIAIS E REAGENTES UTILIZADOS...75
4.5 METODOLOGIA ANALÍTICA...77
4.6 ENSAIOS DE VISCOSIDADE...77
5. RESULTADOS E DISCUSSÃO...78
5.1 PROPORÇÃO DE FASES...78
5.2 INFLUÊNCIA DA UTILIZAÇÃO DE UM AGENTE MODIFICADOR NA FASE MEMBRANA PARA AVALIAR O TEMPO DE QUEBRA DA EMULSÃO PRIMÁRIA...82
5.3 INFLUÊNCIA DA CONCENTRAÇÃO DE EXTRATANTE SOBRE O PERCENTUAL DE EXTRAÇÃO DE CR6+...85
5.4 INFLUÊNCIA DA CONCENTRAÇÃO DE SURFATANTE SOBRE O PERCENTUAL DE EXTRAÇÃO DE CR6+...89
5.5 INFLUÊNCIA DA TEMPERATURA SOBRE O PERCENTUAL DE EXTRAÇÃO DE CR6+...92
5.7 INFLUÊNCIA DO TEMPO DE CONTACTAÇÃO NA ETAPA DE PERMEAÇÃO SOBRE O
PERCENTUAL DE EXTRAÇÃO DE CR6+...102
5.8 REPRODUTIBILIDADE DOS ENSAIOS OBTIDOS COM A CONDIÇÃO SATISFATÓRIA DE EXTRAÇÃO...105
5.9 INFLUÊNCIA DA REUTILIZAÇÃO (RECICLO) DA FASE MEMBRANA CARREGADA SOBRE O PERCENTUAL DE EXTRAÇÃO DE CR6+...107
5.10 AVALIAÇÃO DA OPERAÇÃO EM 02 ESTÁGIOS SOBRE O PERCENTUAL DE EXTRAÇÃO DE CR6+...109
6. CONCLUSÕES... 111
7. SUGESTÕES PARA TRABALHOS FUTUROS... 113
8. REFERÊNCIAS BIBLIOGRÁFICAS...114
A. ANEXOS...121
A.1 DADOS EXPERIMENTAIS...122
LISTA DE FIGURAS
Figura 3.1 – Distribuição geográfica do número de curtumes nas diferentes regiões do
Brasil...15
Figura 3.2 – Estágios de transformação da pele em couro...21
Figura 3.3 - Fluxograma simplificado do processo produtivo da indústria do couro... 22
Figura 3.4 - Processo de curtimento... 26
Figura 3.5 - Esquema da separação de espécies metálicas por extração líquido-líquido...34
Figura 3.6 - Representação esquemática das fases do sistema M.L.S em um glóbulo de emulsão múltipla A/O/A... 40
Figura 3.7 - Etapas do processo de extração pela técnica M.L.S...43
Figura 3.8 - Preparação da emulsão múltipla... 44
Figura 3.9 - Perfil de concentração através de uma membrana líquida plana...48
Figura 3.10 - Transporte facilitado simples...50
Figura 3.11 - Transporte facilitado simples com reação química...51
Figura 3.12 - Co-transporte... 51
Figura 3.13 - Contra-transporte... 52
Figura 3.14 - Mecanismo de extração de íons dicromato por co-transporte, utilizando NaOH como reagente de fase interna... 53
Figura 4.1 - Representação esquemática da etapa de permeação e das características do reator de extração...67
Figura 4.2 - Representação esquemática do processo M.L.S... 69
Figura 4.3 - Estrutura molecular do TOA...75
Figura 5.2 - Concentração de 1-Decanol utilizada em função do tempo de coalescência da emulsão...83 Figura 5.3 - a) sistema sem utilização de Decanol; b) sistema com a presença de 1-decanol...84 Figura 5.4 – Concentração de extratante TOA com relação a % de extração de cromo e concentração final do refinado (p.p.m)... 86 Figura 5.5 – pH final das fases interna e externa, após extração de cromo, em função da
concentração de extratante...87 Figura 5.6 – Concentração de extratante utilizada em função do tempo de coalescência da emulsão primária carregada... 88 Figura 5.7 – % extração de cromo na fase externa e concentração final de Cr6+ (p.p.m) na fase externa em função da concentração de surfatante utilizada... 89 Figura 5.8 – Influência da concentração de surfatante ECA 4360 sobre o tempo de
coalescência da emulsão primária carregada... 90 Figura 5.9 – % extração de cromo (VI) em função da temperatura...93 Figura 5.10 – % extração de cromo (VI) em função do tempo de contactação na etapa de
permeação e da temperatura...94 Figura 5.11 – % extração de cromo (VI) em função do pH... 96 Figura 5.12 – % extração de cromo (VI) em função do pH para valores superiores a
3...98 Figura 5.13 – pH da fase externa inicial em função do pH da fase externa final... 99 Figura 5.14 – pH da fase externa inicial em função da concentração final de cromo no refinado (p.p.m)... 100 Figura 5.15 – pH da fase externa inicial em função do tempo de coalescência da
emulsão primaria carregada... 101 Figura 5.16 – % extração de cromo (VI) e da concentração final de Cr6+ na fase externa
LISTA DE TABELAS
Tabela 3.1 - Mercado mundial de couro bovino... 16 Tabela 3.2 - Evolução prevista do rebanho Brasileiro...17 Tabela 3.3 - Exportações de couro bovino – janeiro a junho de 2004... 19 Tabela 3.4 - Exportações Brasileiras de couro bovino Wet Blue – janeiro a junho de
2004...19 Tabela 3.5 - Caracterização de efluente sem reciclagem... 27 Tabela 3.6 – Parâmetros médios encontrados nas características de resíduos de curtumes que processam curtimento ao cromo e reciclam os banhos de caleiro e curtimento...28 Tabela 3.7 - Variação normalmente encontrada nas características de resíduos de
curtumes...28 Tabela 3.8 - Valores máximos admissíveis de metais... 30 Tabela 4.1 - Condições pré-fixadas utilizadas nos testes para determinação da proporção de fases...71 Tabela 4.2 – Variáveis avaliadas nos ensaios preliminares e seus respectivos níveis...72 Tabela 4.3 – Demais variáveis avaliadas nos ensaios subseqüentes e seus respectivos
níveis...74 Tabela 5.1 – Resultados obtidos de extração utilizando-se diferentes proporções de
fases...78 Tabela 5.2 – Relação entre as quantidades (g) do reagente de fase interna - NaOH
NOMENCLATURA
ABNT: Associação Brasileira de Normas Técnicas
ABQTIC: Associação Brasileira de Químicos e Técnicos da Indústria do Couro AICSUL: Associação das Indústrias de Curtumes do Rio Grande do Sul
BNDES: Banco de Desenvolvimento do Extremo Sul C: Concentração
CICB: Centro das Indústrias de Curtumes do Brasil CONAMA: Conselho Nacional de Meio Ambiente CNPC: Conselho Nacional de Pecuária de Corte Cr (III): Cromo na valência 3+
Cr (VI): Cromo na valência 6+
Emulsão múltipla A/O/A: Fases externa e interna aquosas, e fase membrana orgânica Emulsão A/O: Emulsão em que a fase aquosa encontra-se dispersada em fase orgânica Emulsão múltipla O/A/O: Fases externa e interna orgânicas, e fase membrana aquosa Emulsão O/A: Emulsão em que a fase orgânica encontra-se dispersada em fase aquosa F.E: Fase Externa ou de Alimentação
F.I: Fase Interna ou Receptora F.M: Fase Membrana
SINDIPELES: Sindicato das Indústrias de Curtimento de Couros e Peles no Estado de Minas Gerais
Índices I: Fase interna III: Fase externa a: Fase aquosa f: Final
i: Inicial
1. INTRODUÇÃO
Questões relativas ao meio ambiente e ao bem estar social tornam-se cada vez mais relevantes para o ser humano, isto pode ser constatado através do desenvolvimento de tecnologias para o processamento e tratamento de resíduos, provando a conscientização da importância de evitar, reciclar, diminuir, ou eliminar substâncias que produzem efeitos tóxicos sobre o homem e o meio ambiente.
As indústrias de couro produzem resíduos contaminados com o metal pesado cromo, resultantes das atividades de curtimento e pré-tratamento de couros. Essa problemática decorre da freqüente e necessária utilização de compostos de cromo, visando a melhoria da qualidade do couro.
O setor couro é de extrema importância na economia brasileira, tanto pelo volume de exportações como pela geração de empregos. O Brasil possui o maior rebanho bovino comercializável do mundo, em torno de 195,5 milhões de cabeças anuais (IBGE, 2004), sendo abatidas anualmente cerca de 35 milhões de cabeças de gado (Revista Couro Business, 2004), além de ser um dos maiores parques produtivos em frigoríficos e curtumes.
Segundo o Banco de Desenvolvimento do Extremo Sul (BNDES), nas variáveis geração de emprego e crescimento econômico, o setor ocupa o quarto lugar, sendo responsável pela geração de aproximadamente 700 mil empregos diretos e indiretos (RUPPENTHAL, 2001). O Brasil também está entre os cinco maiores produtores e exportadores de calçados do mundo, ao lado da China, Indonésia e Itália.
O processo de curtimento envolve a transformação de pele animal, putrescível em pouco tempo, em um produto final com uma grande durabilidade, denominado couro. Para que esta transformação ocorra, é necessária a utilização de produtos químicos, denominados agentes curtentes, para realizar o processamento da pele em couro, conferindo-lhe, assim, uma elevada estabilidade.
Porém, as indústrias desse setor obtiveram uma imagem negativa para com a sociedade nos últimos anos, no que diz respeito à poluição ambiental. A exigência de uma postura ambiental das empresas é comprovada através da crescente hostilidade de mercados internacionais aos produtos que não satisfazem aos padrões ambientais estabelecidos. É fato indiscutível o advento de medidas legais restritivas, cada vez mais severas, contra produtos contaminados ou provenientes de países que não cuidam adequadamente de seu meio ambiente.
O principal agente poluidor nos curtumes é o cromo, empregado como agente curtente em cerca de 90% das indústrias do setor, sendo que os outros 10% utilizam curtimento vegetal. Geralmente, o cromo é utilizado na forma de sulfato básico de cromo (Cr(OH)SO4), tendo como principal função, acelerar o processo de curtimento, além de reduzir o inchamento do couro em água.
A substituição do cromo no processo de curtimento já foi exaustivamente testada. Até hoje, no entanto, não se desenvolveu nenhuma alternativa de curtimento que se igualasse à sua eficiência de desempenho e de custos (RUPPENTHAL, 2001).
Somente cerca de 60% do cromo é utilizado no processo de curtimento, restando cerca de 40% de cromo não reagido, que é, então, descartado juntamente com os resíduos líquidos, acarretando problemas sérios para sua deposição (ARAVINDHAN et al., 2004).
Quimicamente, o curtimento com cromo consiste na interligação das moléculas de colágeno, principal componente do couro, através dos grupos hidroxila mediante compostos de cromo (III), formando uma camada protetora a qual previne a penetração de água nos poros do couro, evitando sua putrefação (FABIANI et al., 1996).
Os estados de oxidação do cromo variam de -2 à +6, sendo que os estados mais comumente encontrados no meio ambiente são os estados trivalente (+3) e hexavalente (+6) (COTTON, 1988). Em sua forma trivalente, o cromo aparentemente não é tóxico, além de ser essencial como nutriente para os seres humanos (KELLER et al., 1997). Porém, na valência +6, o cromo é altamente cancerígeno e mutagênico (GOCHFELD, 1991).
Na forma de sulfato básico de cromo, o metal se encontra no estado de oxidação +3, considerada sua forma mais estável, apresentando baixa solubilidade em água e mobilidade com o aumento de pH, devido à formação de Cr(OH)3. Portanto sua deposição não implicaria em maiores riscos ambientais. Porém, ao longo do processo, o seu acúmulo constante, associado a determinadas condições de solo, como a presença de manganês em formas oxidadas (Mn3+ e Mn4+), baixos teores de carbono orgânico e boa aeração, podem promover a sua oxidação para a forma hexavalente (Cr6+), de alta solubilidade e mobilidade, com características tóxicas e mutagênicas para os animais superiores, plantas e microorganismos.
Vários métodos físico-químicos têm sido utilizados para a remoção e recuperação de cromo hexavalente. Dentre estes, a extração líquido-líquido, troca-iônica, adsorção, precipitação/filtração, oxidação/redução e separação por membranas são os mais usuais.
Em particular, o estudo de separação por membranas merece uma atenção especial devido ao fato de apresentar alta capacidade de extração juntamente com uma grande seletividade. Os dois tipos mais comuns de membranas líquidas são membranas líquidas suportadas, formadas por uma matriz polimérica, e membranas líquidas surfatantes (M.L.S).
A técnica M.L.S consiste em uma poderosa ferramenta em processos de separação, pois permite que o soluto extraído seja altamente concentrado na fase receptora. Tem sido aplicada em uma variedade de processos de separação, incluindo remoção de contaminantes a partir de resíduos industriais, fracionamento de hidrocarbonetos, em áreas biomédicas e recuperação e purificação de metais pesados de soluções aquosas (DATTA e BHOWAL, 2001).
Desde sua invenção por LI (1968), a técnica M.L.S tem sido considerada um avanço em relação à extração por solvente para separação e concentração de metais. Essa técnica é baseada no princípio de emulsões múltiplas. Inicialmente, a solução de re-extração, conhecida também como fase interna ou receptora, e a fase membrana são misturadas para formar a denominada emulsão primária. Esta é, então, dispersada em uma fase externa também chamada de fase de alimentação ou fase doadora, solução contendo o(s) soluto(s) a ser(em) extraído(s), formando uma emulsão múltipla.
2. OBJETIVOS
2.1 Objetivo Geral
Estudo da extração de Cr6+ a partir de soluções sintéticas de dicromato de potássio, pela técnica de membranas líquidas surfatantes, utilizando-se como extratante a amina terciária tri-n-octilamina (TOA) e o reagente de fase interna hidróxido de sódio (NaOH), visando a redução da concentração dessa espécie em efluentes líquidos provenientes de indústrias de processamento de couro.
2.1.1 Objetivos Específicos
• Definição do sistema de extração e da proporção entre as fases do sistema M.L.S;
3. REVISÃO BIBLIOGRÁFICA
3.1 O Couro
Entende-se por couro natural, todas as peles animais que tenham sido tratadas por processo químico chamado curtimento e cujas fibras de sua estrutura foram modificadas com auxílio de produtos químicos naturais ou sintéticos, chamados curtentes.
O couro verdadeiro é um produto natural. Respira, é quente, durável e tem características individuais que fazem com que cada couro seja diferente. O couro sempre manterá as marcas se sua origem natural e essas características podem se mostrar como arranhões, marcas de crescimento, áreas de diferentes densidades de fibra e estrutura de poro de cabelo.
O processo de curtimento do couro pode ser realizado por agentes curtentes inorgânicos ou orgânicos. Dentre os curtentes orgânicos, destaca-se o uso dos extratos tanantes vegetais, sendo os mais comumente utilizados: extrato de quebracho (Argentina e Paraguai), extrato de castanheiro (França e Itália) e extrato de acácia negra, muito comum na África do Sul e Brasil. Ainda dentro dos curtentes orgânicos, destacam-se os curtentes sintéticos, fenólicos, naftênicos, acrilatos e glutaraldeído.
Dentre os produtos inorgânicos, os sais de zircônio, sais de alumínio e sais de ferro podem ser empregados como agentes curtentes. Porém, os sais de cromo ocupam lugar de destaque entre os curtentes.
As principais características do cromo como agente curtente são conferir uma elevada estabilidade hidrotérmica ao couro, ou seja, reduzir a capacidade de inchar em água, manter o couro flexível e leve, além de reduzir o tempo de curtimento.
A crescente preocupação do setor de processamento de couro, mais precisamente das indústrias que produzem couro curtido ao cromo, juntamente com a cadeia subseqüente, formada por indústrias de calçados e confecções, em adequar-se às normas internacionais de gestão ambiental, tal como a série ISO 14000, vem estimulando a realização de diversos trabalhos com a finalidade de promover uma destinação adequada aos resíduos sólidos considerados perigosos em função da presença de compostos de cromo.
Vários trabalhos realizados seguindo a orientação aceita de tratamento de resíduos perigosos de cromo indicam, em ordem de preferência, a não geração desses resíduos de cromo nos mesmos ou a diminuição do cromo; a reciclagem dos resíduos ou o reaproveitamento do cromo em outros processos; o tratamento físico, químico ou biológico dos resíduos para sua inertização e, por último, a sua deposição em aterros.
Esta última opção, mais utilizada no Brasil em função das dificuldades de garantia de estanqueidade dos mesmos, encontra-se em processo de desativação total pela comunidade européia desde 2002. No Brasil, a opção por aterros convenientemente licenciados pelo órgão ambiental é utilizada para evitar a deposição dos resíduos em áreas inadequadas, enquanto na União Européia a alternativa tem sido a incineração.
Como o cromo +3 é largamente empregado em processos industriais de curtimento de couro e galvanoplastia, nos quais, boa parte das quantidades usadas evade-se como resíduo, cuidados especiais são necessários tanto na manipulação durante o processo industrial como no tratamento dos resíduos.
Os resíduos não convenientemente tratados e simplesmente abandonados em corpos d’água, aterros industriais ou mesmo lixeiras clandestinas possuem alto poder de contaminação. Com facilidade, o cromo atinge o lençol freático ou mesmo reservatórios ou rios que são as fontes de abastecimento de água de cidades.
Se o resíduo é degradado no solo, o cromo permanece e pode ser absorvido por plantas, que, posteriormente, poderão servir de alimento ao homem ou aos animais. Ao atingir o ser humano, apresenta manifestações iniciais discretas, facilmente confundidas com doenças comuns, como enjôo, dor de cabeça, náusea e indisposições. A médio e longo prazo, surgem doenças graves devido ao acúmulo de cromo no organismo, como tumores, quase sempre irreversíveis (Revista Tecnicouro, 2003).
Em serpentinitos, as concentrações de cromo costumam ser maiores. O cromo antropogênico é introduzido ao meio ambiente tanto como resíduo da produção (indústria química, galvanização, curtumes) como em produtos descartados (roupas, sapatos, outros produtos tingidos com pigmentos de cromo, madeira tratada).
Compostos de cromo também são usados na construção (tintas), impressão (processos de reprodução fotomecânicos), fósforos e fogos artificiais, fitas cassete e em algumas memórias magnéticas em computadores. Sais de cromo também são utilizados como anticorrosivos e algicidas.
3.2 Cromo
O cromo é um metal branco, cristalino e não consideravelmente dúctil ou maleável. Possui massa molar de 51,996 g/mol e funde em torno de 1.765 °C. O metal é solúvel em ácido clorídrico diluído ou concentrado. Na ausência de ar, formam-se íons cromo (II):
2 2 2H Cr H
Cr+ +→ ++ (3.1)
2 2
2
2HCl Cr Cl H
Cr+ → ++ −+ (3.2)
Na presença do oxigênio atmosférico, o cromo é parcial ou completamente oxidado ao estado trivalente:
O H Cr
H O
Cr2 2 4 4 3 2 2
4 + + + +→ ++ (3.3)
Em soluções aquosas, o cromo forma quatro tipos de íons: os cátions cromo (II) e (III) e os ânions cromato (CrO4)- e dicromato (Cr2O7)2-, no qual o cromo tem um estado de oxidação +6. Os íons Cr2+ são derivados do óxido de cromo (II) CrO. Esses íons formam soluções de cor azul. Os íons cromo (II) são muito instáveis, já que são fortes agentes redutores – eles decompõem mesmo a água, lentamente, com a formação de hidrogênio. O oxigênio atmosférico oxida-os facilmente a íons cromo (III).
Nos ânions cromato (CrO4)2- ou dicromato (Cr2O7)2-, o cromo é hexavalente com um estado de oxidação +6. Esses íons são derivados do trióxido de cromo, CrO3. Os íons cromato são amarelos, enquanto os dicromatos têm uma cor laranja. Os cromatos são facilmente transformados em dicromatos por adição de ácido:
O H O Cr H
CrO42 2 2 72 2
2 −+ +←→ −+ (3.4)
A reação é reversível. Em soluções neutras (ou alcalinas), o íon cromato é estável, enquanto, em soluções ácidas, os íons dicromato serão predominantes. Os íons cromato e dicromato são fortes agentes oxidantes (VOGEL, 1981).
O cromo trivalente (Cr3+) é essencial do ponto de vista nutricional. Não é tóxico, sendo pouco absorvido no organismo. Já o cromo hexavalente (Cr6+) é altamente tóxico, afetando seriamente os rins e o sistema respiratório. Embora não esteja claramente definido o nível de “não-efeito” do Cr3+, outros estudos sugerem que a ingestão máxima de 0,5 mg/L evitaria riscos à saúde (Revista Tecnicouro, 2003).
O cromo é um elemento essencial para a vida animal. A deficiência de cromo pode ocorrer em casos extremos em seres humanos (KELLER et al., 1997). Diversas doenças têm sido associadas com uma deficiência de cromo: certas formas de diabete, arteriosclerose, problemas do crescimento, catarata ocular e menor tolerância à glicose.
Considera-se que o cromo na sua forma hexavalente é entre 100 e 1000 vezes mais tóxico que no estado de oxidação trivalente. A dose fatal para seres humanos é 0,5 – 1,0 g de dicromato de potássio (K2Cr2O7). A absorção através da pele pode ser importante.
3.3 Indústria do Couro
A arte de curtir couros é bem antiga. Nossos antepassados retiravam as peles dos animais e colocavam em contato com cascas de árvores durante um longo período a fim de torná-las imputrescíveis. Com o passar do tempo, essa técnica foi sendo aperfeiçoada e o material curtente contido nas cascas de árvores, tanino, passou a ser industrializado, sendo o primeiro material curtente utilizado largamente.
Por um bom período, os couros foram curtidos apenas ao tanino, existindo ainda, curtumes que utilizam o tanino como curtente. É um material orgânico natural, de mais fácil manejo no que se refere à poluição ambiental. Porém as características conferidas ao couro curtido ao tanino não estavam atendendo às exigências do mercado (ROSA, 2003).
A necessidade de um couro mais flexível, mais macio, com maior resistência à temperatura e com menor tempo de processo forçou a indústria a desenvolver novos processos de curtimento. A partir de então, a indústria começou a desenvolver o curtimento ao cromo, um material curtente a base de produtos químicos como dicromato de potássio (K2Cr2O7) e o dicromato de sódio (Na2Cr2O7 . 2H2O), onde o cromo hexavalente era reduzido a cromo trivalente no próprio curtume, pois somente nesta valência o cromo tem poder curtente. Essa técnica oferecia risco ambiental uma vez que poderia sobrar na reação um residual de cromo hexavalente. Hoje existem no mercado produtos comerciais à base de trióxido de cromo (Cr2O3), ou seja, somente cromo trivalente.
Os mais comuns são curtumes de peles bovinas, pela maior facilidade de aquisição da matéria-prima e boas características conferidas aos couros vacuns para a posterior fabricação dos diversos artigos, como tamanho, resistência, espessura, etc.
Os curtumes podem ser caracterizados de acordo com sua etapa de processamento de couro:
• Curtume de Wet Blue: desenvolve o primeiro processamento de couro, qual seja, logo após o abate, o couro salgado ou em sangue é despelado, graxas e gorduras são removidas (etapa denominada depilação e caleiro) e há o primeiro banho de cromo e o couro passa a exibir um tom azulado e molhado, daí o nome wet blue.
• Curtume Integrado: realiza todas as operações, processando desde o couro cru até o couro acabado.
• Curtume de Semi-Acabado: utiliza como matéria-prima o couro wet blue e o transforma em couro crust (semi-acabado).
• Curtume de Acabamento: transforma o couro crust em couro acabado.
Os couros cru, wet-blue e semi-acabado podem ser considerados como bens do tipo
3.4 Situação Atual do Mercado Coureiro no Brasil
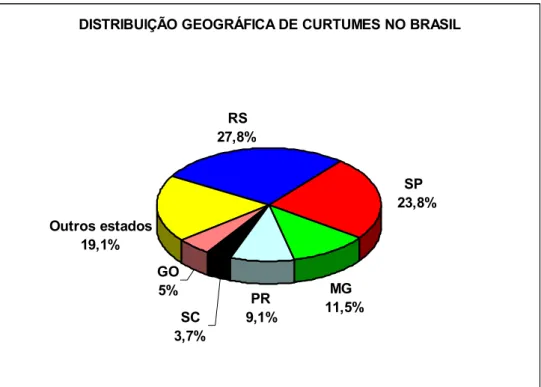
Na Figura 3.1 é apresentada a distribuição geográfica dos curtumes no Brasil. Observa-se que, a maioria dos curtumes concentra-Observa-se nas regiões Sul (40,6 %) e Sudeste (35,3 %). Essas duas regiões juntas assumem papel de destaque na indústria coureira, uma vez que detêm 75,9 % dos curtumes do Brasil. Na região Sul, o estado do Rio Grande do Sul possui aproximadamente 220 curtumes (AICSUL, 2004). Na região Sudeste, o estado de São Paulo possui a maior quantidade de curtumes desta região, com cerca de 191 curtumes, enquanto que o estado de Minas Gerais possui cerca de 91 curtumes (SINDIPELES, 2004).
DISTRIBUIÇÃO GEOGRÁFICA DE CURTUMES NO BRASIL
RS 27,8%
SP 23,8%
Outros estados 19,1%
MG 11,5% PR
9,1% SC
3,7% GO 5%
O Brasil é um dos principais países produtores de carne bovina, e seu rebanho tem evoluído, contínua e positivamente, tendo passado de 11,13% (participação no rebanho mundial), em 2001, para 11,59%, em 2003. Segundo o IBGE, no final de 2004, o rebanho bovino brasileiro ultrapassou o número de habitantes, com cerca de 195 milhões de cabeças. Enquanto o rebanho brasileiro cresce e se expande territorialmente, o mundial se mantém estável ao redor de 1,5 bilhão de cabeças, como apresentado na Tabela 3.1.
Tabela 3.1 – Mercado mundial de couro bovino
Indicador 2001 2002 2003
*Rebanho bovino mundial 1.519,88 1.526,71 1.532,17 *Rebanho bovino brasileiro 169,10 173,30 177,60
Rebanho Brasil/Mundo (%) 11,13 11,35 11,59
**Produção de couro mundial 323,29 327,44 329,75 **Produção brasileira de couros 33,50 34,50 35,50 Produção de Couro Brasil/Mundo (%) 10,36 10,54 10,77 * Milhões de cabeças
** Milhões de couros
Fonte: Revista Couro Business, 2004
O maior número de cabeças de gado está na região Centro-Oeste (cerca de 35% do rebanho total). A região Sudeste possui o segundo maior rebanho, com 33.500 mil cabeças (23% do total), que vem declinando ano a ano. As regiões que apresentaram aumento no número de seu rebanho no período que vai de 1989 a 1998 foram o Norte e o Centro-Oeste, alcançando taxas de crescimento acumuladas de 21% e 11%, respectivamente, naquele período.
A região Sul, que detém o terceiro maior rebanho (16% do total), vem perdendo participação no total nacional. Em 2000, o rebanho dos Estados de Minas Gerais, Mato Grosso, Goiás e Mato Grosso do Sul, totalizou 70,7 milhões de cabeças, quase a metade do rebanho brasileiro.
Tabela 3.2 – Evolução prevista do rebanho Brasileiro
FONTE: CNPC - 1999
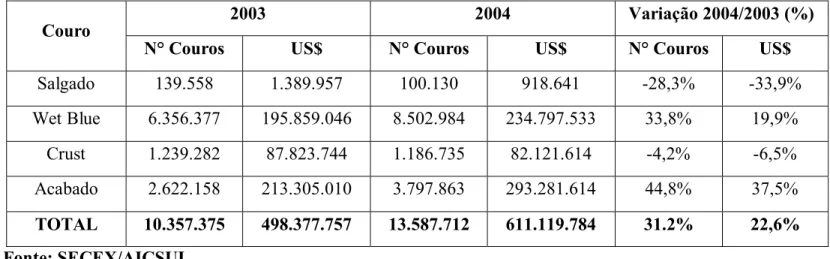
As exportações totais brasileiras atingiram o valor de US$ 43,3 bilhões no primeiro semestre de 2004, apresentando aumento de 31,2% em relação ao mesmo período no ano anterior 2003.
Considerando apenas as exportações de couro bovino, os couros Wet Blue e acabados apresentaram significativo aumento nas exportações em relação ao mesmo período de 2003. As exportações de couro acabado apresentaram, no primeiro semestre de 2004, aumento de 44,8% (em volume) e de 37,5% (em valor).
Tabela 3.3 – Exportações de Couro Bovino – Janeiro a Junho de 2004
2003 2004 Variação 2004/2003 (%)
Couro
N° Couros US$ N° Couros US$ N° Couros US$
Salgado 139.558 1.389.957 100.130 918.641 -28,3% -33,9%
Wet Blue 6.356.377 195.859.046 8.502.984 234.797.533 33,8% 19,9%
Crust 1.239.282 87.823.744 1.186.735 82.121.614 -4,2% -6,5%
Acabado 2.622.158 213.305.010 3.797.863 293.281.614 44,8% 37,5%
TOTAL 10.357.375 498.377.757 13.587.712 611.119.784 31.2% 22,6%
Fonte: SECEX/AICSUL
Tabela 3.4 – Exportações Brasileiras de Couro Bovino Wet Blue – Janeiro a Junho de 2004
2003 2004 País
Número US$ Número US$
Itália 7.205.284 108.915.345 8.209.463 115.071.393
China 901.797 13.429.617 2.971.817 41.859.297
Hong Kong 1.569.167 23.821.822 2.080.493 31.420.361
Taiwan 394.039 6.232.002 746.698 11.777.385
3.5 Processo Produtivo de Couro
O processamento de peles em couros é composto de uma série de etapas físicas, químicas e mecânicas. Durante cada etapa são gerados diversos tipos de resíduos (gasosos, líquidos e sólidos) a serem tratados e dispostos de acordo com a legislação. De acordo com CLAAS e MAIA (1994), a transformação das peles em couro pode ser resumida em quatro etapas principais:
• A conservação das peles: para evitar a autólise e a decomposição por microorganismos, até o momento de seu processamento;
• As operações de ribeira: que promovem a limpeza e eliminação de todos os componentes que não irão constituir o produto final que é o couro;
• O curtimento: a pele limpa e isenta de todos os materiais que não interessam no produto final é, então, submetida a reações com diferentes produtos, denominados agentes curtentes;
Em função dessas operações pode-se afirmar que o couro passa por quatro estágios, conforme pode ser visto na Figura 3.2.
O diagrama de blocos do processo de produção de couro encontra-se representado na Figura 3.3 (RUPPENTHAL, 2001):
A seguir, tem-se um resumo das operações de ribeira e de curtimento para conhecimento dessas etapas do processo produtivo com maior detalhamento.
3.5.1 Operações de Ribeira
Remolho
O remolho pode ser conceituado como processo de limpeza e reidratação das peles, buscando devolver à pele as características de umidade e limpeza que ela apresentava logo após o abate. O processo de remolho tem quatro objetivos fundamentais: interromper a conservação da pele e retorná-la, o máximo possível, ao estado de pele fresca; restabelecer o teor de água da pele uniformemente em toda a sua superfície e espessura; eliminar proteínas solúveis em água (sangue, albuminas, etc.) e sujidades (como sujeiras e esterco) e também de preparar as peles adequadamente para a operação seguinte, denominada etapa de caleiro.
Depilação/caleiro
Descarne
O descarne é realizado em máquina de descarnar que tem por objetivo remover as sujeiras e gorduras aderidas ao lado do carnal da pele (tecido subcutâneo e adiposo). Sua finalidade é facilitar a penetração dos produtos químicos aplicados em etapas posteriores.
Divisão
Em seguida ao descarne, a pele é submetida à divisão em duas camadas: a camada superior (flor) e a inferior (raspa). Deve-se observar que há perda da espessura das camadas assim obtidas em etapas posteriores. Por esta razão, a espessura da divisão deve ser 25% maior que a desejada no material pronto.
Desencalagem
Este processo tem como principal objetivo remover as substâncias alcalinas depositadas ou quimicamente combinadas à pele (cal). Na desencalagem, são utilizados agentes que reagem com a cal, dando origem a produtos de grande solubilidade facilmente removíveis por lavagem. Nesta etapa já inicia-se a redução do pH preparando a pele para as etapas seguintes de píquel e curtimento.
Purga
3.5.2 Operações de Curtimento
Píquel
O píquel tem por objetivo principal preparar as fibras colágenas para uma fácil penetração do agente curtente cromo, que será introduzido na etapa seguinte, denominada curtimento. Para tal, o píquel deve acidificar a pele. É iniciada também a redução do pH (valor final deve ser inferior a 3,0) com a utilização de ácidos, onde estes devem ser adicionados lentamente para evitar choque de pH, inchamento excessivo e até mesmo queima da flor. A operação de píquel é muito importante, pois couros mal piquelados apresentam problemas de atravessamento e distribuição do cromo, além de prejudicar a resistência do produto final.
Curtimento
O curtimento, Figura 3.4, é um processo que consiste na transformação das peles em material estável e imputrescível, ou seja, a transformação da pele em couro devido a ação do cromo modificando a estrutura das protofibrilas do colágeno, propiciando um entrelaçamento de tal maneira que impeça a penetração de água, evitando assim a ação de microorganismos. Essa etapa é um dos pontos de maior contaminação de cromo em processos tradicionais. A contaminação se dá através de (Revista do couro, 2003):
! Banho residual;
! Lavagem do fulão para reinício do processo;
! Pesagem do cromo;
! Adição de cromo no fulão;
! Vazamento de fulão;
Para curtimentos ao cromo, nos processos convencionais, são usados teores em torno de 2,0 a 3,0% de Cr2O3 em relação à massa de peles, adicionados a banhos novos, com 50% de água, ou no mesmo banho do píquel.
Figura 3.4 – Processo de curtimento. Após este processo o couro encontra-se no seu primeiro estágio de venda, Wet Blue.
3.6 Caracterização dos Resíduos Líquidos Gerados no Processo
Industrial
Os vários segmentos da indústria de peles e couros implicam em uma diferença acentuada no que se refere às características dos resíduos líquidos. Indústrias que processam peles somente até a etapa de curtimento geram um efluente de características muito diferentes das que processam, por exemplo, do recurtimento até o acabamento.
Na Tabela 3.5 é apresentada a média dos parâmetros de um efluente líquido homogeneizado, após peneiramento, de uma indústria que processa curtimento ao cromo e não recicla banhos residuais (CLAAS e MAIA, 1994).
Tabela 3.5: Caracterização de efluente sem reciclagem
Já na Tabela 3.6, apresenta-se a média dos parâmetros de um efluente homogeneizado, após peneiramento, de uma indústria que processa curtimento ao cromo e recicla os banhos de caleiro e curtimento.
Parâmetro Concentrações
DBO 2.350 mg O2/L
DQO 7.250 mg O2/L
Sólidos Sedimentáveis 90 mL/L
Sulfeto 26,0 mg/L
Cromo Total 94,0 mg/L
Tabela 3.6: Parâmetros médios encontrados nas características de resíduos de curtumes que processam curtimento ao cromo e reciclam os banhos de caleiro e curtimento.
SELBACH et al. (1991) fizeram um levantamento das variações freqüentemente encontradas nos efluentes de curtumes, conforme mostrado na Tabela 3.7. Os teores de cromo nos efluentes normalmente ficaram compreendidos entre 90 e 125 ppm.
Tabela 3.7 - Variação normalmente encontrada nas características de resíduos de curtumes.
Parâmetro Concentrações
DBO 1.800 mg O2/L
DQO 4.000 mg O2/L
Sólidos Sedimentáveis 21 mL/L
Sulfeto 10,0 mg/L
Cromo Total 15,0 mg/L
pH 7,5
CARACTERÍSTICA VALOR MÍNIMO VALOR MÁXIMO
DBO 500 mg O2/L 1.600 mg O2/L
DQO 2.500 mg O2/L 3.600 mg O2/L
Enxofre 240 mg/L 1.700 mg/L
Cromo 90 mg/L 125 mg/L
A Resolução Nº 20/1986, do Conselho Nacional do Meio Ambiente – CONAMA, estabelece nos seus artigos 19 e 21 o seguinte:
Art.19 – Nas águas das Classes 1 a 8 serão tolerados lançamentos de despejos, desde que, além de atenderem ao disposto no Art. 21 desta Resolução, não venham a fazer com que os limites estabelecidos para as respectivas classes sejam ultrapassados.
Art. 21 – Os efluentes de qualquer fonte poluidora somente poderão ser lançados, direta ou indiretamente, nos corpos de água desde que obedeçam às seguintes condições:
• pH entre 5 e 9;
• temperatura: inferior a 40ºC, sendo que a elevação de temperatura do corpo receptor não deverá exceder a 3ºC;
• materiais sedimentáveis: até 1 mL/L em teste de 1 hora em cone Imhoff;
• regime de lançamento com vazão média de até 1,5 vezes de atividade diária do agente poluidor;
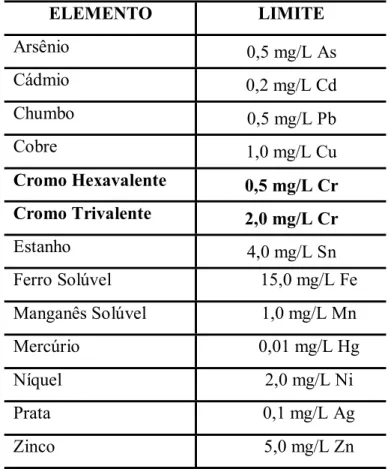
Tabela 3.8 - Valores máximos admissíveis de metais
Fonte: CONAMA (N° 20/1986)
Para o cromo trivalente, o teor permitido por lei pode chegar até 2,0 ppm e para o caso do cromo hexavalente, pode atingir um limite máximo de 0,5 ppm para seu descarte.
Considerando-se um valor médio de cromo no efluente de 100 ppm, e supondo que todo o cromo presente nos resíduos seja oxidado em sua forma hexavalente, a adição direta de 5,0 L de resíduo contendo cromo nessa concentração (100 ppm) em 1 m3 de água já seria suficiente para atingir o limite permitido por lei, conforme a equação (3.5):
+ +
+
+× = 6 = 6 = 6
6 5 , 0 500 500 0 , 5
100mgCr L mgCr mgCr mgCr (3.5)
ELEMENTO LIMITE
Arsênio 0,5 mg/L As
Cádmio 0,2 mg/L Cd
Chumbo 0,5 mg/L Pb
Cobre 1,0 mg/L Cu
Cromo Hexavalente 0,5 mg/L Cr Cromo Trivalente 2,0 mg/L Cr
Estanho 4,0 mg/L Sn
Ferro Solúvel 15,0 mg/L Fe
Manganês Solúvel 1,0 mg/L Mn
Mercúrio 0,01 mg/L Hg
Níquel 2,0 mg/L Ni
Prata 0,1 mg/L Ag
Esses cálculos, embora grosseiros, servem para ilustrar por que esses resíduos não devem ser aplicados diretamente nos corpos d’água, necessitando de um destino final adequado.
Segundo levantamento de CHERNICHARO e VAN VLIET (1996) nos efluentes líquidos de um grupo de 49 curtumes de tamanho médio de Minas Gerais, estavam sendo descarregados cerca de 1.400 kg de cromo por dia. Por tonelada de pele crua, obtém-se cerca de 100 kg de resíduo contendo cerca de 4 kg de cromo.
Conforme descrito nos itens anteriores, o emprego de cromo trivalente, na forma de trióxido de cromo, tem sido utilizado como agente curtente na grande maioria dos curtumes. Tendo em vista a necessidade de se utilizar processos para extração e ou recuperação deste cromo em resíduos industriais, a seguir serão descritas algumas das técnicas normalmente empregadas em indústrias para tratamento de resíduos.
3.7 Processos de Separação Utilizados para Tratamento de
Efluentes Industriais
Existem inúmeros processos que podem ser aplicados no tratamento de efluentes gerados nas indústrias que trabalham com metais pesados, dentre os quais podem ser citados a precipitação química, cementação, extração líquido-líquido e processos de separação com membranas.
3.7.1 Precipitação
Geralmente é realizada para remoção de metais pesados em efluentes industriais. Embora este método seja operacionalmente bastante simples e economicamente viável, seu principal problema é a quantidade de lama gerada. Além disso o efluente pode apresentar concentrações residuais dos metais acima das normas previstas por lei, sendo necessária a aplicação de um processo complementar para o polimento final do efluente.
Definida como uma operação unitária, a precipitação é largamente utilizada em processos hidrometalúrgicos, tais como a recuperação de metais e purificação de soluções. Devido ao fato deste método ter uma significativa aplicação industrial, a operação de precipitação tem como objetivo a recuperação de um produto a partir de uma mistura de vários componentes ou mesmo a remoção de impurezas indesejáveis ao processo.
A forma dos precipitados pode ser alterada durante a precipitação devido a condições operacionais. Altas taxas de aquecimento e resfriamento, por exemplo, conduzem a altas taxas de supersaturação e de nucleação, promovendo altas densidades populacionais e, conseqüentemente, o aumento da taxa de agregação. Condições de supersaturação muito elevadas podem promover o crescimento de partículas amorfas, enquanto baixas condições de supersaturação implicam no crescimento de partículas micro-cristalinas.
Portanto, o controle das etapas de cristalização é muito importante, tendo em vista que pode acarretar a formação de precipitados mais facilmente removíveis da solução onde foram inicialmente gerados.
3.7.2 Extração Líquido – Líquido
A primeira etapa, denominada extração, consiste em misturar uma solução aquosa com um solvente orgânico adequado para permitir a transferência da(s) espécie(s) metálica(s) entre as fases líquidas. Esta contactação se dá por um tempo suficiente para que as fases atinjam uma condição de equilíbrio ou próxima a esta. Em seguida, a fase aquosa, então empobrecida no(s) metal(is) de interesse, denominada de refinado da extração, é separada e encaminhada para tratamento posterior ou descartada. A fase rica nestas espécies, denominada extrato, pode alimentar uma etapa intermediária de lavagem, para a remoção de impurezas co-extraídas durante a etapa de extração, ou ser enviada diretamente para a etapa de reextração, onde ocorre a recuperação das espécies para uma fase líquida adequada, produzindo uma solução purificada que pode ser encaminhada para uma etapa posterior de concentração. O solvente é, então, reciclado de volta à etapa de extração, fechando o circuito. Caso seja necessário, este deve ser tratado em uma etapa de regeneração do solvente antes de voltar à extração, enquanto perdas de solvente devem ser repostas mediante um make-up.
Como a eficiência da separação de uma dada espécie por extração líquido-líquido depende fundamentalmente da forma na qual as fases líquidas entram em contato entre si, diversos equipamentos são disponíveis. Segundo a literatura, verifica-se a existência de mais de 25 tipos de extratores em uso industrial, classificando-os em quatro categorias principais: misturadores-decantadores, centrífugas, colunas sem agitação e colunas agitadas.
3.7.3 Processos de Separação por Membranas
Existem várias técnicas de separação que utilizam membranas semipermeáveis para a purificação e separação de inúmeras espécies químicas, apresentando, em muitos casos, maior eficiência e menor custo do que os processos convencionais como a precipitação, a extração por solvente e a destilação. Vantagens adicionais da utilização de membranas estão relacionadas à obtenção do produto sem a necessidade de mudança de fase, reduzindo o consumo de energia e a possibilidade de realizar o processo à temperatura ambiente, permitindo a separação de soluções termossensíveis sem que haja degradação ou alteração química de seus constituintes (SALUM, 1998).
De uma forma geral, pode-se definir uma membrana como uma interface que separa duas fases e restringe o transporte de espécies químicas de forma seletiva. Dentro deste amplo conceito existe uma grande diversidade de membranas, com características particulares ao processo de separação aos quais são destinadas. Uma membrana pode ser homogênea ou heterogênea, sólida ou líquida, carregar íons ou possuir habilidades complexantes, apresentando espessuras que podem variar de menos de 100 nm até mais de 1 cm (STRATHMANN, 1990). A seleção da membrana apropriada a um dado processo de separação irá depender de fatores como a natureza dos constituintes na mistura, o volume de solução a ser separado, o grau de separação requerido e o custo.
Basicamente, as membranas líquidas podem ser preparadas sob duas formas distintas. Na primeira, a barreira líquida seletiva é estabilizada como um filme fino, por um surfatante em uma emulsão e estabelece o sistema conhecido como membrana líquida surfatante. Na segunda, uma estrutura polimérica microporosa é preenchida com a fase que constitui a membrana líquida, originando a membrana líquida suportada, conforme trabalhos de CHAUDRY et al. (1997).
3.7.4 Membranas Líquidas Surfatantes (M.L.S)
A técnica de extração por membranas líquidas surfatantes (M.L.S) foi inicialmente desenvolvida por Norman N. LI em 1968, e resultou em uma planta piloto para recuperação de metais na década de 70.
Diversas pesquisas têm sido desenvolvidas para aplicação da técnica de MLS, entre as quais estão o fracionamento e recuperação de hidrocarbonetos (LI, 1971), a recuperação e concentração de íons metálicos em processos industriais (SALUM, 1998; CHAUDRY, 1997; DRAXLER e MARR, 1986), ácidos fracos como ácido cítrico (KONZEN, 2000; BOEY et al., 1987), ácido lático (TRINDADE, 2002) e diferentes aplicações nas áreas bioquímica e biomédica.
Tendo como principal objetivo aumentar a estabilidade da membrana e também a área para a permeação, preparou-se uma emulsão entre a solução contendo o surfatante e a fase de alimentação. Tal modificação no sistema permitiu a obtenção de glóbulos com várias gotículas internas, com diâmetro de aproximadamente 0,01 mm, favorecendo a transferência de massa, porém dificultando a quebra da membrana. Este novo problema foi resolvido utilizando-se técnicas de aquecimento ou coalescência eletrostática para promover a recuperação da fase encapsulada na emulsão (LI, 1971).
Uma membrana pode ser definida como uma barreira seletiva entre duas fases. O modo pelo qual o transporte seletivo de material ocorre entre essas duas fases pode variar de acordo com as propriedades químicas e estruturais da membrana e com a natureza das interações entre a superfície da membrana e a fase através da qual o transporte ocorre.
A seletividade é proveniente das diferentes taxas de difusão dos componentes presentes na alimentação através da membrana, e que são induzidas pela diferença de potencial químico entre as suas interfaces. O gradiente de potencial químico é a força-motriz do sistema e pode ser, muitas vezes, representado pela diferença de concentração entre as interfaces da membrana.
3.8 Técnica de Separação por Membranas Líquidas Surfatantes
As membranas líquidas surfatantes consistem de três fases líquidas imiscíveis: a fase de alimentação que possui o(s) soluto(s) de interesse (fase externa), a fase membrana que contém o agente extratante e a fase receptora desse(s) soluto(s) (fase interna). O transporte do soluto através da fase membrana ocorre devido à diferença de potencial químico entre as fases externa e interna.
As membranas líquidas surfatantes podem apresentar duas configurações possíveis: fase aquosa / fase orgânica / fase aquosa (A/O/A), quando a fase membrana é orgânica e as fases externa e interna aquosas; e fase orgânica / fase aquosa / fase orgânica (O/A/O), quando a fase membrana é aquosa e as demais de natureza orgânica (DATTA e BHOWAL, 2001).
Independentemente da configuração escolhida, as fases são denominadas como: fase interna ou receptora (I), responsável pela captação do soluto extraído pela membrana da fase de alimentação; fase membrana (II), responsável pela permeação seletiva do soluto da fase doadora para a fase receptora; e fase de alimentação, doadora ou externa (III), que contém o soluto que se deseja purificar e/ou concentrar.
Na Figura 3.6 é apresentada a disposição das fases considerando-se um glóbulo de emulsão múltipla (KONZEN, 2000).
Figura 3.6 - Representação esquemática das fases do sistema M.L.S em um glóbulo de emulsão múltipla A/O/A.
3.9 Etapas do Processo de Separação por M.L.S
O processo M.L.S é composto por quatro etapas que serão descritas a seguir, representadas na Figura 3.7.
3.9.1 Emulsificação
A etapa de emulsificação consiste em formar, sob intensa agitação, uma emulsão denominada emulsão primária, constituída por duas fases imiscíveis, uma fase dispersa, que se encontra sob a forma de gotículas, conhecida como fase interna (FI), e uma fase contínua, denominada fase membrana (FM). Essa emulsão pode ser de dois tipos: emulsão A/O, quando a fase dispersa é aquosa e a contínua orgânica; e emulsão O/A, quando se tem uma fase orgânica dispersa em uma fase aquosa.
Como uma emulsão possui elevada tensão interfacial, ela é termodinamicamente instável. Assim, há uma tendência à coalescência das fases para minimizar a área interfacial, desfazendo a emulsão. Para tornar essa dispersão estável, é necessária a adição de uma substância tensoativa, de caráter ambifílico, denominada emulsificador ou surfatante, que atua na interface entre os líquidos, reduzindo a tensão interfacial entre eles (ELLER et al., 1979).
As principais variáveis envolvidas nesta etapa são velocidade de agitação, variando entre 5.000 a 25.000 rpm e o tempo, que influenciam diretamente no número e no tamanho dos glóbulos formados, na viscosidade e na estabilidade da emulsão (SALUM, 1998).
Os surfatantes utilizados em emulsões do tipo A/O, que futuramente irão formar emulsões múltiplas do tipo A/O/A, normalmente para casos de extração de metais, possuem HLB variando entre 3 e 8 (ELLER et al., 1979).
Para que um surfatante seja adequado para o processo M.L.S, ele deve possuir as seguintes características:
• possibilitar uma pequena taxa de quebra dos glóbulos; • aumentar a seletividade do soluto a ser separado;
• estabilizar o sistema, sem no entanto, inviabilizar a desemulsificação; • ser estável quimicamente;
• possuir custo viável e ser de fácil síntese.
Além do surfatante apropriado, há alguns fatores que determinam a estabilidade das emulsões:
• natureza física do filme interfacial: deve ser resistente e elástico;
• existência de barreira elétrica ou estérica entre as gotículas: evita a coalescência das gotículas;
• viscosidade da fase contínua: deve ser alta, diminuindo os choques entre gotículas, reduzindo, dessa forma, a coalescência;
• razões de volume fase contínua / fase dispersa: o volume da fase dispersa deve ser menor que o da fase contínua, evitando a inversão de fases;
Figura 3.7: Etapas do processo de extração pela técnica de membranas líquidas surfatantes (KONZEN, 2000).
EMULSIFICAÇÃO
Fase interna
Fase membrana
PERMEAÇÃO
Fase externa
SEDIMENTAÇÃO
Emulsão carregada
Fase externa extraída
DESEMULSIFICAÇÃO
Fase interna carregada
3.9.2 Permeação
Na permeação, a solução contendo o(s) soluto(s) de interesse é misturada à emulsão primária, formando glóbulos que constituem uma emulsão múltipla (Figura 3.7). A agitação na permeação deve ser moderada, entre 100 e 400 rpm (SALUM, 1998), para evitar a quebra dos glóbulos. Na emulsão múltipla, a fase externa ao glóbulo é constituída pela solução contendo o(s) soluto(s), que pode ser aquosa ou orgânica, desde que seja de natureza oposta à da fase membrana. Já os glóbulos encontram-se dispersos na fase externa e são constituídos por uma emulsão O/A ou A/O.
Na etapa de permeação, o(s) soluto(s) será(ão) transportado(s) da fase externa para a fase interna, devido à uma diferença de potencial químico entre essas fases, através da fase membrana, ocorrendo, então, a separação e/ou concentração desse(s) soluto(s).
Esse transporte se dá por diversos mecanismos, a depender da natureza química do soluto e de sua capacidade de difusão através da fase membrana. Essa etapa é a mais lenta, por envolver reações químicas ou solubilização e difusão, sendo, portanto, a etapa controladora do processo de separação por M.L.S. Na Figura 3.8 observa-se a preparação da emulsão múltipla - início da etapa de permeação.
fase interna emulsão primária
fase interna fase orgânica glóbulo fase externa
3.9.3 Sedimentação
Nessa etapa, a emulsão carregada é separada da fase externa empobrecida no(s) soluto(s) por uma operação estritamente física: a sedimentação. A separação dependerá não somente da diferença de densidade, como também da viscosidade da fase contínua, do tempo de residência e da área disponível para a sedimentação. A fase externa pode ser descartada ou submetida a tratamento subseqüente.
3.9.4 Desemulsificação
A desemulsificação é a etapa onde ocorre a quebra da emulsão primária e, conseqüentemente, a liberação da fase interna, rica no(s) soluto(s) de interesse. A desemulsificação pode ser realizada utilizando-se processos térmicos, químicos, ultra-som, centrifugação ou coalescência eletrostática.
Esta última técnica tem sido mais empregada no processo de quebra, pois apresenta alta eficiência e não oferece riscos de contaminação com produtos químicos de difícil separação, além de evitar degradação do soluto por exposição ao calor. Neste método, o campo elétrico aplicado polariza as gotículas de fase interna fazendo com que elas se alinhem em longas cadeias na direção do campo, promovendo a sua coalescência pelo choque entre as gotículas, causada pela força elétrica resultante da presença do campo (SALUM, 1998).
3.10 Mecanismos de Permeação
A extração do soluto na técnica M.L.S é efetuada pela transferência de massa entre as fases externa e interna através da fase membrana. Os mecanismos que regem a permeação do soluto através da membrana dependem das características do soluto e das propriedades físicas e químicas da fase membrana e fase interna.
A etapa de permeação, onde ocorre a transferência de massa, pode ser dividida em 5 etapas (SALUM, 1998):
1. Difusão do soluto através da película da fase externa próxima à superfície do glóbulo;
2. Solubilização do soluto ou reação química na interface fase externa / fase membrana;
3. Difusão do soluto ou complexo através da membrana;
4. Descomplexação, caso haja reação química, ou solubilização do soluto na interface fase membrana / fase interna;
Figura 3.9 - Perfil de concentração através de uma membrana líquida plana (KONZEN, 2000).
A permeação de um soluto através de uma membrana líquida pode ocorrer segundo diferentes mecanismos de transferência de massa. É importante relacionar as seguintes considerações:
• Prevalece o equilíbrio químico e de fases nas interfaces externa e interna; • O sistema encontra-se em regime permanente;
• A difusão na fase membrana é a etapa determinante do processo; • A membrana apresenta as interfaces limites planas e paralelas entre si.
Através destas hipóteses, considera-se que o fluxo de soluto através da membrana é difusivo e atua em regime permanente, podendo-se, dessa forma, descrever a transferência de massa do soluto pela primeira lei de Fick. Estas duas suposições fornecem uma boa aproximação do sistema real porque não há agitação no interior da membrana ou presença de soluto em altas concentrações que possam induzir a formação de um fluxo convectivo. A aproximação de um regime permanente também é válida, pois a membrana oferece grande resistência à transferência de massa, tornando a difusão do soluto lenta o bastante para se desconsiderar uma dependência significativa da
Fase Externa (III) Fase Membrana (II) Fase Interna (I)
∆x CIII C
aqIII
CorgIII
CorgI
CaqI
Quanto aos mecanismos de transporte de soluto, existem duas classificações principais segundo PATNAIK (1995): mecanismos de difusão simples e mecanismos de difusão facilitada. O primeiro deles é denominado mecanismo de difusão simples, e é caracterizado pela separação física através da membrana. Este transporte é governado pela capacidade da espécie desejada em se difundir através da membrana em detrimento de outras substâncias presentes na fase de alimentação. A força-motriz é simplesmente o gradiente de concentração, mais apropriadamente de potencial químico, entre a fase externa e a fase interna.
De fato, para a obtenção de um elevado gradiente de concentração através da membrana, é preciso converter o soluto transportado em uma forma química que possa impedir que haja difusão reversa do soluto para a fase externa.
Apesar deste mecanismo ser simples e pouco dispendioso, sua seletividade e eficiência, geralmente, não são satisfatórias. Além disto, a neutralização, ou outra reação, do soluto que ocorre na fase interna pode não ser suficiente para manter um elevado gradiente de concentração através da membrana quando a fase externa for pobre no soluto. Por essas razões, existe limitação do uso de processos de separação que usam este mecanismo em soluções diluídas ou que contenham mais de uma espécie presente na fase interna.
O segundo tipo de transporte de soluto é denominado mecanismo de difusão facilitada, também conhecido usualmente como mecanismo facilitado (PATNAIK, 1995). Está presente nos sistemas que utilizam um transportador na fase membrana para aumentar a solubilidade do soluto na membrana através da formação de um complexo soluto-transportador. Este tipo de mecanismo descreve os processos de separação de vários íons metálicos, como cádmio, cromo, cobre e mercúrio, utilizando aminas como transportadores. Em todos os casos, o uso do transportador tem como função maximizar a transferência de massa através da membrana.
Nas figuras que serão representadas abaixo, M1 e M2 são os solutos a serem permeados
através da membrana, E é o extratante e R é um reagente auxiliar presente na fase interna ou externa.
a) Transporte facilitado simples: o soluto M1 é transportado da fase externa para a
fase interna através da reação com o extratante E, formando o complexo M1E
solúvel na membrana. Na interface com a fase interna, o soluto é liberado e o transportador livre retorna a interface com a fase externa para captar outra molécula de soluto, dando continuidade ao processo de extração conforme mostra a Figura 3.10. Neste caso, a permeação depende do gradiente de concentração entre as interfaces da membrana e da concentração do transportador (KONZEN, 2000). Este mecanismo explica as extrações de fenóis e amônia em águas residuárias, de ácido benzóico e de uréia.
Figura 3.10 – Transporte facilitado simples
b) Transporte facilitado simples com reação química: o soluto M1, transportado
através da membrana pela formação do complexo M1E, reage com o reagente R ao
ser liberado pelo extratante na interface com a fase interna, formando o produto M1R, insolúvel na membrana como mostrado na Figura 3.11.
Esta condição permite que M1 seja extraído da fase externa até que a sua concentração
atinja níveis muito baixos, pois a força motriz do processo é mantida devido ao consumo do soluto pelo reagente R. Este mecanismo é comum na extração de ácido
M1
M1E
M1
Fase Externa Fase Membrana Fase Interna
Figura 3.11 – Transporte facilitado simples com reação química.
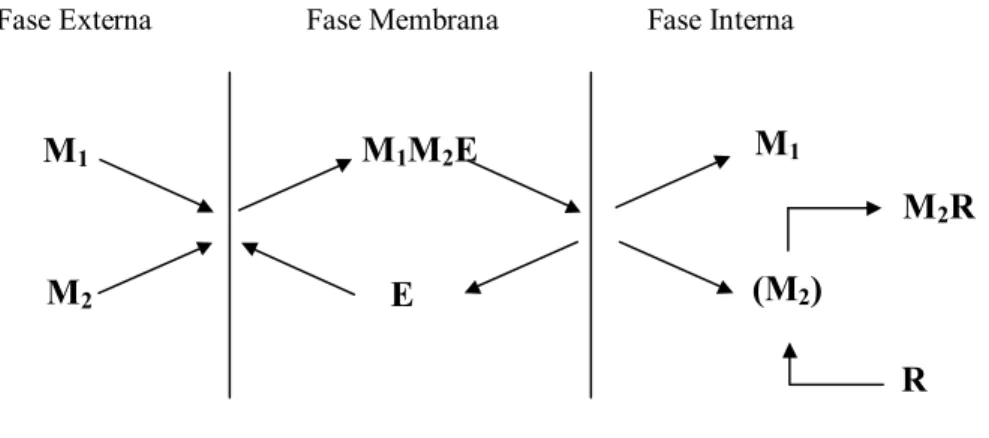
c) Co-transporte: a permeação dos solutos M1 e M2 através da membrana ocorre
simultaneamente e no mesmo sentido, sendo o extratante E responsável pela sua captação na interface com a fase externa através da formação do complexo M1M2E.
Este se difunde através da membrana até a interface com a fase interna, onde E é regenerado pela liberação de M1 e M2 (Figura 3.12). A presença do reagente R nesta
fase leva à formação do produto M2R, impermeável na membrana, permitindo a
extração de M1 mesmo após sua concentração na fase interna e externa se
igualarem, pois a força motriz passa a ser o gradiente de potencial químico de M2
(KONZEN, 2000). Este mecanismo de co-transporte ocorre na extração de íons dicromato (Cr2O7)2- que será o objetivo deste trabalho.
Figura 3.12 – Co-transporte. M1
M1E
Fase Externa Fase Membrana Fase Interna
E
(M1)
R M1R
M1 M1M2E
Fase Externa Fase Membrana Fase Interna
E (M2)
R M2R
M2
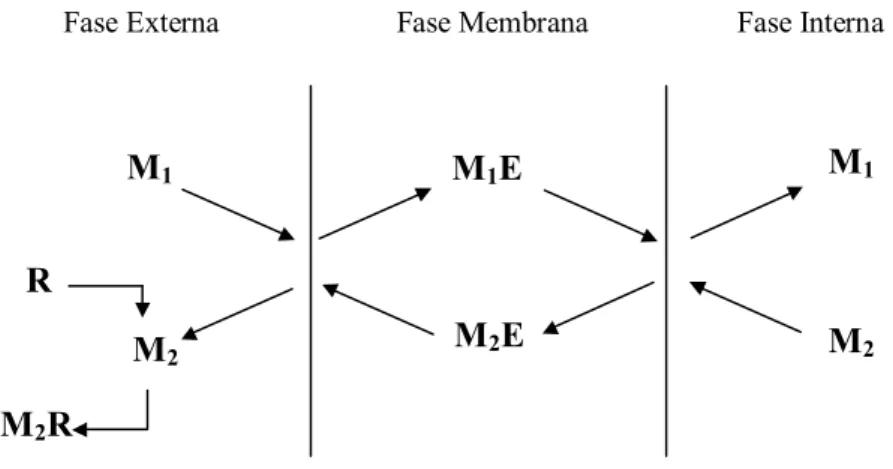
d) Contra-transporte: os solutos M1 e M2 são transportados em sentidos opostos
através da membrana, pela formação dos complexos M1E e M2E. Primeiramente, E
capta o soluto M1 na interface com a fase externa, transportando-o até a fase interna.
Nesta interface, E libera M1 e capta M2 formando o complexo M2E que se difunde
através da membrana em direção a fase externa. Nesta interface M2 é liberado e o
extratante livre pode captar outra molécula de M1, continuando o ciclo de extração
conforme a Figura 3.13 (KONZEN, 2000). Este mecanismo é muito comum na extração de aminoácidos e da maioria dos metais, como Cu2+, Pb2+, Zn2+, Cd2+, Na+, Li+, K+, Ca2+, dentre outros.
Figura 3.13 – Contra-transporte.
Para a extração de íons dicromato, normalmente, são utilizadas aminas terciárias (R3N), cujo mecanismo mais provável para o processo de extração neste caso é o co-transporte. A representação esquemática deste mecanismo, utilizando-se hidróxido de sódio como reagente da fase interna, é apresentada na Figura 3.14.
M1 M1E
Fase Externa Fase Membrana Fase Interna
M2E
M2
M1
M2
M2R
4 NaOH
2 H+
Figura 3.14 – Mecanismo de extração de íons dicromato por co-transporte, utilizando NaOH como reagente de fase interna.
Neste mecanismo apresentado acima, a extração do soluto ocorre em três etapas. Na primeira etapa, ocorre a protonação da amina em meio ácido formando o complexo R3NH+, conforme a equação (3.6). Este complexo reage com o íon dicromato, formando um complexo orgânico de acordo com a equação (3.7):
+ +←→
+2H 2R NH N
R
2 3 3 (3.6)
] O Cr ) NH R [( NH R 2 ) O Cr
( 3 3 2 2 7
2 7
2 + ←→ ⋅
+
− (3.7)
A segunda etapa envolve a difusão do complexo formado até a interface com a fase interna (meio básico). Finalizando, a última etapa ocorre com liberação do metal através de reação com hidróxido de sódio, formando cromato de sódio, água e liberando o extratante em sua forma original, conforme equação (3.8):
4 2 2 3 7 2 2
3 ) ] 4 2 3 2
[(R NH ⋅CrO + NaOH←→ R N+ H O+ Na CrO (3.8) A amina no estado livre retorna à interface com a fase externa para formar novos complexos e dar continuidade ao processo de extração.
(Cr2O7)2-
2 R3N
Fase Externa Fase Membrana Fase Interna
[(R3NH)2.Cr2O7]
2 Na2CrO4 + 3 H2O