UNIVERSIDADE ESTADUAL PAULISTA
CENTRO DE AQUICULTURA
CAMPUS DE JABOTICABAL
TOXICIDADE AGUDA DO SULFATO DE COBRE E
DO TRICLORFON PARA TRÊS ESPÉCIES DE
DAPHNIAS EM PRESENÇA E AUSÊNCIA DE
SEDIMENTO
LUIS RICARDO ROMERO A RAUCO
Dissertação apresentada ao Centro de Aquicultura da Universidade Estadual Paulista Câmpus de laboticabal, como requisito parcial para obtenção do título de Mestre em Aquicultura de Águas Continentais.
A Deus,
A meus irmãos, Miriam, Waldo,
Ivan e primos Rugo e Miguel
Obrigado pelo grande apoio
Agradecimento
Ao Centro de Aquicultura da UNESP de Jaboticabal pela estrutura
oferecida;
Ao Prof Dr. Joaquim Gonçãlves Machado Neto por aceitar minha
orientação;
Aos membros da banca examinadora Prof Dr. Flábio Ruas de Moraes
e Dr. Julio Lombardi pelas sugestões e correção deste trabalho;
A todos os professores do Caunesp que amim trasmiteram
seusconhecimentos, em especial ao Prof Edivaldo Pezzato, Elisabeth Criscuolo
Urbinati, Elisabete Maria Macedo Viegas, Marta Vemardino De Stéfani, Lúcia Reina
Sipaúba Tabares, Francisco Manuel de Souza Braga, Roberto Goitein, Newton
Castagnolli, Wagner Cotroni Valenti, Gilson Luiz Valpato, Antônio de Pádua Sousa,
Mauiricio LaterçaMartins;
Agradeço especialmente as amigas colegas do Caunesp. Rachei e
Carla, pela ajuda na correção da aula de qualificação e dissertação;
Aos amigos colegas do Caunesp Adriana Sacioto, Adriana Mufioz,
Denise, Rosangela, Sonia, Virginia, Claudia Franco, Daniaela, Fabiana, Janessa,
Karina, Lusiene, Leda, Maria Isabel, Ana Isabel, Ana Paula, Ana Eliza, Antonio,
Claudinei, Eduardo, Flávio, GilbertoMarcel, Marcelo, Marcos, Rodrigo, Ronald,
Adriano, Antonio Femando, Atomu, Camilo Ernesto, Érico, Faviano, Jaime,
Leonardo, Lot, Marcelo Assano, Newton e Nilton por terem compartilhado bons
momentos e amizade;
Aos amigos e colegas do Departamento de Fitosanidade da FCA V:
Glaucia,
Marcelo, Adriano, Maurício e Daniele pela amizade e convivência;
Resumo
O objetivo deste trabalho foi avaliar a toxicidade aguda CE50-48 h do sulfato
de cobre e trichlorfon, comparar a sensibilidade e avaliar o risco de intoxicação ambiental para três espécies de daphnias (D. similis, D. magna e D. laevis) na ausência e presença de
sedimento. Os testes de toxicidade aguda foram realizados em condições de laboratório, em sala climatizada de acordo com metodologias normatizadas com algumas adaptações. Os valores de CE50-48h calculados para D. magna foram de 0,345 mg de sulfato de cobre /L com
sedimento e 0,045 sem sedimento; para D. similis, 0,282 com sedimento e 0,042 sem
sedimento e para D. laevis, 0,140 com sedimento e 0,107 sem sedimento. Os valores de CE 50-48h calculados para D. magna foram de 299,70 ηg de trichlorfon /L com sedimento e 0,70
sem sedimento; para D. similis, 381,62 com sedimento e 0,52 sem sedimento e para D. laevis,
282,72 com sedimento e 0,92 sem sedimento. O trichlorfon foi mais tóxico que o sulfato de cobre para as três espécies de daphnias. O sedimento reduziu significativamente a biodisponibilidade do trichlorfon e do sulfato de cobre na água de cultivo para as três espécies de daphnias. Em ausência de sedimento, a Daphnia magna e a Daphnia similis não
apresentam diferença de sensibilidade aos dois agrotóxicos, mas a Daphnia laevis foi
significativamente mais sensível que as outras duas espécies. Na presença do sedimento houve diferença de sensibilidade entre as espécies de daphnia, sendo a Daphnia magna mais
sensível, seguida pela Daphnia similis e Daphnia laevis, que apresentou a menor
sensibilidade ao sulfato de cobre. Na ausência do sedimento, as três espécies de daphnia não apresentam diferença de sensibilidade ao trichlorfon. Na presença do sedimento, a Daphnia magna e a Daphnia laevis não apresentam diferença de sensibilidade ao trichlorfon. O uso do
1 INTRODUÇÃO
A utilização de agrotóxicos, indiscutivelmente, tem contribuído para o aumento da produção agrícola e agropecuária mundial. Contudo, o uso indiscriminado destes compostos tóxicos tem causado impactos negativos ao meio ambiente (RAND e PETROCELLI, 1985).
Os lançamentos mais comuns de poluentes na rede hidrográfica envolvem a entrada de determinados elemento tóxico em períodos de tempo de curta duração e em alta concentração, o qual é transportado no meio aquático como um pulso, reduzindo a concentração e aumentando a extensão da distribuição. Diante de toda esta problemática surgiu, nos últimos anos, uma nova linha de pesquisa denominada de toxicologia aquática. Segundo RAND e PETROCELLI (1985), a toxicidade aquática compreende o estudo quantitativo e qualitativo do efeito tóxico de substâncias químicas e de outras substâncias antropogênicas sobre os organismos aquáticos.
O sulfato de cobre e o tricholorfon são agrotóxicos usados na aqüicultura para o controle de agentes com potencial patogênicO e doenças de peixes. Entretanto, esses usos podeM alterar a composição natural da flora e fauna aquática. Além disso, a deterioração e a poluição dos recursos hídricos naturais têm como conseqüência importante a impossibilidade de aproveitamento das águas para uso humano (FONSECA, 1991), ou de animal.
Além da intoxicação aguda, resultante da exposição a substâncias tóxicas, os organismos aquáticos podem sofrer intoxicação crônica quando expostos por prolongados períodos de tempo a concentrações subletais. Este problema é agravado devido à tendência de metais pesados, como o cobre, se acumularem no sedimento, onde poderão ser translocados através dos diversos componentes da cadeia biológica, ocasionando sua bioconcentração (RAND e PETROCELLI, 1985) e biomagnificação.
Os objetivos do presente trabalho foram:
1) avaliar a toxicidade aguda (CE50-48h) do sulfato de cobre e do inseticida trichlorfon para três espécies de daphnias(Daphnia similis, Daphnia magna e Daphnia laevis) na
ausência e presença de sedimento;
2) comparar a sensibilidade destas três espécies de microcrustáceos ao sulfato de cobre, ao trichlorfon e dicromato de potássio (substância de referência);
2. REVISÃO DE LITERATURA
2.1. Teste de avaliação da toxicidade aguda de substâncias tóxicas
2.1.1. Histórico
O primeiro trabalho no país sobre avaliação de toxicidade de agrotóxicos para organismos aquáticos foi realizado por ALMEIDA (1987), na tentativa de determinar a toxicidade do DDT para fêmeas de Phallocero caudimaculatus. Nesta época não existia
qualquer padronização quanto aos procedimentos laboratoriais e ao estabelecimento de parâmetros biológicos e físico-químicos para a realização dos testes.
BRANCO (1960) estudou a ação de sulfato de zinco, cloreto de zinco, sulfato de cobre e dimetiltiocarbato de zinco sobre “guarú-guarú”. Verificou que os efeitos da exposição deste peixe à solução de cloreto de zinco poderiam ser alterados pela utilização de aeradores na solução. De fato, a solução arejada foi mais tóxica para os organismos, embora as concentrações fossem as mesmas.
espécies: Hemigramus marginaltus (nativo), Tilapia melanopleura e Cyprinus carpio, Salmo gairdneri, Poecilia reticulata e Brachyodaphnia dubia (exótico). Também foram realizados
testes de toxicidade com cladóceros das espécies: Daphnia similis, Ceriodaphnia dubia
(exóticas). Estes organismos foram expostos a efluentes industriais, soluções de compostos metálicos e detergentes com a finalidade de se avaliar a concentração letal 50 % (PEREIRA et al., 1987). Testes de toxicidade crônica foram realizados com o Geophagus brasiliensis
(espécie nativa), exposto a íons cúpricos. PEREIRA et al. (1987) verificaram que exposição crônica a ions cúpricos pode provocar degeneração nas células do baço, fígado e intestinos, enquanto que nas brânquias ocorreu apenas o acúmulo de sais de cobre.
Poucas espécies de organismos nativos utilizadas em testes de toxicidade no Brasil, sejam agudos ou crônicos. Este fato deve-se à maior facilidade na interpretação dos resultados quando se utilizam espécies já padronizadas, à possibilidade de estabelecer comparações com estudos já feitos em diferentes países, às dificuldades decorrentes da ausência de estudos minuciosos sobre a biologia e ecologia de espécies nativas que possam ser utilizadas (FONSECA, 1991).
2.1.2. Conceituação e metodologias dos testes de avaliação de toxicidade de substâncias tóxicas.
Os bioensaios com organismos aquáticos em condições de laboratório possibilitam a qualificação e a mensuração dos efeitos dos compostos orgânicos tóxicos sobre a biota e a estimativa dos riscos de intoxicação ambiental. Os bioensaios, aplicados ao controle da poluição da água, permitem estimar os efeitos dos principais poluentes do meio ambiente, frente a organismos aquáticos (marinhos ou dulcícolas), pertencentes a diferentes níveis tróficos destes ecossistemas (Soares, 1985, apud. ALMEIDA, 1987).
A toxicologia clássica estuda, em condições de laboratório, os efeitos de tóxicos sobre organismos individuais, sistemas, órgãos, tecidos e células, objetivando extrapolar os resultados obtidos para a população humana. A toxicologia do ecossistema é limitada a dados disponíveis sobre espécies de interesse. A ecotoxicologia é uma ciência complexa e multidisciplinar, que se preocupa com a avaliação do risco que determinada perturbação pode trazer a determinado ecossistema, bem como o desenvolvimento de método que contribua para a determinação desse risco. Assim, a ecotoxicologia estuda os efeitos dos agentes tóxicos sobre a estrutura e a função de comunidades bióticas e sobre sua integração com os componentes abióticos (GUIMARÃES, 1996).
bactérias, sendo que alguns métodos já foram padronizados e outros estão em vias de padronização.
O termo teste de toxicidade aquática foi proposto por RAND e PETROCELLI (1985), por acharem que o termo bioensaio seria aplicado apenas às indústrias farmacêuticas, que deles se utilizam para avaliar a potência de vitaminas e outros compostos farmacologicamente ativos.
O teste de toxicidade aquática é um procedimento no qual as respostas de organismos aquáticos são usadas para detectar ou medir a presença ou efeito de uma ou mais substâncias, resíduos ou fatores ambientais, sozinhos ou em combinação. Estes testes são utilizados para avaliar a poluição do corpo de água quando os testes químicos e físicos não são suficientes para avaliar os efeitos potenciais sobre a biota aquática e, conseqüentemente, estabelecer procedimentos para protegê-la (GOLTEIN et al, 1983).
Por meio dos testes de avaliação da toxicidade determina-se o tempo e as concentrações em que o agente químico é potencialmente prejudicial para determinado organismo. Para qualquer produto, o contato com a membrana celular ou sistema biológico pode não produzir efeito adverso se a concentração do produto for baixa ou o tempo de contato for insuficiente. Por outro lado, concentrações e tempo de exposição poderão não ter efeitos prejudiciais em tempo de exposição extremamente curtos (RAND e PETROCELLI, 1985).
Os testes de avaliação da toxicidade das substâncias tóxicas obedecem a um modelo geral de procedimento, que consiste na exposição de organismos-teste a diferentes concentrações do agente tóxico em recipientes sob rigoroso controle das condições ambientais como temperatura, pH e alcalinidade (RAND e PETROCELLI, 1985).
Para efeito de monitoramento de um corpo da água receptor de efluentes contaminados contendo substâncias tóxicas, os testes de toxicidade mais utilizados em laboratório são os de avaliação da toxicidade aguda e crônica. Nos testes agudos, os organismos são expostos aos agentes tóxicos em curto período de tempo, e nos testes crônicos o tempo de exposição envolve períodos bem mais longos, podendo incluir todo o ciclo de vida do organismo. Assim, o impacto dos agrotóxicos sobre os organismos do ambiente aquático pode ser estimado e monitorado por testes de toxicidade conduzidos em condições de laboratório (RAND e PETROCELLI, 1985).
Nos testes de avaliação da toxicidade aguda das substâncias tóxicas estima-se, por meios de modelos matemáticos e/ou estatísticos, a CL50 concentração letal 50% (CE50), definida como a concentração estimada que produz mortalidade em 50% da população exposta ao agente tóxico por determinado período de tempo. Este período é variável com a espécie teste utilizada, mas geralmente situa-se entre 24 e 96 horas (RAND e PETROCELLI, 1985).
Os testes de avaliação da toxicidade aguda são freqüentemente conduzidos em o sistema estático, ou seja, sem renovação de água no decorrer do experimento. Este sistema é muito utilizado por ser mais simples e menos dispendioso quanto comparado ao sistema semi-estático (renovação parcial) ou ao sistema de fluxo contínuo (renovação contínua) (RAND e PETROCELLI, 1985).
1971), o método Binomial (STEPHAN, 1977) e o método “Treimed Sperman Karber” (HAMILTON et. al., 1977). LOMBARDI (1999), estudando a toxicidade aguda de diferentes agrotóxicos para o camarão de água doce, verificou resultados estatisticamente semelhantes com esses diferentes métodos de cálculo da CE50.
2.3. Seleção dos organismos – teste para avaliação de toxicidade aguda.
Os resíduos de compostos químicos introduzidos num ecossistema aquático podem provocar efeitos tóxicos em várias espécies, principalmente quando a descarga é alta, em termos de concentração, em área relativamente pequena (FONSECA, 1991).
Para a escolha de organismos-teste visando ensaios de toxicidade aquática, em condições de laboratório, vários critérios poderão ser utilizados. BAUDO (1987) cita que para a United States Enviromental Protection Agency – USEPA são considerados os seguintes aspectos:
- que o organismo seja representativo de um importante grupo ecológico, em termos de taxonomia ou nível trófico, ocupando, portanto, uma importante posição na cadeia alimentar;
- a disponibilidade para execução dos testes, implicando, em fácil cultivo e manutenção em laboratório, além de estabilidade genética; e
- a existência de informações em relação à biologia e à ecologia da espécie.
RAND e PETROCELLI (1985) enumeram algumas características básicas que devem ser observadas em relação aos organismos-teste, e são as seguintes:
- usar espécies representativas de várias sensibilidades à substância-teste; - dar preferência a espécies abundantes e facilmente disponíveis;
- dar preferência às espécies econômica e ecologicamente importantes;
- as espécies utilizadas devem ser facilmente adaptáveis às condições de laboratório; e - preferencialmente utilizar espécies de comportamento fisiológico e genética conhecida. Segundo TRARWEL e DOUDOROFF (1952) e SPRAGUE (1969), os cientistas que trabalham com testes de toxicidade aquática seguem três diferentes tendências para a seleção de espécies a serem testadas. Tais tendências são complementares, dependendo principalmente do objetivo do trabalho. A primeira delas consiste em testar várias espécies. Isto seria o desejável, mas normalmente não é feito devido à demanda de tempo e esforço. Freqüentemente, as espécies mais sensíveis são testadas inicialmente e detalhadamente. A segunda consiste na escolha da espécie local mais importante e a terceira é o uso de espécie padrões. Entretanto, não existem espécies testes padrões que possam ser utilizadas como representante de diferentes tipos de ecossistemas (BUIKEMA e CAIRS., 1980).
Certamente a detecção e reações tóxicas torna-se mais precisa com o conhecimento detalhado da fisiologia, histologia e comportamento da espécie teste. Os resultados obtidos com espécies padrões devem ser comparados com os de espécies locais, visando contribuir para a identificação e a quantificação dos efeitos tóxicos (SPRAGUE, 1969).
2.4. Testes de avaliação da toxicidade aguda com daphnia
na cadeia alimentar (como presa e predador), ocupam diferentes níveis tróficos e, quando cultivadas em laboratório, apresentam sensibilidade definida (Soares,1985 apud ALMEIDA., 1987).
A Daphnia magna é um microcrustáceo comum no meio aquático usado
como alimento na criação de alevinos de peixes (PAUW et al., 1981). É a espécie-teste mais usada no mundo em testes de toxicidade devido à sua sensibilidade e eficiência nos testes. Foi selecionada e adaptada nas metodologias normatizadas por instituições internacionais (ISO, USEPA, OECD, DIN, AFFNOR) e nacionais (CETESB, ABNT, IBAMA). Seu ciclo biológico é curto, reproduz-se por partenogênese e é de fácil manejo no laboratório (IBAMA, 1987; ABNT, 1993; CETESB, 1991; KOVISTO, 1995; USEPA, 1985; BUIKEMA e CAIRS., 1982), Prestando-se para a execução de testes de toxicidade crônica e aguda.
Daphnia magna e Daphnia similis ocorrem em diversos ecossistemas da
Europa e Estados Unidos (BROOKES, 1957; SCOURFIELD e HARDING, 1966; PENNAK, 1953). A Daphnia laevis é uma espécie nativa que ocorre em diversos ecossistemas aquáticos
nos Estados Unidos (BROOKES, 1957), Brasil (ELMOOR, 1997), Argentina (PAGGI, 1977), Colômbia (SINGERLIN, 1914) e América Central (VANDE VELDE, et al., 1978).
Assim, verifica-se que as espécies Daphnia magna e Daphnia similis são
utilizadas em testes de toxicidade no Brasil, mesmo não sendo nativas do país. Por outro lado, a Daphnia laevis ocorre naturalmente no país, mas não está incluída nas normas brasileiras de
As daphnias podem ser cultivadas em água natural com pH entre 7,2 e 7,6; dureza entre 40 mg/L a 48 mg/L CaCO3 ; condutividade 160 µS/cm ou água natural
superficial ou subterrânea, filtrada em rede de zooplâncton com 30 ou 45 µm e pH próximo da neutralidade (IBAMA, 1987; CETESB, 1991; ABNT, 1993). As daphnias também podem ser cultivadas no meio denominado de M4, com pH 7,0 ± 0,2, dureza total de 250 ± 15 mg/L de CaCO3 (DEUUSCHES INSTITUT FUR NORMUNG, 1982).
2.5. Característica das espécies de daphnias selecionadas para estudo neste trabalho
Segundo ELMOOR (1997) as daphnias pertencem à OrdemAnomopoda
(Sars, 1865); à FamíliaDaphniidae (Straus, 1820); e ao GêneroDaphnia (MULLER, 1785).
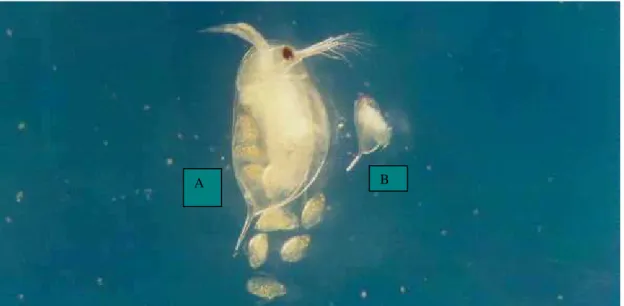
Na Figura 1 verifica-se um exemplar de cada uma das espécies de Daphnia utilizadas nesse
trabalho.
Figura 1. Espécimes das três espécies de daphnias Daphnia similis (A) Daphnia magna (B) Daphnia laevis (C).
A
A Família Daphniidae apresenta antênulas pequenas e nove setas olfativas
na fêmea. Antenas cilíndricas, com setas. Olhos grandes e ocelos geralmente pequenos ou ausentes. Estes organismos têm o pós-abdômen geralmente comprido, sempre com espinhos anais, setas natatórias não colocadas em projeção ou papila. As garras não têm espinhos, sendo sempre denticuladas e algumas vezes pectinada. Têm cinco pares de patas, sendo os dois primeiros prênseis; o quinto par tem uma grande seta recurvada, estendendo-se ao saco branquial. O intestino é simples, com dois cecos hepáticos. O macho, em geral, tem um gancho no primeiro par de patas (ELMOOR, 1997).
O gênero Daphnia tem forma oval ou elíptica, exceto quando modificada
pelo elmo e o corpo comprido lateralmente. Os organismos têm valvas reticuladas, com espinho no ângulo posterior-dorsal e espículas nas margens ventral e dorsal. O rostro é desenvolvido e pontiagudo na fêmea adulta. As antênulas são pequenas ou rudimentares, não móveis e situadas sob o rostro. Estes organismos têm três ou quatro processos abdominais, geralmente todos bem desenvolvidos, sendo o primeiro mais longo e em forma de língua. Apresentam efipios com ovos quando as condições ambientais são desfavoraveis. Os machos têm rostro, antênulas longas e moveis, normalmente com flagelo e o primeiro par de patas com longo flagelo e gancho (ELMOOR, 1997).
A Daphnia magna é um microcrustáceo utilizado em testes de toxicidade
por serem de fácil e econômica manutenção em condições em laboratório, pois são relativamente pequenos, tem ciclo de vida curto, alta fecundidade e reproduzem-se por partenogênese (IBAMA, 1987; CETESB, 1991; KOVISTO, 1995).
A Daphnia laevis (BIRGE, 1878) tem o espinho da carapaça longa,
com a extremidade entre as margens anteriores ventrais da carapaça. Ocelo presente. As antenas são curtas, com cerdas que não alcançam a margem posterior da carapaça. Têm garras com três pectens de espículas finas e iguais em tamanho. O segundo processo abdominal cerca ¼ do comprimento do primeiro e aproximadamente igual ao terceiro; comprimento total do animal é entre 1,0 e 2,0 mm (ELMOOR, 1997).
2.6. Uso dos agrotóxicos selecionados para estudo neste trabalho
O trichlorfon é um inseticida organofosforado muito para o controle de pragas como lagartas, brocas, cigarras, percevejos, moscas da fruta e mariposa que ocorre nas culturas de algodão, amendoim, arroz, banana, cacau, café, cana-de-açúcar, citros, feijão, girassol, goiaba, mangueira, milho, pastagem, seringueira, soja, tomate, trigo e videira (ANDREI, 1996). Este inseticida também é recomendado para o controle de parasitos de peixes em piscicultura (KUBITZA e KUBITZA, 1998).
O trichlorfon (metrifonato) pode ser usado para o tratamento de girodactilídeos, dactilogirídeos na dose de 0,5 mg/L de água, durante três dias. Também pode ser usado para o controle de copépodos ergasilidae em banhos de imersão rápida, de cinco a dez minutos, no concentração de 2,5 g/L de água usa-se quatro vezes por semana a temperatura não superior de 32 ºC. Para o controle de Lernea sp., banhos de imersão rápida,
cinco a dez minutos na concentração de 25 g/L quatro vezes por semana ou banhos prolongados de 0,5 mg/L de água, durante três dias. Para tratamento de Argulus foliaceus, 20
ml/L de água, em banhos de imersão de apenas dois minutos (PAVANELLI et al., 1999). O trichlorfon é um inseticida organofosforado bastante usado no controle de crustáceos parasitos de peixes (Lernaea sp., Argulus sp. e Ergasilus sp.), tremátodos
tratamentos indefinidos com concentrações de 0,13 a 0,25 mg/L; banhos prolongados com 1a 2,5 mg/L e banho 1a 3 minutos com 10 mg/L (KUBITZA, 1999).
O sulfato de cobre (CuSO4.5H2O) e recomendado na aquicultura para o
controle de protozoários, tremátodos monogênios, fungos e baterias externas. Nos Estados Unidos é usado como algicida e sem restrição para uso em cultivos de peixes de mesa (KUBITZA e KUBITZA, 1998).
É um potente algicida, herbicida, eliminando o fitoplâncton e plantas aquáticas, podendo causar drástica redução na concentração de oxigênio dissolvido na água (KUBITZA, 1998).
O artigo 21 da Resolução CONAMA n° 020, de 18 de julho de 1986
estabelece que o valor máximo admissível é de 1,0 mg de sulfato de cobre /L de água e de 1,0
µg de inseticidas organofosforados /L de água (IBAMA, 1987).
2.7. Características principais dos agrotóxicos selecionados para estudo neste trabalho
2.7.1. Trichlorfon
O trichlorfon (dimetil-hidroxi-2,2,2,-tricloroel) é um inseticida não sistêmico com ação de contato e ingestão. Atua inibindo a enzima acetilcolinesterase no sistema colinérgico do sistema nervoso dos organismos vivos (TOMLIN, 1995). De acordo com seus dados de toxicidade aguda, está classificado na classe toxicológica II, altamente tóxico (ANDREI, 1997).
No homem, os inseticidas organofosforados podem causar transtornos sensoriais marcantes como imagens confusas, agravadas pela miose, salivação intensa, lacrimejamento, cólica, diarréia, tenesmo vesical e intestinal, micção dificultada e dolorosa, secreção bronquiolar seguida de tosse e dificuldades respiratórias, ansiedade, confusão mental seguida de alteração depressiva ligado ao sistema neurovegetativo com repercussão sobre os sistemas circulatório e respiratório, convulsões, transtornos na circulação periférica. O paciente intoxicado apresenta cãimbra, dores musculares agudas, palidez e episódios de hipertensão arterial e, quando não tratado a tempo, vai a óbito (SAMPAIO e GUERRA, 1998).
e acaba morrendo. O trichlorfon apresenta baixa persistência ambiental na água, sendo degradado em menos de uma semana (KUBITZA e KUBITZA, 1998).
Os organosfosforados, quando aplicados em tanques, reduzem a população de crustáceos, copépodos e cladóceros planctônicos, mas não afetam rotíferos e fitoplâncton (Mccraaen e Philips, 1977, apud MARTINS, 1998).
2.7.2. Sulfato de cobre
O sulfato de cobre é um dos produtos mais utilizados atualmente para tratamento de parasitoses dos peixes (protozoários, tremátodos, monogênio, fungos e bactérias externas) (Griffn, 1994 apud MARTINS, 1998). Porém estudos devem ser feitos para analisar sua ação sobre o ambiente e o tempo residual em peixe cultivado (MARTINS, 1998). Quanto ao impacto ambiental do sulfato de cobre, em experimentos realizados no Laboratório de Patologia de Organismos Aquáticos do Caunesp foi verificado por MARTINS (1998) que, aos dez dias após a aplicação na água, a fauna e flora voltam ao normal. Na análise residual desse produto na carne do peixe foi verificado que somente após 30 dias da exposição o nível de cobre já estava próximo ao observado em peixes não expostos.
Devido à formação do íon cúprico Cu+2, durante a sua dissolução na água, o
sulfato de cobre é bastante tóxico aos peixes, principalmente em águas com baixa alcalinidade total.
2.7.3. Dicromato de potássio
Nos testes de toxicidade usados para o controle da poluição hídrica, substâncias consideradas como referência são utilizadas para avaliar e controlar a manutenção da sensibilidade de organismos aquáticos ao longo do tempo. Assim, a utilização de uma substância de referência como o dicromato de potássio (K2Cr2O7) num método padronizado
aumenta a confiabilidade (Peltier, e Weber, 1985, Bukema et al., 1982 apud BERTOLETTI et. al., 1989).
O dicromato de potássio (K2Cr2O7) é utilizado como substância de
referência nos testes padronizados de toxicidade para microcrustáceos (IBAMA, 1987), em que a sensibilidade da daphnia varia com a dureza da água de cultivo (DEUUSCHES INSTITUT FUR NORMUNG, 1982).
A faixa aceitável da CE50-24 h de dicromato de potássio para Daphniasimilis
é de 0,04 mg/L a 0,17 mg/L na água do meio de cultivo com pH 7,6, condutividade 160
µS/cm e dureza de 40 a 48 mg/L em CaCO3 (IBAMA, 1987; CETESB, 1991; ABNT, 1993).
Esse método pode ser aplicado a outras espécies do gênero daphnia, desde que sejam conhecidas as condições básicas para sua manutenção e cultivo em laboratório e também sua sensibilidade às substâncias de referência (CETESB, 1991; ABNT, 1993).
Outro método utilizado para se fazer o controle da sensibilidade da cultura de daphnia é o que estabeleceu o intervalo de aceitação da CE50-24 h calculado por média ± 2
2.8. Toxicidade aguda de agrotóxicos e da substância de referência para daphnias
Em testes de toxicidade aguda de trichlorfon para Daphnia magna, cultivada
em meio M4, com dureza de 250 ± 15 mg/L em CaCO2, foram calculados os valores de CE 50-48 h de 0,00096 mg/L (TOMLIN, 1995); 0,01 mg/L (EXOTOXNET, 1996) e 0,000586 mg/L
(FERREIRA, 1998).
Em testes de toxicidade aguda de sulfato de cobre a Daphnia magna
cultivada em meio M4, com dureza 250 ± 15 mg/L em CaCO3 estudadas por
SECO-GORDILLO et al. (1998), KANGAROT e RAY (1989) e ELNABARAWY e ROBIDEN. (1986) calcularam CE50-48 h, respectivamente de 0,21mg/L, 0,54 mg/L e 0,017 mg/L, 0,054mg/L e 0,041 mg/L. Nestas mesmas condições, MOUNT e NORBERG (1984) encontraram valores respectivos para D. pulex e C. dubia de 0,053 mg/L e 0,017 mg/L e
ELNABARAWY e ROBIEN., (1986) encontraram, para os mesmos organismos, valores de CE50 - 48h, respectivos de 0,031 mg/L e 0,023 mg/L. BERTOLETTI et al. (1992),
encontraram valores de CE50-24 h para Daphnia similis de 0,022 mg/L; 0,019 mg/L; 0,024
mg/L; 0,034 mg/L; 0,023 mg/L, também para esse o sulfato de cobre.
Na norma DIN 38.412 (1982), a faixa aceitável de CE50-24 h do dicromato
de potássio para Daphnia magna, cultivada em meio M4, com dureza 250 ± 15 mg/L em
CaCO3, é de 0,9 a 2,0 mg/L, Na norma ISO 6341 (1983), a faixa aceitável de CE50-24 h para D. magna é de 0,9 a 2,4 mg/L.
Em testes de avaliação de toxicidade aguda com Daphnia magna,
FERREIRA (1998) calculou valores de CE50-48 h de 0,07 mg de K2Cr2O7 /L em água de mina
ajustada com pH 7,6, condutividade 160 µS/cm e dureza de 40 a 48 mg/L em CaCO3
cálcio. BASSFELD (2001) encontrou valores de 0,19 mg/L do dicromato de potássio, para D. magna, cultivada em M4 com dureza 118 ± 12 em CaCO3.
Para Daphnia similis, BERTOLETTI et al. (1992) calcularam valores de
CE50-24h em 0,023 mg/L de CuSO4. 5H2O.
Para Dahnia laevis não foi encontrado nenhum trabalho sobre a
sensibilidade desta espécie ao dicromato de potássio.
2.9. Efeito do sedimento sobre a toxicidade de agrotóxicos para organismos aquáticos
O sedimento é um material particulado natural, orgânico ou mineral, que pode ser transportado e depositado normalmente no fundo de ecossistemas aquáticos, (SETAC, 2001). O próprio solo do fundo dos corpos da água também pode ser denominado de sedimento. A função primordial do sedimento é agir como filtro para contaminantes da água, fixando e removendo elementos nocivos ao homem e à natureza (CIHACEK et. al., 1996).
Os compostos químicos podem existir sobre três formas de disponibilidade preferenciais em ecossistemas aquáticos: dissolvidos ou adsorvidos em um componente biótico ou abiótico, suspenso na coluna de água ou depositado no fundo, e acumulado nos organismos (MURILO, 2000).
A taxa de adsorção de substâncias químicas na água depende de fatores como a temperatura, o pH, a concentração de material em suspensão, a dureza, a alcalinidade, o fluxo, a profundidade e o tamanho das partículas presentes e dos compostos químicos (MURILO, 2000).
propriedades físicas e químicas do sedimento, da água e da natureza da molécula. Portanto, assume-se que a biodisponibilidade dos herbicidas para os organismos aquáticos, o potencial destes produtos em manifestar efeitos adversos sobre a biota, são afetados pela partição das moléculas entre as fases aquosas e sólida (JONSSON e MAIA, 1999). Estes autores verificaram também que na ausência de sedimento, o herbicida clamozone é aproximadamente 175 vezes mais tóxico que o quimclorac na presença de sedimento. Para o glyphosate, a maior valor da CL(I)50 na presença de sedimento deveu-se à imobilização do
herbicida no sedimento. Por tanto, há necessidade de maior concentração, ou quantidade do herbicida para causar o mesmo efeito na Daphnia pulex. Portanto, o sedimento imobiliza e
deixou disponível para atingir a Daphnia pulex apenas 59,5% da concentração do herbicida
adicionado na água.
KUSK (1996) estimou valores de CE50-48 h do piramicarb para Daphnia magna de 16 µg/L em ausência de sedimento e de 24 µg/L em presença de sedimento. Este
autor concluiu que o sedimento imobiliza 33,3 % do piramicarb da água, tornando-o menos biodisponivel para a Daphnia magna.
JONSSON e MAIA (1999) calcularam valores de CE50–48 h do herbicida
clamazone para Daphnia similis equivalentes a 1,51 mg/L em sistema sem sedimento e 11,28
mg/L em sistema com sedimento. Nestes resultados, verifica-se que o sedimento imobilizou 86,6% do herbicida na água.
Na bibliografia consultada não for encontrado estudos sobre os efeitos do sedimento na a toxicidade aguda de sulfato de cobre e trichlorfon para as três espécies de daphnias consideradas.
2.10. Risco de intoxicação da contaminação ambiental causado pelo uso de sulfato de cobre e trichlorfon na piscicultura
A recomendação de uso de agrotóxicos resulta em uma concentração ambiental estimada (CAE) que é definida como uma estimativa da exposição de organismos não alvos aos agrotóxicos, resultante da aplicação direta no ambiente (SETAC, 1994).
As decisões em avaliações de risco que envolvem organismos aquáticos são baseadas na taxa de uma única CAE para uma única referência do nível do efeito do agrotóxico. Esta inter-relação é conhecida como o quociente de risco. O quociente máximo aceitável de risco é 0,1; 0,5 e 1 (SETAC, 1994).
O critério de aceitação do risco na CAE equivalente a 0,1 x CE50 é a concentração regulatória atual. Esta concentração é baseada na suposição de que uma intoxicação aguda significativa não ocorrerá neste nível de exposição (SETAC, 1994).
em função da comparação da CE50 com a CAE. O critério de classificação do risco de
intoxicação ambiental das CAEs é o seguinte:
Alto risco de intoxicação da espécie se CAE 0,5 x CE50
Moderado risco de intoxicação da espécie se 0,1 X CE50 CAE < 0,5 x CE 50
3. MATERIAL E MÉTODO
Todo o material e a metodologia utilizados nesse trabalho seguiram as recomendações estabelecidas nas normas e metodologia da APHA (1991), MURTY (1988) e RAND e PETROCELLI (1985), IBAMA (1987) CETESB (1991), ABNT (1993) e DEUTSCHES INSTITUT FUR NORMUNG DIN 38.412 (1982), mas com ligeiras modificações, e estão descritos nos itens a seguir.
3.1. Local da realização dos testes
Os testes de avaliação da toxicidade aguda do sulfato de cobre e do trichlorfon para as três espécies de daphnias foram conduzidos no Laboratório de Ecotoxicologia dos Agrotóxicos e Sanidade Ocupacional, do Departamento de Fitossanidade, da FCAV/Unesp – Câmpus Jaboticabal, associado ao Centro de Aqüicultura da Unesp/Caunesp.
3.2. Organismos-teste
Os exemplares de Daphnia similis (Figura 1 A) foram provenientes de uma
cultura mantida em recipientes de vidro com dois litros de água, em uma estufa incubadora, tipo BOD, mod. 347 FANEM, na temperatura de 20 ± 2°C, no Laboratório de Ecotoxicologia
do Departamento de Defessa Fitossanitária da FCAV / Unesp – Câmpus de Jaboticabal, SP. O fotoperíodo utilizado foi de 12 horas, com intensidade luminosa em torno de 1000 lux, Os exemplares de Daphnia magna (Figura 1 B) foram obtidos de culturas
mantidas na Universidade Federal do Paraná (UFP) no Centro de Estudos do Mar, reproduzidos e mantidos em condições de laboratório.
Os exemplares de Daphnia laevis (Figura 1 C) foram coletados em tanques
de cultivo de peixes no Centro de Aqüicultura da Unesp – Jaboticabal – SP e adaptados as condições de laboratório, usando as mesmas condições de criação das outras duas espécies,
mencionadas acima.
3.2.2. Cultivo das daphnias
3.2.2.1. Água de cultivo
As daphnias foram cultivadas em água natural de mina filtrada em rede de zooplâncton com 30 µm, de acordo com as normas do IBAMA (1987), CETESB (1991); ABNT (1993), com condutividade de 160 µS/cm, pH 7,6 e dureza de 45 mg/L em CaCO3,
previamente aerada por 48 horas, com aerador de aquário modelo TROPICAL 11.
A água de cada cristalizador (Figura 2) foi renovada completamente toda semana, com repicagem e descarte dos organismos mais velhos, no momento da troca de água.
foram descartados nas trocas de água. No meio da semana os recipientes de cultivos foram limpados com sifoneamento das sujeiras dos fundos.
Figura 2. Vista geral da câmara de cultivo das três espécies de daphnias.
3.2.2.2. Alimentação das daphnias
A alimentação das daphnias foi realizada com uma suspensão de células de alga da espécie Scenedesmus subspicatus, na concentração de 5x106 células de alga por
3.2.2.2.1. Cultivo de alga
A alga utilizada na alimentação das daphnias foi cultivada em erlenmeyer de 2 L provido de aeração dentro de uma câmara BOD (Figura 3), na temperatura de 20 ± 2°C,
luminosidade de 500 lux de intensidade e fotoperíodo de 15 h. O meio utilizado para manutenção da cultura de algas foi o LC – OLIGO autoclavado, recomendado pela CETESB (1991).
Figura 3. Vista geral da câmara de cultivo de alga Scenedesmus subspicatus utilizadas
na alimentação dasdaphnias.
3.2.2.2.2.2. Ração fermentada
de 350 µm e misturada com fermento biológico seco instantâneo na proporção de 0,5 g por 100 mL do filtrado (CETESB, 1991).
3.3. Características físico-químicas do solo utilizado como sedimento
O sedimento utilizado foi da camada superficial de 0 a 20cm do solo de uma área isenta de resíduos tóxicos, localizada no Centro de Pesquisas em Sanidade Animal (CPPAR) da FCAV/Unesp Campus de Jaboticabal. O solo foi peneirado e sua composição química e granulométrica foi analisada antes de ser usada nos experimentos e estão contidos na Tabela 1.
Tabela 1. Análises químicas e granulométricas do solo usado como sedimento nos testes de toxicidade aguda.
Elementos Valores
pH (em Ca) 5,8
MO (g/dm3) 24,0
P (g/dm3) 46,0
K (mmlcd/dm3) 4,3
Ca (mmlcd/dm3) 47,0
Mg (mmlcd/dm3) 16,0
H + AL (mmlcd/dm3) 25,0
SB (mmlcd/dm3) 67,3
T (mmlcd/dm3) 92,3
V (%) 73,0
Argila (g/kg) 440,0 Limo (g/kg) 226,0 Areia fina (g/kg) 100,0 Areia grosa (g/kg) 200,0
Classe textural Argilosa
3.4. Preparo das soluções-estoque dos agrotóxicos
produzido pela empresa BAYER Brasileira S.A O sulfato de cobre (CuSO4.5H2O), produzido
pela CYRQ Ind. Brasileira. O dicromato de potássio, produzido pela Chimie Test Ind. Brasileira, com grau analítico, foi utilizado como substância de referência, para o controle da sensibilidade dos organismos-teste IBAMA (1987), CETESB (1991) e ABNT (1993).
3.5. Controle da sensibilidade dos organismos-teste com a substância de referência dicromato de potássio
Foram realizados testes de sensibilidade para as três espécies de daphnias ao dicromato de potássio (K2Cr2O7) de acordo com as metodologias normatizadas por IBAMA
(1987), CETESB (1991) e ABNT (1993).
Os testes foram realizados uma semana antes, durante e após a realização dos testes com os dois agrotóxicos em estudo. Os valores da CL(I)50–24 h foram calculados
em cada teste e todos os valores foram utilizados no cálculo da media durante o período. O critério da média ± 2 desvios padrões foi utilizado para fazer o controle da sensibilidade dos organismos cultivados, de acordo com o controle de qualidade estabelecido na metodologia do IBAMA (1991) e da CETESB (1991).
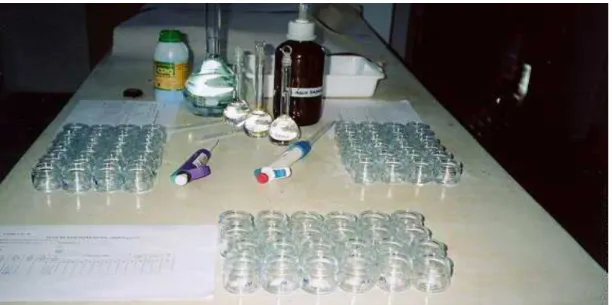
Os testes de sensibilidade foram realizados a partir de soluções estoques com concentrações de 0,1; 1 e 10 mg/L, em uma série de frascos de vidro com capacidade de 50 mL, utilizando-se 30 mL, contendo soluções-teste de K2Cr2 O7, diluídas em água natural
Figura 4. Frascos de vidro utilizados nos testes de sensibilidade das três espécies de daphnia à substância de referência dicromato de potássio.
As concentrações nominais do dicromato de potássio utilizadas nos testes definitivos foram selecionadas de acordo com os dados dos testes preliminares, onde se estabeleceu a faixa de sensibilidade de cada espécie de daphnia. Em cada frasco de vidro foram colocados cinco organismos neonatos, com idade entre seis e 24 horas (Figura 5) e mantidos em BOD por 24 horas, na temperatura a 20 ± 2 °C e no escuro. Após as 24 horas
Figura 5 Espécimes de Daphnia similis: adulto (A) e neonato (B) com idade entre seis e 24
horas.
3.6. Testes de toxicidade aguda do sulfato de cobre e do trichlorfon para as daphnias
Os testes preliminares e definitivos com o sulfato de cobre e trichlorfon foram realizados de acordo com a metodologgia estabelecida pelo IBAMA (1987), CETESB (1991) e ABNT (1993). Entretanto, nos primeiros testes instalados com trichlorfon ocorreu morte de todos os organismos, inclusive nas parcelas sem o agrotóxico. Para solucionar este problema, os testes com trichlorfon foram realizados em frascos de vidro fechados com tampa de plástico, conforme observa-se na Figura 6. Esta modificação na metodologia viabilizou a realização dos testes com o trichlorfon, pois o fechamento dos frascos–teste evitam a volatilização do ingrediente ativo durante os testes e não afetam a sobrevivência dos organismos-teste.
Figura 6. Frascos de vidro fechados utilizados nos testes definitivos com trichlorfon na ausência e presença de sedimento.
3.6.1. Testes preliminares com as três espécies de daphnias
As fêmeas ovadas das três espécies de daphnias foram colocadas separadamente em recipiente de vidro (cristalizador) limpo, contendo água natural filtrada modificada, com pH 7,6; dureza de 45 mg/L em CaCO3 e condutividade de 160 µS/cm. Após
a separação, estas fêmeas foram alimentadas como descrito no item 3.2.2.2. Depois de 24 horas e seis horas antes do início dos testes, as fêmeas ovígeras foram retiradas e os neonatos foram utilizados nos testes de toxicidade (CETESB, 1991).
3.6.2. Soluções estoques de sulfato de cobre e trichlorfon
Antes de começar os testes as soluções estoque de trichlorfon , foram preparadas pipetando 2 mL de Dipterex 500, contendo 500 g de ingrediente ativo/ L e transferido diretamente para balão volumétrico de 1000 mL. O volume do balão foi completado com água destilada agitando com movimentos circulares, obtendo-se solução estoque de 1000 mg/L. Esta solução foi diluída e soluções estoques com concentrações de 0,0001 e 0,00001 mg/L foram obtidas. A partir destas se obteve as soluções-teste (Tabelas Anexos).
Para o dicromato de potássio dilui-se um grama e completado para um litro de água destilada, em balão volumétrico de 1000 mL. Esta solução foi diluída obtendo-se solução estoque de 1000 mg/L com concentrações de 1,0 e 10 mg/L. A partir destas soluções se obteve as soluções-teste (Tabelas Anexo).
Para obtenção das soluções estoques e soluções-teste, utilizou-se a seguinte formula:
C1 x V1 = C2 x V2, onde:
C1 = Concentração inicial
C2 = Concentração Final
V1 = Volume inicial
V2 = Volume final
Numa série de recipientes de vidros com 30 mL de capacidade, foram preparados volumes conhecidos de soluções estoque de sulfato de cobre nas concentrações de 1 e de 10 mg/L ou de trichlorfon, nas concentrações de 0,0001 e de 0,00001 mg/L, completando-se para 9 mL de água de cultivo previamente aerada por 48 horas, para garantir a saturação mínima de oxigênio nas soluções–teste desejadas. Em seguida, para completar o volume das soluções-teste, foi adicionado 1,0 mL com água de cultivo contendo cinco neonatos coletados nos recipientes das fêmeas ovígeras.
3.6.4. Testes com sedimento
Em uma série de recipientes de vidro foram colocados 3,0 g de solo, utilizado como sedimento, e sobre esse foram colocados cuidadosamente 8 mL de água de cultivo previamente aerada por 48 horas, para garantir a saturação mínima de oxigênio. Volumes conhecidos da solução-estoque de sulfato de cobre 10 e 100 mg/L ou de trichlorfon, 0,1 e 0,01 mg/L, foram depositadas nos recipientes de vidro e completado para 9,0 mL com água de cultivo. Imediatamente após a colocação das soluções-teste sobre o sedimento foram colocados 1,0 mL da água de cultivo com cinco neonatos de daphnia coletados dos recipientes das fêmeas ovígeras.
Foram conduzidos experimentos com cinco tratamentos para cada uma das três espécies de daphnia com sulfato de cobre ou trichlorfon, em presença e ausência do sedimento. Cada tratamento foi composto por quatro repetições e um controle para tratamento. As daphnias neonatas dos testes permaneceram na sala de bioensaios durante 48 h na temperatura de 20 ± 2 °C, em ambiente escuro, sem alimentação. Depois de 24 e 48
organismos que não conseguiam nadar por 15 segundos após leve agitação do frasco foram considerados imóveis (CETESB, 1991).
3.7. Testes definitivos com as três espécies de daphnia
Com os intervalos das concentrações estabelecidos nos testes preliminares, foram conduzidos os testes definitivos, seguindo-se o mesmo procedimento do teste preliminar para cada uma das três espécies de daphnia, sem e com sedimento (Figura 7; Figura 8; Figura 9 e Figura 10). Estas figuras são dos testes com sulfato de cobre, identificados pela ausência de tampas nos frascos de vidro, pois nos testes com trichlorfon, todos os frascos de vidro foram fechados com tampa de plástico (Figura 6)
Figura 8. Frascos de vidro utilizados nos testes definitivos com sulfato de cobre em presença de sedimento.
Figura 10. Vista do local das avaliações e contagem dos neonatos após os períodos de exposição dos neonatos de daphnia aos agrotóxicos.
3.8. Cálculo da CE50 –48h
Com os dados de imobilidade das daphnias às 48 h de exposição foram calculados os valores de CE50–48 h utilizando-se o método “Treimed Sperman Karber”
(HAMILTON et. al., 1977), definido por RAND & PETROCELLI (1985) como sendo a concentração estimada que produz 50% de mortalidade, no caso , imobilidade, da população exposta a um agente tóxico por determinado período de tempo. Nos resultados dos testes com a substância de referência dicromato de potássio foram calculados os valores de CE50-24 h
apenas.
3.9. Avaliação do risco de intoxicação ambiental das daphnias devido à contaminação proporcionada pelo uso de sulfato de cobre e trichlorfon em piscicultura
foram realizadas de acordo com a proposta da SETAC (1994). Os riacos de intoxicação ambiental foram avaliados por meio das comparações dos valores de CE50-48 h calculados nos testes de toxicidade aguda, sem e com sedimento, com os valores das concentrações ambientais estimadas (CAE) das recomendações de uso destes dois agrotóxicos em piscicultura (SETAC (1994).
Os cálculos das CAEs foram realizados com a dosagem recomendada dos dois agrotóxicos em estudo para o controle de insetos predadores aquáticos, parasitos e patógenos de peixes em piscicultura em geral.
A CAE do sulfato de cobre utilizada foi de 0,33 mg/L, de acordo com as recomendações de POST (1987), MARTINS (1998), KUBITZA e KUBITZA (1999) e PAVANELLI et al., (1999). A CAE do trichlorfon utilizada foi de 0,13 mg/L, de acordo com as recomendações de REICHENBACH-KLINKE (1982), POST (1987), KINKLELIN et al., (1991), NOGA (1996), MARTINS (1998), KUBITZA e KUBITZA (1999) e PAVANELLI et al., (1999).
O critério utilizado para classificar os riscos ambientais dos agrotóxicos para as daphnias baseia-se na comparação dos valores da CE50–48 h e das CAE, de acordo com a SETAC (1994) e é o seguinte:
Alto risco de intoxicação da espécie se CAE 0,5 x CE 50
Moderado risco de intoxicação da espécie se 0,1 x CE50 CAE < 0,5 x CE50
Baixo risco de intoxicação da espécie se CAE < 0,1 x C50
3.10. Análise estatística
Para o cálculo do coeficiente de variação dos resultados dos testes de toxicidade aguda com dicromato de potássio (K2Cr2O7), para as três espécies de daphnias, foi
C.V.= S.100 / X Onde :
C.V.= coeficiente de variação em %;
S = desvio-padrão dos valores de CE50-24h, em mg/L; X= Média das CE50–24 h, em mg/L.
Os valores das CE50–48 h calculados para cada repetição de cada um dos testes definitivos realizados com o dicromato de potássio foram analisados estatisticamente, de acordo com GOMES (2000), por meio do delineamento inteiramente ao acaso considerando-se como tratamento as três espécies de daphnias e cada um dos seis testes como repetições.
Os valores das CE50–48 h calculados para cada repetição dos tratamentos
utilizados nos testes definitivos com sulfato de cobre e trichlorfon, com as três espécies de daphnias, foram analisados estatisticamente, de acordo com GOMES (2000), por meio do delineamento inteiramente ao acaso e os tratamentos dispostos no esquema fatorial 3x2, sendo os fatores:
E= Espécies de daphnias (D. magna, D. similis e D. laevis); e
4. RESULTADOS E DISCUSSÃO
4.1. Testes de controle da sensibilidade das daphnias com dicromato de potássio
Os valores calculados de CE50-24 h dos seis testes de toxicidade aguda com a substância de referência dicromato de potássio, para as três espécies de daphnias, estão apresentados na Tabela 2, com os respectivos valores de intervalo de confiança, médias do teste (X), desvio padrão (S) e coeficiente de variação (C.V.).
Tabela 2. Valores médios de CE50-24 h (mg de K2Cr2O7/L)calculados para os testes de
toxicidade aguda e do intervalo de confiança (95%) em água natural ajustada, para as três espécies de daphnias.
Daphnia magna Daphnia similis Daphnia laevis
Data do
teste CE50-24h (mg/L)
Intervalo de confiança (95%) CE50-24h (mg/L) Intervalo de confiança (95%) CE50-24h (mg/L) Intervalo de confiança (95%)
20/02/02 0,06 0,05 – 0,09 0,08 0,08 – 0,09 0,07 0,06 – 0,10
27/02/02 0,06 0,04 – 0,07 0,06 0,04 – 0,09 0,03 0,02 – 0,06
07/03/02 0,07 0,05 – 0,09 0,08 0,07 – 0,10 0,04 0,03 – 0,07
11/03/02 0,13 0,11 – 0,17 0,14 0,12 – 0,17 0,12 0,09 – 0,18
18/03/02 0,13 0,17 – 0,19 0,16 0,15 – 0,17 0,15 0,14 – 0,17
25/03/02 0,10 0,09 – 0,12 0,10 0.09 – 0.13 0,09 0,08 – 0,12
X 0,09 A 0,10 A 0,09 A
S 0,03 0,04 0,04
C.V.(%) 36,11 39,42 52,05
F espécie de daphnia = 0,38 NS ; DMS (%) = 0,0596 mg/L
Médias seguidas por mesma letras maiúsculas nas linhas não diferem estatisticamente entre si, pelo teste de Tukey, ao nível de 5% de probabilidade.
Considerando-se o critério de media ± 2 S para determinar o intervalo de
aceitação dos valores de CE50-24 h , para o controle da sensibilidade das daphnias (USEPA, 1985), verifica-se nas Figuras 10, 11 e 12 que as três espécies também o atendem.
Figura 11. Controle de qualidade dos organismos-teste e estabelecimento da faixa aceitável, de CE50-24 horas do dicromato de potássio a Daphnia magna (LS = limite superior; LI = limite inferior; x = média e s = desvio padrão)
0 0,09
0 1 2 3 4 5 6 7
Numero do teste
C
L
(I
)5
0
-2
4
h
(
m
g
/L
)
Figura 12. Controle de qualidade dos organismos-teste e estabelecimento da faixa aceitável, de CE50-24 horas do dicromato de potássio a Daphnia similis (LS = limite superior; LI = limite inferior; x = média e s = desvio padrão).
Figura13 Controle de qualidade dos organismos-teste e estabelecimento da faixa aceitável, de CE50-24 horas do dicromato de potássio a Daphnia laevis (LS = limite superior; LI = limite inferior; x = média e s = desvio padrão).
0 0,1
0 1 2 3 4 5 6 7
Numero do teste
C L (I ) 5 0 -2 4 h ( m g /L ) D. similis 0 0,09
0 1 2 3 4 5 6 7
Numero do teste
Observa-se na Tabela 2 que os valores de CE50–24 h do K2Cr2O7 para as três
espécies de daphnias, comparados com os resultados de outros pesquisadores (Tabela 3) para
Daphnia similis estiveram dentro do intervalo estabelecido como controle de qualidade pelo
CETESB (1991), ABNT (1993) e IBAMA (1987). Nestas metodologias, o intervalo de aceitabilidade da CE50-24h está entre 0,04 e 0,17 mg/L de K2Cr2O7 para D. similis. Estes
dados também concordam com os resultados obtidos por BERTOLETTI et al., (1992). Para
D. magna, o valor de CE50–24 h calculado para o dicromato de potássio (K2Cr2O7) está
próximo aos resultado obtido por FERREIRA (1998).
Os valores calculados neste trabalho para D. magna estão muito inferiores
aos calculados por SORVARI e SILLAMPAA (1996) e BASSFELD (2001). Os maiores valores calculados por estes dois autores podem ser devidos á maior dureza da água de cultivo que utilizaram, de 250 e 118 mg/L em CaCo3, respectivamente. Assim, as diferenças de
sensibilidade podem ser atribuídas ao método utilizado para o cultivo das daphnias, visto que ela varia em função da dureza da água de cultivo (DEUUSCHES INSTITUT FUR NORMUNG, 1982).
Tabela 3. Valores médios de CE50-24 h (mg de K2Cr2O7/ L) calculados para as três espécies
de daphnias neste trabalho e por outros autores.
FONTE RESULTADOS em (mg/L)
Este trabalho Água de cultivo dureza 40-48 mg/L em CaCO3
D.m.= 0,09; D.s.= 0,10; D.l = 0,09
FERREIRA (1998) Água de cultivo dureza 40-48 mg/L em CaCO3
D.m = 0,07
BERTOLETTI et al. (1998) Água mole dureza 40-48 mg/L em CaCO3
D. s = 0,13; 0,15; 0,07; 0,05; 0,09; 0,17; 0,11; 0,09 0,06; 0,05
CETESB (1991); IBAMA(1987); ABNT (1993) Água mole dureza 40-48 mg/L em CaCO3
D. s = 0,04 – 0,17
I.S.O. 6.341 (1983) Meio M4 dureza 250 ± 15 mg/L em CaCO3
D. m = 0,9 – 2,4
DIN 38.412 (1982) Meio M4 dureza 250 ± 15 mg/L em CaCO3
D. m = 0,9 - 2,0
SORVARI e SILLAMPAA (1996) Meio M4 dureza 250 ± 15 mg/L em CaCO3
D. m = 0,34
BASSFELD (2001) Meio M4 dureza 118 ± 12 mg/L em CaCO3
D. m = Daphnia magna, D. s = Daphnia similis, D. l = Daphnia laevis
Para D. laevis na bibliografia consultada, não foi encontrado qualquer artigo
sobre a sensibilidade desta espécie ao dicromato de potássio
Os valores da CE50-24 h calculados do dicromato de potássio para as três
espécies de daphnia demostra que o cultivo destes organismos-teste atenden ao controle de qualidade estabelecido nas normas da ABNT (1993), CETESB (1991) e do IBAMA (1987),
cujo valor de CE50-24 horas deve estar entre 0,04 e 0,17 mg/L. e também ao critério do intervalo correspondente à X = ± 2 S (Figura 10,11 e 12).
4.2. Testes de toxicidade aguda do sulfato de cobre para três espécies de daphnias na ausência e presença de sedimento
Os resultados da análise de variância dos valores de CE50-48 h calculados
nos testes com sulfato de cobre encontram-se na Tabela 4. Verifica-se nestes dados os efeitos altamente significativos dos dois fatores estudados e da interação entre ambos. As análises dos desdobramentos dos graus de liberdade dos níveis dos fatores e da interação estão apresentados na Tabela 5
Tabela 4. Análise de variância dos valores de CE50-48 h do sulfato de cobre para as três
espécies de daphnias na ausência e presença de sedimento.
Causas de variação G.L. S. Q. Q. M. F
Espécies (E) Sedimento (S) Interação E x S
2 1 2 0,211 0,2204 0,799 0,0105 0,2204 0,0400 12,3** 257,6** 46,6**
**significativo ao nível de 1% de probabilidade C.V. = 18,2(%)
Tabela 5. Desdobramento dos graus de liberdade dos fatores do teste de toxicidade aguda de sulfato de cobre para as três espécies de daphnias na ausência e presença do sedimento.
Espécies CE50 – 48h (mg/L)
Agrotóxico Sedimento
D. magna CE50-48h D. similis CE50-48h D. laevis CE50-48h Médias
sulfato de cobre
Ausente
Presente
0,045 b B
0,347 a A
0,042 b B
0,282 b A
0,107 aA
0,140 c A
0,065 B
0,257 A
Médias seguidas seguidas por letras minúsculas diferentes, na linha, indica diferenças significativas entre espécies.
Médias seguidas por letras maiúsculas diferente na coluna, indica diferenças entre presença e ausência de sedimento
DMS (5%) Espécies = 0,4 mg/L; DMS (5%) Sedimento = 0,02 mg/L
Na Tabela 5 verifica-se que na ausência de sedimento, a Daphnia magna e a Daphnia similis não apresentaram diferenças de sensibilidade ao sulfato de cobre, enquanto
que a Daphnia laevis foi significativamente menos sensível que as outras duas espécies. A
maior tolerância de Daphnia laevis ao sulfato de cobre pode ser devida ao fato de ser uma
espécie nativa e, conseqüentemente, mais rústica.
Poucos estudos de avaliação da sensibilidade constataram similar sensibilidade entre membros da família Daphnidae. Esta constatação podem ser devida a comparações de pequeno número de dados de toxicidade aguda (CANTON e ADEMA, 1978; HIECKEY, 1989, MARCHINI et al.; 1993; LILIUS et al, 1995; VESSTEEG, et al, 1996). Estas pesquisas evidenciam uma comparação sistemática da história de vida, distribuição geográfica e métodos de testes de toxicidade com Ceriodaphnia sp. e Daphnia magna.
e D. similis. A maior diferença de CE50-48 h ocoreu com a D. magna, demostrando maior
imobilidade do sulfato de cobre no sedimento que foi 7,7 vezes a concentração na água de cultivo. A segunda maior imobilidade do sulfato de cobre pelo sedimento foi verificado com a
D. similis, que foi de 6,7 vezes a concentração na água de cultivo. Por outro lado, verifica-se
que não houve diferença significativa entre os valores de CE50-48 h calculados para D. laevis
na ausência e presença de sedimento. Este resultado pode ser devido a maior tolerância desta espécie nativa ao sulfato de cobre, entre as três espécies estudadas.
Considerando-se estes resultados, verifica-se que a presença de sedimento imobiliza as moléculas do sulfato de cobre da água de cultivo das daphnias imediatamente após o contato inicial. Acredita-se que este processo de imobilização deve ser crescente ao longo do tempo, dentro de certos limites, dependendo de diversos fatores relacionados ao próprio sedimento e à molécula tóxica.
As diferenças entre as valores de CE50-48 h na ausência e presença de
sedimento podem estar relacionadas ao efeito de absorção, floculação e oxidação do sulfato de cobre na presença de sedimento. JONSON e MAIA (1999) citam que, na maioria dos estudos, o sedimento influencia a intoxicação aguda ou bio-concentração de agentes químicos, de modo que a redução do efeito é causada pelo fenômeno de adsorção ao material particulado, que, por sua vez, diminui a bio-disponibilidade para os organismos-teste.
MARTINS (1998) verificou que o aumento no teor de matéria orgânica na água diminuiu a ação tóxica do permanganato de potássio e do sulfato de cobre para peixes, e pode inativar a formalina. Verifica-se também que a baixa alcalinidade também aumenta a intoxicação de peixes com o sulfato de cobre e a salinidade diminui a ação da formalina e do sulfato de cobre.
CE50–24 h similares de sulfato de cobre para D. similis cultivada em água mole. Os resultados
obtidos com D. magna corroboram os de ELNABARAWY et al. (1986) que calcularam valores similares da CE50-48 h para D. magna criadas em meio M4, bem como os de SECO-
GORDILLO et al. (1998), MOUNT e NORBERG (1984), KHANGAROT e RAY (1989). Os resultados obtidos com D. similis estão de acordo com os de BERTOLETTI et al. (1992). Tabela 6. Valores médios de CE50–48 h de sulfato de cobre calculados para as três espécies de
daphnias neste trabalhoe por outros autores.
Pesquisador ou norma Resultados em (mg/L) Neste trabalho Àgua do cultivo, dureza 45 mg em CaCO3
D. m. = 0,045; D. s. = 0,043; D. l. = 0,10 SECO et al. (1998) Meio M4, dureza 250 ± 15 mg/L em CaCO3
D. m. = 0,21
MOUNT e NORBERG (1984) Meio M4, dureza 250 ± 15 mg/L em CaCO3
D. m. = 0,054; D. p = 0,053.
ELNABARAWY et al. (1986) Meio M4, dureza 250 ± 15 mg/L em CaCO3
D. m. = 0,041; D. p = 0,031.
KHANGAROT e RAY (1989) Meio M4, dureza 250 ± 15 mg/L em CaCO3
D. m. = 0,54.
BERTOLETTI et al. (1992) Água mole, dureza 40 –48 mg em CaCO3
D. s. = 0,022; 0, 019; 0,020; 0,024; 0,034; 0,023
D. m = Daphnia magna; D. s = Daphnia similis; D. l = Daphnia laevis; D. p = Daphnia pulex.
As diferenças dos resultados obtidos podem estar relacionadas com o meio usado para o cultivo e a exposição das daphnias ao sulfato de cobre, ou com o método da norma utilizado para realizar os testes de toxicidade.
Na revisão bibliográfica não foram encontrados resultados de CL(I)50-48 h
para D. laevis para serem comparados com os dados obtidos.
Na Tabela 7 encontram os resultados da análise de variância dos valores de CL(I)50 - 48h calculados nos testes com trichlorfon. Nestes resultados são claros os efeitos altamente significativos do fatores estudados e da interação entre ambos. As análise com desdobramentos dos graus de liberdade dos níveis dos fatores e da interação estão apresentados na Tabela 8
Tabela 7. Análise de variância dos valores de CE50-48 h do trichlorfon para as três espécies de daphnias na ausência e presença de sedimento.
Causas de variação G.L. S. Q. Q. M. F
Espécie (E) Sedimento (S) Interação ExS 2 1 2 11.110,58 616.834,40 11.264,49 5.555,29 616.834,40 5.632,24
12,33 ** 1.370,00 ** 12,51 **
**significativo ao nível de 1% de probabilidade C.V. = 13,2 (%)
G.L= Grau de liberdade; S.Q.= Soma dos quadrados; Q.M.= Quadrado médio.
Na Tabela 8 observa-se que na ausência do sedimento as três espécies de daphnias não apresentam diferença de sensibilidade ao trichlorfon . Esta sensibilidade similar entre as três espécies de daphnias possivelmente seja explicada pelo fato de pertenceram ao mesmo gênero, pois geralmente as daphnias não apresentam diferença da sensibilidade entre espécies. Todavia, podem apresentar diferenças quanto a família e outros microcrustáceos. Todavia, VESSTEEG et al., (1996) verificaram que muitos membros da família Daphnidae apresentam sensibilidades semelhantes à toxicidade aguda e crônica de compostos químicos tóxicos.
CANTON e ADEMA (1978) reportam que D. magna, D. cucullata e D. pulex apresentam similar sensibilidade. HICKEY (1989), comparando a toxicidade de aguda e
crônicas varias substâncias puras e águas poluídas para a sensibilidade de cinco espécies de cladóceros (D. magna D. carinata, S. vetulus, C. dubia, e C. cf. pulchella) verificam que, no
Tabela 8. Desdobramento dos graus de liberdade dos fatores testados no teste de toxicidade aguda de trichlorfon para as três espécies de daphnias na ausência e presença do sedimento
Espécies CE50 – 48h (ηg/L)
Agrotóxico Sedimento
D. magna CE50-48h D. similis CE50-48h D. laevis CE50-48h Médias
Trichlorfon Ausente
Presente
0,70 a B
299,70 b A
0,53 a B
381,62 a A
0,92 a B
282,73 b A
0,72 B
321,35 A
Médias seguidas seguidas por Letras minúsculas diferentes, na linha, indica diferenças significativas entre espécies.
Médias seguidas por letras maiúsculas diferente na coluna, indica diferenças entre presença e ausência de sedimento
DMS (5%) Espécies = 27,1 mg/L; DMS Sedimento = 18,2 mg/L.
Na Tabela 8 observa-se que na presença do sedimento a Daphnia magna e a Daphnia laevis não apresentam diferença de sensibilidade ao trichlorfon, sendo que ambas
apresentam sensibilidade significativamente superior à Daphnia similis.