Susceptibilidade do Staphylococcus aureus
à terapia fotodinâmica (PDT)
LEDA YUMI HORI
Araraquara – SP
Susceptibilidade do Staphylococcus aureus
à terapia fotodinâmica (PDT)
Trabalho de Conclusão de Curso apresentado ao Curso de Graduação em Farmácia-Bioquímica da
Faculdade de Ciências Farmacêuticas da Universidade Estadual Paulista “Júlio de Mesquita Filho”, para obtenção do grau de Farmacêutica-Bioquímica.
Orientadora: Profa Dra. Carla Raquel Fontana Mendonça
Araraquara – SP
Aos meus pais e irmã que, apesar dos
problemas, foram meu alicerce para eu
À minha orientadora que me orientou na realização dos experimentos e foi
paciente na confecção deste trabalho.
À mestranda Maria Rita Ronqui que me ajudou muito na realização dos
testes-piloto e sanou minhas dúvidas, de modo sempre solícito.
À técnica Elaine Toscano Miranda, pela ajuda na execução dos experimentos.
Aos meus amigos que me acompanharam nesses anos acadêmicos e me
ajudaram quando eu mais precisei, mas um agradecimento especial ao Warley
Xavier da Silva, à Leticia Moriya Shiota e à Tatiane Bonfim Ribeiro que me
ajudaram muito na realização deste projeto.
À minha amiga Yuko pelo amor, carinho, cumplicidade e apoio na confecção
1. INTRODUÇÃO...13
2. REVISÃO DA LITERATURA...18
2.1. Staphylococcus aureus...18
2.1.1. Definição e característica...18
2.1.2. Cultura e identificação...20
2.1.3. Doenças causadas por S. aureus......21
2.2. Terapia fotodinâmica (PDT)...22
2.2.1. Breve histórico...22
2.2.2. Princípio básico da PDT...22
2.2.3. Mecanismos fotofísicos e fotoquímicos...23
2.2.4. Mecanismo de dano...25
2.3. Fotossensibilizadores (FS)...26
2.4. Azul de metileno (AM)...29
2.5. Bactérias Gram positiva e Gram negativa...31
2.6. Diodo emissor de luz (LED: light-emitting diode)...33
3. OBJETIVO...35
3.1. Geral...35
3.2. Específico...35
4. MATERIAIS E MÉTODOS...36
4.1. Preparação das placas de ágar...36
4.4. Preparação do inóculo bacteriano...37
4.5. Fotossensibilizador...37
4.6. Grupos estudados...37
4.7. Grupo controle (FS-L-) e Grupo FS (FS+L-)...38
4.8. Grupo Luz (FS-L+) e grupo PDT (FS+L+)...39
5. RESULTADOS...41
6. DISCUSSÃO...47
7. CONCLUSÃO...49
A terapia fotodinâmica (PDT), de maneira simplificada pode ser aplicada
utilizando um fotossensibilizador (FS) e uma fonte de luz com comprimento de
onda específico, que combinados na presença do oxigênio produzem espécies
citotóxicas que causam o dano celular.
O objetivo deste estudo piloto foi verificar a susceptibilidade de
Staphylococcus aureus (ATCC 25923) à PDT, empregando diferentes
concentrações de azul de metileno. As amostras desta bactéria foram
sensibilizadas com azul de metileno nas concentrações de 6,25 µg/mL; 12,5
µg/mL; 25,0 µg/mL; 50,0 µg/mL; 100,0 µg/mL e 200,0 µg/mL e expostas à luz LED vermelha (660nm) por 20 minutos. Após o tratamento de todos os grupos
estudados a fração de sobrevivência foi calculada pela contagem das unidades
formadoras de colônia (UFC). O resultado deste estudo mostrou que o
fotossensibilizador no escuro foi tóxico (dark toxicity) nas concentrações de 100
e 200 µg/mL. Já no grupo onde utilizamos apenas a luz, não houve redução
bacteriana significativa. Entretanto, o uso combinado do AM e da luz LED
(Grupo PDT) mostrou que todas as concentrações testadas causaram uma
redução significativa de S aureus. Desta forma concluímos que a terapia
fotodinâmica antimicrobiana pode ser um tratamento alternativo para redução
Figura 1: Diagrama de Jablonski...23
Figura 2: Estrutura química de alguns FS utilizados para testes clínicos da
PDT...28
Figura 3: Estrutura do AM...29
Figura 4: Estrutura do azul de toluidina (TBO)...30
Figura 5: O esquema ilustra as diferenças entre a membrana das bactérias
Gram positiva e Gram negativa, respectivamente...32
Tabela 1: Média de UFC, média de sobrevivência (%) e desvio padrão dos
grupos FS e controle no S. aureus...41
Tabela 2: Média de UFC, média de sobrevivência (%) e desvio padrão dos
grupos Luz e Controle no S. aureus......43
Tabela 3: Média de UFC, média de sobrevivência (%) e desvio padrão do
Gráfico 1: Média de sobrevivência (%) do S. aureus quando submetido à
diferentes concentracoes de azul de metileno...42
Gráfico 2: Média de sobrevivência (%) do grupo Luz (FS-L+) no S.
aureus...43
Gráfico 3: Média de sobrevivência (%) do grupo PDT (FS+L+) no S. aureus
...45
Gráfico 4: Média de sobrevivência dos grupos Controle (FS-L-), FS (FS+L-),
Luz (FS-L+), e PDT (FS+L+), respectivamente, no S.
A -• Substrato oxidado
A Substrato orgânico
ALA Ácido 5-aminolevulínico
AM Azul de metileno
ATCC American Type Culture Collection
CI Conversão interna
CIS Cruzamento intesistemas
DNA Ácido desoxirribonucléico
EROs Espécies reativas de oxigênio
F Fluorescência
FDA Food and Drug Administration
FS Fotossensibilizador
H2O2 Peróxido de hidrogênio
HpD Hematoporphyrin derivative (Photofrin®)
L Luz
LED Light-emitting diode
LIP Luz intensa pulsada
O2-• Ânion superóxido
3
O2 Oxigênio molecular
1
O2 Oxigênio singleto
OH• Radical hidroxila
PDT Photodynamic Therapy
S1 Fotossensibilizador no estado singleto excitado 1T+• Fotossensibilizador no estado reduzido
T1 Fotossensibilizador no estado tripleto excitado
TBO Toluidine blue O
TSA Trypticase Soy Agar
TSB Trypticase Soy Broth
1. Introdução
A terapia fotodinâmica (PDT - Photodynamic Therapy) é um tratamento que
utiliza um agente fotossensibilizador e luz, em determinado comprimento de onda.
Inicialmente, este tratamento surgiu como uma terapia para diversos tipos de
neoplasias (MAISCH et al., 2005).
A PDT foi aprovada pela FDA (Food and Drug Administration) para diversas
doenças, como degeneração macular associada à idade, carcinomas obstrutivos de
esôfago e traqueobrônquico, esôfago de Barret, queratose actínica, além de
psoríase (BOEHNCKE et al., 2000), arteriosclerose (ROCKSON et al., 2000) e artrite
reumatóide sistêmica (TRAUNER e HASAN, 1996). Há a utilização também, em
estágio inicial, em câncer de cabeça e pescoço e em estágios mais avançados, é
aplicado como paliativo (BIEL, 2007, BREDELL et al., 2010).
A vantagem desse tratamento deve-se à simplicidade na aplicação pelo fato
de ser uma terapia menos destrutiva e invasiva, se comparada a outros tratamentos
convencionais para neoplasias, como cirurgia, radio e quimioterapia.
(KARAKULLUKCU et al., 2011; WAINWRIGHT, 1998, HAMBLIN e HASAN, 2004). A
PDT apresenta também como vantagem o fato de danificar apenas o tecido-alvo, já
que estas células captam mais fotossensibilizador (FS) associadas à irradiação
localizada, diminuindo efeitos adversos (COPPER et al., 2007). O efeito tóxico da
PDT dá-se pela combinação do FS, luz e oxigênio molecular, apresentando três
estágios: excitação do fármaco, produção de espécies reativas de oxigênio (EROs) e
morte celular (CHATTERJEE et al., 2008). Na primeira fase, a fonte de luz transfere
energia para o FS, que a absorve, ficando no estado singleto excitado. A partir
moléculas do FS podem voltar ao estado inicial e liberar a energia por fluorescência.
No outro caminho, as moléculas podem ir para o estado tripleto excitado, passando
a energia absorvida para moléculas de oxigênio ou outras presentes no meio que
vão reagir com oxigênio, reação conhecida como reação do tipo I, gerando na
produção de EROs, como ânion superóxido, radical hidroxila, e peróxido de
hidrogênio. Já na reação do tipo II, o FS excitado pode reagir com o oxigênio
molecular, formando oxigênio singleto, altamente reativo (ALLISON et al., 2008).
Todas essas formas produzidas, nos dois tipos de reação, levam a uma sequência
de eventos oxidativos, gerando diretamente a morte da célula, ativação da resposta
imune do hospedeiro e destruição vascular do tecido- alvo (BUYTAERT et al., 2007).
Atualmente, com a maior resistência dos micro-organismos aos tratamentos
convencionais, devido ao uso incorreto e indiscriminado dos antimicrobianos, falha
de alguns pacientes em completar seu regime terapêutico, elevada replicação e
mutação das bactérias, o uso da PDT tornou-se mais amplo, levando ao fim o
período chamado de “a era do antibiótico” (YOSHIKAWA, 2002). Tal fato,
impulsionou o desenvolvimento de tratamentos alternativos e coadjuvantes para
inativação desses patógenos, como bacteriófagos, peptídeos antimicrobial natural ou
sintético e a PDT (CERVENY et al., 2002, SAJJAN et al., 2001, WAINWRIGHT,
1998).
A PDT antimicrobiana se liga e penetra com mais afinidade na célula
bacteriana ou neoplásica, se comparada às células normais do hospedeiro. Assim,
uma vez exposta à luz específica e submetida à ação de um FS, resulta em morte
de micro-organismos sem danificar as células normais adjacentes (MIZUNO et al.,
2011). Devido ao fato de poder aplicá-la sem que induza resistência em bactérias e
2006). A ausência de resistência deve-se a produção de oxigênio singleto e outras
espécies reativas, que interagem em diversas estruturas das células celulares
(ácidos nucléicos, membranas lipídicas e proteínas) de diversas formas,
prejudicando o desenvolvimento da resistência dos micro-organismos a este
tratamento (KONOPKA et al., 2010).
São variados os FS que tem sido empregados na PDT antimicrobiana,
destaque para as porfirinas (BLISS et al., 2004, CHABRIER-ROSELLO et al., 2005,
DOVIGO et al., 2011a, WILLIAMS et al., 2006), os fenotiazínicos (DEMIDOVA e
HAMBLIN, 2005, SOUZA, 2006, WILSON e MIA, 1993), as ftalocianinas
(MANTAREVA et al., 2007, STRAKHOVSKAYA et al., 2009, WILSON e MIA, 1993) e
o ácido 5-aminolevulínico (ALA) (MONFRECOLA et al., 2004). As porfirinas são,
FS da primeira geração, fotossensíveis, com espectro de absorção entre
610-630nm, sendo o grupo mais avaliado. Tem como mecanismo de ação gerar dano
inicial na membrana plasmática que, por sua vez, permitirá a entrada do FS na
célula. Esse FS irá promover, se a irradiação persistir, danos intracelulares, como
inativação de proteínas da parede celular, peroxidação lipídica e fotodegradação de
esteroides insaturados (DONNELLY et al., 2008). As porfirinas possuem como
desvantagens o baixo comprimento de onda de excitação e a longa sensibilidade
após sua aplicação. Os fenotiazínicos são corantes, como azul de toluidina e azul de
metileno. Encontram-se preferencialmente na membrana, modificam suas
estruturas, quando iluminadas, elevando a permeabilidade celular e consequente
morte da célula (DONNELLY et al., 2008). As ftalocianinas são substâncias
químicas puras que absorvem luz em comprimentos de onda mais longos, se
comparadas aos derivados da hematoporfirina. Possuem propriedades superiores
como espectro de absorção do FS, seletividade e capacidade de ser eliminado do
organismo, já que faz parte da segunda geração. As ftalocianinas são consideradas
como porfirinas de caráter aromático aumentado, assim, apresentam maior
rendimento na síntese de oxigênio singleto, sendo seu poder oxidativo elevado
quando comparado ao dos derivados da hematoporfirina (DAZIANO et al., 1998,
MACHADO et al., 2010).
A maioria das ftalocianinas, apesar das vantagens apresentadas, possui
comportamento hidrofóbico causando a formação de agregados em meio aquoso.
Devido ao fenômeno de agregação, há redução da fotoatividade desses compostos,
com pequena produção de EROs e consequente, menor fotoinativação dos
micro-organismos (MANTAREVA et al., 2011). Assim, tem sido propostos inúmeros
sistemas de veiculação de fármacos que contenham compartimentos hidrofóbicos
para solubilização das ftalocianinas e mantenham suas características hidrofílicas
em soluções aquosas (LONGO et al., 2009, PRIMO et al., 2008, SÉGUIER et al.,
2010). Tais sistemas são compostos por micelas poliméricas, microesferas,
lipossomos, nano-emulsões e nano-partículas (FADEL et al., 2010).
O ideal desses sistemas de veiculação de fármacos era incorporar o FS sem
alteração da atividade do mesmo, fornecer um ambiente para que o FS seja
administrado em sua forma monomérica e biodegradáveis com mínima resposta
imunogênica (CHATTERJEE et al., 2008). Dentre os sistemas existentes, as
nano-emulsões representam uma espécie de veículo de aplicação tópica que possui o
aspecto cremoso (DA VOLTA SOARES, 2011) e, com isso, podem ser utilizadas em
infecções superficiais de pele e mucosa.
Outra característica importante destes veículos é a possibilidade de mudar
interação entre o veículo e o micro-organismo. As paredes celulares de bactérias e
fungos apresentam uma carga superficial residual negativa devido à moléculas de
caráter aniônico, como o ácido teicóico (componente essencial, com importante
função na fisiologia bacteriana) para as bactérias Gram positivas, e o
polissacarídeo, para as Gram negativas (LONGO et al., 2009). Assim, veículos que
possuem carga de superfície positiva tem a tendência de se acumular em maior
quantidade nas células dos micro-organismos e gerar maior fotoinativação
(CORMICK et al., 2009, MANTAREVA et al., 2007, MIZUNO et al., 2011, SPESIA et
2. Revisão da Literatura
2.1 Staphylococcus aureus
2.1.1 Definição e característica
O Staphylococcus aureus faz parte da família Micrococcaceae, em que
também encontra-se os Micrococcus, Stomatococcus e Planococcus, e gênero
Staphylococcus (SMITH, 1976).
A síntese de pigmento amarelo em determinados meios sólidos é
característico de espécies patogênicas, com isso, recebeu a classificação aureus,
enquanto as espécies que produzem pigmentos brancos são espécies menos
patogênicas. Entretanto, algumas podem não ter coloração por perda de pigmento
por sucessivos cultivos. Porém, a síntese desses pigmentos e sua correlação com o
potencial de patogenicidade não é muito confiável, indicando que a determinação de
cada espécie seja feita por meio de outras provas complementares (SMITH, 1976,
JOKLIK et al., 1994).
Esta espécie são cocos Gram positivos, aeróbio ou anaeróbio facultativo, não
esporulam, nem encapsulam, geralmente são imóveis e esféricos com cerca de 0,5
a 1,5 µm de diâmetro, agrupados em forma de cachos de uva. A faixa de
temperatura que se desenvolvem é de 10 a 45°C, sendo a temperatura ótima é
cerca de 37°C (UENO e JORGE, 2006).
Segundo Burnett, Scherp e Schuster (1978) quanto à morfologia da colônia,
pode-se ter colônias brancas ou amarelas, lisas, brilhantes ou opacas, convexas ou
planas e medindo entre 1 a 2 mm de diâmetro na superfície do ágar. Quanto à
O S. aureus é o mais comum como patógeno oportunista, faz parte da
microbiota transitória humana, sendo o mais virulento dentro do gênero e com
elevado potencial de desenvolver resistência a antimicrobianos. É muito presente
em infecções hospitalares e é uma das maiores causas de morte (LIVERMORE,
2000).
O Staphylococcus faz parte da microbiota normal da pele e de mucosas do
homem e animais, sendo a superfície corporal dos mamíferos o habitat natural
primário, onde se encontram em alta quantidade e podem ser agentes etiológicos de
uma elevada quantidade de infecções. Além disso, são muito encontrados na
natureza, podendo ser localizados no ar, água e pó (COLLEE et al., 1971, KLOSS e
JORGENSEN, 1985, JAWETZ et al., 1991). São muito resistentes ao congelamento
e a certas substâncias químicas, à luz solar, à dessecação, podendo sobreviver por
meses em presença de pus seco (PYATKIN, 1967, SMITH, 1976).
São responsáveis por causar inúmeras infecções, como periodontite,
síndrome da pele queimada, furúnculo, amigdalite, etc., e outras mais graves como
infecções de pele e em tecido mole, como bacteremia, pneumonia e endocardite.
Além de poder causar intoxicação alimentar se sua toxina estiver presente em
determinado alimento (LIVERMORE, 2000, UENO e JORGE, 2006).
Dentre as mais de 20 espécies de Staphylococcus, apenas três apresentam
importância clínica: Staphylococcus aureus, Staphylococcus epidermidis e
Staphylococcus saprophyticus. Os Staphylococcus estão entre os micro-organismos
encontrados com maior frequência na rotina médica, e que, apesar da utilização de
antimicrobianos e de melhorias das condições de higiene, que foram fundamentais
século XX, eles tem persistido como um patógeno importante nos hospitais e na
comunidade (JOKLIK et al., 1994).
2.1.2 Cultura e identificação
Em ágar sangue, S. aureus desenvolve-se bem, sendo que as colônias são
circundadas por halo de hemólise do tipo β (hemólise total). As linhagens menos
patogênicas (S. epidermidis) geralmente não possuem halo de hemólise. À 37°C, em
ágar simples, ocorre o crescimento, em 18 a 24h, de colônias em formato circular
com cerca de 1,5mm de diâmetro, lisas, convexas, opacas e brilhantes, podendo
sintetizar pigmentos brancos ou amarelados, dependendo da espécie estafilocócica.
Em caldo simples, obtem-se turvação difusa com pequeno depósito, facilmente
emulsionável e com desenvolvimento estimulado com a adição de 0,1% a 0,2% de
glicose (SOUNIS, 1977, KLOSS e JORGENSEN, 1985, BIER, 1990, JOKLIK, 1994).
As condições ideais para o crescimento de estafilococos é pH 7 e
temperatura de 37°C ( BURNETT, SHERP, SCHUSTER, 1978).
Dentre algumas das propriedades relativas à identificação do S. aureus, as
fundamentais são fermentação do manitol e resposta positiva para prova da
catalase. Quanto ao crescimento das colônias, a temperatura ideal deve estar entre
25°C e 35°C, porém pode haver crescimento em temperaturas muito inferiores,
como 8°C e muito elevadas, como 48°C (SMITH, 1976).
Segundo Waldwogel (1995), os principais testes utilizados como rotina em
laboratório para a identificação do S. aureus são:
2- Prova da coagulase: permite checar a distinção entre o S. aureus, e as
espécies coagulase negativas. Este teste fundamenta-se na adesão celular e
de enzimas sobre a trombina;
3- Fermentação do manitol: que comumente permite a diferenciação do S.
aureus (sempre positiva) do S. epidermidis (raramente positiva).
2.1.3 Doenças causadas por S. aureus
As infecções mais frequentes ocasionadas por este micro-organismo são
abscessos, furúnculos, osteomielites e são caracterizadas por um elemento
inflamatório acentuado. Os ambientes de preferência dos carreadores são parte
anterior das narinas, garganta, períneo e outros locais de pele e mucosa (BARON,
1992).
As infeções mais comuns que ocorrem na pele humana são originadas por
estafilococos coagulase positiva (S. aureus). A intensidade dessas infecções varia
desde processos inflamatórios superficiais, como foliculite, até processos
inflamatórios mais profundos, como furúnculos e carbúnculos. São até mesmo
responsáveis em conjunto com os estreptococos por outras manifestações cutâneas,
como impetigo contagioso comum em recém nascidos (KLOSS e JORGENSEN,
1985, JOKLIK et al., 1994, WALDWOGEL, 1995, MIMS, 1995).
Segundo Smith (1976), o desenvolvimento de doenças sistêmicas por
estafilococos inclui pneumonia, empiema, endocardites, púrpura febril, parótide,
meningite, abscesso cerebral, flebite, cistite e pielonefrite, assim como as infecções
de válvulas proteicas no coração, que podem ser causadas por S. aureus e/ou S.
2.2 Terapia fotodinâmica (PDT)
2.2.1 Breve histórico
A PDT tem origem na Grécia antiga, Índia e Egito, mas desapareceu por
alguns séculos, sendo redescoberta pela civilização ocidental apenas no começo do
século XX (DENIELL, 1991).
O uso pioneiro contemporâneo registrado foi do físico dinamarquês, Niels
Finsen, que demonstrou, com sucesso, PDT utilizando calor para tratar tuberculose
cutânea, Lupus vulgaris. O desenvolvimento da PDT começou a ser fomentado
quando um estudante de medicina alemão, Oscar Raab, que trabalhava com seu
professor Herman Von Tappeiner, descobriu o efeito da acridina e da luz no
paramécio, que diante dessas condições foi possível matá-lo (RAAB, 1900 e
DENIELL, 1991). Em 1903, este grupo descreveu a primeira utilização em pacientes.
(TAPPEINER e JODDLBAUER, 1904). Com suas pesquisas seguintes, criou-se a
denominação “ação fotodinâmica” e descobriu-se que o oxigênio era essencial à
terapia. Nos anos 1970, estudou-se utilizar a técnica no tratamento do câncer
(MITTON e ACKROYD, 2008). Em 1999, o FDA aprovou o uso da PDT para o
tratamento de lesões pré-câncer de face e couro cabeludo (LUI e ANDERSON,
1992). Atualmente, a PDT tem sido indicada para o tratamento de doenças
oncológicas e não-oncológicas (KÜBLER et al., 2005).
2.2.2 Princípio básico da PDT
A PDT é um procedimento fotoquímico não térmico, que emprega,
necessariamente, três elementos: corante fotossensibilizador, FS, luz visível e
é ativado pela luz visível com comprimento de onda droga-específico, gerando a
síntese de EROs, como oxigênio singleto e radicais livres, podendo afetar o DNA e a
membrana da célula, resultando no extravazamento de componentes celulares,
interrupção do sistema de transporte e morte da célula (WAINWRIGHT, 1998,
HAMBLIN e HASAN, 2004).
2.2.3 Mecanismos fotofísicos e fotoquímicos
A descrição do processo depois a absorção da luz visível pelo FS está
representada no diagrama de Jablonski, a seguir (figura 1).
Figura 1: Diagrama de Jablonski
Após a absorção da luz, o FS passa do seu estado fundamental (S0) para seu
estado singleto excitado (S1). Este estado apresenta tempo de vida curto (na ordem
de nanosegundos), perdendo energia por meio de métodos radioativos (emissão de
fluorescência, F) e/ou não radioativos (conversão interna, CI, ou cruzamento
pela inversão de spin eletrônico, fazendo com que o fármaco FS vá ao estado
tripleto excitado (T1). Este retorna ao estado fundamental, por conversão interna ou
pela emissão de fosforescência, P. O estado T1 apresenta tempo de vida na ordem
de microssegundos, tempo suficiente para permitir a interação do FS no estado
excitado com moléculas adjacentes. É neste estado que pode haver transferência de
elétrons com o substrato orgânico, FS reduzido, que ao reagir com oxigênio
molecular (3O2) produz EROs, como radical hidroxila (OH•), ânion superóxido (O2-•) e
peróxido de hidrogênio (H2O2), capazes de causar danos oxidativos nas células
(MACHADO, 2000). Este mecanismo é a reação tipo I da PDT.
Já a reação tipo II, ocorre quando o FS no estado tripleto excitado transfere
sua energia excedente para oxigênio molecular (3O2), gerando oxigênio singleto
(1O2) que apresenta uma vida muito curta e reativa, devido à configuração eletrônica
instável (DENIS et al., 2011).
O tempo de vida, em água, do oxigênio singleto é “relativamente” longo, de 2
a 4µs, por isso é um principal agente oxidante. Em sistemas biológicos, esse tempo
de vida é muito reduzido, menor do que 0,04µs, pois o 1O2 reage com várias
moléculas biológicas (MACHADO, 2000), como proteínas, ácidos nucléicos e
lipídeos e pode levar a citotoxicidade (REDMOND e GAMLIN, 1999).
Assim, os micro-organismos são eliminados pelo oxigênio singleto, incluindo
vírus e fungo, além da bactéria (SHARMAN, ALLEN e VAN LIER, 1999, MOAN e
BERG, 1991). Tanto a reação do tipo I, quanto a do tipo II causam morte celular
2.2.4 Mecanismo de dano
Há dois processos fundamentais propostos para explicar o dano na bactéria:
dano no DNA e na membrana citoplasmática, ocasionando extravazamento do
conteúdo citoplasmático ou inativação do sistema de transporte da membrana e
enzimas. O estrago no DNA deve-se ao rompimento de sua fita simples ou dupla e
ao desaparecimento da porção supercondensada do plasmídeo, seja em bactérias
Gram positiva, quanto Gram negativa, após inativação fotodinâmica (BERTOLONI et
al., 2000, FIEL et al., 1981, MENEZES et al., 1990, CAPELLA et al., 1996). O dano
pode ser revertido por inúmeros mecanismos de reparo do DNA (IMRAY e
MACPHEE, 1973).
Estudos têm sugerido que a síntese de EROs após iluminação com pouca
dose de luz é o processo pioneiro para a fotobiomodulação. Entretanto, elevada
quantidade de EROs são tóxicos tanto para células do hospedeiro, quanto para
bactéria. Por isso, estimou-se a fototoxicidade de luz visível de comprimento de
onda entre 400 a 800nm e uma dose de luz de 120J/cm2 na sobrevivência de
inúmeras bactérias patogênicas: S. aureus, Pseudomonas aeruginosa, Escherichia
coli e Serratia marcescens. Essas bactérias foram selecionadas devido à sua
elevada prevalência em feridas infectadas. Após 24 horas, 1ml de suspensão
bacteriana foi irradiado com luz branca (400 mW/cm2), por 5 minutos (120J/cm2).
Suspensões bacterianas não expostas à luz serviram de controle negativo. A
sobrevivência das células bacterianas foi monitorada pela contagem do número de
unidades formadoras de colônia (UFC) antes e depois ser submetido à iluminação.
Também foi detectado a presença de EROs pela espectroscopia de ressonância
magnética, e a alteração da temperatura durante a iluminação foi controlada. A
viabilidade bacteriana de 62%, 83% e 56% para E. coli, S. aureus e S. marcescens,
respectivamente. Contudo, nenhuma redução na contagem de colônias da P.
aeruginosa foi relatada. A diminuição na viabilidade bacteriana estava diretamente
relacionada à produção de espécies reativas por estes micro-organismos. O máximo
aumento de temperatura foi de 4°C, quando submetido uma dose de 240J/cm2.
Esses resultados indicaram que a redução na viabilidade durante a iluminação não
foi resultante no aumento de temperatura do meio de cultura, mas do efeito
fototóxico causado pela presença das EROs. Concluiu-se que a luz visível em altas
intensidades pode causar morte bacteriana. Com isso, a irradiação de ferimentos
infectados, com elevada fluência e intensidade, pode diminuir a probabilidade de
ocorrer infecção, anteriormente à iluminação, com reduzidas doses empregadas
para fomentar a cicatrização (LIPOVSKY, NITZAN e LUBART, 2008).
Por acarretar morte celular, pela produção de oxigênio singleto e radicais
livres, é improvável que os micro-organismos submetidos à PDT adquiram
resistência (O’ RIORDAN et al., 2005; PERUSSI, 2007).
2.3 Fotossensibilizador (FS)
Os FS são, na maioria das vezes, moléculas aromáticas,
contendo um cromóforo central, com ramificações auxiliares (auxocromo), sendo
responsável por modificar os elétrons do FS e, com isso, modificando seu espectro
de absorção (WAINWRIGHT et al., 2006).
Algumas características gerais são necessárias para o FS ser utilizado na
PDT, como (STERNBERG, DOLPHIN e BRUCKNER,1998, SIMPLICIO, 2002,
YANO et al., 2011):
• reduzida toxicidade no escuro (citotoxicidade);
• fotossensibilidade curta;
• formulação simples;
• elevada estabilidade;
• rápida excreção do organismo (farmacocinética favorável);
• fácil manuseio sintético que permita realizar alterações para otimizar as
características desejáveis;
• fácil análise de todos dos elementos da formulação;
• baixo custo;
• boa reprodutibilidade;
• boa seletividade e
• elevada produção de 1O2
A primeira geração de FS são compostos por derivados de hematoporfirínicos
desenvolvidos por Schwartz, no início dos anos 1950. Ele comprovou que a
substância dos ensaios de fotossensibilidade de Meyer-Betz, em 1913, não era
hematoporfirina, como se acreditava por ser facilmente eliminada do organismo, mas
sim inúmeros compostos oligoméricos (STERNBERG, DOLPHIN e BRUCKNER,
1998). Schwartz enriqueceu essa mistura, denominando-a de HpD (Photofrin®)
(Figura 2), e Lipson, com a orientação de Schwartz, nos anos 1960, expôs a
preferência dela em doenças neoplásicas e a incidência de luz resultava na
regressão da patologia. O tratamento clínico para câncer com PDT, iniciou-se no fim
da década de 1960, uma vez que Lipson tratou, com êxito, uma paciente com câncer
de mama empregando HpD e irradiação seletiva nas células tumorais (LIPSON,
1966). O Photofrin® foi o FS pioneiro aprovado pelo FDA para tratamento de câncer,
Já a segunda geração, é formada por fármacos que apresentam melhorias
nas características foto-físicas em relação ao Photofrin® (SIMPLÍCIO et al., 2002),
isto é, foram projetados para melhor captação seletiva e para aproveitar a
profundidade de penetração da luz em comprimentos de ondas mais elevados que
são utilizada para ativação do Photofrin®. Além de serem, na maioria das vezes,
puros, pode ser ativado quando o comprimento de luz está entre 630 a 800nm e
possuem reduzida incidência e prolongada sensibilidade cutânea (SHIBATA, 2000).
Este grupo abrange o ácido 5-aminolevulínico, derivado de benzoporfirina (Figura 2),
texafirina (Figura 2) e termoporfirina. Estes FS tem elevada capacidade de formar
oxigênio singleto. Na PDT antimicrobiana, os FS mais utilizados são azul de toluidina
O (TBO) e azul de metileno (AM) (Figura 3). Ambos têm propriedades físico-química
idênticas (RAJESH, 2011).
Photofrin® Derivado de benzoporfirina
Texafirina
Figura 2: Estrutura química de alguns FS utilizados para testes clínicos da PDT
2.4 Azul de metileno (AM)
É um FS aromático, heterocíclico, fenotiazínico, solúvel em água, de fórmula
molecular C16H18ClN3S e massa molar 319,85g/mol. O AM é usado como indicador
e como corante bacteriológico, apresenta diversas aplicações nos mais variados
campos, como da biologia e da química. Também é efetivo na PDT, devido ao seu
comprimento de onda de absorção máxima ser de 660nm, além de elevada
penetração no tecido alvo, com reduzido efeito tóxico e atuação antimicrobiana.
Além disso, é um FS acessível, devido ao seu baixo custo. O AM foi utilizado em
recomendação cirúrgica ressonantes em elevadas concentrações (1% m/v) sem
ocasionar toxicidade em humanos. Os corantes fenotiazínicos são mais eficazes
contra bactérias Gram positivas do que em Gram negativas. (MIYAMOTO et al.,
2007, WAINWRIGHT, 1998, MEISEL e KOCHER 2005).
Figura 3: Estrutura do AM (HAMBLIN e HASAN, 2004).
O AM é um FS catiônico, gerando uma ligação eletrostática na superfície
celular externa, ocasionando em uma lesão inicial em sua parede e levando uma
alta ação fotodinâmica antibacteriana (PRATES et al., 2007, JORI, 2006).
O AM, em solução aquosa, é encontrado na forma de monômeros (soluções
diluídas), dímeros e agregados maiores (soluções muito concentradas), sendo estes
diferenciados pelas respectivas bandas de absorção, máximos em 664nm, 600nm e
absorção em comprimentos de onda de 600 a 660 nm, região do espectro vermelho
de radiação favorável à PDT devido à eficiente penetração da luz em tecidos
biológicos (STERNBERG et al., 1998, STERNBERG e DOLPHIN, 1996).
Segundo Usacheva, Teichert e Biel (2001), a eficácia do AM e azul de
toluidina (TBO) (Figura 4) foi verificada contra distintas bactérias na presença e
ausência de irradiação vermelha, com os comprimentos de onda de 630 nm e 664
nm. No meio de seis micro-organismos avaliados, um deles foi o S. aureus. A
concentração do corante variou de 1 a 200 µm empregando 0,45% de solução
fisiológica, como solvente. O experimento demostrou que os dois FS foram eficazes
contra bactéria tanto Gram positivas, como as Gram negativas. Nesta pesquisa, o S.
aureus foi a bactéria de maior resistência ao FS e laser, e o AM apresentou uma
elevada efetividade como FS sobre estes micro-organismos do que o TBO. Ambos
os corantes, sem a luz, manifestou toxicidade contra as bactérias.
Figura 4: Estrutura do azul de toluidina (TBO) (HAMBLIN e HASAN, 2004).
O solvente empregado para o FS (AM) pode ter importância para a
fotoquímica do corante. Os solventes comumente usados são água deionizada ou
destilada, solução fisiológica (0,9% e 0,45%) e solução fisiológica tamponada com
fosfato. A redução microbiana foi maior quando o solvente empregado foi a água
2.5 Bactérias Gram positiva e Gram negativa
Na década de 1990, foi observada uma diferença na susceptibilidade à PDT
entre bactérias Gram positivas e negativas. Descobriu-se que, em geral, moléculas
de FS aniônicas ou neutras são ligadas de modo eficientemente à inativação
fotodinâmica de bactérias Gram positivas, enquanto que as Gram negativas são
relativamente resistentes a estes compostos. A elevada susceptibilidade de
bactérias Gram positivas é elucidada pela membrana citoplasmática, estando
rodeada por uma monocamada relativamente porosa de peptideoglicano e àcido
lipoteicóico e ambas estruturas deixa os FSs não catiônico atravessá-la (figura 5). O
envelope celular das Gram negativas é composto na membrana citoplasmática
interna e uma membrana externa, sendo que entre estas membranas há
peptideoglicano que possui periplasma. A barreira externa forma uma separação
física e funcional entre a célula e o ambiente, sendo formada por diversas proteínas
distintas, algumas delas funcionam como poros que permite a passagem de
nutrientes, enquanto que outras tem função enzimática ou estão envolvidas em
manter a integridade estrutural da membrana externa e a forma da bactéria (MALIK,
Figura 5: O esquema ilustra as diferenças entre a membrana das bactérias Gram
positiva e Gram negativa, respectivamente (Modificado de HAMBLIN e HASAN,
2004).
O FS com carga positiva pode se ligar a superfície de bactérias carregada
negativamente seja Gram positiva, seja Gram negativa. A conjugação não é apenas
ligada à superfície externa das bactérias, mas também penetra na barreira
permeável (HAMBLIN et al., 2002).
2.6 Diodo emissor de luz (LED: light-emitting diode)
Várias fontes de luz podem ser usadas na PDT. Estas pertencem a três
grandes grupos: as lâmpadas de diodo, as lâmpadas de amplo espectro e os lasers.
As fontes de luz não coerentes descritas em pesquisas clínicas em PDT incluem as
lâmpadas halógenas projetoras de diapositivos, as lâmpadas de diodo (LED) e, a
mais moderna, a luz intensa pulsada (LIP). A intensidade de radiação na PDT é
dada em J/cm2 (ZELICKSON, 2005).
O laser é uma das fontes de luz para aplicação na PDT, devido às suas
propriedades que os distinguem da luz comum, como características
monocromáticas (apenas um comprimento de onda), ser coerente e colimada, além
de elevada potência de saída e fácil acoplamento em fibras ópticas para
fornecimento de luz em endoscopia em cavidades corporais ou implantes intestinais.
Entretanto, os lasers são custosos, inviabilizando seu uso em larga escala
(WILSON, 1998).
Assim, um dos avanços recentes na prática da PDT é a disponibilidade dos
LEDs com comprimentos de ondas compatíveis com os FS empregados atualmente.
Como vantagens, apresentam menor exigência de energia elétrica, portabilidade,
alta confiabilidade, baixo custo, pequeno tamanho e emissão mais ampla, quando
diferentes cores de LED com radiação que cobre o espectro eletromagnético visível
(figura 6) e infravermelho. (MANG 2004).
3. Objetivo
3.1. Geral
Estudar a susceptibilidade de Staphylococcus aureus (ATCC 25923) à terapia
fotodinâmica, empregando azul de metileno.
3.2. Específico
- Avaliar a toxicidade no escuro do fotossensibilizador em diferentes
concentrações
- Avaliar a ação da luz na ausência de fotossensibilizador
- Encontrar o melhor parâmetro para a terapia fotodinâmica antimicrobiana em S.
4. Materiais e métodos
4.1 Preparação das placas de ágar
O meio ágar TSA foi preparado utilizando 40 g/L de Trypticase Soy Agar
(BBL, Cockeysville, MD). O meio foi autoclavado e deixado resfriar para verter nas
placas. Este ágar foi utilizado para preparar placas de cultura. Após a geleificação
do ágar, as placas foram devidamente embaladas em filme de PVC e mantidas em
geladeira por no máximo 7 dias antes da utilização.
4.2 Preparação do caldo TSB (Trypticase Soy Broth)
O meio caldo TSB foi preparado utilizando 30 g/L de Trypticase Soy Broth. O
meio foi autoclavado e mantido em geladeira por no máximo 7 dias antes da
utilização.
4.3 Reativação das cepas e cultivo do Staphylococcus aureus
Foi utilizada neste trabalho cepa padrão American Type Culture Collection
(ATCC) identificada como Staphylococcus aureus (ATCC 25923). Para reativação, a
cepa foi inoculada com auxílio de uma alça estéril em um tubo de ensaio contendo
5mL de caldo TSB. O tubo foi incubado a 37ºC por 24 horas e após este período
observou-se a turvação no meio de cultura indicando viabilidade microbiana. Após a
reativação das cepas, procedeu-se a semeadura pela técnica de estrias, para
obtenção de colônias isoladas, em placas de ágar TSA. As placas foram incubadas
a 37ºC por 24 horas. Após a incubação, foram selecionadas 3 a 5 colônias
semelhantes às quais foram transferidas para um tubo com 2 mL de caldo TSB. O
4.4 Preparação do inóculo bacteriano
Para obtenção do inóculo bacteriano, foram pipetados em um tubo de ensaio
aproximadamente 9 µL de caldo TSB e 1µL da suspensão bacteriana, de modo a
produzir uma leve turvação, de densidade visualmente equivalente ao tubo 0,5 da
escala de McFarland. Para o ajuste do inóculo, foram pipetados 200 µL de caldo
TSB em um poço de microplaca e 200µL da suspensão bacteriana em outro poço. A
absorbância foi medida utilizando espectrofotômetro com comprimento de onda de
625 nm. A diferença entre as duas absorbâncias deve variar de 0,08 a 0,10, que
corresponde à escala 0,5 de McFarland.
4.5 Fotossensibilizador
Em ambiente protegido da luz, foi dissolvido o AM, que é fotossensível, em
caldo PBS para permitir concentrações de 200,0; 100,0; 50,0; 25,0; 12,5; 6,25
µg/mL.
Estas seis soluções de azul de metileno em diferentes concentrações foram
preparadas imediatamente antes do uso. Os tubos contendo as soluções foram
envolvidos em papel alumínio para manter o FS sem exposição à luz durante a
realização dos experimentos.
4.6 Grupos estudados
Os experimentos foram realizados em fase planctônica (suspensão) utilizando
Staphylococcus aureus. Os grupos estudados foram: controle: sem FS e sem luz
(FS-L-); FS: com FS e sem luz (FS+L-); Luz: sem FS e com luz (FS-L+) e PDT: com
FS e com luz (FS+L+). Foram realizados 3 experimentos independentes em
4.7 Grupo controle (FS-L-) e Grupo FS (FS+L-)
Para cada concentração do AM do grupo FS e para o controle foi adicionado
1mL do inóculo na escala 0,5 de McFarland em um tubo de Eppendorf. Os tubos
foram centrifugados a 3000rpm por 5 minutos para remoção do excesso de meio de
cultura. Removeu-se o excesso de meio e adicionou-se 1mL de cada concentração
do AM em seus respectivos tubos contendo o pellet bacteriano. Para o controle, o
AM foi substituído por caldo TSB. Em seguida os tubos foram homogeneizados,
envolvidos em papel alumínio para manter o FS sem exposição à luz e mantidos em
temperatura ambiente (20 a 25ºC) por 25 minutos.
Para cada concentração do AM e para o controle foi preparada uma
sequência de tubos de Eppendorf enumerados de 1 a 4. Nos tubos com número 1,
foi adicionado 990µL de caldo TSB e nos tubos de 2 a 4 foi adicionado 900µL de
caldo TSB. Após os 25 minutos, foram transferidos 10µL das soluções
homogeneizadas de cada concentração e do controle para o tubo 1, a partir do qual
foram transferidos 100µL para o tubo 2, e repetiu-se o procedimento até o tubo 4, a
fim de obter-se diluições seriadas na ordem de 106, 105, 104, e 103 bactérias/mL.
Após as diluições, foram transferidos 100µL do tubo 4 para a placa de ágar TSA, na
diluição de 102 bactérias/mL. As suspensões bacterianas foram espalhadas nas
placas com auxílio de alças de vidro autoclavadas. As placas foram mantidas em
estufa à temperatura de 37ºC por 48 horas. Os procedimentos de semeadura foram
realizados em triplicatas. Após 48 horas de incubação, realizou-se a contagem de
4.8 Grupo Luz (FS-L+) e Grupo PDT (FS+L+)
Para cada concentração do AM do grupo PDT e para o grupo Luz foi
adicionado 1mL do inóculo na escala 0,5 de McFarland em um tubo de Eppendorf.
Os tubos foram centrifugados a 3000rpm por 5 minutos para remoção do excesso de
meio de cultura. Removeu-se o excesso de meio e adicionou-se 1mL de cada
concentração do AM em seus respectivos tubos contendo o pellet bacteriano. Para o
grupo Luz, o AM foi substituído por caldo TSB. Em seguida os tubos foram
homogeneizados, envolvidos em papel alumínio para manter o FS sem exposição à
luz e mantidos em temperatura ambiente (20 a 25ºC) por 5 minutos.
Para cada concentração do AM e para o grupo Luz foi preparada uma
sequência de tubos de Eppendorf enumerados de 1 a 4. Nos tubos com número 1,
foi adicionado 990µL de caldo TSB e nos tubos de 2 a 4 foi adicionado 900µL de
caldo TSB. Para a aplicação da PDT, após os 5 minutos as suspensões bacterianas
foram plaqueadas em placa de 96 poços. Cada poço refere-se a uma concentração
do AM do grupo PDT e ao grupo Luz, recebendo 200µL da suspensão. Como fonte
de Luz foi utilizado LED vermelho, com potência de saída de 15 mW cada diodo e
comprimento de onda de 660 nm. A luz foi entregue de maneira a cobrir toda
extensão do poço irradiado, por 20 minutos. Considerando a potencia de 15mW e o
tempo de 20 minutos a dose utilizada foi de aproximadamente 56 Joules/cm2 por
poço irradiado. O formato de feixe gerado por este sistema permitiu uma irradiação
pontual pelo spot uniformemente circular formado. Cada placa recebeu apenas um
tipo de tratamento para não haver qualquer interferência durante a irradiação.
Após os 20 minutos, foram transferidos 10µL das soluções de cada
transferidos 100µL para o tubo 2, e repetiu-se o procedimento até o tubo 4, a fim de
obter-se diluições seriadas na ordem de 106, 105, 104, e 103 bactérias/mL. Após as
diluições, foram transferidos 100µL do tubo 4 para a placa de ágar TSA, na diluição
de 102 bactérias/mL. As suspensões bacterianas foram espalhadas nas placas com
auxílio de alças de vidro autoclavadas. As placas foram mantidas em estufa à
temperatura de 37ºC por 48 horas. Os procedimentos de semeadura foram
realizados em triplicatas. Após 48 horas de incubação, realizou-se a contagem de
5. Resultados
Após o tratamento de todos os grupos estudados a fração de sobrevivência foi
calculada pela contagem das unidades formadoras de colônia (UFC).
A tabela 1 apresenta os resultados da porcentagem média de sobrevivência das
culturas bacterianas de S. aureus na presença de soluções de AM em diferentes
concentrações (Grupo FS +L-).
Tabela 1: Média de UFC, média de sobrevivência (%) e desvio padrão dos grupos
FS e controle no S. aureus.
Grupos Média de UFC Média de sobrevivência (%) Desvio padrão
FS (200 µg/mL) 164,88 40,64 12,71
FS (100 µg/mL) 124,77 34,14 21,28
FS (50 µg/mL) 231,55 56,61 31,90
FS (25 µg/mL) 259,22 60,76 30,71
FS (12,5 µg/mL) 120,77 53,61 31,99
FS (6,25 µg/mL) 258 59,79 22,83
Controle 458,44 100 0
S. aureus
FS (FS+L-)
Controle FS 6.25 FS 12.5 FS 25 FS 50 FS 100 FS 200 0 50 100
I
Grupos Po rc e n ta g e m M é d ia d e So b re v iv ê n c ia ( % )Gráfico 1: Média de sobrevivência (%) do S. aureus quando submetido à diferentes
concentrações de azul de metileno.
O gráfico anterior mostra que a toxicidade do AM, no escuro, foi significativa
para redução de S. aureus apenas nas concentrações de 200 e 100 µg/mL com taxa
de sobrevivência, de aproximadamente 40 e 30%, respectivamente. Já as
concentrações de 6,25 a 50,0 µg/mL demonstraram ser concentrações que podem
ser aplicadas na PDT para este micro-organismo.
A tabela 2 mostra os resultados da aplicação da luz LED vermelha sobre o
Tabela 2: Média de UFC, média de sobrevivência (%) e desvio padrão dos grupos
Luz e Controle no S. aureus.
Grupos Média de UFC Média de sobrevivência (%) Desvio padrão
Luz 252,66 61,88 8,95
Controle 408,33 100 0
Controle Luz
0 50 100
I
S. aureus
LUZ (FS-L+)
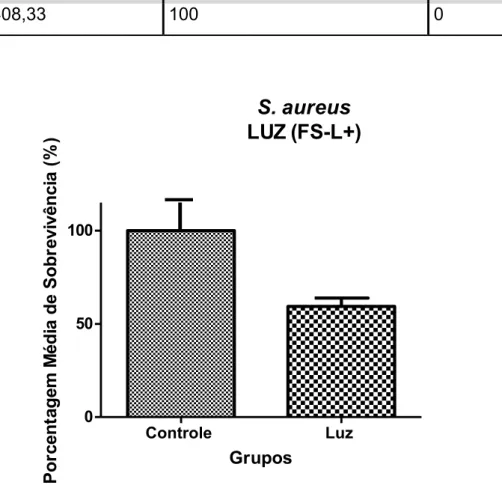
Grupos Po rc e n ta g e m M é d ia d e So b re v iv ê n c ia ( % )Gráfico 2: Média de sobrevivência (%) do grupo Luz (FS-L+) no S. aureus.
O resultado do grupo Luz mostra que não há redução bacteriana significativa,
e que a média de sobrevivência é cerca de 60%. Entretanto, o resultado esperado
era que a sobrevivência fosse maior, fato não encontrado neste estudo
provavelmente devido ao baixo numero de repetições realizadas (apenas 3
A tabela 3, a seguir, apresenta o resultado do efeito antibacteriano da PDT,
utilizando o AM em diferentes concentrações e a luz LED vermelha do grupo PDT
(FS+L+).
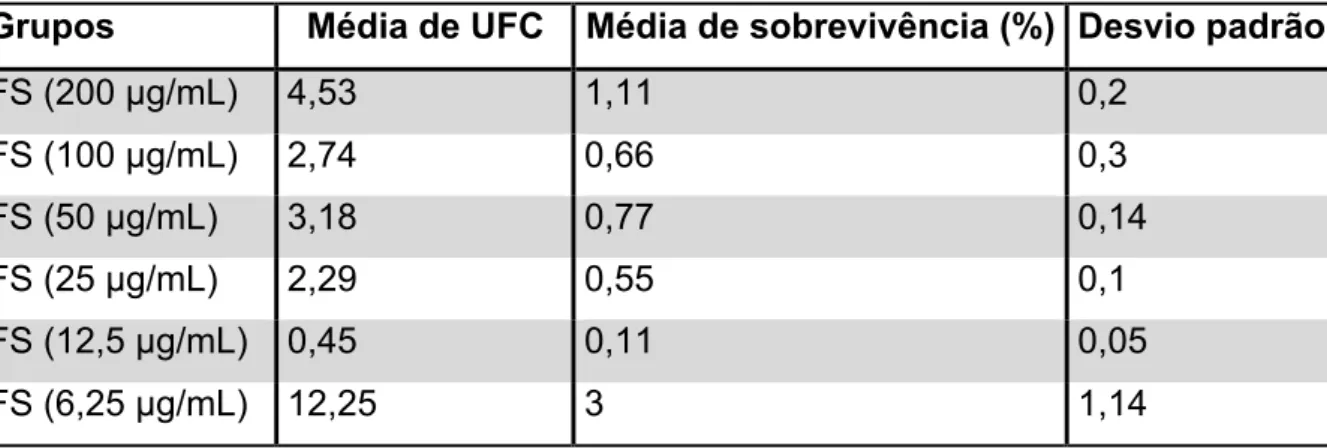
Tabela 3: Média de UFC, média de sobrevivência (%) e desvio padrão do grupo
PDT no S. aureus.
Grupos Média de UFC Média de sobrevivência (%) Desvio padrão
FS (200 µg/mL) 4,53 1,11 0,2
FS (100 µg/mL) 2,74 0,66 0,3
FS (50 µg/mL) 3,18 0,77 0,14
FS (25 µg/mL) 2,29 0,55 0,1
FS (12,5 µg/mL) 0,45 0,11 0,05
FS (6,25 µg/mL) 12,25 3 1,14
Controle PDT 6.25 PDT 12.5 PDT 25 PDT 50 PDT 100 PDT 200 0 50 100 S. aureus PDT (FS+L+)
I
Grupos Po rc e n ta g e m M é d ia d e So b re v iv ê n c ia ( % )Gráfico 3: Média de sobrevivência (%) do grupo PDT (FS+L+) no S. aureus.
O resultado do grupo PDT mostra que em todas as concentrações testadas
observamos uma redução bacteriana significante. Na menor concentração testada,
(6,25µg/mL) notamos a maior média de sobrevivência deste grupo, 3% mas ainda é
uma alta morte bacteriana (aproximadamente 97%).
A concentração 12,5 µg/mL foi a que apresentou menor taxa de
sobrevivência, cerca de 0,1%, neste caso, se o estudo tivesse um maior número de
repetições, esta seria a concentração escolhida para possíveis aplicações clínicas.
As demais concentrações encontram-se próximas de 0,5 a 1% de sobrevivência. As
concentrações 100,0; 50,0 e 25,0 µg/mL seriam consideradas estatisticamente
iguais.
C 6.25 12.5 25 50 100 200 Luz 6.25 12.5 25 50 100 200 0 50 100 S. aureus
I
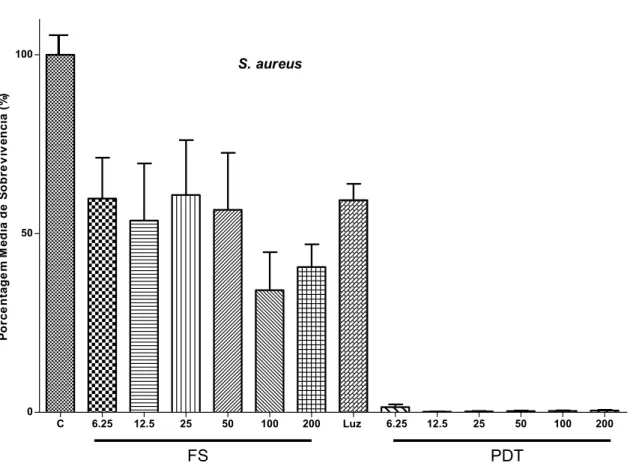
FS PDT Po rc e n ta g e m M é d ia d e So b re v iv ê n c ia ( % )Gráfico 4: Média de sobrevivência dos grupos Controle (FS-L-), FS (FS+L-), Luz
(FS-L+), e PDT (FS+L+), respectivamente, no S. aureus.
O gráfico 4 compara os resultados de todos os grupos testados. No grupo
PDT encontramos resultados muito próximos do zero, mostrando a capacidade de
6. Discussão
A terapia fotodinâmica antimicrobiana tem sido sugerida como tratamento
alternativo para infecções superficiais de mucosa e de derme (WAINWRIGHT,
1998), onde estão presentes micro-organismos susceptíveis e resistentes aos
tratamentos convencionais. Entretanto, apesar de passados 100 anos da primeira
publicação sobre efeitos fotodinâmicos de compostos químicos contra
micro-organismos (RAAB, 1990), a PDT com enfoque antimicrobiano ainda se encontra em
fase de experimentação (BREDELL et al., 2010). Até o momento, os estudos
buscam determinar parâmetros adequados para aplicação clínica da PDT
antimicrobiana, o que envolve avaliar diferentes FS, fontes e doses de luz e
concentrações dos fármacos. Diante disso, os estudos têm procurado identificar FS
com atividade antimicrobiana quando associada com a luz LED, uma fonte de luz de
menor custo e tecnologia mais simples se comparada com a dos aparelhos laser,
facilitando a aplicação clínica dessa terapia (KONOPKA et al., 2007). Dessa forma,
neste estudo utilizamos a luz Led vermelha associada ao azul de metileno na
susceptibilidade de S.aureus.
Nossos resultados estão de acordo com a literatura e demonstram que a
combinação do AM com a luz LED vermelho foi eficaz na redução do S. aureus.
Entretanto, quando aplicados isoladamente, não causam diminuição significativa da
carga microbiana.
Em concordância com nossos resultados, Fimple e colaboradores (2008)
demonstraram que o AM apresentou baixa toxicidade no escuro e que a terapia
fotodinâmica em microrganismos como Enterococcus faecalis apresentou uma taxa
Neste estudo o LED foi utilizado devido ao preço reduzido, portabilidade, alta
confiabilidade e facilidade no transporte, da mesma forma que Giusti e
colaboradores (2010) utilizaram com sucesso LEDs vermelhos na aplicação clínica
para redução bacteriana em pacientes periodontalmente comprometidos.
A redução de S. aureus foi testada por Ferraz e colaboradores (2011) de
maneira pioneira utilizando a quimiluminescência como fonte de energia para
aplicação da terapia fotodinâmica e também obtiveram sucesso na redução de S.
aureus via PDT.
Além disso, quando comparamos com outras terapias antimicrobianas, a PDT
tem muitas vantagens como a alta especificidade (o FS pode ser fornecido à célula e
pode ser altamente focado no local da lesão, nos casos de tratamento cutâneo),
poucos efeitos colaterais indesejáveis e baixa probabilidade de desenvolvimento de
resistência pelos micro-organismos (DOVIGO, 2011b).
Portanto, o resultado deste estudo piloto, quanto à terapia fotodinâmica
antimicrobiana, condiz com os diversos trabalhos encontrados na literatura,
7. Conclusão
Dentro das limitações deste estudo piloto, observamos que a terapia
fotodinâmica mediada por azul de metileno, pode ser utilizada na redução de S.
8. Referências Bibliográficas
ALLISON, R. R.; MOTA, H. C.; BAGNATO, V. S.; SIBATA, C. H. Bio-nanotechnology
and photodynamic therapy – state of the art review. Photodiagnosis Photodyn
Ther. p. 19-28. 2008.
BARON, E. J. The detection, significance, and radionale for control of
methicillin-resistent Staphylococcus aureus. Clinical Microbiology Newsletter. v. 14. n.17. p.
129-132. 1992.
BERTOLONI, G. Photosensitizing activity of hematoporphyrin on Staphylococcus
aureus cells. Biochim. Biophys. Acta. v. 1475. p. 169–174. 2000.
BIEL, M. Photodynamic therapy treatment of early oral and laryngeal cancers.
Photochem and Photobiol. v. 83. p. 1063-1068. 2007.
BIER, O. Estafilococos. Bacteriologia e Imunologia. 30. ed. São Paulo,
Melhoramentos, cap. 26. p. 501-510. 1990.
BLISS, J. M.; BIGELOW, C. E.; FOSTER, T. H.; HAIDARIS, C. G. Susceptibility of
Candida species to photodynamic effects of Photofrin. Antimicrob Agents
Chemother. v. 48. p. 2000-2006. 2004.
BOEHNCKE, W. H.; ELSHORST-SCHMIDT, T.; KAUFMANN, R. Systemic
photodynamic therapy is a safe and effective treatment for psoriasis, Arch.
Dermatol. v. 136. p. 271–272. 2000.
BREDELL, M.; BESIC, E.; MAAKE, C.; WALT, H. The application and challenges of
clinical PD-PDT in the head and neck region: a short review. J. Photochem
BURNETT, G. W.; SCHERP, H. W.; SCHUSTER, G. S. Estafilococos e Infecções
Estafilocócicas. In:______. Microbiologia Oral e Doenças Infecciosas. 4. ed., Rio
de Janeiro, Guanabara Koogan, cap. 21, p. 399-410, 1978.
BUYTAERT, E.; DEWAELE, M.; AGOSTINIS, P. Molecular effectors of multiple cell
death pathways initiated by photodynamic therapy. Biochim Biophys Acta. v. 1776.
p. 86-107. 2007.
CAPELLA, M.; COELHO, A. M.; MENEZES, S. Effect of glucose on photodynamic
action of methylene blue in Escherichia coli cells, Photochem. Photobiol. v.64. p.
205–210.1996.
CARVALLO, F. M. Estudo da incidência de Staphylococcus aureus na mucosa
nasal de pacientes portadores de fissura transforame incisivo. 1996. 96 f.
Dissertação (Mestrado em Odontologia) – Faculdade de Odontologia, Pontifícia
Universidade Católica do Rio Grande do Sul. 1996
CERVENY, K. E.; DEPAOLA, A.; DUCKWORTH, D. H.; GULIG, P. A. Phage therapy
of local and systemic disease caused by Vibrio vulnificus in iron dextran-treated
mice. Infect. Immun. v. 70. p. 6251–6262. 2002.
CHABRIER-ROSELLO, Y. et al. Sensitivity of Candida albicans germ tubes and
biofilms to photofrin-mediated phototoxicity. Antimicrob Agents Chemother. v. 49.
p. 4288-4295. 2005.
CHATTERJEE, D. K.; FONG, L. S.; ZHANG, Y. Nanoparticles in photodynamic
therapy: an emerging paradigm. Adv Drug Deliv Rev. v. 60. p. 1627-1637. 2008.
COLLEE, J. G. et al. Microbiologia, Patologia General y Farmacologia Aplicada. In:
PASSIMORE, R.; ROBSON, J. S. Tratado de Enseñanza Integrada de la
COPPER, M. P. et al. Photodynamic therapy in the treatment of multiple primary
tumours in the head and neck, located to the oral cavity and oropharynx. Clin
Otolaryngol. v. 32. p. 185-189. 2007.
CORMICK, M. P.; ALVAREZ, M. G.; ROVERA, M.; DURANTINI, E. N. Photodynamic
inactivation of Candida albicans sensitized by tri- and tetra-cationic porphyrin
derivatives. Eur J Med Chem. v. 44. p.1592-1599. 2009.
DA VOLTA SOARES, M. et al. Nanostructured delivery system for zinc
phthalocyanine: preparation, characterization, and phototoxicity study against human
lung adenocarcinoma A549 cells. Int J Nanomedicine. v. 6. p. 227-238. 2011.
DAZIANO, J. P. et al. Preferential photoinactivation of leukemia cells by aluminum
phthalocyanine. J Photochem Photobiol B. v. 43. p. 128-135. 1998.
DEMIDOVA, T. N.; HAMBLIN, M. R. Effect of cell-photosensitizer binding and cell
density on microbial photoinactivation. Antimicrob Agents Chemother. v. 49. p.
2329-2335. 2005.
DENIELL, M. D.; HILL, J. S. A history of Photodynamic therapy. Augut N. Z. J. Surg.
v. 61. p. 340-348. 1991.
DENIS, T. G. S. et al. All you need is light - Antimicrobial photoinactivation as an
evolving and emerging discovery strategy against infectious disease. Virulence. v. 2.
p. 509-520. 2011.
DONNELLY, R. F.; MCCARRON, P. A.; TUNNEY, M. M. Antifungal photodynamic
therapy. Microbial Res. v. 163. p. 1-12. 2008.
DOVIGO, L. N. et al. Fungicidal effect of photodynamic therapy against fluconazole-
resistant Candida albicans and Candida glabrata. Mycoses. v. 54. p. 123-130.
DOVIGO, L. N. et al. Investigation of the photodynamic effects of curcumin against
Candida albicans. Photochem. Photobiol. v.87. p.895–903. 2011b.
FADEL, M.; KASSAB, K.; FADEEL, D. A. Zinc phthalocyanine-loaded PLGA
biodegradable nanoparticles for photodynamic therapy in tumor-bearing mice.
Lasers Med Sci. v. 25. p. 283-272. 2010.
FERRAZ, R. C. et al. Chemiluminescence as a PDT light source for microbial control.
J Photochem Photobiol B. v.103. n. 2. p.87-92. 2011.
FIEL, R. J. et al. Induction of DNA damage by porphyrin photosensitizers. Cancer
Res. v. 41. p. 3543–3545. 1981.
FIMPLE, J. L. et al. Photodynamic treatment of endodontic polymicrobial infection in
vitro. NS. J Endod. v. 34. n. 6. p. 728-734. 2008.
GIUSTI, J. S. et al. Single equipment combines simultaneous application of
mechanical ultrasound and photodynamic action for microbial control.
Photodiagnosis Photodyn Ther. v.7. n. 2. p.137-138. 2010.
HAMBLIN, M. R; HASAN, T. Photodynamic therapy: a new antimicrobial approach to
infectious disease? Photochem Photobiol Sci. v. 3. n. 5. p. 436-450. 2004.
HAMBLIN, M.R. et al. Polycationic photosensitizer conjugates: effects of chain length
and Gram classification on the photodynamic inactivation of bacteria. J Antimicrob
Chemother. v. 49. p. 941. 2002.
HENDERSON, B.W.; DOUGHERTY, T.J. How does photodynamic therapy work?
Photochem Photobiol. v. 55. p. 145–157. 1992.
IMRAY, F. P.; MACPHEE, D. G. The role of DNA polymerase I and the rec system in
survival of bacteria and bacteriophages damaged by the photodynamic action of
JAWETZ, E. et al. Os Estafilococos. In:_____. Microbiologia Médica. 18 ed. Rio de
Janeiro: Guanabara Koogan, cap. 14. p.161-165. 1991.
JOKLIK, W. et al. Los Estafilococcus. In_____. Zinsser-Microbiologia. 2 ed. Buenos
Aires: Panamericana, cap. 23. p. 554-575. 1994.
JORI, G. et al. Photodynamic therapy in the treatment of microbial infections: basic
principles and perspective applications. Lasers in Surgery and Medicine. v.38.
p.468-481. 2006.
KARAKULLUKCU, B. et al. Photodynamic therapy of early stage oral cavity and
oropharynx neoplasms: an outcome analysis of 170 patients. Eur Arch
Otorhinolaryngol. v. 268. p. 281-288. 2011.
KLOSS, W. E.; JORGENSEN, J. H. Aerobic Bacteria: Staphylococci. In: LENNET et
al. Manual of clinical Microbiology. American Society for Microbiology. 4. ed.
Washington. cap. 15. p. 143-153. 1985.
KONOPKA, K.; GOSLINSKI, T. Photodynamic therapy in dentistry. J Dent Res. v.
86. p. 694-707. 2007.
KONOPKA, K.; DOROCKA-BOBKOWSKA, B.; GEBREMEDHIM, S.; DÜZGÜNES, N.
Susceptibility of Candida biofilms to histatin 5 and fluconazole. Antonie van
Leeuwenhoek. v. 97. p. 413-417. 2010.
Kübler, A. C. Photodynamic therapy. Medical Laser Application. v.20. p. 37–45.
2005.
LIPSON, R.L. Em Proceedings of the 9th International Cancer Congress.
Tóquio, Japão, 1966.
LIPOVSKY, A.; NITZAN, Y.; LUBART, R. A possible mechanism for visible
LIVERMORE, D.M. Antibiotic resistence in Staphylococci. International Journal of
Antimicrobial Agents. v.16. p. 3-10. 2000.
LONGO, J. P. et al. Photodynamic therapy disinfection of carious tissue mediated by
aluminum-chloride-phthalocyanine entrapped in cationic liposome: an in vitro and
clinical study. Lasers Med Sci. 2011.
LONGO, J. P. et al. Photodynamic therapy with aluminium-chloro-phthalocyanine
induces necrosis and vascular damage in mice tongue tumors. Photochem
Photobiol B. v. 94. p.143-146. 2009.
LUI, H.; ANDERSON, R.R. Photodynamic therapy in dermatology: Shedding a
different light on skin disease. Arch Dermatol. v.128. p.1631-1636. 1992.
MACHADO, A.E.H. Photodynamic Therapy: principles, potential of application and
perspectives. Química Nova. v. 23. n. 2. p. 237-243. 2000.
MACHADO, A. H. et al. Cellular changes after photodynamic therapy on HEp-2 cells
using the new ZnPcBr (8) phthalocyanine. Photomed Laser Surg. v. 28 Supl 1. p.
143-149. 2010.
MAISCH, T. et al. Photodynamic effects of novel XF porphyrin derivatives on
prokaryotic and eukaryotic cells. Antimicrob Agents Chemother. v. 49. p.
1542-1552. 2005.
MALIK, Z.; LADAN ,H.; NITZAN, Y. Photodynamic inactivation of Gram-negative
bacteria: problems and possible solutions. J. Photochem. Photobiol. B. v. 14. p.
262–266. 1992.
MANG, T. S. Lasers and light sources for PDT: past, present and future;