Fabiana Alves Nunes
ESTUDO DA DENSIDADE DAS CÉLULAS ENDÓCRINAS E
PRODUTORAS DE GHRELINA NA MUCOSA GÁSTRICA
DE PACIENTES PORTADORES DE OBESIDADE MÓRBIDA
Belo Horizonte
2005
ESTUDO DA DENSIDADE DAS CÉLULAS ENDÓCRINAS E
PRODUTORAS DE GHRELINA NA MUCOSA GÁSTRICA
DE PACIENTES PORTADORES DE OBESIDADE MÓRBIDA
Dissertação apresentada ao Programa de Pós
Graduação da Faculdade de Medicina da
Universidade Federal de Minas Gerais
(UFMG), como requisito parcial à obtenção
ao título de Mestre em Medicina, área de
Concentração em Gastroenterologia.
Orientador: Prof. Alfredo José Afonso
Barbosa
Nunes, Fabiana Alves
N972e Estudo da densidade das células endócrinas e produtoras de ghrelina na mucosa gástrica de pacientes portadores de obesidade mórbida/Fabiana Alves
Nunes. Belo Horizonte, 2005. 77 f. ilus.
Dissertação (mestrado) - Universidade Federal de Minas Gerais, Faculdade
de Medicina
Área de concentração: Gastroenterologia Orientador: Alfredo José Afonso Barbosa
1.Obesidade mórbida 2.Estômago/fisiopatologia 3.Mucosa gástrica/
REITORA
Ana Lúcia Almeida Gazzola
PRÓ-REITOR DA PÓS-GRADUAÇÃO Jaime Arturo Ramires
PRÓ-REITOR DE PESQUISA José Aurélio Garcia Bergmann
DIRETOR DA FACULDADE DE MEDICINA Geraldo Brasileiro Filho
COORDENADOR DO CENTRO DE PÓS-GRADUAÇÃO Francisco José Penna
COORDENADOR DA PÓS-GRADUAÇÃO EM GASTROENTEROLOGIA Marco Túlio Costa Diniz
COLEGIADO DA PÓS-GRADUAÇÃO EM GASTROENTEROLOGIA Marco Túlio Costa Diniz
Luiz Gonzaga Vaz Coelho Teresa Cristina de Abreu Ferrari
Luciana Dias Moretzsohn Cláudia Alves Couto
Dissertação apresentada e defendida perante a Comisão Examinadora,
constituída pelos Professores:
Prof. Alfredo José Afonso Barbosa/orientador
Prof. Fausto Edmundo Lima Pereira
Prof. Marco Túlio Costa Diniz
DEDICATÓRIA
“ O mais amplo do mundo, o conhecimento, o reconhecimento, a alegria deixada por um
presente, como um suavíssimo cometa, tudo isto e muito mais cabem na extensão de uma palavra:
Obrigado! “
Pablo Neruda
À Deus, pelo dom da vida e por iluminar meu caminho
Ao Prof. Alfredo, pela amizade, estímulo e orientação. Por acreditar no meu trabalho, e me despertar para a pesquisa e para a Pós-graduação desde os tempos de estudante.
Aos colegas do Instituto Alfa de Gastroenterologia do Hospital das Clínicas da UFMG, em especial o Prof. Dr. Marco Túlio da Costa Diniz e Dr. Jairo Nunes, pelo apoio e colaboração na realização do trabalho
À Profa. Lúcia Porto de Castro e à Lourdinha, do Laboratório de Imuno-histoquímica pelo apoio na realização da técnica de Imuno-histoquímica.
Ao Prof. Eugênio Marcos Andrade Goulard pelas orientações na análise estatística
Aos meus pais e irmãos, Tati, Fred e Geo, e meus amigos pelo incentivo e compreensão
Ao Alexandre, sonho antigo que se realizou, pelo companheirismo, paciência e incentivo durante a realização deste trabalho
À Adriana Maria Kakehasi, pela amizade, e pelas valiosas sugestões
À Profa. Maria de Fátima H. Sander Diniz pelas sugestões e apoio
Aos amigos do LPDN, em especial à Helen, pela colaboração
Aos funcionários do Instituto Alfa de Gastroenterologia, em especial Luciene, pela colaboração
Aos pacientes que aceitaram participar do estudo e à todos que de alguma forma contribuiram na realização deste trabalho
“Não existe ponto final. Tudo acaba em
pontos de partida...”
AGRP Proteína Agouti
APUD Amine Precusor Uptake and Decarboxilation
Arg Célula argirófila
A/X like Célula semelhante às células A e X
CART Transcrito regulado por cocaína e anfetamina Células D Células produtoras de somatostatina
Células EC Células Enterochromaffin Células ECL Células Enterochromaffin-like Células G Células produtoras de gastrina Células P Células parietais
EDA Endoscopia digestiva alta GABA Ácido gama aminobutírico GH Hormônio de crescimento
GHRH Hormônio estimulador da secreção do GH GHS-R Receptor de secretagogo de GH
GLP-1 Peptídeo semelhante ao glucagon tipo 1 Ghr Célula imunoreativa à ghrelina
HE Hematoxilina eosina Hp Helicobacter pylori
IBGE Instituto Brasileiro de Geografia e Estatística IMC Índice de massa corporal
LPDN Laboratório de Patologia Digestiva e Neuroendócrina MC4R Receptor da melanocortina 4
MCH Hormônio concentrador demelanina
mg Miligramas
mm Milímetros
mm2 Milímetros quadrados
MSH α α-Melanotropina
NCHS Nacional Center for Health Statistics NEM Neoplasia endócrina múltipla
NHES National Health Examination Survey
OMS Organização Mundial de Saúde PBS Tampão fosfato
POMC Proopiomelanocortina PP Polipeptídeo pancreático PYY Peptídeo YY
SPW Síndrome de Prader Willi
FIGURA 1 Esquema de contagem das células argirófilas e das células
imunorreativas à ghrelina : Seis (6) campos seguidos de 0,04 mm2 em toda a espessura da mucosa; Aumento de 400x
FIGURA 2 Esquema de células com distribuição normal e diferentes tipos de hiperplasias endócrinas da mucosa gástrica. A-Normal; B-
Hiperplasia difusa; C-Hiperplasia linear; D-hiperplasia nodular; E- Hiperplasia adenomatóide.
FIGURA 3 Mucosa gástrica de paciente portador de Obesidade, sem alterações histológicas relevantes
A-Corpo gástrico, B- Antro gástrico, HE, 50x
FIGURA 4 Mucosa gástrica de paciente portador de obesidade, com infiltrado inflamatório. Gastrite crônica, HE, 50x
FIGURA 5 Presença da bactéria Helicobacter pylori nas fovéolas gástricas Giemsa, 100x
FIGURA 6 Células endócrinas (argirófilas) da mucosa oxíntica, Grimelius, 400x
FIGURA 7 Células imunorreativas à ghrelina na mucosa oxíntica, Imunohistoquímica, 400x
FIGURA 8 Hiperplasia de células argirófilas na mucosa gástrica antral A- Difusa e linear, 50x B-Nodular, Grimelius, 400x
FIGURA 9 Hiperplasia de células imunorreativas à ghrelina na mucosa antral A- Difusa, B-Nodular, Imono-histoquímica, 400x
25
26
30
30
30
32
39
49
TABELA 1 Classificação sobrepeso e obesidade de acordo com o IMC
segundo a OMS (1997)
TABELA 2 Distribuição da frequência dos achados histológicos da mucosa
gástrica de pacientes obesos e não obesos
TABELA 3 Densidade (cels/mm2) de células argirófilas na mucosa oxíntica dos pacientes obesos e não obesos.
TABELA 4 Densidade (cels/mm2 ) de células argirófilas na mucosa antral de pacientes obesos e não obesos.
TABELA 5 Densidade (cels/mm2 ) das células argirófilas na mucosa oxíntica e relação com achados histológicos nos pacientes obesos
TABELA 6 Densidade (cels/mm2) das células argirófilas na mucosa oxíntica e relação com achados histológicos nos pacientes não obesos
TABELA 7 Densidade (cels/mm2) das células argirófilas na mucosa antral
e relação com achados histológicos em pacientes obesos
TABELA 8 Densidade (céls /mm2 ) das células argirófilas na mucosa antral e relação com achados histológicos em pacientes não obesos
TABELA 9 Densidade (céls /mm2 ) de células argirófilas na mucosa oxíntica em relação ao sexo
TABELA 10 Densidade (céls /mm2 )de células argirófilas na mucosa oxíntica em pacientes obesos em relação ao sexo
TABELA 11 Densidade (céls /mm2 ) de células argirófilas na mucosa oxíntica em pacientes não obesos em relação ao sexo
TABELA 12 Densidade (céls /mm ) de células argirófilas na mucosa antral em relação ao sexo
TABELA 13 Densidade (céls /mm2 ) de células argirófilas na mucosa antral em pacientes obesos em relação ao sexo
TABELA 14 Densidade (céls /mm2 ) de células argirófilas na mucosa antral em pacientes não obesos em relação ao sexo
TABELA 15 Densidade (céls /mm2 ) de células imunorreativas à ghrelina na mucosa oxíntica de pacientes obesos e não obesos
TABELA 16 Densidade (céls /mm2 ) de células imunorreativas à ghrelina na mucosa antral de pacientes obesos e não obesos
TABELA 17 Densidade (céls /mm2 ) de células imunorreativas à ghrelina na mucosa oxíntica e relação com achados histológicos em pacientes obesos
TABELA 18 Densidade (céls /mm2 )de células imunorreativas à ghrelina na
mucosa oxíntica e relação com achados histológicos em pacientes não obesos
TABELA 19 Densidade (céls /mm2) de células imunorreativas à ghrelina na mucosa antral e relação com achados histológicos em pacientes obesos
TABELA 20 Densidade (céls /mm2 ) de células imunorreativas à ghrelina na mucosa antral e relação com achados histológicos em pacientes não obesos
36
37
37
39
40
40
40
41
mucosa oxíntica e relação com sexo em todos os pacientes, obesos e não obesos
TABELA 22 Densidade (céls /mm2) de células imunorreativas à ghrelina na mucosa oxíntica em pacientes obesos em relação ao sexo
TABELA 23 Densidade (céls /mm2 ) de células imunorreativas à ghrelina na mucosa oxíntica em pacientes não obesos em relação ao sexo
TABELA 24 Densidade (céls /mm2) de células imunorreativas à ghrelina na mucosa antral em relação ao sexo
TABELA 25 Densidade (céls /mm2 ) de células imunorreativas à ghrelina na mucosa antral em pacientes obesos em relação ao sexo
TABELA 26 Densidade (céls /mm2 ) de células imunorreativas à ghrelina na mucosa antral em pacientes não obesos em relação ao sexo
TABELA 27 Densidade (céls /mm2 )das células argirófilas na mucosa oxíntica versus Helicobacter pylori
TABELA 28 Densidade (céls /mm2 )das células argirófilas na mucosa antral versus Helicobacter pylori (cels/mm2)
TABELA 29 Densidade (céls /mm2 )das células argirófilas na mucosa oxíntica versus Helicobacter pylori em pacientes obesos
TABELA 30 Densidade (céls /mm2 )das células argirófilas na mucosa oxíntica versus Helicobacter pylori em pacientes não obesos
TABELA 31 Densidade (céls /mm2) das células argirófilas na mucosa antral versus Helicobacter pylori em pacientes obesos
antral versus Helicobacter pylori em pacientes não obesos
TABELA 33 Densidade (céls /mm2 ) das células imunorreativas à ghrelina na mucosa oxíntica versus Helicobacter pylori
TABELA 34 Densidade (céls /mm2 ) das células imunorreativas à ghrelina na mucosa antral versus Helicobacter pylori
TABELA 35 Densidade (céls /mm2 ) das células imunorreativas à ghrelina na mucosa oxíntica versus Helicobacter pylori em pacientes obesos
TABELA 36 Densidade (céls /mm2 ) das células imunorreativas à ghrelina na mucosa oxíntica versus Helicobacter pylori em pacientes não obesos
TABELA 37 Densidade (céls /mm2 ) das células imunorreativas à ghrelina na mucosa antral versus Helicobacter pylori em pacientes obesos
TABELA 38 Densidade (céls /mm2 ) das células imunorreativas à ghrelina na mucosa antral versus Helicobacter pylori em pacientes não
obesos
TABELA 39 Mucosa oxíntica -Distribuição da frequência das hiperplasias das células argirófilas nos grupos obeso e não obeso
TABELA 40 Mucosa antral- Distribuição da frequência das hiperplasias de células argirófilas nos grupos obeso e não obeso
TABELA 41 Mucosa oxíntica- Distribuição da frequência das hiperplasias de células produtoras de ghrelina nos grupos obeso e não obeso
TABELA 42 Mucosa antral- Distribuição da frequência das hiperplasias de células produtoras de ghrelina nos grupos obeso e não obeso
RESUMO
Fabiana Alves Nunes. Estudo da densidade das células endócrinas e produtoras de
ghrelina na mucosa gástrica de pacientes portadores de obesidade mórbida. Belo
Horizonte, 2005. Dissertação de Mestrado em Medicina, área de Concentração em Gastroenterologia- Faculdade de Medicina da UFMG
Introdução e objetivos: A obesidade, condição definida pelo acúmulo
excessivo do tecido adiposo, apresenta uma prevalência crescente, numa taxa alarmante em todo o mundo, e está associada a co-morbidades e elevados custos. A recente descoberta de peptídeos produzidos no tubo digestivo com provável papel sobre o equilíbrio energético, em especial a ghrelina gástrica, tem aberto novas perspectivas de estudo sobre possíveis fatores patogênicos deste distúrbio metabólico. O objetivo do presente estudo foi estudar as alterações histopatológicas da mucosa gástrica, em pacientes portadores de obesidade mórbida, enfatizando-se a presença e características da gastrite e a presença do
Helicobacter pylori, assim como, estudar a densidade da população de células
endócrinas em geral e das células produtoras de ghrelina em particular, na mucosa gástrica da região antral e oxíntica tendo como controle pacientes dispépticos funcionais, não obesos. Pacientes e métodos: Cinqüenta pacientes
entre a população de células imunorreativas à ghrelina no grupo dos pacientes obesos, sendo mais numeroras no sexo feminino (p<0,05). A densidade de
células imunorreativas à ghrelina na mucosa oxíntica foi significativamente maior entre os pacientes Hp negativos. Foi observada maior freqüência de alterações hiperplásicas focais tanto das células argirófilas quanto das células imunorreativas à ghrelina na mucosa antral de pacientes obesos mórbidos em relação aos pacientes não obesos( p<0,05). Conclusões: O presente trabalho sugere que alterações na população de células endócrinas gastrointestinais e em particular as células produtoras de ghrelina, associadas à presença da bactéria Hp, possam estar associadas à fatores individuais na fisiopatogênse da obesidade.
Fabiana Alves Nunes. Study of the density of endocrine and ghrelin producer cells
in the gastric mucosa of patients with morbid obesity. Belo Horizonte, 2005.
Dissertation for M.Sc in Gastroenterology - School of Medicine, UFMG, Brazil.
Introduction and objectives: Obesity, a condition defined as the excessive
accumulation of adipose tissue, has shown increasing prevalence, and an alarming rate worldwide, with associated comorbidity and high costs. The recent discovery of peptides produced in the digestive tube with a probable role in energy equilibrium, and in particular gastric ghrelin has opened new perspectives of study into possible pathogenic factors of this metabolic disturbance. The objective of the present study was to study the histopathological alterations of the gastric mucosa, in patients with morbid obesity, with emphasis on the presence and characteristics of gastritis and the presence of Helicobacter pylori, as well as, study the population density of endocrine cells in general and of ghrelin cell producers in particular, in the antral and oxyntic gastric mucosa with a control group of functionally dyspeptic patients who were not obese. Patients and methods: Fifty morbidly obese patients, candidates for bariatric surgery, and fifty dyspeptic patients, with BMI <30, underwent upper digestive endoscopy. Fragments of oxyntic and antral gastric mucosa were collected for histological evaluation, silver stained
hyperplastic alterations both of the argyrophilic cells as well as immunoreactive cells to ghrelin in the antral mucosa of morbidly obese patients in relation to
patients who were not obese (p<0.05). Conclusions: The present study suggests that alterations in the gastrointestinal endocrine cell population and in particular the producer cells of ghrelin, associated with the presence of Hp bacteria, may be associated with individual factors in the physio-pathogenesis of obesity.
SUMÁRIO
INTRODUÇÃO...01
Revisão da literatura...03
Obesidade...03
Hormônios gastrointestinais e ingestão alimentar...10
Ghrelina...12
Mucosa gástrica...16
OBJETIVOS DO TRABALHO...20
PACIENTES E MÉTODOS...22
Pacientes...22
Endoscopia Digestiva Alta...22
Colorações para estudo histológico...23
Avaliação histopatológica da mucosa gástrica...24
Contagem das células argirófilas e imunorreativas à ghrelina...24
Avaliação das alterações hiperplásicas...25
Análise estatística...27
RESULTADOS...29
Avaliação histológica da mucosa gástrica...29
Avaliação da população de células argirófilas da mucosa gástrica...31
Avaliação das células imunorreativas à ghrelina na mucosa gástrica...37
Avaliação da presença da bactéria Helicobacter pylori...44
Avaliação das alterações hiperplásicas...49
DISCUSSÃO...53
CONCLUSÕES...61
REFERÊNCIAS BIBLIOGRÁFICAS...64
ANEXOS: Termo de Consentimento e Livre esclarecimento...76
INTRODUÇÃO
Nas diferentes fases da vida, a composição corporal de cada indivíduo, definida como a quantificação do corpo humano em massa magra (músculos, ossos, órgãos) e gordura (1), reflete a interação do patrimônio genético e constitucional com o macro ambiente sócio-econômico e cultural. A composição corporal é um importante fator de equilíbrio da saúde dos indivíduos, com reflexos não somente orgânicos, mas também psicológicos, principalmente nos valores vigentes na sociedade atual.
Quando se consideram as condições de saúde e nutrição das populações tem-se a oportunidade de identificar não apenas os indivíduos capazes de manter a composição corporal adequada, mas também aqueles que por algum motivo perderam essa capacidade e como conseqüência desenvolveram sobrepeso ou obesidade (2). A Organização Mundial de Saúde recomenda a classificação de sobrepeso e obesidade nos indivíduos segundo o Índice de Massa Corporal (IMC), coeficiente obtido pela divisão do peso em quilogramas pelo quadrado do valor da altura em metros. Considera-se sobrepeso quando o IMC for igual ou superior a 25 e obesidade quando o IMC encontrar-se igual ou superior a 30. Os indivíduos cujo IMC for igual ou superior a 40 são considerados obesos mórbidos (3).
A obesidade, condição definida pelo acúmulo excessivo do tecido adiposo, apresenta uma prevalência crescente, numa taxa alarmante em todo o mundo, tanto em
países desenvolvidos quanto nos em desenvolvimento. Além disso, como o problema parece estar aumentando rapidamente em crianças, as consequências reais para a saúde podem ser desastrosas no futuro.
As consequências da obesidade sobre a saúde são inúmeras, variando de um risco aumentado de morte prematura a várias doenças não fatais, porém debilitantes, que possuem efeitos deletérios sobre a qualidade de vida. A obesidade é um fator de risco para doenças como diabetes mellitus tipo 2, hipertensão arterial sistêmica, doença cardiovascular, dislipidemia, síndrome da hipoventilação, doenças osteoarticulares e está relacionado com risco aumentado de determinados tipos de neoplasias, como de cólon, mama, próstata, dentre outros (2).
peptídeo ghrelina, produzido principalmente na mucosa gástrica e cuja liberação parece estar relacionada com os estados de jejum e de saciedade tanto no homem como em animais de experimentação (4, 5).Trabalhos sugeriram que esse possível controle do
consumo de alimentos estaria alterado em pacientes obesos (6, 7).
As células produtoras de ghrelina foram identificadas em diversos órgãos como hipotálamo, pâncreas, duodeno, pulmões, entre outros, mas é a mucosa oxíntica do estômago o principal local de produção e a responsável pela maior parte da concentração sérica deste peptídeo (8, 9). A remoção cirúrgica do corpo gástrico de ratos provocou redução de 80% da concentração sérica de ghrelina e da mesma forma os níveis séricos de ghrelina reduziram de forma significativa após cirurgia bariátrica de
“By-pass” gástrico (10,11).
Alguns estudos tem relacionado a presença da bactéria Helicobater pylori na mucosa gástrica com os níveis séricos de ghrelina, com resultados divergentes, porém a maioria dos estudos realizados observaram aumento da ghrelina sérica após a erradicação da bactéria.
REVISÃO DA LITERATURA
Obesidade
A obesidade é uma condição complexa e multifatorial, caracterizada por distúrbio do estado nutricional traduzido por aumento de tecido adiposo. Geralmente, homens com mais de 25% de gordura corporal e mulheres com mais de 35% são considerados obesos (2).
No decorrer da maior parte da história humana, o ganho de peso e o armazenamento de gordura foram vistos como sinais de saúde e prosperidade. Em épocas de trabalho árduo e escassez de alimentos, garantir a ingestão adequada para suprir as necessidades era a principal preocupação nutricional. Atualmente, porém, como os padrões de vida continuam a melhorar, o ganho de peso e a obesidade representam ameaças crescentes em países desenvolvidos assim como em países em desenvolvimento, atingindo a população adulta e crianças.
Registros históricos de épocas remotas da civilização greco-romana demonstraram evidência clínica de obesidade, mas houve pouco progresso científico na compreensão desta
condição até o século XX. No século XVIII, Lavoisier sugeriu que o metabolismo dos humanos e animais envolvia combustão de carbono e hidrogênio e que humanos obesos e magros obedeciam às leis da termodinâmica (12). A descoberta de que a gordura é armazenada em células levou à idéia de que a obesidade poderia ser causada pela presença de muitas células de gordura (12).
No início do século XX, análises de dados de seguros de vida indicaram que a obesidade estava associada a um aumento da taxa de mortalidade. Uma base familiar para a obesidade foi sugerida na década de 1920 e a doença de Cushing e a obesidade hipotalâmica foram descritas nesta época. A seguir, a introdução do hormônio tireoidiano e derivados de anfetamina como tratamentos farmacológicos para a obesidade abriram caminho para a compreensão de várias formas específicas de obesidade (12).
A avaliação do estado nutricional de adultos era tradicionalmente feita através do conceito de "peso ideal" obtido pela comparação da massa corporal em função da estatura com um padrão antropométrico internacional. Se a massa corporal estivesse acima de 20% do padrão, dizia-se que a pessoa era obesa (2). Muitos estudiosos questionam sobre a inadequação da utilização de padrão único universal para adultos, já que há grande variação da estatura média das populações adultas do mundo. Portanto, existe a necessidade do desenvolvimento de indicadores antropométricos do estado nutricional que reflitam a composição corporal e que sejam simples de se obter. A busca para o desenvolvimento de tais indicadores tem sido baseada nos dados de massa corporal e estatura. Análises de grandes bancos de dados foram realizadas na tentativa de se encontrar a melhor relação massa corporal/estatura que preenchesse os requisitos mencionados. Há duas décadas, Keys et al. (13) sugeriram chamar a relação massa corporal/estatura2 de Índice de Massa Corporal (IMC), com a massa corporal expressa em quilogramas e a estatura em metros, e desde então esta relação ficou popular na avaliação nutricional de adultos, e alguns estudiosos passaram a
chamá-la também de índice de Quetelet em homenagem a seu criador. Essa popularização se deve ao fato do IMC ser aparentemente o índice de melhor correlação com o peso (valores do
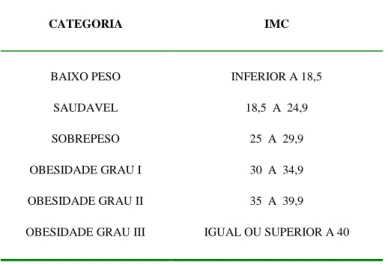
coeficiente de correlação "r" normalmente superiores a 0,8), fato documentado internacionalmente em amostras de populações adultas (2,12). Hoje a classificação de sobrepeso e obesidade recomendada pela Organização Mundial de saúde baseia-se no IMC (TABELA 1). A definição de obesidade mórbida segundo o IMC é determinada se o valor obtido por este índice for igual ou superior a 40, embora existam estudiosos que utilizam o termo superobesidade para os casos cujo IMC é superior a 50. ( 14 ).
TABELA 1: Classificação sobrepeso e obesidade de
acordo com o IMC segundo a OMS (1997)
CATEGORIA IMC
BAIXO PESO INFERIOR A 18,5
SAUDÁVEL 18,5 A 24,9
SOBREPESO 25 A 29,9
OBESIDADE GRAU I 30 A 34,9
OBESIDADE GRAU II 35 A 39,9
Dois tipos básicos de distribuição da gordura corporal em pessoas obesas têm sido descritos: a obesidade andróide (central) e a obesidade ginecóide (gluteofemoral). Um método útil para distinguir o tipo de obesidade é a razão da cintura/quadril (12,15).
De modo simplificado, a obesidade ocorre como resultado do desequilíbrio entre a energia gasta e a ingestão calórica diária. Embora as causas deste desequilíbrio não sejam totalmente compreendidas, vários mecanismos e fatores têm sido propostos. Entre eles se destacam: (a) mecanismos de ordem genética; (b) mecanismos fisiopatológicos; (c) fatores ambientais.
Entre os mecanismos admitidos como de ordem genética citam-se os dismorfismos que constituem várias síndromes clínicas conhecidas e associadas à obesidade. São elas: Síndrome de Bardet-Bield, caracterizada por obesidade, retinite pigmentosa, retardo mental e polidactilia; Síndrome de Simpson-Golabi-Behmel, caracterizada por obesidade, dismorfia facial, retardo mental, polisindactilia, má formações esqueléticas e viscerais ; Síndrome de
Cohen, caracterizada por obesidade, hipotonia muscular, retardo mental, deformidades esqueléticas, surdez; Síndrome de Carpenter, caracterizada por obesidade, polidactilia,
braquidactilia e craniosinostose; Síndrome de Alstrom caracterizada por retinite pigmentosa, surdez, obesidade, diabetes mellitus e a Síndrome de Prader Willi, caracterizada por obesidade, retardo mental, hipogonadismo e deficiência de hormônio de crescimento (GH). Nessas síndromes os mecanismos genéticos são a causa primária. São disordens raras e nas pessoas afetadas, a obesidade pode ser moderada a grave (2,15).
Entre os mecanismos fisiopatológicos, o baixa consumo de energia tem sido proposto como uma das causas do ganho ponderal. Algumas pesquisas acreditam que o corpo tenta manter o ritmo metabólico dentro de um específico ponto de corte que pode ser controlado pelo sistema nervoso simpático e este nível pode ser mais elevado que o desejável em algumas pessoas (15). Também existem vários peptídeos gastrointestinais (como a colecistocinina, enterostatina, glucagon, mais recente a ghrelina, entre outros) e neurotransmissores que parecem influenciar na etiologia da obesidade e iremos detalhar adiante. Lesões ou estimulações nas regiões ventromedial e lateral do hipotálamo causam diminuição da saciedade ou aumentam o apetite, que se manifestam com hiperfagia, diminuição da atividade física e obesidade (15).
Entre os fatores ambientais, várias drogas como antipsicóticos, antidepressivos tricíclicos, insulina, glicocorticóides, sulfoniluréias, entre outros, têm sido associadas ao ganho de peso (2). Hiperfagia e dieta rica em lípides estão associados à obesidade. Dietas hiperlipídicas têm baixo poder de saciedade e o conteúdo calórico da gordura é o dobro de
calorias comparados a proteínas e carboidratos (15). O aumento da ingestão alimentar global, os tamanhos das porções, a disponibilidade de alimentos de alto conteúdo calórico e baixo
poder sacietógeno associados ao sedentarismo, promovem um desequilíbrio energético e promovem sobrepeso e obesidade (2,15).
Em 1989 uma revisão de literatura que citou dois estudos longitudinais, demonstrou uma relação de causa e efeito entre baixos níveis sócio-culturais e obesidade (15).
Fatores culturais e étnicos também tem sido associados à obesidade. Por exemplo, a incidência de obesidade nos EUA é elevada em mulheres afro-americanos, nativas americanas e população latina (19). No Brasil, a miscigenação racial não permite tais conclusões.
Fatores psicológicos como depressão e baixa auto-estima podem exacerbar o consumo excessivo de alimentos. Psiquiatras caracterizam a compulsão alimentar como um distúrbio que pode ter contribuído com o desenvolvimento da obesidade em 20% a 30% dos casos de pacientes obesos (2).A obesidade pode ser o resultado de distúrbios psicológicos induzidos por dificuldades de ordem sexual, perda de entes próximos, alcoolismo em familiares, desordens familiares ou conjugais (15).
população geral era de 12,8%, aumentando para 14,5% em 1980 e atingindo a taxa de 22,5% em 1994 (19). Esse último percentual sobe para 55% se forem incluídos neste grupo aqueles indivíduos considerados sobrepeso.
Na Europa, a prevalência de obesidade foi estimada pelo estudo MONICA da Organização Mundial De Saúde (OMS) entre 1983 e 1986, e os números encontrados foram de 15% nos homens e 22% nas mulheres, com variabilidade entre os países pesquisados. A menor prevalência encontrada foi na Suécia, 7% em homens e 9% em mulheres e a maior na Lituânia, 22% em homens e 45% em mulheres (20). Na Inglaterra, entre 1980 e 1993, a população obesa aumentou em 50%(12). Os dados mais recentes de estudos individuais em países europeus sugerem que a prevalência da obesidade encontra-se entre 10 a 20% em homens e 10 e 25% em mulheres (12).
Na Ásia, o primeiro estudo conduzido para avaliar a prevalência de sobrepeso e obesidade foi realizado em 1985 na Tailândia e detectou-se que 2,2% dos homens e 3% das mulheres eram obesos e estes números têm mostrado tendência a aumento nas pesquisas mais
recentes (21). No Japão, os dados da pesquisa de nutrição nacional conduzida pelo Ministério Japonês de Saúde e Bem Estar, mostraram que houve um aumento na prevalência da
obesidade tanto em homens quanto em mulheres no período de 1976 a 1993 (12). Na China, a prevalência de obesidade foi estimada em 1,2% em homens e 1,64% em mulheres (22).
Os dados da população geral da Austrália a da Nova Zelândia em 1989 mostraram obesidade em 10 a 15% entre homens e mulheres (23). Na África, mesmo com dados fragmentados em algumas áreas, foi evidenciado que a obesidade existe, particularmente no sexo feminino, em países desenvolvidos e em países em desenvolvimento. Nas Ilhas Maurício em 1992 foi detectada uma prevalência de obesidade de 5% em homens e 15% em mulheres (24).Em países do leste mediterrâneo (Kuwait, Emirados Árabes Unidos e na ilha de Chipre) foi encontrado, em estudo transversal entre 1990 e 1993, elevado número de obesos, principalmente mulheres, com valores maiores dos que os encontrados nos países industrializados, aproximadamente, 23% em homens e 34% em mulheres (25, 26).
entre os homens (de 2,8% para 8,8%) principalmente na faixa etária até os 50 anos de idade (29). Por outro lado, o excesso de peso e a obesidade entre mulheres cresceram 50% de 1974 a 1989 e mantiveram-se estáveis entre 1989 e 2003, com exceção da região Nordeste, onde persistiu o aumento do excesso de peso e obesidade entre as mulheres. Comparando os dados obtidos na região sudeste pelos pesquisas realizadas em 1989 e 1997, pode-se detectar uma redução significativa (de 13,2% para 8,2%) da prevalência da obesidade feminina na população de maior renda familiar enquanto na população de menor renda houve tendência oposta (aumento da prevalência de 11,6% para 15,0%) (30).
Até o momento não ha pesquisas feitas com o objetivo especifico de avaliar a prevalência de obesidade mórbida. No inquérito feito no Brasil em 1997 a prevalência de indivíduos com índice de massa corporal (IMC) de 40 ou mais kg/m2 foi de 0,2% em homens, 0,8% em mulheres e 0,5% nos dois sexos (30).
Estimativas dos custos da obesidade têm sido propostas e envolvem dados relacionados com custos diretos associados ao tratamento da obesidade e custos indiretos decorrentes da morbidade envolvida. Os custos econômicos da obesidade foram avaliados em vários países desenvolvidos e estão na faixa de 2 a 7% dos custos totais com cuidados com a saúde. O primeiro estudo realizado sobre o custo econômico da obesidade foi o de Colditz et al. (31). As doenças incluídas na estimativa de custo foram o diabetes mellitus, doença cardiovascular, hipertensão arterial crônica, colecistopatia e câncer de cólon e de mama. Os custos totais atribuíveis à obesidade e co-morbidades foram estimados em US$39,3 bilhões no ano de 1986 nos Estados Unidos. Em 1994 foi publicado um trabalho estimando o custo nos Estados Unidos em 1990 de US$ 68,8 bilhões, dos quais US$ 45,8 bilhões foram devidos aos custos diretos com a obesidade e os US$23,3 restantes foram estimados em função da produtividade perdida e mortalidade por doenças associadas à obesidade (32).
Os efeitos do excesso de peso na morbidade e mortalidade têm sido relatados por mais
de 2000 anos. Hipócrates reconheceu que “morte súbita é mais comum nos obesos que magros” (12). As doenças associadas com excesso de peso são responsáveis por custos
Uma das co-morbidades associadas à obesidade é a doença cardiovascular. A obesidade predispõe o indivíduo a fatores de risco cardiovascular, incluindo hipertensão arterial, dislipidemia e intolerância à glicose. Estudos recentes sugerem que a obesidade é um fator de risco independente para a morbidade e mortalidade cardiovascular. O estudo de Framingham categorizou o peso corpóreo como o terceiro preditor mais importante da doença cardiovascular entre o sexo masculino, após idade e dislipidemia (35). Similarmente, nas mulheres, um estudo americano prospectivo publicado em 1990, encontrou correlação positiva entre o IMC e o risco de desenvolver a doença cardiovascular (12). A associação entre hipertensão e obesidade está bem documentada. No estudo NHANES II mostrou-se que a prevalência de hipertensão em adultos com sobrepeso é 2,9 vezes maior que a população com IMC dentro da normalidade (36).O risco de desenvolver hipertensão aumenta com a duração da obesidade, e a redução do peso leva à queda da pressão arterial. Razões para esta associação entre obesidade e hipertensão são os níveis elevados de insulina circulante com consequente resistência insulínica e retenção renal de sódio, resultando em elevação nos
níveis pressóricos. Outros prováveis fatores etiológicos incluem renina plasmática elevada e aumento da atividade catecolaminérgica nos pacientes portadores de obesidade (15).
Associação positiva entre obesidade e o risco de desenvolver diabetes mellitus tipo 2 foi documentada em inúmeros estudos prospectivos e transversais. Comparando com indivíduos com IMC dentro da normalidade, pacientes obesos classe III têm um risco 18 e 13 vezes maior de desenvolver diabetes mellitus tipo 2, para homens e mulheres respectivamente (15). Estudos sobre a perda ponderal em pacientes com diagnóstico de diabetes mellitus tipo 2 mostraram que a redução de 10% a 15% do peso em pacientes diabéticos obesos resultou em melhoras significativas no controle glicêmico (37).
Uma série de estudos correlacionou a obesidade com a incidência de cânceres, particularmente aqueles dependentes de hormônios e os do trato gastrointestinal. Os riscos aumentados de câncer endometrial, ovariano, cervical e de mama foram documentados em mulheres obesas (especialmente nos casos de distribuição centrípeta da adiposidade) e de próstata em homens obesos (12,15). Homens e mulheres com IMC acima de 35 têm mortalidade aumentada para câncer de cólon (38).
Acredita-se que a supersaturação da bile com colesterol e a mobilidade reduzida da vesícula biliar sejam fatores subjacentes à formação de cálculos biliares (15).
Também a osteoartrose é mais prevalente em pacientes obesos, assim como distúrbios do sono, incluindo a apnéia do sono. Um terço dos portadores de apnéia de sono são obesos. Em casos severos de hipoventilação associada à obesidade (Síndrome de Pick Wick) ocorre hipertensão pulmonar e cor pulmonale, aumentando o risco de morte cardiovascular (2,12,15).
A obesidade está associada à irregularidade menstrual e infertilidade. Os fatores associados são a hiperinsulinemia e hiperandrogenismo que ocorrem nos indivíduos obesos e interferem no eixo hipotálamo-hipófise-gônadas (15).
Outras co-morbidades associadas à obesidade são hiperuricemia, esteatose hepática, refluxo gastroesofágico, incontinência urinária, hipertensão intracraniana idiopática, insuficiência venosa periférica, distúrbios da imunidade e complicações durante a gestação (2).
Hormônios gastrointestinais e ingestão alimentar
Há muitas décadas vêm-se tentando entender os mecanismos que regulam a fome e a saciedade. Estudiosos postularam que a insulina estaria diretamente relacionada com a ingestão alimentar. Várias pesquisas foram realizadas para comprovar tal efeito, no entanto até o momento os resultados são contraditórios no que diz respeito às ações da insulina sobre o controle do consumo de alimentos (39, 40, 41).
O sistema nervoso central recebe múltiplos estímulos que influenciam a ingestão de alimentos. São estímulos visuais, auditivos, olfatórios e são processados antes mesmo da ingestão alimentar. A fase cefálica da resposta à ingestão de alimentos consiste em aumentar a
salivação e na secreção de hormônios gastrointestinais (42). Estudos já demonstraram que existe diferença na resposta cefálica da ingestão alimentar entre indivíduos magros e obesos, no entanto esta diferença não está totalmente entendida (43).
animais, uma inibição na ingestão alimentar, reduzindo o tamanho e duração das refeições (44). Esse efeito parece ser mediado via receptor da colecistocinina no nervo vago e núcleo arqueado do hipotálamo (45). No entanto a administração contínua é ineficaz em reduzir a ingestão após as primeiras 24 horas, demonstrando um efeito de curta regulação da fome e saciedade deste peptídeo. Também em estudos experimentais, houve aumento compensatório do número de refeições após a administração da colecistocinina (45).
O PYY pertence à família dos peptídeos PP composta do peptídeo pancreático e do neuropeptídeo Y, um potente orexígeno central. O PYY é secretado principalmente na porção distal do trato gastrointestinal, resultando em aumento da saciedade. A ingestão alimentar resulta na liberação do PYY destas células e os níveis séricos atingem um pico uma a duas horas após e parece que este pico depende do número de calorias ingeridas e da composição do alimento ingerido (45).
A Oxintomodulina e o peptídeo semelhante ao glucagon-1 (GLP-1) são produtos do gen preproglucagon, que são expressos nas células L do intestino delgado e pâncreas. Esses
dois peptídeos são rapidamente liberados após a ingestão alimentar e parecem afetar o controle a curto prazo da saciedade. Inibem o esvaziamento gástrico em humanos e suprimem
o apetite e consumo de alimentos com a administração periférica em humanos normais e em portadores de diabetes mellitus (45).
A apolipoproteína A-IV é produzida no fígado e intestino delgado e é incorporada a quilomicrons e lipoproteínas. Sua síntese é estimulada pela absorção de lípides e sua ação consiste em inibir a ingesta alimentar atuando em receptores no sistema nervoso central (45).
A enterostatina é um pentapeptídeo derivado da digestão da procolipase pancreática no lúmen intestinal. A síntese da procolipase é estimulada por dietas hiperlipídicas. A enterostatina inibe a ingestão alimentar, em particular de lípides (45).
Ghrelina
No final de 1970, num esforço de desenvolver um narcótico menos potente, foi detectado um análogo de encefalina que possuia fraca atividade estimuladora da liberação do hormônio de crescimento (GH), e desta forma iniciaram-se várias pesquisas com outros secretagogos de GH e ainda, a caracterização do hormônio estimulador da secreção do GH (GHRH) em 1982, despertou outro foco de pesquisa (48). O receptor de secretagogo de GH (GHS-R) foi identificado por Smith et al. (49) em 1996 e em 1999 Kojima et al. (4)adotando estratégica de receptor órfão descobriu um ligante endógeno desse GHS-R e monitorou as mudanças intracelulares da concentração de cálcio em extratos de diferentes tecidos de roedores (cérebro, pulmão, coração, rins, intestino e estômago), após a ligação dessa substância ao GHS-R. Inesperadamente a mais alta atividade foi encontrada no estômago dos ratos e foi então purificado o peptídeo de 28 amino-ácidos. O peptídeo foi nomeado ghrelina, de ghre, prefixo indo-europeu que significa crescimento, referência da ação deste hormônio
sobre o GH.
Após análise da estrutura química da ghrelina constatou-se que o grupo acyl, na
porção serina 3 é necessário para a atividade biológica do peptídeo (10, 50). A ghrelina humana difere do rato apenas por dois aminoácidos e circula com uma concentração plasmática de aproximadamente 150 fmol/ml (50).
Células produtoras de ghrelina estão presentes de forma mais abundante na mucosa oxíntica do estômago. Date et al. em 2000 (8) e posteriormente Dornoville et al.(9) identificaram células na mucosa gástrica de humanos, imunorreativas à grelina semelhantes
ao tipo A dos ratos e semelhantes à célula X nos cães, e por isso as nomeou de células “A/X
As células secretoras de ghrelina podem ser do tipo abertas ou fechadas em relação ao lúmen glandular. Na mucosa gástrica predominam as células do tipo fechadas e provavelmente respondem ao estímulo mecânico de distensão gástrica (50).
Em experimentos com ratos, removendo-se a parte produtora de ácido do estômago, houve queda de aproximadamente 80% da ghrelina circulante, confirmando que a mucosa oxíntica é a maior fonte de produção da ghrelina plasmática (10). Infusão de gastrina ou hipergastrinemia induzida pelo inibidor de bomba de prótons omeprazol não afetou os níveis de ghrelina sérica, ou os níveis de RNAm para ghrelina (50).Isso sugere que, ao contrário de outras células endócrinas, a célula secretora de grelina não sofre influência da gastrina. No entanto há estudos que mostraram que a ghrelina estimula a secreção ácida e a motilidade gastrointestinal em roedores e os níveis de ghrelina circulantes são correlacionados com o esvaziamento gástrico em humanos (10,49).
Um estudo feito em 2003 por Gokcel et al. (52) mostrou que os pacientes Helicobacter
pylori positivos não apresentavam níveis de ghrelina sérica mais altos que os controles e
estudo de Nwokolo et al.(53) evidenciou que após a erradicação da bactéria Helicobacter
pylori (Hp) ocorria aumento significativo dos níveis séricos de grelina. Em 2005, Osawa et al.
(54)estudaram a densidade das células imunorreativas à ghrelina e os níveis séricos desse peptídeo em pacientes com e sem Hp presente na mucosa gástrica. No grupo Hp positivo os níveis séricos e a densidade das células imunorreativas à ghrelina foram menores que o grupo Hp negativos.
Em humanos ocorre aumento dos níveis séricos de ghrelina durante o jejum e há um ritmo de secreção diurno semelhante ao ritmo do GH, com aumento ao longo do dia e um pico entre 0.00 e 2.00 horas (50). Elevação nos níveis circulantes de ghrelina em relação à idade foi observado em ratos, porém não confirmado ainda em humanos (55). Estudos recentes no entanto, indicam que a secreção de ghrelina diminui com a idade durante o período da infância (56). No que diz respeito às concentrações séricas de ghrelina em homens e mulheres, os estudos são contraditórios. Prunnel et al. (57) e Broglio et al. (58) demonstraram não existir diferença entre os sexos, no entanto Barkan et al. (59) detectaram elevações nos níveis séricos de ghrelina em mulheres quando comparadas aos níveis séricos de ghrelina nos homens estudados.
controversa. Há evidências de que possa ocorrer uma contra-regulação entre os dois hormônios. A administração de insulina reduz as concentrações de ghrelina e vice-versa (50). No entanto Caixas et al. (60) demonstraram que doses fisiológicas de insulina não suprimiam
a secreção de ghrelina em humanos. Foi demonstrada expressão de ghrelina nas células α e β
pancreáticas principalmente no pâncreas fetal e estudos experimentais demonstraram que a ghrelina estimulou a secreção insulínica em ratos normais e diabéticos (61, 62) .
Em experimentos com roedores a administração aguda de ghrelina levou ao aumento do apetite e a administração crônica levou ao ganho de peso (50). Wren et al. (63) utilizando voluntários observaram aumento de 28% no consumo médio de calorias após infusão endovenosa de ghrelina na dose de 5 pmol/kg/minnestes indivíduos.
A expressão da ghrelina foi encontrada num grupo de neurônios adjacentes ao terceiro ventrículo entre o núcleo dorsal, ventral, paraventricular e arqueado que sabidamente produzem e liberam neurotransmissores orexígenos, principalmente o neuropeptídeo Y (NPY), proteína Agouti (AGRP), hormônio concentrador de melatonina (MCH). Até o atual
conhecimento, foi visto que as vias hipotalâmicas são os mediadores da influência da ghrelina no balanço energético, através de receptores de secretagogos do hormônio de crescimento
(GHS) do tipo 1a. Uma dessas vias envolve os neurônios de NPY e outra via envolve receptores de melanocortina e seus ligantes agonistas e antagonistas, respectivamente α
-melanocortina (α-MSH) derivado do produto de clivagem proteolítica da proopiomelanocortina (POMC) e o orexígeno AGRP. A ghrelina eleva as concentrações de AGRP e NPY após sua administração aguda e crônica e a expressão hipotalâmica do AGRP está exacerbada após a ativação crônica por várias semanas pela ghrelina. Dessa forma configura-se um efeito crônico da ghrelina através do AGRP, enquanto que o NPY estaria envolvido na ação aguda da ghrelina. Outros possíveis mediadores da ação da ghrelina no hipotálamo seriam a inibição do POMC, do transcrito regulado por cocaína e anfetamina (CART), do fator de crescimento neurotrópico ciliar e ativação de hipocretinas, do ácido gama-aminobutírico (GABA) e da galanina (10).
Cummings et al. (68) evidenciaram um aumento pré prandial dos níveis séricos de ghrelina (média de 78%), sugerindo um papel na iniciação das refeições. Neste estudo também foi demonstrada uma diminuição dos níveis séricos de ghrelina uma hora após a refeição. Em estudos posteriores com pacientes obesos os níveis plasmáticos de ghrelina pré prandiais eram inferiores aos dos pacientes não obesos e o estudo de English et al. evidenciaram que os níveis plasmáticos da ghrelina caíram 39,5%, 30min após a refeição e que não houve mudanças nos níveis séricos da ghrelina após a refeição em pacientes obesos (6, 69).
A perda de peso pela dieta foi associada a elevação nos níveis séricos de ghrelina (aumento médio de 24%) (70). Em pacientes submetidos à cirurgia de by-pass gástrico, os níveis plasmáticos de ghrelina mantiveram-se significativamente mais baixos que os pacientes que perderam peso com a dieta ou com outros procedimentos cirúrgicos, sugerindo que o sucesso deste tipo de tratamento cirúrgico para obesidade severa talvez seja em parte resultado da exclusão da região gástrica produtora da ghrelina (71,72,73). No entanto, estudos
mais recentes relatam aumento gradual dos níveis de ghrelina sérica após um período tempo mais prolongado após procedimentos cirúrgicos, mesmo quando é realizada a gastrectomia,
podendo-se pensar que outros tecidos produtores de ghrelina possam compensar a ausência do estômago nestes casos (10).
Os efeitos dos macronutrientes da dieta sobre os níveis plasmáticos da ghrelina foram estudados em diversos experimentos. A distensão gástrica com solução salina não provocou alterações na ghrelina, enquanto que com a solução de glicose a 50% levou a redução dos níveis séricos da ghrelina (50, 74). Uma dieta hipolipídica (15% de lípides) não afetou os níveis séricos de ghrelina em 24 horas quando comparada com os controles em dieta isocalórica e normolipídica, porém verificou-se uma redução na liberação da ghrelina pós prandial naqueles com dieta hipolipídica (75).
Pacientes portadores da Síndrome de Prader Willi (SPW), condição conhecida de obesidade hipotalâmica, apresentam elevados níveis séricos de ghrelina quando comparados com indivíduos com IMC saudável, assim como a densidade das células imunorreativas à ghrelina está aumentada na mucosa oxíntica destes pacientes (77, 78, 79). Embora a etiologia genética da SPW não explique o papel patogênico da ghrelina, mecanismos indiretos como a hipoinsulinemia e a deficiência de GH nestes casos podem responder pela hiperghrelinemia e suas consequências. No entanto, estudo com administração de análogos de somatostatina, conhecido inibidor da grande maioria dos peptídeos gastrointestinais e outros hormônios, determinou redução do peso nos pacientes portadores desta síndrome (80).
Além da hiperinsulinemia, achado frequente nos pacientes obesos, estudos sugerem que exista um sinal derivado dos adipócitos que levaria à um ajuste adaptativo da secreção de ghrelina com redução dos níveis séricos nos obesos. Estudos no receptor mutante de leptina em ratos Kuzer, ratos com receptor db/db e ratos ob/ob sugerem que a leptina possa não ser esse sinal, pois os níveis de ghrelina nesses ratos obesos são baixos quando comparados com
controles magros, indicando que a ativação do receptor de leptina ao nível das células secretoras de ghrelina não seja o sinal crucial e que outras adipocinas possam ser um dos
responsáveis pelos níveis mais baixos de ghrelina na obesidade (10).
Embora já tenha sido descrito que os níveis séricos de ghrelina estão elevados em condições com baixo IMC como anorexia nervosa, câncer e caquexia cardíaca, a existência de uma síndrome de resistência à ação da ghrelina nessas situações ainda não foi estabelecida (10, 81, 82 ).
Estudos morfológicos pelo método de imuno-histoquímica em pacientes com diagnóstico de câncer folicular de tireóide, câncer de próstata, câncer pulmonar e carcinóides do trato digestório, mostraram presença de células imunorreativas à ghrelina nesses tumores, assim como em aéreas de hiperplasia de células argirófilas na gastrite atrófica do corpo gástrico (10, 83, 84 ). Foi sugerido desta forma, um papel modulador da ghrelina na proliferação celular.
Mucosa gástrica
ou corpo), a mais extensa e rica em células parietais responsáveis pela secreção de ácido, e a mucosa antral caracterizada pela presença de glândulas mucosas.
A mucosa cárdica possui glândulas mucosas, tipo antrais, frequentemente com presença de numerosas células parietais ou mesmo glândulas do tipo oxínticas.
A mucosa oxíntica possui muitos tipos celulares, entre elas a célula parietal, responsável pela produção de ácido que é secretada na luz do estômago, e de considerável importância nos mecanismos digestórios locais.
A mucosa antral é constituída quase que exclusivamente por glândulas mucosas que se abrem na luz através de fovéolas longas e revestidas por epitélio mucoso que também secretam mucinas neutras.
Do mesmo modo que a mucosa intestinal, a mucosa gástrica é rica em numerosas células endócrinas, principalmente no fundo gástrico. No final de década de 60, com o isolamento dos primeiros hormônios gastrointestinais e a produção de anticorpos para os mesmos, iniciou-se a utilização e aperfeiçoamento de métodos imuno-histoquímicos para a
identificação dos diferentes hormônios nos tipos específicos de células endócrinas. Pearse verificou, estudando essas células, que elas eram capazes de descarboxilar o
L-5-hidroxitriptofano e L-diidroxifenilalanina em suas aminas serotonina e dopamina respectivamente, e passou a agrupá-las em um grupo denominado Amine Precursors Uptake
and Descarboxilation (APUD) (85).
Entre os mamíferos, as células endócrinas do sistema digestivo estão distribuídas ao longo da mucosa gastrointestinal, no pâncreas e vias biliares. As células endócrinas mais bem conhecidas são as antrais, onde ocorrem três tipos de células endócrinas, são elas: células G, produtoras de gastrina, as células D produtoras de somatostatina e as células EC, que produzem serotonina. As células da mucosa cárdica têm sido pouco estudadas e dados recentes têm demonstrado que a maioria delas são constituídas por células enterocromafim (EC) produtora de serotonina. A mucosa oxíntica, apesar de sediar numerosas células endócrinas, não se conhece bem todos os tipos existentes, assim como o papel dessas células. A célula predominante é Enterochromaffin-like (ECL), que não mantém contato com a luz glandular, e é muito sensível a gastrina, respondendo num primeiro momento com aumento da atividade da enzima formadora de histamina, a histidina descarboxilase e, num segundo momento, com hiperplasia celular. As células ECL podem ser facilmente identificadas através das características estruturais de suas vesículas de secreção, que geralmente são grandes (86).
classificadas de acordo com seus grânulos de secreção. As células ECL foram as mais freqüentemente encontradas (30 a 40%), seguidas pelas células P ( 20 a 30 %), seguidas pelas células D (20 a 25%). As células A like constituem 13% do total das células endócrinas da mucosa oxíntica (86). Na impossibilidade de demonstrar com precisão essas células e suas características específicas, muitos autores têm utilizado metodologia e critérios que dão números aproximados desses elementos. Aplicando-se a imuno-histoquímica (cromograninaA) ou o método da prata (Grimelius) que detecta células argirófilas (Arg) obtém-se o número total de células endócrinas da mucosa, do qual se subtrai o número de células imunorreativas à serotonina e somatostatina, considerando a diferença como o número de células ECL (87).
Na mucosa antral ocorrem três tipos de células endócrinas, que podem ser caracterizadas à microscopia eletrônica ou pela imunocitoquímica. São as células G, produtoras de gastrina, que compõem cerca de 60% das células endócrinas antrais, as células D, produtoras de somatostatina, cuja distribuição é mais irregular e as células EC produtoras
de serotonina, menos numerosas. A gastrina é o principal peptídeo da mucosa gástrica que regula a secreção ácida em suas três fases: cefálica, gástrica e intestinal e estimula a
OBJETIVOS DO TRABALHO
1. Estudar as alterações histopatológicas da mucosa gástrica, em pacientes portadores de obesidade mórbida, enfatizando-se a presença e características da gastrite e a presença do Helicobacter pylori;
PACIENTES E MÉTODOS
Pacientes
Cinqüenta (50) pacientes portadores de obesidade grave ( 2 pacientes classe II e 48 pacientes classe III de obesidade) que foram selecionados para cirurgia bariátrica, em acompanhamento no Instituto Alfa de Gastroenterologia do Hospital das Clínicas da UFMG, e que foram submetidos à endoscopia digestiva alta (EDA), como exame pré operatório, segundo indicação do médico assistente.
Cinqüenta (50) pacientes não obesos (IMC<30) que foram submetidos à EDA no Instituto Alfa de Gastroenterologia por queixas dispépticas, com idade e sexo semelhantes ao grupo de pacientes obesos.
Foram excluídos do estudo os indivíduos com úlcera péptica em atividade e anemia perniciosa, condição sabidamente conhecida que acarreta hiperplasia de células endócrinas.
Os pacientes envolvidos neste estudo assinaram um termo de consentimento e livre esclarecido.
O projeto de pesquisa assim como o termo de consentimento foram aprovados pelo Comitê de ética em pesquisa da UFMG- parecer no. ETIC114/03
Endoscopia Digestiva Alta
Todos os exames endoscópicos foram realizados no Instituto Alfa de Gastroenterologia. Os aparelhos utilizados foram os endoscópios da marca Fujinon e Olympus, utilizando pinça padrão para biópsia endoscópica. Foi utilizado anestésico Midazolan 2,5 mg endovenoso para facilitar a introdução do endoscópio.
No grupo dos não obesos foram colhidos fragmentos da mucosa oxíntica (parede posterior e região proximal da pequena curvatura) e do antro proximal e distal.
Colorações para estudo histológico
Os fragmentos foram fixados em formol tamponado, lavados em álcool 70% e mantidos nesta solução por 18 a 24 horas até o início do processamento para inclusão em parafina. Para inclusão em parafina os fragmentos foram orientados manualmente para melhorar a obtenção dos cortes histológicos contendo toda a espessura da mucosa.
Os blocos de parafina contendo o material obtido das biópsias foram cortados com 4
m de espessura. Para a fixação dos cortes na lâmina foi utilizado fixador à base de albumina para as técnicas de HE, Giemsa e Grimelius e um ultra fixador com Poli-N-Lisina (1:10-SIGMA-ALDRICH CO. USA) em lâminas para a técnica de imuno-histoquímica.
Todas as lâminas foram rotuladas de acordo com os registros padronizados no Instituto Alfa e no LPDN.
Em todos os fragmentos foram procedidas colorações pelo HE para avaliação histopatológica e seleção de cortes que incluíssem toda a espessura da mucosa para estudo morfométrico.
Para o estudo da distribuição das células endócrinas presentes na mucosa oxíntica e antral, utilizou-se a técnica de Grimelius (87). Resumidamente, os cortes foram tratados com solução de nitrato de prata a 0,08% em tampão acetato 0,02M, pH 5,6 por 3 horas a 60º. Após este período os cortes foram submersos numa solução reveladora constituída de hidroquinona e sulfito de sódio anidro (5,0g) em 100ml de água destilada pos dois minutos, a 60º com controle microscópico.
Para estudo da distribuição das células imunorreativas à ghrelina utilizou-se o método da imunoperoxidase indireta e anticorpo policlonal específico (anticorpo anti ghrelina- PHOENIX, USA). O método consta de várias etapas:
1. Tratamento dos cortes histológicos em solução de tampão citrato pH 6,0 aquecido em Steamer (potência alta) por 15 minutos e resfriamento posterior em temperatura ambiente por 40 minutos
2. Tratamento dos cortes histológicos em peroxidase de hidrogênio 30º
4. Tratamento dos cortes histológicos com tampão fosfato 0,01M, pH 7,2 (PBS) 5. Tratamento dos cortes histológicos com anticorpo (Link)
6. Tratamento dos cortes histológicos com tampão PBS
7. Tratamento dos cortes histológicos com Steptavidina-biotina peroxidase 8. Tratamento dos cortes histológicos com tampão PBS
9. Três banhos consecutivos em tampão-fosfato 0,01M, pH 7,2 por cinco minutos cada e revelação em solução de diaminobenzidina (25mg%) em tampão fosfato 0,01M, pH 7,2 com 0,03% de H2O2 por quatro a cinco minutos, com controle ao microscópio;
10.Lavagem em tampão-fosfato 0,01M, pH 7,2 e contra coloração com hematoxilina diluída por 30 segundos, desidratação e montagem em bálsamo.
Avaliação histopatológica da mucosa gástrica
Todos os cortes foram corados pelo HE para o estudo histológico da mucosa. A
avaliação da presença e intensidade de infiltrado inflamatório na mucosa oxíntica e antral através da coloração pelo HE foi feita considerando-se os seguintes aspectos: (a) presença de polimorfonucleares e mononucleares na lâmina própria, graduando-se a intensidade em discreta, moderada e intensa; (b) distribuição do infiltrado na mucosa (superficial ou toda a mucosa); (c) presença de metaplasia intestinal; (d) presença de sinais histológicos de atrofia glandular. A presença da bactéria Helicobacter pylori foi avaliada através de colorações pelo Giemsa.
Contagem das células argirófilas e imunorreativas à Ghrelina
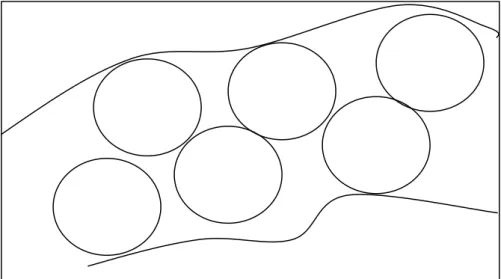
comprometida, impossibilitando a visualização adequada. A contagem foi realizada por dois observadores, duplo mascarado, seguindo um esquema único de contagem (figura 1).
FIGURA 1: Esquema de contagem das células argirófilas e das células
imunorreativas à ghrelina : Seis (6) campos seguidos de 0,04 mm2 em toda a espessura da mucosa; Aumento de 400x
Avaliação das alterações hiperplásicas
FIGURA 2: Esquema de células com distribuição normal e diferentes tipos de hiperplasias
endócrinas da mucosa gástrica. A- Normal; B- Hiperplasia difusa; C-Hiperplasia linear; D-hiperplasia nodular; E- Hiperplasia adenomatóide.
A B
C D
Análise estatística
RESULTADOS
Avaliação histológica da mucosa gástrica
O estudo histológico dos 50 pacientes portadores de obesidade, revelou:
1. Mucosa gástrica antral e oxíntica sem alterações histopatológicas relevantes (dentro da normalidade histológica) em 19 pacientes ( 38 %)
2. Gastrite antral ou predominantemente antral sem sinais de atrofia em 17 pacientes ( 34%)
3. Gastrite antral com sinais de atrofia em 3 pacientes( 6 %)
4. Pangastrite crônica ativa sem evidências de atrofia glandular em 10 pacientes (20 %)
5. Pangastrite crônica em atividade e com sinais de atrofia glandular em 1 paciente
( 2 %) (tabela 2)
TABELA 2-Distribuição da frequência dos achados histológicos da mucosa gástrica
de pacientes obesos e não obesos
Diagnóstico histológico Obesos* n-50 (%)
Não obesos** n-50 (%)
Normal 19 (38%) 9 (18%)
Gastrite antral sem atrofia
17 (34%) 22 ( 44%)
Gastrite antral com atrofia 3 (6%) 5 (10%)
Pangastrite crônica ativa sem atrofia
10 (20%) 10 (20%)
Pangastrite com atrofia 1 (2%) 4 (8%)
Total 50 (100%) 50 (100%)
FIGURA 3: Mucosa gástrica de paciente portador de obesidade, sem alterações histológicas
relevantes A-Corpo gástrico, B- Antro gástrico, HE, 50x
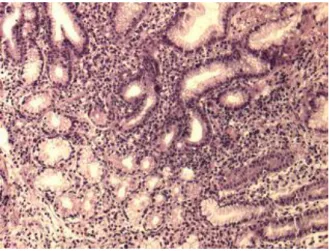
FIGURA 4: Mucosa gástrica de paciente portador de obesidade
com infiltrado inflamatório. Gastrite crônica, HE, 50x
FIGURA 5: Presença da bactéria Helicobacter pylori nas fovélas gástricas. Giemsa,100x
Avaliação da população de células argirófilas da mucosa gástrica
A média de células argirófilas (Arg) /mm2 reveladas pelo método de Grimelius, foi de
225,61 86,95 céls/mm2 na mucosa oxíntica do grupo de pacientes portadores de obesidade
mórbida, enquanto que no grupo nos pacientes com IMC<30 a média de células argirófilas
(Arg) na mucosa oxíntica foi de 239,94 67,67 céls/mm2 (tabela 3). A média de células
Arg/mm2 na mucosa antral no grupo de pacientes portadores de obesidade mórbida, reveladas
pelo método de Grimelius, foi de 212,24 83,05 céls/mm2 enquanto que a média de células
Arg na mucosa antral no grupo com IMC <30 foi de 206,92 70,67 céls/mm2 . A avaliação das densidades das células argirófilas nestas áreas não mostrou diferença significativa (tabela 4).
Em relação aos achados histopatológicos a densidade de Arg/mm2 na mucosa oxíntica
foi 231,05 106,62 céls/mm2 nos pacientes obesos com gastrite antral, 222,53 69,48
céls/mm2 nos pacientes com pangastrite, 225,70 95,60 céls/mm2 nos pacientes sem
alterações histológicas. Nos pacientes não obesos, a densidade de Arg/mm2 na mucosa
oxíntica foi 221,83 86,50 céls/mm2 nos pacientes com gastrite antral, 240.62 50,27
céls/mm2 nos pacientes com pangastrite, 264,77 83,29 céls/mm2 nos pacientes sem
alterações histológicas (tabelas 5 e 6).
Em relação aos achados histopatológicos a densidade de Arg/mm2 na mucosa antral
foi 206,16 73,49 céls/mm2 nos pacientes obesos com gastrite antral, 205,16 81,01
céls/mm2 nos pacientes com pangastrite, 219,78 93,39 céls/mm2 nos pacientes sem
alterações histológicas. Nos pacientes com IMC <30, a densidade de células argirófilas/mm2
na mucosa antral foi 184,08 71,99 céls/mm2 nos pacientes com gastrite antral, 206,64
64,64 céls/mm2 nos pacientes com pangastrite, 243,30 78,66 céls/mm2 nos pacientes sem
alterações histológicas (tabelas 7 e 8 ).
Os resultados das densidades das células argirófilas de acordo com a distribuição por sexo (feminino ou masculino) nas mucosas oxíntica e antral dos cem pacientes e
separadamente nos grupos obesos e não obesos estão expressos nas tabelas 9, 10, 11 e 12. Houve diferença estatisticamente significativa na densidade de células argirófilas na mucosa oxíntica de mulheres obesas e homens obesos, com número maior de células Arg /mm2 no sexo feminino.
TABELA 3- Densidade (cels/mm2) de células argirófilas na mucosa oxíntica dos pacientes obesos e não obesos.
N Densidade média ( céls /mm2 )
Obesos 50 225,61 86,95 Não obesos 49 239,94 67,67
Total 99
t=0.91 p=0.364
TABELA 4- Densidade (cels/mm2 ) de células argirófilas na mucosa antral de pacientes obesos e não obesos.
N Densidade- média ( céls /mm2 )
Obesos 48 212,24 83,05
Não obesos 50 206,92 70,67
Total 98
t=0,34 p=0,733
TABELA 5: Densidade (cels/mm2 ) das células argirófilas na mucosa oxíntica e relação com achados histológicos nos pacientes obesos
Diagnóstico histológico Densidade média ( céls /mm2 )
Normal n=19 225,70 95,60
Gastrite antral n=11 231,05 106,62
Pangastrite n=20 222,53 69,48
Total n=50