UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE TECNOLOGIA
PROGRAMA DE PÓS-GRADUAÇÃO EM ENGENHARIA MECÂNICA
DISSERTAÇÃO DE MESTRADO
Redução carbotérmica do TiO2 por descarga em cátodo oco
RAQUEL GUILHERME DE CARVALHO
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE TECNOLOGIA
PROGRAMA DE PÓS-GRADUAÇÃO EM ENGENHARIA MECÂNICA
Redução carbotérmica do TiO2 por descarga em cátodo oco
RAQUEL GUILHERME DE CARVALHO
Dissertação apresentada ao Programa de Pós-Graduação em Engenharia Mecânica da Universidade Federal do Rio Grande do Norte, como parte dos requisitos para obtenção do título de Mestre em Engenharia Mecânica.
Orientador: Prof. Dr. Clodomiro Alves Júnior
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE TECNOLOGIA
PROGRAMA DE PÓS-GRADUAÇÃO EM ENGENHARIA MECÂNICA
Redução carbotérmica do TiO2 por descarga em cátodo oco
Raquel Guilherme de Carvalho
Esta dissertação foi julgada adequada para a obtenção do título de
MESTRE EM ENGENHARIA MECÃNICA sendo aprovada em sua forma final.
___________________________
Clodomiro Alves Júnior
BANCA EXAMINADORA
_________________________________ Clodomiro Alves Júnior - Presidente
__________________________________
Franciné Alves da Costa - UFRN
__________________________________
Se precisar tentar... tente, mas se pensar em desistir... prossiga. Descubra-se, abra os olhos para o que ainda não pode ver. Surpreenda-se com seus próprios
resultados!
DEDICATÓRIA
Dedico este trabalho a minha mãe Jandira Guilherme e meus irmãos Catarina e
AGRADECIMENTOS
A Deus, pela presença constante em todos os momentos.
Ao Prof. Dr. Clodomiro Alves Jr., pela orientação, oportunidade de realização deste trabalho e toda paciência pela espera dos resultados.
Ao Prof. Dr. Jorge Magner Lourenço, pelo fornecimento da pedra sabão para preparação das peças do reator e o pó de grafite utilizado neste trabalho.
Ao programa de Pós-Graduação em Engenharia Mecânica e a UFRN.
Aos professores Dr. Uílami Umbelino e Dr. Franciné Alves da Costa pelas sugestões na correção desse trabalho.
Ao Laboratório de Materiais Cerâmicos e Metais Especiais pela realização do ensaio de granulometria a laser e a utilização do moinho Planetário. A aluna de mestrado Samara Melo pela execução da analise de granulometria a laser.
Ao professor Lúcio Fontes e aos técnicos da oficina mecânica da UFRN, Frazão, Fernando e Xavier na confecção das peças de pedra sabão para o reator.
A empresa Millenium Inorganic Chemicals Mineração Ltda. por fornecer o minério rutilo utilizado neste trabalho.
A todos os colegas do laboratório de processamento de materiais por plasma.
A Natália Dautd, pelo incentivo, as discussões dos resultados e, principalmente, pelo companheirismo nos feriados e finais de semana no laboratório.
RESUMO
Neste trabalho foi utilizado o plasma como fonte energética no processo de
redução carbotérmica do minério rutilo (TiO2). Os pós de rutilo e grafite foram
moídos durante 15 h e introduzidos numa descarga produzida por cátodo oco a fim
de obter carbonitreto de titânio diretamente da reação, sendo verificado a influência
dos parâmetros de processamento de plasma, temperatura e tempo na síntese de
TiCN. As reação foram efetuadas a 600, 700 e 800˚C por 3 e 4 horas numa
atmosfera de nitrogênio e argônio. Durante todas as reações o plasma foi
monitorado pela técnica de espectroscopia de emissão óptica (EEO) para verificar
as espécies ativas presente no processo de redução carbotérmica de TiO2. Os pós
obtidos após as reações foram caracterizados pelas técnicas de difração de raios X
(DRX) e microscopia eletrônica de varredura (MEV). Pela técnica de EEO foram
detectados em todas as reações os espectros CO e NO, sendo essas fases gasosas
resultante da redução do TiO2. Os resultados de difração de raios X confirmou essa
redução, onde para todas as condições estudadas houve evidência de início da
redução do TiO2 através do aparecimento de óxidos intermediários. Nas amostras
reduzidas a 600 e 700˚C observou-se apenas a fase Ti6O11, naquelas reduzidas a
800 ˚C apareceram as fases Ti5O9, Ti6O11 e Ti7O13, comprovando que com a redução
carbotérmica em plasma, houve redução do minério rutilo (TiO2) em uma série de
óxido intermediários de titânio (TinO2n-1) onde n varia entre 5 e 10.
ABSTRACT
In this study we used the plasma as a source of energy in the process of
carbothermic reduction of rutile ore (TiO2). The rutile and graphite powders were
milled for 15 h and placed in a hollow cathode discharge produced by in order to
obtain titanium carbonitride directly from the reaction, was verified the influence of
processing parameters of plasma temperature and time in the synthesis of TiCN. The
reaction was carried out at 600, 700 and 800˚C for 3 to 4 hours in an atmosphere of
nitrogen and argon. During all reactions was monitored by plasma technique of
optical emission spectroscopy (EEO) to check the active species present in the
process of carbothermal reduction of TiO2. The powder obtained after the reactions
were characterized by the techniques of X-ray diffraction (XRD) and scanning
electron microscopy (SEM). The technique of EEO were detected in all reactions the
spectra CO and NO, and these gas-phase resulting from the reduction of TiO2. The
results of X-ray diffraction confirmed the reduction, where for all conditions studied
there was evidence of early reduction of TiO2 through the emergence of intermediate
oxides. In the samples reduced at 600 and 700˚C, there was only the phase Ti6O11,
those reduced to 800˚C appeared Ti5O9 phases, and Ti6O11 Ti7O13, confirming that
the carbothermal reduction in plasma, a reduction of the ore rutile (TiO2) in a series of
intermediate titanium oxide (TinO2n-1) where n varies between 5 and 10.
SUMÁRIO
1. INTRODUÇÃO………...………...…....17
2. REVISÃO DA LITERATURA...………...………….....21
2.1. Minério rutilo...21
2.1.1 Aplicações do minério rutilo...23
2.2. Processo de redução carbotérmica...26
2.2.1. Mecanismo de redução carbotérmica do TiO2...28
2.3. Plasma...32
2.3.1. Aplicações do plasma...35
2.3.2. Efeito do catodo oco...36
3. MATERIAIS E MÉTODOS...40
3.1. Procedimento experimental...40
3.2. Parâmetros das reações carbotérmica em descarga em cátodo oco...41
3.3. Caracterização dos materiais precursores...41
3.3.1. Preparação dos pós TiO2 e C...42
3.3.2. Distribuição de tamanhos de partículas...43
3.3.3. Identificação das fases presentes nos pós de TiO2 e C...44
3.3.4. Morfologia dos pós TiO2 e C moídos e após a redução carbotérmica...45
3.3.5. Diagnótico do plasma durante o processo de redução carbotérmico...45
3.4. Reator de sinterização...46
4. RESULTADOS E DISCUSSÕES...49
4.1. Caracterização das Matérias-Primas...49
4.1.1. Difração de Raios X...49
4.1.3. Distribuição de tamanho de partículas...54
4.2. Redução Carbotérmica das misturas de TiO2 e C em atmosfera de Plasma de nitrogênio...56
4.3. Espectrômetro de Emissão Óptica...63
4.4. Morfologia das fases obtidas nas reações Carbotérmica em atmosfera de Plasma de nitrogênio...66
5. CONCLUSÕES...71
SUGESTÕES PARA FUTUROS TRABALHOS...72
LISTA DE ABREVIATURAS E SÍMBOLOS
Labplasma Laboratório de processamento de materiais a plasma UFRN Universidade Federal do Rio Grande do Norte
DRX Difração de raios X
MEV Microscopia Eletrônica de Varredura EEO Espectroscopia de Emissão ótica ºC Graus Celsius
Ar Argônio
LISTA DE FIGURAS
Figura 1 – Minério Rutilo (TiO2) 21
Figura 2 – Estrutura cristalográfica do TiO2(rutilo) 22
Figura 3 – Esquema da estrutura do rutilo 23
Figura 4 – Processo de cloretação do minério de titânio 24
Figura 5 – Gráfico TG da redução carbotérmica de TiO2 28
(adaptada de BERGER, 2000) Figura 6 – Esquemático do mecanismo da reação de redução carbotérmica do TiO2 29
Figura 7 – Diagrama de fases Ti-O 32
Figura 8 – Estados da Matéria: Sólido, líquido, gasoso e o plasma 33
Figura 9 – Ilustração do efeito do catodo oco .. 36
(adaptada de MENDES 2005) Figura 10 – Fluxograma com as etapas realizadas no procedimento Experimental 40
Figura 11 - Modelo esquemático do equipamento de EEO em uso no reator a plasma...45
Figura 12 – Esquema do reator de plasma utilizado na redução carbotérmica 46
Figura 13 – Difratograma de raios X do pó de rutilo 49
Figura 14 – Difratograma de raios X do pó de grafite 50
Figura 15 – Difratograma de raios X da mistura do pó de TiO2/C . 51
Figura 16 – Micrografia das partículas do TiO2 52
Figura 17 – Micrografia das partículas de carbono 53
Figura 18 – Micrografia da mistura dos pós de TiO2 e grafite 54
Figura 19 – Histograma da distribuição do tamanho de partículas do pó de TiO2 55
Figura 21 – Difratograma de raios X (a) TiO2 puro, (b) TiO2/C e (c) TiO2/C após reação em temperatura de 600˚C com tempo isotérmico de 3 horas
e 4 horas 57
Figura 22 – Difratograma de raios X (a) TiO2 puro, (b) TiO2/C e (c) TiO2/C após reação em temperatura de 700˚C com tempo isotérmico de 3 horas
e 4 horas 58
Figura 23 – Difratograma de raios X (a) TiO2 puro, (b) TiO2/C e (c) TiO2/C
após reação em temperatura de 800˚C com tempo isotérmico de 3 horas
e 4 horas 59
Figura 24 – Difratograma com o perfil de raios X da amostra antes da reação e as amostras reagidas a temperaturas de 600, 700 e 800˚C por 4 horas 62
Figura 25 – Gráfico da constante do parâmetro de rede x temperatura
de reação 63
Figura 26 – Espectro obtido durante as reações carbotérmica no reator
de plasma 64
Figura 27 – Valores de intensidade relativa às principais espécies
observadas no processo de redução carbotérmica 65
Figura 28 – Micrografias das amostras aquecidas: (a) mistura de TiO2
LISTA DE TABELA
Tabela 1– Diferença entre o valor comercial do minério rutilo (TiO2) e dióxido de
titânio (pigmento de TiO2) (adaptada de ANDRADE 2009) 25
Tabela 2 – As condições de tempo e temperatura usados durante as reações
carbotérmica dos pós de TiO2 41
Tabela 3 – Concentração e impurezas do TiO2 42
CAPÍTULO 1
Introdução 17
Raquel Guilherme de Carvalho
Nos últimos anos, a busca pelo desenvolvimento de materiais e
componentes da engenharia com melhor desempenho em condições de
serviço tem sido objeto de muitos estudos. Nesse contexto, as ferramentas de
corte à base de carbetos, nitretos, carbonitretos, os oxicarbonitretos titânio,
têm despertado grande interesse e, consequentemente, a atenção dos
pesquisadores para sua produção, por apresentarem alta dureza associada à
alta tenacidade à fratura, para aplicações onde é necessária resistência
mecânica em alta temperatura (COUTINHO, 2005;GRILLO, 2008).
As ferramentas de corte à base de carbonitreto de titânio (TiNC) são
conhecidas por terem maior dureza a quente, maior tensão de ruptura
transversal (TRS), melhor resistência à oxidação e condutividade térmica
(DAOPING et al., 2008). Essas caracteristicas são resultados da combinação
de TiC e TiN, que fornece ao TiCN melhores propriedades em alta
temperatura, apresentando maior resistência e menor coeficiente de atrito do
que TiC e TiN (LIN et al., 2007; DAOPING et al., 2007).
TiCN é geralmente sintetizado por tratamento térmico de pó de TiC em
atmosfera N2 ou por reação direta entre TiC e TiN. O processo de redução
carbotérmica de dióxido de titânio em atmosferas inertes ou contendo
nitrogênio é conhecido como o método mais econômico para a produção de
pós de carbeto, nitreto e carbonitreto de titânio (BERGER et al., 2002; KWON
et al., 2009). A vantagem da redução carbotérmica quando comparada aos
processos de obtenção desses materiais, é que ela utiliza materia-prima de
baixo custo, sendo capaz de produzir TiCN com teores de N e C variáveis
(BERGER et al., 1999, ANIMESH et al., 1999; SETOUDEH et al., 2006; XIANG
Introdução 18
Raquel Guilherme de Carvalho
Existem diversas pesquisas envolvendo esse processo em fornos
resistivos em atmosfera de nitrogênio usando a mistura dos pós de TiO2 e
carbono sólido. (XIANG et al., 2006; SETOUDEH et al., 2006; HE et al., 2010).
A aplicação da tecnologia de plasma para a síntese de compostos de titânio
tem sido quase sempre envolvendo a nitretação de superfície de titânio em
atmosfera de nitrogênio e metano.
A pesquisa que foi desenvolvida no laboratório de processamento de
materiais por plasma, trata – se de um processo de redução carbotérmica em
um reator de plasma contendo a mistura de gases N2/Ar, utilizando como
materia prima o minério rutilo (TiO2) e o pó de grafite. Nesse trabalho
discute-se a influência dos discute-seguintes parâmetros: temperatura e o tempo de reação no
processamento a plasma na síntese de TiCN a partir da redução carbotérmica
do minério rutilo (TiO2), a fim de encontrar adequadas condições tecnológicas
para aplicação do plasma neste processo. Portanto esse trabalho fornecerá
importantes informações para trabalhos futuros.
Para melhor entendimento desse trabalho, o mesmo foi dividido em
capítulos. No capítulo 2 encontra-se a revisão da literatura do trabalho, onde
são apresentadas as características do minério rutilo, processo de redução
carbotérmica e do plasma.
No capítulo 3 será apresentada as características do aparato
experimental e a metodologia de ensaio utilizado no presente trabalho.
Inicialmente será apresentados os parâmetros utilizados nas reações, em
Introdução 19
Raquel Guilherme de Carvalho
técnicas utilizadas para caracterizar os materiais precursores e o produto das
reações.
No capitulo 4 são apresentados e discutidos os resultados referentes ao
processo de redução carbotérmico dos pós de TiO2 e C em um reator de
plasma em atmosfera de N2/Ar, no primeiro momento serão abordados os
dados obtidos na caracterização dos pós precursores e, em seguida, os
resultados obtidos nas reações. As conclusões sobre a pesquisa e as
CAPÍTULO 2
Revisão da Literatura 21
2. REVISÃO DA LITERATURA
2.1. Minério rutilo
O rutilo é um mineral com elevado teor em TiO2 podendo conter até 10%
de impurezas tais como SiO2, Cr2O3, V2O5, Al2O3 e FeO. O termo rutilo vem do
latim rutilus que significa “avermelhado”. O rutilo (TiO2) apresenta-se nas cores
vermelha ou castanho avermelhado a preta. (MAIO, 2001; BALTAR et al.,
2005). A Figura 1 mostra a foto do minério rutilo que foi utilizado neste trabalho.
Figura 1 – Minério rutilo (TiO2)
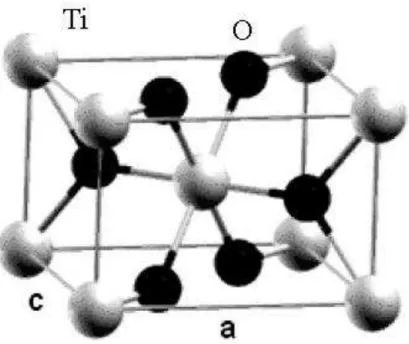
O rutilo tem massa específica de 4,18 a 4,25 g/cm3 e cristaliza-se no
sistema tetragonal. A estrutura tetragonal do rutilo está apresentada na Figura
Revisão da Literatura 22
Raquel Guilherme de Carvalho
átomo de titânio coordenado a dois átomos de oxigênio a 2,01 Å e outros
quatro a 1,92 Å, dando origem a um octaedro distorcido. Na estrutura do rutilo,
o Ti4+ está localizado no centro dos octaedros de oxigênio, os quais são unidos
pelas arestas, formando cadeias de octaedros paralelas ao eixo c. As cadeias
são ligadas entre si pelos vértices dos octaedros, com os seguintes parâmetros
de cela unitária a = 4,59 Å, c = 2,96 Å ( LEE, J. D., 1996).
Revisão da Literatura 23
Raquel Guilherme de Carvalho
Figura 3 – Esquema da estrutura do rutilo
A Austrália, Ucrânia e África do Sul possuem os principais depósitos
mundiais do minério rutilo (TiO2). No Brasil, os principais depósitos estão
localizados ao longo da costa, nos Estados do Rio de Janeiro, Paraíba e Bahia.
O depósito de Mataraca, na Paraíba, é o mais importante, visto que representa
52% das reservas de rutilo do País (DNPM, AMB 2008).
2.1.1. Aplicações do minério rutilo
O minério rutilo é utilizado como matéria prima para a obtenção dióxido
de titânio (pigmento de TiO2) e o titânio metálico. De acordo com dados obtidos
por Baltar et al. (2005), cerca de 90% da produção de concentrados de minério
de titânio, tais como ilmenita (FeTiO3) e rutilo (TiO2) são utilizados na produção
dióxido de titânio (pigmento de TiO2) produto esse é um pigmento branco
Revisão da Literatura 24
Raquel Guilherme de Carvalho
cosméticos, e o restante é empregado na obtenção de titânio metálico, suas
ligas, e na produção de cerâmicas avançadas.
O processo de cloretação é um método mais utilizado para o
beneficiamento do dióxido de titânio (pigmento de TiO2). O fluxograma da
Figura 5 mostra as etapas do processo de cloretação do minério rutilo, neste
processo, o rutilo é clorado na presença de carbono a uma temperatura de
1000°C produzindo o tetracloreto de titânio (TiCl4) volátil, que é oxidado, com ar
ou oxigênio, para formar dióxido de titânio (pigmento de TiO2), outra parte do
TiCl4 é destinada à produção do titânio metálico adicionando magnésio
(BALTAR, 2005).
Revisão da Literatura 25
Raquel Guilherme de Carvalho
Recentemente, o minério rutilo vem sendo utilizado como precursor para
sintetizar nanofibras de titanatos através de tratamento hidrotérmico. Suziki et
al. (2007) sintetizou nanofibras de titanatos pelo tratamento hidrotérmico,
utilizando o minério rutilo (conhecido também como areia de rutilo) com 96% de
TiO2. No Brasil, um grupo de pesquisa da PUC descobriu que o minério rutilo
submetida ao tratamento hidrotérmico gera um produto nanoestruturado com
morfologia tubular. A opção de utilizar o minério rutilo como precursor é devido
o seu baixo custo. A tabela 1 mostra a diferença no valor comercial do minério
rutilo e o dióxido de titânio (pigmento de TiO2) (ANDRADE, 2009).
Tabela 1– Diferença entre o valor comercial do minério rutilo (TiO2) e dióxido de titânio ( pigmento de TiO2) (adaptada de ANDRADE, 2009)
Precursor
Preço por tonelada
Minério rutilo (95 -96% de TiO
2)
U$$ 420,00
Dióxido de titânio (pigmento de
TiO
2–
99% de TiO
2)
U$$ 2000,00
Na literatura, encontram-se estudos sobre o processo de redução
carbotérmica de dióxido de titânio em atmosferas inertes ou contendo
nitrogênio para a produção de pós de carbetos e carbonitreto de titânio para
aplicação em materiais compósitos, como cermets ou cerâmica preta. Os
trabalhos publicados foram realizados utilizando tanto o minério rutilo, como o
dióxido de titânio (pigmento de TiO2), sendo obtidos resultados satisfatórios na
obtenção de TiC, TiN e TiCN. É interessante salientar que esses estudos trata
a reação em fornos convencionais (LICKO, 1989; BERGER, 1994; DAOPING,
Revisão da Literatura 26
Raquel Guilherme de Carvalho
2.2. Processo de redução carbotérmica
No processo de redução carbotérmica para produção de carbetos,
nitreto e carbonitretos, o dióxido de titânio é utilizado como matéria-prima ao
invés do titânio metálico para produção de composto de titânio. Isto representa
um método econômico, pois utiliza matéria-prima de baixo custo em
comparação ao titânio puro.
Os carbonetos e oxicarbetos em pó podem ser economicamente
produzidos pelo processo redução carbotérmica a partir de misturas
homogêneas de pós de óxido e carbono. Para a preparação de WC, SiC, TiC e
TiCxOy, a reação ocorre em uma atmosfera inerte. Nitretos, carbonitretos, e
oxicarbonitretos, como Si3N4, AlN, TiCxNz e TiCxOyNz são produzidos em
atmosferas contendo nitrogênio.
A reação geral do processo de redução carbotérmica de um tipo de
óxido pode ser descrita de acordo com a equação (1).
Oxido (s) + Carbono (s) → Carbeto (s) + CO (g) (1)
Portanto, o processo de redução carbotérmica, a partir de dois materiais
sólidos (óxido e carbono), são formados dois produtos da reação: um sólido
(carbeto) e um gasoso (CO). A reação global desse processo para a formação
de TiC a partir de TiO2 está de acordo com a seguinte equação:
TiO2 + 3C → TiC + 2CO (2)
A redução carbotérmica de dióxido de titânio para produzir TiN conforme
a reação abaixo:
Revisão da Literatura 27
Raquel Guilherme de Carvalho
Para a preparação das fases cúbica de TiCxNy, a reação é realizada em
uma atmosfera contendo nitrogênio para incorporação do produto durante a
reação. Esse processo pode ser descrito pela equação geral mostrada abaixo:
TiO2(sólido)→ Carbono(sólido) [+Nitrogênio(gás)] → Ti (C, N)(sólido) + CO(gás)
Em ambos os casos, um produto sólido da reação é formado a partir de
duas matérias-primas sólidas (óxido e carbono).
Como em qualquer reação química, a formação de TiC, TiN e TiCN no
processo de redução carbotérmico de TiO2 é influência pelas caracteristicas
das materiais prima, preparação dos pós e as condições de reação.
Licko et al. (1989), investigou o efeito da temperatura de reação no
processo de redução carbotérmico de TiO2 misturado com carbono em um
fluxo de nitrogênio, em seus experimentos, observou que a redução começou a
cerca de 1000˚ C, e que essa redução resultou na formação de vários óxidos
no estado menos oxidado.
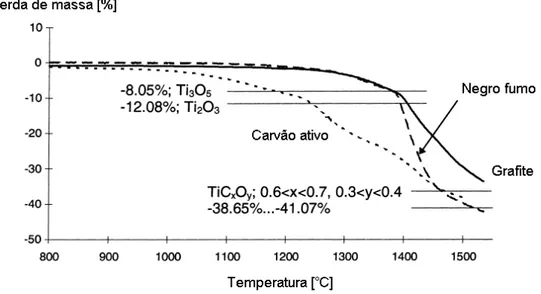
Berger et al (1999) realizou uma pesquisa sobre a reatividade dos
diferentes tipo de carbono em um forno convecional e constatou que o tipo de
carbono influência a taxa de reação significativamente, como pode ser
observado na Figura 5 a reatividade de ambos os tipos de carbono começa
acima da temperatura de 1000˚C, sendo o carvão ativo o mais reativo, e que a
redução proporciona o surgimento de óxidos no estado menos oxidado, como
Revisão da Literatura 28
Raquel Guilherme de Carvalho
Figura 5 – Gráfico TG da redução carbotérmica de TiO2 (adaptada de Berger, 1999)
Esses experimentos citados foram realizados em fornos resistivo a
vácuo. He et al (2010), investigou o efeito da temperatura e tempo quando as
reações são realizados em um sistema sem vácuo. As fases obtidas com a
mudança de temperatura e tempo são as mesmas observadas em outros
experimentos em forno a vácuo.
2.2.1. Mecanismo de redução carbotermica do TiO2
De acordo com Berger (1999), a redução carbotérmica consiste em três
etapas, como mostrado na Figura 6. Nesse modelo de reação, os óxidos são
reduzidos e a transferência de massa é realizada pelo CO com a formação de
CO2. A continuação da reação requer uma regeneração imediata de CO2 para
Revisão da Literatura 29
Raquel Guilherme de Carvalho
Figura 6 – Esquemático do mecanismo da reação de redução carbotérmica do TiO2 (adaptada de BERGER et al., 1999)
O mecanismo de redução carbotérmica consiste no surgimento da fase
gasosa de CO, que atua como agente redutor no início da reação, formado
pela reação entre as partículas de óxido e o carbono, resultando na formação
de óxidos menos oxidados (TinO2n-1 fases Magnéli). Ao final dessa etapa de
reação, Ti3O5 ou Ti2O3 são formados. Berger et al (2002), em seus
experimentos, confirmou que o Ti2O3 não aparece quando existe a presença de
nitrogênio, permitindo concluir que o Ti2O3 é instável em atmosferas contendo
nitrogênio. Na segunda etapa a fase cúbica TiCxOy é formada a partir Ti3O5 ou
Ti2O3. O CO como um agente redutor, simultaneamente, entra na superfície,
que é rica em defeitos de rede, e acomoda a incorporação de carbono na rede
cristalina.
Durante a reação, o CO2 é gerado e imediatamente convertido de CO no
carbono sólido. Em todo processo, o CO é regenerado pelo conversão imediata
de CO2 sobre o carbono sólido. As taxas de reação de perda de oxigênio, e a
incorporação de carbono não são iguais e, consequentemente, as fases
Revisão da Literatura 30
Raquel Guilherme de Carvalho
A última etapa da reação é descrita como sendo a substituição de
oxigênio por carbono com a formação de TiCxOy. A transferência de massa é
realizada pelo o mesmo mecanismo de reação como na segunda etapa de
reação. Esse esquema também serve para relatar o mecanismo para formação
de nitreto e carbonitreto, que nesse caso, os átomos de N e C vão substituir os
átomos de oxigênio para formar a fase TiCN (BERGER et al., 1999).
Em outras publicações observou-se a sequência de reação do processo
de redução carbotérmica com simultânea nitretação sendo quase idêntico,
diferindo apenas os tipos de carbono, a temperatura e o tempo utilizados em
cada experimento. Berger et al (2002) realizou nos seus experimentos à
redução carbotérmica do pó de TiO2 misturado com três tipos de carbono,
carbono ativado, negro fumo e grafite, levando à formação de oxicarbonitretos
e carbonitretos com temperatura variável entre 1300 - 1800˚C. Ele concluiu que
apesar das diferentes estruturas de negro fumo e de grafite, a composição e o
tamanho das partículas de oxicarbonitreto obtidos em condições de reação
idênticas são praticamente independentes do tipo de carbono usado.
Daoping et al (2007) relata que a redução de TiO2 é semelhante com a
reação de preparação de TiCN pelo processo de redução carbotérmica sob
atmosfera de nitrogênio. Durante a primeira etapa de redução, é observada a
formação de óxidos menos oxidados, TiO2 → TinO2n-1 (4 <n <10) → Ti4O7
→Ti3O5. Na segunda etapa da reação, ocorre a formação de Ti (C, N, O), a
partir de Ti3O5. Porque existe um número maior de sítios intersticiais desocupados em sua rede, é que consequentemente a fase Ti3O5 acomoda
Revisão da Literatura 31
Raquel Guilherme de Carvalho
(C, N) é o resultado da contínua substituição dos átomos de Oxigênio por
átomos de C e N (DAOPING et al., 2006).
É importante ressaltar que no caso da formação de Nitreto, o carbono
será totalmente consumido durante a reação, com a formação de CO e CO2.
Assim, somente o nitrogênio será acomodado na rede cristalina.
Como foi relatado, durante a redução carbotérmica a partir da redução
do rutilo-estrutura do TiO2 são formados grande quantidade de tipos de óxidos,
fases essas com menor teor de oxigênio, TinO2n-1, com n = 4-10 que
corresponde a uma série de óxidos intermediários. Portanto a incorporação de
altas concentrações de defeitos devido a tratamentos redutores força o material
a alterar sua estrutura criando várias outras estequiometrias.
O óxido de titânio, TiO2, é conhecido por ser um óxido
não-estequiométrico com alta deficiência de oxigênio. A fórmula correta para este
material é TiO2-x, onde x é determinado pela concentração de defeitos na
rede. Na literatura encontramos que este material suporta uma grande
concentração de defeitos, dentre os quais podemos citar vacâncias de
oxigênio, VO, titânio intersticial, Tii e vacâncias de titânio, VTi. (BRANDÃO,
Revisão da Literatura 32
Raquel Guilherme de Carvalho
Figura 7 – Diagrama de fases Ti-O (adaptada de PAYYAPILLY, 2008)
Na figura 7 está representado o diagrama de fase do sistema Ti-O.
Podemos observar a variedade de compostos produzidos quando há variação
da razão O/Ti. Logo após a região do composto TiO2, rutilo, há uma região com
um baixo teor de oxigênio, sendo denominada de fases de Magnéli. Essas
fases são caracterizada pelo deslocação dos átomos na rede cristalina, e a
formação de compostos não estequiométricos defeituosos.
2.4. Plasma
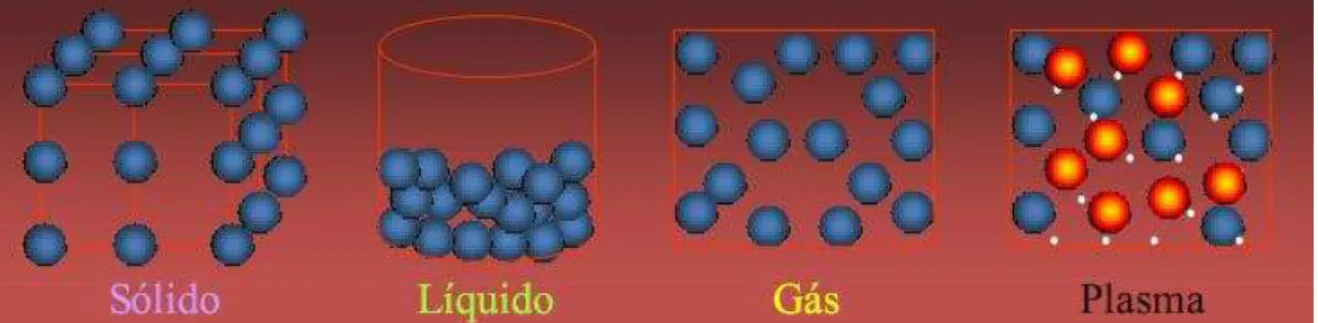
Diferentemente dos demais estados da matéria, sólido, líquido e gasoso,
Revisão da Literatura 33
Raquel Guilherme de Carvalho
de elétrons livres, íons e átomos neutros, em proporções variadas e que
apresenta um comportamento coletivo.
Figura 8 – Estados da Matéria: sólido, líquido, gasoso e o plasma
Como observado na Figura 8, o plasma é o estado da matéria mais
reativo do que os estados sólido, líquido e gasoso. Quando uma substância
sólida em equilíbrio térmico, geralmente passa para o estado líquido quando a
temperatura aumenta em uma pressão fixa. O líquido passa para o estado de
gás quando a temperatura continua a se elevar. O gás quando submetido a
temperaturas elevadas, os átomos decompõem-se em partículas carregadas
de movimentos livres (elétrons e íons positivos) e a substância entra no estado
de plasma (ALVES Jr., 2001; LIEBERMAN1994, apud FREITAS,2009).
O plasma é produzido quando se estabelece uma diferença de potencial
entre dois eletrodos (catodo e anodo) contidos em um recipiente
hermeticamente fechados, em um meio gasoso, submetido a uma pressão
suficientemente baixa. Quando essa diferença de potencial é estabelecida,
uma corrente elétrica surge entre os dois eletrodos. Esses elétrons, por sua
vez, passam a colidir com as moléculas gasosas, dando origem às diversas
espécies existentes no plasma, por exemplo, elétrons livres, íons positivos,
Revisão da Literatura 34
Raquel Guilherme de Carvalho
Independente do tipo e tamanho do dispositivo empregado, a geração do
plasma requer três ou quatro elementos fundamentais, são:
Fonte de Energia para ionização – A energia fornecida depende do tipo e
finalidade do tratamento e tipo de substrato, podendo ser uma fonte de energia
contínua, rádio frequência, descontínua, microondas dentre outras. Em todos
os tipos, emprega-se uma diferença de potencial entre dois eletrodos situados
na câmara de reação.
Um bomba para geração de vácuo – Composto por uma bomba rotativa e uma
bomba de óleo para assegurar a eliminação do gás.
Uma câmara de reação – Local onde será introduzido o substrato e que pode
ter diferentes formas construtivas, dependendo do tipo de substrato.
Sistema de gases para o fornecimento de gás – Os gases empregados
costumam ser inorgânicos: Hidrogênio, Oxigênio, Argônio, Hélio, Cloro; ou
orgânicos metano, etileno etc.
No aquecimento direto por plasma, depois que o gás é introduzido à
baixa pressão (1 – 10 torr), o calor é produzido pela descarga luminescente
que envolve as partículas, decorrente da colisão das partículas carregadas com
a superfície. Nesse método, a taxa de aquecimento da superfície pode ser
controlada pela potência fornecida ao sistema. Esse método possui como
inconvenientes a formação de gases aprisionados nos interiores dos poros das
partículas reagidas e a existência de moléculas adsorvidas em sua superfície,
durante a etapa de aquecimento (Silva, 2003).
Quando esses gases são liberados na descarga, são ionizados e na
pequena área deixada por eles cria-se uma alta densidade de corrente,
Revisão da Literatura 35
Raquel Guilherme de Carvalho
abrir um intenso arco elétrico e extinguir o processo. Portanto, esse problema
limita os altos valores da taxa de aquecimento que poderiam ser obtidos com o
método.
2.4.1. Aplicação do Plasma
Durante as últimas décadas muitos trabalhos têm sido feitos para
desenvolver novos processos baseados em tecnologia de plasma. O processo
de redução de óxidos metálicos por hidrogênio à plasma esta presente em
trabalhos acadêmicos. A vantagem de utilizar o hidrogênio como reagente é
sua alta capacidade reativa no estado ionizado, gerando uma grande
quantidade de calor e transferência de massa. O ciclo de redução por plasma
envolve o aquecimento do pó até a temperatura de tratamento. A redução de
óxidos metálicos por hidrogênio à plasma para o processo de redução de óxido
de tungstênio, foi desenvolvido no laboratório de processamento de materiais
por plasma na universidade federal do Rio Grande do Norte. Nesta tese de
doutorado foi possível produzir tungstênio com estrutura morfológica adequada
para a produção de carbeto de tungstênio (SILVA, 2005).
O emprego do plasmas térmicos gerados por tochas de plasma tem sido
utilizado no mundo inteiro em diversos processos industriais, incluindo
processo metalúrgico (lingotamento contínuo, produção de ferroligas e outros).
O plasma termicos vem sendo destaque em várias aplicações tais como, corte
de metais, soldagem, produção de aço e metais refratários, reciclagem de
alumínio, esferoidização de partículas, depoisição de partículas em substratos
Revisão da Literatura 36
Raquel Guilherme de Carvalho
Atualmente, o plasma vem sendo bastante aplicado em tratamentos
termoquímicos a plasma de nitretação, nitrocarbonetação e oxidação. Estes
processos são utilizados para a melhoria de várias propriedades
físico-químicas de aços como a dureza, a resistência ao desgaste, à corrosão e à
fadiga, que resultam em um aumento na vida útil de peças tratadas. As
aplicações industriais são várias, abrangendo o tratamento de ferramentas de
corte, engrenagens, eixos e mancais.
2.4.2. Efeito do cátodo oco
A configuração do cátodo oco é obtida quando se tem superfícies
paralelas polarizadas catodicamente com mesmo potencial, posicionadas a
uma distância pequena (MENDES, 2005). Pode ser obtido através das
seguintes geometrias: por duas placas paralelas, por um tubo cilíndrico ou até
mesmo por um fio em forma espiral (BARÁNKOVA e BARDOS, 2001, apud
MENDES, 2005). O efeito catodo oco está ilustrado na Figura 9.
Figura 9 – Ilustração do efeito do catodo oco (adaptada de MENDES, 2005)
Ao se modificar a característica geométrica de uma descarga
luminescente convencional para a configuração cátodo oco, provoca-se um
Revisão da Literatura 37
Raquel Guilherme de Carvalho
plasmas estáveis e de alta densidade, sem que sejam necessárias altas
pressões de operações, ou campos magnéticos externos (ALVES Jr. et al,
2003; MENDES, 2005; BRITO, 2007).
O aumento da magnitude da corrente da descarga na configuração
catodo oco se dá devido à polarização negativa desse eletrodo oco, como
catodo, formando uma cavidade negativa, onde os elétrons ficam confinados
oscilando eletronicamente entre as paredes de cavidade onde está a amostra,
aumentando, assim, a concentração de elétrons, que atingem valores de
aproximadamente 10-12 cm-3 e, consequentemente, aumenta o número de
colisões ionizantes, aumentando também a produção de íons e a densidade do
fluxo de íons.
Os novos elétrons produzidos são, então, acelerados em direção ao
volume do plasma e novamente ficam oscilando entre as paredes e as
amostras, gerando novas colisões ionizantes, alimentando este ciclo. Esse
conjunto de efeitos descritos que geram o aumento da magnitude da corrente
são conhecidos como efeito catodo oco (BRITO, 2007).
Como consequência, a produção de íons e a densidade do fluxo de íons
sobre a superfície aumentam. Dependendo da distância de separação entre a
amostra e a parede do catodo, da pressão do gás e da densidade do plasma, o
gás dentro do catodo pode ser aquecido a temperaturas extremamente altas,
afetando a temperatura de superfície da amostra tratada (ALVES Jr. et al,
2003).
O uso da configuração catodo oco exibe muitas vantagens em relação à
Revisão da Literatura 38
Raquel Guilherme de Carvalho
elétrons, o alto grau de ativação das espécies, o sistema apresenta –se de
forma versátil e uma eficiente transferência de calor (MENDES, 2005).
No laboratório de processamento de materiais por plasma foram
desenvolvidos pesquisas envolvendo o efeito do catodo oco no processo de
redução de óxido, como, pentóxido de nióbio (Nb2O3), óxido de tântalo (Ta2O5),
ambas reações aluminotérmica foram realizadas no reator de sinterização, o
CAPÍTULO 3
40 Materiais e Métodos
Raquel Guilherme de Carvalho
3. MATERIAIS E MÉTODOS
3.1. Procedimento experimental
O procedimento experimental realizado neste trabalho está ilustrado no
fluxograma da Figura 10, os detalhes são dados nos tópicos seguintes.
Figura 10 – Fluxograma com as etapas realizadas no procedimento experimental
41 Materiais e Métodos
Raquel Guilherme de Carvalho
3.2. Parâmetros das reações carbotérmica em descarga em cátodo oco
Vários parâmetros influenciam o processo de obtenção de novos
materiais, tais como a natureza das matérias-primas e sua preparação, como
também o tempo e a temperatura de reação do processo. Os parâmetros
estudados nesse trabalho foram o tempo e a temperatura de processo de
redução carbotérmica em atmosfera de plasma de nitrogênio, com o intuito de
analisar o processo de produção de carbonitreto de titânio. Essas variáveis
estão listadas na Tabela 2
Tabela 2 – As condições de tempo e temperatura usados durante as reações carbotérmica dos pós de TiO2.
Temperatura (˚C) Tempo (Horas)
600˚C 3 e 4 horas
700˚C 3 e 4 horas
800˚C 3 e 4 horas
3.3. Caracterização dos materiais precursores
A caracterização de pós consiste num procedimento muito complexo,
uma vez que as propriedades dos mesmos não refletem somente as
características das partículas individuais, mas também dos agregados e vazios
existentes nesses agregados (BRITO, 2007). A caracterização dos materiais de
partida utilizados para a realização dos ensaios de redução carbotérmica em
42 Materiais e Métodos
Raquel Guilherme de Carvalho
Os materiais precursores utilizados neste trabalho são minério de TiO2
(rutilo) e grafite. O TiO2 foi fornecido pela empresa Millenium Inorganic
Chemicals Mineração Ltda localizada na cidade de Mataraca/PB. A pureza e os
teores de impurezas foram obtidas pela técnica de fluorescência de raios X no
laboratório de materiais no Ctgás. Os valores quantitativos do TiO2 estão
listados na Tabela 3.
Tabela 3 – Concentração e impurezas do TiO2
3.3.1. Preparação dos pós TiO2 e C
A mistura dos pós foi preparada na proporção mássica estequiométrica
apresentada na Tabela 4. Os pós de rutilo e grafite na proporção de 1:3 foram
colocados em um recipiente de metal duro, juntamente com bolas também de
metal duro e moídos em um moinho planetário do tipo Fritsch Pulverisete, sob
um rotação de 360 rpm durante 15 horas. A moagem foi efetuada a seco sob ar
atmosférico. A razão em massa de pó para massa de bolas usado foi de 1:5.
Depois de moídos os pós passaram em uma peneira 250 mesh.
Tabela 4 – Proporção mássica estequiométrica dos reagentes
Reagente Peso
molecular (g/mol)
Massa total (g)
Razão mássica
TiO2 79,87 g/mol 80g 68,97
C 12 g/mol 36g 31,03
Minério rutilo
43 Materiais e Métodos
Raquel Guilherme de Carvalho
3.3.2. Distribuição de tamanhos de partículas
A distribuição de tamanho de partículas dos materiais precursores (TiO2
e C) foi medida pela técnica de granulometria a laser através de um
equipamento CILAS, modelo 920 L. Inicialmente, foi notado que não estava
sendo possível obter resultados claros do tamanho das partículas com os pós
aglomerados, então os pós antes dos ensaios foram colocados junto com
acetona P.A. em um frasco para dispersar as partículas dos pós, e em seguida,
o material foi colocado no reservatório e o software de versão 2.56 foi
executado.
3.3.3. Identificação das fases presentes no pós de TiO2 e C
A mistura dos pós de TiO2 e C e o material obtido nas reações foram
caracterizados pela técnica de difração de raios X, para identificar as fases do
material obtido nas reações. O equipamento utilizado neste trabalho foi um
difratômetro de raios X, do Núcleo de Pesquisa de Petróleo e Gás Natural da
UFRN, da Shimadzu, modelo XRD-6000, com tubo de radiação CuKα,
velocidade de 2º min-1 e uma faixa angular de 20º a 80º. Para identificação das
fases utilizou-se o programa (Pmgr) da Shimadzu, com acesso o banco de
44 Materiais e Métodos
Raquel Guilherme de Carvalho
3.3.4. Morfologia dos pós de TiO2+C moídos e após ao processo de redução
Os pós precursores de TiO2 e C, assim como, os resultantes das
reações, foram analisados pelo microscópio eletrônico de Varredura modelo Philips XL30 – ESEM no Centro Tecnológico de Gás Natural (Ctgás).
A análise por MEV dos pós foi aplicada para observar a morfologia dos
materiais precursores (TiO2 e C), dos pós misturados e reagidos. Foram
aplicadas as técnicas de elétrons retroespalhados (BSE) para avaliar a
diferença de tonalidade entre as fases obtidas nas reações.
Para evitar a aglomeração do pó durante a análise de MEV, o pó foi
colocado dentro de um frasco descartável com acetona; em seguida, o pó foi
disperso na acetona, e por último, lentamente depositado no porta-amostra, por
meio de uma pipeta, logo em seguida o pó foi observado no MEV. Esse
procedimento repetiu-se para cada pó, separadamente, e também para os pós
misturados mecanicamente e da reação.
3.3.5. Diagnóstico do plasma durante o processo de redução carbotérmico
A análise de espectroscopia de emissão ótica (EEO) foi efetuada
durante a reação de redução carbotérmica em atmosfera de plasma de
45 Materiais e Métodos
Raquel Guilherme de Carvalho
CO e CO2. O espectrômetro utilizado neste trabalho foi o Ocean Optics HR4000CG-UV-NIR.
Figura 11 - Modelo esquemático do equipamento de EEO em uso no reator a plasma.
Na figura 11 está apresentado um modelo esquemático do equipamento
de EEO em uso no reator a plasma. A radiação emitida pelo plasma é
capturada e conduzida pela fibra óptica até chegar ao espectrômetro óptico que
converte luz em corrente elétrica. As leituras de corrente elétrica são
interpretadas pelo “Spectrahub” e transformadas em dados computacionais.
Os dados são expostos em forma de gráfico cujos eixos indicam intensidade
46 Materiais e Métodos
Raquel Guilherme de Carvalho
3.4. Reator de sinterização
O equipamento utilizado para a realização deste trabalho consiste de um
reator de plasma desenvolvido no Laboratório de Processamento de Materiais
por Plasma (LABPLASMA) da Universidade Federal do Rio Grande do Norte. A
câmara de redução utilizada é composta por um tubo feito de vidro borosilicato
de formato cilíndrico (altura de 12 cm e diâmetro de 9 cm), fechado em ambos
os lados por flanges de aço inox. Na Figura 12 está apresentado o modelo
esquemático e a foto do equipamento de plasma em cátodo oco.
47 Materiais e Métodos
Raquel Guilherme de Carvalho
Para realização dos experimentos foi utilizada a técnica do efeito do
catodo oco. A amostra de pó foi colocada dentro de um cilindro de dimensões
15 mm de altura e 19 mm de diâmetro confeccionado em aço inox, assim o
plasma é confinado formando o efeito do catodo oco. Logo depois, o vácuo da
câmara foi realizado por meio de uma bomba mecânica que realiza a
evacuação até uma pressão de 0,6 Mbar. O fluxo de gases usado nos
experimentos foi ajustado a 12 sccm de N2 e 3 sccm de Ar através de um
fluxímetro.
A temperatura de tratamento é medida por um termopar do tipo
cromel-alumel, inserido no catodo. Após o tratamento, desliga-se a fonte de tensão DC
e a amostra é resfriada dentro da própria câmara. Em seguida o pó resultante
Raquel Guilherme de Carvalho
CAPÍTULO 4
Resultados e Discussão 49
Raquel Guilherme de Carvalho
4. RESULTADOS E DISCUSSÃO
4.1. Caracterização das Matérias-Primas
4.1.1. Difração de Raios X
Nas Figuras 13 e 14 são apresentados os difratogramas de raios X dos
pós de TiO2 e grafite, respectivamente. É possível observar o caráter cristalino
de ambos os materiais. Os picos relativos à fase TiO2 são bem definidos e
estão nas regiões em que 2θ varia entre 20˚ a 70˚, com picos estreitos com
altas intensidades. Suas linhas de difração corresponde à ficha JCPDS
77-0442.
20 30 40 50 60 70 80
0 500 1000 1500 2000 2500 3000 In te n s id a d e u . a .
2
(1 1 0 ) (1 0 1 ) (2 1 1 ) (2 2 0 ) (0 0 2 ) (3 1 0 ) (3 0 1 ) (1 1 2 ) (1 1 1 ) TiO
2 77-0442
Resultados e Discussão 50
Raquel Guilherme de Carvalho
No difratograma do pó de grafite, o pico de maior concentração de
grafite está localizado em 2θ = 26,58.
10 20 30 40 50 60 70 80 90
0 2000 4000 6000 8000 10000 In te n s id a d e u . a .
2
(0 0 2 ) (1 0 1 ) (0 0 4 ) (1 0 3 ) (1 1 0 ) (1 1 2 )
C 89- 8487
Figura 14 – Difratograma de raios X do pó de grafite
Os pós de TiO2 e grafite foram moídos em um moinho de bola por 15
horas, logo depois, os pós foram passados em uma peneira 250 mesh. A
Figura 15 apresenta o resultado de difração de raios X do pó moído.
Observa-se no difratograma que ambas as faObserva-ses TiO2 e C permanecem cristalinas após
a moagem, sendo notado o alargamento dos picos, essa característica pode
está relacionada à deformação da rede cristalina de ambos produzida pela alta
energia de impactado e frequência de colisões dos meios de moagem contra
Resultados e Discussão 51
Raquel Guilherme de Carvalho
20 30 40 50 60 70 80
0 200 400 600 800 1000 1200 1400 1600 1800 In te n s id a d e u . a .
2
(0 0 2 ) (1 1 0 ) (1 0 1 ) (2 0 0 ) (1 1 1 ) (2 1 0 ) (2 1 1 ) (2 2 0 ) (0 0 2 ) (3 1 0 ) (3 0 1 ) (1 1 2 )
TiO2
C
Figura 15 – Difratograma de raios X do pó de TiO2+C moído por 15 horas em moinho planetário
4.1.2. Microscopia eletrônica de varredura
Na Figura 16 está apresentada a micrografia das partículas de TiO2
dispersas em acetona. Observa-se que as partículas de TiO2 possuem formas
de placas irregulares, com a presença de partículas menores interligadas as
Resultados e Discussão 52
Raquel Guilherme de Carvalho
Figura 16 – Micrografias das partículas do pó de TiO2
A figura 17 mostra a micrografia das partículas de grafite, Observa-se
através da imagem a morfologia típica das partículas grafite, estrutura essa
Resultados e Discussão 53
Raquel Guilherme de Carvalho
Figura 17– Micrografia das partículas do pó de carbono
Durante a moagem, a morfologia e o tamanho das partículas mudam,
em consequência do impacto e colisões dos meios de moagem contra as
partículas. Na figura 18 observa-se a formação de aglomerados de pequenas
partículas de TiO2 e grafite. Através da análise por elétrons retroespalhados
(BSE) é possível identificar após a moagem as partículas de grafite (fase mais
escura) e as partículas de TiO2 (fase mais clara), ambas com aspecto
Resultados e Discussão 54
Raquel Guilherme de Carvalho
Figura 18 – Microscopia do pó de TiO2+C moído em moinho planetário por 15 horas
4.1.3. Distribuição de tamanhos de partículas
As figuras 19 e 20 apresenta o resultado da analise de distribuição de
tamanho de partículas dos pós de TiO2 e grafite, respectivamente. O
histograma de TiO2 indica que os pós tem uma distribuição de tamanho de
partícula não uniforme. A larga distribuição de tamanho de partículas é
conseqüência de aglomerados, o que é confirmado ao resultado apresentado
na figura 16 com morfologia constituída por aglomerados na forma de placas
irregulares, e constituídas por partículas finas interligadas. Observa-se também
que existem três picos principais, que se encontram na faixa de 0,3 a 10,0 µm.
Um dos picos encontra-se interceptado pelo eixo Y do equipamento em 0,3 µm,
o que indica provavelmente que existem partículas com tamanhos inferiores,
Resultados e Discussão 55
Raquel Guilherme de Carvalho
Figura 19 – Histograma da distribuição do tamanho de partículas do pó de TiO2
Na figura 20 está o resultado da analise de distribuição do tamanho de
partícula do pó de grafite, que também apresenta uma distribuição de tamanho
Resultados e Discussão 56
Raquel Guilherme de Carvalho
Figura 20 – Histograma da distribuição do tamanho de partículas do pó de grafite
4.2. Redução carbotérmica das misturas de TiO2 e C em atmosfera de
plasma de nitrogênio
Durante a reação carbotérmica são formadas fases de TinO2n-1,
conhecidas como fases magnéli onde o n pode assumir valores maior que 10.
Essas fases são dificéis de serem identificadas por causa de suas pequenas
diferenças estruturais ( HE, 2010).
Na Figura 21 é observado os difratogramas de raios X do pó de TiO2
puro, do pó de TiO2+C moído por 15 horas, e o pó de TiO2+C aquecido por
plasma à temperatura de 600˚C durante 3 e 4 horas, respectivamente. Nota-se
que após a moagem, o difratograma que corresponde a essa mistura de
TiO2+C teve uma diminuição do principal pico de TiO2, que está localizado no
Resultados e Discussão 57
Raquel Guilherme de Carvalho
alargamento do pico de TiO2 durante a moagem com a deformação na rede
cristalina do TiO2. A presença de grafite na mistura com TiO2 é observada
através do pico 2θ= 26,58 (carta 89-8487).
Quando os pós de TiO2+C moídos foram aquecidas por plasma à
temperatura de 600˚C, com tempo isortérmico de 3 e 4 horas, ocorreu o
aparecimento da fase Ti6O11 com baixa intensidade. Isso indica que o carbono
reagiu com o óxido à temperatura de 600˚C. Nota-se, ainda, que essa fase
aparece com maior intensidade no tempo isotermico de 4 horas, sem aparecer
qualquer indício de nova fase. Contudo, a presença ainda dos picos que
corresponde a TiO2 e grafite mostra que a essa temperatura não foi possível
uma redução completa.
20 40 60 80
0 1000 2000 3000 0 1000 2000 3000 0 1000 2000 3000 0 1000 2000 3000 TiO2 In te n si d a d e u .a .
2
TiO2+C
In te n si d a d e u .a .
600C/3 horas
In te n si d a d e u .a .
600C/4 horas
In te n si d a d e u .a .
Figura 21 – Difratograma de raios X (a) TiO2 puro, (b) TiO2+C e (c) TiO2+C após reação em temperatura de 600˚C com tempo isotérmico de 3 horas e (d) 4 horas 30 40 0 100 200 300 400 500 0 100 200 300 400 500 0 100 200 300 400 500 0 100 200 300 400 500 (d) (c)
2
(a) (b)
TiO2
C
Ti6O11
Resultados e Discussão 58
Raquel Guilherme de Carvalho
Observa-se na Figura 22 os resultados das amostras aquecidas por
plasma à temperatura de 700˚C com tempo isotérmico de 3 e 4 horas. A fase
Ti6O11 também apareceu quando a amostra foi aquecida à temperatura de
700˚C. Quando o tempo isotérmico passou para 4 horas de reação, foi
observado o aumento de intensidade do pico que corresponde com a fase
Ti6O11, e a diminuição contínua da intensidade do pico de carbono. Isso indica
que mesmo com o aumento da temperatura passando de 600 a 700˚C, não é
possível obter uma maior reatividade do grafite com o óxido. Geralmente, essa
fase é obtida em temperaturas acima de 1000˚C, principalmente quando o
grafite está misturado com o TiO2 (BERGER, 2002).
20 40 60 80
0 1000 2000 3000 0 1000 2000 3000 0 1000 2000 3000 0 1000 2000 3000 TiO2 In te n si d a d e u .a .
2
TiO2+C
In te n si d a d e u .a .
700C/3 horas
In e tn si d a d e u .a .
700C/4 horas
In e tn si d a d e u .a .
Figura 22 – Difratograma de raios X (a) TiO2 puro, (b) TiO2+C e (c) TiO2+C após reação em temperatura de 700˚C com tempo isotérmico de 3 horas e (d) 4 horas 30 40 0 100 200 300 400 500 0 100 200 300 400 500 0 100 200 300 400 500 0 100 200 300 400 500
2 (a) (b) (c) (d)
TiO2 C Ti6O11
Resultados e Discussão 59
Raquel Guilherme de Carvalho
Na Figura 23 são apresentados os resultados de TiO2 puro, o TiO2
misturado com carbono em moagem de 15 horas, e o TiO2+C aquecido por
plasma à temperatura de 800˚C com tempo isotérmico de 3 e 4 horas,
resultados esses obtidos pela técnica de difração de raios X. Nota-se a
formação de novas fases obtidas pela a reação carbotérmica quando o pó foi
aquecimento à temperatura de 800˚C com tempo de 4 horas. Isto indica que o
óxido de titânio reagiu com o carbono formando, óxidos com menor estado de
oxidação, esses são formados em uma faixa de 20˚ a 40˚, essas fases
correspondem os óxidos Ti5O9, Ti6O11 e Ti7O13.
20 40 60 80
0 1000 2000 3000 0 1000 2000 3000 0 1000 2000 3000 0 1000 2000 3000 TiO2 In te nsi da de u . a . 2
TiO2+C
In te nsi da de u . a .
800C/4horas
800C/3horas
In te nsi da de u . a . In te nsi da de u .a .
Figura 23 – Difratograma de raios X (a) TiO2 puro, (b) TiO2+C, (c) TiO2+C após reação em temperatura de 800˚C com tempo isotérmico de 3 horas e (d) 4 horas 30 40 0 100 200 300 400 5000 100 200 300 400 5000 100 200 300 400 5000 100 200 300 400 500 TiO2 C
Ti5O9
Ti6O11
Ti7O13
Resultados e Discussão 60
Raquel Guilherme de Carvalho
Como foi obsevado anteriormente, a partir da temperatura de 600˚C com
tempo isotérmico de 3 horas, a reação da redução do rutilo começa e é
marcada pela presença da fase de um óxido intermédiario e a intensidade do
pico de grafite (002) e do rutilo diminuem. Somente a temperatura de 800˚C
com o tempo de 4 horas é formado mais fases de óxidos intermédiarios com
baixa intensidade. De fato, ocorreu a formação de picos de três fases
correspondentes aos óxidos menos oxidados, não sendo detectado a formação
de fases TiN e TiC.
A idéia de que a proporção de carbono presente na reação não tenha
sido suficiente para gerar a redução completa é eliminada, pois a proporção de
óxido e carbono foi preparada com mistura estequiométrica de 3 mol de C para
a formação de TiC, geralmente é usado 2,7 mol de C para produzir TiCxNy,
portanto, a quantidade de carbono está em excesso.
É conhecido que durante a redução carbotérmica o carbono é
consumido em consequência da formação dos gases CO e CO2, que é formado
no início da reação com o contato entre óxido e as partículas de carbono no
estado sólido. As amostras aquecidas as temperaturas de 600˚C e 700˚C com
tempo isotérmico de 3 e 4 horas, a presença de carbono foi detectada por
difração de raios X. No entanto, a ausência do pico de carbono foi somente
observada na amostra reagida à temperatura de 800˚C, com o tempo
isotérmico de 4 horas. Provavelmente, o carbono deve está em baixa
quantidade não sendo possível ser detectado pelo equipamento.
Em todas as temparaturas utilizadas nos experimentos foi possível obter
Resultados e Discussão 61
Raquel Guilherme de Carvalho
forneceu maior energia de redução, onde foi obtidos mais oxidos
intermediários.
As seqüências de fase durante as reações carbotérmica em atmosfera
de nitrigênio é descrita da seguinte forma, TiO2 → TinO2n-1 (n > 10) →TinO2n-1 →
(10 > n > 4) → Ti3O5 → TiCxNy. A formação de TiCxNy ocorre a partir de Ti3O5,
por causa do número de sítios intersticiais desocupados em sua rede, que
acomoda facilmente a incorporação de C ou N em rede cristalina. Neste caso
os resultados obtidos nestes experimentos indicam que a temperatura de
800˚C ainda não foi suficiente para transformar uma fase com teores menores
de oxigênio.
Mesmo não apresentando a formação de fases correspondente a TiN ou
mesmoTiC, foi observado, na amostra tratada a 800˚C por 4 horas, o
deslocamento de picos. É fato que o parâmetro de rede de uma solução sólida
varia com a concentração do soluto, possibilitando a determinação da
composição da solução sólida (CULLITY, 1978).
Observa-se na figura 24 os difratogramas da amostra antes das reações
e as obtidas após ao processo de redução carbotérmico nas temperaturas de
600, 700 e 800˚C por 4 horas. As fases de óxidos intermediários que foram
obtidas com o processo de redução deste trabalho são conhecidos por se tratar
de fases caracterizada pela deslocação dos átomos na rede cristalina do TiO2,
compostos não estequiométricos defeituosos, como foi observados
anteriomente no diagrama Ti-O. Assim o deslocamento de picos e
consequentemente a alteração no parâmetro de rede observados nas Figuras
Resultados e Discussão 62
Raquel Guilherme de Carvalho
27,0 27,9 28,8
0 500 1000 In te n si d ad e u . a .
2
TiO2+C
800C 700C 600C
28 32 36
0 500 1000 In te n s id a d e u . a .
2
TiO
2+C
800C
700C
600C
Figura 24 – Difratograma com o perfil de raios X da amostra antes da reação e as amostras reagidas a temperaturas de 600, 700 e 800˚C por 4 horas
A figura 25 apresenta o gráfico que corresponde à mudança do
parâmetro de rede com o aumento da temperatura 600, 700 e 800˚C, com
Resultados e Discussão 63
Raquel Guilherme de Carvalho
600 650 700 750 800
4,600 4,605 4,610 4,615 4,620 4,625 4,630
Pa
râ
m
e
tr
o
d
e
r
e
d
e
Temperatura C
Figura 25 – Medida dos parâmetros de rede dos pós TiO2/C em função da temperatura de redução carbotérmica
4.3. Espectrômetro de emissão óptica
O espectrômetro de emissão óptica foi utilizado durante as reações
carbotérmica para identificar as espécies químicas formada durante as
reações, que geralmente são CO e CO2 identificados e reconhecimento como o
produto da reação de redução carbotérmica. A Figura 26 apresenta os
espectros obtidos por espectroscopia de emissão óptica (EEO) presente na
reação carbotérmica. Observa-se as espécies química CO e NO, sem a
presença de CO2. A formação de CO é uma evidência da reação direta das
partículas de carbono com o TiO2. Berger (1999) confirma em seus
Resultados e Discussão 64
Raquel Guilherme de Carvalho
durante a reação carbotérmica uma regeneração imediata de CO2 para CO
pela reação com o carbono sólido.
400 600 2000 2200 2400 2600 2800 3000 3200 3400 3600 C O 5 19 ,8 n m N O 3 80 ,0 9 nm N O 4 13 n m
N+2
In te n si d ad e u . a .
Comprimento de onda N2
N+2
800°C/0 hora
Figura 26 – Espectro obtido durante as reações carbotérmica no reator de plasma
Os perfis ópticos apresentado na figura 27 mostram claramente que
presença maior de CO é na temperatura de 600˚C, e nas temperaturas de 700
e 800˚C a intensidade dessa espécie é muito baixa e constante durante toda
reação. No entanto, a espécie de NO apareceu com maior intensidade
justificando assim a redução apresentada nos resultados de difração de raios X
nessas temperaturas. Esses resultados indicam que as espécies CO e NO