UNIVERSIDADE PRESBITERIANA MACKENZIE
Centro de Ciências Biológicas e da Saúde
Programa de Pós Graduação em Distúrbios do Desenvolvimento
CYNTIA MORAES TEIXEIRA
EXPRESSÃO DA DESIODASE DO TIPO III NO CÉREBRO DE
FILHOTES DE RATAS OBESAS
UNIVERSIDADE PRESBITERIANA MACKENZIE
Centro de Ciências Biológicas e da Saúde
Programa de Pós Graduação em Distúrbios do Desenvolvimento
Cyntia Moraes Teixeira
EXPRESSÃO DA DESIODASE DO TIPO III NO CÉREBRO DE
FILHOTES DE RATAS OBESAS
Dissertação vinculada à linha de Pesquisa Básica em Neurobiologia e Comportamento no Desenvolvimento e seus transtornos, apresentada ao Programa de Pós Graduação em Distúrbios do Desenvolvimento da Universidade Presbiteriana Mackenzie de São Paulo para a obtenção do título de Mestre.
Orientadora: Profa. Dra. Miriam Oliveira Ribeiro.
T266e Teixeira, Cyntia Moraes
Expressão da Desiodase do Tipo III no cérebro de ratas obesas - Cyntia Moraes Teixeira. 2012.
43 f. ; 30 cm
Dissertação (Mestrado em Distúrbio do Desenvolvimento) - Universidade Presbiteriana Mackenzie. São Paulo, 2012. Referências bibliográficas: f. 36-39.
1. Transtorno do espectro do autismo. 2. Trajetória familiar. 3. Serviços de saúde. 4. Diagnóstico e tratamento. I. Título.
UNIVERSIDADE PRESBITERIANA MACKENZIE
Centro de Ciências Biológicas e da Saúde
Programa de Pós Graduação em Distúrbios do Desenvolvimento
Aprovada em: 09 de agosto de 2012
Comissão Examinadora
Dissertação para a obtenção do título de mestre em Distúrbios do Desenvolvimento
Presidente e Orientadora: Profa. Dra. Miriam Oliveira Ribeiro Universidade Presbiteriana Mackenzie
Primeira Examinadora: Profa. Dra. Roberta Monterazzo Cysneiros Universidade Presbiteriana Mackenzie
AGRADECIMENTOS
Agradeço a Deus pela realização desse sonho, e por ter me ajudado a chegar até aqui.
Aos meus pais, que estiveram por perto, mesmo estando tão longe. Deles pude sentir
apoio, carinho, cuidado, estímulo. Esse trabalho é fruto de tudo o que aprendi com vocês!
À minha irmã Jacqueline, que me acolheu nos momentos de dificuldades e que sempre
esteve do meu lado quando precisei.
À minha querida orientadora Profa. Dra. Miriam Oliveira Ribeiro, por ter aceitado o
desafio de me instruir nesse processo, pela paciência em me esclarecer vezes coisas tão
simples. Pelo companheirismo, amizade e confiança que depositou em mim. Saiba que
descobri muitas coisas no decorrer desse processo e isso graças a você!
A Profa. Dra. Roberta Monterazzo Cysneiros, por sua contribuição, colaboração
incentivo e por me permitir acompanhar e aprender protocolos e métodos que me serviram de
grande aprendizado.
Ao Prof. Dr. Fúlvio pelas contribuições o e aceite de fazer parte deste processo.
A todos os professores do Programa de Distúrbios de Desenvolvimento.
A querida amiga Renata Nassif, pela companhia durante essa caminhada e por
partilhar comigo de conhecimentos específicos de pesquisa que foram de grande contribuição.
Sei que este agradecimento não é o suficiente para expressar o quanto sou grata e o quanto me
ajudou.
A querida Adelisandra Castelhano, pela contribuição em diversos momentos,
principalmente por mesmo impossibilitada em pleno feriado, ter vindo me instruir em como
Ao Gustavo Fernandes, pelo conhecimento específico de Western Blot divido. Muito
obrigada pela paciência em me ensinar cada faceta do processo, e pelas contribuições para que
este trabalho fosse realizado.
A Nailliw, Fabi e Babi pela amizade e disposição em ajudar.
As alunas de iniciação científica, em especial Cícera, Bruna e Loredana pelas
contribuições durante essa caminhada.
Aos laboratoristas: Nathália, Júnior, Vitor, Layor pelo auxílio, contribuição e
disposição em me ajudar sempre. Vocês são a base da realização desse trabalho.
Aos funcionários do Biotério de Ratos: Sr. Domingos e a veterinária Raquel.
Em especial aos amigos, Rafael, Fernando, Adriano Song, Paulo, Marta, Maísa, Paola
e Pritty por terem me dado forças nos momentos mais difíceis desta jornada. Muito obrigada
pelo colo e ombro amigo. Sem vocês e a força de vocês não teria conseguido chegar até aqui.
A todos amigos, colegas e companheiros de trabalho que respeitaram e entenderam
quando por alguns meses me ausentei e me silenciei...
À Universidade Presbiteriana Mackenzie, pela oportunidade de desfrutar até o final da
bolsa de estudos, mesmo não fazendo mais parte do corpo colaborativo da instituição.
Sem sonhos, as perdas se tornam insuportáveis, As pedras do caminho se tornam montanhas, Os fracassos se transformam em golpes fatais,
Mas, se você tiver grandes sonhos…
Seus erros produzirão crescimento, Seus desafios produzirão oportunidades, Seus medos produzirão coragem. Por isso, meu ardente desejo é que você Nunca desista dos seus sonhos.
RESUMO
A obesidade é uma epidemia de ordem mundial que é fator de risco para o desenvolvimento
de hipertensão arterial, dislipidemia, hiperglicemia, diabetes tipo 2 e esteatose hepática. O
aumento de obesidade em gestantes além de aumentar o risco do desenvolvimento de doenças
cardiovasculares, também pode estar relacionado com anomalias no desenvolvimento do
Sistema Nervoso Central dos embriões como, por exemplo, redução dos potenciais de longa
duração (LTP) e da neurogênese no hipocampo. É possível que os níveis reduzidos de BDNF
observados nestes embriões, estejam envolvidos com o prejuízo nos processos de aprendizado
e memória exibidos por esses animais. Estudos também mostram que o BDNF se encontra
reduzidos em fetos de mães com hipotiroidismo subclínico materno. Estes filhotes apresentam
piora no desenvolvimento neurológico, demonstrando déficits na memória de longo e de curto
prazo. O presente avaliou se a obesidade materna pode alterar os níveis de BDNF e a
expressão da enzima desiodase do tipo III (D3) no cérebro dos filhotes, com consequente
alteração dos níveis locais de T3 ao 7°, 10° e 16° dias de vida pós-natal. Os nossos resultados
mostraram que a obesidade reduziu a expressão da D3 no 7º dia de vida pós-natal dos filhotes
de mães obesas, mas não nos dias posteriores, sem alteração significativa nos níveis de
BDNF. Não houve alteração significativa nos níveis de BDNF em nenhum dos dias avaliados.
Os nossos dados sugerem que é possível que o hormônio tiroideano esteja envolvido nas
alterações neurofisiológicas observadas em filhotes de ratas obesas.
Palavras– chaves: Obesidade Materna. Desiodase. Obesidade Infantil. BDNF.
ABSTRACT
Obesity has been considered epidemic in the whole world and is a risk factor for the
development of hypertension, dyslipidemia, hyperglycemia, type 2 diabetes and hepatic
steatosis. The increase of obesity in during pregnancy not only increases the risk of
developing cardiovascular diseases but may also be related to abnormalities in the developing
CNS of embryos, for example, reduction of potential long-term (LTP) in the hippocampus
and neurogenesis . It is possible that the reduced levels of BDNF observed in these embryos,
are involved with the injury in the processes of learning and memory observed in these
animals. Studies also show that BDNF is reduced in fetuses of mothers with maternal
subclinical hypothyroidism. These puppies have worsening neurological development, with
deficits in long and short term memory. Here we evaluated whether maternal obesity may
alter levels of BDNF and enzyme expression of type III deiodinase (D3) in the brains of pups,
with consequent alteration of local levels of T3 to 7 °, 10 ° and 16 ° day-old post -natal. Our
results showed that obesity reduced the expression of D3 on the 7th day of postnatal life of
the offspring of obese mothers, but not in later days. There were no significant alterations in
the levels of BDNF in any of the evaluated days. Our data suggest that it is possible that
thyroid hormone is involved in neurophysiological abnormalities observed in offspring of
obese rats.
LISTA DE FIGURAS
FIGURA 1: Peso corporal das ratas controle e tratadas com dieta rica em gordura (40%) antes do acasalamento...25 FIGURA 2: Variação do peso corporal das ratas controle e tratadas com dieta rica em gordura (40%) antes do acasalamento...26
FIGURA 3: Peso corporal das ratas controle e tratadas com dieta rica em gordura (40%) durante a gestação...26
FIGURA 4: Variação do peso corporal das ratas controle e tratadas com dieta rica em gordura (40%) ao longo da gestação...27
FIGURA 5: Consumo de ração das ratas controle e alimentadas com dieta rica em gordura (40%) ao longo da gestação...27
FIGURA 6: Peso corporal dos filhotes machos das mães controle e mães obesas aos 7, 10 e 16 dias de vida pós-natal...28
FIGURA 7: Peso corporal dos filhotes fêmeas das mães controle e mães obesas aos 7, 10 e 16 dias de vida pós-natal...28
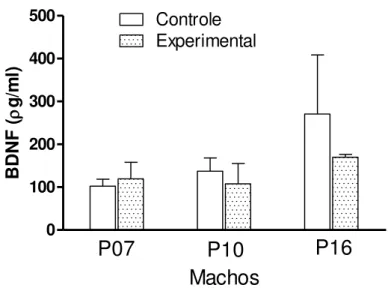
FIGURA 8: Medida da concentração de BDNF em homogenato de cérebro de filhotes machos de mães controle e obesas aos 07, 10 e 16 dias de vida pós-natal...29
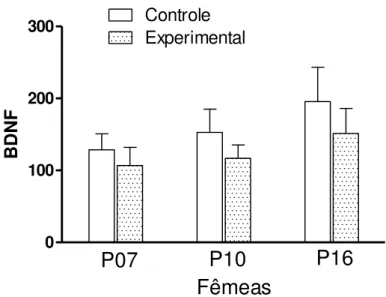
FIGURA 9: Medida da concentração de BDNF em homogenato de cérebro de filhotes fêmeas de mães controle e obesas aos 07, 10 e 16 dias de vida pós-natal...30
FIGURA 10: Medida da expressão de D3 por western blot de homogenato de cérebro de filhotes de mães controle e obesas aos 07 dias de vida pós-natal...31
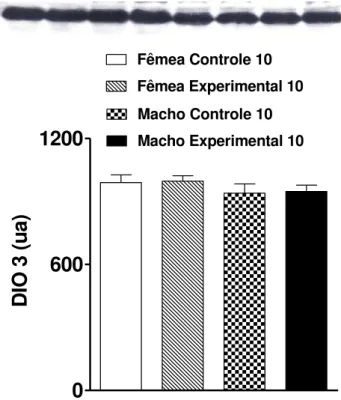
FIGURA 11: Medida da expressão de D3 por western blot de homogenato de cérebro de filhotes de mães controle e obesas aos 10 dias de vida pós-natal...32
SUMÁRIO
1. INTRODUÇÃO... 12
1.2. Obesidade Materna e Prematuridade.... 16
1.3. BDNF e o desenvolvimento... 17
1.4. Hormônio Tireoidiano e Sistema Nervoso Central... 18
2. OBJETIVO... 20
3. MATERIAL E MÉTODOS... 21
3.1. Animais e procedimentos de alimentação... 21
3.2. Procedimento experimental... 22
4. ANÁLISE ESTATÍSTICA... 24
5. RESULTADOS... 25
6. DISCUSSÃO... 33
REFERÊNCIAS BIBLIOGRÁFICAS... 36
12
1. INTRODUÇÃO
A obesidade pode ser definida como um distúrbio multifatorial, caracterizado pela
deposição excessiva de gordura nos tecidos e está diretamente relacionada ao
desenvolvimento da Síndrome Metabólica (MORAES,2011) Pode ser compreendida como
um conjunto de fatores de risco associados ao desenvolvimento de doenças e distúrbios
cardiovasculares, tais como aumento nos níveis de triglicérides, diminuição nos níveis séricos
da lipoproteína de alta densidade (HDL), desenvolvimento de hipertensão arterial, aumento da
glicemia em jejum e resistência à insulina, o que pode preceder o desenvolvimento de
diabetes tipo II (ALBERTI, ZIMMET & SHAW, 2005; YAMADA, et al., 2012).
Nos últimos anos, o aumento significativo da prevalência da síndrome metabólica em
diversas populações e a sua manifestação tanto em crianças quanto em indivíduos adultos,
torna possível sua classificação como uma epidemia de ordem mundial (HELLERSTEIN &
PARKS, 2007).
Porém, é interessante considerar nesse quadro o crescimento da incidência da
obesidade em mulheres em idade reprodutiva. O que torna fundamental compreender nesta
população quais variáveis agem como determinantes no desenvolvimento deste problema
(SULLIVAN, et al., 2010).
No desenvolvimento da obesidade observa-se tanto a hipertrofia quanto a hiperplasia
das células adiposas no organismo (ARNER, et al,. 2010)
A gravidez é considerada um período de risco para o aumento dos depósitos de
gordura por hiperplasia, especialmente o ultimo trimestre (FAZIO, 2010). O aumento dos
casos de obesidade entre gestantes constitui um novo foco para o desenvolvimento de
13
desencadear doenças como diabetes gestacional, a pré-eclampsia e, consequentemente, o
aumento de cesarianas e nascimento de prematuros (FAZIO,2010).
Além disso, a obesidade gestacional pode estar envolvida no aumento das taxas de
anomalias congênitas e natimortalidade do feto (MORAES, 2011). Dessa forma, os riscos de
doenças no período de gestação, a obesidade na gravidez pode causar problemas de saúde em
longo prazo, tais como doenças cardíacas, hipertensão e diabetes. Estes riscos afetam também
a criança, que tem mais chance de desenvolver obesidade, doenças cardiovasculares e
diabetes (COSTA & SILVA, 2010).
Certamente, a principal causa de obesidade durante a gravidez esta relacionada à
ingestão de alimentação inadequada, (FAZIO, 2010). Por meio de consumo excessivo de
alimentos ricos em açúcares simples, de gorduras animais, ácidos graxos saturados, gorduras
trans (ALLEN, 2005). O acesso a alimentos com alto teor calórico facilita o desenvolvimento
da obesidade não apenas em mulheres, mas também na população infantil (PERGHER et al.,
2010).
Este fator sugere a restrição de crescimento fetal, como forma de resposta adaptativa a
insuficiente oferta de nutrientes necessários para o desenvolvimento do feto, ocasionando
mudanças estruturais e metabólicas resultando no desvio de nutrientes para o crescimento de
outros órgãos (COSTA & SILVA, 2010).
O consumo de micronutrientes e vitaminas considerados fundamentais para a saúde da
gestante e do feto, a saber, ácido fólico, iodo, cálcio e ferro (FAZIO, 2010) proporcionará um
estado nutricional compatível com as necessidades fisiológicas em cada etapa do período
reprodutivo e no período pós-parto (CASTRO, KAC & SICHIERI, 2009).A obesidade infantil
vem sendo objeto de estudos que buscam entender suas causas e consequências. No inicio da
década de 90, a Organização Mundial da Saúde emitiu alerta mundial, com base em
14
sobrepeso (PETROSKI, 2007). Dentre as causas sociais apontadas encontra-se o novo modelo
familiar moderno, que além de ter como prole apenas um filho, tem em muitos casos as
mulheres como chefe da economia familiar. Isso poderia resultar num alargamento na
disciplina cotidiana dos filhos, induzindo-os a ingestão exagerada de alimentos com altos
níveis de calorias (PETRINI, 2007 apud SANTOS & RABINOVICH, 2011).
Outro fator social evidenciado nessas pesquisas diz respeito à visão acerca do
problema da obesidade infantil. Países considerados economicamente desenvolvidos
apresentam uma relação negativa entre alto nível socioeconômico e obesidade, já os países em
desenvolvimento apresentam uma relação oposta, sendo possível encontrar uma relação
positiva entre alto nível socioeconômico e obesidade infantil (PETRINI, 2007 apud SANTOS
& RABINOVICH, 2011). A obesidade materna parece desempenhar um papel direto na
transmissão de traços obesogênico e diabéticos para a próxima geração. Estudos com animais
demonstraram que a obesidade materna aumenta os riscos de obesidade, hipertensão e outras
facetas de doenças metabólicas na prole (SRINIVASAN et al, 2006;. SAMUELSSON et al,
2008;. SHANKAR et al, 2008;. CHANG et al. , 2008).
Além disso, há a constatação recente que a obesidade materna pode modular a
formação de circuitos neurais, interferindo diretamente no desenvolvimento do Sistema
Nervoso Central da criança (WRIGHT, EVANS & VOIGT, 2011). Estudos recentes têm
relatado que filhos de mães obesas mostram anormalidades no desenvolvimento do circuito
neural (TOZUKA et al., 2009b).
O fator neurotrófico derivado do cérebero (BDNF) desempenha um papel importante
na sobrevivência, manutenção e diferenciação de muitos tipos de neurônios e é
abundantemente expressa no hipocampo. Evidências sugerem que reduções nos níveis de
BDNF interferem com potenciais de longa duração (LTP) e neurogênese (BINDER &
15
recém formados podem contribuir para a função do hipocampo, constituindo um possível
mecanismo celular para a aprendizagem e memória (SHORS et al, 2001;. SAXE et al, 2006;.
ZHANG et al, 2008;. DUPRET et al, 2008;. FARIOLI-VECCHIOLI et al, 2008;. IMAYOSHI
et al, 2008).
Animais alimentados com dieta rica em gordura (HFD) apresentam aprendizagem
hipocampo-dependentes prejudicada, baixos níveis de BDNF no hipocampo e neurogênese
reduzida em comparação com os animais alimentados com dieta normal (MOLTENI et al,
2002;. LINDQVIST et al, 2006;. STRANAHAN et al. , 2008b).
Esses resultados sugerem que a obesidade pode levar a uma redução na aprendizagem
e a memória como resultado da diminuição dos níveis de BDNF resultante da menor
arborização dendrítica no hipocampo de novos neurônios. Em filhotes de camundongas
alimentadas com dieta rica em gordura também se observa prejuízo na realização de tarefas
comportamentais dependentes do hipocampo. O teste de labirinto Barnes mostra que filhotes
de mães tratadas com HFD apresentam prejuízos na aquisição de aprendizado espacial nos
jovens. Também foi observada nesses animais, redução na produção de BDNF no hipocampo
(TOZUKA, et al.,2010).
Tomados em conjunto, esses dados sugerem que a obesidade durante a gravidez
interfere no desenvolvimento do Sistema Nervoso Central dos filhotes e, que esse fenômeno
16
1.2. Obesidade Materna e Prematuridade
A prematuridade teve um aumento significativo nos últimos anos e é dependente da
idade gestacional (IG), mas é multifatorial. Mesmo havendo a implantação de políticas de
assistência e de acompanhamento obstetrícia por parte dos governos de diversos países, esse é
um evento que não sofreu redução, mesmo em países desenvolvidos. Infecções maternas
possuem a maior predominância como causa do nascimento prematuro, como também o
estresse e a distensão abdominal (DEMARTINI, BAGATIN & BOGUDZEWAKI, 2011). O
parto prematuro espontâneo está diretamente relacionado ao histórico familiar da mãe e ao
baixo nível econômico, sendo assim, entre 40% e 50% nascimentos prematuros são
considerados de causas desconhecidas (DEMARTINI, BAGATIN &
BOGUDZEWAKI,2011).
A Síndrome Metabólica (SM) também pode estar envolvida no aumento da
prematuridade, devido às doenças cardiovasculares, diabetes e infecções que são ocasionadas
pela alimentação desregrada e rica em gordura (DAMIANI, et al., 2011). Desta forma,
mulheres com sobrepeso e obesas, possuem o risco maior de parto prematuro, nascimento
pré-termo induzido e aumento do risco de parto prematuro antes de 33 semanas (NOMURA,
2012). Quanto mais pesada a mulher, maior o risco de pré-termo precoce, assim como
também é maior o risco de ter um bebê de peso extremamente baixo ao nascer (COSTA &
SILVA, 2011; YESSOUFOU & MOUTAIROU, 2011). Há avanços contínuos na terapia
intensiva dos neonatos, levando a diminuição da mortalidade que, na sua maioria, possuem
peso de nascimento e idade gestacional inferior, comprometendo a qualidade de vida, seu
crescimento e o desenvolvimento neuropsicomotor (DEMARTINI, BAGATIN &
17
No período de desenvolvimento da criança, identificar o excesso de peso durante o
crescimento é de grande importância por constituir um grande risco de sobrepeso e obesidade
na vida adulta, afinal a obesidade infantil está correlacionada com fatores de risco comuns na
idade adulta para doenças crônicas como a diabetes, doença cardiovascular, e outras
morbidades. Como também, há uma forte correlação do excesso de gordura visceral
abdominal e uma moderada correlação de deposição no músculo esquelético e hepática de
lípidos (BOUCHARD, 2009; DUARTE & SILVA).
1.3. BDNF e o desenvolvimento
O BDNF é um membro da família das neurotrofinas (NT), juntamente com o fator de
crescimento do nervo (NGF) e as neurotrofinas-3 e -4/ 5 (NT-3 e NT-4/5), que é constituída
por pequenas proteínas que desempenham importante papel no desenvolvimento do sistema
nervoso em vertebrados. Uma característica comum de organização do gene nesta família é a
existência de um exon de codificação única cuja expressão é complexa devido à
multiplicidade do promotor e por splicing alternativo de transcritos.
As várias funções de BDNF são significativas no sistema nervoso periférico (PNS) e
do sistema nervoso central (SNC), exercendo proliferação, diferenciação e sobrevivência de
efeitos, bem como funções de execução essenciais para sustentar os processos normais de
comportamento.
BDNF desempenha um papel chave na regulação da atividade sináptica, na
neurotransmissão e na plasticidade em muitos grupos de neurônios maduros.
Na obesidade sua importância está atrelada ao desenvolvimento neurológico,
plasticidade sináptica e tem papel importante em processos de aprendizagem e memória. Há
18
energia (NOBLE et al., 2010) . Por exemplo, os baixos níveis circulantes de BDNF têm sido
encontrados em indivíduos com obesidade e diabetes tipo 2 (DAVIDSON et al.,2009), bem
como uma relação inversa entre a concentração de BDNF periférica e índice de massa
corporal (IMC) em crianças e adultos (DAVIDSON et al.,2005). No entanto, em humanos
com diabetes tipo 2, os níveis plasmáticos de BDNF são mais baixos independentemente da
obesidade, sugerindo que o BDNF pode regular a obesidade e resistência à insulina através de
mecanismos diferentes (SCHWARTZ &MOBBS, 2012).
1.4. Hormônio Tireoidiano e Sistema Nervoso Central
Os produtos sintetizados pela tireoide, que incluem a 3,5,3’-triiodotironina (T3) e a
3,5,3’,5’-tetraiodotironina ou tiroxina (T4), requerem a presença de quantidades adequadas de
iodo, que oscilam entre 100 a 150 µg/dia em um indivíduo adulto (LARSEN; DAVIES; HAY,
1999). Na maior parte do mundo há pequenas quantidades de iodo nos alimentos devido a sua
escassez no solo (GRANNER, 2003). Uma maneira simples e eficiente de se evitar a
deficiência de iodo e a ocorrência de bócio endêmico foi a implantação de política pública de
se acrescentar o iodo no sal de cozinha.
Em seres humanos o principal produto da tireoide é o T4. No entanto, o T3 é a forma
biologicamente ativa que se liga ao seu receptor, fazendo do T4 apenas um pró-hormônio
(CATALDO et al., 2001). Menos de 20% do total de T3 circulante é oriundo da secreção
direta pela glândula (MEDEIROS-NETO; KNOBEL, 1992) sendo a maior parte derivada da
desiodação do anel externo da molécula de T4 nos tecidos por ação de enzimas chamadas
19
A desiodação do hormônio tireoidiano é dependente das desiodases do tipo I, II e III
(D1, D2, D3, respectivamente). Essas três enzimas constituem um grupo de proteínas que
podem ativar ou inativar o hormônio da tireoide. D1 e D2 agem ativando o pró-hormônio T4
em T3. A D1 é considerada cineticamente menos eficiente quando comparada à D2 e seu
papel ainda não está muito claro. (BIANCO & KIM, 2006). A D2 é encontrada na tireoide,
cérebro, hipófise anterior, gordura marrom, coração, músculo esquelético e placenta e parece
ser a principal responsável pelo T3 circulante (BIANCO & KIM, 2006).
Em contraste, a desiodase tipo III (D3), previne a ativação do T4, convertendo-o em
T3 reverso (rT3) e transformando T3 em T2, que são consideradas formas inativas do
hormônio, o que confere à D3 o papel único de causar hipotireoidismo local, ou seja, apenas
em alguns tecidos específicos. A D3 pode ser encontrada no cérebro, pele, intestino, útero e
placenta. Embora seja expressa em poucos tecidos na vida pós-natal, é vastamente observada
em pacientes criticamente doentes, durante inflamação crônica e em hipóxia e sua atividade
está associada à redução de T3 sistêmico (FISHER, 1990; BURROW et AL., 1994;
SIMONIDES, W.S., et al 2008).
Os hormônios tireoidianos produzidos pela mãe durante a gravidez, especialmente
tiroxina (T4), são cruciais para o desenvolvimento do cérebro no início da fase embrionária de
mamífero. Estudos epidemiológicos e relatos de caso têm mostrado que o hipotireoidismo
subclínico materno pode resultar em efeitos negativos significativos na gravidez e
desenvolvimento neurológico do feto. Filhotes de ratas com hipotiroidismo subclínico
mostram déficits na memória de longo e de curto prazo.
Além disso, esses animais também apresentam níveis reduzidos de RNAm para o gene
do BDNF assim como a expressão do próprio BNDF no hipocampo, o que pode explicar o
20
Assim, é razoável supor que as alterações observadas nos filhotes de grávidas obesas
podem estar relacionadas a variações no conteúdo de T3 disponível no Sistema Nervoso
Central, que levariam a mudanças na expressão do BNDF com consequente prejuízo nos
processos de aprendizado e memória.
O balanço energético positivo causado pela ingestão prolongada de HFD induz à
hiperativação do eixo hipotálamo-hipófise-tireoide, caracterizada por elevações do TRH
hipotalâmico, aumento na captação de iodeto pela tiróide e aumento dos níveis plasmáticos de
TSH. No entanto, os níveis de T3 e T4 permanecem normais sugerindo uma alteração na
atividade das desiodases. De fato, a atividade da desiodase do tipo 1 no fígado encontra-se
aumentada no fígado e no rim com consequente elevação dos níveis de rT3 (ARAUJO et al.,
2010). É possível que o aumento da atividade do eixo HPT leve ao aumento na atividade da
atividade da D3.
Assim, a hipótese deste trabalho contemplou a possibilidade de que durante a obesidade
materna observe-se aumento na expressão da enzima desiodase do tipo III no cérebro dos
filhotes, com consequente redução dos níveis de T3. De modo que o hipotireoidismo local
possa estar envolvido com os prejuízos nos processos de aprendizado e memória observados
nos filhotes de mães obesas.
2. OBJETIVO
Avaliar a expressão da enzima desiodase do tipo III (DIII) e o índice do BDNF presente no
21
3. MATERIAL E MÉTODOS
3.1. Animais e procedimentos de alimentação
Os procedimentos foram realizados sob a autorização do Conselho de Ética da
Universidade Presbiteriana Mackenzie, Processo CEUA/UPM Nº 089/03/2012 (anexo 1).
Foram utilizadas 10 ratas fêmeas Wistar, com 2 meses de vida alojadas em gaiolas
de plástico e submetidas a um ciclo 12h claro/escuro, na temperatura de 22°C e acesso ad
libitum à água e comida divididas nos seguintes grupos:
Controle (n=10): Ratas alimentadas com ração padrão
Experimental (n=10): Ratas alimentadas com dieta rica em gordura (40%) por 1 mês
para o desenvolvimento da obesidade.
Após esse período as ratas foram expostas a ratos machos para o acasalamento.
As fêmeas foram acompanhadas para observação do dia da fecundação e separadas
em gaiolas individuais. O peso corporal das ratas foi avaliado diariamente até o dia do
nascimento dos filhotes. O peso corporal dos filhotes foi determinado desde o nascimento até
o final dos protocolos experimentais.
Cada rata permaneceu com apenas 6 filhotes e os filhotes excedentes foram
eutanasiados por excesso de anestésico injetável (uretana). Os protocolos experimentais
22
3.2. Procedimento experimental:
Quantificação da D3 por Western blot: Aos 7 dias de idade, 2 filhotes de cada
fêmea foram anestesiados com Uretana (1200 mg/kg) e o cérebro foi removido e
imediatamente congelado para a quantificação da desiodase do tipo 3 por Western
blotting, a fim de determinar se a obesidade materna eleva a expressão da D3 nos
seus filhotes. O mesmo procedimento foi realizado para os animais de 10 dias e 16 dias.
Neste experimento iremos utilizar 20 animais.
Western blot: 20 mg de proteínas foram submetidas à corrida eletroforética em gel de
poliacrilamida para separação, de acordo com o peso molecular, sem perda de
unidades protéicas. O processo envolveu um sistema descontínuo de dois géis contíguos com
concentrações diferentes: o primeiro gel, o gel de resolução [stacking gel – 5% (acrilamida
5%; bisacrilamida 0,5%; stacking buffer – TRIS Buffer 0,125 M; SDS 1% pH 6,8;
Temed 0,025% e persulfato de amônio 0,025%)] e o segundo gel, o gel de separação [running
gel –10% (acrilamida 30%; bisacrilamida 0,8%; running buffer – TRIS Base 0,375 M pH 8,8;
SDS 0,1%; Temed 0,025% e persulfato de amônia 0,025%)] onde as proteínas foram
separadas de acordo com seus pesos moleculares. As amostras foram solubilizadas em
tampão contendo SDS 2%; glicerol 10% TRIS Base 0,0625 M pH 6,8; bromofenol blue
0,001% e 2- mercaptoentanol 5%. O tampão de corrida utilizado consiste de TRIS Base
0,025M; glicina 0,192M e SDS 0,1%. Paralelamente às proteínas mitocondriais, correu-se um
marcador de peso molecular. A 5D3, de 31 kD, foi localizada, utilizando-se como
referência a proteína anidrase carbônica de 30 kD. As amostras foram então transferidas
eletroforeticamente para uma membrana de nitrocelulose (Immobilon, Millipore Co, Bedford
MA), usando tampão de transferência (Tris base 0.17M, glicina 0.17M, metanol a15%,
pH 8.3). A membrana foi incubada overnight com tampão Tris e solução bloqueadora 0.5 %,
23
usando-se um kit comercial de quimioluminescência para western blot (Roche
Molecular Biochemicals, Indianapolis IN), de acordo com as instruções do fabricante.
A intensidade do sinal foi medida por densitometria, usando-se um programa de imagem
NIH (Scientific Computing Resource Center).
Determinação dos níveis de BDNF no cérebro. A fim de confirmar que a obesidade
materna leva à redução dos níveis de BDNF nos filhotes, quantificamos por imunoensaio esse
fator neurotrófico. Assim, anestesiamos 2 filhotes de fêmeas controles e experimentais
distintas com uretana (1200mg/Kg) aos 7, 10 e 16 dias de vida para remoção do cérebro que
foi imediatamente congelado. A homogeneização do tecido foi preparada com tampão (pH
7,0) e centrifugada para a realização do imunoensaio. O número total de animais utilizados
em cada grupo está especificado nas figuras.
Procedimento de imunoensaio: O imunoensaio foi realizado de acordo com a tecnologia
Multiplex, utilizando-se kit comercial Milliplex map, baseada na tecnologia Luminex® x
MAP®, que utiliza código interno de cores em microesferas
com dois corantes fluorescentes. Através de concentrações precisas destes corantes, 100
conjuntos de esferas coloridas distintas podem ser criados, cada uma das quais é revestida
com umanticorpo de captura. Após o analito da amostra ser capturado pelo grânulo, um
anticorpo biotinilado de detecção é introduzido. A mistura de reacção é, em seguida,
incubadas com estreptavidina-PE conjugado, a molécula repórter, para completar a reacção na
superfície de cada microesfera. As microesferas passam através de um laser, que excita os
corantes internos que marcam o conjunto de microsferas. Um segundo laser excita PE, o
24
velocidade identifica cada microesfera individualmente e quantifica o resultado do sua
bioensaio com base nos sinais fluorescentes repórteres.
4. ANÁLISE ESTATÍSTICA
A significância estatística da diferença entre os valores médios dos grupos foi testada pela
Anova One-way, seguido do teste Student-Newman- Keuls para detectar diferenças entre os
grupos. Para a realização dos testes estatísticos e construção dos gráficos foi utilizado o
software Prisma (GraphPad Software, San Diego, CA, USA). Para todos os testes p<0,05 foi
considerado estatisticamente significante. Todos os resultados foram expressos como média e
25
5. RESULTADOS
No presente estudo nós avaliamos o efeito da obesidade materna sobre a expressão da
D3 e dos níveis de BDNF no cérebro dos filhotes. Para tanto, induzimos a obesidade em ratas
fêmeas por meio do tratamento com dieta rica em gordura (40%) por três semanas antes do
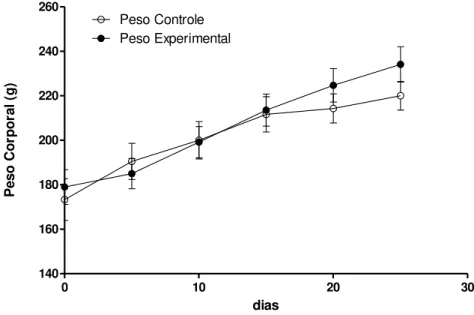
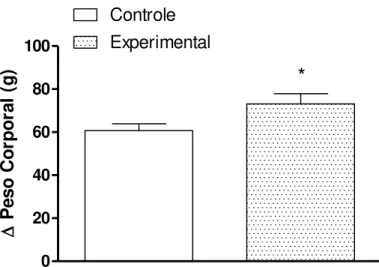
acasalamento. Como podemos ver nas Figuras 1 e 2, as fêmeas tratadas com dieta rica em
gordura engordaram significativamente mais do que as fêmeas do grupo controle no período
que antecedeu a fecundação. Uma vez estabelecida a obesidade nas ratas fêmeas, elas foram
acasaladas e, como podemos observar na Figura 3, o aumento de peso nas ratas obesas não foi
diferente do aumento do peso observado nas ratas controles, ou seja, a dieta rica em gordura
não levou a maior ganho de peso durante a gestação.
0 10 20 30
140 160 180 200 220 240 260 Peso Controle Peso Experimental dias P e s o Co rp o ra l (g )
26 0 20 40 60 80 100 Controle Experimental
*
P e s o C o rp o ra l (g )Figura 2. Variação do peso corporal das ratas controle e tratadas com dieta rica em gordura (40%) antes do acasalamento. Os valores estão expressos como média±EP. * vs. Controle com p< 0.008.
Dias
P
e
s
o
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 0 100 200 300 400 500 Controle Experimental
Figura 3. Peso corporal das ratas controle e tratadas com dieta rica em gordura (40%) durante a gestação. Os valores estão expressos como média±EP.
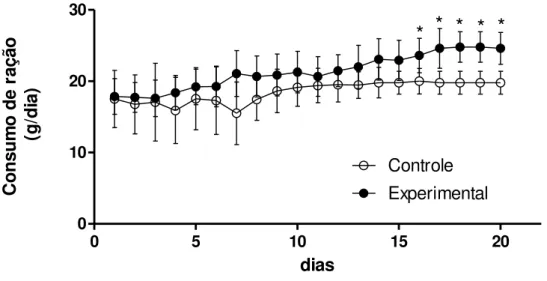
É intrigante o fato das ratas alimentadas com dieta rica em gordura apresentarem, ao
27
padrão. Seria de se esperar que esse aumento no consumo de ração hipercalórica resultasse em
maior ganho de peso corporal, mas isso não foi observado.
0 50 100 150 Controle Experimental P e s o Co rp o ra l (g )
Figura 4. Variação do peso corporal das ratas controle e tratadas com dieta rica em gordura (40%) ao longo da gestação. Os valores estão expressos como média±EP.
0 5 10 15 20
0 10 20 30 Controle Experimental
*
* *
*
*
dias Co n s u m o d e r a ç ã o ( g /d ia )Figura 5. Consumo de ração das ratas controle e alimentadas com dieta rica em gordura (40%) ao longo da gestação. Os valores estão expressos como média±EP. * vs. Controle com p< 0.0001.
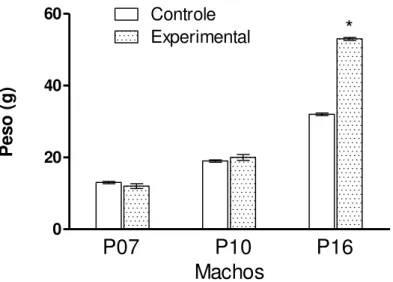
Como podemos observar na Figura 6, os filhotes de mães obesas não apresentam
aumento no peso corporal a não ser no 16° dia de vida. O mesmo aconteceu com os filhotes
28 0 20 40 60 Controle Experimental
P07 P10 P16
*
P e s o ( g )Machos
Figura 6. Peso corporal dos filhotes machos das mães controle e mães obesas aos 7, 10 e 16 dias de vida pós-natal. Os valores estão expressos como média±EP. * vs. P16 controle com p<0.001.
0 10 20 30 40 50 Controle Experimental
P07 P10 P16
*
P e s o ( g )Fêmeas
Figura 7. Peso corporal dos filhotes fêmeas das mães controle e mães obesas aos 7, 10 e 16 dias de vida pós-natal. Os valores estão expressos como média±EP. * vs. P16 controle com p<0.001.
Como não fizemos o esfregaço nas fêmeas para determinar a data da fecundação, não
podemos incluir se houve algum caso de prematuridade. Mas três ninhadas de ratas obesas
apresentaram morte de neonatos, mas não observamos isso nos animais controles. Além disso,
em uma ninhada houve o óbito de um filhote que estava bem abaixo do peso em relação aos
29
Umas das alterações no cérebro de animais obesos descritas na literatura é a menor
expressão de BDNF (TOZUKA et al,.2010). Assim, nós nos perguntamos se a obesidade
materna poderia influenciar os níveis desse fator de crescimento nos seus filhotes. Para tanto,
nós medimos o BDNF no cérebro dos filhotes nos dia 07, 10 e 16 de vida pós-natal. Como
podemos observar nas Figuras 8 e 9, tanto filhotes machos quanto fêmeas apresentam
tendência de diminuição nos níveis de BDNF, mas sem significância estatística. É possível
que com um número maior de animais pudéssemos observar queda significativa.
0 100 200 300 400
500 Controle
Experimental
P07
P10
P16
Machos
BD
NF
(
g
/m
l)
30
BDNF
0 100 200
300 Controle
Experimental
P07
P10
P16
Fêmeas
Figura 9. Medida da concentração de BDNF em homogenato de cérebro de filhotes fêmeas de mães controle e obesas aos 07, 10 e 16 dias de vida pós-natal. Os valores estão expressos como média±EP.
A principal pergunta do presente estudo foi a se os níveis de D3 estariam alterados em
filhotes de mães obesas. Assim, medimos por Western blot a expressão dessa enzima no
cérebro dos filhotes a fim de tentar responder a essa questão.
Como podemos observar nas figuras 10,11 e 12 existe uma queda na expressão da D3
nos filhotes fêmeas de mães obesas ao 07º dia de vida pós-natal. No entanto, não se observa
esse efeito aos 10º e 16º dias de vida pós-natal. Embora nossos dados sejam ainda
preliminares, parece que a obesidade materna leva a alterações na expressão da D3, que leva a
alterações nas quantidades locais de T3 disponíveis no cérebro.
Além disso, há a constatação recente que a obesidade materna pode modular a
formação de circuitos neurais, interferindo diretamente no desenvolvimento do Sistema
Nervoso Central da criança (WRIGHT, EVANS & VOIGT, 2011). Estudos recentes têm
relatado que filhos de mães obesas mostram anormalidades no desenvolvimento do circuito
neural (TOZUKA et al., 2009b).
O fator neurotrófico derivado do cérebero (BDNF) desempenha um papel importante
31
abundantemente expressa no hipocampo. Evidências sugerem que reduções nos níveis de
BDNF interferem com potenciais de longa duração (LTP) e neurogênese (BINDER &
SCHARFMAN, 2004; MATTSON, 2008). Recentemente demonstrou-se que os neurônios
recém formados podem contribuir para a função do hipocampo, constituindo um possível
mecanismo celular para a aprendizagem e memória (SHORS et al, 2001;. SAXE et al, 2006;.
ZHANG et al, 2008;. DUPRET et al, 2008;. FARIOLI-VECCHIOLI et al, 2008;. IMAYOSHI
et al, 2008).
0.0
0.5
1.0
1.5
Fêmea Controle 07
Fêmea Experimental 07
Macho Controle 07
Macho Experimental 07
*
DI
O
3
(
u
a
)
*
32
0
600
1200
Fêmea Controle 10
Fêmea Experimental 10
Macho Controle 10
Macho Experimental 10
D
IO
3
(
u
a
)
Figura 11. Medida da expressão de D3 por western blot de homogenato de cérebro de filhotes de mães controle e obesas aos 10 dias de vida pós-natal. Os valores estão expressos como média±EP.
0
500
1000
Fêmea Controle 16 Fêmea Experimental 16 Macho Controle 16 Macho Experimental 16
DI
O
3
(
u
a
)
33
6. DISCUSSÃO
A obesidade está relacionada com diversas alterações sistêmicas que são chamadas em
conjunto de Síndrome Metabólica (SM). A SM é caracterizada por adiposidade central,
hiperglicemia, dislipidemia, diabetes tipo 2 e esteatose hepática.
Recentemente a obesidade materna tem sido relacionada com alterações
neurofisiológicas que resultam em prejuízos nas funções cognitivas e de memória da criança
(WRIGHT, EVANS & VOIGT, 2011). De fato, filhotes de ratas obesas mostram
anormalidades no desenvolvimento do circuito neural principalmente em hipocampo
(TOZUKA et al., 2009b).
Um fator muito importante no desenvolvimento do SNC é o hormônio tiroideano. Sua
disponibilidade local é regulada pelas enzimas desiodases que são capazes de ativar o T4 em
T3 ou inativar o T4 em r T3 e o T3 a T2. No presente estudo nós avaliamos a expressão da
enzima desiodase do tipo 3, D3, no cérebro de filhotes de mães obesas em diferentes idades
de vida pós natal a fim de determinar a condição de obesidade materna leva a flutuações no
níveis locais de T3 que poderiam estar envolvidas nas alterações dos circuitos cerebrais
descritas na literatura (SHARMAR&FULTON, 2012).
Ao contrário do que esperávamos, houve redução na expressão da D3 no cérebro aos
07 dias de vida pós-natal, o que pode ser responsável pela menor inativação do T4 a rT3. É
possível que o aumento do T3 local durante fases críticas do desenvolvimento do SNC esteja
envolvido nas alterações observadas nos circuitos neurais do hipocampo de filhotes de maes
obesas. É sabido que o hipertiroidismo materno também resulta em alterações severas no
desenvolvimento do SNC (AHMED et al,.2012).
Sabe-se que os níveis de T3 ao longo do desenvolvimento do SNC apresenta
34
3. Se a obesidade materna altera a expressao da D3, então também teremos mudanças nos
niveis locais de T3, podendo resultar em modificações neurofisiologias importantes. No
entanto, não podemos descartar um possível envolvimento da D2. A expressão ou atividade
dessa enzima não foi avaliada no presente estudo. Se nos animais estudados houve diminuição
concomitante na atividade da D2, os níveis de T3 estariam normalizados, uma vez que a D2
ativa o T4 em T3. Assim, mais experimentos precisam ser realizados para confirmar esses
dados.
Nos dias 10 e 16 de vida pós natal não foram encontradas diferenças significativas na
expressão da D3. Sabe-se que nas fases mais tardias do desenvolvimento do SNC, a expressão
da D3 cai significativamente e sua importância nessa fase diminui. Talvez por isso não
tenhamos detectado alterações na expressão dessa enzima
No modelo estudado nao conseguimos mostrar alterações significativas nos niveis de
BDNF no cérebro dos filhotes de ratas obesas, apesar de haver clara tendência de queda tanto
em filhotes fêmeas quanto em machos em todos os dias de vida estudados. Talvez a obesidade
induzida no nosso modelo nao tenha sido suficiente para levar à alterações mensuráveis nos
níveis de BDNF. Ou ainda, a metodologia empregada, medida da expressão da D3 por
Western blot em homogenato do cérebro inteiro, não seja refinada o suficiente para detectar as
variações induzidas pela obesidade. Além disso, a análise no cérebro inteiro e não em regiões
específicas como o hipocampo, também podem prejudicar a análise dos resultados.
É necessário que outros experimentos sejam feitos em ratas com obesidade mais
severa e por mais tempo antes do acasalamento. De fato, esse seria um modelo mais adequado
por replicar mais fidedignamente o que se observa na população de humanos e deve ser
testado no futuro próximo.
Quando analisamos os pesos dos filhotes notamos que aos 07 e 10 dias não há
35
Portanto, no nosso modelo, não encontramos efeitos da obesidade materna sobre o peso dos
filhotes até o 10 dia de vida. No entanto, em animais mais velhos aos 16 dias de vida
pós-natal, tanto machos quanto fêmeas, apresentaram ganho significativo de peso quando
comparados aos animais filhos de maes tratadas com dieta padrão. Assim, é possível que a
obesidade materna tenha influência sobre o peso corporal dos filhotes nas fases mais tardias.
Outra possibilidade, no entanto, é dos filhotes estarem se alimentando da dieta da mãe. Isso
levaria ao aumento do peso corporal independente do peso materno.
Conclusão: A obesidade materna reduz a expressão da enzima D3 no SNC dos seus filhotes.
Esse aumento na ativadade da D3 pode levar a maior disponibilidade de T3 no SNC. Esse
“hipertiroidismo” local pode estar envolvido nas alterações dos circuitos neurais do filhotes
36
Referências Bibliográficas
ALBERTI, K.G., ZIMMET, P., and SHAW, J. The metabolic syndrome--a new worldwide definition. Lancet 366:1059-1062, 2005.
ALLEN LH. Multiple micronutrients in pregnancy and lactation: an overview. Am J Clin Nutr.; 81 (Supl): S1206-S12, 2005.
AHMEDA, O.M., AHMEDB, R.G., GAREIBC, A.W. El, BAKRYB, A.M, EL-TAWABA, A. Effects of experimentally induced maternal hypothyroidism and
hyperthyroidism on the development of rat offspring: II—The developmental
pattern of neurons in relation to oxidative stress and antioxidant defense system. International Journal of Developmental Neuroscience, 2012.
AMER, E.; WESTERMARK, P.O; SPALDING, K. L.; BRITTON, T.; RYDÉN. M.; FRISÉN, J.; BERNARD, J. and AMER, P. Adipocyte Turnover: Relevance to Human Adipose Tissue Morphology. Diabetes. 2010. January; 59(1): 105–109.
ARAUJO, R.L; ANDRADE, B.M.; PADRÓN, A.S.; GAIDHU M.P, PERRY, R.L.; CARVALHO D.P. and CEDDIA, R.B. High-fat diet increases thyrotropin and oxygen consumption without altering circulating 3,5,3'-triiodothyronine (T3) and thyroxine in rats: the role of iodothyronine deiodinases, reverse T3 production, and whole-body fat oxidation. Endocrinology. 2010 Jul;151(7):3460-9.
CASTRO, M. B. T., KAC, G. e SICHIERI, R..Determinantes nutricionais e sócio-demográficos da variação de peso no pós-parto: uma revisão da literatura. Rev. Bras. Saúde Matern. Infant., Recife, 9 (2): 125-137, abr. / jun, 2009
37
DAMIANI, D., KUBA, V.M., COMINATO, L., DAMIANI, D., DICHTCHEKENIAN, V. e MENEZES FILHO, H.C. Síndrome metabólica em crianças e adolescentes: Dúvidas na terminologia, mas não nos riscos cardiometabólicos. Arq. Bras. Endocrinol Metab. 2011; 55/8.
DAVIDSON TL, CHAN K, JARRARD LE, KANOSKI SE, CLEGG DJ, BENOIT
SC. Contributions Of The Hippocampus And Medial Prefrontal Cortex To Energy And Body Weight Regulation. Hippocampus 19: 235–252, 2009.
____________, KANOSKI SE, WALLS EK, JARRARD LE. Memory Inhibition And Energy Regulation. Physiol Behav 86: 731–746, 2005.
____________, MCKERNAN MG, JARRARD LE. Hippocampal Lesions Do Not Impair Negative Patterning: A Challenge To Configural Association Theory. BEHAV NEUROSCI 107: 227–234, 1993.
DEMARTINI, A. A. C, BAGATIN, A.C, SILVA, R.P., BOGUDZEWAKI, M.C.S. Crescimento de crianças prematuras. Arq. Bras. Endocrinol Metab.2011
DODSON, M.V.; MIR, P.S.; HAUSMAN, G.J.; GUAN, L.L.; DU, M.; JIANG, Z.; FERMYHOUGH, M.E., and BERGEN, W.G. Obesity, metabolic syndrome, and adipocytes. J Lipids 2011:721686.
FAZIO, E. de S. Perfil nutricional de gestantes que recebem orientação dietética: avaliação do ganho ponderal materno total, tipo parto e resultados perinatais. Dissertação de Mestrado. Faculdade de Medicina da Universidade de São Paulo, 2010.
LIU D, TENG W, SHAN Z, YU X, GAO Y, WANG S, FAN C, WANG H, ZHANG H. The effect of maternal subclinical hypothyroidism during pregnancy on brain development in rat offspring. Thyroid. 2010 Aug;20(8):909-15.
38
MORAES, A.C.F. Fatores Associados à obesidade em adolescentes. Dissertação de Mestrado. Faculdade de Medicina da Universidade de São Paulo, 2011.
NOBLE, E.E., BILLINGTON, C.J, KOTZ, C.M and WANG, CH.F. The lighter side of BDNF. Am J Physiol Regul Integr Comp Physiol . 300: R1053–R1069, 2011.
NOMURA, R.M.Y, PAIVA, L.V, COSTA, V.N, WLIAO, A.W e ZUGAIB, M. Influência do estado nutricional materno, ganho de peso e consumo energético sobre o crescimento fetal, em gestações de alto risco. Rev Bras Ginecol Obstet. 2012; 34(3):107-12
RODRIGUEZ-SUAREZ, E.; DUCE, A.M.; CABALLERIA, J.; MARTINEZ ARRIETA, F.; FERNANDEZ, E.; GOMARA, C.; ALKORTA, N., ARIZ, U., MARTINEZ-CHANTAR, M.L., LU, S.C., et al. Non-alcoholic fatty liver disease proteomics. Proteomics Clin Appl
4:362-371.
SANTOS, L. R. da C.; RABINOVICK, E.P. Situações Familiares na Obesidade Exógena Infantil do Filho Único. Saúde Soc. São Paulo, v.20, n.2, p.507-521, 2011
SHARMA, S. and FULTON,S. Diet-induced obesity promotes depressive-like behaviour that is associated with neural adaptations in brain reward circuitry. International Journal of Obesity, 2012.
SCHWARTZ, E.& MOBBS, C. V. Hypothalamic BDNF and obesity: found in translation. Nature Medicine. Number 4, volume 18, 2012.
SUI L, LI BM. Effects of perinatal hypothyroidism on regulation of reelin and brain-derived neurotrophic factor gene expression in rat hippocampus: Role of DNA methylation and histone acetylation. Steroids. 2010 Dec;75(12):988-97.
39
TOZUKA,Y.; KUMON, M.; WADA, E.; ONODERA, M.; MOCHIZUKI, H. and WADA, K. Maternal obesity impairs hippocampal BDNF production and spatial learning performance in young mouse offspring. Neurochemistry International 57,(2010) 235- 247.
PERGHER, R.N.Q.; MELO, M.E.de.; HALPEM, A.; MANCINI, M.C. e LIGA DA OBESIDADE INFANTIL. Artigo de Revisão. Jornal de Pediatria - Vol. 86, Nº 2, 2010
YAMADA-GOTO, NOBUKO., KATSUURA, G., OCHI, Y., EBIHARA, K., KUSAKABE, T., HOSODA, K. and NAKAO, K.. Impairment of fear-conditioning responses and changes of brain neurotrophic factors in diet-induced obese mice. Journal of Neuroendocrinology, 2012
YESSOUFOU, AKADIRI AND MOUTAIROU, KABIROU. Maternal Diabetes in Pregnancy: Early and Long-Term Outcomes on the Offspring and the Concept of “Metabolic Memory”.
40
ANEXO 1