PATRÍCIA AMARAL SOUZA TETTE
ADESÃO DE Staphylococcus aureus EM SUPERFÍCIES E CONDIÇÕES DO
PROCESSAMENTO DE PRODUTOS CÁRNEOS.
Dissertação apresentada à Universidade Federal de Viçosa, como parte das exigências do Programa de Pós-Graduação em Ciência e Tecnologia de Alimentos para obtenção do título de Magister Scientiae.
VIÇOSA
PATRÍCIA AMARAL SOUZA TETTE
ADESÃO DE Staphylococcus aureus EM SUPERFÍCIES E CONDIÇÕES DO
PROCESSAMENTO DE PRODUTOS CÁRNEOS.
Dissertação apresentada à Universidade Federal de Viçosa, como parte das exigências do Programa de Pós-Graduação em Ciência e Tecnologia de Alimentos para obtenção do título de Magister Scientiae.
APROVADA: 30 de julho de 2010.
Profª. Maria Cristina Dantas Vanetti
(Co-orientadora) Prof. José Antonio Marques Pereira (Co-orientador)
Profª. Edimar Aparecida Filomeno Fontes Dra. Cláudia Lúcia de Oliveira Pinto
ii
Ao meu marido, pelo amor
incondicional, carinho
e compreensão.
iii
“... Sê forte e corajoso; não temas, nem te
espantes, porque o Senhor, teu Deus,
é contigo por onde quer que andares”.
iv AGRADECIMENTOS
Ao soberano Deus pelo amor, fidelidade e presença constante em minha vida. Toda honra e glória seja dada a ti!
À Universidade Federal de Viçosa, pela oportunidade concedida de realização deste curso.
Ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) pelo apoio financeiro.
À Professora Regina Célia Santos Mendonça pela orientação, amizade, confiança, oportunidade de aprendizado e crescimento.
À professora Maria Cristina Dantas Vanetti pela amizade, ensinamentos, incentivo, preciosas sugestões e participação na banca examinadora.
Ao professor José Antonio Marques Pereira pelas sugestões, contribuições com o trabalho e participação na banca examinadora.
À professora Edimar Aparecida Filomeno Fontes e a Dra Cláudia Lúcia de Oliveira Pinto (EPAMIG) pelas sugestões e participação na banca examinadora.
À minha linda família... Minha querida mãe, Eunice, pelo infinito amor, incentivo, orações e compreensão. Meu pai, José Luiz, pelo amor, apoio e orações. Aos meus irmãos, Edmilson e Rodrigo, pelo carinho, amizade, exemplo e pelos suportes em informática. Amo vocês!
Ao meu super marido, Wálmiron Tette, pelo amor incondicional, pelas oportunas palavras de apoio, pelo respeito, compreensão e companheirismo. Sem você essa trajetória seria muito difícil. Obrigada por tornar tudo na minha vida mais simples e mais feliz. Te amo!
v Ao Raphael e a Mary Hellen pela sensacional ajuda nos experimentos em biologia molecular. Não sei como agradecer vocês...
À minha família em Viçosa, grandes amigas, Fatinha, Andréia, Ana Cláudia e Lívia pelas conversas, risadas e por tornarem minha estadia em Viçosa muito mais feliz.
Às amigas Ana Carolina e Élida pela ajuda no experimento, momentos de descontração, passeios pelas lojas da cidade e pela alegria contagiante.
À todos os amigos do Laboratório de Microbiologia de Patógenos de Origem Alimentar e Hídrica (LAMPOAH): Márcia, Andreza, Humberto, Arthur, Micaela, Luiz Augusto, Delaine, Daniela, Flávia, Ariana, Isabelle e Janaína, pela amizade, momentos vividos, pela colaboração na execução do experimento e parceria nos trabalhos.
À família da minha cunhada Luciane, Sr. Geraldo, Dona Graça, Darlan e Júnior, pelo carinhoso acolhimento em minha chegada em Viçosa e durante todo o período do curso.
Aos meus vizinhos em Itabirito, Sirlene, Reinaldo e Pedrinho, por toda generosidade e carinho.
À grande amiga Ana Iris pela força, companhia nos estudos e sugestões na redação da dissertação. Sou sua fã!
Ao professor José Ivo pelos esclarecimentos quanto às análises estatísticas.
À professora Andréia Ribon por disponibilizar o Laboratório de Biotecnologia Molecular (LBM) para realização de parte do experimento.
Ao Professor Daniel Assis (ICB/UFMG), pela amizade, incentivo, correções da dissertação e por ser exemplo de professor e pesquisador.
À professora Patrícia Cisalpino (ICB/UFMG) e a todos os pesquisadores do Laboratório de Interação Micro-organismo Hospedeiro (LIMHO), em especial ao Marco Aurélio pela paciência no ensino de técnicas de biologia molecular.
À toda a equipe da Agrogenética, em especial a Néia e o Darlan pela disposição em ajudar.
Aos funcionários do Departamento de Tecnologia de Alimentos pela amizade e colaboração.
vi BIOGRAFIA
Patrícia Amaral Souza Tette, filha de José Luís de Souza e Maria Eunice do Amaral Souza, nasceu em 13 de abril de 1985, na cidade de Santa Bárbara, Minas Gerais.
vii SUMÁRIO
LISTA DE FIGURAS ... ix
LISTA DE TABELAS ... x
RESUMO ... xi
ABSTRACT ... xiii
1.INTRODUÇÃO ... 1
2. REVISÃO DA LITERATURA ... 3
2. 1. Staphylococcus aureus ... 3
2. 1. 1. Características de S. aureus ... 3
2. 1. 2. Intoxicação alimentar estafilocócica ... 3
2. 2. Fatores que interferem no comportamento de S. aureus ... 5
2. 2. 1. Temperatura ... 5
2. 2. 2. pH ... 6
2. 2. 3. Nitrito de sódio ... 7
2. 2. 4. Cloreto de sódio ... 8
2. 3. S. aureus na indústria de produtos cárneos ... 9
2. 3. 1. S. aureus em produtos cárneos fermentados ... 11
2. 4. Adesão e formação de biofilmes ... 12
2. 5. Genes envolvidos na adesão e formação de biofilme ... 14
2. 6. Superfícies utilizadas no processamento de alimentos ... 16
2. 7. Microbiologia preditiva ... 18
2. 8. Metodologia de Superfície de Resposta ... 20
3. MATERIAIS E MÉTODOS ... 22
3. 1. Planejamento experimental ... 22
3. 1. 1. Delineamento experimental ... 22
3. 1. 2. Modelo estatístico ... 24
3. 2. Procedimentos experimentais ... 24
3. 2. 1. Manutenção e ativação de S. aureus ... 24
3. 2. 2. Superfícies avaliadas ... 24
3. 2. 3. Preparo dos cupons... 25
3. 2. 4. Preparo dos meios de cultura ... 25
3. 2. 5. Suspensão do micro-organismo ... 26
3. 2. 6. Determinação da adesão de S. aureus ... 26
3. 3. Validação do modelo ... 27
3. 4. Análise da expressão gênica de S. aureus ... 28
3. 4. 1. Extração do RNA total ... 29
3. 4. 2. Quantificação do RNA e tratamento com Dnase ... 30
3. 4. 3. Síntese de cDNA ... 30
3. 4. 4. PCR quantitativo em tempo real ... 31
viii
4. 1. Adesão de S. aureus em aço inoxidável ... 32
4. 2. Adesão de S. aureus em poliuretano ... 35
4. 3. Adesão de S. aureus em cloreto de polivinila ... 38
4. 4. Modelo da adesão de S. aureus ... 43
4. 5. Validação do modelo ... 45
4. 6. Expressão gênica em S. aureus ... 49
5. CONCLUSÃO ... 52
6. REFERÊNCIAS BIBLIOGRÁFICAS ... 53
ix LISTA DE FIGURAS
Figura 1. Gráficos de superfície de resposta (1a, 1c e 1e) e de contorno (1b, 1d e
1f) da adesão de S. aureus em superfície de aço inoxidável 304 (AIN):
1a e 1b) temperatura em função do tempo de contato, onde o pH do tratamento foi mantido constante em 6,25; 1c e 1d) pH em função do tempo de contato, onde a temperatura do tratamento foi mantida
constante à 35 oC; 1e e 1f) temperatura em função do pH, onde o tempo
de contato do tramento foi mantido constante por 6h... 33
Figura 2. Gráficos de superfície de resposta (2a, 2c e 2e) e de contorno (2b, 2d e
2f) da adesão de S. aureus em superfície de poliuretano (PU): 2a e 2b)
pH em função da concentração de NaCl, onde tempo de contato do tratamento foi mantido constante em 6 h; 2c e 2d) concentração de NaCl em função do tempo de contato, onde o pH do tratamento foi mantido constante em 6,25; 2e 2 2f) pH em função do tempo de contato, onde a concentração de NaCl do tratamento foi mantida constante em 4 %. .... 36
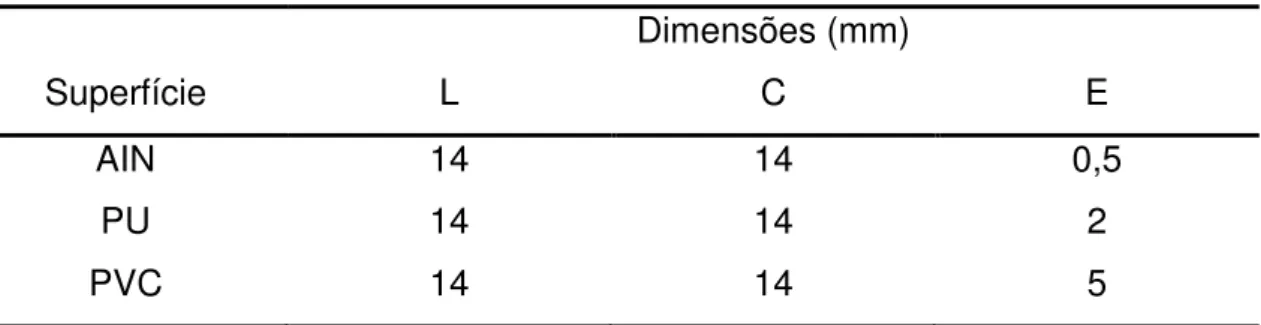
Figura 3. Gráficos de superfície de resposta (3a, 3c e 3d) e de contorno (3b, 3d e
3f) da adesão de S. aureus em superfície de cloreto de polivinila (PVC):
3a e 3b) temperatura em função do pH, onde a concentração de NaCl (4 %) e o tempo de contato (6 h) do tratatamento foram mantidos constantes; 3c e 3d) temperatura em função da concentração de NaCl, onde o pH (6,25) e o tempo de contato (6h) do tramento foram mantidos constantes; 3e e 3f) temperatura em função do tempo de contato, onde o pH (6,25) e a concentração de NaCl (4 %) do tratamento foram mantidos constantes. ... 39
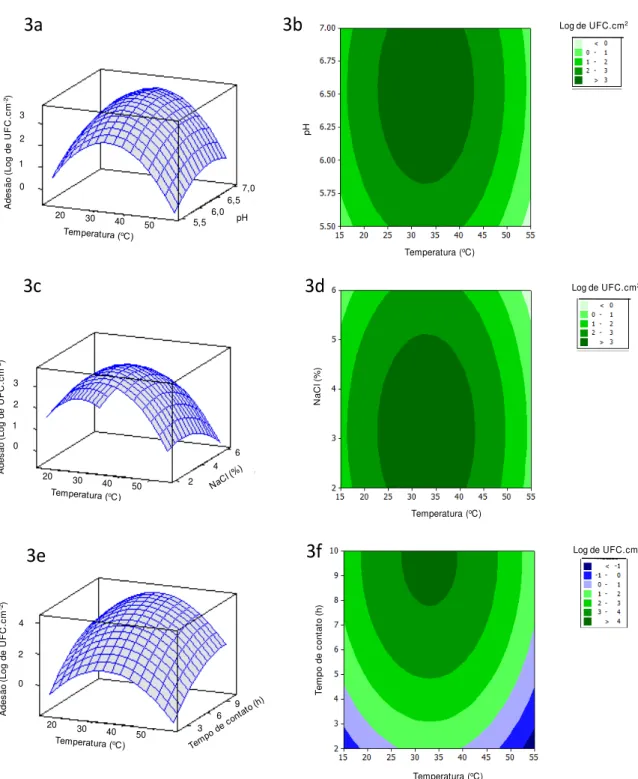
Figura 4. Gráficos de superfície de resposta (4a, 4c e 4e) e de contorno da adesão
de S. aureus em superfície de cloreto de polivinila (PVC): 4a e 4b)
concentração de NaCl em função do pH, onde a temperatura (35 oC) e o
tempo de contato (6h) foram mantidos constantes; 4c e 4d) pH em
função do tempo de contato, onde a temperatura (35 oC) e a
concentração de NaCl (4 %) foram mantidas constantes; 4e e 4f) concentração de NaCl em função do tempo de contato, onde a
temperatura (35 oC) e o pH (6,25) foram mantidos constantes... 42
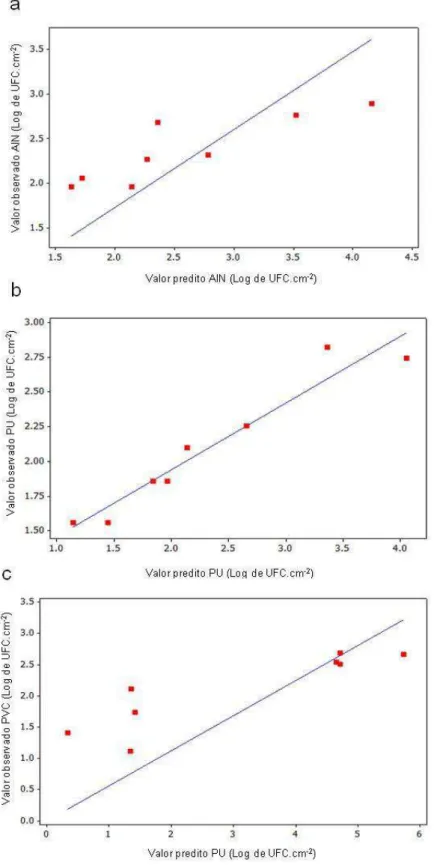
Figure 5. Comparação entre os valores observados e os valores preditos da
adesão de S. aureus sobre as superfícies de a) aço inoxidável (AIN); b)
poliuretano (PU) e c) cloreto de polivinila (PVC). ... 48
Figura 6. Expressão dos genes icaD (a) e icaR (b) em S. aureus quando
submetidos a diferentes tratamentos. O tratamento a 35 oC foi utilizado
x LISTA DE TABELAS
Tabela 1. Delineamento experimental Box-Behnken utilizado na avaliação da
adesão de S. aureus em função dos fatores temperatura, pH, NaCl,
NaNO2 e tempo de contato ... 23
Tabela 2. Dimensões dos cupons utilizados para avaliar a adesão de S. aureus .. 25
Tabela 3. Experimento de validação do modelo gerado para as superfícies de aço inoxidável, poliuretano e cloreto de polivinila. ... 28
Tabela 4. Oligonucleotídeos iniciadores utilizados para a avaliação da expressão
gênica de S. aureus. ... 29
Tabela 5. Equação de regressão do modelo ajustado das superfícies: aço inoxidável, poliuretano e cloreto de polivinila. ... 43
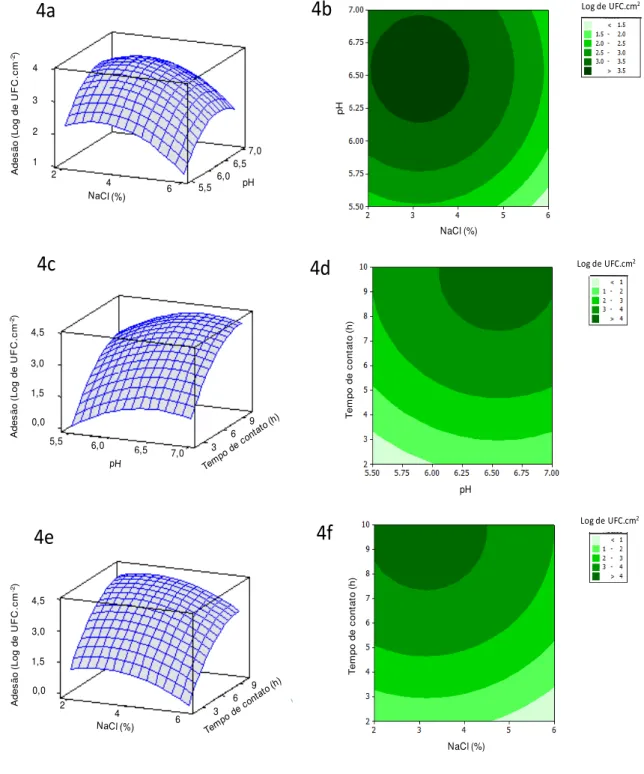
Tabela 6. Combinação dos fatores estudados que maximizam e minimizam a
adesão de S. aureus sobre as superfícies de processamento de
alimentos ... 44
Tabela 7. Valores observados e preditos da adesão de S. aureus em superfícies de
aço inoxidável, poliuretano e cloreto de polivinila sob diferentes condições utilizadas na validação do modelo de superfície de resposta. ... 46
Tabela 8. Avaliação matemática do modelo de superfície de resposta gerado com
base nos dados da adesão de S. aureus em superfícies de aço
xi RESUMO
TETTE, Patrícia Amaral Souza, M.Sc., Universidade Federal de Viçosa, julho de 2010. Adesão de Staphylococcus aureus em diferentes superfícies e
condições utilizadas no processamento de produtos cárneos. Orientador:
Regina Célia Santos Mendonça. Co-orientadores: Maria Cristina Dantas Vanetti e José Antonio Pereira.
Em função da demanda por alimentos mais saudáveis e convenientes, existe a necessidade crescente do desenvolvimento de modelos matemáticos que descrevam o comportamento dos micro-organismos sob diversas condições. Este trabalho teve como objetivo avaliar o efeito de diferentes combinações de temperatura, pH, concentração de NaCl, concentração de NaNO2 e tempo de contato, aplicadas simultaneamente, na adesão de
Staphylococcus aureus em superfícies de aço inoxidável (AIN), poliuretano (PU) e cloreto de polivinila (PVC). Os experimentos foram conduzidos de acordo com o delineamento de Box-Behnken, sendo portanto, escolhidos três níveis de cada variável independente estudada. Os níveis inferiores, centrais e superiores de cada variável foram designados como -1, 0 e +1. Foram ensaiadas 40 combinações entre os níveis dos cinco fatores de interesse e seis repetições referente a combinação no ponto central para estimativa da variância experimental. O programa MINITAB® 13 foi utilizado nas análises estatísticas. S. aureus aderiu, em determinadas condições, nas superfícies de AIN, PU e PVC. Em todas as superfícies estudadas os níveis extremos dos fatores proporcionaram menor capacidade de adesão do micro-organismo à superfície, sendo a condição ótima de adesão próxima ao ponto central estudado. Foi observado que a adesão de S. aureus às superfícies torna-se maior com o aumento do tempo de contato. Nenhuma das concentrações de NaNO2 influenciaram a adesão de S. aureus (p > 0,05). As condições
xii temperaturas, além de diminuir a proliferação de S. aureus neste produto podem impedir que esse micro-organismo inicie o processo de adesão sobre as superfícies de AIN, PU e PVC. Os altos valores de coeficiente de determinação (R2) demonstraram a adequação do modelo quadrático em
xiii ABSTRACT
TETTE, Patrícia Amaral Souza, M.Sc., Universidade Federal de Viçosa, Julho de 2010. Adhesion of Staphylococcus aureus on different surfaces and
conditions used in the processing of meat products. Adviser: Regina Célia Santos Mendonça. Co-advisers: Maria Cristina Dantas Vanetti and José Antonio Pereira.
Depending on the demand for healthier foods and convenience, the researchers acknowledge that there is a growing need for mathematical models that describe the behavior of micro-organisms under different conditions. This study aimed to evaluate the effect of different combinations of temperature, pH, NaCl concentration, concentration of NaNO2 and contact time, applied
simultaneously, in the adhesion of Staphylococcus aureus on surfaces of stainless steel (STS), polyurethane (PU) and polyvinyl chloride (PVC). The experiments were conducted in accordance with the Box-Behnken design, being therefore, selected three levels of each independent variable studied. The lower, central and upper levels of each variable were designated as -1, 0 and +1. 40 combinations between the levels of five factors and six replicates of interest regarding the combination at the center point to estimate the experimental variance were tested. The Minitab® 13 program was used in the
statistical analysis. S. aureus was able to adhere, under certain conditions, on the surfaces of STS, PU and PVC. On all studied surfaces the extreme levels of the factors provided lower adhesion ability of the microorganism to the surface, being the best condition of the adhesion close to the studied central point. It was observed that the adherence of S. aureus to the surfaces becomes more pronounced as the contact time increases. None of the NaNO2 concentrations
xiv aureus in this product may prevent the micro-organism to start the adhesion process on the surfaces of STS, PVC and PU. The high coefficients values of determination (R2) demonstrated the suitability of the quadratic model to explain
1 1. INTRODUÇÃO
As doenças resultantes do consumo de alimentos contaminados continuam a aumentar consideravelmente em todo o mundo. Um dos tipos mais comuns de intoxicação alimentar é causada pela toxina de Staphylococcus aureus. Esse micro-organismo é mau competidor e apresenta maiores riscos em alimentos onde a microbiota normal é inativada ou inibida, como por exemplo, carnes cozidas e salgadas.
Alimentos embutidos fermentados são comumente envolvidos em surtos de intoxicação causados por S. aureus. A contaminação desses produtos pode ser proveniente de condições inadequadas de abate e evisceração, extensa manipulação a qual o alimento é submetido, bem como superfícies de equipamentos e utensílios utilizados em sua produção.
Se as condições forem favoráveis, S. aureus pode aderir às superfícies de processamento de alimentos e formar biofilmes. A ocorrência de biofilmes é ubíqua e constitui uma estratégia de sobrevivência microbiana. Acredita-se que a formação de biofilmes esteja associada, por exemplo, à proteção contra agentes estressantes do ambiente. Os biofilmes maduros tendem a se dispersar, liberando micro-organismos que podem colonizar novos ambientes. Deste modo, a adesão e consequente formação de biofilme por patógenos nas superfícies de equipamentos de indústrias de alimentos é fonte de alto risco de contaminação cruzada. Esse processo é passível de ocorrer na maior parte das superfícies envolvidas no processamento de alimentos.
Superfícies de aço inoxidável (AIN), poliuretano (PU) e cloreto de polivinila (PVC) são amplamente utilizadas em várias indústrias de alimentos, incluindo a de produtos cárneos. Portanto, torna-se necessário o estudo de identificação das condições de processamento de alimentos, armazenagem e distribuição em que S. aureus é capaz de sobreviver, multiplicar e formar biofilme. Deste modo, a metodologia de superfície de resposta (MSR) é recomendada, pois permite avaliar a influência simultânea de diversos fatores na resposta.
2 Assim, os objetivos deste trabalho foram:
a) Avaliar o efeito da temperatura, pH, concentração de NaCl, concentração de NaNO2 e tempo de contato semelhantes às utilizadas
na indústria de produtos cárneos na adesão de S. aureus em superfícies de AIN, PU e PVC.
b) Modelar os dados experimentais da adesão de estirpes de S. aureus nas superfícies de AIN, PU e PVC em função da temperatura, pH, concentração de NaCl, concentração de NaNO2 e tempo de contato
utilizando a técnica de superfície de resposta;
c) Validar o modelo obtido, por meio de condições experimentais diferentes daquelas utilizadas na construção do modelo;
3 2. REVISÃO DA LITERATURA
2. 1. Staphylococcus aureus
2. 1. 1. Características de S. aureus
Staphylococcus são micro-organismos freqüentemente analisados no laboratório de microbiologia (PALAVECINO, 2002). As bactérias pertencentes ao gênero Staphylococcus são cocos gram-positivos, imóveis, não esporulados, capsulados ou não e anaeróbios facultativos (JAY, 2005). O gênero Staphylococcus é composto por 38 espécies, sendo S. aureus o mais envolvido em doenças humanas (SHALE et al, 2005).
S. aureus é uma bactéria patogênica e entre os fatores de virulência produzidos encontram-se estafiloquinases, hialuronidases, fosfatases, coagulases, hemolisinas e toxinas termorresistentes (SANT’ANA e AZEREDO, 2005).
A mucosa nasal representa a principal reserva ecológica de S. aureus em humanos (MELLES et al, 2004; WERTHEIM et al, 2005; CORNE et al, 2005; SOUZA e SANTOS, 2009). Quando presente em alimentos, S. aureus é muitas vezes associado à manipulação inadequada por parte do pessoal contaminado com este micro-organismo (GUNDOGAN et al, 2005; MARQUES et al, 2006). Em unidades de processamento de alimentos pode aderir e formar biofilmes (MORETRO et al, 2003; HERRERA et al, 2007; MARQUES et al, 2007; RODE et al, 2007).
2. 1. 2. Intoxicação alimentar estafilocócica
Diversas espécies de Staphylococcus são capazes de produzir toxinas, mas apenas uma espécie, S. aureus, está comumente associada com doença de origem alimentar (LINDQVIST et al, 2002; HUDSON, 2004). As enterotoxinas de S. aureus podem ser detectadas quando a população excede 105 células g-1 (NEWSOME e STEWART, 2004; RODRIGUES et al, 2004). Este agente produz diversas enterotoxinas (A, B, C1, C2, C3, D, E, G, H e I)
4 menos de 1 µg da toxina pode resultar em doença (NEWSOME e STEWART, 2004). A produção dessas toxinas depende principalmente da natureza do alimento, dos processos aos quais foi submetido e da exposição ao tratamento térmico (FIGUEROA et al, 2002).
As enterotoxinas estafilocócicas são compostos de massa molar entre 27 e 31 kDa resistentes a enzimas proteolíticas e estáveis ao calor (NEMA et al, 2007), embora a célula vegetativa de S. aureus possa ser facilmente inativada por tratamento térmico (SHALE et al, 2005). Algumas são formadas durante o crescimento exponencial da bactéria, outras são predominantemente formadas quando a bactéria entra em fase estacionária. As condições ambientais para que S. aureus seja capaz de produzir toxina são mais restritas do que aquelas necessárias para seu crescimento (LINDQVIST et al, 2002).
A intoxicação é causada pela ingestão de alimentos com enterotoxinas produzidas por S. aureus normalmente porque o alimento foi mantido à temperatura ambiente. Os alimentos que requerem considerável manipulação durante a preparação e que são mantidos sem refrigeração são geralmente implicados em intoxicação alimentar estafilocócica (RODRIGUES et al, 2004; BAEZA et al, 2009). Assim, os alimentos contaminados com S. aureus são potenciais fontes de enterotoxinas quando armazenados em temperaturas que favoreçam o crescimento do micro-organismo e síntese enterotoxinas (HUANG et al, 2007).
O período de incubação da doença pode variar de 30 min até 8 h, porém, na maioria dos casos, os sintomas são manifestados entre 2 a 4 h após a ingestão do alimento contaminado com enterotoxinas estafilocócicas preformadas (RODRIGUES et al, 2004). Os efeitos agudos incluem náuseas, vômitos, dor abdominal e diarréia (LINDQVIST et al, 2002; JORGENSEN et al, 2005). Esses sintomas são reduzidos com 24 a 48 h, mas a doença pode permanecer durante 7 a 10 dias.
5 laboratório e inadequada análise laboratorial (NEWSOME e STEWART, 2004). 2. 2. Fatores que interferem no comportamento de S. aureus
Muitos fatores são apontados por desempenhar importante função na sobrevivência e multiplicação de S. aureus, incluindo presença e concentração de sais, pH, temperatura, atividade de água (Aw), exposição ao processamento, competição microbiana, entre outros (PORTOCARRERO et al, 2002). A literatura consultada é escassa com relação ao efeito da interação desses fatores no comportamento de S. aureus.
S. aureus é um organismo muito adaptável e pode sobreviver em uma grande variedade de ambientes (RODE et al, 2007). Deste modo, torna-se importante para indústria de alimentos identificar as condições em que este micro-organismo é capaz de sobreviver e multiplicar no que diz respeito ao processamento de alimentos, armazenagem e distribuição.
2. 2. 1. Temperatura
O uso de temperaturas abusivas no processamento de alimentos permite a produção de toxinas por S. aureus, sendo essa uma das principais causas de intoxicação alimentar (RODE et al, 2007). Esta bactéria é capaz de multiplicar em uma ampla faixa de temperatura que varia de 7 a 48 °C com ótimo entre 35 e 37 °C, um intervalo de temperatura que pode ser freqüente em climas tropicais (JOFRÉ et al, 2008; BAEZA et al, 2009).
6 proteolíticos, geralmente não produzem odores nos alimentos ou os fazem parecer deteriorados. A presença da bactéria ou de suas toxinas nos alimentos não pode ser detectável por métodos sensoriais (NEWSOME e STEWART, 2004).
A contaminação dos alimentos com S. aureus também pode ser em decorrência da adesão e formação de biofilmes. Estudos têm mostrado que a temperatura pode influenciar a adesão de S. aureus em superfícies inertes (MARQUES et al, 2007; RODE et al, 2007).
2. 2. 2. pH
É geralmente aceito que a multiplicação de S. aureus é efetivamente controlada em ambiente de pH 5,3 ou menor (ANANOU et al, 2005). Em pH baixo, a capacidade de linhagens enterotoxigênicas produzir enterotoxinas também é reduzida (LINDQVIST et al, 2002).
A fermentação é um método simples e barato para conservação de carne e produtos à base de carne desde a antiguidade. O processo tem uma vantagem adicional de permitir a formação de produtos específicos que contribuem com o aroma e sabor do produto final. Produção de ácido, produção de H2O2 e bacteriocinas, quer isoladamente ou em conjunto com
culturas iniciadoras, são responsáveis por prevenir o crescimento de bactérias patogênicas e deterioradoras na carne (SAKHARE e RAO, 2003).
A diminuição do pH é o fator chave para a manutenção da estabilidade de produtos fermentados à base de carne (SAKHARE e RAO, 2003). Uma das formas recomendadas de inibir o crescimento de S. aureus em produtos cárneos fermentados é a adição de bactérias láticas na formulação, para reduzir esse pH em um curto intervalo de tempo (ANANOU et al, 2005).
7 Além do efeito do pH na sobrevivência e multiplicação de S. aureus, o pH influencia na resistência do micro-organismo no interior do biofilme e também afeta a hidrofobicidade das superfícies de processamento de alimentos, o que pode contribuir com a formação de biofilme (MOZES et al, 1987; BEENKEN et al, 2004; WEINRICK et al, 2004; BORE et al, 2007; HAMADI et al, 2009)
2. 2. 3. Nitrito de sódio
Aditivos alimentares, como sais de nitrato e nitrito de sódio (NaNO2) e de
potássio, são amplamente utilizados no processamento de produtos cárneos (OLIVEIRA et al, 2005). Constituem agentes de cura e além disso, os nitritos e compostos derivados agem como eficazes antioxidantes e, assim, previnem a oxidação lipídica e o desenvolvimento de odores de ranço (GOTTERUP et al, 2007).
Staphylococcus coagulase-negativos são utilizados como culturas iniciadoras para maturação de diferentes tipos de carne (BLAIOTTA et al, 2004). Esses cocos gram-positivos, catalase positivos e não patogênicos são comumente aplicados como fermento na carne e a maioria das espécies possuem enzimas envolvidas no metabolismo de nitrato e nitrito (GOTTERUP et al, 2007).
De acordo com Newsome e Stewart (2004), S. aureus é tolerante ao nitrito e pode, portanto, multiplicar em soluções de cura ou carnes curadas, se for submetido às condições favoráveis de crescimento. No entanto, as concentrações desse composto capazes de serem toleradas por S. aureus e os mecanismos envolvidos na resistência não estão bem elucidados (NEWSOME e STEWART, 2004).
Segundo Schlag et al (2007), a adição de nitrito tem função importante na promoção do crescimento das células microbianas, embora altas concentrações de compostos derivados de nitrito e nitrato serem tóxicas. Em condições ácidas, os nitritos podem formar ácido nitroso (HNO2), que tem forte
8 2007). Um dos mecanismos sugeridos é que esse composto orienta a indução da transcrição de icaR, o que resulta em repressão dos genes icaADBC, envolvidos na formação do biofilme. No entanto, o efeito do NaNO2 na adesão
e formação de biofilmes, por S. aureus,em condições relevantes à indústria de alimentos não tem sido muito estudado (SCHLAG et al, 2007).
2. 2. 4. Cloreto de sódio
A presença do cloreto de sódio (NaCl) pode funcionar como um inibidor do desenvolvimento de micro-organismos presentes no alimento. No ambiente com a presença desse composto bactérias halofílicas são selecionadas (LARA et al, 2003).
A adição de cloreto de sódio ao alimento reduz a Aw do produto e juntamente com a temperatura e pH, é uma das principais características que influenciam o crescimento e a sobrevivência bacteriana. O efeito de uma baixa Aw está relacionado ao fato da turgescência da célula ser estabelecida como resultado da Aw intracelular e a Aw do meio circundante. O processo conhecido como plasmólise, descreve como o choque hiperosmótico causa efluxo instantâneo de água, acompanhado por um diminuição do volume citoplasmático da célula (WIJNKER et al, 2006).
A resposta universal à perda temporária de turgor é o acúmulo citoplasmático dos chamados solutos compatíveis. Solutos compatíveis são pequenas moléculas orgânicas que partilham certo número de propriedades comuns: entre outras, são solúveis em alta concentração e podem ser acumulados em concentrações muito altas (até 1 mol.L-1) no citoplasma de células osmoticamente estressadas, não alteram a atividade enzimática e podem proteger as enzimas de desnaturação por sais. Exemplos de solutos compatíveis conhecidos são betaína, glicerol, sacarose e prolina (BEALS, 2004).
9 como glicina, prolina e betaína no interior do citoplasma, sem interferir nos processos celulares (GUTIERREZ,1995).
A alta concentração de cloreto de sódio e, em particular os baixos valores de Aw são obstáculos importantes para inibir o desenvolvimento de S. aureus (LARA et al, 2003). No entanto, o crescimento pode ocorrer em Aw tão baixa quanto 0,86 em condições aeróbias ou Aw de 0,90 em condições anaeróbias (NEWSOME e STEWART, 2004). Por outro lado, a alta osmolaridade no ambiente parece contribuir com a adesão e formação de biofilme por S. aureus. Diversos estudos têm mostrado que a presença de NaCl estimula esse comportamento do micro-organismo (RACHID et al, 2000; MORETRO et al, 2003; LIM et al, 2004; PLANCHON et al, 2006; RODE et al, 2007; HERRERA et al, 2007)
2. 3. S. aureus na indústria de produtos cárneos
O aumento progressivo da população mundial e as mudanças no estilo de vida resultaram em maiores exigências na qualidade de alimentos de origem animal (DUBAL et al, 2004). Devido às suas propriedades (Aw, pH e nutrientes) e as extensas manipulações e processamentos a que são expostos, a carne e produtos à base de carne estão envolvidos em muitos surtos de doenças de origem alimentar (ANANOU et al, 2005).
Embora a carne de animais hígidos seja, geralmente, livre de micro-organismos contaminantes, pode ser contaminada pelo contato com pele suja, cascos, pelos, conteúdo intestinal, facas, ferramentas de corte, pessoal infectado, água poluída, ar, processo de abate deficiente, manuseio e armazenamento pós-abate. Diferentes tipos de organismos patogênicos e deterioradores podem ser introduzidos na carne durante o abate e o processamento, o que provoca sua rápida deterioração, grande perda de proteínas essenciais e danos a saúde de humanos. Portanto, é muito importante reduzir a carga microbiana inicial para aumentar a vida de prateleira desse alimento (DUBAL et al, 2004).
10 contaminação por bactérias resistentes, (ii) das conseqüências para a saúde humana de uma infecção com uma bactéria resistente a um determinado antimicrobiano específico e (iii) do consumo de um volume específico do produto (PRESI et al, 2009).
Bactérias com potencial deteriorador ou patógenos geralmente associados com carnes vermelhas incluem Bacillus cereus, S. aureus, Pseudomonas spp., Listeria monocytogenes, Escherichia coli e Salmonella (NEL et al, 2004).
O fato de S. aureus ser mau competidor e crescer em valores baixos de Aw são refletidos nos tipos de produtos cárneos normalmente associados com doenças de origem alimentar causadas por este organismo: alimentos cozidos e, portanto, sem competidores presentes, e alimentos que contêm altas concentrações de sal, proporcionam maiores chances de S. aureus multiplicar e produzir toxinas (HUDSON, 2004).
Segundo Nel et al (2004) devido à falta de higiene pessoal e práticas inadequadas aplicadas na sala de desossa, as carcaças são mais contaminadas por S. aureus do que o manipulador de alimentos. A alta incidência de S. aureus em amostras de carne é particularmente preocupante, porque pode se tornar fonte de contaminação para outros alimentos e representar risco em alimentos processados, por isso, é essencial reduzir a incidência de S. aureus na carne. Além disso, alta população de S. aureus no alimento, combinada com temperatura e armazenamento inadequados, aumenta a possibilidade dos consumidores se intoxicarem com o produto.
11 2. 3. 1. S. aureus em produtos cárneos fermentados
Desde a antiguidade, o homem busca preservar as características da qualidade da carne para manter a provisão de alimentos, o desenvolvimento e a conservação da espécie, originando-se, assim, processos e tecnologias de transformação, inicialmente rudimentares e atualmente controláveis por padrões tecnológicos para manter a qualidade dos produtos. A fabricação de embutidos propicia o aumento da vida de prateleira das carnes, bem como diversifica a oferta de derivados (OLIVEIRA et al, 2005).
Embutidos, como lingüiças, salsichas e salames, são definidos como alimentos condimentados contidos em envoltório natural ou artificial, cuja elaboração emprega carne de bovinos, suínos ou aves, podendo ser cozidos ou não, curados, maturados ou dessecados (BRASIL, 2001). Sua obtenção requer uma série de etapas de manipulação, o que aumenta as possibilidades de contaminação por micro-organismos, patogênicos e deterioradores, o que pode comprometer a qualidade microbiológica do produto final, desde que ocorram falhas e não conformidades em seu processamento (MAURIELLO et al, 2004).
12 KLEIN et al (2006) em estudo da qualidade microbiológica do salame tipo colonial encontraram contaminação expressiva por S. aureus nas amostras e concluíram que a contaminação desse alimento por esse micro-organismo é um problema de saúde pública e que maior rigor por parte dos órgãos competentes deve ser direcionado na fiscalização desses alimentos, uma vez que esse é muito consumido in natura, o que representa uma importante via de transmissão desse patógeno.
Nos últimos anos, várias contaminações por estafilococos em alimentos que incluem carne vermelha foram implicados em surtos de intoxicação alimentar. Devido à ubiquidade de organismos pertencentes ao gênero Staphylococcus em humanos, a contaminação de alimentos em plantas de processamento tem se apresentado como resultado de manipuladores de alimentos portadores assintomáticos e infectados com lesões cutâneas (SHALE et al, 2005; SOUZA e SANTOS, 2009).
O isolamento da mesma estirpe do alimento e de determinado manipulador, no mesmo período de tempo, ou durante a investigação de um surto, sugere fortemente que o manipulador de alimentos pode ser a fonte de contaminação (GUNDOGAN et al, 2005). No caso da intoxicação alimentar estafilocócica, a recuperação do paciente em curto espaço de tempo é também razão de pouco conhecimento e notificação dos surtos. No entanto, com o surgimento de mercados globais e o desenvolvimento de aparatos de pesquisas, estudar e relatar tais surtos podem ser possíveis (NEMA et al, 2007).
2. 4. Adesão e formação de biofilmes
A adesão bacteriana é um fenômeno reconhecido como o primeiro passo no desenvolvimento de biofilmes (VALCARCE et al, 2002). Os mecanismos de adesão dos micro-organismos são bastante complexos e afetados por diferentes fatores, incluindo as características do organismo, o ambiente circundante (temperatura do ambiente, pH, umidade relativa, entre outros) e as propriedades da superfície como porosidade, geometria, composição, aspereza e hidrofobicidade (FOSCHINO et al, 2003).
13 (RAYNER, 2004; FUSTER-VALLS et al, 2008; SIMÕES et al, 2008). Biofilmes, de micro-organismos patogênicos e de deteriorantes, foram identificados nas paredes, pisos, ralos, borracha, correias transportadoras e equipamentos de processamento de alimentos (OULAHAL et al, 2007; FUSTER-VALLS et al, 2008; SHI e ZHU, 2009).
Grande parte das bactérias em ambientes naturais está organizada em biofilmes (LASA e PENADÉS, 2006; RODE et al, 2007). A formação do biofilme ocorre por uma série de eventos sequenciais em que a adesão inicial das bactérias planctônicas à superfície é seguida por subsequente multiplicação e acúmulo de camadas de células e, finalmente, pela formação da comunidade microbiana, embebida em matriz de exopolissacarideo (ZOTTOLA e SASAHARA, 1994; HERRERA, 2007; OULAHAL et al, 2008;). Polissacarídeos, proteínas, fosfolipídeos e ácidos nucléicos são os principais componentes das substâncias poliméricas extracelulares (EPS) que caracterizam o biofilme (SHI e ZHU, 2009).
O crescimento de qualquer biofilme também é limitado pela disponibilidade de nutrientes no ambiente circundante e pela multiplicação das células localizadas no interior do biofilme (SILVA et al, 2006). Os biofilmes maduros são ecossistemas altamente organizados nos quais canais de água estão dispersos e podem fornecer passagens para troca de nutrientes, metabólitos e produtos de resíduos (SHI e ZHU, 2009). O desprendimento do biofilme pode causar contaminação pós-processamento, o que leva a redução da vida de prateleira do produto ou à ocorrência de doenças (DEVERE e PURCHASE, 2007). Além disso, podem causar bloqueios mecânicos, redução na transferência de calor, aumento da resistência friccional de fluidos e corrosão de metais (RAYNER, 2004; FUSTER-VALLS et al, 2008).
14 protegem de condições ambientais mais agressivas, incluindo agentes químicos antimicrobianos (HERRERA, 2007; SIMÕES et al, 2009).
Em unidades de processamento de alimentos, S. aureus pode aderir às superfícies e formar biofilmes (HERRERA et al, 2007). Esse micro-organismo pode persistir no biofilme durante longo período na indústria de alimentos e ser transferido para outro ponto causando contaminação cruzada (SHALE et al, 2005). A formação de biofilme por S. aureus é considerado um importante fator de virulência (TOLEDO-ARANA et al, 2005). Segundo Rode et al (2007), o biofilme é uma estratégia de sobrevivência de S. aureus e a sua formação é maior em condições sub-ótimas de crescimento.
2. 5. Genes envolvidos na adesão e formação de biofilme
A capacidade de S. aureus em produzir biofilme é dependente das condições ambientais, o que sugere que há um mecanismo que detecta e responde a sinais do ambiente (TOLEDO-ARANA et al, 2005).
Várias proteínas de superfície bacteriana contribuem significativamente para a adesão e foram identificadas como sendo importantes na formação do biofilme estafilocócico (HALL-STOODLEY, 2004). As autolisinas atlA, autolisina de S. aureus (OSHIDA et al, 1995), e atlE, autolisina de S. epidermidis (HEILMANN et al, 1997), pertencem a um grupo de peptideoglicano hidrolases que desempenham um papel fundamental na degradação da parede celular bacteriana. Durante a divisão celular, estas autolisinas são responsáveis pela separação do septo entre duas células filhas (ZOLL et al, 2010).
A atl é predominante em estafilococos, sendo atlA e atlE muito semelhantes em sequência e propriedades. As enzimas são bifuncionais, compostas por uma amidase e uma glucosamidase. Mutantes de S. aureus e S. epidermidis com deleção de atlA e atlE são deficientes na fixação primária à superfície, resultando em não formação de biofilme (BISWAS et al, 2006).
1,6-N-15 acetilglicosamina (MORETRO et al, 2003; CHOKR et al, 2007). Estudos têm demonstrado que isolados que produzem PIA são capazes de formar espesso biofilme em placas de microtitulação de poliestireno (MORETRO et al, 2003).
A expressão do operon ica tem sido associada com a formação de biofilme em S. aureus, porém o aumento da transcrição não está necessariamente correlacionado com o aumento da formação de biofilme (FITZPATRICK et al, 2005).
O operon ica foi identificado pela primeira vez em Staphylococcus epidermidis. No entanto, esse operon também está presente e parece ter a mesma função em S. aureus (BEENKEN et al, 2004). Genes do operon ica são encontrados em até 100 % dos isolados clínicos de S. aureus (RODE et al, 2007). Entre os genes ica, o icaA e icaD são relatados como significativos na formação de biofilme em S. aureus e S.epidermidis (YAZDANI et al, 2006).
Cramton et al (1999) demonstraram que ambas as espécies, S. epidermidis e S. aureus, controlam a etapa de adesão célula-célula na formação do biofilme por meio do locus ica e que a deleção dos genes ica elimina a capacidade de produzir PIA e formar biofilme in vitro. No entanto, está claro que existem diferenças estirpes-dependentes com relação à capacidade global de formação do biofilme in vitro (BEENKEN et al, 2004).
Estudos revelaram que todas as estirpes com o gene icaA, um componente do locus ica, também ostentam icaD. Assim, a detecção de um destes genes pode ser usada para determinar se S. aureus é um formador em potencial de biofilme. No estudo de Arciola et al (2001) foi relatado que 60 % das estirpes de S. aureus foram capazes de produzir biofilme (ARCIOLA et al, 2001). Resultados contraditórios, obtidos por outros pesquisadores, sugeriram que todas as estirpes de S. aureus possuem genes icaADBC (ROHDE et al, 2001)
Grinholc et al (2007) sugeriram que não é possível determinar, com base na detecção de apenas um dos genes ica, se a estirpe tem potencial para produção do biofilme. Existe uma variação considerável na expressão gênica entre as estirpes de S. aureus, o que indica a necessidade de estudar várias estirpes dessa espécie antes de concluir quanto à formação de biofilme (RODE et al, 2007).
16 regulamentação ambiental. Certos nutrientes e outras substâncias químicas incluindo glicose, pH ácido, sal, ácido salicílico e concentrações sub-inibitória de antibióticos têm efeitos sobre a transcrição de genes de virulência e de outros genes acessórios em S. aureus (WEINRICK et al, 2004). Glicose e NaCl, em separado ou em conjunto, podem induzir a formação de biofilme pela indução do operon icaADBC em S. epidermidis e em S. aureus (MORETRO et al, 2003). O crescimento anaeróbio também está relacionado com a indução da expressão do operon ica e produção de PIA nesses micro-organismos (BEENKEN et al, 2004).
A constatação de que a formação de biofilme por S. aureus pode ser promovida em condições utilizadas na indústria de alimentos indica que os produtores de alimentos devem estar cientes da importância do controle desse processo (RODE et al, 2007).
2. 6. Superfícies utilizadas no processamento de alimentos
A contaminação cruzada dos alimentos via superfícies de contato constitui uma das grandes preocupações por sua estreita associação com doenças de origem alimentar (DEVERE e PURCHASE, 2007).
As superfícies de processamento devem ser inertes sob condições normais de uso. Além disso, seus componentes não devem ser tóxicos, não podem migrar nem serem absorvidos pelos alimentos. Superfícies lisas, duras, contínuas sem fendas ou fissuras são as mais indicadas. As características das superfícies auxiliam a realização de um procedimento de higienização adequado. As características macroscópicas e, particularmente microscópicas, das superfícies são determinantes para maior ou menor adesão microbiana. Quanto mais lisa a superfície, mais fácil a higienização. O ideal é que nas superfícies não sejam formados poros e ranhuras e que sejam resistentes às deformações, como o abaulamento. As características das superfícies devem ser consideradas para a realização de procedimento de higienização adequado (ANDRADE et al, 2008).
17 de alimento, que podem originar processos de adesão bacteriana e a formação de biofilmes (LEJEUNE, 2003).
Embora muitos fatores diferentes possam estar envolvidos na colonização bacteriana sobre a superfície, os tipos de matérias-primas utilizadas podem afetar a formação do biofilme bacteriano durante o processamento e manuseio dos alimentos (SILAGYI et al, 2009). Rodriguez e McLandsborough (2007) demonstraram que a eficiência da transferência de bactérias do aço inoxidável para os alimentos também foi dependente da atividade de água dos alimentos testados.
Dentre os tipos de aço inoxidável disponíveis, os que contém 18 % de cromo e 8 % de níquel são os mais utilizados para a construção de equipamentos de processamento de alimentos. Neste grupo, estão as ligas da classe 300, por exemplo, 304 e 316, que são resistentes a corrosão causada pela maioria dos alimentos, detergentes e sanitizantes, além de serem facilmente higienizáveis e relativamente baratas. Essas superfícies são comumente usadas na construção de equipamentos e utensílios em geral, como: tanques de fabricação e estocagem, trocadores de calor, silos, tachos, tubulações, mesas, pias, bancadas para manuseio, entre outras aplicações, o que atende as necessidades da indústria de alimentos (JULLIEN et al, 2002).
Entretanto, a microtopografia do aço inoxidável apresenta ranhuras e fendas que propiciam a proteção das células bacterianas contra as forças exercidas pelo fluxo do alimento, detergentes e sanitizantes (ZOTTOLA e SASAHARA, 1994).
Superfícies utilizadas em ambientes de processamento de alimentos mostram características de microtopografia muito distintas (CARELI et al, 2008). Mesmo o aço inoxidável tipo 304 recomendado para fabricação de equipamentos para a indústria de alimentos devido a sua estabilidade físico-química e alta resistência a corrosão, também pode permitir a formação de biofilmes (SHI e ZHU 2009).
18 Superfícies revestidas, como o PVC e o poliuretano, frequentemente utilizadas em indústria de produtos cárneos, podem apresentar protuberâncias, elevações microescavações, desgaste, ondulações e depressões, com diâmetros diferentes e ocorrência de bolhas de ar devido a defeitos de protuberância que suportam o crescimento microbiano, o que pode resultar em um elevado número de células aderidas nessas superfícies (CARELI et al, 2009).
Biofilmes formados nas superfícies de contato com os alimentos, como o aço inoxidável, o cloreto de polivinila e o poliuretano, representam uma fonte de contaminação alimentar contínua de bactérias deterioradoras e agentes patogênicos no ambiente de processamento de alimentos (SILAGYI et al, 2009).
2. 7. Microbiologia preditiva
A microbiologia preditiva é uma área emergente e multidisciplinar da microbiologia de alimentos. Ela engloba disciplinas como matemática, microbiologia, engenharia e química (VALERO et al, 2007). É uma importante área da microbiologia de alimentos em que o comportamento de micro-organismos é quantitativamente descrito quanto ao crescimento celular, fase
“lag” e morte celular com a ajuda de modelos matemáticos (MCMEEKIN e
ROSS, 2002).
O modelo pode ser definido como "a descrição de um sistema, teoria, ou fenômeno que explica as suas propriedades conhecidas ou inferidas e podem ser utilizados para um estudo mais aprofundado das suas características”. É uma descrição simplificada, muitas vezes das relações entre as observações do sistema (respostas) e os fatores que são acreditados em causar as respostas observadas. Essa descrição pode ser expressa em palavras ou expressa quantitativamente, em uma ou mais relações matemáticas ou equações. Assim, um modelo matemático pode simplesmente descrever uma coleção de dados ou pode representar uma hipótese ou uma série de hipóteses sobre relações subjacentes entre as variáveis independentes que levam à observações ou dados (MCMEEKIN et al, 2008).
19 de muitos ambientes ou estresses, tornaram-se fundamentais (VALERO et al, 2007; BRUL et al, 2008).
A capacidade de modelar o comportamento microbiano em alimentos, com razoável precisão pode, em grande parte, ser devido aos fatores controláveis do ambiente no alimento (MCMEEKIN et al, 2008).
A microbiologia preditiva pode descrever o crescimento ou inativação de micro-organismos presentes nos alimentos em condições ambientais específicas, quantificar os efeitos das interações entre dois ou mais fatores e permitir a interpolação de combinações que não foram testadas de forma explícita (ESNOZ et al, 2006).
Em Microbiologia de Alimentos, métodos qualitativos para descrever respostas da população microbiana predominaram até o advento da
microbiologia preditiva “moderna” que permitiu estudar de forma quantitativa a
ecologia microbiana dos alimentos. Por sua vez, a descrição fenomenológica pode ser reforçada por suposições, baseadas em fatos iniciais, levando a hipóteses mais bem definidas e, talvez, a idéias mecanicistas e teorias subjacentes para caracterizar os fenômenos envolvidos (MCMEEKIN et al, 2008). Essa metodologia pode ser usada para estimar tanto o crescimento de micro-organismos patogênicos quanto de deteriorantes sob condições específicas (SUMNER e KRIST, 2002).
O objetivo final da Microbiologia Preditiva de Alimentos é auxiliar o analista de alimentos a escolher, antecipadamente, a combinação mais adequada de condições de estresse para chegar a uma formulação de produto estável (BRUL et al, 2008).
Considerando a demanda por alimentos mais saudáveis e convenientes, os cientistas reconhecem que existe uma necessidade crescente de modelos que auxiliem o estudo da inibição do crescimento microbiano (MCMEEKIN et al, 2000). Modelos que quantifiquem a probabilidade microbiana de crescimento e definam combinações de fatores que impeçam o seu crescimento. Isso ocorre porque o crescimento microbiano é limitado por uma gama de fatores, e, por vezes, o crescimento diminui acentuadamente quando o nível de cada fator é aumentado (VALERO et al, 2007).
20 em perigo a saúde pública. Na Austrália, os principais órgãos reguladores da qualidade de produtos cárneos, reconheceram a utilidade da microbiologia preditiva na adequação do conhecimento (MEAT e LIVESTOCK AUSTRALIA, 1999). Na indústria de produtos cárneos a microbiologia preditiva vem sendo aplicada em uma variedade de setores, incluindo os de desossa a quente, retalhamento, regimes de refrigeração estendidos, fermentação, fabricação e distribuição dos produtos (SUMNER e KRIST, 2002).
Esses tipos de modelos podem ser úteis para o desenvolvimento de processos que permitem produzir produtos que visem uma alimentação mais segura e forneçam informações estimativas mais realistas dos riscos de segurança alimentar (MCKELLAR et al, 2002; VALERO et al, 2007). No entanto, a aplicação bem sucedida da microbiologia preditiva depende do desenvolvimento e validação adequada dos modelos (ESNOZ et al, 2006). Mas esse conceito de validação dos modelos preditivos não parece ser um consenso entre os pesquisadores. A literatura dispõe de estudos onde os modelos gerados não passaram por qualquer forma de validação (BEVILACQUA et al, 2010; PEÑAS et al, 2010) e de outros que foram validados utilizando diferentes metodologias, como a validação do modelo no ponto central (LIEW et al, 2005) e também por escolha aleatória de níveis dentro da região de interpolação (DONG et al, 2007; ARROYO-LÓPEZ et al, 2009).
Segundo Mcmeekin et al (2008), juntamente com o compromisso de manter a investigação estratégica, bem como desenvolver tecnologias inovadoras, o futuro da microbiologia preditiva parece destinado a superar expectativas.
2. 8. Metodologia de Superfície de Resposta
21 Além disso, esta metodologia gera um modelo matemático, que descreve o produto ou o processo (BAS e BOYACI, 2007).
Durante os últimos anos, em microbiologia de alimentos, muitos esforços têm sido direcionados ao desenvolvimento de modelos que descrevem os efeitos combinados de vários fatores no crescimento de micro-organismos (GARCÍA-GIMENO et al, 2002). A MSR tem sido amplamente utilizada em microbiologia de alimentos, para explicar o efeito combinado de fatores em processos de fermentação (TANYILDIZI et al, 2005; TSAPATSARIS e KOTZEKIDOU, 2004), otimização da composição do meio para a produção de micro-organismos probióticos (LIEW et al, 2005) e predição dos parâmetros de crescimento de micro-organismos sob diferentes condições experimentais (ZURERA-COSANO et al, 2004; DONG et al, 2007; HWANG e MARMER, 2007).
22 3. MATERIAIS E MÉTODOS
Os experimentos foram conduzidos no Laboratório de Microbiologia de Patógenos de Origem Alimentar e Hídrica (LAMPOAH) do Departamento de Tecnologia de Alimentos e no Laboratório de Biotecnologia Molecular (LBM) do Departamento de Bioquímica Agrícola da Universidade Federal de Viçosa.
3. 1. Planejamento experimental
3. 1. 1. Delineamento experimental
Utilizou-se o delineamento experimental Box-Behnken em que são planejados tratamentos oriundos de experimentos de três a sete fatores de interesse, combinados em níveis codificados pelos pontos da parte cúbica ( 1) com os níveis do ponto central (0), cujos ensaios são geralmente repetidos no último ponto.
Foram estudadas as variáveis e níveis: temperatura (15, 35 e 55 ºC), pH (5,5, 6,25 e 7,0) concentração de NaCl (2, 4 e 6 %), concentração de NaNO2
23 Tabela 1. Delineamento experimental Box-Behnken utilizado na avaliação da adesão de S. aureus em função dos fatores temperatura, pH, NaCl, NaNO2 e tempo de contato
Combinações dos
níveis Fatores
Ensaios Temperatura
(oC) pH NaCl (%) (mg.LNaNO-12) contato (h) Tempo de
1 55 5,50 4 110 6
2 35 6,25 6 170 6
3 35 7,00 4 110 2
4 35 6,25 2 170 6
5 35 5,50 4 110 10
6 35 6,25 4 170 2
7 35 5,50 4 170 6
8 35 5,50 4 110 2
9 15 6,25 4 110 2
10 35 6,25 6 110 10
11 15 6,25 4 50 6
12 55 6,25 4 50 6
13 35 6,25 2 110 2
14 55 7,00 4 110 6
15 35 6,25 4 110 6
16 35 6,25 4 110 6
17 35 7,00 2 110 6
18 35 6,25 4 50 10
19 55 6,25 4 170 6
20 35 6,25 4 110 6
21 15 6,25 4 170 6
22 15 6,25 4 110 10
23 35 6,25 4 170 10
24 15 6,25 2 110 6
25 35 7,00 4 110 10
26 55 6,25 6 110 6
27 35 6,25 4 50 2
28 35 6,25 6 50 6
29 35 6,25 4 110 6
30 35 7,00 4 50 6
31 15 6,25 6 110 6
32 55 6,25 2 110 6
33 35 7,00 4 170 6
34 15 5,50 4 110 6
35 35 6,25 2 50 6
36 35 5,50 2 110 6
37 35 6,25 4 110 6
38 35 6,25 2 110 10
39 15 7,00 4 110 6
40 35 6,25 4 110 6
41 35 5,50 6 110 6
42 55 6,25 4 110 10
43 55 6,25 4 110 2
44 35 5,50 4 50 6
45 35 7,00 6 110 6
24 3. 1. 2. Modelo estatístico
O programa MINITAB® 13 (Minitab Inc., USA) foi utilizado na construção do modelo estatístico. A equação polinomial quadrática, abaixo, foi usada para expressar a resposta em função das variáveis independentes:
em que Y representa a variável dependente a ser modelada; b0, bi, bj e bij representam os coeficientes do modelo; e Xi e Xj representam as variáveis independentes. A qualidade do ajuste dos modelos obtidos foi avaliada pelo R2, coeficiente de determinação múltipla, o teste F de Fischer (derivados P valores) e pelo erro padrão da estimativa. Gráficos de superfície tridimensional foram desenhados para ilustrar os efeitos das variáveis independentes sobre a dependente (adesão de S. aureus).
Análises de variância foram efetuadas para a variável resposta de cada superfície em que P valores indicam os termos significativos do modelo, em nível de significância de 5 %. Uma ferramenta de cálculo foi utilizada para identificar os níveis dos fatores estudados que minimizam e maximizam a resposta.
3. 2. Procedimentos experimentais
3. 2. 1. Manutenção e ativação de S. aureus
Foi utilizada a estirpe de S. aureus, ATCC 6538, fornecida pelo Departamento de Microbiologia da Universidade Federal de Viçosa.
Cultura estoque desse isolado foi conservada a - 80 oC em caldo BHI
(Acumedia®) acrescido de 20 % de glicerol (Vetec®). O micro-organismo foi
ativado em caldo BHI (Acumedia®) por 24 h a 37 oC, em estufa (Fanem®) antes
de ser utilizado nos experimentos. 3. 2. 2. Superfícies avaliadas
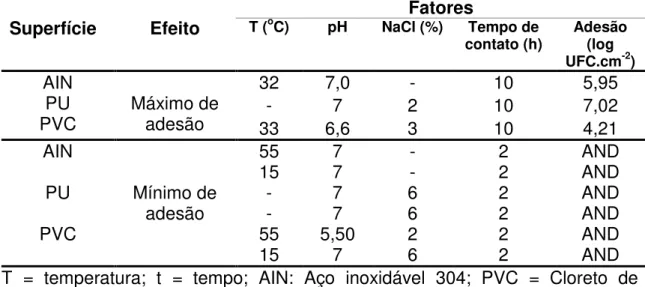
25 (PU), as quais foram trabalhadas na forma de cupons. As dimensões de cada cupom são apresentadas na Tabela 2.
Tabela 2. Dimensões dos cupons utilizados para avaliar a adesão de S. aureus
Superfície
Dimensões (mm)
L C E
AIN 14 14 0,5
PU 14 14 2
PVC 14 14 5
L = Largura; C = Comprimento; E = Espessura.
AIN = aço inoxidável 304; PVC = cloreto de polivinila; PU = poliuretano.
3. 2. 3. Preparo dos cupons
Os cupons, perfurados em um dos vértices, foram esfregados com auxílio de uma escova de cerdas macias e detergente neutro líquido em água e, a seguir, enxaguados por quatro vezes, em água destilada. Resíduos de gordura foram retirados pela imersão em acetona (Dinâmica®) durante 30 min.
A seguir, foram imersos em solução de NaOH (Vetec®) 0,1 mol.L-1 durante 1 h,
e enxaguados por quatro vezes com água destilada (MACHADO, 2006). Após secagem ao ar, cada cupom foi preso na extremidade com fio de algodão (Coast®), embrulhado em papel Kraft e esterilizado a 121 ºC, durante 15 min em autoclave.
3. 2. 4. Preparo dos meios de cultura
Concentrações de NaCl (Vetec®)de 2 a 6 % foram obtidas por adição de quantidades apropriadas de NaCl a 100 mL de caldo infusão cérebro coração (BHI) (Acumedia®) distribuídos em frascos que foram submetidos a esterilização a 121 ºC, durante 15 min, em autoclave.
Após a esterilização, o pH foi ajustado com solução de HCl (Vetec®) (5 mol.L-1), para valores de 5,5 a 7,0. Soluções de NaNO2 (Vetec®) foram
26 foram dispensadas no caldo BHI (Acumedia®) de forma a obter concentrações finais de 50 a 170 mg.L-1.
3. 2. 5. Suspensão do micro-organismo
O preparo do inóculo de S. aureus, ATCC 6538, foi realizado, por transferência da estirpe para um tubo com 5 mL de caldo BHI (Acumedia®) e
incubado em estufa (Fanem®) a 37 ºC por 24 h. Subculturas foram realizadas
em três dias sucessivos em estufa (Fanem®) a 37 ºC por 24 h. A terceira
subcultura foi obtida transferindo-se 1 mL do inóculo em fase logarítmica para frasco com 100 mL de caldo BHI (Acumedia®) para obter inóculo de,
aproximadamente, 103 UFC.mL-1.
3. 2. 6. Determinação da adesão de S. aureus
Após a esterilização, dois cupons foram depositados em frasco com 100 mL de caldo BHI (Acumedia®) inoculado com, aproximadamente, 103 UFC.mL-1 de S. aureus, em cada condição experimental. Nos tempos 2, 6 e 10 h, os cupons foram retirados e mergulhados em 10 mL de água peptonada tamponada (Difco®), durante 1 min, para remoção das células planctônicas. Em seguida, o cupom foi transferido para um tubo com 5 mL de água peptonada tamponada (Difco®) e homogeneizado em agitador de tubos tipo vortex (Scientific Industries®) na velocidade máxima, durante 2 min, para remoção das células aderidas (RIEU, 2008).
A adesão bacteriana foi avaliada pelo método de contagem em placas. O número de UFC recuperado de cada cupom foi determinado por plaqueamento de diluições apropriadas em placas com ágar BHI (Acumedia®)
incubadas em estufa (Fanem®) a 37 ºC por 48 h. O número de unidades formadoras de colônias por centímetro quadrado (UFC.cm-2) foi determinado usando a fórmula, abaixo, onde, Y representa as unidades formadoras de colônias por centímetro quadrado (UFC.cm-2); VD o volume do diluente usado
na remoção das células planctônicas (mL); VA o volume da alíquota utilizada no
27 Após a determinação do número de células aderidas em UFC.cm-2 os dados foram transformados em logaritmo UFC.cm-2 (log UFC.cm-2).
3. 3. Validação do modelo
Após o estabelecimento dos modelos de superfície de resposta, novas condições, dentro do intervalo do modelo, foram escolhidas aleatoriamente para a validação. A mesma cultura, S. aureus, ATCC 6538, foi utilizada nos experimentos elaborados a partir das novas condições escolhidas (Tabela 3).
28 Tabela 3. Experimento de validação do modelo gerado para as superfícies de
aço inoxidável, poliuretano e cloreto de polivinila.
Superfícies Fatores
Temperatura
(oC) pH NaCl (%) contato (h) Tempo de
AIN
1 45 5,9 - 4
2 25 5,9 - 8
3 45 5,9 - 8
4 25 6,6 - 8
5 25 6,6 - 4
6 25 5,9 - 4
7 45 6,6 - 4
8 45 6,6 - 8
PU
1 25 - 5 8
2 25 - 3 4
3 25 - 5 4
4 25 - 3 8
5 25 - 3 8
6 25 - 5 8
7 25 - 5 4
8 25 - 3 4
PVC
1 25 5,9 3 4
2 25 6,6 5 4
3 25 6,6 3 8
4 45 5,9 3 8
5 45 6,6 5 8
6 45 5,9 5 4
7 25 5,9 5 8
8 45 6,6 3 4
AIN = Aço inoxidável 304; PVC = Cloreto de polivinila; PU = poliuretano.
3. 4. Análise da expressão gênica de S. aureus
A técnica da reação em cadeia da polimerase (PCR) em tempo real foi realizada para avaliar a expressão dos genes icaD, icaR e atl na linhagem de S. aureus, ATCC 6538, em doze condições compreendidas no intervalo do estudo de adesão: temperatura (15, 35 e 42 ºC), pH (5,5, 6,25 e 7,0) concentração de NaCl (2, 4 e 6 %) e concentração de NaNO2 (50, 110 e
29 Tabela 4. Oligonucleotídeos iniciadores utilizados para a avaliação da
expressão gênica de S. aureus
Gene Sequência 5’ → 3’ Referência
icaD GGGTGGATCCTTAGTGTTACAATTTT
TGACTTTTTGGTAATTCAAGGTTGTC KOREM et al, 2010
icaR TTGCGAAAAGGATGCTTTCA
GATAAAGATGACAAAAGAAGACTTTCAG KOREM et al, 2010
atl GCCTGTTGCAAAGTCAACAA
CACCGACACCCCAAGATA AG
MCLAUGHLIN e HOOGEWERF, 2006
gyrB AGTAACGGATAACGGACGTGGTA
CCAACACCATGTAAACCACCAGAT
RODE et al, 2007
3. 4. 1. Extração do RNA total
S. aureus foi inoculado em, meio base, caldo BHI (Acumedia®) modificado pela adição de 2, 4 e 6 % de NaCl; 50, 110 e 170 mg.L-1 de NaNO2;
ajuste de pH 5,50, 6,25 e 7,00; e temperatura de 15, 35 e 42 oC. Cada condição foi avaliada individualmente, sendo a temperatura de incubação 35 oC
em todos os tratamentos, com exceção dos tratamentos em que se desejava avaliar o efeito da temperatura. As extrações foram realizadas em triplicata, totalizando 36 extrações.
O volume de 1,5 mL da cultura foi centrifugado (Thermo Electron Corporation®) a 6000 x g, durante 5 min quando a densidade óptica (DO)
30 adicionou-se 250 µL de isopropanol (Sigma®) e 250 µL de solução de precipitação (0,8 M citrato de sódio (Sigma®) + 1,2 M de cloreto de sódio (Fluka®). Após homogeneização o material foi mantido a -20 ºC por, aproximadamente, 12 h e em seguida centrifugado (Thermo Electron Corporation®) a 13000 x g, por 10 min. O sobrenadante foi descartado, adicionou-se 200 µL de etanol 70 % (Sigma®) e nova centrifugação (Thermo Electron Corporation®) foi realizada a 13000 x g, por 5 min. O etanol foi cuidadosamente removido e após secagem total do centrifugado, o mesmo foi ressuspendido em água tratada com dietil pirocarbonato (DEPC) (Amresco®),
incubado a 60 ºC, em banho-maria (Hemoquímica®), por 10 min e estocado a
-80 ºC.
3. 4. 2. Quantificação do RNA e tratamento com Dnase
O RNA extraído das amostras foi quantificado em espectrofotômetro UV Evolution 60 (Thermo Scientific®). A integridade do RNA foi visualizada em gel de agarose 1 % (Uniscience®) por meio do sistema de eletroforese horizontal submersa. Em seguida o RNA foi tratado com a enzima Dnase (Promega®). A reação foi composta por 0,4 µL de Dnase, 1 µL de tampão que acompanha a enzima e 2 µg de RNA. A reação foi realizada em um volume final de 10 µL, sendo o volume completado com água livre de Rnase. O material foi homogeneizado e incubado à 37 oC, em banho-maria (Nova Ética®), por 50 min. Transcorrido o tempo de incubação foi adicionado 1 µL da solução neutralizante da enzima e as amostras foram incubadas à 65 oC, em
banho-maria (Hemoquímica®), por 10 min.
A eficiência da reação foi verificada por meio de reação da PCR com oligonucleotídeo do gene 16S, a fim de confirmar a ausência de contaminação por DNA total bacteriano. As amostras foram visualizadas em gel de agarose 1 % (Uniscience®).
3. 4. 3. Síntese de cDNA