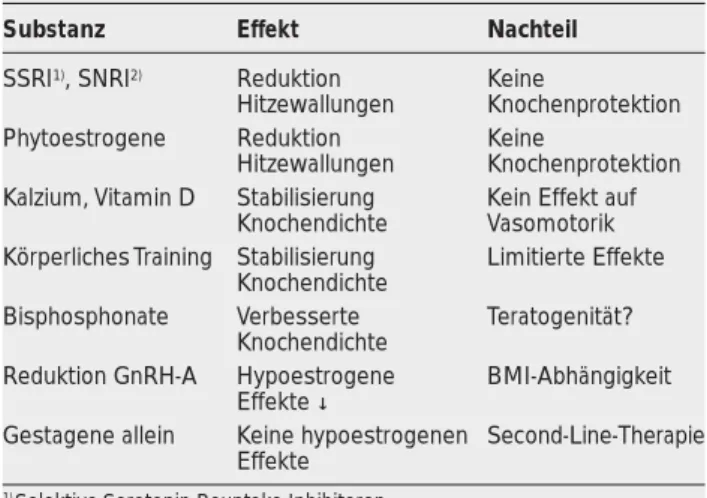
GnRH-Analoga und Add-back-Verfahren
Texto
Imagem
Documentos relacionados
Alle Patienten, deren Stein- erkrankung durch MRU nicht diagnostiziert werden konnte, hatten kleine Steine; für die Dia- gnostik nicht von Bedeutung waren
Keywords: Biodiversity conservation; Biological invasions; Earth observation; Human well- being; Iberian Peninsula; Nature Contributions to People; Non-native trees; Protected areas;
Mit der vorliegenden Arbeit konnte gezeigt werden, daß die Lokalanästhesie mit der Lidocain- Prilocain-Kombinationscreme (EMLA ® 5 %-Creme) für die.. Operation von Meatus-
konnten nachweisen, daß eine Kompression des echten Lumens durch Reduktion des Bluteinstromes über den primären Intimaeinriß und/oder durch Verbesserung des Abstromes aus dem
Neben einer direkten Infiltration durch den Primär- tumor können auch Metastasen, ausgehend von knöcher- nen Strukturen der Wirbelsäule und des Beckens oder von Lymphknoten, sowohl
Na reunião, a Emissora solicitou a retirada dos cheques da cobrança, visto que como não houve o acordo entre as partes, os cheques não faziam mais parte das negociações e por isso
Nach radikaler retropubischer Prostatektomie konnte in einer Pilotstudie durch den Einsatz der lokalen Hyperthermie bei 16 Patienten eine Penisverkürzung vermieden werden, nur bei
nach ischämischem Insult eingeschlos- sen worden sind – wurde durch Gabe von 75 mg Clopidogrel im Vergleich zu 325 mg Aspirin täglich eine relative Risiko- reduktion von 8 % in