1
Universidade Federal de Minas Gerais
Instituto de Ciências Biológicas
Departamento de Fisiologia e Biofísica
ESTUDO DA RESPOSTA INFLAMATÓRIA CEREBRAL E SISTÊMICA
INDUZIDA POR LPS EM CAMUNDONGOS GENETICAMENTE
DEFICIENTES PARA O RECEPTOR MAS
Onésia Cristina de Oliveira Lima
2
ONÉSIA CRISTINA DE OLIVEIRA LIMA
ESTUDO DA RESPOSTA INFLAMATÓRIA CEREBRAL E SISTÊMICA
INDUZIDA POR LPS EM CAMUNDONGOS GENETICAMENTE
DEFICIENTES PARA O RECEPTOR MAS
Orientadora: Prof.ª Dr.ª Juliana Carvalho Tavares
Co-orientador: Prof. Dr. Robson Augusto Souza dos Santos
Belo Horizonte
2014
3
Dedico esse trabalho
4 AGRADECIMENTOS
À minha orientadora Juliana Carvalho Tavares pela oportunidade, orientação e por todo tratamento respeitoso e amigável para comigo durante todo o tempo em que estamos trabalhando juntas. Agradeço por contribuir para meu crescimento científico e pessoal.
Ao meu co-orientador Robson Augusto Souza Santos pela confiança, por oportunidades que proporcionaram grande crescimento científico e por todo apoio necessário para o desenvolvimento desse trabalho.
Ao grupo de pesquisa sob a coordenação do pesquisador Michael Bader - Max Delbrück Center for Molecular Medicine (Berlim, Alemanha) pela indispensável contribuição para realização desse trabalho.
À todos os professores e alunos do laboratório Núcleo de Neurociências (NNC)-UFMG por todo suporte, estrutura e discussões para realização deste trabalho.
Ao Vinicius pela ajuda nos testes de comportamento doentio e à Luciana por me ensinar a cirurgia estereotáxica.
Ao laboratório de Hipertensão pelo apoio necessário para o desenvolvimento desse trabalho.
Aos meus pais, Almir e Elda, por serem meus exemplos, pelos ensinamentos que fazem parte de mim, me trouxeram até aqui e me levarão muito mais adiante. Obrigada pela nossa família, pelo amor, segurança e por todo o sacrifício para dar suporte à minha formação e felicidade, amo vocês!
Aos meus irmãos, Ana, Bárbara e Eduardo por todo apoio, presença e principalmente pelo conforto em saber que posso contar com vocês para o que for preciso, sempre.
Ao Mauro, grande companheiro, que esteve ao meu lado durante todo esse período, agradeço por toda motivação, amor, cuidado e por partilhar seu conhecimento, contribuindo para realização deste trabalho.
Aos antigos amigos e àqueles que fiz nesse período.
À querida amiga Dani, que estando perto ou longe esteve sempre presente e disponível para ajudar. Obrigada pela amizade e torcida.
À Luíza, pela dedicação em cuidar dos animais geneticamente modificados utilizados nesse trabalho.
Aos funcionários da secretaria de pós-graduação em Fisiologia e Farmacologia.
Aos membros da banca avaliadora por aceitarem o convite e dedicarem parte do seu tempo para ler e discutir este trabalho.
Às agências de fomento, Capes, CNPQ e Fapemig
À todas as pessoas que ajudaram diretamente ou indiretamente na realização desse trabalho e contribuíram para minha formação.
5
RESUMO
Além das ações clássicas do sistema renina-angiotensina sobre a regulação da homeostase cardiovascular, estudos prévios têm demonstrado o envolvimento deste sistema na resposta inflamatória aguda e crônica. Enquanto inúmeras evidências demonstram os efeitos pró-inflamatórios mediados pela ativação do receptor AT1
através da Angiotensina II (Ang II), pouco se sabe sobre o envolvimento do receptor Mas em processos inflamatórios. O objetivo deste trabalho foi avaliar a resposta inflamatória cerebral e sistêmica induzida por lipopolissacarídeo (LPS) em animais geneticamente deficientes para o receptor Mas (Mas-/-). Camundongos Mas-/- e
C57BL/6 selvagens (WT), com 8 a 12 semanas de idade, foram desafiados com uma injeção intraperitoneal de LPS (5mg/Kg), sendo as avaliações realizadas 3 horas (3h) e 24 horas (24h) após a administração de LPS. Clinicamente, o LPS induziu importante perda de peso, hipotensão e hipotermia, a qual foi mais intensa nos animais Mas comparados aos WT. Em relação aos parâmetros neuroinflamatórios, os camundongos Mas-/- apresentaram aumento significativo no número de leucócitos aderidos na microvasculatura cerebral e maior recrutamento de monócitos e neutrófilos para a pia-máter se comparados aos WT tanto 3h quanto 24h após o desafio. Estes resultados foram associados à maior expressão cerebral de IL-1β 3h após a injeção de LPS, bem como à maior expressão de fatores quimiotáticos para neutrófilos e monócitos, CXCL-1/KC, CXCL2/MIP-2 e MCP-1 no tempo 24h. Alterações morfológicas indicativas de ativação de micróglia foram observadas 24h após administração de LPS, de uma forma similar em animais Mas-/- e WT. Em
relação aos parâmetros sistêmicos, os níveis plasmáticos de IL-1β e IL-10 (3h após o LPS), bem como de quimiocinas CXCL1/KC e MCP-1 (24h após o LPS) estavam aumentados em camundongos Mas-/- comparados aos WT. Considerando que neutrófilos e monócitos foram recrutados para microcirculação cerebral, essas populações celulares foram avaliadas no sangue e na medula óssea. Três horas após o desafio com LPS, todos os camundongos apresentaram importante redução no número de neutrófilos e monócitos no sangue. Similarmente, foi observada intensa redução no número de leucócitos na medula óssea. Essa redução foi mais marcante nos camundongos Mas-/-, os quais apresentaram menor número de neutrófilos e monócitos na medula óssea 3h e 24h após o desafio com LPS, respectivamente, sugerindo aumento na mobilização de leucócitos a partir da medula óssea nesse grupo de animais. Camundongos Mas-/- apresentaram maior expressão de CD11b em neutrófilos e monócitos da medula óssea após a administração de LPS, o que denota maior ativação leucocitária nesses animais quando comparados aos WT. O aumento na expressão de CD11b pode ser um mecanismo molecular associado ao aumento da adesão leucocitária sobre a microvasculatura cerebral observada nos camundongos Mas-/-, uma vez que esta é
uma molécula capaz de mediar a firme adesão de leucócitos às células endoteliais. Em conclusão, a deleção genética do receptor Mas apresentou-se associada com uma resposta inflamatória exacerbada nos camundongos Mas-/- desafiados com
LPS, demonstrando assim o importante papel deste receptor na regulação de resposta inflamatória cerebral e sistêmica induzida por LPS.
6
ABSTRACT
Beyond the classical actions of the renin-angiotensin system on the regulation of cardiovascular homeostasis, previous studies have shown its involvement in acute and chronic inflammation. While several evidences have shown the proinflammatory effects mediated by AT1 receptor activation through Angiotensin II (Ang II), less is
known about the role of Mas receptor on inflammation. The aim of this work was to evaluate the cerebral and systemic inflammatory response induced by LPS, in Mas deficient animals (Mas-/-). Mas-/- and C57BL/6 wild-type (WT) mice (8-12 weeks-old) were challenged by intraperitoneal injection of LPS (5 mg/kg) and the inflammatory evaluations were performed 3 and 24 hours after LPS administration. Clinically, LPS induced pronounced body weight loss, hypotension and hypothermia which was more intense in Mas-/- mice compared to WT. Regarding neuroinflammatory
parameters, Mas-/- mice had a significant increase in the number of adherent leukocytes on the brain endothelial cells compared to WT and more monocytes and neutrophils were recruited to the pia-mater in this group. The greater number of adherent leukocytes to the brain microvasculature in Mas-/- mice was associated with
increased brain expression of IL-1β 3h after LPS injection, as well as increased
expression of neutrophil and monocytes chemoattractants, CXCL-1/KC, CXCL2/MIP-2 and MCP-1 CXCL2/MIP-24h later. Microglial activation was observed CXCL2/MIP-24h after LPS injection, in a similar way for Mas-/- and WT mice. Regarding systemic inflammation, the plasmatic levels of IL-1β and IL-10 (3h after LPS), as well as chemokines CXCL1/KC and MCP (24h later) were increased in Mas-/- compared to WT mice. As neutrophils
and monocytes were recruited to cerebral microvasculature, these cell populations were evaluated in the blood and in the bone marrow. 3h after LPS injection, the mice presented an important decrease in the number of neutrophils and monocytes in the blood. Similarly, LPS induced a pronounced decrease in the number of leukocytes in the bone marrow. The decrease was accentuated in Mas-/- mice, which presented a lower number of neutrophils and monocytes in the bone marrow, 3h and 24h after LPS challenge, respectively, suggesting increased leukocytes mobilization from bone marrow. Mas-/- mice presented increased CD11b expression on neutrophils and monocytes from bone marrow, after LPS injection, which indicates increased leukocyte activation when compared to WT. The increased expression of CD11b could be a molecular mechanism associated to increased leukocyte adhesion on brain microvasculature observed in Mas-/- mice, once CD11b is a molecule able to mediate the firm adhesion of leukocytes to endothelial cells. In conclusion, genetic deletion of Mas receptor appears to be associated with exacerbated inflammation in LPS-challenged Mas-/- mice, indicating an important role for this receptor in the regulation of cerebral and systemic inflammatory response induced by LPS.
7
LISTA DE ABREVIATURAS E SIGLAS
ANOVA – Análise de variância Ang I - Angiotensina I
Ang II - Angiotensina II
Ang-(1-7) – Angiotensina-(1-7)
AT1 - Receptor tipo 1 da angiotensina II
AT2 - Receptor tipo 2 da angiotensina II
BHE - Barreira hematoencefálica BSA - Albumina de soro bovino
CCR2 - Receptor de quimiocinas do tipo CC2 CXCL- Ligante de quimiocinas com motivo CXC CD – Grupamento de diferenciação
CCL – Ligante de quimiocinas com motivo C ECA - Enzima conversora da Angiotensina g- Gramas
GCSF - Fator estimulador da colônia de granulócitos
GMCSF - Fator estimulador da colônia de macrófagos e granulócitos h – Hora
i.p. - Intraperitoneal
icv - Intracerebroventricular
IMF – Intensidade média de fluorescência IL - Interleucina
KC – Quimiocina derivada do queratinócito Kg – Quilograma
LBP- Proteína ligante do LPS
LFA-1 - Antígeno 1 associado à função linfocitária LPS - Lipopolissacarídeo
MAC1- Antígeno do macrófago 1
MAdCAM-1- Molécula de adesão celular da adressina-1 Mas-/- - Animal geneticamente deficiente para o receptor Mas
MCP-1 - Proteína quimiotática de monócitos-1
8 mg - Miligrama
min - Minuto
MIP-2 - Proteína inflamatória macrofágica-2 NEP - Endopeptidase neutra
NK - Células assassinas naturais
PAMP - Padrão molecular associado à patógeno PBS - Solução tampão fosfato
PCP - Prolil-carboxipeptidase PEP - Prolil-endopeptidase
PSGL1 - Glicoproteína ligante de P-selectina NF-κB - Fator nuclear kappa B
SRA - Sistema renina-angiotensina
TGF-β - Fator de transformação do crescimento beta TLR4- Receptor Toll-4
9
LISTA DE FIGURAS
Figura 1. Cascata do recrutamento leucocitário...17 Figura 2. Via de sinalização do TLR4...20 Figura 3. Visão simplificada e atualizada do Sistema Renina-Angiotensina...24 Figura 4. Etapas realizadas durante o procedimento de microscopia intravital ... ...33 Figura 5. Avaliação da variação do peso e temperatura corporal de
camundongos Mas-/- e WT após administração de LPS...39 Figura 6. Avaliação da pressão arterial média de camundongos Mas-/- e WT
após administração de LPS... ...40 Figura 7. Efeito da administração de LPS sobre a interação leucócito endotélio na microvasculatura cerebral de camundongos Mas-/- e WT ... 41 Figura 8. Efeito da administração de LPS sobre o recrutamento de neutrófilos e monócitos para a pia-máter de camundongos Mas-/- e WT...44
Figura 9. Níveis cerebrais de quimiocinas após administração de LPS em camundongos Mas-/- e WT ... ....46 Figura 10. Níveis cerebrais de citocinas após administração de LPS em camundongos Mas-/- e WT ... ...47
Figura 11. Avaliação de alterações morfológicas indicativas de ativação de micróglia induzidas pela administração de LPS em camundongos Mas-/- e WT...51 Figura 12. Níveis plasmáticos de quimiocinas após administração de LPS em camundongos Mas-/- e WT ... ...53 Figura 13. Níveis plasmáticos de citocinas após administração de LPS em camundongos Mas-/- e WT ... ...54
10 Figura 16. Análise da cinética temporal da variação no número de leucócitos circulantes após administração de LPS em animais WT... ... 58 Figura 17. Estratégia utilizada para análise das populações de neutrófilos e monócitos na medula óssea de camundongos Mas-/- e WT ... ...59
Figura 18. Avaliação das populações de neutrófilos e monócitos na medula óssea de camundongos Mas-/- e WT desafiados com LPS... ... 60 Figura 19. Avaliação da expressão de CD11b em populações de neutrófilos e monócitos da medula óssea de camundongos Mas-/- e WT desafiados com
11
SUMÁRIO
1. INTRODUÇÃO...13
1.1. Resposta inflamatória: aspectos gerais ... 13
1.2. O papel de neutrófilos e monócitos durante a resposta inflamatória...14
1.3. Recrutamento leucocitário durante a resposta inflamatória ... 16
1.4. Lipopolissacarídeo bacteriano (LPS) e seu reconhecimento pelo sistema imune ... 19
1.5. Neuroinflamação induzida por administração sistêmica de LPS ... 21
1.6. Sistema Renina-Angiotensina: Aspectos gerais...23
1.7. Receptor Mas: receptor funcional da Ang - (1-7) ... ...26
1.8. Sistema renina-angiotensina e resposta inflamatória ... 27
2. JUSTIFICATIVA ...29
3. OBJETIVOS...30
3.1. Objetivo Geral...30
3.2. Objetivos específicos...30
4. MATERIAL E MÉTODOS ... .31
4.1. Animais e reagentes ... .31
4.2. Avaliação do peso e temperatura corporal...31
4.3. Avaliação da pressão arterial ...31
4.4. Microscopia intravital...32
4.5. Imunohistoquímica ... 33
4.6. ELISA ... ....35
4.7. Citometria de fluxo ... 36
12
4.9. Análise estatística ... ....38
5. RESULTADOS...38
6. DISCUSSÃO...61
7. CONCLUSÃO...69
13
1. INTRODUÇÃO
1.1. Resposta inflamatória: aspectos gerais
A resposta imunológica é uma reação aos componentes de microrganismos, à macromoléculas e à substâncias químicas reconhecidas como elementos estranhos pelo organismo (Abbas, 2011). A resposta inflamatória desencadeada pelo sistema imune compreende quatro componentes típicos: os estímulos inflamatórios; os sensores que os detectam; a produção de mediadores inflamatórios induzidos pelos sensores e os tecidos alvo que serão afetados pela resposta inflamatória (Medzhitov, 2010).
14 A imunidade adaptativa é uma resposta específica e de longa duração devido a uma exposição à antígenos. Essa resposta é capaz de lembrar e responder com mais intensidade em exposições repetidas ao mesmo microrganismo. Os principais componentes celulares da imunidade adaptativa são os linfócitos e os mediadores inflamatórios produzidos por estas células. A resposta imune inata e adaptativa são componentes de um sistema integrado de defesa do hospedeiro, no qual células e mediadores atuam em cooperação a fim de se obter uma resposta inflamatória eficaz (Abbas, 2011). A resposta inflamatória bem sucedida é aquela que resulta na eliminação do agente infeccioso seguida pela fase de resolução e reparo tecidual, o qual é mediado principalmente pelos macrófagos recrutados e residentes (Serhan e Savill, 2005). É importante que haja um equilíbrio no processo de resolução da inflamação, pois o processo inflamatório exacerbado pode causar dano e injúria tecidual (Medzhitov, 2010).
1.2. O papel de neutrófilos e monócitos durante a resposta inflamatória
Os neutrófilos são os tipos de leucócitos mais abundantes no sangue, correspondendo a 50-70% dos leucócitos circulantes em humanos e 10-25% em camundongos. Essas células apresentam importante papel na resposta imune inata, uma vez que são as primeiras células capazes de migrar para os tecidos em resposta à patógenos invasores (Summers, Rankin et al., 2010). Os neutrófilos possuem uma meia vida curta de 6 a 8 horas na circulação, período após o qual sofrem processo espontâneo de apoptose (Summers, Rankin et al., 2010), entretanto, durante a inflamação a longevidade dessas células pode aumentar (Kolaczkowska e Kubes, 2013).
15 demanda de neutrófilos. Neste caso, o processo de granulopoiese é intensificado e ocorre a liberação de neutrófilos maduros e imaturos da medula óssea para o sangue (Manz e Boettcher, 2014). Após serem liberados da medula óssea, os neutrófilos circulam pelo sangue e subsequentemente são recrutados para o local da inflamação, onde eles primariamente exercem sua função de eliminar microrganismos invasores através de vias como fagocitose, liberação de enzimas granulares e proteínas e; produção de espécies reativas de oxigênio (Summers, Rankin et al., 2010). Os neutrófilos são também capazes de sintetizar várias citocinas, tais como, fator de necrose tumoral alfa (TNF-α); interleucina-1beta
(IL-1β); interleucina-8 (IL-8), fator de transformação do crescimento beta (TGF-β) e
ainda outros reguladores inflamatórios tais como o fator estimulador da colônia de granulócitos (GCSF), fator estimulador da colônia de macrófagos (MCSF) e fator estimulador da colônia de macrófagos e granulócitos (GMCSF) (revisado por Cassatella, 1995). É importante ressaltar que além do importante papel na resposta imune inata, os neutrófilos também apresentam importantes funções sobre a resposta imune adaptativa(Mantovani, Cassatella et al., 2011).
Os monócitos são subtipos leucocitários que constituem aproximadamente 10% dos leucócitos periféricos em humanos e 4 % em camundongos (Strauss-Ayali, Conrad et al., 2007). A meia-vida de monócitos circulantes tem sido estimada em torno de 3 dias em humanos e 1 dia em camundongos (Van Furth e Cohn, 1968). Essas células têm a capacidade de migrar da circulação em direção aos tecidos, onde eles se diferenciam em macrófagos ou células dendríticas, sendo importantes para manter essas populações teciduais (Murray e Wynn, 2011).
16 remodelamento tecidual bem como resolução da resposta inflamatória (Gordon, 2007). Em resposta ao LPS, produzem grandes quantidades de citocinas pró-inflamatórias tais como IL-6; IL-1β e TNF-α (Caroff, Karibian et al., 2002).
Assim, como os neutrófilos, os monócitos e macrófagos são importantes células fagocíticas (Murray e Wynn, 2011). Durante a resposta inflamatória, a orquestrada ação desses fagócitos é crucial para a efetiva eliminação de agentes invasores bem como debris celulares. Em fase inicial da resposta inflamatória monócitos clássicos e macrófagos residentes, respondem ao agente antigênico com a produção de citocinas e fatores quimiotáticos para atrair neutrófilos, tais como CXCL1/KC; CXCL2/MIP-2 e CXCL5 (Soehnlein e Lindbom, 2010). Os neutrófilos então são recrutados para o local da inflamação e liberam o conteúdo de seus grânulos, os quais medeiam efeitos citotóxicos contra o agente invasor e estimulam o extravasamento de monócitos para o local da injúria. Em fase posterior, os neutrófilos recém-migrados sofrem processo de apoptose o qual emite sinais que previnem o influxo de mais neutrófilos e por outro lado intensifica o influxo de mais monócitos. Nessa fase, os macrófagos teciduais têm importante função em exercer a limpeza tecidual dos neutrófilos que estão em apoptose e exercem um papel anti-inflamatório, liberando citocinas tais como IL-10 e TGF-B. Esse papel é importante para o reparo e reestabelecimento da homeostasia tecidual (Soehnlein e Lindbom, 2010).
1.3. Recrutamento leucocitário durante a resposta inflamatória
17
Figura 1. Sequência do recrutamento leucocitário. Eventos sequenciais durante o recrutamento
de neutrófilos da microvasculatura em direção ao tecido. O processo de rolamento depende da expressão de selectinas, enquanto adesão, rastejamento e transmigração dependem da interação de integrinas leucocitárias com imunoglobulinas expressas sobre células endoteliais. A presença de quimiocinas na porção intraluminal do vaso ativam neutrófilos e induzem mudanças conformacionais de integrinas em sua superfície e permitem os subsequentes eventos. O rastejamento dos leucócitos segue um gradiente de quimiocinas ao longo do endotélio, o qual os guia para o local preferencial para transmigração. Há duas vias de transmigração conhecidas, a paracelular (entre células endoteliais) e a transcelular (através de células endoteliais). A figura representa somente a via paracelular. Adaptado de Kolaczkowska e Kubes (2013).
18 quatro resíduos de cisteínas ligados à pontes dissulfeto, sendo classificadas de acordo com o arranjo do resíduo de cisteína amino terminal em quatro subfamílias (CXC, CC, C e CX3C). As quimiocinas transmitem seus sinais através da interação com receptores acoplados à proteína G, expressos nos leucócitos (Baggiolini, 2001), o que leva à ativação das integrinas leucocitárias (Luo, Carman et al., 2007). A interação de integrinas leucocitárias com as imunoglobulinas expressas sobre as células endoteliais, tais como, a molécula de adesão intercelular-1 (ICAM-1) e molécula de adesão celular-vascular-1 (VCAM-1) é um evento que medeia a adesão de leucócitos às células endoteliais (Cinamon, Shinder et al., 2004; Diamond, Staunton et al., 1991). Especificamente, o processo de recrutamento de neutrófilos para o sítio de inflamação é estritamente regulado por quimiocinas específicas tais como CXCL-8 em humanos e seus análogos em camundongos CXCL1/KC; CXCL2/MIP-2 e CXCL5, sinais que ativam o receptor CXCR2 expresso nos neutrófilos (Soehnlein e Lindbom, 2010). Essa ativação induz à translocação de estoques intracelulares de integrinas, bem como causam mudanças na conformação das mesmas sobre a superfície celular, o que aumenta a sua afinidade de ligação às moléculas de adesão expressas sobre o endotélio vascular. Esse evento conduz à firme adesão e viabiliza motilidade celular. As integrinas do tipo β2, antígeno 1 associado à função linfocitária (LFA-1) e antígeno do macrófago-1 (MAC-1) são citadas como importantes mediadoras do recrutamento de leucócitos. Estruturalmente, as integrinas do tipo β2 são formadas por uma subunidade β conhecida como CD18 associada à uma cadeia α variável, que compreende uma das distintas subunidades α: CD11a, CD11b, CD11c ou CD11d (Luo, Carman et al., 2007). A integrina LFA1 (também denominada αLβ2 ou CD11a-CD18) compreende a subunidade CD18 complexada à subunidade α CD11a e apresenta importante papel nas etapas de rolamento lento, adesão e transmigração leucocitárias (Luo, Carman et al., 2007) (Carlos e Harlan, 1994). A integrina MAC-1 (também denominada αMβ2
ou CD11b-CD18), compreende a subunidade CD18 complexada à subunidade α
19 Pluskota, et al., 2005). O CD11b é expresso principalmente em células da linhagem mielóide como neutrófilos e monócitos, mas também em subpopulações de linfócitos, onde apresenta sua capacidade em mediar adesão dos leucócitos ao endotélio (Luscinskas, Brock et al., 1989; Thompson e Matsushima, 1992; Jerke, Rolle et al., 2013; Fagerholm, Varis et al., 2006; Solovjov, Pluskota, et al., 2005).
Especificamente, em relação aos monócitos, o recrutamento destas células é um processo que depende principalmente da quimiocina CCL2/MCP-1 interagindo com seu receptor CCR2 (Gerszten, Garcia-Zepeda et al., 1999). Esse processo conduz à ativação dos monócitos favorecendo a sua interação com o endotélio. Em camundongos, os monócitos expressam integrinas comoLFA-1; MAC-1 e a integrina β1, VL4 (α4β1), as quais interagem com ligantes tais como ICAM-2; ICAM-1 e V-CAM expressos sobre o endotélio vascular mediando adesão e transmigração celular (Imhof e Aurrand-Lions, 2004).
De um modo geral, a interação de integrinas leucocitárias com as imunoglobulinas endoteliais resulta em firme adesão ao endotélio vascular o que conduz finalmente à migração celular por uma rota transcelular ou paracelular (Luster, Alon et al., 2005; Petri, Phillipson et al., 2008).
A interação leucócito-endotélio in vivo tem sido amplamente investigada através da técnica da microscopia intravital. Esse método permite a visualização de processos de rolamento, adesão e em algumas circunstâncias transmigração de células do vaso sanguíneo em direção ao tecido (Kolaczkowska e Kubes, 2013).
1.4. Lipopolissacarídeo bacteriano (LPS) e seu reconhecimento pelo sistema imune
O Lipopolissacarídeo bacteriano é o principal componente da membrana externa de bactérias gram-negativas, essencial para o crescimento e sobrevivência da bactéria. Estruturalmente, é uma macromolécula glicolipídica composta de uma região lipídica bifosforilada denominada lipídio A associado á uma cadeia de
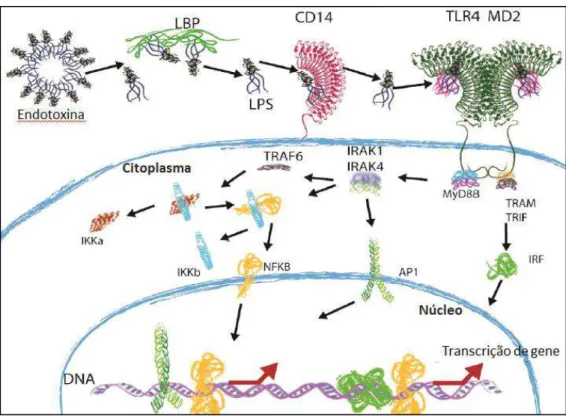
20 variedade de células que participam da resposta imune inata, destacando-se neutrófilos, monócitos, macrófagos (incluindo os do SNC denominados micróglia), células endoteliais e células dendríticas (Ganley-Leal, Liang et al., 2010; Andonegui, Zhou et al., 2009). Brevemente, em sua cascata de sinalização o LPS solúvel ativa o TLR4 em um mecanismo dependente da proteína ligante do LPS (LBP) e de CD14, uma proteína que pode estar solúvel na circulação ou ancorada na membrana celular de monócitos, neutrófilos e macrófagos. A sinalização intracelular mediada pela ativação do TLR4 via LPS compreende sequencial ativação de proteínas específicas, que por fim, conduzem à translocação do fator nuclear kB (NFkB) para o núcleo. O NFkB regula transcricionalmente genes promotores de citocinas inflamatórias como IL-1β, IL-6 e TNF-α (Figura 2). A produção dessas moléculas promove uma sinalização variada para células do sistema imune, mediando a resposta inflamatória sistêmica e generalizada observada após a exposição ao LPS (Opal, 2007; Nijland, Hofland et al., 2014).
Figura 2. Via de sinalização do TLR4. O LPS se liga à proteína ligante do LPS (LBP) e é transferido
para CD14. Em seguida é formado o complexo LPS-MD2-TLR4. A dimerização de TLR-4 conduz ao recrutamento de moléculas adaptadoras: MyD88, proteína adaptadora contendo domínio TIR indutora de IFN-β(TRIF) e a molécula adaptadora relacionada a TIRF (TRAM). A cascata de sinalização é
21
1.5. Neuroinflamação induzida por administração sistêmica de LPS
Há várias evidências de que a infecção sistêmica tem um impacto negativo sobre a função do sistema nervoso central (SNC). Nesse contexto, a inflamação sistêmica é capaz de induzir um quadro de inflamação cerebral, como observado em casos de encefalopatia induzida por sepse, a qual em longo prazo pode conduzir à disfunção cognitiva (Green, Scott, et al., 2004). Além disso, a inflamação sistêmica é capaz de modular a inflamação e dano neural pré-existentes tais como aqueles observados em modelo experimental de Alzheimer (Kitazawa, Oddo et al., 2005), Parkinson (Pott Godoy, Tarelli et al., 2008), acidente vascular encefálico (Mccoll, Rothwell et al., 2007), doença priônica (Cunningham, Wilcockson et al., 2005) e esclerose múltipla (Perry, Newman et al., 2003).
Diversos estudos demonstram que a administração sistêmica de LPS conduz à importante resposta inflamatória cerebral (Masocha, 2009; Buttini, Limonta et al., 1996; Puntener, Booth et al., 2012; Qin, Wu et al., 2007; Zhou, Andonegui et al., 2009; Murray, Skelly et al., 2011; Bohatschek, Werner et al., 2001; Rummel, Inoue et al., 2010; Czapski, Gajkowska et al., 2010). Essa resposta é caracterizada pela presença de vários mediadores inflamatórios no cérebro tais como IL1-β; IL-6;
TNF-α; MCP-1, MIP-2, prostaglandina 2, (Teeling, Cunningham et al., 2010; Teeling, Felton et al., 2007; Zhou, Andonegui et al., 2009); ativação de células endoteliais, onde observa-se rolamento e adesão de leucócitos sobre a microvasculatura cerebral (Zhou, Andonegui et al., 2009) e aumento na reatividade de astrócitos (Biesmans, Meert et al., 2013). A administração de doses mais altas desencadeia a ativação de micróglia em uma fase precoce após o desafio (Reinert, Umphlet et al., 2014; Qin, Wu et al., 2007) a qual pode ser acompanhada de elevados níveis de citocinas pró-inflamatórias (Qin, Wu et al., 2007). A ativação da micróglia e elevados níveis de TNF-α nesses casos, se mantêm cronicamente por até mesmo vários meses após decorrido o desafio, o que a longo prazo progride para neurodegeneração (Masocha, 2009; Qin, Wu et al., 2007).
22 2007). A morfologia da micróglia em estado de repouso/vigilância é caracterizada por corpos celulares arredondados e processos finos ramificados, enquanto a ativação subsequente ao LPS demonstra alterações morfológicas caracterizadas por espessamento dos corpos celulares e assimetria nos processos (Chen, Jalabi et al., 2012; Reinert, Umphlet et al., 2014; Qin, Wu et al., 2007). Quando a micróglia é ativada por fatores bacterianos ocorre um padrão de fagocitose associado à liberação de diversos mediadores pró-inflamatórios (Hausler, Prinz et al., 2002). Em fase de resolução da infecção, durante a remoção de restos apoptóticos de células envolvidas na resposta imune, a micróglia apresenta a liberação de fatores anti-inflamatórios (Magnus, Chan et al., 2001). Dentre os diversos fatores que as células da micróglia são capazes de produzir citam-se IL-1β; TNF-α; IL-6; IL-10; MCP-1, MIP-1, RANTES, dentre outros (Hanisch, 2002).
23 soro (Chakravarty e Herkenham, 2005). Ao passo que a presença do TLR-4 somente em células hematopoiéticas, mas não em células residentes do SNC medeia a liberação de citocinas sistêmicas da fase aguda, mas a resposta inflamatória no SNC apresenta-se reduzida em duração (Chakravarty e Herkenham, 2005).
A resposta inflamatória que ocorre no SNC em consequência da administração sistêmica de LPS em camundongos provê um modelo que mimetiza inflamação cerebral associada à infecção sistêmica. Assim, esse é um modelo experimental comumente utilizado para estudar os efeitos da inflamação periférica no cérebro(Chakravarty e Herkenham, 2005; Masocha, 2009; Buttini, Limonta et al., 1996; Puntener, Booth et al., 2012; Qin, Wu et al., 2007; Zhou, Andonegui et al., 2009; Murray, Skelly et al., 2011; Bohatschek, Werner et al., 2001; Rummel, Inoue et al., 2010; Czapski, Gajkowska et al., 2010).
1.6. Sistema Renina-Angiotensina: Aspectos gerais
Sob uma visão clássica, o sistema renina-angiotensina (SRA) é conhecido como um sistema cujo papel fundamental está relacionado com o controle da pressão arterial e homeostasia hidroeletrolítica do organismo. Entretanto, após as primeiras descobertas sobre o SRA, há mais de um século, muito se avançou na compreensão de seus componentes e hoje sabe-se que suas funções fisiológicas são muito mais amplas (Santos, Ferreira et al., 2013; Passos-Silva, Verano-Braga et al., 2013; Tiegerstedt e Bergman em 1898).
Os componentes clássicos desse sistema incluem a renina, enzima conversora da angiotensina (ECA), angiotensina II (Ang II); angiotensina III (Ang III) e os receptores da angiotensina do tipo I (AT1) e II (AT2) (Santos, 2014). Nas últimas
24 Mas - tipo D (MrgD) (Lautner, Villela et al., 2013). A figura 3 mostra uma visão atual e simplificada do SRA.
Figura 3. Visão esquemática e atualizada do Sistema Renina-Angiotensina. ECA indica enzima
conversora da angiotensina; AMP, aminopeptidase; Ang, angiotensina; AT1, receptor da angiotensina do tipo 1; AT2, receptor da angiotensina do tipo 2; D-Amp, dipeptidil aminopeptidase I-III; IRAP, aminopeptidase regulada por insulina; Mas, receptor Mas; MrgD, receptor acoplado a proteína G relacionado ao Mas - tipo D; NEP, endopeptidase neutra; PCP, prolilcarboxipeptidase; PEP, prolilendopeptidase. Adaptado de Santos e colaboradores (2014).
25 origem a outros peptídeos bioativos, como por exemplo, a Ang III, a Ang-(1-7) e a Ang A (Santos, 2014). A Ang II atua através dos receptores AT1 e AT2, ambos são
receptores com sete domínios transmembrana acoplados à proteína G (Kim e Iwao, 2000). Os receptores AT1 medeiam ações tais como vasoconstrição, aumento da
pressão arterial, retenção de sódio, liberação de aldosterona pela adrenal, efeitos pró-fibróticos, e que favorecem a proliferação celular (Fyhrquist e Saijonmaa, 2008; Santos, Ferreira et al., 2008). Os papéis funcionais do receptor AT2 não foram
totalmente elucidados, mas eles podem antagonizar em condições fisiológicas os efeitos mediados pelo AT1, apresentando efeito anti-proliferativo (Ohkubo,
Matsubara, et al., 1997) vasodilatador (Batenburg, Garrelds et al., 2004) e pró-apoptótico (Horiuchi, Hayashida et al., 1997).
A Ang-(1-7) é um heptapeptídeo que por muitos anos foi considerado como um componente inativo do SRA. Entretanto, desde os primeiros estudos conduzidos por Santos e colaboradores, demonstrando que Ang-(1-7) era o principal produto formado a partir de Ang I em cérebro de cães, sua importância fisiológica vem sendo amplamente evidenciada (Santos, Brosnihan et al., 1988). A Ang-(1-7) pode ser formada diretamente a partir de Ang II pela ECA 2 ou por outras peptidases, incluindo prolil-endopeptidase (PEP) e prolil-carboxipeptidase (PCP). A ECA 2 também pode converter Ang I em Ang-(1-9) a qual pode ser posteriormente hidrolisada pela ECA ou por endopeptidase neutra (NEP) formando Ang-(1-7). Além disso, Ang-(1-7) pode ser formada diretamente a partir de Ang I por endopeptidases incluindo neprilisina, PEP e NEP (Vickers, Hales et al., 2002; Welches, Brosnihan et al., 1993; Etelvino, Peluso et al., 2014). A Ang-(1-7) atua através do receptor Mas, um receptor com sete domínios transmembrana acoplado á proteína G (Santos, Simoes E Silva et al., 2003). As ações de Ang-(1-7) incluem vasodilatação dependente de óxido nítrico, efeito arritmogênese, trombogênese, anti-fibrogênese, anti-hipertrófico, dentre outros (Menon, Soto-Pantoja et al., 2007; Fyhrquist e Saijonmaa, 2008; Grobe, Mecca et al., 2006) (Giani, Mayer et al., 2009; Ferreira e Santos, 2005). A Ang-(1-7), atuando via receptor Mas demonstra um importante papel por contra-regular muitas ações decorrentes da ativação do receptor AT1. Baseando-se em funções antagônicas mediadas por diferentes
26 II-receptor AT1 e a via contra-regulatória formada principalmente por
ECA2-Ang-(1-7)-receptor Mas (Simoes E Silva, Pinheiro et al., 2006; Chappell, 2007; Santos e Ferreira, 2007).
1.7. Receptor Mas: receptor funcional da Ang - (1-7)
O gene que codifica o receptor Mas, um receptor acoplado à proteína G com sete domínios transmembrana, foi inicialmente isolado, clonado e caracterizado em 1986 (Young, Waitches, et al., 1986). Em 2003, o grupo de Santos e colaboradores, identificou o receptor Mas como sendo um receptor funcional para a Ang-(1-7) (Santos, Simoes E Silva et al., 2003). No camundongo, a presença do receptor Mas já foi detectada em diferentes áreas como testículos, rins, baço, cardiomiócitos, endotélio de artérias coronárias (Villar e Pedersen, 1994; Alenina, Xu et al., 2008). Especificamente no cérebro, o receptor Mas foi detectado no epitélio do plexo coroide, microvasos radiais e interneurais e em várias áreas como tálamo, hipotálamo e gânglios da base, sendo essa expressão muito intensa no córtex piriforme e giro denteado do hipocampo (Freund, Walther et al., 2012; Alenina, Xu et al., 2008). O receptor Mas também já foi identificado em diferentes células do sistema imune tais como células dendríticas derivadas da medula óssea de ratos (Nie, Yan et al., 2009), macrófagos peritoneais (Souza e Costa-Neto, 2012), macrófagos alveolares (Wosten-Van Asperen, Lutter et al., 2011) e micróglia (Regenhardt, Desland et al., 2013) o que sugere o envolvimento desse receptor em mecanismos imunes.
27 do receptor Mas via Ang-(1-7) em modelo experimental de isquemia cerebral, bem como efeitos benéficos sobre aprendizado e memória (Mecca, Regenhardt et al., 2011; Regenhardt, Desland et al., 2013; Jiang, Gao et al., 2012; Lazaroni, Raslan et al., 2012).
A importância do receptor Mas vem sendo demonstrada através de vários estudos in vivo utilizando-se o animal geneticamente deficiente para este receptor, que foi desenvolvido em 1998 (Walther, Balschun et al., 1998). Os animais Mas-/- apresentam um fenótipo caracterizado por várias alterações. Entre estas, cita-se importante disfunção cardíaca, reduzida capacidade de contratilidade do miocárdio e alterações na expressão de colágeno no músculo cardíaco caracterizadas por um perfil pró-fibrótico (Santos, Castro et al., 2006; Castro, Santos et al., 2006). O fenótipo de hipertensão arterial é background dependente apresentando-se nos animais FVB/N, mas não nos C57Bl/6 (Xu, Costa-Goncalves et al., 2008; Rabelo, Xu
et al., 2008). Além destas alterações, citam-se redução do baroreflexo (De Moura,
Dos Santos et al., 2010) e disfunção endotelial, observada através de uma redução marcante na vasodilatação dependente do endotélio induzida por acetilcolina (Rabelo, Xu et al., 2008). Os animais Mas-/- apresentam redução no fluxo sanguíneo
em órgãos como rins, pulmão, mesentério, baço e tecido adiposo. Entretanto, nenhuma diferença foi observada em relação ao fluxo sanguíneo no microambiente cerebral de animais Mas-/- jovens (Botelho-Santos, Bader et al., 2012).
Recentemente, Souza e colaboradores demonstraram que estes animais são mais susceptíveis à morte em um modelo de endotoxemia induzido por LPS (Souza, Duchene et al., 2014). E em relação ao microambiente cerebral, alterações comportamentais tais como aumentado nível de ansiedade (Walther, Balschun et al., 1998) e comprometimento na memória de reconhecimento de objetos (Lazaroni, Raslan et al., 2012) já foram detectadas nos animais Mas-/-.
1.8. Sistema renina-angiotensina e resposta inflamatória
28 Owen e Campbell, 1998; Gomez, Norling et al., 1993). Neste contexto, foi demonstrado que Ang II ativa várias funções celulares e vias de sinalização molecular relacionadas ao processo inflamatório. Foi observado o papel da Angio II como moduladora do NF-κB em leucócitos mononucleares (Kranzhofer, Browatzki et al., 1999), além de sua capacidade em regular algumas citocinas pró- inflamatórias, tais como o TNF-α; IL1-β e IL-6 (Lapteva, Ide et al., 2002).
Especificamente, em relação ao processo de recrutamento leucocitário vários estudos demonstram que Ang II atuando via receptor AT1 estimula a interação
leucócito-endotélio e aumenta a migração de leucócitos in vivo. A exposição de arteríolas da microcirculação mesentérica à Ang II, conduz ao aumento na expressão de moléculas de adesão sobre o endotélio de vênulas e arteríolas bem como aumenta a adesão leucocitária; efeitos mediados pela ativação do receptor AT1 (Alvarez, Cerda-Nicolas et al., 2004). Similarmente, a administração
intraperitoneal de Ang II (até mesmo em doses subvasoconstritoras) induz aumento na interação leucócito-endotélio na microcirculação do mesentério (Piqueras, Kubes et al., 2000) e induz a migração de neutrófilos para cavidade peritoneal, efeito que se associa à maiores níveis das quimiocinas CXCL1/KC e CXCL2/MIP-2 (Nabah, Mateo et al., 2004). Resultados similares foram observados na microvasculatura cerebral, onde a infusão direta de Ang II foi capaz de causar aumento nos processos de rolamento e adesão leucocitária na microvasculatura da pia-máter, bem como aumento na permeabilidade da BHE (Zhang, Mao et al., 2010). Em modelo de artrite experimental, o tratamento com Losartan, um bloqueador farmacológico do receptor AT1, diminuiu o processo de rolamento e adesão leucocitária sobre a
microvasculatura sinovial no interior da articulação do joelho, diminuindo também a produção de TNF-α, IL1-β e CXCL-1 no tecido periarticular e reduzindo o dano tecidual (Silveira, Coelho et al., 2013). Em concordância com o fato de o receptor AT1 ser o principal mediador das ações inflamatórias de Ang II, foi demonstrado que
o bloqueio deste receptor reduziu o recrutamento de neutrófilos e liberação de citocinas em diferentes modelos de inflamação (Price, Lockhart et al., 2007; Mateo, Abu Nabah et al., 2006).
29 do eixo Ang-(1-7)/receptor Mas em diferentes condições inflamatórias (Da Silveira, Coelho et al., 2010; Sukumaran, Veeraveedu et al., 2011; Rodrigues-Machado, Magalhaes et al., 2013; Wosten-Van Asperen, Lutter et al., 2011; El-Hashim, Renno et al., 2012; Mecca, Regenhardt et al., 2011; Regenhardt, Desland et al., 2013; Jiang, Gao et al., 2012; Souza e Costa-Neto, 2012; Souza, Duchene et al., 2014).
2. JUSTIFICATIVA
Várias evidências demonstram que a inflamação sistêmica pode ter um impacto negativo sobre a função do sistema nervoso central, sendo capaz de induzir ou exacerbar inflamação cerebral pré-existente (Green, Scott, et al., 2004; Kitazawa, Oddo et al., 2005; Pott Godoy, Tarelli et al., 2008; Mccoll, Rothwell et al., 2007). Diversos estudos relatam o envolvimento do sistema renina-angiotensina na resposta inflamatória, onde é bem estabelecido que ativação do receptor AT-1 pela
Ang II é uma via mediadora de efeitos pró-inflamatórios (Ruiz-Ortega, Lorenzo et al., 2001; Owen e Campbell, 1998; Gomez, Norling et al., 1993). Sabe-se que as ações decorrentes da ativação do receptor AT1, são na maioria das vezes, opostas àquelas
30
3. OBJETIVOS
3.1. Objetivo Geral
Avaliar a resposta inflamatória cerebral e sistêmica em animais geneticamente deficientes para o receptor Mas
3.2. Objetivos específicos
Etapa I:
Avaliar o efeito da deleção genética do receptor Mas sobre o estado clínico de camundongos desafiados com LPS, através da análise dos parâmetros:
- Peso corporal;
- Temperatura corporal; - Pressão arterial.
Etapa II:
Avaliar o efeito da deleção genética do receptor Mas na inflamação cerebral induzida por desafio com LPS, através da análise dos seguintes parâmetros:
- Interação leucócito-endotélio na microvasculatura cerebral;
- Fenótipo de células inflamatórias recrutadas para microvasculatura cerebral; - Níveis cerebrais de quimiocinas CXCL1/KC; CXCL2/MIP-2 e MCP-1;
- Níveis cerebrais das citocinas TNF-α; IL1-β e IL-10;
- Alterações morfológicas indicativas de ativação de micróglia.
Etapa III:
Avaliar parâmetros inflamatórios sistêmicos associados à resposta inflamatória cerebral observada em camundongos WT e Mas-/- desafiados com LPS, através da análise de:
- Níveis plasmáticos de citocinas e quimiocinas; - População de neutrófilos e monócitos no sangue;
- População de neutrófilos e monócitos na medula óssea;
31
4. MATERIAL E MÉTODOS
4.1. Animais e reagentes
Neste estudo foram utilizados camundongos C57BL6/J selvagens (WT) e animais geneticamente deficiente para o receptor Mas, em um background C57BL6/J (Mas-/-), machos, com 8 a 12 semanas de idade; pesando 25-30 gramas (g). Os animais foram obtidos do biotério de animais transgênicos do Departamento de Fisiologia e Biofísica – UFMG e mantidos em gaiolas (5 animais/gaiola) dentro de uma estante ventilada, sob condições controladas de temperatura e luminosidade (ciclo claro/escuro de 12 horas) com livre acesso à ração e água. Os protocolos experimentais utilizados neste estudo foram aprovados pelo Comitê de Ética em Experimentação Animal (CETEA-UFMG), protocolo n° 259 / 2012.
O modelo de inflamação (endotoxemia) foi induzido através de uma administração intra-peritoneal (i.p.) de 5mg/Kg de lipopolissacarídeo (LPS) (Escherichia coli O111:B4, Sigma Aldrich, St Lois, USA) e o grupo controle recebeu uma administração de NaCL 0,9% (10µl/g) (Reinert, Umphlet et al., 2014; Qin, Wu et al., 2007). Todos os experimentos foram realizados 3 horas (3h) e 24 horas (24h) após administração de LPS a fim de avaliar as fases aguda e tardia em resposta ao LPS.
4.2. Avaliação do peso e temperatura corporal
O peso corporal (g) e temperatura corporal (ºC) foram avaliados em condição basal, 3h e 24h após o desafio com LPS. Um sensor anal (Fine Science Tools, Vancouver, Canada) foi utilizado para mensurar a temperatura. Para minimizar o estresse com este procedimento, os camundongos foram habituados durante dois dias antes do experimento, duas vezes ao dia.
4.3. Avaliação da pressão arterial
32 Paulínea, Brasil) e submetidos à cirurgia para implantação de uma cânula modificada na artéria femoral. Após a introdução da cânula, esta foi dirigida subcutaneamente, com auxílio de um trocater, para a cintura escapular, onde foi exteriorizada e fixada com linha de sutura. O registro da pressão arterial foi feito um dia após a canulação da artéria femoral. A cânula arterial foi conectada a um transdutor de pressão conectado a um amplificador e um conversor analógico/digital (A/D) MP100 (Biopac Systems, Inc.). O software utilizado foi o AcqKnowledge 5 (Biopac Systems, Inc.). Durante os experimentos os camundongos foram mantidos dentro de gaiolas podendo se mover livremente. Por um período de 1 hora registrou-se a pressão arterial em condições basais, após o registro basal, foi feita a administração do LPS (5mg/Kg, i.p.), e os animais foram acompanhados por aproximadamente 7 horas consecutivas para registro da pressão arterial média (mm/Hg).
4.4. Microscopia intravital
A microscopia intravital foi utilizada para avaliar, in vivo, o processo de rolamento e adesão de leucócitos na microvasculatura cerebral dos animais WT e Mas-/- desafiados com LPS. Os experimentos foram realizados em condições controle, 3h e 24h após a administração de LPS.
Os animais foram previamente anestesiados por via intra-peritoneal com uma mistura de Ketamina (100mg/Kg, Dopalen, Paulínea, Brasil) e Xilasina (10mg/Kg, Anasedan, Paulínea, Brasil). Em seguida foi realizada a cirurgia de craniotomia na região parietal do crânio utilizando uma mini-broca (Dremel, USA). Com esse procedimento, as membranas dura-máter e aracnóide são removidas, sendo formada uma janela aberta para visualização dos vasos sangüíneos da pia-máter. A superfície cerebral dos animais foi continuamente superfundida com uma solução de fluido cerebroespinhal artificial (composição iônica em mmol/L: NaCl 132, KCl 2.95, CaCl2 1.71, MgCl2 0.64, NaHCO3 24.6, dextrose 3,71 e uréia 6.7), à temperatura de
33 Devido a esta propriedade, a rodamina é utilizada para o estudo de leucócitos em ensaios de microscopia intravital, com o objetivo de examinar a cinética in vivo destas células mesmo na presença de uma alta velocidade de fluxo (Baatz, Steinbauer et al., 1995). Um microscópio de fluorescência (AXIOIMAGER M2 ZEISS, Jena, Germany), com objetiva de 20X, foi utilizado para observar os eventos de rolamento e adesão na microvasculatura cerebral. A fluorescência associada à rodamina 6G foi visualizada com epi-iluminação a 510-560 nm, usando um filtro de emissão de 590 nm. Uma câmera de vídeo (AxioCam MRm ZEISS, Göttingen, Germany) projetou as imagens que foram gravadas em microcomputador para posterior análise com uso do programa Axio Vision 4 (ZEISS, Germany). Os leucócitos em rolamento eram identificados como as células que apresentassem um movimento rotacional ao longo do endotélio com velocidade menor que a do fluxo sanguíneo. O rolamento foi expresso em número de células rolando por minuto, em uma extensão de 100m/ vaso. Os leucócitos eram considerados aderidos se permanecessem estacionários ao endotélio por um período de pelo menos 30 segundos, a adesão foi expressa como número de células por 100m/vaso. A figura 3 representa o procedimento experimental para realização da técnica da microscopia intravital.
Figura 4. Etapas realizadas durante o procedimento de microscopia intravital.
4.5. Imunohistoquímica
35
4.6. ELISA
O ensaio de ELISA foi realizado para mensurar os níveis de citocinas e quimiocinas no plasma e em homogenato de cérebro dos camundongos após o desafio com LPS. Os camundongos foram anestesiados com uma mistura de Ketamina (100mg/Kg, Dopalen, Paulínea, Brasil) e Xilasina (10mg/Kg, Anasedan, Paulínea, Brasil) e o sangue foi coletado por punção cardíaca e acondicionado em tubos individuais contendo EDTA, a 4ºC. Imediatamente após a obtenção do sangue, os cérebros dos animais foram retirados e devidamente acondicionados em nitrogênio líquido até o final da coleta das amostras. Ao fim da coleta, as amostras de sangue foram centrifugadas a 3000 rotações por minuto (rpm) por 10 minutos, a 4ºC, para obtenção do plasma. As amostras de cérebro foram pesadas e homogeneizadas em solução adequada para extração de citocinas, contendo inibidor de protease preparada a partir de uma solução de PBS 1x (NaCl 0,4 M; Tween 20 0,05%; Albumina de soro bovino (BSA) 0,5%; Fluoreto de fenilmetilsufonila (PMSF) 0,1mM; cloreto de benzetônio 0,1 mM; EDTA 10 mM; 20 μI de aprotinina). Para cada 100 mg de tecido foi adicionado 1mL de solução para o processo de homogeneização. O homogenato foi centrifugado a 10000 rpm, por 10 minutos, a 4ºC. O sobrenadante foi recolhido, aliquotado e estocado a -20ºC até o uso. Os kits ELISA para dosagem das citocinas TNF-α; IL-1β; IL-10 e da quimiocina CXCL1/KC foram obtidos da R&D Systems (Minneapolis, USA). Os kits das quimiocinas CXCL2/MIP-2 e MCP-1 foram obtidos da Peprotech’s Elisa
36 biotinilado e específico para cada molécula, seguida de incubação de duas horas e uma etapa de lavagem. Transcorrida essa etapa, foram adicionadas a cada placa uma solução contendo estreptavidina ligada à peroxidase. Após 30 minutos, a placa foi novamente lavada, e foi adicionado o tampão substrato contendo o-fenilenodiamina (OPD) e H2O2. Após cerca de 30 minutos, a reação foi interrompida
com 50 µl de ácido sulfúrico (H2SO4) 1M. A leitura das placas foi feita utilizando um leitor de placas a 492 nm (Thermo Plate reader). A concentração referente a cada amostra foi calculada a partir da curva padrão correspondente. Sendo que a concentração mínima detectável para cada molécula avaliada foi: MCP-1, 3.9 pg/mL; CXCL-2/MIP-2, 15.62 pg/mL; CXCL-1/KC, 15.65 pg/mL; IL-1β, 15.62 pg/mL IL-10, 31.25 pg/mL e TNF-α: 31.2 pg/mL.
4.7. Citometria de fluxo
A técnica de citometria de fluxo foi utilizada para análise das populações de monócitos e neutrófilos no sangue e medula óssea, bem como para análise da expressão de CD11b nos neutrófilos e monócitos da medula óssea.
Os camundongos foram anestesiados com uma mistura de Ketamina (100mg/Kg, Dopalen, Paulínea, Brasil) e Xilasina (10mg/Kg, Anasedan, Paulínea, Brasil) e o sangue foi coletado por punção cardíaca e mantido em tubos individualizados contendo EDTA. Sobre um volume de 400μl de sangue foi adicionado 4mL de solução de lise (FACS Lysing Solution BD, San Jose, CA) (1x), a mistura foi mantida sob incubação por 5minutos à temperatura ambiente, com objetivo de causar lise das hemácias.
38
Especificidade Célula
Alvo Fluorocromo Diluição Marca
CD45 Leucócitos PB 1:1000 Biolegend
CD115 Monócitos PE 1:1000 Biolegend
Ly6G Neutrófilos FITC 1:1000 Biolegend
CD11b --- APC 1:2000 Biolegend
Tabela 1. Relação de anticorpos monoclonais conjugados à diferentes fluorocromos direcionados à
detecção de proteínas de superfície celular, utilizados nos experimentos de citometria de fluxo.
4.8. Contagem global de Leucócitos com uso de Câmara de Neubauer
Para a contagem global de leucócitos circulantes, foram coletados 5µl de sangue da cauda do animal e adicionados à 95 µL de solução de Turkey. A contagem foi feita usando uma câmara de Neubauer (Carvalho, 1983), em condição basal e a cada trinta minutos após a administração de LPS em animais WT, por um período total de 3 horas.
4.9. Análise estatística