UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE TECNOLOGIA
DEPARTAMENTO DE ENGENHARIA QUÍMICA
PROGRAMA DE PÓS-GRADUAÇÃO EM ENGENHARIA QUÍMICA
TESE DE DOUTORADO
Otimização do Meio de Cultura para a Produção
de Quitosanase por Metarhizium anisopliae em
Cultivo Descontínuo Submerso
Raimundo Cosme da Silva Filho
Raimundo Cosme da Silva Filho
Otimização do Meio de Cultura para a Produção de
Quitosanase por
Metarhizium anisopliae
em Cultivo
Descontínuo Submerso
Tese apresentada ao Programa de Pós-Graduação em Engenharia Química – PPGEQ, da Universidade Federal do Rio Grande do Norte, como parte dos requisitos para obtenção do título de Doutor em Engenharia Química, sob a orientação do Prof. Dr. Everaldo Silvino dos Santos e a coorientação da Profª. Drª. Gorete Ribeiro de Macedo.
Catalogação da Publicação na Fonte. UFRN / CT / PPGEQ
Biblioteca Setorial “Professor Horácio Nícolas Sólimo”.
Silva Filho, Raimundo Cosme da.
Otimização do meio de cultura para a produção de quitosanase por Metarhizium anisopliae em cultivo descontínuo submerso / Raimundo Cosme da Silva Filho. -
Natal, 2013. 98 f.: il.
Orientador: Everaldo Silvino dos Santos. Co-orientador: Gorete Ribeiro de Macedo.
Tese (Doutorado) - Universidade Federal do Rio Grande do Norte. Centro de Tecnologia. Departamento de Engenharia Química. Programa de Pós-Graduação em Engenharia Química.
1. Quitosana - Tese. 2. Quitina - Tese. 3. Quitosanase – Tese. 4. Metarhizium anisopliae - Tese. I. Santos, Everaldo Silvino dos. II. Macedo, Gorete Ribeiro de.
III. Universidade Federal do Rio Grande do Norte. IV. Título.
AGRADECIMENTOS
A Deus, por estar presente em todos os momentos da minha vida e por me ceder à oportunidade de iniciar e concluir este trabalho.
A minha mãe Cândida Inocência da Silva que esteve comigo em todos os momentos da minha vida me educando, me amando e sempre me dando muito carinho.
Ao meu pai Raimundo Cosme da Silva, que não está mais aqui para ver este trabalho, mas que foi a pessoa que mais me apoiou e me incentivou, em todos os momentos da minha vida, para que eu pudesse chegar o mais longe possível na minha carreira acadêmica. Pai muito obrigado por toda atenção, educação, amor e carinho que recebi durante toda a minha vida.
Aos meus irmãos e familiares que sempre estiveram comigo dividindo momentos de grande alegria e às vezes de tristeza, mas sempre nos mantendo unidos para superarmos todos os obstáculos.
A minha namorada Rochelly Caroliny por todo amor e carinho que me deu e que me entendeu nos momentos que estive ausente para a conclusão deste trabalho.
Ao meu orientador Professor Doutor Everaldo Silvino dos Santos por confiar em mim e me aceitar como orientando além de toda a amizade, orientação e dedicação em todas as etapas de desenvolvimento e conclusão deste trabalho.
À Professora Doutora Gorete Ribeiro de Macedo, “pessoa que admiro muito como profissional e principalmente, como pessoa, um exemplo a ser seguido”, pelos conselhos e críticas quando necessários ao desenvolvimento deste trabalho. Professora a senhora é considerada uma mãe para de todos os alunos que tiveram a honra de conhecê-la e trabalhar com a senhora.
Aos meus amigos Engenheiros Químicos, Ana Carmen, Ana Katerine, Andréa Farias, Anita Lima, Sirtys Lessa, Alexandre, Sérgio, Márcio Bezerra e ao Biólogo Daniel Souza, que sempre me ouviram e que me ajudaram de alguma forma nesse trabalho.
A Eusamar Coelho de Lima, Mazinha, secretária do PPGEQ, pelo apoio, pela paciência e orientação nas questões burocráticas do processo.
A Carlos e Jardelson, pela grande colaboração e dedicação nos experimentos do laboratório.
Ao meu amigo Ubiratan Nazaré por me ajudar na organização do texto e na tradução para o Abstract.
SILVA FILHO, Raimundo Cosme da – Otimização do Meio de Cultura para a Produção de Quitosanase por Metarhizium anisopliae em Cultivo Descontínuo Submerso. Tese de
Doutorado. UFRN - Programa de Pós-Graduação em Engenharia Química. Área de Concentração: Pesquisa e Desenvolvimento de Tecnologias Regionais – Subárea: Engenharia de Processos – Alimentos e Biotecnologia, Natal/RN, Brasil.
Orientação: Prof. Dr. Everaldo Silvino dos Santos
Coorientação: Profª. Drª. Gorete Ribeiro de Macedo
___________________________________________________________________________
RESUMO:
No presente trabalho utilizou-se um Planejamento Plackett & Burman, com 8 fatores e 12 ensaios em 2 níveis e mais 3 repetições na condição do ponto central, para se investigar a influência das concentrações de quitosana, peptona, extrato de levedura, NaNO3,K2HPO4, KCl, MgSO4.7H2O e FeSO4 na produção da enzima quitosanase por Metarhizium
anisopliae. Os ensaios para produção da enzima foram realizados em cultivo descontínuo
submerso. Os resultados para o Planejamento Plackett & Burman mostraram que a atividade quitosanolítica foi favorecida pelo aumento da concentração de substrato (quitosana) e de sulfato ferroso (FeSO4), enquanto que o aumento da concentração dos outros fatores não
contribuiu de forma significativa para a atividade quitosanolítica. A otimização do meio de cultura para a produção da enzima foi realizado por meio de um Planejamento Composto Central, com os dois fatores que mais influenciaram a atividade quitosanolítica (quitosana e FeSO4), conforme Planejamento Plackett & Burman, mantendo-se os outros nutrientes em
seus valores mínimos. Nesse planejamento, para o fator FeSO4, tomou-se o limite inferior (-1)
como sendo o limite superior do Planejamento Plackett & Burman. Os resultados mostraram que a produção da enzima foi favorecida pelo aumento da concentração quitosana e pela diminuição da concentração de FeSO4. A produção máxima de atividade quitosanolítica foi da
ordem de 70,0 U/L e foi atingida em apenas 18 h de fermentação, resultado esse vinte e oito vezes maior aos obtidos anteriormente para o mesmo microrganismo que foi 2,5 U/L em 48h.
ABSTRACT
In this work a Plackett-Burman Design with 8 factors and 12 trials in 2 levels with 3 repetitions at the center point was used in order to investigate the influence of the concentration of chitosan, peptone, yeast extract, NaNO3, K2HPO4, KCl, MgSO4.7H2O
and FeSO4 on chitosanase production by Metarhizium anisopliae. Runs were carried out
using submerged discontinuous cultivation for enzyme production. The results of the Plackett & Burman Design showed that only two factors, chitosan concentration as well as FeSO4 had influence on chitosanolytic activity, while the increase in concentration of
other factors not contributed significantly to the quitosanolítica activity. Cultivation medium optimization for enzyme production was carried out using a Composite Central Design, with the most important factors for chitosanolytic activity (chitosan and FeSO4), in accordance with Plackett & Burman Design, and keeping the other nutrients
in their minimum values. On this other design, it was taken the highest limit in Plackett & Burman Design as the lowest limit (-1) to FeSO4 factor. The results showed that the
enzyme production was favoured by increasing the chitosan concentration and by decreasing FeSO4. Maximum production for chitosanolytic activity was about 70.0 U/L
and was reached in only 18 h of fermentation, a result about twenty-eight times greater than a former study using the same microorganism (about 2.5 U/L at 48 h).
Sumário
LISTA DE FIGURAS LISTA DE TABELAS NOMENCLATURA
INTRODUÇÃO...15
REVISÃO BIBLIOGRÁFICA...18
2.1. Enzimas...18
2.1.1. Quitosana e seus derivados...19
2.1.2. Quitosanases...24
2.2. Fungos...29
2.2.1. Características gerais...29
2.2.2. Reprodução dos Fungos...32
2.2.3. Metabolismo de fungos...33
2.2.4. Nutrição de fungos...34
2.2.5. O Fungo Metarhizium anisopliae ...36
2.3. Fermentação...40
2.3.1. Preparo do inóculo...41
2.3.2. Produção de enzimas em cultivo submerso descontínuo...42
2.4. Planejamento experimental...42
2.4.1. Planejamento fatorial...43
2.4.2. Planejamento Plackett & Burman...43
2.4.3. Aplicações do Planejamento Plackett & Burman...44
METODOLOGIA EXPERIMENTAL...50
3.1. Quitosana...50
3.2. Microrganismo...50
3.2.2. Manutenção da cepa...50
3.3. Produção de enzima...51
3.4. Determinação da Proteína Total...51
3.5. Determinação da Atividade Quitosanolítica e Atividade Específica...51
3.6. Planejamento Experimental...52
3.6.1. Planejamento de seleção de fatores Plackett Burman...52
3.6.2. Planejamento Composto Central para Otimização do meio de cultura para a Produção da Enzima em Cultivo Submerso...53
3.7. Perfil Cinético durante o Cultivo...56
RESULTADOS E DISCUSSÃO...58
4.1. Imagem do micélio de Metarhizium anisopliae em meio PDA ...58
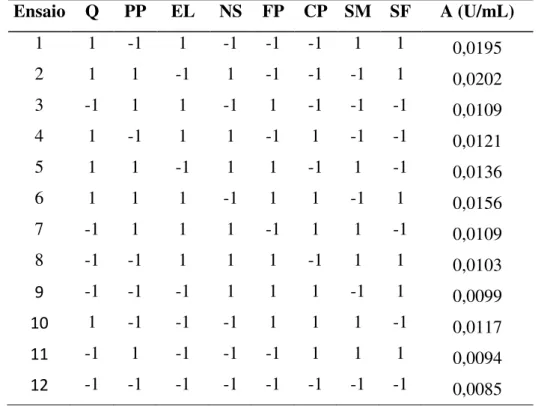
4.2. Planejamento Plackett & Burman...59
4.2.1. Análise do Plackett & Burman com 8 fatores e 12 ensaios ...59
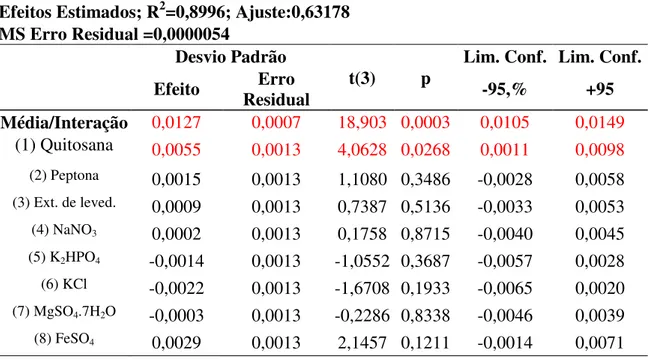
4.2.2. Análise do Plackett & Burman com 12 ensaios e mais 3 repetições na condição do ponto central ...61
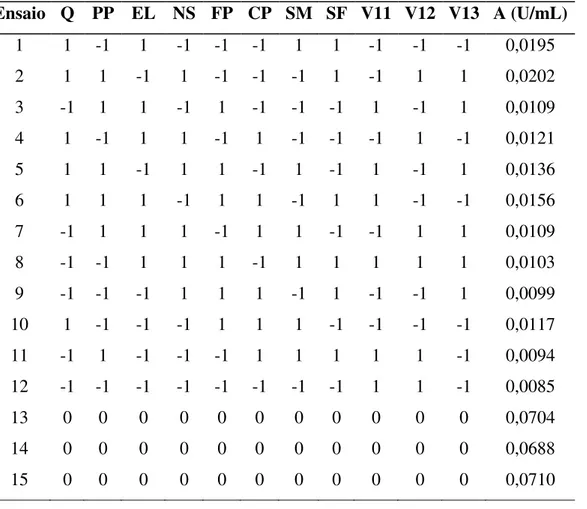
4.3. Planejamento Composto Central para Produção de Quitosanase por Metarhizium anisopliae em Cultivo Descontínuo Submerso...64
4.4. Perfil Cinético – Melhor Condição...69
CONCLUSÃO...75
REFERÊNCIAS BIBLIOGRÁFICAS...78
APÊNDICE I...93
Metodologia para Repique da Cepa ...93
APÊNDICE II...94
Montagem da Curva de Calibração Usando o Método DNS...94
APÊNDICE III...96
Lista de Figuras
Figura 1 – Estrutura da quitosana...20
Figura 2 – Estrutura da glicosamina...23
Figura 3 – Estrutura do sulfato de glicosamina...23
Figura 4 – Representação da estrutura geral de uma célula de fungo...30
Figura 5 – Estrutura das Hifas: a) septadas e b) asseptadas...31
Figura 6 – Conídios de Aspergillus e Penicillium...33
Figura 7 – Imagem do MEV do micélio de Metarhizium anisopliae em meio PDA ...58
Figura 8 – Gráfico de Pareto do planejamento Plackett & Burman mostrando a influência dos fatores estudados...60
Figura 9 – Gráfico de Pareto do planejamento Plackett & Burman com triplicata no ponto central mostrando a influência dos fatores estudados...63
Figura 10 – Gráfico de Pareto do planejamento Composto Central mostrando a influência dos fatores estudados...67
Figura 11 – Valores preditos em função dos valores observados...68
Figura 12 – Atividade quitosanolítica em função da concentração de quitosana e da concentração de FeSO4 para os fatores não significativos no ponto central ...68
Figura 13 – Concentração de proteínas totais em função do tempo de cultivo na produção de quitosanase por Metarhizium anisopliae em meio de cultivo contendo 0,2% de quitosana ...70
Figura 14 – Perfil da atividade quitosanolítica em função do tempo de fermentação com o Metarhizium anisopliae cultivado em meio contendo 0,2% de quitosana...70
Figura 15 – Perfil da atividade específica da quitosanase em função do tempo de fermentação com o Metarhizium anisopliae cultivado em meio contendo 0,2% de quitosana...71
Figura 16 – Perfil de açúcares redutores por Metarhizium anisopliae em meio de cultivo contendo 0,2% de quitosana...72
Figura 17 – Curva padrão de glicosamina ...95
Lista de Tabelas
Tabela 1 – Comparação das enzimas com os catalisadores químicos...19
Tabela 2 – Fontes naturais de quitina e quitosana ...20
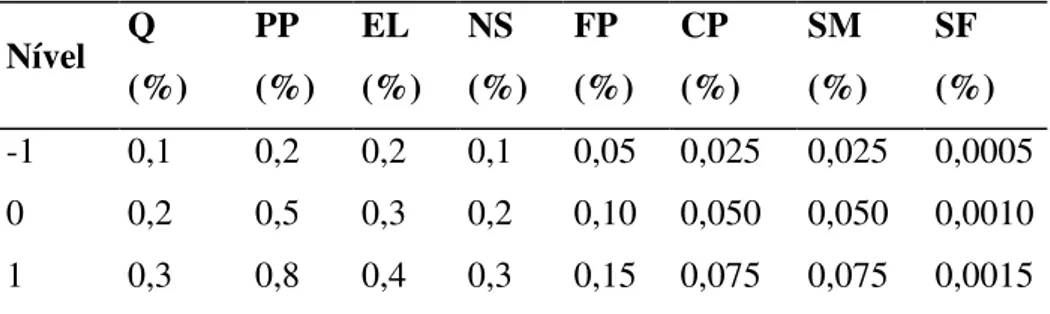
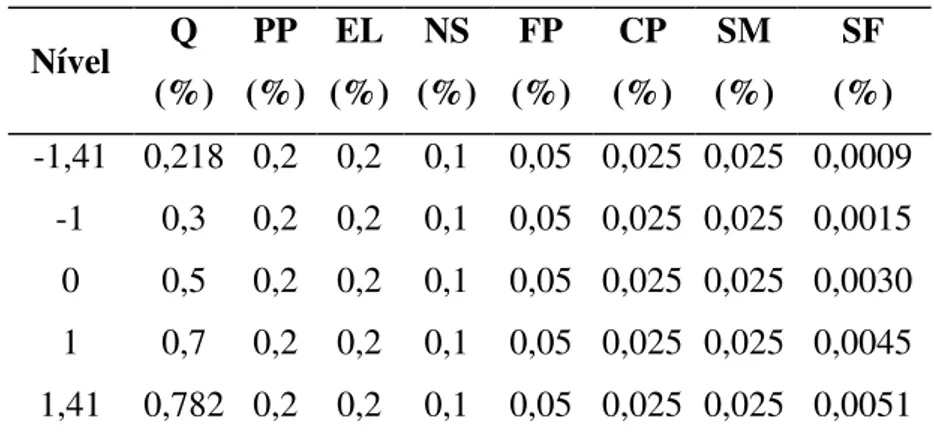
Tabela 3 – Níveis para os fatores e seus valores codificados...53
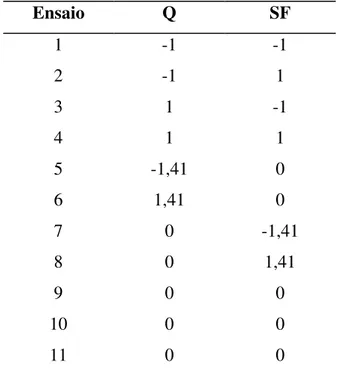
Tabela 4 – Matriz do planejamento Plackett & Burman com 8 fatores e 12 ensaios e mais 3 repetições na condição do ponto central ...53
Tabela 5 – Matriz do planejamento Composto Central...54
Tabela 6 – Níveis para os fatores e seus valores codificados para o cultivo submerso – Planejamento Composto Central...55
Tabela 7 – Matriz do planejamento Plackett & Burman com 8 fatores e 12 ensaios...59
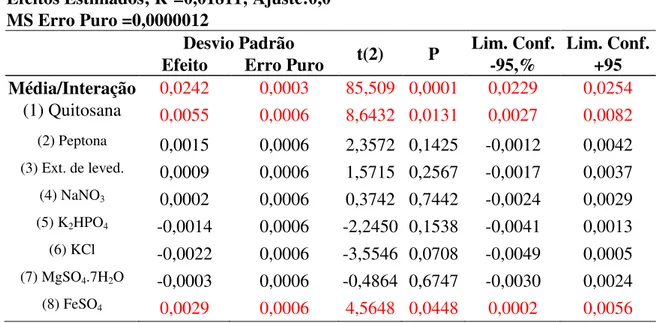
Tabela 8 – Efeitos Estimados do planejamento Plackett & Burman...60
Tabela 9 – Matriz do planejamento Plackett & Burman com 8 fatores e 15 ensaios...61
Tabela 10 – Efeitos Estimados do planejamento Plackett & Burman com triplicata no ponto central...62
Tabela 11 – Matriz do planejamento Composto Central com os respectivos resultados da atividade enzimática...65
Tabela 12 – Efeitos Estimados do planejamento Composto Central...65
Tabela 13 – Resumo da ANOVA...66
Tabela 14 – Dados para construção da curva de calibração usando o Método DNS ...94
Tabela 15 – Medidas de absorbância a 600 nm para construção da curva de calibração...94
NOMENCLATURA
A – Atividade quitosanolítica (U/L) AE – Atividade específica (U/mg)
ANN-GA – algoritmo genético de rede neural artificial ANOVA – Análise de variância (Analysis of Variance)
BSA – Albumina de soro bovino (Bovine Sereum Albumin) CCD – Planejamento Composto Central
CDA – Chitosan Dector Agar
Cs – Concentração de substrato (%)
CP – Concentração de KCl (%) Da – Dalton
DEQ – Departamento de Engenharia Química DNS – Ácido Dinitrosalissílico
E – Enzima
Ea – Energia de ativação
EC – Comissão para nomenclatura e classificação de enzimas EL – Concentração de Extrato de Levedura (%)
FP – Concentração de K2HPO4 (%)
NS – Concentração de NaNO3 (%)
GDA – Grânulos dispersíveis em água k – Número de fatores, variáveis
LEB – Laboratório de Engenharia Bioquímica mRNA – RNA mensageiro
n – Número de níveis de um determinado fator N – Número de ensaios de um planejamento P – Pressão
PP – Concentração de Peptona (%) PDA – Batata Dextrose Agar pH – Potencial hidrogeniônico Q – Concentração de Quitosana (%) Qm – Quadrado médio
r – Agitação (rpm)
RA – Razão de aeração rpm – Rotações por minuto
RSM – Metodologia de superfície de resposta S – Molécula de substrato
SF – Concentração de FeSO4 (%)
SM – Concentração de MgSO4.7H2O (%)
SQ – Soma de quadrados
SSF – Fermentação de estado sólido T – Temperatura
TMC – Temperatura de cultivo
V11,V12,V13 – Variáveis inertes para cálculo do erro VHG – Fermentação de alta densidade
WP – Pó molhável X – Concentração celular Xi – variável independente
Xj – variável independente xi – Fator independente real x0 – Valor de xi no ponto central
xi – Variação de valor
Y – Resposta do modelo de primeira ordem
Yp – Resposta do modelo polinomial de segunda ordem 0 – Interseção dos modelos de primeira ou segunda ordem
i – Coeficiente linear dos modelos de primeira ou segunda ordem
Capítulo 1 Introdução
______________________________________________________________________
Raimundo Cosme da Silva Filho – Tese de Doutorado – UFRN – PPGEQ
15
1. Introdução
As quitosanases foram descobertas simultaneamente há quase quarenta anos por Monaghan et al. (1973), como pelo grupo de Ramirez-León & Ruiz-Herrera (1972), e
são enzimas obtidas a partir do metabolismo de bactérias, fungos e extraídas de plantas. Desde então, vários estudos vêm apresentando a obtenção de quitosanase deste microrganismos, na forma intracelular ou extracelular (Osswald et al., 1994;
Somashekar & Joseph, 1996), como a do presente estudo. A quitosanase (EC 3.2.1.132) representa uma classe de enzimas hidrolíticas que catalisam a hidrólise de ligação -(1 4) glicosídica da quitosana, gerando oligômeros chamados quito-oligossacarídeos (Reddy et al., 2008).
A quitosana é um biopolímero hidrofílico obtido a partir da quitina, um polissacarídeo abundante na natureza. Na literatura, é considerado quitosana o produto da desacetilação da quitina para um grau de desacetilação superior a 75% e solúveis em ácidos como o acético e o fórmico. A quitosana é conhecida por exibir uma ampla variedade de atividade fisiológica como atividade antitumoral, mas o peso molecular e a insolubilidade em água da quitosana são desvantagens para várias aplicações. Atualmente, há interesse nas quitosanas quando as mesmas são convertidas em quito-oligossacarídeos porque eles não apenas são solúveis em água e possuem baixo peso molecular, mas também têm atividades biológicas bem notáveis, como atividade anticancerígena atóxica e biocompatível, incluindo efeito antimetastático, atividade anti-HIV, hepatoprotetora, antioxidante, hipocolesterolêmica, antimicrobiana, imunoestimulate, antitumoral, anti-inflamatória e atividade aceleradora da absorção de cálcio e ferro. No entanto, estes quito-oligossacarídeos são obtidos tradicionalmente na indústria por reação de hidrólise usando ácidos, que apresenta muitos problemas como dificuldade em controlar a hidrólise, produzindo uma grande quantidade de oligossacarídeos de cadeia pequena e oligossacarídeos de baixo rendimento, alto custo de separação e, também, poluição ambiental, uma vez que utiliza um ácido como catalisador. Como alternativa, com suas vantagens em termos de compatibilidade ambiental, baixo custo e reprodutibilidade, a obtenção destes quito-oligossacarídeos por hidrólise com quitosanase se tornou cada vez mais popular nos últimos anos (Azevedo
Capítulo 1 Introdução
______________________________________________________________________
Raimundo Cosme da Silva Filho – Tese de Doutorado – UFRN – PPGEQ
16 Devido a todos estes aspectos positivos é que, em geral, as enzimas vêm sendo estudadas em diferentes aplicações, mostrando que esta é uma tendência na indústria.
No presente trabalho, foi desenvolvido um processo fermentativo visando a otimização do meio de cultura para a produção da enzima quitosanase em cultivo descontínuo submerso, por Metarhizium anisopliae, capaz de sintetizar oligômeros com
aplicações na indústria farmacêutica e de química fina, partindo de quitosana como única fonte de carbono.
Nesse caso, avaliou-se, através de um planejamento Plackett & Burman (método de delineamento de seleção de fatores) e de um planejamento Composto Central as melhores condições para a produção da enzima. A técnica do planejamento experimental Plackett & Burman para realizar triagem de fatores na otimização de um determinado processo foi utilizada neste trabalho para identificar quais os fatores que influenciam de forma significativa na produção da enzima quitosanase. A influência destes fatores (concentração de quitosana e concentração de FeSO4) foi então
investigada pelo planejamento Composto Central com 22 experimentos na parte fatorial, repetição em triplicata no ponto central e quatro experimentos na parte axial. A repetição do ponto central permite também a determinação do erro puro e da repetibilidade do processo, sendo uma forma de identificar melhor se o processo está sob controle.
Capítulo 2
Capítulo 2 Revisão Bibliográfica
______________________________________________________________________
Raimundo Cosme da Silva Filho – Tese de Doutorado – UFRN – PPGEQ
18
2. Revisão Bibliográfica
2.1. Enzimas
As enzimas são catalisadores biológicos constituídos por longas cadeias de aminoácidos que atuam em substratos reduzindo a energia de ativação, acelerando assim a velocidade da reação, e transformando-os em produtos. Sua atuação catalítica visa facilitar a atividade das células através da quebra de moléculas ou junção das mesmas para formação de novos produtos. Podem apresentar alto grau de especificidade relativa a apenas um substrato ou a vários substratos ao mesmo tempo, como a certos tipos de ligações glicosídicas α-1,4 das moléculas de amido, ou para determinado tipo particular de isômero óptico como ocorre na oxidação da β-D-glicose pela glicose oxidase (Furigo Junior & Pereira, 2001).
Enzimas são proteínas que apresentam em sua estrutura um centro ativo (apoenzima) e, em alguns casos, um grupo prostético denominado cofator (coenzima ou íon metálico ativo) e sua atividade depende de alguns fatores como estrutura da proteína, número de cadeias peptídicas, arranjo dessas cadeias na molécula, natureza do substrato e natureza do grupo prostético (Politzer & Bon, 2006).
Todos os organismos vivos produzem, em pequena ou grande quantidade, certa variedade de enzimas, sejam elas intra ou extracelulares. As enzimas extracelulares são excretadas para o meio externo e podem decompor compostos insolúveis como celulose, quitina e quitosana.
Algumas destas enzimas podem ser usadas tanto nas indústrias de detergentes, têxteis e farmacêuticas, como também de alimentos, de bebidas, etc., sendo utilizadas em processos biotecnológicos industriais em substituição aos processos químicos que muitas vezes causam grandes prejuízos ao meio ambiente. A produção comercial das enzimas pode ser realizada através do cultivo de microrganismos como fungos e bactérias.
Capítulo 2 Revisão Bibliográfica
______________________________________________________________________
Raimundo Cosme da Silva Filho – Tese de Doutorado – UFRN – PPGEQ
19 velocidade de reação, como desvantagem cita-se o custo de obtenção (isolamento e purificação).
Tabela 1 – Comparação das enzimas com os catalisadores químicos (Adaptado de Furigo Junior & Pereira, 2001).
Característica Enzimas Catalisadores Químicos
Especificidade ao substrato Alta Baixa
Natureza da estrutura Complexa Simples
Sensibilidade à T e pH Alta Baixa
Condições de reação (T, P e pH) Suaves Drástica (geralmente) Custo de obtenção (isolamento e purificação) Alto Moderado
Natureza do processo Batelada Contínuo
Consumo de energia Baixo Alto
Formação de subprodutos Baixa Alto
Separação catalisador/produtos Difícil/cara Simples Atividade catalítica (temperatura ambiente) Alta Baixa
Presença de cofatores Sim Não
Estabilidade do preparado Baixa Alta
Energia de Ativação Baixa Alta
Velocidade de reação Alta Baixa
2.1.1. Quitosana e seus derivados
A quitosana e seus derivados apresentam grande importância devido ao conhecimento de suas funcionalidades biológicas, médicas, tecnológicas, etc (Shimosaka et al, 1993; Shimosaka et al, 1995; Mitsutomi et al., 1995). A quitosana é
Capítulo 2 Revisão Bibliográfica
______________________________________________________________________
Raimundo Cosme da Silva Filho – Tese de Doutorado – UFRN – PPGEQ
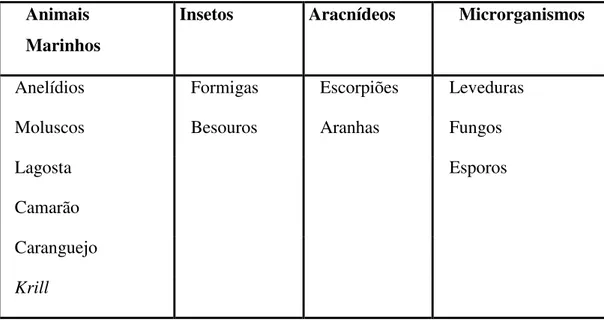
20 Tabela 2 – Fontes naturais de quitina e quitosana. (Adaptado de Polymar, 2003).
Animais Marinhos
Insetos Aracnídeos Microrganismos
Anelídios Formigas Escorpiões Leveduras
Moluscos Besouros Aranhas Fungos
Lagosta Esporos
Camarão Caranguejo
Krill
A Figura 1 abaixo mostra a estrutura química da quitosana
Figura 1 – Estrutura da quitosana (Fonte: Polymar, 2003)
Quitosana totalmente desacetilada não existe na natureza. Graus de acetilação (GA) nferior a 50% a torna mais solúvel em soluções ácidas (Muzzarelli, 1993; Muzzarelli et al., 1994; Dung et al., 1994; Stoyachenko et al.,1994). Pelletier &
Sygusch (1990) enfatizaram que grande parte dos resíduos sólidos da indústria pesqueira, principalmente da carcinicultura, é jogada ao mar ocasionando degradação ambiental. Logo, a utilização desses resíduos como matéria-prima para formação de novos produtos, não só reduz de forma drástica o impacto ambiental, mas também daria maior valor agregado à indústria pesqueira.
Capítulo 2 Revisão Bibliográfica
______________________________________________________________________
Raimundo Cosme da Silva Filho – Tese de Doutorado – UFRN – PPGEQ
21 quitosana e seus derivados contra microrganismos, tais como bactérias, bolores e leveduras tem tido maior atenção ultimamente.
Devido à interação entre a quitosana, que é positivamente carregada, e as membranas celulares dos microrganismos, negativamente carregadas, ocorre a formação de verdadeiros poros na membrana, que são canais de vazamento de conteúdo protéico e outros componentes intracelulares. A quitosana tem também a propriedade de agir como agente quelante que se liga de forma seletiva a traços de metais, inibindo, assim, a produção de toxinas e o crescimento microbiano. Ainda é capaz de ativar mecanismos de defesa em tecidos hospedeiros, atuando como agente sequestrante de água e inibindo várias enzimas. A ligação da quitosana com DNA e a inibição da síntese do mRNA ocorre via penetração da quitosana no núcleo dos microrganismos e interferência na síntese do mRNA e proteínas, (Craveiro et al., 2004).
Em um estudo clínico conduzido por Giustina & Ventura (1995) com 100 pessoas com sobrepeso de 10 a 25%, ao final de 4 semanas as pessoas que receberam quitosana demonstraram perda de peso significativa (7,3 Kg contra 3,0 Kg nos grupos controle). As pessoas que tomaram quitosana também demonstraram redução na pressão sanguínea sistólica (de 145 para 135 mm Hg) e diastólica (92.6 para 84.2 mm Hg), assim como uma redução na taxa respiratória (27.6/min a 21.2/min).
Kondo & Osada (1996) pesquisaram a influência da quitina e da quitosana na biodisponibilidade do zinco em ratos alimentados com uma dieta com suplementos de 5% ou sem fibra dietética (quitina, quitosana, celulose, pectina e agar-agar) durante 31 dias. Observaram que os ratos alimentados com dietas contendo 5% de fibras, exceto quitosana, o consumo de alimento foi maior do que o controle. O ganho de peso em todos os grupos alimentados com fibra foi maior do que o controle, exceto para o grupo suplementado com quitosana (5%) onde a ingestão de alimento e o ganho de peso foram menores do que os grupos controle e das demais fibras.
Segundo Craveiro et al. (2004), derivados da quitosana obtidos pela reação com
Capítulo 2 Revisão Bibliográfica
______________________________________________________________________
Raimundo Cosme da Silva Filho – Tese de Doutorado – UFRN – PPGEQ
22 Han et al. (1999) examinaram os efeitos da quitosana sobre a atividade da lipase
pancreática in vitro e sobre o grau de armazenamento de gorduras induzido em ratos
pela administração oral de uma dieta rica em gorduras por nove semanas. Como resultado, observou-se que os animais alimentados com quitosana, reduziram o peso corporal, a hiperlipidemia e a gordura hepática. Como conclusão, os autores propõem que os efeitos anti-obesidade da quitosana em ratos alimentados com alto teor de gordura se devem parcialmente a inibição da absorção intestinal das gorduras dietéticas.
Em outro ensaio, Zahorska-Markiewicz et al. (2002) realizaram um estudo para
avaliar o efeito da quitosana no tratamento da obesidade. Segundo os autores do estudo, a quitosana pode ser usada como um valioso e seguro coadjuvante em tratamentos para a obesidade em longo prazo. A quitosana parece acentuar a redução da pressão arterial, juntamente com a perda de peso.
Assis (2010) estudou a produção e caracterização de quitooligossacarídeos produzidos pelo fungo Metarhizium anisopliae e avaliação da citotoxicidade em células
tumorais. A hidrólise da quitosana foi realizada em tempos de 10 a 60 min para a produção de quitooligossacarídeos. A avaliação da citotoxicidade dos oligômeros de quitosana foi realizada em células tumorais (HepG2 e HeLa) e não tumoral (3T3). A produção de oligômeros de quitosana teve maiores rendimentos durante 10 minutos de hidrólise, os pentâmeros apresentaram concentração de 0,15 mg/mL, no entanto os hexâmeros, que apresentam maior interesse por causa de suas propriedades biológicas, só foram detectados com 30 minutos de hidrólise com uma concentração de 0,004 mg/mL.
Ghorbel-Bellaaj et al. (2010) estudaram a otimização da extração de quitina a
partir de fermentação de resíduos de camarão por Pseudomonas aeruginosa A2
utilizando o planejamento Plackett-Burmam e a metodologia de superfície de resposta. Os resultados mostraram que a eficiência máxima de extração da quitina foi conseguida nas seguintes condições: concentração de casca de camarão 50g/L, glicose 50g/L, tempo de incubação de 5 dias e inoculo como 0,05 OD (densidade óptica).
Capítulo 2 Revisão Bibliográfica
______________________________________________________________________
Raimundo Cosme da Silva Filho – Tese de Doutorado – UFRN – PPGEQ
23
Figura 2 – Estrutura da glicosamina (Fonte: Polymar, 2003)
O sulfato de glicosamina é um derivado da quitosana sendo utilizado no tratamento da osteoartrite sintomática dos joelhos, quadris, coluna, mãos e outras regiões (Craveiro et al., 2004). O sulfato de glicosamina estimula a síntese de
proteoglicanos necessários para o bom funcionamento das articulações, estimula a regeneração das cartilagens e ainda incorpora enxofre ao tecido cartilaginoso. Estudos de longa duração, acima de 3 anos, mostram que o sulfatos de glicosamina evita a progressão de danos estruturais nas articulações e induz melhora significativa nas dores e funções físicas (Craveiro et al., 2004). A Figura 3 apresenta a estrutura química do
sulfato de glicosamina.
Capítulo 2 Revisão Bibliográfica
______________________________________________________________________
Raimundo Cosme da Silva Filho – Tese de Doutorado – UFRN – PPGEQ
24
2.1.2. Quitosanases
Dependendo do tipo de quitosanase obtida, ocorrem diferentes mecanismos de hidrólise da quitosana, isso devido a diferentes microrganismos produzirem enzimas com diferenças nas suas estruturas (Kurita et al., 1977; Seino et al., 1991).
Quitosanases (EC 3.2.1.132) são enzimas que catalisam a reação de hidrólise de quitosana em oligossacarídeos. As enzimas quitosanases são produzidas por vários microrganismos, bactérias, actinomicetos e fungos, e até por algumas plantas. Estas enzimas agem em polímeros com grau de acetilação de 30% a 60%. Os monômeros resultantes da hidrólise da quitosana por estas enzimas são melhores digeridos, ao serem ingeridos, como é o caso da glicosamina. Estudos efetuados até o presente momento classificam as quitosanases em cinco famílias: 5, 8, 46, 75, 80, sendo que a família 46 é a mais estudada. As quitosanases tem grande aplicação na geração de oligômeros de quitosana (Somashekar & Joseph, 1996; Chen et al., 2005).
Nogawa et al. (1998) estudaram a produção, purificação e caracterização total de
uma quitosanase produzida pelo fungo Trichoderma reseei PC-3-7. Estes pesquisadores
inocularam 106 conídios em 100 mL de um meio basal contendo 0,3% de N-acetilglicosamina em incubator rotativo com agitação de 220 rpm a 28oC. Destaca-se que o fungo não produziu quitosanase em meio contendo quitosana ou quitina. Entretanto, o microrganismo produziu quitosanase em meio contendo glicosamina e N-acetilglicosamina, sendo que para este último obteve-se uma atividade específica máxima de 1,5 U/mg após 72 horas de incubação. É importante ressaltar que uma agitação vigorosa favoreceu a produção da enzima. Esse artigo ilustra a presença de exo-β-D-glicosaminidase e exo-β-D-N-acetilglicosaminidase.
Piza et al. (1999) estudaram a produção, purificação e caracterização parcial de
uma quitosanase produzida por Bacillus cereus. Nesse caso, investigou-se através de um
planejamento fatorial fracionário a influência dos fatores: concentração de sulfato de amônio (0,4; 2,2 e 4,0%), razão de aeração (2; 6 e 7), tempo de fermentação (16; 24 e 32 horas), pH (5; 6 e 6,5) e concentração de quitosana (1,0; 1,5 e 2,0%). Os resultados mostraram que os fatores mais significativos para esse planejamento foram a concentração de sulfato de amônio, a aeração, o pH e a interação entre sulfato de amônio e a aeração.
Capítulo 2 Revisão Bibliográfica
______________________________________________________________________
Raimundo Cosme da Silva Filho – Tese de Doutorado – UFRN – PPGEQ
25 induzida em meio contendo quitosana como única fonte de carbono e também na presença de quitina coloidal. A indução da enzima foi realizada em temperaturas variando na faixa de 28 a 30ºC, pois essa espécie não cresceu bem em temperaturas superiores a 37ºC.
Zhang et al. (2000) estudaram a produção, purificação e caracterização de
quitosanase e Exo-β-D-Glucosaminidase por Aspergillus oryzae IAM2660. Os
microrganismos utilizados neste estudo foram mantidos em placas de Petri contendo agar para contagem em placas (PDA). Destaca-se que para produzir a enzima, conídios foram retirados das placas e inoculados em meio Czapeq-dox com os seguintes componentes: 1,0g K2HPO4, 0,5g KCl, 2,0g NaNO3, 0,5g MgSO4.7H2O, 0,02g
FeSO4.7H2O, 20g de sacarose e 1,0L de água deionizada, com pH do meio igual a 5,5.
Foi adicionado ao meio 0,5 g de peptona e 0,5g de extrato de levedura com concentração de esporos da ordem de 1,0x106 esporos.mL-1. Após a incubação, feita em incubador rotativo a 26ºC por um período de 60h, micélios foram coletados e após filtração e secagem a 80ºC foram utilizados para ensaio de quitosanase.
Kuroiwa et al. (2002) estudaram os fatores que afetam a composição de
oligossacarídeos produzidos através da hidrólise de quitosana por quitosanase originária de Bacillus pumilus BN-262. Neste experimento foi utilizado quitosana 100%
desacetilada dissolvida em ácido acético 1M. O pH do meio foi ajustado em 5,6. Neste estudo a quitosanase foi imobilizada em agar e Sepharose. Os resultados mostraram que
a concentração de enzima, a temperatura, a velocidade de agitação, e concentração de substrato influenciaram de forma significativa na composição dos oligossacarídeos produzidos.
Ichikawa et al. (2002) estudaram a imobilização e estabilização da ligação
multiponto da quitosanase tendo agar como suporte e concluíram que a imobilização aumentou a termoestabilidade da quitosanase. Os oligossacarídeos de quitosana foram continuamente produzidos usando um reator coluna contendo quitosanase imobilizada. A percentagem de quitosana imobilizada após 28 dias de reação foi de 44%.
Hung et al. (2002) estudaram a purificação, através de troca iônica, e
Capítulo 2 Revisão Bibliográfica
______________________________________________________________________
Raimundo Cosme da Silva Filho – Tese de Doutorado – UFRN – PPGEQ
26 0,2mg.mL-1, respectivamente. Enquanto que quitosanase apresentou o pH, temperatura e Km ótimo de 3,0, 50ºC e 0,88mg.mL-1, respectivamente.
Zhu et al. (2003) estudaram as melhores condições fermentativas e propriedades
de uma quitosanase produzida por Acinetobacter sp. C-17. A espécie de bactéria
utilizada neste ensaio foi isolada do solo e identificada como sendo Acinetobacter sp
C-17 e capaz de produzir quitosanase. O microrganismo foi mantido em placas contendo o meio agar com os seguintes componentes: 0,5 % de quitosana, 0,2 % K2HPO4, 0,1 %
KH2PO4, 0,07 % MgSO4, 0,05 % NaCl, 0,05 % KCl, 0,01 % CaCl2, 0,05 % de extrato
de levedura e 2 % agar, o pH do meio de manutenção foi mantido em 7,2 e a temperatura foi mantida em 30ºC durante 3 a 5 dias, para identificar a ação da enzima quitosanase. A ação da quitosanase foi identificada através da observação de uma colônia de microrganismo existente na placa. A bactéria foi então isolada da placa e colocada em fermentador rotativo a 200 rpm durante 72h em meio contendo: 0,07 % K2HPO4, 0,03 % KH2PO4, 0,05 % MgSO4, 0,03 % peptona, 0,03 % de extrato de
levedura e 1,0 % de quitosana. O pH foi de 7,0 e a temperatura 30ºC. Como fontes de carbono foram utilizadas além de 1,0 % de quitosana, 1,0 % de quitina e 1,0 % de glicose. Os resultados mostraram que as melhores condições para produção da quitosanase foram alcançadas quando se utilizou 1,0 % de solução de quitosana a 30ºC, pH 7,0 durante 24 horas de incubação.
Liu et al. (2003) estudaram a produção de quitinase por Verticillium lecanii
F091 usando fermentação submersa, a atividade de quitinase foi de 9,95 mU/mL em um meio de cultura otimizado, com um volume de cultura de 200 mL, agitação de 150 rpm e temperatura de 24ºC cultivado em incubador rotativo e concluíram que a taxa de agitação e o pH foram os fatores mais significativos para a produção de quitinase, no entanto, as taxas de agitação e aeração poderiam modificar a concentração de oxigênio dissolvido afetando diretamente no crescimento do Verticillium lecanii e na produção
de quitinase.
Donzelli et al. (2003) estudaram a hidrólise enzimática avançada de quitina de
casca de caranguejo langostino com misturas de enzimas de bactérias e fungos e concluiram que a combinação de enzimas de Trichoderma atroviride e Serratia marcescens foram capazes de degradar completamente altas concentrações de quitina
Capítulo 2 Revisão Bibliográfica
______________________________________________________________________
Raimundo Cosme da Silva Filho – Tese de Doutorado – UFRN – PPGEQ
27 procariótica apresentaram atividades menores que as enzimas de T. atroviride, para
catalisar a reação com quitosana.
Jo et al. (2003) estudaram a caracterização e a avaliação cinética de quitosanase
produzida por Bacillus sp. Destaca-se que na produção da enzima utilizada neste ensaio
o meio continha 0,5% de concentração de quitosana, 1% de triptona e 1% de NaCl, o pH do meio foi ajustado em 5,5 e a temperatura foi mantida em 37ºC com agitação de 180 rpm em incubador rotativo.
Fu et al (2003) estudaram a caracterização de três iso-enzimas de quitosanase
isolada de pepsina comercial e denominado como PSC-I, PSC-II, PSC-III, respectivamente, em relação a hidrólise enzimática da quitosana, o meio ótimo para a produção destas iso-enzimas continha as seguintes características: pH 5,0; 5,0 e 4,0 e temperaturas de 40ºC, 40ºC e 30ºC, o valor de Km foi de 5,2, 4,0 e 5,6 mg.mL-1,
respectivamente. As massas moleculares das três iso-enzimas foram de 40 kDa. Os resultados mostraram que as três iso-enzimas apresentaram atividade em meio contendo quitosana, produzindo oligômeros da ordem de 68 – 88% desacetilada.
Choi et al. (2004) estudaram a produção, purificação e caracterização total de
uma quitosanase produzida por Bacillus sp KCTC 0377BP. Nesse caso, com relação à
produção da enzima foi possível obter um aumento de 1,2 U/ml em incubator rotativo para 100,0 U/ml em fermentador piloto de 500 L, utilizando uma concentração de substrato de 0,5% de quitosana e como fonte de nitrogênio polipeptona (2,5%) em pH igual a 6,8, com 100 rpm de 100,0 rpm a 30oC.
Shimosaka et al. (2003) estudaram a produção, purificação e caracterização total
de duas quitosanases produzida por Acinetobacter sp CHB101. Nesse caso, com relação
Capítulo 2 Revisão Bibliográfica
______________________________________________________________________
Raimundo Cosme da Silva Filho – Tese de Doutorado – UFRN – PPGEQ
28 Kim et al. (2004) estudaram a produção, purificação e caracterização de uma
quitosanase produzida pelo Bacillus sp e identificado pelo número 1299. Destaca-se que
na produção da enzima quitosanase foi utilizado um meio contendo os seguintes componentes: 0,5 % de quitosana, 0,42 % (NH4)2SO4, 0,2 % K2HPO4, 0,02 % uréia,
0,03 % CaCl2.2H2O, 0,03% MgSO4.7H2O, 0,1% peptona, 0,2% Tween 80, 0,2 % da
solução (0,5% FeSO4.7H2O, 0,16% MnSO4.H2O, 0,14% ZnSO4.7H2O, 0,2% CoCl2) e
1,7% agar. O pH do meio para este ensaio foi mantido em 7,0. Este microrganismo foi escolhido por ser grande produtor de quitosanase.
Chen et al. (2005) estudaram a purificação e a caracterização de dois tipos de
quitosanase produzidas por Aspergillus sp. CJ22-326 em cultivo submerso. Na
produção da enzima foi utilizado um meio de cultivo contendo 1,0% de quitosana, 2,0% de gérmen de trigo, 0,2% de sulfato de amônio, 0,2 % de fosfato de potássio e 0,05% de sulfato de magnésio por litro de solução em pH 5,6. O cultivo foi realizado em frasco de 500 mL contendo 150 mL de meio de cultura a 30ºC por 96 horas com uma agitação de 150 rpm. Os autores apresentam um gel de eletroforese com as duas enzimas purificadas com massa molar de 29 kDa e 109 kDa.
Silva Filho et al. (2005) estudaram, através de planejamento fatorial 24 com
repetição em triplicata no ponto central, a produção de quitosanase por Aspergillus ochraceus em cultivo descontínuo submerso. Os resultados mostraram que foi possível
produzir quitosanase com atividade na ordem de aproximadamente 5,9 U/mL utilizando
Aspergillus ochraceus e que a atividade foi favorecida pelo aumento da agitação (r), da
razão de aeração (RA) e da concentração de substrato (Cs), enquanto que o aumento da temperatura de cultivo (TMC) não favoreceu a resposta (atividade quitosanolítica).
Pode-se classificar as quitosanases em endoquitosanases e exoquitosanases. As primeiras diferenciam-se por catalisar a hidrólise aleatoriamente, no interior do biopolímero, gerando diversos tamanhos de oligossacarídeos. As exoquitosanases são capazes de hidrolisar as terminações não redutoras, produzindo assim unidades redutoras (Peter, 2005).
Palma-Guerrero et al. (2008) estudaram o biocontrole de fungos patogênicos e
Capítulo 2 Revisão Bibliográfica
______________________________________________________________________
Raimundo Cosme da Silva Filho – Tese de Doutorado – UFRN – PPGEQ
29 pode ajudar a desenvolver novas estratégias para o biocontrole em geral de fungos patogênicos, evitando o uso de fungicidas que prejudicam o meio ambiente e a saúde humana.
Pagnoncelli (2008) estudou a produção de quitooligossacarídeos com propriedades nutracêuticas a partir da quitosana por hidrólise enzimática, utilizando processo fermentativo simultâneo. Duas cepas produtoras de quitosanaes foram selecionadas, Paenibacillus chitinolyticus e Paenibacillus ehimensis, e avaliadas quanto
ao comportamento em meio de cultivo contendo açúcares simples e em relação às variações de pH do meio. Os quitooligossacarídeos produzidos a partir do complexo enzimático da primeira cepa apresentaram maior pico após 9h de hidrólise, enquanto para a segunda cepa avaliada, após 20min, observou-se quitooligossacarídeos com grau de polimerização entre 3 e 6 unidades.
2.2. Fungos
2.2.1. Características gerais
Desde o final dos anos 60 que os fungos deixaram de pertencer ao reino das plantas e passaram a ter um reino próprio chamado de Reino Fungi. Foi a partir de estudos morfológicos, bioquímicos e citológicos onde se concluiu que eles são tão diferentes dos vegetais como dos animais. Distinguem-se de outros organismos eucariotas por serem seres quimiorganoheterotróficos e, ainda, por apresentarem parede celular rígida que é composta por quitina e glucano e uma membrana celular em que o ergosterol substitui o colesterol (Trabulsi & Toledo, 1996; Murray et al., 2005).
Fazem parte do Reino Fungi cerca de 100 mil espécies, desde grandes como os cogumelos, até microscópicas como os bolores e leveduras. Ainda hoje é utilizada essa classificação, mas os avanços da biologia molecular e estudos bioquímicos levaram a outras propostas de classificação em que os fungos e organismos afins foram incluídos em três diferentes reinos: Protozoa, Chromista e Fungi (Kirk et al.,2008).
Abaixo, são apresentadas características que diferenciam os fungos das plantas:
• são incapazes de sintetizar clorofila, como também não apresentar celulose em
sua parede celular, com exceções como fungos aquáticos;
Capítulo 2 Revisão Bibliográfica
______________________________________________________________________
Raimundo Cosme da Silva Filho – Tese de Doutorado – UFRN – PPGEQ
30
• podem ser eucarióticos (as leveduras), ou multinucleados (os bolores), e
apresentar retículo endoplasmático rugoso e mitocôndrias em seu citoplasma;
• são heterotróficos, alimentam-se de matéria orgânica viva (fungos parasitários),
ou morta (fungos saprofíticos);
Os fungos são amplamente encontrados na natureza, crescem rapidamente no solo, na água, na atmosfera, bem como nos animais, nos vegetais, resíduos orgânicos e desempenham um papel importante na vida do homem, quer de uma maneira benéfica, quer de um modo prejudicial. Os fungos são um dos principais microrganismos responsáveis pela decomposição da matéria orgânica, interferindo no ciclo do carbono, do nitrogênio e de outros nutrientes da biosfera. São capazes de deteriorarem produtos e bens de consumo, tais como alimentos, tecidos, papel, madeira. Os alimentos armazenados representam um vasto meio para a proliferação dos fungos, principalmente quando não são consideradas as condições básicas de armazenamento correto (Trabulsi & Toledo, 1996).
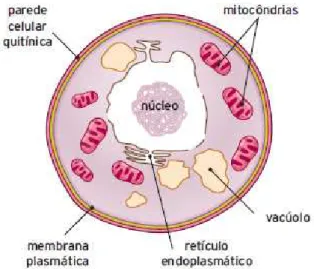
Estão presentes funcionalmente em vários processos industriais, tais como, de fabricação de pão, cervejas, vinhos e determinados tipos de queijos, sendo também utilizados na produção comercial de muitos ácidos orgânicos, de alguns fármacos, como a ergometrina e a cortisona, na obtenção de diferentes antibióticos, como a penicilina, e de substâncias imunossupressoras, como a ciclosporina (Esteves et al., 1990). A Figura
4 ilustra a estrutura geral de uma célula de fungo.
Capítulo 2 Revisão Bibliográfica
______________________________________________________________________
Raimundo Cosme da Silva Filho – Tese de Doutorado – UFRN – PPGEQ
31 Os fungos podem se desenvolver em meios de cultivo especiais formando colônias de dois tipos, leveduriformes e filamentosas, que se diferenciam pela macromorfologia e micromorfologia. O primeiro tipo apresenta, em geral, característica de consistência cremosa de cor branca a creme, brilhantes ou opacas, podendo apresentar às vezes coloração escura ou alaranjada, e são formados por microrganismos unicelulares que apresentam as funções vegetativas e reprodutivas. As filamentosas apresentam características granulares, cotonosas, aveludadas ou pulverulentas, são multinucleadas e apresentam-se em forma de tubos denominadas de hifas. Essas hifas podem ser não septadas (cenocíticas) ou septadas (tabicadas). O conjunto de hifas é denominado micélio.
As hifas asseptadas têm aparência anastomosada (concisa), formada por um citoplasma estendido e polinucleado, enquanto que as hifas septadas contêm células individualizadas, cada uma contendo o seu núcleo. Na Figura 5 são mostradas as estruturas das hifas septadas e não septadas.
Figura 5 – Estrutura das Hifas: a) septadas e b) asseptadas. (Adaptado de Guia.Bio, 2012)
Capítulo 2 Revisão Bibliográfica
______________________________________________________________________
Raimundo Cosme da Silva Filho – Tese de Doutorado – UFRN – PPGEQ
32
2.2.2. Reprodução dos Fungos
A reprodução dos fungos ocorre em ciclos assexuais, sexuais e parassexuais. Em fungos, a reprodução assexuada é observada com mais freqüência do que a reprodução sexuada. A reprodução assexuada é normalmente a reprodução mais importante para a propagação da espécie, feita através de fragmentação de artroconídios, fissão de células somáticas, brotamento ou gemulação do blastoconídios-mãe e produção de conídios. A reprodução sexuada envolve a união de duas células ou de dois órgãos sexuais sexualmente compatíveis. A reprodução sexuada culmina na produção de basidiósporos, no caso de basidiomicetos. A reprodução parassexuada ocorre com a fusão de hifas e formação de um heterocário, que consiste na existência de núcleos haplóides geneticamente distintos num mesmo citoplasma, os quais, após a fusão, originam núcleos diplóides heterozigotos sujeitos a sucessivas divisões mitóticas. Apesar da raridade dessas, a reprodução parassexual é de grande importância na evolução de alguns fungos (Pelczar et al., 1996).
A reprodução assexuada é feita por conídios, esporos assexuados formados no ápice de hifas modificadas, os conidióforos. Os conidióforos não possuem esporângios de forma que os conídios ficam expostos. Na reprodução sexuada, com o encontro de duas hifas haplóides distintas, ocorre a plasmogamia e um novo conjunto de hifas dicarióticas é formado.
Os conídios podem ter formas esféricas, fusiformes, cilíndricas, piriformes, entre outras. Apresentam-se como hialinos ou pigmentados, podem estar isolados ou agrupados, a parede celular pode ser lisa ou rugosa e podem ser formados por apenas uma célula ou apresentarem septos em mais de um plano.
Os conídios também podem originar-se em qualquer parte do micélio vegetativo e são denominados conídios sésseis como é o caso do Trichophyton rubrum.
Alguns fungos patogênicos são identificados a partir de estruturas formadas pela célula conidiogênica e o conidióforo. Essas estruturas são denominadas: aparelho de frutificação ou conidiação. Os conídios podem formar cadeias sobre fiálides em volta de uma vesícula, dilatando a extremidade do conidióforo. Essas estruturas ocorrem em
Capítulo 2 Revisão Bibliográfica
______________________________________________________________________
Raimundo Cosme da Silva Filho – Tese de Doutorado – UFRN – PPGEQ
33
Figura 6 – Conídios de Aspergillus ePenicillium
2.2.3. Metabolismo de fungos
Os fungos são seres aeróbicos e heterotróficos, podendo se desenvolver em ambientes com baixa quantidade de oxigênio, como ocorre no crescimento vegetativo e na reprodução assexuada, como também em ambientes com grande quantidade de oxigênio como é o caso da reprodução sexuada.
Os fungos são capazes de produzir certas enzimas como lipases, invertases, lactases, quitosanases, proteases, amilases, etc., que fazem a hidrólise do substrato facilitando o mecanismo de transporte ativo e passivo. Esses substratos induzem a formação de enzimas degradativas. Algumas espécies de fungos desenvolvem-se em meios que apresentam amônia ou nitrilos como única fonte de nitrogênio. As melhores fontes orgânicas para o seu desenvolvimento são carboidratos, como a D-glicose, e alguns sais minerais como sulfatos e fosfatos.
A água é uma necessidade de todos os seres vivos, não sendo diferente para os fungos que precisam de água para o seu desenvolvimento. Certos fungos apresentam características halofílicas podendo crescer nos ambientes com grandes concentrações de sal.
Capítulo 2 Revisão Bibliográfica
______________________________________________________________________
Raimundo Cosme da Silva Filho – Tese de Doutorado – UFRN – PPGEQ
34 concentrações de oxigênio, apesar de cada espécie possuir condições ideais para o seu desenvolvimento (Chao et al., 2002).
Devido a grande faixa de temperatura ótima para o seu crescimento, os fungos apresentam espécies psicrófilas, mesófilas e termófilas. Para a maior parte das espécies fúngicas, a temperatura de desenvolvimento situa-se entre os 20 e 24 ºC e não crescem acima dos 29 ºC. Em relação à umidade relativa, necessitam de pelo menos 50 %, mas geralmente necessitam de mais de 65 % (Colakoglu, 2001).
O pH ideal para o desenvolvimento dos fungos varia na faixa entre 5 e 7. Destaca-se, entretanto, que a maioria dos fungos suportam grandes variações de pH como ocorre com os fungos filamentosos que podem crescer em pH variando entre 1,5 e 11. Por outro lado, as leveduras não suportam pH alcalino.
Os fungos crescem lentamente, se comparados com as bactérias, em meio de incubação para o seu desenvolvimento. Para evitar contaminação por bactérias, que podem se sobrepor ou inibir o seu crescimento, pode-se introduzir no meio de cultura um antibacteriano de largo espectro como o cloranfenicol.
Algumas espécies de fungos se desenvolvem na presença de luz, outras são inibidas e algumas podem crescer tanto na presença quanto na ausência deste agente. No entanto a irradiação solar, em geral, é prejudicial ao seu desenvolvimento, por causa da radiação ultravioleta.
2.2.4. Nutrição de fungos
Capítulo 2 Revisão Bibliográfica
______________________________________________________________________
Raimundo Cosme da Silva Filho – Tese de Doutorado – UFRN – PPGEQ
35 Os fungos decompositores, saprófagos (do grego, saprós, “podre”, e phagos,
“comedor”), juntamente com as bactérias, são os principais decompositores da biosfera, participando intensamente do processo de degradação da matéria orgânica morta, o que promove a reciclagem dos elementos químicos constituintes dos seres vivos. A maioria deles vive no solo, obtendo nutrientes de seres mortos. Em florestas, onde a matéria orgânica vegetal é abundante, os micélios dos fungos decompositores absorvem os nutrientes de folhas e galhos caídos, decompondo-os. Os fungos decompositores também são responsáveis pelo apodrecimento de alimentos e de outros materiais, como a madeira.
Os fungos parasitas vivem à custa de outros organismos vivos, prejudicando-os. Ao parasitar o corpo de um ser vivo, animal ou vegetal, o fungo pode até provocar sua morte. Várias doenças são causadas por fungos parasitas. Nas plantas, cita-se a ferrugem do café, que, no Brasil, é motivo de grande preocupação por parte dos cafeicultores, devido aos prejuízos que acarreta. As micoses que atacam a pele de seres humanos e animais são provocadas por fungos.
Existem fungos que se associam a outros organismos, estabelecendo uma relação em que há benefício mútuo para os indivíduos envolvidos. Esses fungos são denominados mutualísticos. A maioria vive associada a seres fotossintetizantes, como as plantas, cedendo-lhes parte da água e dos nutrientes que as hifas absorvem do solo. As plantas, por sua vez, cedem ao fungo certos açúcares e aminoácidos. Duas associações mutualísticas formam estruturas bem características: as micorrizas, associação que envolve fungos e raízes de plantas, e os líquens, formados por fungos e algumas variedades de algas e cianobactérias.
Certos fungos atuam como predadores. Na maioria dos casos, as hifas secretam substâncias aderentes que aprisionam os organismos que tocam os fungos. Dessa maneira, as hifas penetram o corpo da presa, crescem e se ramificam, espalhando-se no interior do organismo e absorvendo seus nutrientes, causando-lhe a morte. O gênero
Arthrobotrys apresenta uma forma mais elaborada de predação. O fungo vive no solo e
captura nematódeos microscópicos que habitam o mesmo ambiente. As hifas apresentam pequenos anéis que se estreitam quando a presa passa por eles. As hifas do fungo logo invadem o corpo do nematódeo, digerindo-o.
Capítulo 2 Revisão Bibliográfica
______________________________________________________________________
Raimundo Cosme da Silva Filho – Tese de Doutorado – UFRN – PPGEQ
36
2.2.5. O fungo Metarhizium anisopliae
Existem três espécies de fungos do gênero Metarhizium, divididas em dez
variedades: M. anisopliae, variedades anisopliae, majus, lepidiotum e acridum; M. flavoviride, variedades tipo E, flavoviride, minus, novazealandicum e pemphigum; e M. album (Driver et al. 2000). E, mais recentemente, foi descrita na China uma nova
variedade de M. anisopliae, dcjhyium (Dong et al. 2009).
Data de 1879 quando o russo Ilya Metchnikoff aplicou o fungo para combater larvas de um curculionídeo, praga de beterraba, e foi classificado como Metarhizium anisopliae por Sorokin em 1883. É um fungicida natural para mais de 300 espécies de
insetos, especialmente pragas da agricultura e pecuária. No Brasil, o fungo Metarhizium anisopliae teve a sua aplicação com sucesso pela primeira vez em 1965, no controle da
cigarrinha-da-cana Mahanarva posticata (Alves, 1998).
O fungo Metarhizium anisopliae é um importante agente entomopatogênico
utilizado no controle de pragas, como cupins, gafanhotos, cigarrinhas e besouros, sendo amplamente estudado em todo o mundo. Existe amplamente na natureza e é facilmente encontrado no solo, onde sobrevive por longos períodos e seu desenvolvimento se dá geralmente entre 15 e 32 °C, sendo ideal entre 24 e 30 °C e com pH ótimo igual a 6,9. Apresenta micélio hialino e septado, com conidióforos característicos, sobre os quais surgem conídios cilíndricos organizados em colunas. Este fungo ao atacar os insetos provoca rigidez e os recobre por uma camada pulverulenta de conídios, resultando em colorações que variam do verde claro ao escuro, cinza ou branco com pontos verdes (Tinline, 1971; Alves, 1998, Driver et al. 2000; Arruda, 2005).
Quanto a sua morfologia, apresenta-se como um fungo filamentoso, com corpo de frutificação equivalente a um esporodóquio agregado a hifas intimamente entrelaçadas, com massa compactada de conidióforos característicos, simples ou ramificados, formando células esporogênicas denominadas fiálides, resultando nos fialosporos (Wang et al., 2002).
O Metarhizium anisopliae é um fungo de cultivo simples, sendo necessário
quase que exclusivamente o nutriente a base de amido. Um dos fungos mais estudados em programas de manejo de pragas já que apresenta grande potencialidade entomopatogênica (Onofre et al., 2002). O Metarhizium anisopliae é um microrganismo
Capítulo 2 Revisão Bibliográfica
______________________________________________________________________
Raimundo Cosme da Silva Filho – Tese de Doutorado – UFRN – PPGEQ
37 Em geral, os fungos produzem enzimas que convertem os tecidos dos insetos em nutrientes. Porém, a cutícula esclerotizada dos insetos não é bem utilizada pelos fungos, excetos pelos entomopatogênicos que desenvolveram enzimas eficientes para degradar essa camada protetora. Destaca-se a enzima Pr1, produzida por Metarhizium anisopliae,
que tem um poder de degradação bem superior a qualquer outra enzima sintetizada por esse grupo de fungos (Dias, 2005). Desta forma, o Metarhizium anisopliae (fungo
entomopatogênico) ao atacar a célula dos insetos, produz grande quantidade de enzimas que degradam a membrana citoplasmática e inativa a célula e, consequentemente, mata o inseto, logo é evidente a relação entre o controle de pragas e produção de enzimas.
No momento, sobre a comercialização de fungos entomopatogênicos no Brasil, em sua maioria, são formulados em grânulos, compostas do fungo mais o substrato (arroz + fungo), como também na forma de pó molhável (WP), resultado da moagem do fungo com o substrato. Esses produtos representam 90% e 8,5%, respectivamente, da produção de fungos no Brasil, e sendo suas concentrações finais ficam em torno de 5x108 conídios/g para Metarhizium anisopliae e 1x109 conídios/g para Beauveria bassiana (Alves et al., 2008).
Segundo Batista Filho et al. (2002), Garcia et al. (2005) e Mello et al. (2006), o Metarhizium anisopliae tem sido bastante utilizado para o controle de diferentes pragas
no Brasil, como a broca da bananeira, pragas de grãos armazenados, carrapatos, cupim de montículo em pastagens, larvas de escarabeídeos que atacam a cana de açúcar e cigarrinha da cana-de-açúcar.
É comum a ocorrência natural do fungo Metarhizium anisopliae atacando
cigarrinha-das-raízes de canaviais pelo país, o que incentiva a utilização dele como agente de controle biológico em áreas infestadas por esse tipo de praga. A aplicação de recursos no uso de programa de manejo integrado da cigarrinha tem sido reforçado por razões ambientais e econômicas (Dinardo-Miranda, 2001).
Capítulo 2 Revisão Bibliográfica
______________________________________________________________________
Raimundo Cosme da Silva Filho – Tese de Doutorado – UFRN – PPGEQ
38 em alguns casos, como exigência de lavagem, e em outros podendo causar o entupimento de bicos dos pulverizadores devido à elevada proporção de inertes, principalmente quando são empregados baixos volumes de aplicação. Outro problema evidenciado com os inseticidas nacionais diz respeito à pequena sobrevida, devendo a ser usados em, no máximo, 30 dias depois de produzidos, quando armazenados à temperatura ambiente e em local sombreado, fazendo as vendas ocorrerem quase que, exclusivamente, sob encomenda. Comparativamente, os bons inseticidas sob comercialização em outros países apresentam maior concentração de ingrediente ativo, maior sobrevida (alguns produtos podem ser armazenados por mais de 8 meses à temperatura ambiente) e praticidade (são formulados na forma de GDA (grânulos dispersíveis em água) ou de óleos emulsionáveis, por exemplo, podendo ser adicionados diretamente ao tanque do pulverizador.
Rangel et al. (2007), instalaram uma Unidade de Observação para o controle
microbiano das cigarrinhas das pastagens Distrito de Itahum, em Dourados/MS, devido as necessidades de agricultores familiares de produção de leite. As aplicações do fungo
Metarhizium anisopliae foram realizadas por pulverização com equipamento de tração
animal. As condições do ambiente de estudo foram favoráveis ao desenvolvimento da população das cigarrinhas e à incidência do fungo. Como resultados, observaram que os níveis de espumas, ninfas e adultos reduziram significativamente após as aplicações, levando os Agricultores Familiares a total satisfação com os ganhos na produção de todos os envolvidos.
Segundo Vieira et al. (2007), o fungo entomopatogênico Metarhizium anisopliae
var. acridum tem sido utilizado no controle de pragas, e assim, visando este fim,
Capítulo 2 Revisão Bibliográfica
______________________________________________________________________
Raimundo Cosme da Silva Filho – Tese de Doutorado – UFRN – PPGEQ
39 Lopes et al. (2007) avaliaram o efeito de formulações de Beauveria bassiana e Metarhizium anisopliae sobre ninfas de Amblyomma cajennense (transmissor da febre
maculosa ao homem) em laboratório. Ninfas não alimentadas foram pulverizadas com suspensões contendo 2x107 e 4x107 conídios/mL de B. bassiana, e 1x107, 1,5x107,
2x107, 3x107 e 5x107 conídios/mL de M. anisopliae. A mortalidade de ninfas,
decorridos três dias da aplicação, foi significativa nas concentrações de 3x107 e 5x107 conídios/mL de M. anisopliae, com 57,1 e 56,2 %, respectivamente. Após seis dias a
mortalidade foi de 100 % nessas duas concentrações. A mortalidade foi significativamente maior que a observada para B. bassiana em concentrações
semelhantes.
Guirado et al. (2009) realizaram estudos para controlar cupins de montículo em
área de pastagem, utilizando fungos entomopatogênicos Metarhizium anisopliae e Beauveria bassiana em diferentes doses e formulações. A avaliação foi realizada após
30 dias da aplicação dos produtos. Os melhores resultados em ordem decrescente de eficiência foram: M. anisopliae 30 mL + 1000 mL de água com 100 % de eficiência; B. bassiana 10g + M. anisopliae 20 mL + 1000 mL de água com 85,71 % de eficiência; M. anisopliae 20 mL + 1000 mL de água com 71,42 % de eficiência. Os demais
tratamentos não diferiram da testemunha.
Loureiro et al. (2012) compararam a eficiência de isolados de Metarhizium anisopliae em controlar populações naturais de Mahanarva fimbriolata
(cigarrinha-da-raiz) em cultivos comerciais de cana-de-açúcar colhida mecanicamente. Foram aplicados os isolados IBCB 348, IBCB 408, IBCB 410 e IBCB 425 do fungo em concentração de 1,5×1012 conídios/ha. Aplicou-se o planejamento experimental em blocos casualizados com 5 tratamentos e 4 repetições, sendo cada repetição composta por 7 linhas de 100 m de comprimento e espaçamento de 1,5 m. Após 30 dias de pulverização foi observado para os isolados IBCB 408 e IBCB 425 uma eficiência de controle de ninfas de 63 e 62%, respectivamente, já no caso dos adultos chegou a 100%. Após 60 dias o isolado IBCB 425 foi o mais eficiente para controlar as ninfas com 48,4%.
Assis et al. (2012) estudaram a citotoxidade de quitoolissacarídeos (QOS) e
oligômeros A, B e C (soluções compostas por diferentes quantidades de QOS) produzidos por hidrólise enzimática pelo fungo Metarhrizium anisopliae. Foi analisado
Capítulo 2 Revisão Bibliográfica
______________________________________________________________________
Raimundo Cosme da Silva Filho – Tese de Doutorado – UFRN – PPGEQ
40 também em célula normal (3T3). A atividade antioxidante foi analisada em vários experimentos in vitro. A glicosamina apresentou maior toxicidade (cerca de 92%) para
todas as células estudadas. No entanto, os oligômeros obtidos após hidrólise não demonstraram efeito tóxico sobre a célula normal (3T3). Além disso, mostraram que uma pequena quantidade de outros COS pode diminuir o efeito citotóxico da glicosamina contra células 3T3, indicando que glicosamina poderia ser usada como uma droga antitumoral na presença de outros COS.
2.3. Fermentação
Os processos fermentativos são caracterizados por processos nos quais microrganismos realizam a conversão catalítica de uma dada substância num determinado produto. Estes processos podem ser classificados como processos descontínuos, contínuos e descontínuos alimentados. A classificação destes processos está diretamente ligada à forma de como o substrato é adicionado e como o produto é retirado. No processo de fermentação descontínuo o substrato é colocado no fermentador, em seguida é inoculado e após o término do processo o produto é retirado. No processo contínuo, o substrato é colocado num reator com vazão constante e o meio fermentado é retirado com a mesma vazão de entrada do reator (Faccioti, 2001). Nos processo descontínuos alimentados à adição de substrato e a retirada do mesmo deve ocorrer de forma intermitente (Carvalho & Sato, 2001).
De certa forma, os processos fermentativos representam um elo entre as antigas artes de elaboração de alimentos, como queijos e vinho, a partir de uma flora microbiana natural, com a moderna indústria de fermentação de alimentos, onde são utilisados cultivos puros e equipamentos sofisticados para o controle do processo (Assis, 2010).