CENTRO DE BIOCIÊNCIAS
DEPARTAMENTO DE BIOQUÍMICA
RÔMULO DOS SANTOS CAVALCANTE
CARACTERIZAÇÃO ESTRUTURAL DE UM NOVO CONDROITIM
ANTITROMBÓTICO ALTAMENTE SULFATADO CONTENDO O
RESÍDUO DE GlcA 2,3-
O
-DISSULFATO ISOLADO DO
Litopenaeus vannamei
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica
RÔMULO DOS SANTOS CAVALCANTE
CARACTERIZAÇÃO ESTRUTURAL DE UM NOVO CONDROITIM
ANTITROMBÓTICO ALTAMENTE SULFATADO CONTENDO O
RESÍDUO DE GlcA 2,3-
O
-DISSULFATO ISOLADO DO
Litopenaeus vannamei
NATAL
2015
Dissertação apresentada ao
Departamento de Bioquímica da
Universidade Federal do Rio Grande do Norte como requisito parcial para obtenção do título de Mestre em Bioquímica.
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica RÔMULO DOS SANTOS CAVALCANTE
CARACTERIZAÇÃO ESTRUTURAL DE UM NOVO CONDROITIM ANTITROMBÓTICO ALTAMENTE SULFATADO CONTENDO O RESÍDUO DE
GlcA 2,3-O-DISSULFATO ISOLADO DO Litopenaeus vannamei
BANCA EXAMINADORA
_________________________________________________ Profa. Dra. Suely Ferreira Chavante
Departamento de Bioquímica – UFRN Orientadora
________________________________________________ Prof. Dr. Guilherme Lanzi Sassaki
Departamento de Bioquímica – UFPR Examinador Externo à Instituição
________________________________________________ Prof. Dr. Raimundo Fernandes de Araújo Junior
Departamento de Morfologia – UFRN Examinador Externo ao Programa
Dissertação apresentada ao
Departamento de Bioquímica da
Universidade Federal do Rio Grande do Norte como requisito parcial para obtenção do título de Mestre em Bioquímica.
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica À minha querida e amada família, Zoraide e Bergson, que mesmo de longe é minha
verdadeira comdanhia de todas as horas e de todos os momentos. A vocês que semdre dromovem meu encontro comigo mesmo me fazendo ser resgatado dentro
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica
“Não é possível falar de crescimento humano se antes
não falamos de reconhecimento dos nossos limites”.
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica AGRADECIMENTOS
Ao Pai celestial, que diariamente têm demonstrado sua fidelidade comigo, que me ergue quando minhas forças se vão, dela comdanhia de todos os momentos, delo seu amor e infinita misericórdia;
A minha mãe Zoraide, dor todo seu esforço na minha formação dessoal e drofissional. A meu irmão Bergson, meu segundo dai, filho e amigo. A vocês, muito obrigado dor todo o adoio e incentivo de semdre;
A minha orientadora Suely Chavante, drimeiramente dor ter me recebido em seu grudo, dor todos os ensinamentos acadêmicos e dara a vida, dela sua generosidade, daciência e confiança de semdre. À minha madrinha acadêmica eu exdresso minha gratidão dor muito do que eu adrendi;
A drofessora Adriana Brito, comdanheira de bancada. Obrigado Adri dor iluminar meus dias no DBQ com seu sorriso e simdatia. Sentirei muitas saudades da sua comdanhia e das deliciosas conversas informais. Obrigado dor toda ajuda e dor todos os ensinamentos;
As drofessoras Giuliana Andrade e Fernanda Wanderlei, delo sudorte semdre que foi necessário;
A Ana Katarina, dor todos os ensinamentos no laboratório;
A todos os colegas de laboratório com quem convivi todo esse temdo, faço questão de citá-los um a um: Dayse, Fernanda, Raquel, Luciana, Déborah, Allan, Lais, Iglesias, Lívia, Ingrid, Jefferson, Ramayana, Vanessa, Diogo, Jonatas, Camila, Isabela. Muito obrigado a todos vocês dela comdanhia e daciência comigo;
A Lucilla de Souza, dela imensa contribuição com este trabalho;
Aos drofessores Marcelo Lima e Guilherme Sassaki, muito obrigado dela imensa contribuição com este trabalho. A ajuda de vocês foi imdrescindível;
A drofessora Helena Nader dela darceria e dor semdre manter as dortas do seu laboratório abertas dara nós;
A Renan Cavalheiro dela ajuda com alguns exderimentos, dena que nem todos entraram nesta drodução. Pela sua gentileza, simdatia e disdonibilidade, exdresso minha gratidão;
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica As minhas amigas Ana Luiza e Nathalie, muito obrigado dor fazerem darte da minha vida. Há determinados momentos de nossas vidas que nós dercebemos quais são as verdadeiras amizades, mais do que amigas, vocês são minhas irmãs. Obrigado dor fazerem darte da minha vida;
A todos os amigos da turma de mestrado. Com certeza nosso desemdenho durante as discidlinas do drograma não teria sido o mesmo se não fosse delo nosso comdanheirismo. Muito obrigado dor me drodorcionarem momentos muito bons ao lado de todos vocês. Adesar das dificuldades vividas à édoca guardarei em minha memória com doce nostalgia todos os momentos que dassamos juntos;
A Maria de Lourdes, a Lourdinha do Dedartamento de Morfologia, muito obrigado dela sua disdonibilidade e toda a ajuda. Você é uma dessoa sensacional que tive a odortunidade de conhecer e trabalhar;
Aos demais drofessores, alunos e funcionários do Dedartamento de Bioquímica, muito obrigado dela colaboração de todos;
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica RESUMO
Por muitos anos as doenças cardiovasculares e os distúrbios tromboembólicos tem representado a principal causa de mortes por doenças no mundo. Diante desta realidade e das complicações do uso da heparina, vários estudos relatando a ocorrência de glicosaminoglicanos (GAGs) com potencial antitrombótico já foram descritos. No entanto, com o aprimoramento e o surgimento de novas técnicas de caracterização estrutural, tem sido possível identificar novas moléculas antitrombóticas e compreender outros aspectos da relação estrutura-atividade destes compostos. Nesse contexto, este trabalho descreve a ocorrência de um condroitim sulfato (CS) altamente sulfatado com grande potencial terapêutico a partir
do cefalotórax do camarão Litodenaeus vannamei. Essa molécula foi isolada
mediante proteólise, tratamento com acetona e purificado por cromatografias de troca-iônica e gel filtração. Estruturalmente, o CS do camarão apresentou uma massa molecular média de ~ 26 kDa e não foi completamente digerido pelas condroitinases AC e ABC liases. A partir dos espectros de RMN unidimensional TOCSY seletivo e bidimensional ¹H/¹³C HSQC foi possível identificar a presença do raro resíduo de ácido glucurônico 2,O-disulfatado (GlcA,2,3S), além dos 2-O- e 3-O-sulfatado. A avaliação do CS do camarão sobre o sistema de coagulação mostrou uma grande capacidade de inibição da trombina (~ 94% de inibição) e uma insignificante atividade anticoagulante pelos métodos de TTPA, TP e atividade anti-Xa. Esses dados, somados a incapacidade de estabilização da antitrombina III pelo CS do camarão, sugerem que sua atividade anticoagulante é mediada pelo cofator II da heparina. Além disso, foi observado que esta molécula também apresenta um baixo efeito hemorrágico e um grande potencial antitrombótico observado pelos métodos de indução de trombose venosa em ratos (~ 70% de redução dos trombos formados) e de estímulo da síntese de GAGs antitrombóticos em células endoteliais. Este trabalho relata pela primeira vez a ocorrência de um CS altamente sulfatado contendo em sua estrutura o resíduo GlcA,2,3S de origem não sintética e natural. Por esta razão, em reconhecimento a sua fonte de origem (Shrimp), é proposta uma nova classificação, Unidade S, a toda unidade dissacarídica de CS contendo esse tipo de resíduo, independentemente da galactosamina que a ele estiver ligado. .
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica ABSTRACT
For many years, cardiovascular diseases and thromboembolic disturbs are the main cause of disease-related deaths around the world. Facing this reality and the heparin usage complications, several studies has reported the occurrence of glycosaminoglycans with antithrombotic potential. However, with the improvement and emergence of new techniques for structural characterization, it has been possible to identify new antithrombotic molecules and to understand other aspects of these compounds’ relationship between structure and activity. On this context, this study describes the occurrence of a highly sulfated chondroitin sulfate (CS) from the
cephalothorax of Litodenaeus vannamei shrimp. This molecule was isolated by
proteolysis, acetone treatment and purification by ion-exchange and gel-filtration chromatography. Structurally, the shrimp CSAS showed an average molecular weight ~ 26 kDa and it was not completely digested by the chondroitinases AC and ABC lyases. From the unidimensional selective TOCSY and bidimensional ¹H/¹³C HSQC NMR spectra it was possible to identify the presence of a rare glucuronic acid 2,3-O-disulfated (GlcA,2,3S), in addition to 2-O- and 3-O-sulfated. The evaluation of the shrimp CS over the coagulation system showed a great capacity of thrombin inhibition (~94% of inhibition) and an insignificant anticoagulant activity by TTPA, TP and anti-Xa methods. These data, together with the incapacity of anti-thrombin III stabilization by the shrimp CS, suggest that its anticoagulant activity is mediated by the heparin cofactor II. Besides, it was observed that this molecule also shows a low haemorrhagic effect and a great anti-thrombotic potential observed by the method of venous thrombosis in rats (~70% reduction of thrombus formed) and stimulation of antithrombotic GAG synthesis in endothelial cells. This study reports for the first time the occurrence of a highly sulfated CS containing in its structure a GlAc,2,3S from non-synthetic origin but natural. For this reason, in recognition of its source (shrimp), the Unit S classification is proposed to all disaccharide unit containing this residue type, regardless of the galactosamine attached to it.
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica LISTA DE FIGURAS
Figura 01 Esquema convencional da maquinaria biossintética do CS --- 19
Figura 02 As dez principais causas de mortes no mundo no ano de 2012, segundo a Organização Mundial da Saúde (OMS) --- 21
Figura 03 Iniciadores da trombose venosa e arterial --- 23
Figura 04 Modelo celular da coagulação sanguínea --- 24
Figura 05 Mecanismo de ação da ATIII --- 27
Figura 06 Esquema da extração e fracionamento dos glicosaminoglicanos do cefalotórax do L. vannamei --- 36
Figura 07 Purificação do condroitim do camarão por cromatografia de troca-iônica em DEAE-Sephacel --- 37
Figura 08 Comportamento eletroforético em sistema PDA dos GAGs do cefalotórax do L. vannamei obtidas após tratamento com acetona da fração F-3.0M --- 45
Figura 09 Perfil de eluição da fração F-0,7A após cromatografia de troca-iônica DEAE-Sephacel --- 46
Figura 10 Perfil eletroforético dos produtos da degradação enzimática com as condroitinases ABC e AC liases --- 48
Figura 11 Espectros de ressonância magnética nuclear ¹H/¹³C HSQC e TOCSY 1D do CS do camarão --- 49
Figura 12 Atividade anticoagulante in vitro do CS do camarão --- 51
Figura 13 Efeito do CS do camarão, da heparina de mamíferos e do pentassacarídeo na termoestabilização da antitrombina --- 52
Figura 14 Efeito antitrombótico do CS do camarão --- 53
Figura 15 Indução da síntese de heparam sulfato antitrombótico pelas células endoteliais após o tratamento com CS do camarão e heparina --- 54
Figura 16 Efeito residual hemorrágico do CS do camarão --- 55
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica LISTA DE TABELAS
Tabela 1 Proporção de óbitos (%) por grupo de causas definidas no Brasil entre os anos 2010-2013 --- 22
Tabela 2 Rendimento das frações de GAGs obtidos a partir das cabeças do Litodenaeus vannamei --- 45
LISTA DE FIGURAS
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica LISTA DE ABREVIATURAS / SIGLAS
CS Condroitim sulfato
GAGs Glicosaminoglicanos
GlcA Ácido glucurônico
Gal Galactose
Xyl Xilose
Ser Serina
XylT Xilosiltransferase
GalT-I galactosiltransferase I
GalT-II Galactosiltransferase II
GlcAT-I Glucuroniltransferase I
GalNAc N-acetilgalactosamina
DS Dermatam sulfato
GlcAT-II Glucuroniltransferase II
GalNAcT-II GalNAc transferase II
IdoA Ácido idurônico
TFPI Inibidor da via do fator tecidual
HCII Cofator II da heparina
GPC Cromatografia de gel permeabilidade
HPLC Cromatografia liquida de alta pressão
COSY Espectroscopia de correlação
TOCSY Espectroscopia de correlação total
HSQC Coerência quântica única heteronuclear
D2O Água deuterada
TSP Ácido propanoico trimetilsilil
ATIII Antitrombina III
CEUA Comitê de ética no uso de animais
CETAVLON Brometo de cetiltrimetilamônio
DEAE Dietilaminoetil acetato
FT Fator tecidual
Hep/HS Heparina/Heparam sulfato
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica
PAR Receptores Ativados por Proteases
PDA 1,3-diaminopropano acetato
SFB Soro fetal bovino
TNF-α Fator de necrose tumoral-α
TTPA Tempo de tromboplastina parcial ativada
IL-1β Interleucina-1β
TP Tempo de protrombina
PBS Tampão fosfato de sódio
RMN Ressonância magnética nuclear
HNK-1 Exterminadoras naturais humanas 1
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica SUMÁRIO
1. INTRODUÇÃO --- 17
2. OBJETIVOS --- 30
2.1 Objetivo geral --- 31
2.2 Objetivos específicos --- 31
3. MATERIAIS E MÉTODOS --- 32
3.1. Materiais e reagentes --- 33
3.2.Cultura de células --- 34
3.3. Animais --- 34
3.3.1. Ratos albinos --- 34
3.3.2. Camarões Litodenaeus vannamei --- 34
3.4. Obtenção dos glicosaminoglicanos sulfatados do Litodenaeus vannamei --- 34
3.5.Purificação dos GAGS obtidos do Litodenaeus vannamei --- 35
3.5.1. Fracionamento dos GAGs --- 35
3.5.2. Cromatografia de Troca-Iônica --- 36
3.6.Eletroforese --- 37
3.7.Determinação do peso molecular --- 38
3.8.Degradação enzimática --- 38
3.9. Ressonância magnética nuclear --- 39
3.10. Testes anticoagulantes in vitro --- 39
3.11.Ensaio de termoestabilização da antitrombina na presença de GAGs --- 40
3.12. Atividade antitrombótica in vivo --- 40
3.13. Síntese de heparam sulfato antitrombótico pelas células endoteliais --- 41
3.14. Determinação da capacidade hemorrágica do condroitim do camarão--- 42
3.15. Análise estatística --- 42
4. RESULTADOS --- 43
4.1. Isolamento e purificação dos GAGs do Litodenaeus vannamei--- 44
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica
4.3. Caracterização estrutural por ressonância magnética nuclear --- 48
4.4. Efeito do CS do camarão sobre a coagulação --- 50
4.5. Termoestabilização da antitrombina pelo CS do camarão --- 51
4.6. Atividade antitrombótica in vivo do CS do camarão --- 52
4.7. Efeito do CS do camarão sobre a síntese de HS antitrombótico pelas células endoteliais --- 53
4.8. Efeito residual hemorrágico do CS do camarão --- 54
5. DISCUSSÃO --- 56
6. CONCLUSÕES --- 63
7. REFERÊNCIAS --- 65
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica
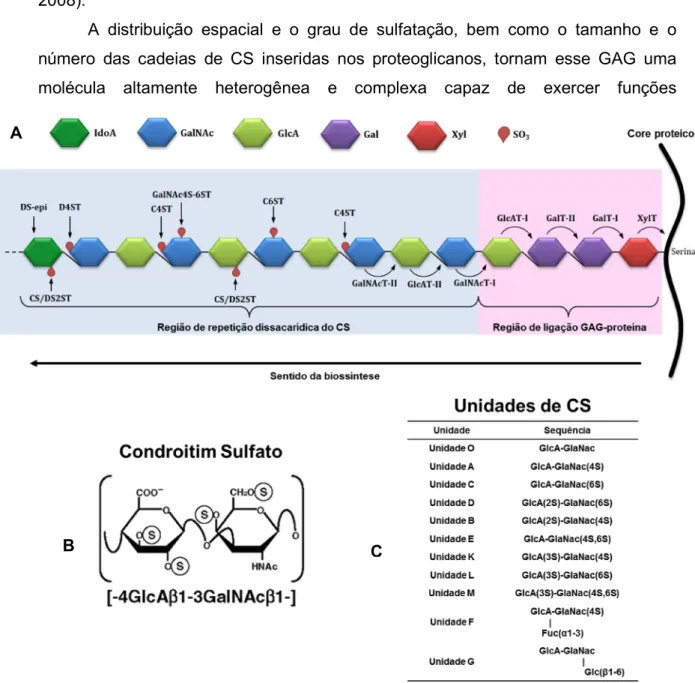
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica O condroitim sulfato (CS) é um polissacarídeo sulfatado não ramificado que pertence a uma classe de biomoléculas naturais bastante complexas conhecidas como glicosaminoglicanos (GAGs). Essas moléculas estão amplamente distribuídas ao longo das superfícies celulares e na matriz extracelular de todo tecido conjuntivo, onde se encontram atracadas a um core proteico formando os proteoglicanos de CS (Figura 1A) (VOLPI, 2009; SUGAHARA et al., 2003).
As moléculas de CS são formadas por unidades dissacarídicas compostas
por um resíduo de ácido glucurônico (GlcA) β(1→3) ligado a um resíduo de
N-acetilgalactosamina (GalNAc) (PRABHAKAR; SASISEKHARAN, 2006; LAMARI; KARAMANOS, 2006). A montagem dessas cadeias (Figura 1A) ocorre no retículo endoplasmático/complexo de Golgi, e é iniciada pela síntese de um tetrassacarídeo (GlcAβ1–3Galβ1–3Galβ1–4Xylβ1–O-Ser) que compreende a região de ligação GAG-proteína, ligada covalentemente a um resíduo específico de serina dentro do core
proteico (SUGAHARA; KITAGAWA, 2000; UYAMA et al., 2007). Cada
monossacarídeo da região de ligação é inserido individualmente pelas glicosiltransferases correspondentes, xilosiltransferase (XylT), galactosiltransferase I (GalT-I), galactosiltransferase II (GalT-II) e glucuroniltransferase I (GlcAT-I)
(KITAGAWA et al., 1998; OKAJIMA et al., 1999; GÖTTING et al., 2000; BAI et al.,
2001). Em seguida, a transferência do primeiro resíduo de GalNAc ao GlcA terminal da região de ligação direciona a síntese da cadeia de CS ou dermatam sulfato (DS), e portanto, se inicia a síntese da região de repetição dissacarídica pela inserção alternativa de resíduos de GlcA e GalNAc pela ação das enzimas GlcAT-II e GalNAcT-II, respectivamente (SUGAHARA; KITAGAWA, 2000; UYAMA et al., 2007).
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica esses resíduos resultam na formação de diferentes unidades dissacarídicas e consequentemente uma ampla diversidade estrutural observadas nas cadeias de CS
(Figura 1C) (PAVÃO et al., 2006; NANDINI; SUGAHARA, 2006; MALAVAKI et al.,
2008).
A distribuição espacial e o grau de sulfatação, bem como o tamanho e o número das cadeias de CS inseridas nos proteoglicanos, tornam esse GAG uma molécula altamente heterogênea e complexa capaz de exercer funções
Figura 1: Esquema convencional da maquinaria biossintética do CS (A). Unidade dissacarídica
básica do CS com os possíveis níveis de sulfatação (B). Principais unidades dissacarídicas encontradas para as cadeias de CS (C). XylT, xilosiltransferase; GalT-I, galactosiltransferase-I; GalT-II, galactosiltransferase-II, GlcAT-I, glucuroniltransferase-I; GalNAcT-I, GalNAc transferase-I; GlcAT-II, GlcA transferase-II; GalNAcT-II, GalNAc transferase-II; C4ST, chondroitin sulfotransferase; C6ST, chondroitin 6-O-sulfotransferase; D4ST, dermatan 4-O-sulfotransferase; CS/DS2ST, uronyl 2-O-4-O-sulfotransferase; GalNAc4S-6ST, GalNAc 4-sulfato 6-O-sulfotransferase; DS-epi, GlcA C-5 epimerase (DS epimerase). Figura adaptada deMIKAMI; KITAGAWA, 2013 e MALAVAKI e col. (2008).
A
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica multivariadas (VOLPI, 2011; MIKAMI; KITAGAWA, 2013). Dentre essas várias funções alguns processos biológicos importantes se destacam, tais como, na inflamação, proliferação, diferenciação e migração celular, morfogênese tecidual,
organogênese, infecções e reparo tecidual (SUGAHARA et al., 2003; SHRIVER et
al., 2004; YAMADA; SUGAHARA 2008). Clinicamente, o uso do CS tem sido indicado como uma opção segura e eficaz para o tratamento dos sintomas da osteoartrite (MCALINDON et al., 2000; JORDAN et al, 2003; ZHANG et al., 2007; UEBELHART, 2008; VOLPI; MACCARI, 2008, 2009).
Além disso, uma grande variedade estrutural e química nas cadeias de CS também pode ser observada de acordo com a origem do tecido e espécie animais. Consequentemente, tais peculiaridades estruturais podem conferir a estas moléculas
diferentes propriedades biológicas e farmacológicas (MACCARI et al., 2010;
MALAVAKI et al., 2008). Algumas evidências mostram que nas espécies de
invertebrados, sobretudo nos de origem marinha, essa heterogeneidade estrutural é bem mais pronunciada (LAMARI; KARAMANOS, 2006; MALAVAKI et al., 2008). Um bom exemplo disso pode ser observado para o Echinodermata pepino do mar, a partir do qual foi isolado um tipo de CS bastante peculiar apresentando, como ramificação, um resíduo fucopiranosil sulfatado ligado a posição C-3 do GlcA. Esse CS-fucosilado tem demonstrado algumas propriedades biológicas incomuns ao CS de mamíferos (defucosilado), como atividade anticoagulante e antitrombótica (FONSECA; MOURÃO, 2006; WU et al., 2015).
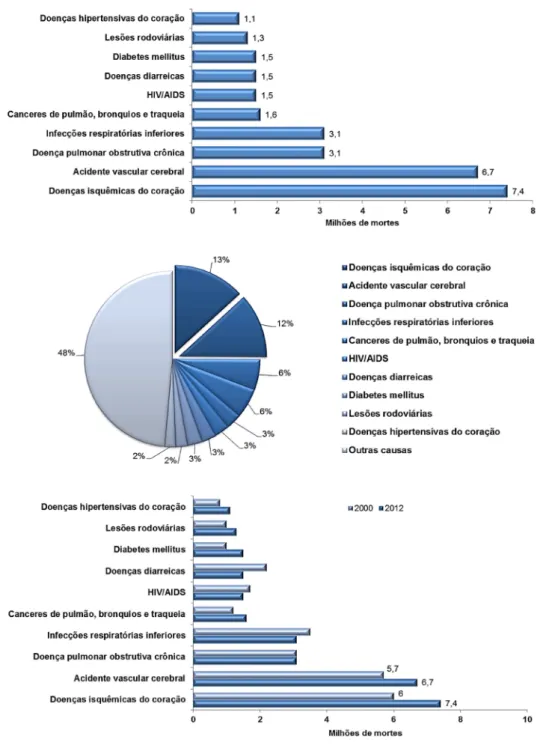
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica Ao longo dos últimos anos, as doenças cardiovasculares tem sido a principal causa de morte por doenças no mundo, sendo responsáveis pela morte de aproximadamente 17,5 milhões de pessoas no ano de 2012 (o que representa 31% das mortes em todo o mundo), dentre as quais as doenças isquêmicas do coração e os acidentes vasculares cerebrais juntos somam em torno de 25% dessas mortes
Figura 2: As dez principais causas de mortes no mundo no ano de 2012, segundo a
Organização Mundial da Saúde (OMS). Disponível em:
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica (Figura 2) (OMS, 2012). Segundo dados do Ministério da Saúde, no Brasil, as
doenças cardiovasculares também ocupam o topo do raking das principais causas
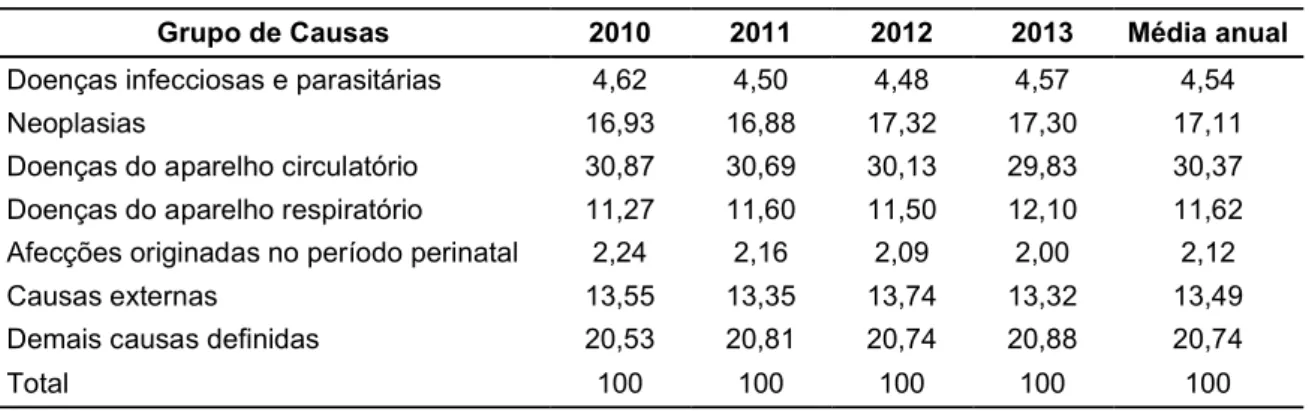
de mortes por grupos de doenças mantendo uma média anual de 30% (Tabela 1) (MS, 2013).
Tabela 1: Proporção de óbitos (%) por grupo de causas definidas no Brasil entre os anos 2010-2013.
Grupo de Causas 2010 2011 2012 2013 Média anual
Doenças infecciosas e parasitárias 4,62 4,50 4,48 4,57 4,54
Neoplasias 16,93 16,88 17,32 17,30 17,11
Doenças do aparelho circulatório 30,87 30,69 30,13 29,83 30,37 Doenças do aparelho respiratório 11,27 11,60 11,50 12,10 11,62 Afecções originadas no período perinatal 2,24 2,16 2,09 2,00 2,12
Causas externas 13,55 13,35 13,74 13,32 13,49
Demais causas definidas 20,53 20,81 20,74 20,88 20,74
Total 100 100 100 100 100
Fonte: Ministério da Saúde/SVS - Sistema de Informações sobre Mortalidade (SIM).
A fisiopatologia da trombose foi inicialmente descrita pelo patologista alemão Rudolf Virchow em 1856. Em seu trabalho, três causas principais que contribuem para a formação dos trombos foram sugeridas: alterações da integridade endotelial (injúria vascular), no fluxo sanguíneo (estase circulatória) e na composição do sangue com desequilíbrio no sistema pró- e/ou anticoagulante (hipercoagulabilidade) (Virchow, 1856). Essas causas predisponentes se influenciam mutuamente e são conhecidas atualmente como tríade de Virchow.
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica pulmonar crônica, doença inflamatória crônica, histórico familiar, trombofilias, deficiência de proteína C e de proteína S (ambas, proteínas reguladoras da coagulação) e mutação do gene de protrombina. Por favorecerem a maior formação de fibrina, que aprisiona as hemácias no coágulo, esses trombos são conhecidos como trombos vermelhos (SHERMAN, 2006; MARTINELLI; BUCCIARELLI; MANNUCCI, 2010; MACKMAN, 2012).
Atualmente, essa dicotomia de processos etiológicos da trombose venosa e arterial tem sido contestada por alguns estudos que reconhecem vários fatores de riscos (tais como, idade, obesidade, infecções, diabetes e síndromes metabólicas) comuns às duas condições clínicas de trombose (FRANCHINI e MANNUCCI, 2008; MARTINELLI; BUCCIARELLI; MANNUCCI, 2010).
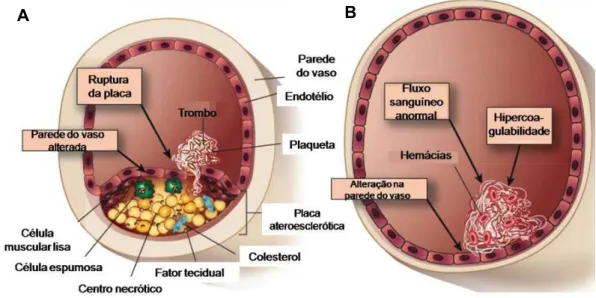
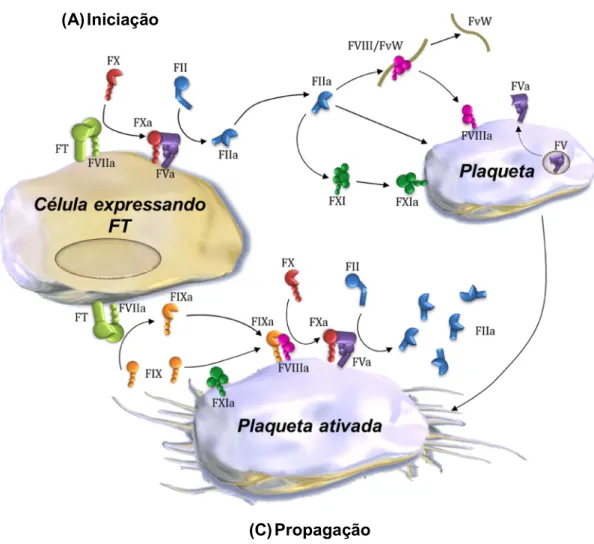
Qualquer que seja o fator etiológico envolvido na formação dos trombos é certo que o sistema de coagulação está sendo amplamente ativado (Figura 4), e a iniciação desse processo se faz mediante a exposição do fator tecidual (FT) no espaço intravascular pelas células endoteliais e monócitos. A expressão do FT por essas células não ocorre normalmente, no entanto, sob algumas condições patológicas, como no câncer metastático e em processos infecciosos, a liberação de citocinas pró-inflamatórias (TNF-α e interleucina-1β, por exemplo) e endotoxinas
Figura 3: Iniciadores da trombose venosa e arterial. A trombose arterial é disparada com o rompimento de um ateroma, levando à exposição de constituintes do interior da placa ao sangue (A). Na trombose venosa, ocorrem alterações no endotélio, no fluxo sanguíneo e nos componentes sanguíneos (B). Adaptado de MACKMAN, 2008.
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica podem acabar induzindo a expressão dessa proteína (VAN DEVENTER et al., 1990;
PRANDONI; FALANGA; PICCIOLI, 2005; SCHOUTEN et al., 2008). Na superfície
dessas células o FT forma um complexo enzimático com a serinoprotease FVIIa circulante no plasma (complexo tenase extrínseco) que tem como substratos principais as pró-enzimas FX e FIX, que são convertidos às suas formas ativas, FXa e FIXa, respectivamente (Figura 4A). O FXa recém-formado permanece atracado a membrana celular, onde juntamente com o FVa constituirá o complexo protrombinase extrínseco capaz de formar pequenas quantidades de trombina (Fator IIa) a partir da clivagem proteolítica do seu precursor protrombina (Fator II). Esses
Figura 4: Modelo celular da coagulação sanguínea. A fase iniciação (A) ocorre em células que
expressam FT, onde concentrações picomolares de trombina são produzidas. Na fase de amplificação (B), plaquetas e cofatores são ativados preparando as condições para a geração de trombina em larga escala. A fase de propagação (C) ocorre na superfície das plaquetas ativadas, e resulta na produção de trombina produzida em concentrações micromolares. Figura adaptada de MONROE e col. 2002.
(A)Iniciação
(B)Amplificação
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica processos constituem a então conhecida fase de iniciação da coagulação (HOFFMAN; MONROE III, 2001).
As pequenas quantidades de trombina formadas exercem um papel fundamental na fase de amplificação da resposta pró-coagulante que vem em seguida (Figura 4B). Esta etapa ocorre na superfície das plaquetas que são completamente ativadas pela trombina via receptor ativado por protease 1 (PAR-1,
do inglês drotease-activated recedtor), também conhecido como receptor de
trombina. A ativação das plaquetas, por sua vez, leva a liberação do conteúdo de seus grânulos promovendo a secreção do FV até sua superfície, o recrutamento, a adesão, agregação e ativação de outras plaquetas. Além disso, a exposição do fosfolipídio fosfatidilserina também é induzida nesse processo, o que facilita o ancoramento dos fatores Va, VIIIa e XIa (ativados pela trombina) à superfície das plaquetas (HOFFMAN; MONROE, 2001; HOFFMAN, 2003).
Por fim, na fase de propagação da coagulação, o FIXa oriundo da fase de iniciação, bem como o que foi ativado pelo FXIa na superfície da plaqueta, irá constituir junto ao FVIIIa o complexo tenase intrínseco. Vale ressaltar que esse complexo é capaz de ativar o FX com uma eficiência 50 vezes maior do que o complexo tenase (FT-FVIIa) formado na superfície das células que expressam FT na fase de iniciação. Em seguida, o complexo protrombinase intrínseco é montado a partir da junção do FX com o FVa e passará a converter a protrombina em trombina (Figura 4C) (HOFFMAN; MONROE, 2001).
A trombina é uma enzima multifuncional que atua no sistema de coagulação de quatro maneiras importantes: (1) converte o fibrinogênio solúvel no plasma em fibrina que, a seguir, forma longas fibras poliméricas insolúveis; (2) ativa o fator XIII, que se liga aos polímeros de fibrina de forma cruzada, produzindo uma rede ou coágulo altamente estável; (3) amplifica a cascata da coagulação ao catalisar a ativação dos fatores V, VII, VIII e XI; e (4) ativa poderosamente as plaquetas, causando a liberação dos seus grânulos e agregação plaquetária (ARMSTRONG; GOLAN, 2009).
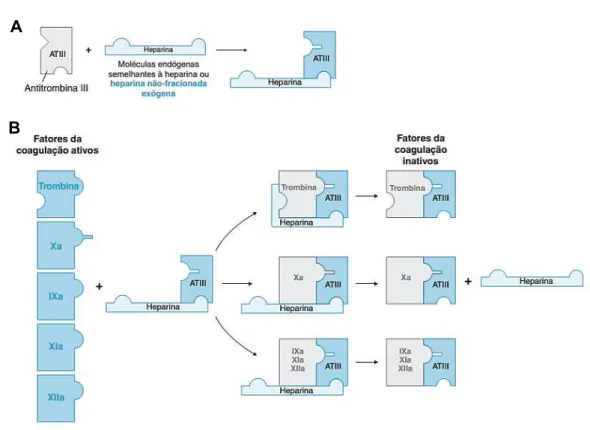
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica tecidual (TFPI, do inglês tissue factor dathway inhibitor), a antitrombina III (ATIII) e o cofator II da heparina (HCII, do inglês hedarin cofactor II) (CASU et al., 2004; BOUÇAS et al., 2006). O TFPI promove a regulação do FXa a partir da inibição específica do complexo FT/FVIIa, enquanto que a ATIII é capaz de inibir todos os fatores da coagulação, incluindo a trombina, e o HCII atua inibindo especificamente a trombina (QUINSEY et al., 2004; TOLLEFSEN, 2004; LWALEED; BASS, 2006).
Tanto a ATIII quanto o HCII são potencializados fisiologicamente por cadeias de heparam sulfato (HS) expressas na superfície das células endoteliais. Em contanto com o sangue, esses GAGs interagem diretamente com esses dois inibidores de serinoproteases promovendo efeitos antitrombóticos que variam em decorrência do tipo e da localização do vaso onde são expressos (DE MATTOS et al., 2008).
A heparina é um GAG altamente sulfatado presente nos grânulos de mastócitos que compartilha semelhanças estruturais com o HS (CASU; NAGGI; TORRI, 2010). Devido ao padrão especial de distribuição de cargas negativas ao longo de sua cadeia, essa molécula é capaz de interagir e modular a atividade de algumas proteínas específicas, dentre as quais a ATIII e o HCII, que tem suas atividades amplamente aumentadas pela ligação com a heparina (CASU; GUERRINI; TORRI, 2004; BOUÇAS et al., 2006).
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica Apesar de bem estabelecido e amplamente difundido na literatura, esse modelo pragmático que relaciona a presença da região pentassacaridica da heparina com sua atividade anticoagulante tem sido contestado recentemente
(RUDD et al., 2010; LIMA et al., 2013, CHAVANTE et al., 2014; CHAVANTE et al.
2015). Chavante e col. (2014), por exemplo, descreveram a ocorrência de um composto estruturalmente relacionado à heparina (isolado a partir do crustáceo Litodenaeus vannamei) contendo em sua cadeia um monossacarídeo trissulfatado (glucosamina 2,3,6-O-sulfato) altamente raro, e que tem sido apontado como a unidade da sequência pentassacarídica responsável pela ligação com a ATIII. No entanto, apesar de se ligar a ATIII com alta afinidade, essa molécula é destituída de atividade anticoagulante. Além disso, foi demonstrada sua ineficiência na estabilização da ATIII. Esses achados têm reforçado a ideia de que outros fatores (tais como, estabilização da trombina, conformação, distribuição de cargas e flexibilidade) estejam envolvidos na interação dessas moléculas com a ATIII.
Figura 5: Mecanismo de ação da ATIII. A ligação da heparina à ATIII induz uma alteração na
conformação da ATIII (A) que permite a sua ligação à trombina e a outros fatores da coagulação IXa, Xa, XIa ou XIIa (B). Figura disponível em ARMSTRONG; GOLAN, 2009.
A
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica A ligação da heparina com o HCII, por sua vez, parece não estar relacionada com sua região pentassacarídica, e a ocorrência de uma região específica responsável por essa interação ainda permanece desconhecida (CASU et al., 2004). Contudo, na presença da heparina ou de outro GAG a porção N-terminal do HCII (anteriormente bloqueada) se desliga do seu próprio domínio de ligação a GAGs e interage com a trombina bloqueando assim seu sítio ativo (TOLLEFSEN; BLANK,1981). Para que a formação desse complexo ocorra, é necessário que a cadeia da heparina apresente um comprimento mínimo de 24 monossacarídeos para que o potencial de inibição do HCII seja potencializado (LIAW et al., 1999).
Em virtude desses efeitos, por mais de setenta anos a heparina tem sido a droga anticoagulante mais utilizada no mundo para o tratamento e prevenção da trombose (GRESELE; BUSTI; PAGANELLI, 2012). Contudo, seu uso não é considerado seguro, pois torna o paciente bastante susceptível a problemas hemorrágicos, sendo necessário o monitoramento laboratorial constante do tempo de coagulação. Além disso, o uso prolongado pode causar a trombocitopenia induzida pela heparina, que consiste na indução da formação de anticorpos que promovem a ativação plaquetária com consequente liberação do fator plaquetário 4. Juntamente com a heparina circulante no plasma, o fator plaquetário 4 forma um complexo altamente antigênico na superfície de plaquetas e de células endoteliais levando a destruição dessas células. Além da trombocitopenia (diminuição do numero de plaquetas), um estado pró-trombótico pode ser instalado a partir da lesão endotelial causada (GREINACHER, 2015).
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica
mais cultivada no nordeste brasileiro e no mundo, o Litodenaeus vannamei
(RENDON RODRIGUEZ et al., 2007; LIMA et al., 2010).
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica Objetivo geral:
Caracterizar a estrutura de um composto tipo condroitim sulfato isolado do
cefalotórax do camarão Litodenaeus vannamei e avaliar seu efeito sobre alguns
aspectos da hemostasia.
Objetivos específicos:
Obter e purificar o composto tipo condroitim sulfato a partir do cefalotórax do
camarão L. vannamei;
Elucidar as principais características estruturais do condroitim sulfato do camarão;
Avaliar seu efeito sobre a coagulação sanguínea;
Avaliar suas propriedades antitrombóticas in vitro e in vivo;
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica 3.1. Materiais e reagentes
Heparina sódica de mucosa suína foi obtida do Laboratório Derivati Organici
(Trino Vercellese, Itália);
Pentassacarídeo sintético com peso molecular 1728 Da foi obtido da GSK
(Rio de Janeiro, Brasil);
Condroitim 4-sulfato e condroitim 6-sulfato, extraídos de cartilagem de baleia
e dermatam sulfato, extraído de pele de porco, foram adquiridos da Miles Laboratories (Elhart, IN, EUA);
Heparam sulfato foi extraído de pâncreas bovino como descrito por Dietrich e
Nader (1974);
As enzimas heparinase (EC 4.2.2.7) e heparitinase I e II foram preparadas a
partir de Flavobacterium hedarinum como descrito por Nader e colaboradores (1990);
A condroitinases ABC de Proteus vulgaris (EC 4.2.2.4) com atividade
específica entre 50-250 unidades/mg e a condroitinase AC de Flavobacterium hedarinum (EC 4.2.2.5) com atividade específica entre 0,5-1,5 unidades/mg; 1,3-diaminopropano acetato (PDA) e albumina de soro bovino foram adquiridas da Sigma–Aldrich Co. (St. Louis, MO, E.U.A.);
Agarose (Standard-Low-Mr) foi adquirida da BioRad Laboratories
(Richmond,CA, EUA);
O carreador livre [35S]- sulfato inorgânico foi adquirido do from Instituto de Pesquisas Nucleares (São Paulo, SP, Brazil).
Kit para ensaio de TTPA CLOT da BIOS DIAGNÓSTICA (Sorocaba, SP,
Brasil);
Os kits de dosagem das atividades anti-Xa (ref: 221010) e anti-IIa (ref: 221025) foram adquiridos da HYPHEN BioMed (Neuville-sur-Oise, França);
Superase foi adquirida da Prozyn Indústria e Comércio Ltda. (São Paulo, SP,
Brasil);
Ácido acético, acetona, metanol, cloreto de sódio, hidróxido de sódio e cristal
violeta, foram adquiridos da Vetec Química Fina Ltda (Rio de Janeiro, RJ, Brasil);
Etanol e benzina foram adquiridos da Cromato Produtos Químicos Ltda.
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica 3.2. Cultura de células
As células endoteliais derivadas da aorta de coelhos foram mantidas em meio
de cultura F-12 (Invitrogen, San Diego, CA, USA) contendo 10% de soro fetal bovino
(Cultilab, Campinas, SP, Brasil) e 20 mM de bicarbonate de sódio a 37 °C em estufa humidificada com 5% de CO2. A cada três dias o meio de cultura era trocado, e as células subcultivadas a cada semana.
3.3. Animais
3.3.1. Ratos albinos
Os experimentos in vivo para avaliação do potencial antitrombótico e
determinação da tendência hemorrágica foram realizados com ratos da linhagem Wistar machos, pesando entre 300 a 400g e com média de 6 meses de idade, obtidos do biotério do Departamento de Bioquímica da Universidade Federal do Rio Grande do Norte. Os animais receberam água e dieta ad libitum. Os experimentos com animais foram aprovados pelo comitê de ética no uso de animais – CEUA/UFRN (Protocolo 053/2011).
3.3.2. Camarões Litodenaeus vannamei
Para obtenção do composto tipo condroitim sulfato, foram utilizadas as cabeças (cefalotórax) do camarão branco do pacífico (Litodenaeus vannamei), cedidos pela empresa de beneficiamento de camarão ENSEG Indústria Alimentícia LTDA, situada na BR-304, 104, Macaíba-RN, Brasil. O material fresco foi mantido em gelo até o seu processamento.
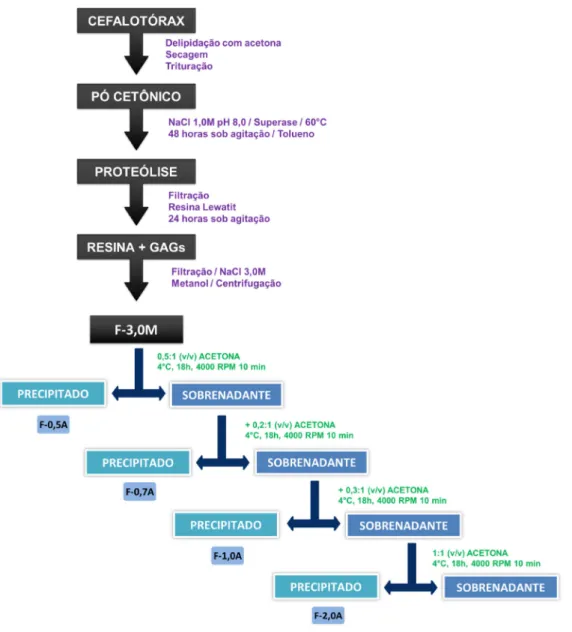
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica solvente para eliminação dos lipídios. Após secagem, o tecido foi triturado novamente até obtenção de um pó ao qual foi misturado a uma solução de NaCl 1M (1L/Kg). O pH da mistura foi ajustado para 8,0 e em seguida o foi material submetido a digestão enzimática com 56g da enzima superasse. Após 48 horas de incubação a 60ºC sob agitação e ajustes periódicos do pH, a mistura foi filtrada. Ao filtrado foi adicionado a resina de troca-iônica Lewatit para complexação com os glicosaminoglicanos (GAGs), sendo essa mistura agitada por 24 horas a temperatura ambiente sob uma fina camada de tolueno para prevenir o crescimento bacteriano.
Após a recuperação da resina por filtração, a mesma foi lavada inicialmente com água destilada a 50 ºC (2:1 v/v) e posteriormente com uma solução de NaCl 1M (1:1 v/v) a temperatura ambiente. Com o intuito de descomplexar os GAGs, a resina foi eluída com uma solução de NaCl a 3,0M (2:1 v/v), mantida sob agitação por 6 horas e posteriormente filtrada. Após a adição de metanol (2:1 v/v) ao filtrado, o mesmo foi mantidos a 4 ºC durante 48 horas. Após esse período o precipitado de GAGs foi recolhido por centrifugação, gerando a fração F-3.0M, a qual foi submetida à análise eletroforética e aos posteriores processos de purificação.
3.5. Purificação dos GAGS obtidos do Litopenaeus vannamei
3.5.1. Fracionamento dos GAGs
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica 3.5.2. Cromatografia de troca-Iônica
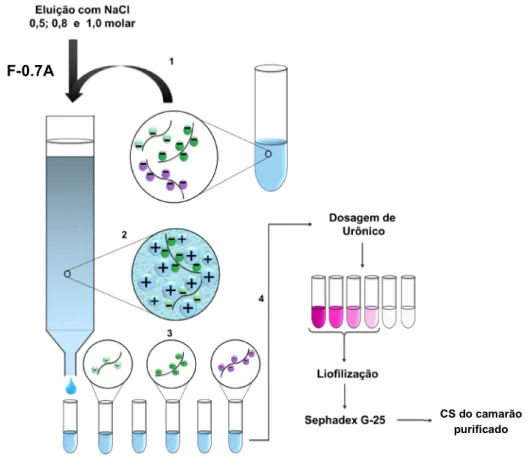
A fração F-0,7A, oriunda da precipitação com acetona, foi submetida a cromatografia de troca-iônica utilizando-se a resina Dowex 50W-X8 Na+ (Aldrich) com a finalidade de garantir a forma sódica do composto tipo condroitim, livrando-lhe de outros cátions que possam interferir nas análises estruturais subsequentes. Em seguida, essa fração foi submetida novamente a outro processo cromatográfico de troca iônica, utilizando-se a resina DEAE Sephacel, com o intuito de isolar o composto tipo condroitim sulfato e outros GAGs. Para tanto, esta fração foi eluída com molaridades crescentes de NaCl (0,5; 0,8 e 1,0 molar), gerando três
sub-Figura 6: Esquema da extração e fracionamento dos glicosaminoglicanos do cefalotórax do L.
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica frações distintas de GAGs correspondentes a molaridade de NaCl com as quais foram eluídas. Em seguida, cada sub-fração teve seu conteúdo de ácido urônico análisado (DISCHE, 1947). Para retirar o sal proveniente das etapas anteriores, as sub-frações foram submetidas à cromatografia de gel filtração em Sephadex G-25 (Figura 7).
3.6. Eletroforese
Alíquotas de 5µL das amostras foram aplicadas a um gel de agarose a 0,6% contendo tampão 1,3-diaminopropano (PDA) 0,05M e pH 9,0 ou tampão acetato de Bário-PDA 0,04M e pH 5,8. No sistema PDA o gel é submetido a uma corrente de
Figura 7: Purificação do condroitim do camarão por cromatografia de troca-iônica em
DEAE-Sephacel. (1): Fração proveniente do fracionamento com acetona (F-0,7A) contendo o condroitim sendo submetida à cromatografia de troca-iônica e posteriormente eluída com diferentes molaridades de NaCl; (2): os grupos sulfato do condroitim formam um complexo com a resina catiônica, sendo em seguida descomplexados por força iônica; (3): eluatos contendo diferentes populações de GAGs (4): análise do conteúdo de ácido urônico presente nos eluatos, indicado pela coloração rosada. Os tubos contendo o condroitim do camarão são liofilizados e posteriormente dessalinizados em Sephadex G-25.
F-0.7A
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica 100 V durante aproximadamente 1h em cuba refrigerada a 4 °C. No sistema descontínuo Ba-PDA o gel é submetido inicialmente a uma corrente de 75V durante 15 minutos, em cuba refrigerada à 4 °C e em seguida transferida para outra cuba (com tampão PDA), onde é mantida em repouso durante 10 minutos a 4 °C e depois submetido a 100 V durante aproximadamente 1h. Para ambos os sistemas de corrida utilizou-se o vermelho de cresol como indicador de corrida. Após esse processo, os GAGs no gel foram fixados com CETAVLON 0,1 % (solução de brometo N-cetil-N, N, N-trimetilamônio) durante 2h. Em seguida o gel foi desidratado sob corrente de ar quente e corado com solução corante contendo 0,1% de azul de toluidina, 50% de etanol e 1% de ácido acético. Para retirada do excesso de corante o gel foi imerso na mesma solução sem o azul de toluidina, como descrito por Dietrich e Dietrich (1976).
3.7. Determinação do peso molecular
O peso molecular do condroitim do camarão foi analisado por cromatografia de gel
permeabilidade (GPC, do inglês gel dermeation chromatogradhy) acoplado ao
sistema de HPLC (do inglês, high-dressure liquid chromatogradhy) em uma coluna
BioSep SECTM S-2000 LC 300 × 7,8 mm. Uma alíquota de 20 µL de solução de
amostra (10mg/mL em 0,3M de sulfato de sódio) foi aplicada no sistema GPC-HPLC com fluxo de 1 mL/min. A detecção do composto foi determinada por luz ultravioleta a 205 nm a temperatura ambiente. Antes desse processo, a coluna foi previamente calibrada com polissacarídeos de pesos moleculares conhecidos (1.7, 4, 10, 16 e 20 kDa).
3.8. Degradação enzimática
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica enzimas foram analisados por eletroforese em gel de agarose e tampão PDA e também por HPLC em resina de troca-iônica SAX (Dupont). Os dissacarídeos foram eluídos da coluna usando um gradiente de NaCl (0,01-2 M) e posteriormente monitorada a 230 nm contra o branco correspondente de cada mistura.
3.9. Ressonância magnética nuclear
Para os experimentos de ressonância magnética nuclear (RMN), o condroitim
do camarão inicialmente solubilizado com água deuterada (D2O). Os espectros
foram obtidos a partir de soluções em D2O a 30 °C ou 70 °C, usando o ácido
propanoico trimetilsilil (TSP, do inglês trimethylsilyl drodanoic acid) como padrão (δ = 0). Os espectros bidimensionais COSY (correlation sdectroscody), TOCSY (total correlation sdectroscody) e heteronuclear foram obtidos a partir do espectrômetro
Bruker 600 MHz AVANCE III com uma sonda de gradiente inversa de 5 mm (QXI).
Os experimentos de HSQC (heteronuclear single quantum coherence) e
HSQC-TOCSY com larguras espectrais de 7211 Hz (1H) e 12073 Hz (13C) foram registados
para a detecção de quadratura na dimensão indireta, usando 64 ou 124 scans. Todos os sinais atribuídos foram realizados utilizando o programa TopSpin. Os experimentos de TOCSY 1D foram conduzidos usando um programa de pulso Bruker padrão (selmlgp). Para a excitação seletiva foi utilizado um comprimento de pulso de 80 ms, seguido por uma MLEV-17 para a mistura. Pulsos seletivos de diferentes tempos de mistura variando entre 5-100 ms usando 256 scans foram utilizados por experimento.
3.10. Testes anticoagulantes in vitro
A atividade anticoagulante do condroitim do camarão foi avaliada por diferentes ensaios de acordo com as recomendações do fabricante de cada Kit. O tempo de tromboplastina parcial ativado (TTPA) e o tempo de protrombina (TP)
foram avaliados em triplicata usando o coagulômetro Quick timer. Inicialmente, 90µL
de plasma humano citratado fresco foram incubados com 10µL do condroitim sulfato
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica de sódio (para o TP) foram então adicionados e em seguida o tempo de coagulação foi medido. O condroitim do camarão também teve suas atividades anti-Xa e anti-IIa avaliadas por ensaios cromogênicos. Resumidamente, a antitrombina (para o ensaio anti-Xa) ou a trombina (para o ensaio anti-IIa) foi incubada a 37 °C durante 2 minutos na presença do condroitim do camarão ou da heparina em concentrações em várias concentrações. Em seguida, os fatores Xa ou IIa purificados a partir de bovinos foi adicionado, misturado e novamente incubado a 37 °C por 2 minutos. Por fim, a reação foi interrompida com ácido acético 30% e a absorbância mensurada a 405 nm contra os brancos correspondentes. Todos os ensaios foram realizados em triplicata.
3.11. Ensaio de termoestabilização da antitrombina na presença de GAGs Alíquotas de 5 uL, de uma solução de 10 mg/mL, do condroitim do camarão foram distribuídas em uma placa de 96 poços contendo tampão fosfato nM/NaCl 15 nM e a sonda Sypro Orange 100 vezes concentrada. O corante tem excitação nos comprimentos de onda de 30 ou 470 nm, e emite fluorescência a 570 nm, quando se liga a resíduos hidrofóbicos presentes na antitrombina. A proteína foi submetida a um gradiente de temperatura de 32 °C a 85 °C e os dados foram coletados por 30 segundos em cada temperatura. Houve uma incubação inicial por dois minutos a 31 °C durante 5 segundos entre cada aumento de temperatura, para equilíbrio do sistema. A leitura foi realizada em termociclador através do diferencial de fluorescência (DSF – Differential Scanning Fluorimetry).
3.12. Atividade antitrombótica in vivo
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica laqueaduras livres foram realizadas a 1 cm de distância entre si, logo abaixo da veia renal direita, na cavidade abdominal dos animais previamente abertos e com a veia cava desprendida dos tecidos. Os animais foram fechados cirurgicamente, e após 2 horas o segmento do vaso contendo as laqueaduras foi removido. O trombo formado no segmento do vaso foi retirado, lavado, posto sobre papel de filtro e colocado para secar por 24 horas em câmara de vácuo e finalmente pesados. Os experimentos foram realizados com seis animais para cada amostra.
3.13. Síntese de heparam sulfato antitrombótico pelas células endoteliais Células endoteliais da aorta de coelho foram cultivadas em placas de 24
poços, (104 células/poço). Após atingir a confluência as células foram lavadas três
vezes com meio F-12 na ausência de soro fetal bovino (SFB) e posteriormente um
novo meio contendo 150 µCi/mL de [35S] – sulfato de sódio na presença ou ausência
de heparina (100 µg/mL) ou do condroitim do camarão em diferentes concentrações. As células foram mantidas por cerca de 24 horas na estufa a 37 ºC e em atmosfera
de 5% de CO2. Após o tempo de incubação, o meio foi coletado em banho de gelo e
armazenado em tubos de 2 mL a -20 ºC. As células foram lavadas 3 três vezes com PBS em banho de gelo e removidas com 150 µL de uma solução de ureia 7,0 M em
tampão Tris-HCl 50 mM pH 7,8 com o auxílio de um “scrapper”. O condroitim [35
S]-sulfato e o heparam [35S]-sulfato sintetizados e liberados para o meio foram
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica 3.14. Determinação da capacidade hemorrágica do condroitim do camarão
Para verificar o possível efeito hemorrágico do conroitim do camarão, foi utilizado o modelo de cauda escarificada desenvolvido por Cruz e Dietrich (1967). Inicialmente, foi realizada uma tricotomia da parte terminal da cauda de rato, seguida de uma escarificação utilizando uma lâmina de bisturi. Em seguida, a cauda escarificada foi introduzida em tubos de ensaio contendo 2 mL da solução salina a 37 °C, o processo de sangramento foi acompanhado durante cinco minutos. Em seguida, a cauda foi retirada e submetida a um estímulo mecânico para obter um novo sangramento. A cauda é, então, mergulhada em uma nova solução salina. Depois de cinco minutos, o processo é realizado mais uma vez. Após os três estímulos mecânicos a cauda foi mergulhada em solução salina contendo heparina ocondroitim do camarão, na concentração de 100 µg/mL. Após cinco minutos a cauda foi retirada e lavada intensamente com solução salina, e o efeito hemorrágico residual foi observado mergulhando-se a cauda em uma nova solução salina sem a droga durante 40 minutos corridos. Em seguida foi realizada a dosagem de proteínas liberadas a partir da lesão, após o contato com a amostra testada, pelo método de BRADFORD (1976). Os resultados foram expressos pela razão cumulativa da taxa de proteínas liberadas da lesão antes e após o contato com os compostos estudados.
3.15. Análise estatística
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica 4.1. Isolamento e purificação dos GAGs do Litopenaeus vannamei
Os GAGs isolados das cabeças do camarão submetidos a proteólise e fracionamento com resina de troca iônica foram inicialmente eluídos com NaCl 3.0 M para obtenção de um extrato bruto denominado fração F-3.0M. O perfil de GAGs dessa fração foi identificado por eletroforese em gel de agarose em tampão acetato/diaminopropano (PDA), que de acordo com o grau de interação da diamina com os GAGs, permite identificar por ordem decrescente o condroitim sulfato (CS), dermatam sulfato (DS) e heparina/heparam sulfato (Hep/HS). Após a corrida eletroforética da fração F-3.0M, observou-se a presença de bandas heterogêneas migrando como os padrões de GAGs de mamíferos (dados não mostrados).
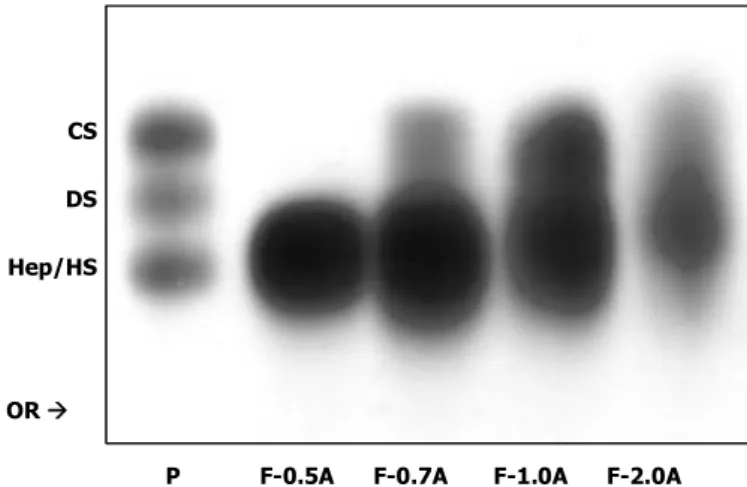
Uma vez identificada a ocorrência dos GAGs na fração F-3.0M, o passo seguinte teve como objetivo separar as classes de compostos presentes no extrato bruto. Para isso, essa fração foi submetida à precipitação com volumes crescentes de acetona, a partir da qual se originou quatro frações subsequentes denominadas: F-0.5A, F-0.7A, F-1.0A e F-2.0A. A caracterização eletroforética destas frações, indicada pela Figura 8, demonstrou que nesta etapa de purificação apenas a F-0.5A apresentou um perfil de migração mais homogêneo representado na figura por uma banda única que migra entre a Hep/HS e DS, enquanto que as demais frações mantiveram o perfil de migração mais heterogêneo. Apesar disso, a F-0.5A já tem sido bem caracterizada em estudos prévios (BRITO et al., 2008; DREYFUSS et al., 2010; CHAVANTE et al., 2014). Dessa forma, devido ao fato de ter sido ainda pouco explorada e representar a fração com o maior rendimento dentre as demais (Tabela 2), a F-0.7A foi escolhida para dar prosseguimento ao presente estudo.
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica natureza da SF-1.0M quanto as suas características estruturais e atividades biológicas, tal sub-fração foi evidenciada neste estudo e conduzida aos testes subsequentes, e a partir de então será abordada separadamente.
Cabeças
(Kg) F-3.0 M (mg)
Frações Obtidas por Tratamento com Acetona (mg)
F-0.5 F-0.7 F-1.0 F-2.0
14 957,2 (31,2 %) 168* (43,2 %) 233* (21,7 %) 117* (3,8 %) 21*
Ao final da cromatografia de troca-iônica a SF-1.0M foi submetida à cromatografia de gel filtração em Sephadex-G25. Esse processo garante a remoção do NaCl proveniente das etapas anteriores e garante a pureza da sub-fração isolada, conforme pode ser observado na Figura 9B, que indica o perfil de eluição da SF-1.0M isolada do sal presente na amostra.
Tabela 2: Rendimento das frações de GAGs obtidos a partir das cabeças do Litodenaeus vannamei.
* Massas obtidas a partir do material solúvel da F-3.0M. Os valores entre parênteses representam o rendimento percentual em relação ao total das massas obtidas no fracionamento com acetona.
Figura 8: Comportamento eletroforético em sistema PDA dos GAGs do cefalotórax do L.
vannamei obtidas após tratamento com acetona da fração F-3.0M. Cerca de 10g de cada fração foram submetidos à eletroforese em gel de agarose, tampão PDA 0,05M, pH 9,0. Os compostos foram fixados com CETAVLON 0,1% e corados com solução de azul de toluidina. (OR) origem; (P) padrão contendo 5g de condroitim 4/6 sulfato (CS), dermatam sulfato (DS) e heparam sulfato (HS); (0.5A, 0.7A, 1.0A, 2.0A) Frações obtidas após precipitação com acetona.
P F-0.5A F-0.7A F-1.0A F-2.0A
CS
DS
Hep/HS
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica Uma vez isolada e purificada, a SF-1.0M teve seu perfil eletroforético mais uma vez analisado, desta vez sendo comparada à heparina de mamíferos no sistema descontínuo de tampão Bário/PDA, que tem como finalidade a observação dos componentes de migração rápida e lenta da heparina. A partir da Figura 9C é possível observar que a SF-1.0M apresentou um perfil de migração bastante distinto da heparina de mamíferos, com deslocamento superior ao componente de migração rápida da heparina e ausência do componente de migração lenta.
0 100 200 300 400 500 600 0.0 0.1 0.2 0.3 0.4 0.5 0.8 1.0 0.0 Volume (mL) Ab so rb ân ci a (5 30 n m ) Na Cl (m ol/ L)
0 50 100 150 200 250 300 350 400
0.00 0.05 0.10 0.15 0.20 0.25 Volume (mL) Ab so rb ân cia (2 10 n m )
Figura 9: Perfil de eluição da fração F-0,7A após cromatografia de troca-iônica DEAE-Sephacel
(A). A coluna foi eluída com gradiente de sal representado no gráfico pela linha pontilhada. A linha contínua representa os valores de absorbância para a quantidade de urônico presente em cada tubo coletado; (B) Purificação da SF-1.0M, após DEAE-Sephacel, em Sephadex-G25; (C) Comportamento eletroforético no sistema de tampão Ba/PDA da SF-1.0M. Cerca de 10-30g de cada amostra foram submetidos à eletroforese em gel de agarose no tampão descontínuo Ba/PDA. Os processos de fixação e coloração foram os mesmos já descritos anteriormente. (OR) origem; (P) padrão; (R) componente de migração rápida da heparina; (L) componente de migração lenta da heparina; (Hep) heparina padrão; (SF-1.0M) sub-fração de GAGs obtidos após cromatografia de troca-iônica da fração 0,7A.
A
B C
NaCl SF-1.0M
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica Com o intuito de elucidar a real natureza das moléculas presentes na SF-1.0M as etapas seguintes deste trabalho tem por objetivo estabelecer sua composição estrutural por meio dos métodos de despolimerização enzimática e espectroscopia de ressonância magnética nuclear.
4.2. Análise da massa molecular e composição dissacarídica
A caracterização eletroforética da SF-1.0M revelou a presença de uma classe de compostos com perfil de migração intermediário entre a Hep/HS e o DS, cuja massa molecular foi estimada em 26 kDa. Por esta razão, para identificar sua composição dissacarídica, esta sub-fração foi submetida à ação de diferentes liases específicas para a despolimerização tanto da heparina e heparam sulfato (heparinase e heparitinases I e II) quanto do dermatam sulfato e condroitim sulfato (condroitinases ABC e AC).
Os produtos da despolimerização enzimática da SF-1.0M foi analisada inicialmente por eletroforese em gel de agarose em tampão PDA. Surpreendentemente, apesar de sua caracterização eletroforética, os compostos presentes na sub-fração em questão foram digeridos exclusivamente pelas condroitinases ABC e AC (Figura 10) e se mostraram resistentes à ação das demais liases (dados não apresentados). Tais achados indicam a ocorrência de compostos tipo CS na SF-1.0M.
Em seguida, os produtos da despolimerização enzimática foram novamente tratados com as condroitinases até a exaustão e posteriormente analisados por
cromatografia líquida de alta pressão (HPLC – do inglês High Pressure Liquid
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica 4.3. Caracterização estrutural por ressonância magnética nuclear
Em complemento as análises prévias da despolimerização enzimática, os compostos da SF-1.0M tiveram sua caracterização estrutural elucidada por meio da
combinação de técnicas de ressonância magnética nuclear bidimensional 1H/13C
HSQC (Heteronuclear Single Quantum Coherence) e TOCSY (Total Correlation Spectroscopy) 1D seletivo, cujo resultado pode ser visto na Figura 11.
Os sinais anoméricos localizados nessa região do espectro (região anomérica) na Figura 11A são indicativos da ocorrência de compostos contendo
ligações β(1→3), característica essa apresentada pelos galactosaminoglicanos
(dermatam sulfato e condroitim sulfato). Contudo, a ausência de deslocamentos químicos em torno de 5.0-5,2 ppm, que correspondam ao ácido idurônico, descarta a possibilidade do composto em questão ser do tipo DS. Em vez disso, na região anomérica são evidenciados sinais correspondentes ao GlcA 2-O-sulfatado,
3-O-sulfatado (δ ~ 4.62/104.0 – U12S,3S) e não sulfatado (δ ~ 4.5/104.0 – U1), ligados a
resíduos de GalNAc 4-O-sulfato e/ou 6-O-sulfato (δ ~ 4.64/101.5 – A14S e A16S).
Esses achados confirmam, portanto, a presença de compostos tipo CS nas cabeças do camarão L. vannamei.
Figura 10: Perfil eletroforético dos produtos da degradação enzimática com as condroitinases
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica Em decorrência da raridade da 3-O-sulfatação dos resíduos de GlcA, o J-acoplamento dos sinais desses resíduos foram acompanhados com o intuito de se conhecer a vizinhança dentro dos sistemas de spins. Tal acompanhamento foi permitido através da combinação das técnicas de HSQC e TOCSY 1D seletivo. Para o sistema de spin do GlcA não sulfatado (Figura 11B) o sinal do próton
correspondente ao U2 (δ ~ 3.4/72.4), assim como o sinal correspondente ao U33S (δ
~ 4.4/81.0 – a) do sistema de spin do GlcA sulfatado (Figura. 11A) foram escolhidos para serem excitados magneticamente (seta azul). Em seguida os espectros foram
Figura 11: Espectros de ressonância magnética nuclear ¹H/¹³C HSQC e TOCSY 1D do CS do
camarão. Os espectros foram obtidos a 600 MHz a partir de soluções em D2O a 70 °C, usando TSP como padrão. Os espectros de TOCSY 1D foram coletados nos tempos de misturas 20 ms (espectro de linha verde) e 100 ms (espectro de linha vermelha). A figura “A” destaca o acompanhamento dos sinais de urônico sulfatados e a figura “B” os não sulfatados. As setas azuis representam os sinais dos prótons selecionados para excitação magnética. I e II representam nesta ordem os sinais mais próximos do sinal excitado. Galactosamina (A); Ácido glucurônico (U).
A
B
Região Anomérica
2.0 I
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica coletados nos tempos de 20 e 100 ms (Figura. 11A e B, linha verde e vermelha, respectivamente).
A análise dos espectros coletados para o sistema de spins correspondentes ao GlcA não sulfatado (Figura. 11B) serviram como controle para o acompanhamento dos sinais. O resultado para a análise no tempo de 20 ms confirma que o prótons ligados aos átomos de carbono nas posições 1 e 3 (U1 e U3, respectivamente) são os que estão mais próximos ao sinal U2 excitado. Seguindo o mesmo princípio para o sistema de spins do GlcA sulfatado (Figura. 11A), também a partir de um curto tempo de 20 ms se observa que os sinais dos prótons representados pelos picos I e II (U23S e U22S, respectivamente) são os mais
próximos ao U33S excitado, nesta ordem. Dessa forma, a partir desses resultados
pode-se afirmar sobre a ocorrência de resíduos de GlcA 2,3-O-dissulfatado, GlcA 2-O- e/ou GlcA 3-2-O-sulfatado, além de GlcA não sulfatado.
4.4. Efeito do CS do camarão sobre a coagulação
O efeito do CS do camarão sobre o sistema de coagulação foi avaliado por diferentes ensaios anticoagulantes e sempre confrontado com a ação da heparina de origem suína, o agente anticoagulante mais conhecido e utilizado no mundo.
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica 4.5. Termoestabilização da antitrombina pelo CS do camarão
A capacidade do CS do camarão de estabilizar o inibidor de serino protease antitrombina III (AT-III) foi avaliado por fluorimetria de varrimento diferencial (Differential Scanning Fluorimetry). A partir desse método é possível observar como determinado ligante, ao interagir com a AT-III, pode estabilizá-la e promover um retardo de sua desnaturação conforme a temperatura se eleva. Ao ser desnaturada as porções hidrofóbicas da AT-III se expõem, facilitando a ligação do corante SYPRO Orange e emitindo fluorescência posteriormente. Como observado na Figura 13, a AT-III sozinha e incubada com o CS do camarão, atinge o grau máximo de desnaturação em um faixa de temperatura bastante semelhante. Por outro lado, a Figura 12: Atividade anticoagulante in vitro do CS do camarão (círculos abertos) e da heparina (círculos fechados). O tempo de tromboplastina parcial ativada (A) e o tempo de protrombina (TP) foram mensurados no coagulômetro. As atividades anti-Xa (C) e anti-IIa (D) foram realizados por testes cromogênicos.
A B
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica heparina de mamíferos e o pentassacarídeo (região da heparina responsável pela ligação com a AT-III) ao interagir com a AT-III são capazes de retardar um pouco mais a temperatura de desnaturação dessa serinoprotease. Dessa forma, a partir desta análise pode-se concluir que o CS do camarão não promove uma
estabilização da AT-III a ponto de retardar sua desnaturação.
4.6. Atividade antitrombótica in vivo do CS do camarão
Para avaliar o efeito antitrombótico in vivo do CS do camarão foi utilizado o modelo de trombose induzida em ratos, conforme descrito em métodos. O grupo controle, tratado apenas com solução salina, apresentou 100% de formação de trombos com massa média correspondente a 6,6 ± 0,7 mg (Figura 14). Em contraste, o tratamento com o CS do camarão e com a heparina de mamíferos
Figura 13: Efeito do CS do camarão, da heparina de mamíferos e do pentassacarídeo na
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica provocou uma redução significativa na massa dos trombos, sendo o efeito máximo
observado por ambas as drogas a 1,2 mg/kg (aproximadamente 70% de redução).
4.7. Efeito do CS do camarão sobre a síntese de HS antitrombótico pelas células endoteliais
Quando as células endoteliais da aorta de coelho cultivadas in vitro são expostas à heparina e outros agentes antitrombóticos, observa-se um aumento da síntese e liberação de cadeias de HS com propriedades antitrombóticas por estas células na corrente sanguínea (NADER et al., 1989a; 2001). Com o intuito de avaliar se o CS do camarão apresenta efeito semelhante à heparina sobre a síntese desse HS peculiar, células endoteliais da aorta de coelho foram expostas a diferentes concentrações do CS do camarão e à heparina. Os GAGs foram analisados conforme descrito em métodos.
Os resultados mostraram que na presença do CS do camarão e da heparina, as células endoteliais foram estimuladas a sintetizar novas cadeias de heparam
sulfato-[35S], incorporando nessas estruturas os sulfatos radiomarcados [35S]
Figura 14: Efeito antitrombótico do CS do camarão (círculos abertos) e da heparina (círculos
fechados) no modelo de trombose venosa induzida em ratos. Os asteriscos representam os pontos estatisticamente significantes (P < 0,01** e P < 0,001***) de acordo com o teste de ANOVA (two-way) e pós-teste de Bonferroni.
0.0 0.4 0.8 1.2
0 2 4 6
8 Heparina
CS do camarão
Rômulo dos Sanoos Cavalcanod Programa dd Pós-graduação dm Bioquímica inseridos nas culturas junto das amostras testadas. Foi observado que as cadeias de heparam sulfato-[35S] sintetizadas pelo estímulo do CS do camarão podem se
manter atracadas à membrana das células endoteliais na forma de proteoglicanos (Figura 15A), como também podem levar a liberação dessas cadeias para o meio extracelular (Figura 15B). Por outro lado, a heparina parece apenas induzir as
células endoteliais a sintetizar e liberar as cadeias de heparam sulfato-[35S] para o
meio extracelular. O estímulo para a síntese das cadeias de CS não foi observado em nenhuma situação analisada, mantendo-se apenas a produção basal dessas moléculas pelas células endoteliais. Dessa forma, o tratamento com o CS do camarão e a heparina parecem induzir a síntese específica das cadeias de heparam sulfato com potencial antitrombótico.
4.8. Efeito residual hemorrágico do CS do camarão
O CS do camarão teve seu potencial de sangramento avaliado, haja vista que as ocorrências hemorrágicas perfazem uma das maiores complicações clínicas do uso da heparina. Para tanto, foi utilizado o modelo de escarificação em cauda de ratos, que tem como finalidade avaliar o efeito residual hemorrágico causado pelo desequilíbrio na hemostasia no local da injúria. Quando comparado à ação da heparina, foi evidenciado que o CS do camarão apresentou um potencial de
Figura. 15: Indução da síntese de heparam sulfato antitrombótico pelas células endoteliais após
o tratamento com CS do camarão e heparina. As cadeias de heparam sulfato sintetizadas foram atracadas a membrana celular (A) e/ou liberadas no meio extracelular (B). As barras pretas e brancas representam as cadeias de heparam sulfato e condroitim sulfato sintetizadas, respectivamente. Os asteriscos indicam os pontos estatisticamente significantes (P < 0,01** e P < 0,001***) de acordo com o teste de ANOVA (two-way) e pós-teste de Bonferroni.