MINISTÉRIO DA EDUCAÇÃO
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS DA SAÚDE
EOSINÓFILOS SANGUÍNEOS E FECAIS EM CRIANÇAS INFECTADAS POR HELMINTOS E PROTOZOÁRIOS
VANESSA MARQUES DE ARAÚJO SILVA
VANESSA MARQUES DE ARAÚJO SILVA
EOSINÓFILOS SANGUÍNEOS E FECAIS EM CRIANÇAS INFECTADAS POR HELMINTOS E PROTOZOÁRIOS
Orientador: Prof. Dra. Valéria Soraya de Farias Sales
NATAL/RN 2012
Dissertação apresentada ao Programa de Pós-Graduação em Ciência da Saúde da Universidade Federal do Rio
Grande do Norte como
requisito para a obtenção do título de Mestre em Ciências da Saúde.
CATALOGAÇÃO NA FONTE
W245e
Wanderley, Vanessa Marques de Araújo Silva.
Eosinófilos sanguíneos e fecais em crianças infectadas por helmintos e protozoários / Vanessa Marques de Araújo Silva Wanderley. – Natal, 2012.
56 f.: il.
Orientadora: Profª. Drª. Valéria Soraya de Farias Sales.
Dissertação (Mestrado) – Programa de Pós-Graduação em Ciências da Saúde. Centro de Ciências da Saúde. Universidade Federal do Rio Grande do Norte.
– –
– – –
VANESSA MARQUES DE ARAÚJO SILVA WANDERLEY
EOSINÓFILOS SANGUÍNEOS E FECAIS EM CRIANÇAS INFECTADAS POR HELMINTOS E PROTOZOÁRIOS
Aprovada em: ____/_____/____
Banca examinadora:
Presidente da Banca: Profa. Dra. Valéria Soraya de Farias Sales – UFRN
Membros da Banca: Profa. Dra. Valéria Soraya de Farias Sales - UFRN
Profa. Dra. Amália Cíntia Menezes do Rêgo - UFPB
Profa. Dra. Cecília Maria de Carvalho X. Holanda - UFRN
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS DA SAÚDE
Coordenadora do Programa de Pós-Graduação em Ciências da Saúde: Profa. Dra. Ivonete Batista de Araújo
DEDICATÓRIA
Dedico este trabalho a...
DEUS, por ter alcançado mais esta etapa em minha vida, ter me cedido força e
sabedoria, compreensão e paciência para enfrentar todos os empecilhos
encontrados no caminho.
Meus pais, Edna Marques e Edvaldo Cabral, pela força constante, união e
amor sempre presentes em nossa linda família.
Meu pai, com seu velho ditado que estudar é o melhor caminho a seguir.
“Conhecimento jamais será perdido”. Obrigado pelo apoio sempre, sempre.
Minha Mãe, que conseguiu influenciar a todos nós, filhos, a pesquisar e buscar.
Obrigado por suas orientações, discussões, debates e conhecimentos
brilhantes.
Meu irmão, muito forte em suas teorias, estava sempre presente em cada
passo dado, me orientando com seus pensamentos primorosos.
Meu esposo, Bruno Wanderley, pela paciência e força em todos os momentos.
Sempre ao meu lado, caminhando juntos e com muita fé.
AGRADECIMENTOS
Aos pacientes e seus responsáveis, pela disponibilidade e interesse.
Agradeço pelos ensinamentos, por ora, demonstrados e aprendidos. Pela
perseverança da luta pela vida, pelo carinho e compreensão.
A professora, quase doutora e minha mãe Edna Marques de Araújo
Silva, pelos constantes ensinamentos, que com muita sabedoria,
discernimento, bom senso e dedicação esteve ao meu lado me encorajando
nas horas difíceis e me aplaudindo nos momentos de glória.
À Profa. Dra. Valeria Soraya de Farias Sales, orientadora desta dissertação, por todo empenho, sabedoria, compreensão, e acima de tudo,
tranquilidade e orientação.
A Profa. Dra. Tereza Neuma de Souza Brito, primeiramente pela amizade, nos momentos mais desestimulantes ela estava presente dando forças e sendo
otimista. Pela grande ajuda fornecida em todas as etapas do estudo, sempre
me orientando e buscando soluções para o trabalho, cuidando desse como se
fosse seu.
A Profa. Dra. Ana Cláudia Galvão Freire Gouveia, pela amizade, companheirismo e ensinamentos ao longo da minha vida acadêmica.
A ex-aluna e agora farmacêutica Fernanda Bezerra Paes Leitão, sempre
disposta em ajudar, me acompanhou em todas as coletas, acordando de
madrugada e muito disposta. Agradeço pela delicadeza e cuidado com cada
criança.
A técnica Maria Daluz da Silva Filho, agradeço imensamente pela
participação constante, pela disponibilidade e interesse demonstrados, pelos
cuidados com cada amostra coletada, pela organização, zelo e competência
indiscutível.
A farmacêutica-bioquímica Luanda Canário, pela amizade e
disponibilidade nunca negada em todas as etapas do estudo, nas participações
das discussões e sugestões, pela competência e paciência incompatível.
A técnica Maria Lúcia J. de Lima pela disponibilidade constante, por
sempre estar presente e nunca se negar a nos acompanhar nas coletas, por
nos ajudar toda vez que a solicitamos e pelo cuidado com cada paciente.
A bioquímica Gioconda Dias R. Leão, pela grande ajuda na realização
dos hemogramas e pelo interesse no sucesso do trabalho.
A Sarah Medeiros, Aleida e Karina, companheiras de laboratório e de
descontração, que dividiram comigo todos os sucessos e angústias no decorrer
da pesquisa.
Ao Programa de Pós-graduação em Ciências da Saúde pela oportunidade
de realizar esse trabalho e pelos conhecimentos adquiridos durante todo este
período.
E, finalmente, a todos aqueles que direta ou indiretamente contribuíram
para a conquista de mais um etapa da minha vida.
RESUMO
Em infecções parasitárias helmínticas a eosinofilia é um dos fatores essenciais
à resistência do hospedeiro, entretanto, infecções com protozoários raramente
resultam em eosinofilia periférica. O objetivo deste estudo foi identificar
infecções por enteroparasitas em crianças e associá-las com eosinófilos
sanguíneos e fecais. Os exames parasitológicos efetuados pelo método de
Blagg, a pesquisa de eosinófilos pelo tricômio e coloração por Leishman foram
realizados em 346 crianças. Amostras positivas para parasitas representaram
80,1% e negativas 19,9%. A eosinofilia absoluta periférica foi encontrada em
55,9% das crianças, sendo 82,7% representado por crianças parasitadas e
destacando que 54,9% dos infectados por protozoários apresentaram
eosinófilos acima de 500células/mm3. Das 62 crianças com amostras fecais positivas para eosinófilos, 77,4% eram parasitadas por helmintos e/ou
protozoários. A presença dos cristais de Charcot-Leyden nas fezes foi positiva
em 39,1% das amostras, se mostrando estatisticamente significante nas
crianças parasitadas com helmintos (p=0,022). As crianças são residentes em
áreas endêmicas de parasitoses intestinais e como pôde ser observado a maior
parte das crianças que apresentaram eosinofilia e eosinófilos nas fezes eram
parasitadas por helmintos e/ou protozoários.
Palavras-chaves: infecção parasitária intestinal, crianças, sangue, fezes.
LISTA DE ABREVIATURAS E SIGLAS
A.lumbricoides Ascaris lumbricoides
CEP-HUOL Comitê de Ética em Pesquisa do Hospital Universitário Onofre Lopes
CLC Cristal de Charcot-Leyden
C.mesnilii Chilomastix mesnilii
ECP Proteína Catiônica Eosinofílica EDN Neurotoxina Derivada de Eosinófilo EDTA Ácido etilenodiaminotetracético EPO Proteína Peroxidase-eosinofílica
EUA Estados Unidos da América
E.coli Entamoeba coli
E.histolytica/díspar Entamoeba hystolytica/díspar
E.nana Endolimax nana
E.vermiculares Enterobius vermiculares
GM-CSF Fator estimulador de colônias de macrófagos e granulócitos
G.lamblia Giardia lamblia
H.nana Hymenolepis nana
IC Intervalos de confiança
IgA Imunoglobulina A
IgE Imunoglobulina E
IL-3 Interleucina-3
IL-4 Interleucina-4
IL-5 Interleucina-5
IL-13 Interleucina-13
I.butschlii Iodamoeba butschlii
MBP Proteína Básica Maior
NKT Células T natural killer
RP Razão de prevalência
Th2 Células T helper
T.trichiura Trichuris trichiura
UFRN Universidade Federal do Rio Grande do Norte
LISTA DE FIGURAS
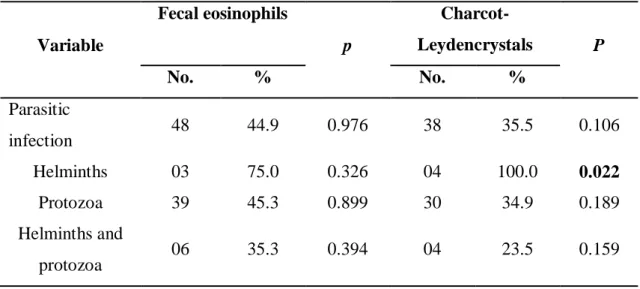
Figura 1a Eosinófilos nas fezes de pacientes infectados por parasita intestinal, observado ao microscópio óptico (1000X)
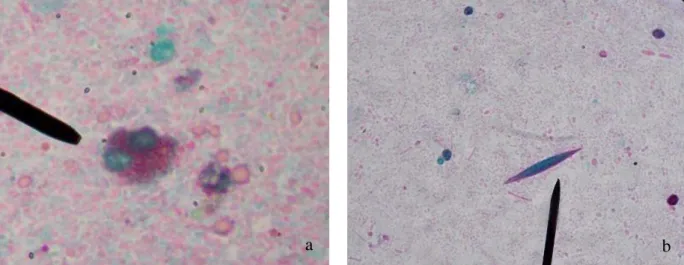
Figura 1b Cristais de Charcot-Leyden nas fezes de pacientes infectados por parasita intestinal, observado ao microscópio óptico (1000X)
LISTA DE TABELAS
Tabela 1 Frequência de infecções parasitárias em crianças de 01 a 09 anos de idade.
Tabela 2 Eosinofilia sanguínea absoluta de acordo com os grupos parasitários (helmintos e protozoários) em 227 crianças que realizaram exame hematológico.
Tabela 3 Eosinófilos e Cristais de Charcot-Leyden de acordo com os grupos parasitários (helmintos and protozoários), em 138 amostras frescas.
SUMÁRIO
DEDICATÓRIA
AGRADECIMENTOS
RESUMO
LISTA DE ABREVIATURAS E SIGLAS
LISTA DE FIGURAS
LISTA DE TABELAS
1 INTRODUÇÃO... 14
2 JUSTIFICATIVA... 17
3 OBJETIVOS... 18
3.1 Objetivo geral... 18
3.2 Objetivos específicos... 18
4 MÉTODO... 19
4.1 População de estudo... 19
4.2 Considerações éticas... 19
4.3 Coleta das amostras fecais e análise dos parasitas intestinais... 19
4.4 Coleta sanguínea... 20
4.5 Entrega de resultados... 21
4.6 Análise estatística... 21
5 ARTIGO PRODUZIDO... 22
6 COMENTÁRIOS, CRÍTICAS E SUGESTÕES... 46
7 REFERÊNCIAS... 52
8 APÊNDICE... 55
9 ANEXO... 56
1. INTRODUÇÃO
As infecções parasitárias intestinais são amplamente distribuídas no
mundo (1), sendo considerada doenças endêmicas, principalmente em países
com clima tropical e subtropical (2), que possuem áreas relativamente úmidas
(1). Água não potável, sistemas de esgoto nem sempre disponíveis (3),
precária higiene pessoal e comunitária, mal-nutrição e baixa renda
socio-econômica (1), são alguns dos fatores que permitem a transmissão ininterrupta
de muitos parasitas (3), sobretudo entre crianças em idade escolar (4),
resultando em atraso no desenvolvimento físico, baixa capacidade de
aprendizagem (2) e reduzido desenvolvimento cognitivo na infância (5).
A resistência do hospedeiro contra microorganismos,
incluindoprotozoários e helmintos, depende da evolução do sistema
imunológico (6-7) e resulta em uma resposta imune principalmente mediada
por células T helper (Th2) (8). A iniciação e manutenção deste tipo de resposta
é mediadapor mastócitos, basófilos, eosinófilos, alternativamente macrófagos
ativados, células T natural killer (NKT), células epiteliais e células T gama delta
(9). A eosinofilia é considerada um dos fatores essenciais para a defesa do
organismo, juntamente com o aumento do nível de imunoglobulina E (IgE) e
mastócitos, para a infecção parasitária helmíntica (10). Infecções com
protozoários raramente resultam em eosinofilia periférica (11).
Eosinófilos são células granulocíticas multifuncionais (12),
tradicionalmente reconhecidas como importantes mediadores na resposta
imune (13). Em resposta a citocinas eosinofilopoiéticas (interleucina-3 [IL-3],
15
interleucina-5 [IL-5]) (12), estas células deslocam-se para a circulação periférica (11), onde são encontrados em baixos valores, apenas2-5%
dosglóbulos brancos (10). Durante os processos alérgicos e as infecções
helmínticas os eosinófilos são rapidamente recrutados (14) para as superfícies
epiteliais (baço, linfonodos, trato digestivo, timo, glândulas mamárias e útero)
por meio de selectinas específicas, moléculas de adesão, quimiocinas
(eotaxina) e citocinas (IL-5) (12), liberam seus grânulos primários, principal sítio
de produção da proteína cristal de Charcot-Leyden (15), e secundários,
constituídos pelas proteínas catiônicas peroxidase-eosinofílica (EPO), proteína
básica maior (MBP) e as com atividade de ribonucleases, proteína catiônica
eosinofílica (ECP) e neurotoxina derivada de eosinófilo (EDN) (16),
respondendo rapidamente aos antígenos (14). A interleucina-5 e a eotaxina,
uma quimiocina atraente específica para os eosinófilos, em condições normais
são de grande importância para a manutenção destas células na corrente
sanguínea, como para o tráfego e a acumulação dos eosinófilos no trato
gastrointestinal (16).
Os eosinófilos são produzidos na medula óssea,transportados parao
sangue, edaí migram para os tecidos, se infiltram namucosaintestinal, podendo
atingir o lúmenintestinale serem eliminadosnas fezes (17). A presença dos
cristais de Charcot-Leyden pode refletir a ação dessas células na defesa contra
esses parasitas invasores (17-18), principalmente os helmintos. A
degranulação dos eosinófilos é frequentemente observada próximo a parasitas
danificados in vivo (15).
Diversas funcões são exercidas pelos grânulos primários e secundários
(CLC; agora identificado como galactina-10) parece estar envolvida nas
interações entre eosinófilos e os abundantes resíduos de carbono que os
parasitas carreiam em suas superfícies (15). Além dos cristais os eosinófilos
também liberam as proteínas dos grânulos secundários que podemdanificar
diretamente os tecidosou os parasitas (14-16).
O papel dos eosinófilos nas infecções parasitárias intestinais causadas
por helmintos e protozoários é um assunto bastante discutido entre os
pesquisadores que atribuem sua elevação no sangue periférico e também nas
fezes, como reflexo da sua presença na mucosa intestinal. Assim, esse estudo
se propõe a investigar qual a associação existente entre os parasitas
intestinais, eosinofilia sanguinea e a presença de eosinófilos e cristais de
17 2. JUSTIFICATIVA
Hoje muitas pesquisas são realizadas na área da Parasitologia
associada à Imunologia na busca da descoberta da reação do sistema imune
do hospedeiro frente à ação dos parasitas no organismo humano. Dentre
tantas buscas, diversas controvérsias também são encontradas. Portanto, os
diversos questionamentos sobre o papel dos eosinofilos têm levado
pesquisadores a investigar a participação dos eosinófilos na defesa contra
helmintos e protozoários, através da presença destas na circulação sanguínea
3. OBJETIVOS
3.1 – Objetivo geral
Identificar a associação entre os parasitas intestinais (helmintos e
protozoários), eosinofilia sanguínea e presença de eosinófilos nas fezes em
crianças de áreas endêmicas.
3.2 – Objetivos específicos
Identificar a prevalência de infecções parasitárias (helmintos e
protozoários) em crianças na faixa etária de 1 a 9 anos, de ambos os sexos,
estudantes de creches e escolas públicas localizadas em áreas com baixas
condições econômicas da zona oeste e sul da cidade de Natal;
Determinar o número de eosinófilos no sangue periférico e a presença
de eosinófilos e cristais de Charcot-Leyden nas fezes;
Verificar a associação entre as crianças parasitadas por helmintos e
protozoários e o número de eosinófilos no sangue periférico;
Constatar a associação das infecções helmínticas e protozoárias e a
presença de eosinófilos nas fezes;
Observar a associação do tipo de infecção parasitária (helmíntica e
protozoária) e a presença de Cristais de Charcot-Leyden;
Associar o número de crianças parasitadas por helmintos ou
protozoários ou os dois simultaneamente, com eosinofilia sanguínea, presença
19 4. MÉTODO
4.1.População de estudo
A população de estudo compreendeu, aleatoriamente, 346 crianças de
ambos os sexos, com idade variando entre 01 e 09 anos (média = 4,6), no
período de novembro de 2009 a novembro de 2010, frequentadoras de
Creches e Escolas públicas, com período integral e meio período
respectivamente, localizadas em áreas com baixas condições econômicas da
zona oeste e sul da cidade de Natal/RN.
4.2.Considerações éticas
O presente projeto foi submetido à apreciação pelo Comitê de Ética em
Pesquisa do Hospital Universitário Onofre Lopes UFRN, protocolo de número
378/09-CEP-HUOL, sendo este aprovado pelo referido Comitê (APÊNDICE 1).
Para a obtenção da aprovação e apoio de todas as instituições
participantes deste estudo, foi realizada uma reunião com a direção das
creches integrantes, e um ofício de anuência foi encaminhado a Prefeitura
Municipal de Natal para autorização da execução do projeto. Aceita as
solicitações, uma reunião com pais e/ou responsável legal pelas crianças foi
efetuada para explicação do objetivo do projeto e de todos os procedimentos a
serem realizados no decorrer do estudo. A participação das crianças na
referente pesquisa ocorreu após assinatura do “Termo de Consentimento Livre
e Esclarecido”, pelos pais e/ou responsável, segundo a resolução 196/96 de
4.3. Coleta das amostras fecais e análise dos parasitas intestinais
Coletores universais com solução conservadora (formaldeído 10%)
foram distribuídos aos pais e/ou responsáveis, e após a coleta das três
amostras seriadas realizada diretamente por eles, estes foram recolhidos para
posterior preparação e observação da presença de enteroparasitas por técnica
de concentração (19). Para realização da pesquisa de eosinófilos nas fezes,
uma amostra fecal fresca foi coletada em um coletor universal fornecido aos
pais e/ou responsáveis, e dentro de 24 horas ou 30 minutos após a coleta,
estas amostras foram recolhidas para coloração com o tricômio (18), onde duas
lâminas de cada amostra foram preparadas para leitura posterior, por 3
observadores diferentes, ao microscópio no aumento de 1000X.A presença de
pelo menos um eosinófilo na amostra foi considerado resultado positivo para o
teste. Os cristais de Charcot-Leyden encontrados nas amostras seguiu o
mesmo padrão de positividade dos eosinófilos nas fezes. Todas as análises
parasitológicas foram realizadas no Laboratório de Parasitologia Clínica,
Departamento de Análises Clínicas e Toxicológicas, UFRN.
4.4. Coleta sanguínea
As amostras foram coletadas em tubos contendo anticoagulante EDTA
no turno da manhã, estando às crianças em jejum de 8 horas e sem estar em
uso de medicamento durante o período da pesquisa, e processadas para
realização do hemograma em analisador hematológico automatizado (ABX
Micros 60), no Laboratório Integrado de Análises Clínicas da Universidade
21
O número relativo de eosinófilos no sangue periférico foi determinado
utilizando-se esfregaço sanguíneo, corado pelo Leishmann, após contagem de
100 leucócitos em microscópio óptico.
4.5. Entrega de resultados
Todos os resultados dos parâmetros parasitológicos e hematológicos
foram entregues aos pais e/ou responsável legal ao fim do estudo em uma
reunião final para esclarecimentos sobre higiene e parasitoses intestinais,
assim como a medicação devidamente prescrita por médico responsável foi
entregue a cada pai e/ou responsável. A orientação para o uso dos
medicamentos foi realizada individualmente a cada responsável.
4.6. Análise estatística
As análises estatísticas dos resultados foram realizadas pelo SPSS v.17
para Windows (SPSS, Chicago, IL, EUA). As associações foram desenvolvidas
através da razão de prevalência (RP), intervalos de confiança (IC) e teste
Qui-quadrado e/ou exato de Fisher. P-valores inferiores a 0,05 foram considerados
5. ARTIGO PRODUZIDO
5.1. O artigo “FECAL AND BLOOD EOSINOPHILS IN CHILDREN INFECTED
WITH HELMINTHS AND PROTOZOA” será submetido para publicação na
revista INTERNATIONAL JOURNAL OF PARASITOLOGY que possui fator de
impacto 3,637 e um qualis “A2” da CAPES para Medicina II. O referido artigo
23 FECAL AND BLOOD EOSINOPHILS IN CHILDREN INFECTED WITH
1
HELMINTHS AND PROTOZOA 2
SILVA, VANESSA M. A.; SOUZA, LUANDA B. F. C.; SILVA, EDNA M. A.; 3
SALES, VALÉRIA S. F. 4
Departamento de Análises Clínicas e Toxicológicas, Universidade Federal do Rio 5
Grande do Norte, Rua Cordeiro de Farias, s/n, Petrópolis, Faculdade de Farmácia, 6
Natal, RN, Brazil. 7
Corresponding author: Valéria Soraya de Farias Sales, Laboratório de Imunologia 8
Clínica, Departamento de Análises Clínicas e Toxicológicas, Universidade Federal do 9
Rio Grande do Norte, Rua Cordeiro de Farias, s/n, Petrópolis, Faculdade de Farmácia, 10
Natal, RN, Brazil. 11
ABSTRACT 25
26
The host resistance to intestinal parasitic infections is due to eosinophilia, considered 27
one of the important factors for parasitic helminth infection. Protozoan infections 28
seldom result in peripheral eosinophilia. The aim of this study was to identify 29
enteroparasitic infections in children and associate them to blood and fecal eosinophils. 30
Parasitological examinations, carried out using the formaldehyde-ether method, 31
eosinophil identification by trichrome and Leishman’s stains, were performed in 346 32
children. Samples positive and negative for parasites were 80.1% and 19.9%, 33
respectively. Relative peripheral eosinophilia was found in 65.8% of children with 34
parasites and 65.5% of those infected by protozoa exhibited eosinophils above 5%. The 35
number of samples with eosinophil in faeces was 44.9%, and of these 77.4% werefrom 36
children with parasitic infection and 22.6% from non-infected individuals. Charcot-37
Leyden crystals were observed in 39.1% of individuals, 70.4% from infected children 38
and 29.6% from those with no parasites, showing statistical significance in children 39
with parasitic helminthes (p=0.022). A total of 31.4% exhibited both blood eosinophilia 40
and eosinophils in feces. However, these children reside in areas endemic for intestinal 41
parasitoses and most who exhibited eosinophilia and eosinophils in feces had helminth 42
and/or protozoan parasites. 43 44 45 46 KEYWORDS 47
Eosinophils; Intestinal Parasites Infection; Children; Blood; Faeces 48
25 1. INTRODUCTION
50 51
Intestinal parasite infections, which are distributed worldwide (Bdir, Adwan, 2010), 52
are considered endemic diseases, especially in tropical and semitropical countries (Al-53
Mohammed et al. 2010). Non-potable water, lack of sewage systems (Supali et al. 54
2010), precarious personal and community hygiene, malnutrition and low 55
socioeconomic status (Bdir, Adwan, 2010), are some of the factors promoting 56
uninterrupted transmission of many parasites (Supali et al. 2010), primarily in school 57
age children (Nematian et al. 2004). This led to delayed physical development, 58
compromised learning capacity (Al-Mohammed et al. 2010) and reduced cognitive 59
development in childhood (Harhay et al. 2011). 60
Host resistance against microorganisms, including protozoa and helminths, 61
depends on the evolution of the immunological system (Allen, Maizels, 2011; Cotton et 62
al. 2011), resulting in an immune response, primarily mediated by T-helper cells (Th2) 63
(Peterson et al. 2010). Initiation and maintenance of this type of response is mediated 64
by mastocytes, basophils, eosinophils, alternatively-activated macrophages, natural 65
killer T-cells (NKT), epithelial cells and gamma-delta T-cells (Cho et al. 2011). Along 66
with increased immunoglobulin E (IgE) and mastocyte levels, eosinophilia is considered 67
one of the essential factors for organism defense, against parasitic helminth infection 68
(Cadman, Lawrence, 2010). Protozoan infections rarely result in peripheral eosinophilia 69
(Nutman, 2007). 70
Eosinophilia are multifunctional granulocytic cells (Roufosse, Weller, 2010), 71
traditionally recognized as important mediators in immune response (Silva et al. 2007). 72
As a response to eosinophilopoietic cytokines (interleukin-3 [IL-3], macrophage and 73
2010), these cells begin to circulate peripherally (Nutman, 2007) at low values, only 2-75
5% of white cells (Cadman, Lawrence, 2010), and migrate to the tissues (Roufosse, 76
Weller, 2010 77
Eosinophils are rapidly recruited during allergic processes and infections, 78
particularly helminth (Shamri et al. 2011) by means of specific selectins, adhesion 79
molecules, chemokines (eotaxin) and cytokines (IL-5) (Roufosse and Weller, 2010), 80
releasing their primary granules, the main Charcot-Leyden crystal protein production 81
site (Shin et al. 2009), and secondary granules, consisting of eosinophil-peroxidase 82
proteins (EPO), major basic proteins (MBP) and those with ribonuclease activity, 83
eosinophilic cationic protein (ECP) and eosinophil-derived neurotoxin (EDN) (Yan and 84
Shaffer, 2009), responding rapidly to antigens (Shamriet al. 2011). Eosinophil 85
degranulation is frequently observed in vivo near damaged parasites (Shinet al. 2009). 86
The various questions rergarding the role of eosinophils in parasites have led 87
researchers to investigate these cells in peripheral blood and feces, as a result of their 88
presence in intestinal mucosa. Thus, the aim of the present study was to identify the 89
association between intestinal parasites (helminths and protozoa), blood eosinophilia 90
27 2. MATERIALS AND METHODS
100 101
2.1.Study population 102
The study population was composed of 346 children of both sexes, from November 103
2009 and November 2010, enrolled at nursing schools and public schools, for a full day 104
and half day, respectively. The institutions are located in low socioeconomic areas in 105
the west and south zones of the city of Natal. 106
107
2.2.Ethical considerations 108
The study was approved by the Research Ethics Committee of Onofre Lopes 109
University Hospital at the Federal University of Rio Grande do Norte (UFRN), under 110
protocol no. 378/09-CEP-HUOL. 111
A meeting was held with nursery school management to obtain approval and support 112
from all participating institutions and the project was authorized by the municipal 113
government of Natal. Accepted requests a meeting with parents and / or legal guardian 114
for the children was made to explain the purpose of the project and all the procedures to 115
be performed during the study. Children's participation in related research occurred after 116
signing the "Statement of Informed Consent," by parents and / or guardian, according of 117
the National Health Council resolution 196/96. 118
119
2.3.Fecal sample collection and intestinal parasite analysis 120
Parents or legal guardians were given universal collectors with preserving solution 121
(10% formaldehyde), and collected three serial samples, which were gathered for later 122
preparation and to determine the presence of enteroparasites using the Blagg technique 123
verify for fecal eosinophils, which were stained with trichrome (Petithory, Ardoin, 125
2002). Two slides of each sample were prepared for later examination under an optical 126
microscope with 1000X magnification. The presence of at least one eosinophil in the 127
sample was considered a positive result for the evaluation. The Charcot-Leyden crystals 128
found in the samples followed the same positivity pattern as fecal eosinophils. All 129
parasitological analyses were conducted at the Clinical Parasitology Laboratory, 130
Department of Clinical and Toxicological Analyses, UFRN. 131
132
2.4.Blood collection 133
Blood samples were collected in the morning in tubes containing EDTA 134
anticoagulant, with children fasting and not using any medication during the study 135
period. Samples underwent a hemogram in an automated hemotology analyzer (ABX 136
Micros 60), at the Integrated Laboratory of Clinical Analyses at the Federal University 137
of Rio Grande do Norte. The absolute number of peripheral blood eosinophils was 138
determined using blood smears stained by Leishmann after differential count of 100 139
leukocytes under a light microscope and their proportion to the number of leukocytes. 140
Was defined as a criterion for eosinophilia when blood eosinophils exceeded 500 141
cells/mm3. 142
143
2.5.Statistical analysis 144
Results were statistically analyzed with SPSS 17 (SPSS, Chicago, IL, USA) and 145
Statistica 7 software. Associations were determined using the chi-square and/or Fisher 146
exact tests. P-values of less than 0.05 were considered statistically significant. 147
29 3. RESULTS
150 151
A total of 346 children aged between 1 and 9 years (mean = 4.6 years), 54.3% 152
(n=188) males and 45.7% (n=158) females, took part in the study. Parasitological stool 153
examination was positive in 80.1% (n=277) of samples and negative in 19.9% (n=69). 154
Eleven species of intestinal parasites were detected, seven of which are considered 155
pathogenic species [Ascaris lumbricoides (A.lumbricoides), Trichuris trichiura 156
(T.trichiura), Hymenolepis nana (H.nana), Ancilostomídeo, Enterobius vermiculares 157
(E.vermiculares), Entamoebahystolytica/díspar (E.histolytica/díspar) and Giardia 158
lamblia (G.lamblia)] and four non-pathogenic [Entamoeba coli (E.coli), Endolimax 159
nana (E.nana), Iodamoeba butschlii (I.butschlii) and Chilomastix mesnilii (C.mesnilii)]. 160
Table 1 shows the frequency of each parasite group in the population. 161
The most commonly found pathogenic parasites were Giardia Lamblia (48.4%, 162
n=134) and Entamoeba histolytica/díspar (46.9%, n=130) in the group of protozoa and 163
Ascaris lumbricoides (15.2%, n=42) and Trichuris trichiura (11.6%, n=32) among 164
helminths. 165
166
3.2.Peripheral eosinophilia and intestinal parasites 167
Of the 346 children who underwent parasitological stool examination, 65.6% 168
(n=227) were submitted to blood collection. Absolute peripheral eosinophilia was found 169
in 56.1% (n=105) of samples from parasitically-infected children and eosinophils in 170
blood between 40 and 6847 cells/mm3. The average of eosinophilia among parasitized 171
corresponds to 1131.4 cells / mm3, highlighting the average of 1005.6 cells / mm3 of 172
eosinophilia in infected individuals only by protozoa. Table 2 shows the percent 173
175
3.3.Fecal eosinophils, Charcot-Leyden crystals and intestinal parasites 176
Due to the necessity of working with fresh samples removed shortly after the 177
evacuation was possible to collect 138 fecal samples. Of these, 44.9% (n = 62) exhibited 178
at least one fecal eosinophil (figure 1a), 77.4% (n = 48) of which were from 179
parasitically-infected children and 22.6% (n =14) from non-infected individuals. 180
Charcot-Leyden crystals (figure 1b) were detected in 39.1% (n=54) of the samples, 181
70.4% (n=38) and 29.6% (n = 16) from infected and non-infected children, respectively. 182
Of the 54 children who had positive crystals in stools, thirty also exhibited fecal 183
eosinophils (p=0.044). Table 3 illustrates positive cases among infected children. 184
185
3.4.Peripheral blood eosinophilia, eosinophils and Charcot-Leyden crystals in 186
stools 187
Of the population of 346 children, 105 underwent a hemogram and submitted a 188
fresh stool sample for eosinophil and Charcot-Leyden crystal determination. Of the 105 189
children studied, 58 had blood eosinophilia and 48 fecal eosinophils, 20.0% (n = 21) 190
exhibited both blood eosinophilia and eosinophils in the stool, these 85.7% (n = 18) 191
were parasitized (helminths and/or protozoa). Of the 21 with blood and fecal 192
eosinophils, eight also had Charcot-Leyden crystals, and 87.5% (n = 07) of children 193
parasitized. 194
31 4. DISCUSSION
197 198
Parasitic infections are classified as neglected tropical diseases by the World 199
Health Organization (Brandelli et al. 2011). These infections, caused by protozoa and 200
helminths, continue to be one of the major causes of gastrointestinal disorders 201
worldwide (González-Moreno et al. 2011), children being an important high-risk group 202
(Gonçalves et al. 2011). This is corroborated by the results obtained in the present 203
study, which correspond to parasite positivity in more than 80% of infected children. 204
A greater prevalence was observed for protozoan infection, more specifically 205
G.lamblia, one of the most frequently found enteroparasites in both developed and 206
developing countries (David et al. 2011).This parasite compromises child growth and 207
development; as well as learning capacity (Lopez-Velez et al. 2010). The second most 208
prevalent pathogenic parasite was the protozoan Entamoeba histolytica/dispar 209
(E.histolytica/dispar), which causes amebiasis, one of the most important parasitic 210
diseases in human beings (Feng et al. 2011). E.histolytica/dispar infects 500 million 211
people per year, causes disease in 50 million (James et al. 2010) and is responsible for 212
40,000 – 100,000 deaths every year (Peterson et al. 2010). 213
E.histolytica/dispar are actually two genetically distinct species that exhibit 214
different behavior patterns: E.histolytica (Schaudinn) is pathogenic and Entamoeba 215
dispar (Brumpt), non-invasive, supposedly non-pathogenic (Kretschmer, López-Osuna, 216
1997). The two species are morphologically indistinguishable (Feng et al. 2011). 217
G.lamblia and E.histolytica/dispar are transmitted primarily by food and water 218
contaminated with feces and prevalence is greater in areas with inadequate basic 219
sanitation (James et al. 2010). These factors explain the high infection rate found in this 220
A. lumbricoides infect 1.2 billion people (Dold, Holland, 2011). Infections by 222
soil-transmitted helminths (Ascari slumbricoides, Trichuris trichiura and Ancylostoma 223
duodenale/Necator americanus) are common problems that affected our ancestors and 224
continue to be a public health problem (Tanner et al. 2011). Prevalence of these 225
helminths is much higher in tropical regions, where communities have no access to 226
basic sanitation (Trönnberg et al. 2010). 227
Gastrointestinal parasitic infections have been considered because they induce 228
Th2 responses, producing IL-4, IL-5, IL-13 and IgE, necessary for their expulsion (Mc 229
Sorley, Loukas, 2010). The toxic-allergic effects of certain parasites in the host’s 230
organism lead to an increase in the number of eosinophils (Okyay et al. 2004), 231
inflammatory cells significantly involved in allergic and parasitic diseases in vertebrates 232
(Yan and Shaffer, 2009). The association of eosinophils and dead or dying parasites has 233
been observed for more than 70 years, leading to the hypothesis that eosinophils are 234
cytotoxic to helminths and suggesting parasitic death mediated by cationic proteins 235
derived from eosinophilic granules [MBP (Main Basic Protein), ECP Eosinophilic 236
Cationic Protein), EDN (Eosinophil-Derived Neurotoxin) and EPO (Eosinophil 237
Peroxidase)] in the presence of antibodies and/or complement (Shamri et al. 2011). 238
It is known that a wide range of infectious agents, almost exclusively helminths, 239
provoke eosinophilia (Nutman, 2007). However, the association between eosinophilia 240
and intestinal parasitic infections caused by protozoa is scarcely described in the 241
scientific literature. Although not statistically significant, this studied found a higher 242
number of eosinophils in the blood of parasitically-infected children.noting that 54.9% 243
of children had eosinophils protozoa above 500 cells/mm3 and when the infection was 244
caused simultaneously by two parasitic groups the percentage of children with 245
33 determined by the development, migration and distribution of the parasite within the 247
host, as well as by the latter’s immune response against it (Nutman, 2007), since it is 248
reported that intestinal parasites found in the intestinal lumen are incapable of inducing 249
eosinophilia. However, it is pronounced when tissue invasion occurs (Melo-Reis .et al. 250
2007). 251
The mechanism by which G.lamblia invades tissues remains unknown; however, 252
studies report that the trophozoite form of this parasite can invade the intestinal mucosa 253
of humans (Fontenele et al. 2006). This mechanism can cause an inflammatory process 254
that induces the formation of immunoglobulins IgA and IgE, which promote 255
identification and activation of effector cells (eosinophils) (Melo-Reis et al. 2007). 256
Some authors (Sotilloset al. 1991; Arduan et al. 1990; Suzuki et al. 2010) report an 257
association between eosinophilia with infection caused by G.lamblia. Santos and Vituri 258
(1996) studied 42 children parasitically only infected withG.lamblia and observed that 259
the number of blood eosinophils ranged from 563 to 912 cells/mm3. Melo-Reis et al. 260
(2007) suggest that intestinal parasitoses provoked by G.lamblia may be associated to 261
blood eosinophilia. 262
Eosinophils, however, are found in initial invasive tissue lesions of Entamoeba 263
histolytica. Eosinophilia, a feature of verminoses, is certainly not a clinical 264
characteristic of amebiase. Non-activate human eosinophils easily succumb to the lytic 265
effect of amoeba, as do neutrophils. By contrast, activated eosinophils are quite efficient 266
in destroying parasites (Kretschmer, López-Osuna, 1997). 267
A number of studies report intestinal parasitic infections with the presence of 268
eosinophils in peripheral blood, but rarely in fecal species. This investigation showed 269
the presence of fecal eosinophils in patients infected with intestinal parasites, whether 270
the blood, from where they migrate to the tissues, infiltrating into the intestinal mucosa 272
and eliminated in feces (Petithory, Ardoin, 2006). Parasitic invasion into the intestinal 273
mucosa may have resulted in the presence of fecal eosinophils observed in the children 274
studied and the Charcot-Leyden crystals detected in most of them may be due to the 275
action of these cells in defending against parasitic invaders(Petithory, Ardoin, 2002, 276
2006), primarily helminths. Several functions are exerted by primary and secondary 277
granules during eosinophil activation (Yan and Shaffer, 2009). The primary granule is 278
the main production site of Charcot-Leyden crystal proteins (CLC; now identified as 279
galactin-10), which seem to be involved in interactions between eosinophils and the 280
abundant carbon residues that parasites carry on their surfaces (Shinet al. 2009). In 281
addition to crystals, eosinophils also release secondary granule proteins, which can 282
damage either tissues or parasites (Shinet al. 2009; Yan, Shaffer, 2009; Shamri et al. 283
2011). 284
There are numerous factors that can interfere with staining and detection of fecal 285
eosinophils, including pH, the presence of biliverdin and cell degranulation (Petithory, 286
Ardoin, 2002). Petithory and Ardoin (2002) detected eosinophils in 32 of 223 fecal 287
samples in patients presenting with intestinal parasitic infection, allergy or other 288
intestinal diseases, and in 9 of 72 samples of apparently healthy patients, whereas 289
Charcot-Leyden crystals were observed in only 9 fecal species, all of which were 290
positive for eosinophils. In 2005 these authors found fecal eosinophils in 27 of 54 291
samples of patients infected with parasites, including A.lumbricoides and T.trichiura, 292
but in none infected with protozoa, except Isospora belli and Cryptosporidium parvum. 293
Petithory and Ardoin (2006) detected fecal eosinophils in 14% of their samples, most 294
35 Other causes of eosinophilia were not excluded from this study. It is therefore, 296
assumed that the expected frequency would be around 50%, owing to the random action 297
of these other factors in each patient. However, these children live in areas endemic for 298
intestinal parasitoses and most of those presenting with eosinophilia and fecal 299
eosinophils were infected with helminths and/or protozoa. 300
Thus, eosinophilia and the presence of eosinophils and Charcot-Leyden crystals 301
in the stools of children from the endemic area highlight the importance of this cell in 302
defending against parasitoses caused by helminths and/or protozoa. 303
ACKNOWLEDGEMENTS 321
322
We would like to thank all participating municipal institutions, school principals, 323
coordinators, teachers, parents/legal guardians and students. We are also grateful to the 324
Department of Clinical and Toxicological Analyses, Professors Edna Marques de 325
Araújo Silva (PhD), Tereza Neuma de Souza Brito (PhD) and Ana Cláudia Galvão 326
Freire Gouvéia (PhD), biochemists Gioconda Dias R. Leão, Luanda B. F. Canário de 327
Souza and Fernanda B. P. Leitão, and technicians Maria Daluz da S. Filho and Maria 328
Lúcia J. de Lima for their assistance, dedication and invaluable contributions since the 329
beginning of the study. We thank Professor L. Karla Arruda (PhD) from the 330
Universidade de Medicina de Ribeirão Preto/USP, for her constant help throughout this 331
research. 332
333
334 335 336 337
338
339
340
341
342
37 REFERENCES
Allen, J. E., Maizels, R. M., 2011. Diversity and dialogue in immunity to helminthes. Nat. Rev. Immunol. 11, 375-388.
Al-Mohammed, H. I., Amin, T. T., Aboulmagd, E., Hablus, H. R. and Zaza, B. O., 2010. Prevalence of intestinal parasitic infections and its relationship with socio-demographics and hygienic habits among male primary schoolchildren in Al-Ahsa, Saudi Arabia. Asian Pac J Trop Med. 3, 906-912.
Arduan, O. A., Castillo, J. M., Carreira, J.,Cubero, L. L., Miranda,R., Casado, Y. M. J., 1990. Gastroenteritiscon eosinofilia por Giardia lamblia. Ver Clin Esp. 197,68-70.
Bdir, S. and Adwan, G., 2010. Prevalence of intestinal parasitic infections in Jenin Governorate, Palestine: a 10-year retrospective study. Asian Pac J Trop Med. 3, 745-747.
Blagg, W., Scholoegel, E. L., Mansour, N. S., Khalaf, G. L., 1955. A new
concentration technique for the demonstration of protozoa and helminth eggs in feces. Am J Trop Med Hyg . 4, 23-28.
Cadman, E. T. and Lawrence, R. A., 2010. Granulocytes: effector cells or
immunomodulators in the immune response to helminth infection?. Parasite Immunol.
32, 1–19.
Cho, M. K., Lee, C. H. and Yu, H. S., 2011. Amelioration of intestinal colitis by macrophage migration inhibitory factor isolated from intestinal parasites through Toll-like receptor 2. Parasite Immunol. 33, 265–275.
Cotton, J. A., Beatty, J. K. and Buret, A. G., 2011. Host parasite interactions and pathophysiology in Giardia infections.
Int J Parasitol
. 41, 925–933.David, E. B., Coradi, S. T., Oliveira-Sequeira, T. C. G., Ribolla, P. E. M., Katagiri, S., Guimarães, S., 2011. Diagnosis of Giardia infections by PCR-based methods in children of an endemic area. J Venom Anim Toxins. 17, 209-215.
Dold, C., Holland, C. V., 2011.Ascaris and ascariasis. Microbes Infect. 13, 632-637.
Feng, M., Yang, B., Yang, L., Fu, Y., Zhuang, Y., Liang, L., Xu, Q., Cheng, X.,
Tachibana H., 2011. High prevalence of Entamoeba infections in captive long-tailed
macaques in China. Parasitol. Res. 109, 1093-1097.
39 Gonçalves, A. L. R., Belizário, T. L., Pimentel, J. B., Penatti, M. P. A., Pedroso, R. S.,
2011. Prevalence of intestinal parasites in preschool children in the region of
Uberlândia, State of Minas Gerais, Brazil. Rev. Soc. Bras. Med. Trop. 44, 191-193.
González-Moreno, O., Domingo, L., Teixidor, J., Gracenea, M., 2011. Prevalence and associated factors of intestinal parasitisation: a cross-sectional study among outpatients with gastrointestinal symptoms in Catalonia, Spain. Parasitol. Res. 108, 87-93.
Harhay, M. O., Horton, J., Olliaro, P. L., Utzinger, J., 2011.Diagnostics are central for a truly holistic approach against intestinal parasitic diseases. Int. J. Infect. Diseases. 15, e76–e77.
James, R., Barratt, J., Marriot, D., Harkness, J., Stark, D., 2010.Soroprevalence of Entamoeba histolytica infection among men who have sex with men in Sydney,
Australia. Am. J. Trop. Med.Hyg. 83, 914-916.
Kretschmer, R., Ltpez-Osuna, M., 1997. Eosinophils, HLA and Amebic Disease.Infection. 25, 327-328.
Lopez-Velez, R., Batlle, C., Jiménez, C., Navarro, M., Norman, F. and Perez-Molina, J.,2010. Short Course Combination Therapy for Giardiasis after Nitroimidazole Failure. Am. J. Trop. Med. Hyg. 83, 171-173.
Melo-Reis, P. R., Diniz-Filho, J. A. F., Dias-Penna, K. G. B., Costa, S. H. N., Mesquita, M. M., Silva, J. B., Castro, F. S., Chen, L. C., 2007. Rev. Bras. Anal. Clin. 39, 237-239.
Nematian, J., Nematian, E., Gholamrezanezhad, A., Asgari, A. A., 2004. Prevalence of intestinal parasitic infections and their relation with socio-economic factors and
hygienic habits in Tehran primary school students. Acta Trop. 92, 179–186.
Nutman, T. B., 2007. Evaluation and differential diagnosis of marked, persistent eosinophilia. Immunol. allergy Clin. 27, 529–549.
Okyay, P., Ertug, S., Gultekin, B., Onen, O., Beser, E., 2004. Intestinal parasites prevalence and related factors in school children, a western city sample-Turkey. BMC Public Health. 4: 1-6.
Peterson, K. M., Shu, J., Duggal, P., Haque R., Mondal, D. and Petri Jr, W. A.,2010. Association between TNF-α and Entamoeba histolytica Diarrhea. Am. J. Trop. Med. Hyg. 82, 620–625.
Petithory, J. C., Ardoin, F. G., 2002. The demonstration, staining and prevalences, in pathological and non-pathological specimens of eosinophils in faeces. Ann Trop Med Parasito. 96, 523-528.
41 Petithory, J. C., Ardoin, F. G., 2006 . L’éosinophilie fécale: Méthode de recherché et intérêt diagnostique dans les parasitoses et l’allergie intestinale. Revue Francophone des Laboratoires. 385, 79-83.
Roufosse, F., Weller, P. F., 2010. Practical approach to the patient with hypereosinophilia. J. Allergy Clin. Immunol.126, 39-44.
Santos, J. I., Vituri, C. L., 1996. Some hematimetric findings in human Giardia lamblia infection. Rev. Inst. Med. Trop. São Paulo. 38, 91-95.
Shamri, R., Xenakis, J. J., Spencer, L. A., 2011. Eosinophils in innate immunity: an
evolving story. Cell Tissue Res. 343, 57-83.
Shin, M. H., Lee, Y. A., Min, Duk-Young., 2009.Eosinophil-Mediated Tissue Inflammatory Responses in Helminth Infection. Korean J. Parasitol. 47, S125-S131.
Silva, A. C., Levy, L., Trindade, J. C., Mendonça, P., Silva, C., Lopes, A. I., 2007. Faecal and serum levels of eosinophil cationic protein in a healthy paediatric population. Scand. J. Clin. Lab. Inv. 67, 757–766.
Sotillos, E. A., Ganuza, R. F. J., Navarrete, H. C., 1991. Eosinofilia y parasitación intestinal por Giárdia lamblia. Rev. Clín. Esp. 189, 296.
Suzuki, Y., Nakamura, T., Tokoro, M., Togano, T., Ohsaka, M., Kohri, M., Hirata, Y., Miyazaki, K., Danbara, M., Horie, R., Miura, I., Sunakawa, K., Higashihara, M., 2010. A case of giardiasis expressing severe systemic symptoms and marked
hypereosinophilia. Parasitol. Inter. 59, 487–489.
Tanner, S., Chuquimia-Choque, M. E.,Huanca, T., McDade, T. W., Leonard, W. R., Reyes-García, V., 2011. The effects of local medicinal knowledge and hygiene on helminth infections in an Amazonian society. Soc. Sci. Med. 72, 701-709.
Trönnberg, L., Hawksworth, D., Hansen, A., Archer, C., Stenström, T. A., 2010. Household-based prevalence of helminths and parasitic protozoa in rural KwaZulu-Natal, South Africa, assessed from faecal vault sampling. T Roy. Soc. Trop. Med. H. 104, 646–652.
43 LIST OF TABLES
Variable No. %
Parasitic infections 277 80.1
Helminths 08 2.9
Protozoa 211 76.2
Helminths and protozoa 58 20.9
Non-infected 69 19.9
Variable
Eosinophils ≤ 500 céls/mm3
Eosinophils>500
céls/mm3 P
No. % No. %
Parasitic infection 82 43,9 105 56,1 0,894
Helminths 05 71,4 02 28,6 0,134
Protozoa 64 45,1 78 54,9 0,550
Helminths and
protozoa 13 34,2 25 65,8 0,180
Table 1.Frequency of parasitic infections in children aged 1 to 9 years.
Variable
Fecal eosinophils
p
Charcot-Leydencrystals P
No. % No. %
Parasitic
infection 48 44.9 0.976 38 35.5 0.106
Helminths 03 75.0 0.326 04 100.0 0.022
Protozoa 39 45.3 0.899 30 34.9 0.189
Helminths and
protozoa 06 35.3 0.394 04 23.5 0.159
45 LIST OF FIGURES
a
Figure 1. a) Eosinophil b) Charcot-Leyden crystal, both found in stools of patients infected with intestinal parasites, as observed under optical microscope (1000X).
6. COMENTÁRIOS, CRÍTICAS E SUGESTÕES
As principais etapas propostas pelo anteprojeto “Eosinófilos e Anticorpos
IgE em crianças com enteroparasitas” foram cumpridas: pesquisa da infecção
parasitária através da coleta da amostra fecal conservada, o hemograma para
detecção do número de eosinófilos no sangue e a pesquisa de eosinófilos nas
fezes, consequentemente de cristais de Charcot-Leyden. Todos os métodos
para realização das etapas cumpridas já eram conhecidos, com exceção da
pesquisa de eosinófilos nas fezes, onde previamente realizamos um piloto para
detecção do grau de dificuldade da coleta e realização, já que se tratava de
fezes frescas coletadas logo após a evacuação. Porém, o trabalho encontrou
problemas para execução das demais etapas, devido a ausência de recursos
financeiros e dependência do comparecimento da criança, acompanhado por
seu devido pai e/ou responsável ao ambulatório de pediatria do Hosped para
execução do teste alérgico de hipersensibilidade imediata. Tentativas foram
feitas com ajuda financeira fornecida aos pais e/ou responsáveis para
locomoção até o local, porém sem sucesso, pois esses utilizavam a ajuda para
outros fins. Devido a essas dificuldades encontradas no decorrer da execução
do projeto, o estudo passou a ser intitulado “Eosinófilos sanguíneos e fecais em
crianças infectadas por helmintos e protozoários” e alguns prazos foram
minimamente ultrapassados.
O método para realização do parasitológico de fezes empregado no
estudo, Método de Blagg, foi de suma importância uma vez que permitiu
visualizar com maior abrangência a detecção dos enteroparasitas, no entanto,
47
poderia ter evidenciado com maior precisão a presença de Enterobius
vermiculares nas crianças.
Para que iniciássemos o estudo efetivamente, a anuência foi solicitada a
Secretaria Municipal de Saúde de Natal e reuniões com as creches e escolas
públicas de Natal, participantes da população de estudo, foram realizadas para
esclarecimentos sobre o trabalho. Reuniões com os pais e/ou responsáveis
também foram efetuadas para explicação sobre a proposta do trabalho, o
propósito da pesquisa e o procedimento de cada etapa, esclarecimento sobre o
termo de consentimento livre e esclarecido e o comprometimento necessário
para participação no estudo, entre outras questões.
Todos os resultados dos exames fecais e hematológicos foram
entregues aos pais e/ou responsável legal ao fim do estudo em uma reunião
final para esclarecimentos sobre higiene e parasitoses intestinais, assim como
a medicação devidamente prescrita por médico responsável foi entregue a
cada pai e/ou responsável. A orientação para o uso dos mesmos foi realizada
individualmente a cada responsável.
As dificuldades encontradas nas diversas áreas da nossa pesquisa,
como na parasitologia, imunologia, hematologia e educação sanitária, no
decorrer do desenvolvimento do trabalho serviram para obter maior
conhecimento e aprendizagem, pois experiências novas foram efetuadas, além
do desenvolvimento da interdisciplinaridade. As pesquisas realizadas antes e
durante o trabalho foram de suma importância, pois foi a partir delas que
conseguimos desenvolver ideias e concretizá-las.
Poucos trabalhos são encontrados na literatura sobre a pesquisa de
encontrar eosinófilos em infecções por protozoários, nos incentivou a buscar
informações sobre estas células, tão presentes na defesa contra infecção
parasitária, no sangue e fazer associação entre elas. Portanto trata-se de um
trabalho inovador, no assunto em questão, para a pesquisa científica.
Eosinofilia é causada pelo efeito da IL-5 sintetizada a partir de células
Th2. IL-5 é a citocina mais importante na transformação e desenvolvimento de
eosinófilos, e age como um "ativador de eosinófilos". Uma das causas
importantes do aumento na quantidade de eosinófilos no sangue está doenças
parasitárias. Efeitos tóxicos-alérgicos de certos parasitas no organismo do
hospedeiro levam a um aumento no número de eosinófilos, especialmente.
Eosinófilos são efetores contra alvos parasitárias (20).
Eosinofilia não é um achado incomum na prática clínica e, quando
encontradas em associação com uma constelação de sinais e sintomas, pode
servir como uma pista muito útil para o diagnóstico diferencial (12).
Algumas pesquisas encontradas na literatura onde há presença de
eosinófilos em outras doenças intestinais, além das parasitárias, detectados
por meio de biópsia, nos incentiva a realizar mais buscas e grupos de
49
- Produção gerada:
7. REFERÊNCIAS
1. Bdir S, Adwan, G. Prevalence of intestinal parasitic infections in Jenin
Governorate, Palestine: a 10-year retrospective study. Asian Pac J Trop Med.
2010;3:745-47.
2. Al-Mohammed HI, Amin TT, Aboulmagd E, Hablus HR, Zaza BO. Prevalence
of intestinal parasitic infections and its relationship with socio-demographics and
hygienic habits among male primary schoolchildren in Al-Ahsa, Saudi Arabia.
Asian Pac J Trop Med. 2010;3:906-12.
3. Supali T, Verweij JJ, Wiria AE, Djuardi Y, Hamid F, Kaisar MMM, et al.
Polyparasitism and its impact on the immune system. Int. J. Parasitol.
2010;40:1171-76.
4.Nematian J, Nematian E, Gholamrezanezhad A, Asgari AA. Prevalence of
intestinal parasitic infections and their relation with socio-economic factors and
hygienic habits in Tehran primary school students. Acta Trop. 2004;92:179-86.
5. Harhay MO, Horton J, Olliaro PL, Utzinger J. Diagnostics are central for a
truly holistic approach against intestinal parasitic diseases. Int. J. infect. Dis.
2011;15:76-7.
6. Allen JE, Maizels RM. Diversity and dialogue in immunity to helminthes. Nat.
Rev. Immunol. 2011;11:375-88.
7. Cotton JA, Beatty JK, Buret AG. Host parasite interactions and
pathophysiology in Giardia infections. Int. J. Parasitol. 2011;41:925-33.
8. Peterson KM, Shu J, Duggal P, Haque R, Mondal D, Petri Jr WA. Association
between TNF-α and Entamoeba histolytica Diarrhea. Am. J. Trop. Med. Hyg.
53
9. Cho MK, Lee CH, Yu HS. Amelioration of intestinal colitis by macrophage
migration inhibitory factor isolated from intestinal parasites through Toll-like
receptor 2. Parasite Immunol. 2011;33:265-75.
10. Cadman ET, Lawrence RA. Granulocytes: effector cells or
immunomodulators in the immune response to helminth infection? Parasite
Immunol. 2010;32:1-19.
11. Nutman TB. Evaluation and differential diagnosis of marked, persistent
eosinophilia. Immunol. Allergy Clin.North Am. 2007;27:529-49.
12. Roufosse F, Weller PF. Practical approach to the patient with
hypereosinophilia. J. AllergyClin. Immunol. 2010;126:39-44.
13. Silva AC, Levy L, Trindade JC, Mendonça P, Silva C, Lopes AI. Faecal and
serum levels of eosinophil cationic protein in a healthypaediatric population.
Scand. J. Clin. Lab. Invest. 2007;67:757-66.
14. Shamri R, Xenakis JJ, Spencer LA. Eosinophils in innate immunity: an
evolving story. Cell Tissue Res. 2011;343:57-83.
15. Shin MH, Lee YA, Min Duk-Young. Eosinophil-Mediated Tissue
Inflammatory Responses in Helminth Infection. Korean J. Parasitol.
2009;47:125-31.
16. Yan BM, Shaffer EA. Primary eosinophilic disorders of the gastrointestinal
tract. Gut. 2009;58:721-32.
17. Petithory JC, Ardoin FG. L’éosinophilie fécale: Méthode de recherché et
intérêt diagnostique dans les parasitoses et l’allergie intestinale. Revue
18. Petithory JC, Ardoin FG. The demonstration, staining and prevalences, in
pathological and non-pathological specimens of eosinophils in faeces. Ann.
Trop. Med. Parasitol. 2002; 96:523-28.
19. Blagg W, Scholoegel EL, Mansour NS, Khalaf GL. A new concentration
technique for the demonstration of protozoa and helminth eggs in feces. Am.J.
Trop. Med. Hyg. 1955;4:23-8.
20. Okyay P, Ertug S, Gultekin B, Onen O, Beser E. Intestinal parasites
prevalence and related factors in school children, a western city sample-Turkey.
9. ANEXO
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE CIÊNCIAS DA SAÚDE
DEPARTAMENTO DE ANÁLISES CLÍNICAS E TOXICOLÓGICAS TERMO DE CONSENTIMENTO LIVRE E ESCLARECIDO
Título do projeto: Eosinófilos e IgE em crianças infectadas por enteroparasitas.
Responsável pela pesquisa: Valéria Soraya de Farias Sales
O menor pelo qual o Senhor (a) é responsável está sendo convidado (a) a participar, voluntariamente, de uma pesquisa que visa identificar a resposta do organismo a parasitas. Para avaliação desta pesquisa será necessário a coleta de amostras fecais para a realização do exame parasitológico e 5mL de sangue para realização de exames hematológicos e imunológicos. O sangue será coletado na veia das crianças nas Creches ou Escolas onde elas estudam ou no posto de saúde por técnicos capacitados e as amostras de fezes serão coletadas pelo Senhor (a) na residência, em recipiente descontaminado (vaso) ou em um papel limpo sobre o chão, e em seguida, com o auxílio de uma palheta, deve ser retirado parte desse material e colocado no
e será ressarcido por despesas comprovadamente relacionadas a participação na pesquisa. A aceitação não está vinculada a nenhum tipo de remuneração e nem haverá despesas antecipadas devido à participação. O pesquisador se compromete a utilizar os dados somente para essa pesquisa, mantendo em sigilo as informações obtidas.
A pesquisa se encerra com o procedimento realizado e resultado analisado.
Estas informações estão sendo fornecidas para que seja permitida a participação voluntária do menor sob sua responsabilidade, neste estudo. Em caso de desistência ou dúvidas sobre a pesquisa, entrar em contato com a Professora Valéria Soraya de Farias Sales do Departamento de Análises Clínicas da UFRN, Av. General Gustavo Cordeiro de Farias s/n, Petrópolis, fone: 3215-4229. Lembre-se que o Senhor (a) pode retirar o consentimento de participação na pesquisa em qualquer momento, sem qualquer prejuízo. Este projeto foi avaliado pelo Comitê de Ética da Universidade Federal do Rio Grande do Norte. Em caso de frasco coletor plástico próprio, que lhe será cedido pelos pesquisadores do projeto. Todo o procedimento da coleta da amostra lhe será explicado com antecedência e a amostra de fezes deverá ser entregue na Escola ou Creche. As amostras (sangue e fezes) serão analisadas no Laboratório de Imunologia Clínica e Parasitologia Clínica, além do Laboratório Integrado de Análises Clínicas (LIAC) da UFRN, situados em Natal/RN. Se necessário será realizado um teste para avaliar alergia (teste cutâneo de hipersensibilidade imediata). O mesmo será efetuado por médico alergista no ambulatório de pediatria do Hosped ou no posto de saúde do bairro da sua residência. Será aplicado uma gota de um líquido (alérgeno) na pele do antebraço seguida de uma puntura (compressão com agulha fina). Se a criança for alérgica poderá ser observado uma pápula (carocinho) no local com até 20 minutos da aplicação. Esta pápula desaparecerá nas primeiras horas após o teste.
Os resultados dos exames serão entregues ao Senhor (a), para poder então ser avaliado pelo médico e este definir a melhor forma de tratamento.
Os riscos de participação nesta pesquisa são mínimos e não há riscos previsíveis. Porém, em caso de dano pessoal diretamente causado pelo procedimento, o participante tem direito a tratamento médico na Instituição, bem como as indenizações legalmente estabelecidas necessidade de informações adicionais relativas a esta pesquisa, o Senhor (a) pode entrar em contato pelo telefone CEP-UFRN, 3215-3135.
Eu, ______________________________________________________ fui esclarecido (a) a respeito do estudo sobre parasitas. Ficou claro qual o propósito do estudo, o procedimento a ser realizado, seus desconfortos e riscos, as garantias de confidencialidade e de esclarecimentos permanentes, portanto, concordo com a participação do meu filho (a) ou menor sob minha responsabilidade, ______________________________________________ neste estudo. Estou ciente que poderei retirar o meu consentimento a qualquer momento, sem penalidade ou prejuízo à minha pessoa ou a minha família no atendimento a este serviço. Desta forma, permito que seja realizado o exame aqui esclarecido e concordo que os dados obtidos sejam utilizados para os fins que se prestam.
Assinatura dos pais ou responsável legal:
57
Declaro que discuti as questões acima com os pais ou responsável legal do(a) paciente participante deste estudo. É minha convicção que o paciente entendeu de forma apropriada o consentimento livre e esclarecido.
Pesquisadora: ________________________________________