UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE BIOCIÊNCIAS
DEPARTAMENTO DE MORFOLOGIA
PROGRAMA DE PÓS-GRADUAÇÃO EM BIOLOGIA ESTRUTURAL E FUNCIONAL
HÉLDER HENRIQUE ALVES DE MEDEIROS
CITOARQUITETURA E IMUNOISTOQUÍMICA PARA TIROSINA-HIDROXILASE DOS NÚCLEOS DOPAMINERGICOS MESENCEFÁLICOS
DO MORCEGO (Artibeus planirostris)
HÉLDER HENRIQUE ALVES DE MEDEIROS
CITOARQUITETURA E IMUNOISTOQUÍMICA PARA TIROSINA-HIDROXILASE DOS NÚCLEOS DOPAMINERGICOS MESENCEFÁLICOS
DO MORCEGO (Artibeus planirostris)
Dissertação de Mestrado apresentada ao Programa de Pós-graduação em Biologia Estrutural e Funcional da Universidade Federal do Rio Grande do Norte
Orientador: Prof. Dr. Expedito Silva do Nascimento Junior.
Catalogação da Publicação na Fonte. UFRN / Biblioteca Setorial do Centro de Biociências
Medeiros, Hélder Henrique Alves de.
Citoarquitetura e imunoistoquímica para tirosinahidroxilase dos núcleos dopaminérgicos mesencefalicos do morcego (Artibeus
planirostris) / Hélder Henrique Alves de Medeiros. – Natal, RN, 2015.
54 f.: il.
Orientador: Prof. Dr. Expedito Silva do Nascimento Junior.
Dissertação (Mestrado) – Universidade Federal do Rio Grande do Norte. Centro de Biociências. Programa de Pós-graduação em Biologia Estrutural e Funcional.
1. Artibeus planirostris. – Dissertação. 2 Área Tegumental Ventral.– Dissertação. 3. Dopamina. – Dissertação. I. Nascimento Junior, Expedito Silva do. II. Universidade Federal do Rio Grande do Norte. III. Título.
AUTOR: Medeiros, Hélder Henrique Alves de
TÍTULO: CITOARQUITETURA E IMUNOISTOQUÍMICA PARA TIROSINA-HIDROXILASE DOS NÚCLEOS DOPAMINERGICOS MESENCEFÁLICOS DO MORCEGO (Artibeus planirostris).
Dissertação de Mestrado apresentada ao Programa de Pós-graduação em Biologia Estrutural e Funcional da Universidade Federal do Rio Grande do Norte
DATA DA DEFESA: ___/ ___/ ___
BANCA EXAMINADORA:
Professor Drº Expedito Silva do Nascimeto Junior Universidade Federal do Rio Grande do Norte
Professor Drº José Rodolfo Lopes de Paiva Cavalcanti Universidade do Estado do Rio Grande do Norte
AGRADECIMENTOS
Agradeço primeiramente a Deus por ter me abençoado e me guiado até este momento.
Agradeço aos meus avós, Maria Santos de Medeiros e Josias Alves de Medeiros (in Memorian) por todo amor e carinho que tem por mim.
Agradeço aos meus pais, Rosimar Alves de Medeiros e Agnaldo Rodrigues Cabral por todo amor e ensinamentos da vida.
Agradeço a Tatiana Mayara Mendes Cardoso por todo o amor, carinho, paciência, estimulo passado para mim durante todo esse tempo.
Agradeço ao meu professor/ orientador Expedito Jr. por todo o ensinamento, orientação e pela confiança conferida a mim quando aceitou me orientar.
Agradeço ao meu amigo e professor Eudes Euller que me incentivou e me indicou a fazer a seleção de mestrado do PGBioEF.
Aos professores do LabNeuro: Profa Miriam, Prof Judney e Prof Ruthnaldo pelas dicas e duvidas esclarecidas.
À turma do LabNeuro: Joacil, Paulão, Karen, Nayra, Wylki e Tulio pela ajuda no trabalho, duvidas esclarecidas e momentos de descontração. Em especial ao "grupo quiropteros" Melquisedec, pelo companheirismo e ensinamentos passados, Mariana, por todos os trabalhos feitos em conjunto, Nellyane, pela força para não parar, Luisa e Lara que tanto trabalharam e ajudaram neste trabalhos. A todos um forte abraço.
A Regina, pelo carinho e garantia da ordem do LabNeuro e execução dos experimentos.
Ao Departamento de Morfologia - DMOR/ UFRN e ao Programa de Pós-graduação em Biologia Estrutural e Funcional que garantiram a infraestrutura necessária para realização deste trabalho.
LISTA DE FIGURA
Figura 1. Representação esquemática do metabolismo e catabolismo da dopamina...11
Figura 2. Árvore molecular das famílias de morcegos existentes. Família do modelo experimental em destaque. (Adaptado de Jones e Teeling, 2006)...14
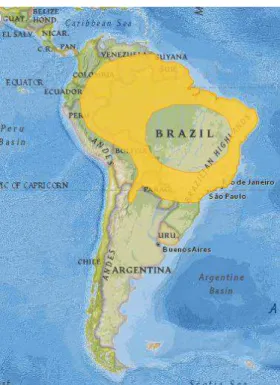
Figura 3. Distribuição geográfica do Artibeus planirostris. (Fonte: The IUCN Red List)………15
Figura 4. Artibeus planirostris (Foto: Marilia Barros)...15
Figura 5. Fotografia do encéfalo do A. planirostris. (A) Vista ventral, (B) vista dorsal e (C) vista lateral. Barra: 10mm...23
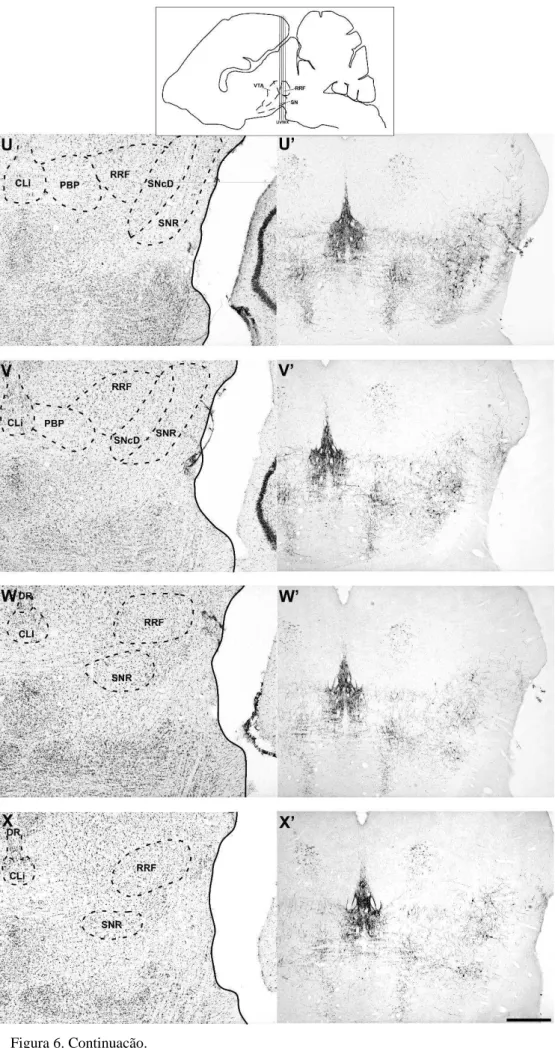
Figura 6. Fotomicrografias em campo claro e respectivos desenhos esquemáticos das secções coronais do encéfalo do A. Planirostris ao longo da extensão rostrocaudal do mesencéfalo. Na coluna da esquerda as fotos coradas com a técnica de Nissl com desenhos esquemáticos, dando uma visão geral da distribuição e aparência dos núcleos dopaminérgicos. Na coluna da direita imunoistoquimica para TH. Substância Negra compacta Dorsal (SNCD), Substância Negra compacta Medial (SNCM), Substância Negra compacta Ventral (SNCV) Substância Negra compacta Lateral (SNCL), Cauda da Substância Negra (CSN) e Substância Negra Reticulada (SNR), Núcleo Interfascicular (IF), Núcleo Linear Caudal da Rafe (CLi) e Núcleo Linear Rostral da Rafe (RLi), Núcleo Paranigral (PN), Núcleo Parainterfascicular (PIF), Área Tegmental Ventral Rostral (VTAR) e Núcleo Parabraquial Pigmentado (PBP) e Zona Retrorubral (RRF). 3V: Terceiro ventrículo; ml: Leminisco Medial. Barra: 500µm...26-33
Figura 7. Fotomicrografias em campo claro de secções coronais do encéfalo do A.
planirostris mostrando a neurônios, fibras e terminais imunorreativos a TH do
mesencéfalo. (A) Imunoistoquímica para TH; (B) Ampliação de caixa homônima em A, área correspondente a Substância Negra compacta Medial (SNCM); (C) Ampliação de caixa homônima em A, área correspondente a Substância Negra compacta Dorsal (SNCD); (D) Ampliação de caixa homônima em A, área correspondente a Substância Negra compacta Ventral (SNCV). Barra: 100µm (A) 50µm (B, C e D)...34
Figura 8. Fotomicrografias em campo claro de secções coronais do encéfalo do A.
planirostris mostrando a neurônios, fibras e terminais imunorreativos a TH do
mesencéfalo. (A) Imunoistoquímica para TH; (B) Ampliação de caixa homônima em A, área correspondente a Substância Negra compacta Lateral (SNCL); (C) Ampliação de caixa homônima em A, área correspondente a Cauda da Substância Negra (CSN). Barra: 100µm (A) 50µm (B, C)...35
Figura 9. Fotomicrografias em campo claro de secções coronais do encéfalo do A.
planirostris mostrando a neurônios, fibras e terminais imunorreativos a TH do
Pigmentado (PBP). Barra: 100µm (A) 50µm (B, C)...36
Figura 10. Fotomicrografias em campo claro de secções coronais do encéfalo do A.
planirostris mostrando a neurônios, fibras e terminais imunorreativos a TH do
mesencéfalo. (A) Imunoistoquímica para TH; (B) Ampliação de caixa homônima em A, área correspondente ao núcleo Paranigral (PN); (C) Ampliação de caixa homônima em A, área correspondente ao núcleo Interfascicular (IF); (D) Ampliação de caixa homônima em A, área correspondente ao núcleo Parainterfascicular (PIF). Barra: 100µm (A) 50µm (B, C e D)...37
Figura 11. Fotomicrografias em campo claro de secções coronais do encéfalo do A.
planirostris mostrando a neurônios, fibras e terminais imunorreativos a TH do
mesencéfalo. (A) Imunoistoquímica para TH; (B) Ampliação de caixa homônima em A, área correspondente ao núcleo Linear Rostral da rafe (RLi); (C) Ampliação de caixa homônima em A, área correspondente ao núcleo Linear Caudal da rafe (CLi). Barra: 100µm (A) 50µm (B, C)...38
Figura 12. Fotomicrografias em campo claro de secções coronais do encéfalo do A.
planirostris mostrando a neurônios, fibras e terminais imunorreativos a TH do
mesencéfalo. (A) Imunoistoquímica para TH; (B) Ampliação de caixa homônima em A, área correspondente a Zona Retrorubral (RRF). Barra: 100µm (A) 50µm (B)...39
Tabela 1. Tabela de comparação de área dos núcleos dopaminérgicos do mesencéfalo de A.planirostris...40
Tabela 2. Tabela de comparação de diâmetro dos núcleos dopaminérgicos do mesencéfalo de A.planirostris...40
LISTA DE ABREVIAÇÕES
3V Terceiro Ventrículo
CLi Núcleo Linear Caudal da Rafe
Cp Pedúnculo Cerebral
DA Dopamina
IF Núcleo Interfascicular
ml Lemnisco Medial
ns Fibras Nigroestriatais
PBP Núcleo Parabraquial Pigmentado
PIF Núcleo Parainterfascicular
PN Núcleo Paranigral
RLi Núcleo Linear Rostral da Rafe
RRF Zona Retrorubral
SNC Substância Negra pars Compacta
SNCD Substância Negra pars Compacta Dorsal
SNCL Substância Negra pars Compacta Lateral
SNCM Substância Negra pars Compacta Medial
SNCV Substância Negra pars Compacta Ventral
SNR Substância Negra Reticulada
CSN Cauda da Substância Negra
TH Tirosina Hidroxilase
VTA Área Tegmental Ventral
SUMÁRIO
Conteúdo Página
RESUMO... 9
ABSTRACT... 10
1. INTRODUÇÃO... 11
1.1.CONSIDERAÇÕES GERAIS SOBRE A DOPAMINA... 11
1.2.NÚCLEOS DOPAMINÉRGICOS... 12
1.3.SUJEITO EXPERIMENTAL... 13
2. OBJETIVOS... 17
2.1.GERAL... 17
2.2.ESPECÍFICO... 17
3. METODOLOGIA... 18
3.1.SUJEITOS... 18
3.2.PROCEDIMENTOS... 18
3.2.1. ANESTESIA... 18
3.2.2. PERFUSÃO... 18
3.2.3. REMOÇÃO DOS ENCÉFALOS... 19
3.2.4. MICROTOMIA... 19
3.2.5. MÉTODO DE NISSL... 20
3.2.6. IMUNOISTOQUÍMICA... 20
3.2.7. OBTENÇÃO DAS IMAGENS E ANÁLISE DOS RESULTADOS... 21
3.2.8. ANÁLISE ESTATÍSTICA... 22
4. RESULTADOS... 23
4.1.SUBSTÂNCIA NEGRA (SN/ A9)... 23
4.2. ÁREA TEGMENTAL VENTRAL (VTA/ A10)... 24
4.3.ZONA RETRORUBRAL (RRF/ A8)... 25
4.4. ANÁLISE MORFOMÉTRICA... 26
5. DISCUSSÃO... 41
5.1.CONSIDERAÇÕES GERAIS... 41
5.2.SUBSTÂNCIA NEGRA PARS COMPACTA... 42
5.3.ÁREA TEGMENTAL VENTRAL... 42
5.4.ZONA RETRORUBRAL... 43
5.5. MORFOMETRIA DAS CÉLULAS DOPAMINÉRGICAS... 43
5.6.CONSIDERAÇÕES FINAIS... 43
6. CONCLUSÃO... 45
7. REFERÊNCIAS... 46
RESUMO
A Zona Retrorubral (RRF, grupo A8), a Substância Negra pars compacta (SNC, grupo A9) e a Área Tegmental Ventral (VTA, grupo A10) são núcleos do mesencéfalo que expressam dopamina (DA) e estão envolvidos na regulação motora, aprendizado, cognição e desordens neuropsíquicas. A DA é uma monoamina do grupo das catecolaminas e consiste na substância precursora da síntese de noradrenalina e adrenalina, tendo a enzima Tirosina-Hidroxilase (TH) como reguladora desse processo. Além disso, a DA tem a capacidade de atuar como neurotransmissor no Sistema Nervoso Central, sendo o neurotransmissor principal de neurônios de nove núcleos encefálicos, nomeados de A8 ao A16. Todavia, muitos aspectos de caráter morfofuncional desses núcleos ainda continuam sem esclarecimentos. Considerando a relevância dos núcleos dopaminérgicos mesencefálicos, o objetivo deste trabalho é caracterizar morfologicamente os núcleos dopaminérgicos (grupamentos A8, A9 e A10) do mesencéfalo do morcego (Artibeus planirostris). O Artibeus planirostris é um morcego comum no Rio Grande do Norte. Foram utilizados dez animais nesta pesquisa. Os animais foram anestesiados, perfundidos e os encéfalos removidos da cavidade craniana. Após desidratação em sacarose, os encéfalos foram submetidos a microtomia e secções coronais foram obtidas e coletadas em seis compartimentos distintos. Os compartimentos foram submetidos a coloração pela técnica de Nissl para análise citoarquitetônica e as demais séries foram submetidas a imunoistoquímica para TH. Com base na técnica de Nissl e na imunoistoquímica para TH foi possível verificar os limites anatômicos, assim como a citoarquitetura e possíveis subdivisões dos três núcleos dopaminérgicos do mesencéfalo. No sentido rostro-caudal, os primeiros neurônios dopaminérgicos a surgirem fazem parte da SNC e se estendem até níveis mais caudais do mesencéfalo. A VTA surge nas secções rostrais e continua até o nível caudal. No nível caudal surge a RRF. O padrão de organização desses núcleos no Artibeus
planirostris têm mostrado uma subdivisão na SNC, denominada de cauda, que foi
Palavras-chave: Mesencéfalo; Dopamina; Zona Retrorubral; Substância Negra; Área Tegumentar Ventral; Morcego; Artibeus planirostris.
ABSTRACT
The retrorubral field (RRF - A8), the substantia nigra (SN - A9), and the ventral tegmental area (VTA - A10) dopamine (DA) neurons have been implicated in the motor regulation, reward, aversion, cognition, and several neuropsychiatric disorders. The DA is a monoamine of catecholamine family and is the precursor substance synthesis of noradrenaline and adrenaline, having the enzyme Tyrosine Hydroxylase (TH) as this regulatory process. In addition, the DA has the ability to act as a neurotransmitter in the Central Nervous System, being the main neurotransmitter of brain nuclei, namely of A8 to A16. Interestingly, many of the morphological bases of these neural disturbance remain unknown. Considering the relevance of mesencephalic dopaminergic nuclei, the aim of this research is to characterize morphologically the dopaminergic nuclei (clusters A8, A9 and A10) of the midbrain of the bat (Artibeus planirostris). The Artibeus
planirostris is a common bat in Rio Grande do Norte. Ten animals were used in this
research. The animals were anesthetized, perfused, and the brain was removed from the skull. After dehydration in sucrose, the brain was underwent microtomy. Saggital and coronal sections were obtained and collected in six separate series. The series were Nissl-stained to identify the cytoarchitectonic boundaries and the other series were subjected to immunohistochemistry for TH. After cytoarchitectonic analysis and TH+ cells identification was possible to establish the anatomical boundaries of the nuclei, as well as the subdivisions of three of the midbrain dopaminergic nuclei. The SNC is the most rostral nucleus observed in the midbrain and is identified throughout the rostrocaudal extension of the midbrain. The VTA neurons were seen immediately caudal to the SNC appearance. The RRF neurons were observed just in the caudal levels of the midbrain. The organizational pattern of these nuclei in the Artibeus planirostris have shown a conspicuous tail in the SN, which was described just in the rock cavy, a Brazilian rodent specie, as well as, a great diversity in the neuronal morphology. The present results reveled an apparent philogenetic stability in these structures. Although, the SN tail could represent a functional specialization in this specie.
1. INTRODUÇÃO
1.1. CONSIDERAÇÕES GERAIS SOBRE A DOPAMINA
A 3-Hidroxitiramina/ Dopamina (DA) é uma monoamina que se encontra no grupo das catecolaminas, consistindo na substância precursora da síntese de noradrenalina e adrenalina e é um dos principais neurotransmissores de modulação no Sistema Nervoso Central (Chen et al., 2008; Jones e Pilowski, 2002; Marín et al., 2005). Em 1958, Carlsson e colaboradores constataram que a DA possuía a capacidade de atuar como neurotransmissor no Sistema Nervoso Central, independentemente de ser precursora de noradrenalina e adrenalina (Björkund e Dunnett, 2007a). A síntese da DA (Figura 1) inicia a partir da conversão do aminoácido Tirosina em L-DOPA pela ação da enzima TH. Essa enzima se torna eficaz com um cofator chamado 6-tetrahidrobiopterina (BH4) (Nagatsu e Ichinose, 1999). A L-DOPA é convertida em DA pela ação do
Aminoácido Aromatico Descarboxilase (AADC) (Nagatsu et al., 1964). Depois disso, a DA é armazenada em vesículas pela ação do Transportador vesicular de monoamina (VMAT2) (Lowlor e During, 2004). Quando acaba a sua atuação nos receptores pós-sinápticos a DA é metabolizada na própria fenda pela ação da enzima Catecol-O-Metiltransferase (COMT) e também pode ser metabolizada na parede das mitocôndrias pela ação da Monoamino Oxidase (MAO) (Goole e Amighi, 2009).
Os receptores específicos onde a DA poderá realizar ligação, são cinco subtipos, divididos em dois grupos – D1 e D2. O grupo D1 é composto pelos subtipos – d1 e d5, o grupo D2 é constituído pelos subtipos – d2, d3 e d4 (De La Mora et al., 2009). Os receptores dopaminérgicos dos tipos d1, d2 e d5 estão localizados no striatum, sistema límbico e bulbo olfatório. Já os subtipos d3 e d4 restringem-se à área
límbica (Cave e Baker, 2009). No entanto, em 2009, Acosta-Garcia e colaboradores mostram a participação dos receptores d4 na circuitaria dos núcleos da base. Os receptores d1 e d2 estão envolvidos na circuitaria neuronal dos núcleos da base, cuja função reside na modulação da motricidade (Deongaokar e subramanian, 2005). Os receptores d1 modulam principalmente os neurônios da via direta, ativando a via excitatória, já os receptores d2 estão localizados nos neurônios estriato-palidais da via indireta, inibindo a via inibitória, favorecendo assim o movimento (Gerfen, 2003; Siegel, 2006).
1.2. NÚCLEOS DOPAMINÉRGICOS
A DA é produzida e utilizada como neurotransmissor em núcleos específicos no encéfalo. Com isso foi possível identificar nove núcleos encefálicos, que foram codificados de A8 – A16 (A8: Zona Retrorubral; A9: Substância Negra; A10: Área Tegumental Ventral: A11 – A14: Grupos Hipotalâmicos; A15: Tubérculo Olfatório; A16: Bulbo Olfatório) e Células interplexiformes da Retina – A17 (Dahlström e Fuxe, 1964; Kandel et al., 2000; Marín et al., 2005).
Os núcleos dopaminérgicos presentes no mesencéfalo merecem uma atenção maior, pois estão envolvidos na determinação comportamental do animal, na motivação, cognição, recompensa e algumas desordens neuropsiquiátricas (Bjorkund e Dunnett, 2007a; German e Manaye, 1993). Esses núcleos se localizam na Zona Retrorubral (RRF), Substância Negra (SN) e Área Tegmental Ventral (VTA), respectivamente A8, A9 e A10. Alguns autores consideram esses núcleos como os principais núcleos dopaminérgicos (Dahlström e Fuxe, 1964; François et al., 1999; Björkund e Dunnett, 2007b; Smith e Kieval, 2000).
mesocortical inerva diversas regiões do córtex frontal e está envolvida em aspectos de memória e aprendizagem (Pritchard et al., 2009). Já a via mesolímbica projeta-se para o estriado ventral (núcleo accumbens), o tubérculo olfatório e partes do sistema límbico. Esta via está ligada ao comportamento motivacional (Chen et al., 2009).
Em relação as subdivisões desses núcleos, há um problema que dificulta a análise detalhada destas áreas, que se relaciona com as limitações da atual terminologia. Em primeiro lugar, a RRF é facilmente confundida com o Núcleo Retrorubral, que é um grupo de células não-dopaminérgicas. Em segundo lugar, a delimitação adequada das regiões da VTA. Atualmente a VTA é o nome coletivo de vários grupos distintos de células dopaminérgicas na região ventral do mesencéfalo, istmo e área tegmental do diencéfalo (Dahlström e Fuxe, 1964; Puelles et al., 2007). Estudos anteriores de citoarquitetura em ratos e seres humanos dividiram a VTA em cinco subgrupos: Núcleo Paranigral (PN), Núcleo Interfascicular (IF), Núcleo Parabraquial Pigmentado (PBP), Núcleo Linear Caudal da Rafe (CLi), e Núcleo Linear Rostral da Rafe (RLi) (Halliday e Tork 1986; Oades e Halliday 1987; Swanson, 1982). Em 2012, Fu e colaboradores encontraram outras 2 subdivisões em camundongos, Área Tegmental Ventral Rostral (VTAR) e Núcleo Parainterfascicular (PIF). Finalmente, a SN é subdividida classicamente em várias espécies de mamíferos em Substância Negra Reticulada (SNR) e Substância Negra pars Compacta (SNC), a SNC possui subdivisões as quais são Substância Negra pars Compacta Dorsal (SNCD), Substância Negra pars Compacta Ventral (SNCV), Substância Negra pars Compacta Lateral (SNCL) e Substância Negra
pars Compacta Medial (SNCM) (Dahlström e Fuxe, 1964; Franklin e Paxinos, 2008; Fu
et al., 2012; González-Hernández e Rodríguez, 2000; Halliday, 2004; McRitchie et al.,
1996; Paxinos e Watson, 2007).
1.3. SUJEITO EXPERIMENTAL
Os morcegos são mamíferos placentários pertencentes à ordem Quiróptera, que é dividida, com base em caracteres morfológicos de espécies fósseis e atuais, em duas subordens monofiléticas: Megaquiróptera e Microquiróptera (Simmons, 1994; Simmons e Geisler, 1998) e composta por cerca de 1.100 espécies (Kunz e Lumsden, 2003). Os morcegos são os únicos mamíferos capazes de voar, possuindo uma serie de adaptações que possibilitam o voo.
tropicais do Velho Mundo (Neuweiler, 2000). Já os microquirópteros são cosmopolitas e englobam as 17 demais famílias (Simmons, 1998), incluindo a família Phyllostomidae à qual pertence A. planirostris. Os microquirópteros desenvolveram um complexo sistema de ecolocalização laringeal ausente nas raposas-voadoras, que apresentam apenas algumas espécies cavernícolas (gênero Rousettus) capazes de utilizar um sistema rudimentar de ecolocalização a partir de estalidos da língua (Altringham, 1996).
Recentemente, porém, esta classificação tem sido contrariada por estudos filogenéticos baseados em dados moleculares, que indicam que alguns grupos de morcegos com ecolocalização sofisticada compartilham um ancestral comum com as raposas-voadoras (Teeling et al. 2005; Teeling, 2009; Van der Bussche e Hoofer, 2004). Dessa maneira, a família Pteropodidae e mais cinco famílias de microquirópteros foram agrupados na subordem Yinpteroquiróptera, e as famílias restantes, incluindo a Phyllostomidae, na subordem Yangoquiróptera (Figura 2) (Jones e Teeling, 2006; Teeling et al., 2012).
O Artibeus planirostris é representante da subordem Microquiróptera (Yangoquiróptera), família Phyllostomidae e subfamília Stnodermatinae, apresenta ampla distribuição geográfica, ocorrendo em zonas tropicais de diversos países da América do Sul (Hollis, 2005). É um morcego comum em muitas regiões do Brasil (Zortea, 2007), inclusive no Rio Grande do Norte (Figura 3).
O Artibeus planirostris (Figura 4) é um morcego primariamente frugívoro, alimentando-se de uma grande variedade de frutas silvestres e cultivadas e, em menor frequência, de néctar, pólen e insetos (Zortea, 2007). Habita fragmentos de mata, em áreas de floresta úmida ou xeromórfica (Reis et al, 2013). Durante o dia, a espécie utiliza folhagem e ocos de árvores como abrigo (Reis et al, 2013).
As fêmeas grávidas no Brasil têm sido capturadas entre dezembro e janeiro (Da Silva et al., 2001). No Nordeste do Brasil, Artibeus planirostris apresenta poliestria sazonal (Willig, 1985). Partos (junho até março) e lactação (outubro até dezembro e janeiro até março), correspondendo com a estação chuvosa, quando a disponibilidade de alimentos é maior (Willig, 1982).
Figura 4. Artibeus planirostris (Foto: Marilia Barros).
As características que distinguem os morcegos os tornam únicos, em termos evolutivos e ecológicos, quando comparados com animais do mesmo tamanho (como os roedores), pois apesar de pequenos, apresentam longa expectativa de vida, baixa fecundidade, período longo de dependência com a mãe por parte dos filhotes, idade relativamente avançada para atingir a maturidade sexual e apresentam pouca variação morfológica quando adultos.
Além disso, estes animais utilizam o sistema de sonar para sua locomoção bem como o sistema visual, tal fato pode implicar em alterações morfológicas nos núcleos em questão, tornando este animal um modelo interessante as pesquisas em neuroanatomia, sobretudo para entender os aspectos filogenéticos relativos ao sistema dopaminérgico de mamíferos, que é um sistema envolvido no controle dos movimentos.
2. OBJETIVOS
2.1. GERAL
Caracterizar morfologicamente os núcleos dopaminérgicos (grupamentos A8, A9 e A10) do mesencéfalo do morcego (Artibeus planirostris).
2.2. ESPECÍFICOS
Delimitar a citoarquitetura desses núcleos, a partir do método de Nissl;
Identificar, mediante Imunoistoquímica para TH, os núcleos
dopaminérgicos do mesencéfalo do morcego;
Comparar a média das área, diâmetro e perímetro dos corpos neuronais
3. METODOLOGIA
3.1. SUJEITOS
Dez machos adultos de Artibeus planirostris (peso corporal, 40-47g) foram utilizados no experimento. Os exemplares de Artibeus planirostris utilizados no estudo foram capturados no campus da Universidade Federal do Rio Grande do Norte, Natal (RN), nordeste do Brasil (Licença SISBIO Nº 25233-2).
Para as capturas, foram utilizadas de uma a três redes de neblina Ecotone® de nylon, dimensões 12 x 3 m e tamanho de malha 19 x 19 mm. As redes foram armadas no nível do solo e, em cada noite de captura, foram abertas logo após o pôr do sol e permaneceram expostas por duas horas consecutivas.
Cada indivíduo capturado foi analisado quanto ao sexo e à faixa etária. Mantidos em sacos de algodão até o término da amostragem e transporte até o laboratório. Os demais indivíduos foram soltos no mesmo local de captura. Todos os animais capturados para o estudo foram perfundidos imediatamente após a coleta no Laboratório de Neuroanatomia – Departamento de Morfologia – DMOR/UFRN.
Todos os cuidados foram tomados no sentido de evitar dor e sofrimento aos animais durante os procedimentos experimentais, seguindo estritamente às normas e princípios da Lei Arouca (Brasil, Lei Nº 11.794, de 8 de outubro de 2008), a qual versa o tratamento de animais em pesquisas e atividades científicas e às normas estabelecidas pelo Comitê de Ética para uso de Animais da UFRN (CEUA), o projeto referente a este trabalho foi aprovado pelo CEUA (protocolo N.º 067/2013). Os princípios estabelecidos no livro Guidelines for the Care and Use of Mammals in Neuroscience and Behavioral Research (National Research Council of the National Academies, 2003), também foram seguidos.
3.2. PROCEDIMENTOS 3.2.1.ANESTESIA
3.2.2.PERFUSÃO
Ao atingir o plano anestésico, cada animal foi submetido a perfusão transcardíaca, que compreende os seguintes passos:
I. Posicionamento do animal em decúbito dorsal sobre tela de arame e sob ponto de água.
II. Toracotomia, com incisão de pele, músculos e arco costal, sendo estes removidos em bloco, para exposição do coração.
III. Cardiopunção no ventrículo esquerdo, utilizando uma agulha de dimensões 17mm x 1,5mm, a qual foi direcionada para o cone arterioso, seguindo-se uma incisão no átrio direito. A agulha foi conectada a uma bomba peristáltica (Cole-Parmer), passando-se 150 ml de solução salina a 0,9% em tampão fosfato 0,1M, pH 7,4 com heparina (Parinex, Hipolabor, 2ml/1000ml de solução salina) a um fluxo de 60 ml por minuto, seguida de 300ml de solução de paraformaldeido 4% em tampão fosfato 0,1M, pH 7,4, dos quais 150 ml a um fluxo inicial de 60 ml por minuto e mais 150 ml a um fluxo final de 30ml por minuto.
3.2.3.REMOÇÃO DOS ENCÉFALOS
Concluída a etapa da perfusão os encéfalos foram retirados da cavidade craniana, por fratura dos ossos da calota craniana, com o uso de broca e trocater. Em seguida foram pós-fixados na mesma solução fixadora por duas horas e então colocados em solução sacarose 30% em tampão fosfato 0,1M, pH 7,4, a 4ºC, até serem submetidos à microtomia.
3.2.4.MICROTOMIA
Terminada a etapa de pós-fixação e imersão em tampão sacarose 30%, os encéfalos foram submetidos a microtomia cuja espessura dos cortes foi padronizada em 30µm.
Os encéfalos foram congelados por gelo seco e seccionados em micrótomo de deslizamento (Leica SM 2000R), obtendo-se secções coronais e sagitais. Estas foram distribuídas sequencialmente em seis compartimentos contendo um meio liquido de tampão fosfato 0,1M, pH 7,4. As secções foram depositadas nesses compartimentos de maneira cíclica e sequenciada, de modo que a distância entre as secções de um mesmo compartimento foi de aproximadamente 180 µm.
para solução anticongelante e conservados a -20ºC, para utilização posterior em procedimento de imunoistoquímica.
3.2.5.MÉTODO DE NISSL
Através da coloração de Nissl o retículo endoplasmático rugoso, o núcleo e o nucléolo das células são seletivamente corados, sejam elas, neurônios ou células da glia. Proporcionando a possibilidade de identificá-las através de seu tamanho, forma e localização. A cor resultante da marcação é azul-arroxeada. Esse procedimento foi realizado com cada um dos animais utilizados, uma vez que, podem ocorrer diferenças individuais nas estruturas encefálicas.
3.2.6.IMUNOISTOQUÍMICA
A imunoistoquímica tem como princípio a utilização de um anticorpo específico ao antígeno estudado, cuja interação pode ser identificada pela ligação a um marcador que pode ser uma molécula fluorescente ou uma enzima (peroxidase ou fosfatase), cuja atividade será utilizada para produzir um complexo colorido na presença de um cromógeno.
Precedendo a técnica de imunoistoquímica, foi necessário realizar um pré-tratamento dos cortes, na perspectiva de atenuar ou abolir a presença de artefatos. Esta etapa consiste em:
Cinco lavagens de cinco minutos cada em tampão fosfato 0,1M, pH 7,4;
Incubação em solução de peroxido de hidrogênio (H2O2) a 0,3%, durante
vinte minutos;
Cinco lavagens de cinco minutos cada em tampão fosfato 0,1 M, pH 7,4.
Em seguida os cortes foram lavados novamente por cinco vezes de cinco minutos cada em tampão fosfato 0,1M, pH 7,4 e colocados na solução do complexo avidina-biotina-HRP (protocolo ABC, Kit elite da Vector), numa diluição de 1:100 em Triton X-100 a 0,4% contendo NaCl, por noventa minutos. Essa solução foi preparada trinta minutos antes, para que ocorresse a formação de complexos avidina-biotina-peroxidase. Ao fim da incubação neste complexo os cortes foram lavados novamente por cinco vezes de cinco minutos cada em tampão fosfato 0,1M, pH 7,4. Para visualização da reação, as secções foram postas em meio contendo peroxido de hidrogênio (H2O2), como substrato e 25mg de 3,3’,4,4’
tetrahidrocloretodiaminobenzidina (DAB), utilizada como cromógeno. A solução de DAB e tampão foi preparada cinco minutos antes dos cortes entrarem em contato, e estes permaneceram em contato com a solução durante aproximadamente cinco minutos. Após este período foi acrescentado H2O2 a 0,3%, que na solução final se torna
0,03%. Ao adicionar o H2O2 a reação inicia e o substrato começa a ser utilizado,
deixando reagir até que fique com coloração marrom, cerca de 1 a 10 minutos. Ao final desta etapa os cortes foram lavados por cinco vezes de cinco minutos cada em tampão fosfato 0,1M, pH 7,4.
Os cortes foram montados em lâminas gelatinizadas, que após secas foram imersas em solução de tetróxido de ósmio a 0,05% com o intuito de intensificar a reação. Após as etapas de desidratação, em baterias de álcool de graduação crescente até o álcool absoluto, e diafanização em xilol, foram montadas as lamínulas.
3.2.7.OBTENÇÃO DAS IMAGENS E ANÁLISE DOS RESULTADOS As secções do encéfalo, coradas pelo método de Nissl e/ou submetidas à imunoistoquímica para TH, foram examinadas ao microscópio óptico (Nikon Eclipse Ni) em campo claro. As imagens digitais foram obtidas usando uma videocâmara digital (Nikon DS-Ri1) acoplada ao microscópio, ajustado com as objetivas de 4X, 10X e 20X. As imagens foram analisadas, corrigidas minimamente para brilho e contraste com auxílio do software Adobe Photoshop CS5 e os esquemas construídos a partir do software Canvas 12, tomando como base o The Rat Brain in Stereotaxic Coodinates (Paxinos e Watson, 2007) e o Forebrain Atlas of the Short-tailed Fruit Bat, Carollia
perspicillata (Scalia et al., 2013). Para realização da contagem e mensuração das células
neurônios visíveis no mesmo plano focal, através do software NIS ELEMENTS AR 4 20 00.
3.2.8.ANÁLISE ESTATÍSTICA
4. RESULTADOS
A extensão rostrocaudal do encéfalo do Artibeus planirostris, do limite anterior do bulbo olfatório ao limite bulbo-espinal, foi em média de 17,65mm (Figura 5). Com base nas técnicas de Nissl e na imunoistoquimica para TH foi possível constituir os limites anatômicos, assim como a citoarquitetura e possíveis subdivisões dos três núcleos dopaminérgicos do mesencéfalo.
No sentido rostrocaudal, os primeiros neurônios dopaminérgicos a aparecerem fazem parte da Substância Negra pars Compacta (SNC) e se estendem até níveis mais caudais (Figura 6 A-V). A Área Tegmental Ventral (VTA) surge no nível rostral e continua até o nível caudal (Figura 6 F-Z). No nível caudal surge a Zona Retrorubral (RRF) (Figura 6 M-Z).
4.1. Substância Negra (SN/ A9)
Com base na densidade de distribuição de neurônios, ao longo da extensão da SNC é possível identificar subdivisões deste núcleo. A SN foi dividida em Substância Negra pars Compacta (SNC) e Substância Negra Reticulada (SNR). Foi possível dividir a SNC em Substância Negra pars Compacta Dorsal (SNCD/ A9D), Substância Negra
pars Compacta Lateral (SNCL/A9L), Substância Negra pars Compacta Medial
A B C
(SNCM/A9M), Substância Negra pars Compacta Ventral (SNCV/A9V) e Cauda da Substância Negra (cSN/ CA9).
A SNR é uma região que contém apenas alguns neurônios de dopamina, é a maior parte da SN e encontra-se ventralmente a SNCD e dorsalmente ao pedúnculo cerebral (cp) nos níveis rostral e médio do mesencéfalo (Figura 6 A-Z). Fibras TH+ dos neurônios dopaminérgicos de outras regiões da SNC foram vistos próximos a SNR.
A SNCD é a primeira subdivisão da SNC a surgir no sentido rostro-caudal. Ela surge na porção ventrolateral do tegmento mesencefálico, localizando-se ventralmente a fibra nigro estriatais (ns) e dorsalmente a SNR e ao cp (Figura 6 A-G). No nível médio a SNCD encontra-se lateralmente a SNCM e a subdivisões da Área Tegmental Ventral, medialmente a SNCL e dorsalmente a SNCV e a SNR (Figura 6 H-Q). No nível caudal a SNCD localiza-se ventrolateralmente a RRF (Figura 6 R-V). Os neurônios da SMCD apresentaram formato ovoide, sendo bipolares e multipolares (Figura 7 C).
Os neurônios da SNCM foram encontrados ao nível rostral, medialmente a SNCD e SNR e ventralmente a subdivisões da Área Tegmental Ventral (Figura 6 B-G). No nível medio a SNCM encontra-se lateralmente a subdivisões da Área Tegmental Ventral (Figura 6 H-O). No nível caudal a SNCM está localizada ventralmente a RRF (Figura 6 P-T). A SNCM apresentou neurônios de formato ovoide, sendo bipolares e multipolares (Figura 7 B).
Foram identificados neurônios TH+ lateralmente em uma região ventral as porções intermediarias da SNCD, implantados na SNR. A este grupo de neurônios deu-se o nome de SNCV (Figura 6 H-S). A SNCV apredeu-sentou neurônios de formato ovoide, sendo bipolares e multipolares (Figura 7 D)
Em relação a SNCL, este grupo de neurônios foi identificado nas porções mais laterais do tegmento mesencefálico, estando dorsalateralmente a SNR e lateralmente à SNCD, nos níveis medial e caudal (Figura 6 H-T). Os neurônios dessa subdivisão apresentaram formatos ovoide, piriforme e fusiforme por toda sua distribuição rostro-caudal, sendo na maior parte multipolares (Figura 8 B).
Neurônios TH+ surgiram nos níveis médio e caudal em uma região dorsal à SNCD e SNCL, este grupamento celular recebeu o nome Cauda da Substância Negra (cSN) (Figura 6 M-T). Este grupamento apresenta neurônios bipolares, ovoides, fusiformes e estrelado (Figura 8 C).
O grupo de células A10 foi o mais diverso dentro dos grupos celulares de dopamina. Três subgrupos principais foram identificados: Subgrupos da linha média, Núcleo interfascicular (IF), Núcleo Linear Caudal da Rafe (CLi) e Núcleo Linear Rostral da Rafe (RLi); Subgrupos médios, Núcleo Paranigral (PN) e Núcleo Parainterfascicular (PIF); e Subgrupos laterais, Área Tegmental Ventral Rostral (VTAR) e Núcleo Parabraquial Pigmentado (PBP).
No nível rostral o PBP foi diretamente adjacente a SNCM, localizado dorsalmente e ligeiramente medial (Figura 6 F-G). Dorsomedial ao PBP e misturado com as fibras nigroestriatais (ns), surge os neurônios TH+ da VTAR (Figura 6 G). Esta subdivisão possui neurônios multipolares, ovoides e fusiformes (Figura 9 B). No nível medio o PBP está localizado dorsomedialmente a SNCM e ventrolateralmente ao PIF e lateralmente ao RLi e IF (Figura 6 H-P). No nível caudal o PBP logo se encontra medialmente a RRF e ventrolateralmente ao CLi (Figura 6 O-V). Os neurônios que pertencem a PBP, são ovoides, bipolares e multipolares (Figura 9 C)
No nível medial, quando o lemnisco medial é incorporado na borda dorsal do PBP, as partes rostrais do IF, RLi, PN e PIF aparecem (Figura 6 H-Q). IF localizou-se na linha média, medialmente ao PBP (Figura 6 H-P), possuindo neurônios ovoides, multipolares e bipolares (Figura 10 C). O RLi também estava situado na linha média, dorsalmente ao IF (Figura 6 H-P). O RLi possui neurônios ovoides, multipolares e bipolares (Figura 11 B). O PIF localizou-se ventromedial ao PBP, separado deste último pelo lemnisco medial (ml) (Figura 6 H-I). O PIF possui neurônios multipolares e arredondados (Figura 10 D). O PN estava adjacente à borda ventromedial do PIF e lateralmente ao ml (Figura 6 H-I) e possui neurônios multipolares, arredondados e triangulares (Figura 10 B). E estes dois núcleos estão ventrolateralmente ao IF. Nos níveis medial e caudal, o PN encontra-se medialmente ao PBP e ventralmente ao RLi e CLi (Figura 6 J-P). O CLi aparece na região caudal, a parte mais rostral do CLi encontra-se na linha media adjacente ao RLi, localizado ventralmente e dorsalmente ao PBP e PN (Figura 6 M-P). A parte mais caudal está localizado medialmente a RRF (Figura 6 Q-Z). O CLi contém neurônios ovoides, multipolares e bipolares (Figura 11 C).
4.3. Zona Retrorubral (RRF/ A8)
deste núcleo observa-se subdivisões da substância negra que se encontram lateralmente e subdivisões da Área Tegmental Ventral que estão medialmente à RRF (Figura 6 M-T). No nível mais caudal este núcleo encontra-se lateralmente ao CLi e dorsalmente a SNCD, SNR e ao PBP (Figura 6 U-Z). A RRF apresentou neurônios ovoides e bipolares (Figura 12 B).
4.4.Análise morfometrica
Os grupamentos celulares dopaminérgicos do mesencéfalo apresentaram um padrão uniforme em relação a morfometria das células. Utilizando o teste paramétrico anova one-way, não foi possível observar diferença significativa entre as áreas, diâmetro e perímetro da SN, VTA e RRF obtendo um p ˃ 0,05 (Área - F=1,234, p=0,296; Diâmetro – F=2,967, p=0,057; Perímetro – F=0,359, p=0,699) (Figura 13).
Tabela de comparação de perímetro (µm) dos núcleos dopaminérgicos do mesencéfalo.
N Média Desvio padrão
Modelo padrão
Intervalo de confiança de 95%
para média
Mínimo Máximo
Limite inferior
Limite superior
RRF 30 46,15767 13,184332 2,407119 41,23456 51,08078 27,810 87,270 SN 30 50,06667 16,492653 3,011133 43,90821 56,22512 25,900 84,550 VTA 30 49,33400 25,221427 4,604782 39,91616 58,75184 23,020 115,000 Total 90 48,51944 18,853589 1,987343 44,57064 52,46825 23,020 115,000
Tabela de comparação de área (µm2) dos núcleos dopaminérgicos do mesencéfalo. N Média Desvio
padrão
Modelo padrão
Intervalo de confiança de 95% para média
Mínimo Máximo
Limite inferior
Limite superior
RRF 30 113,18367 44,170854 8,064458 96,69000 129,67733 51,650 215,700 SN 30 140,95867 64,307424 11,740876 116,94588 164,97145 41,090 289,190 VTA 30 127,62600 89,366164 16,315955 94,25613 160,99587 41,090 404,540 Total 90 127,25611 68,670333 7,238489 112,87339 141,63883 41,090 404,540
Tabela de comparação de diâmetro (µm) dos núcleos dopaminérgicos do mesencéfalo.
N Média Desvio padrão
Modelo padrão
Intervalo de confiança de 95%
para média
Mínimo Máximo
Limite inferior
Limite superior
RRF 30 11,78267 2,336252 ,426539 10,91030 12,65504 8,110 16,570 SN 30 13,04133 3,115285 ,568771 11,87807 14,20460 7,230 19,190 VTA 30 10,97200 4,220670 ,770585 9,39598 12,54802 6,150 22,700 Total 90 11,93200 3,387970 ,357123 11,22240 12,64160 6,150 22,700
Tabela 3. Comparação de perímetro dos núcleos dopaminérgicos do mesencéfalo de A.planirostris. Tabela 1. Comparação de área dos núcleos dopaminérgicos do mesencéfalo de A.planirostris.
5. DISCUSSÃO
5.1. Considerações gerais
O presente trabalho fornece a primeira descrição detalhada da distribuição dos neurônios dopaminérgicos em A8, A9 e A10 do encéfalo do morcego (Artibeus
planirostris), baseado na imunoistoquímica para TH e na técnica de Nissl.
A TH é uma enzima comum à síntese de todas as catecolaminas, podendo a sua expressão imunoistoquímica evidenciar tanto neurônios dopaminérgicos, noradrenérgicos ou adrenérgicos. Entretanto, estudos fisiológicos, farmacológicos, clínicos e de biologia molecular, permitem assegurar que os grupamentos neuronais imunorreativos a TH no mesencéfalo são produtores de dopamina, podendo a imunorreatividade a TH ser considerada um marcador molecular confiável para a identificação dos grupamentos dopaminérgico no mesencéfalo (Grimm et al., 2004; Prakash e Hurst, 2006; Margolis et al., 2006).
Através dos resultados observados, constatou-se que, de um modo geral os núcleos dopaminérgicos se mantem conservados ao que já foram descritos em outras espécies de mamíferos, com pequenas diferenças anatômicas quanto a localização, muitas vezes causadas pela própria diferença anatômica dos encéfalos desses animais.
A maioria dos trabalhos feitos até o momento foram realizado com animais da ordem Rodentia, onde estão incluídos o rato (German e Manaye, 1993; McRitchie et al., 1996; Paxinos e Watson, 2007), camundongo (Fu et al., 2012), hamster (Vincent, 1988),
Tatera brantsii (Moon et al., 2007), Mus minutoides (Krunger et al., 2012), Cryptomys
hottentotus (Da Silva et al., 2006; Bhagwandin et al., 2008), Bathyergus suillus
(Bhagwandin et al., 2008), Thryonomys swinderianus (Dwarika et al., 2008), Hystrix
africaeaustralis (Limacher et al., 2008).
Resultados semelhantes foram encontrados em estudos de caracterização morfológica desses núcleos em animais de diferentes ordens, como por exemplo, humanos (McRitchie et al., 1996), Papio ursinus (McRitchie et al., 1998), Procavia
capensis (Gravett et al., 2009), Elephantulus myurus (Pieters et al., 2010) e Giraffa
camelopardalis (Bux et al., 2010) e Sarcophilus harrisii (Patzke et al., 2014).
Em relação aos quirópteros, trabalhos realizados com animais da subordem Megaquiróptera, Rousettus aegyptiacus (Maseko et al., 2007), Eidolon helvum e
Epomophorus wahlbergi (Dell et al., 2010), tem mostrado as mesmas divisões e
Chaerophon pumilus, Coleura afra, Hipposideros commersoni e Triaenops persicus
(Krunger et al., 2010), não foi possível observar as mesmas subdivisões. 5.2.Substância Negra pars Compacta
A primeira subdivisão da SNC, a SNCD possui neurônios ovoides, bipolares e multipolares, esta subunidade nigral não apresenta divergências quando comparadas com outros estudos (Bux et al., 2010; Limacher, et al., 2008). Com relação a SNCM, estudos prévios relatam a existência de neurônios ovoides e bipolares (Bhagwandin et
al., 2008; Gravett et al., 2009), sendo possível encontrar neurônios multipolares e
triangulares (Pieters et al., 2010; Moon et al., 2007). Na SNCM do A.planirostris foi encontrado neurônios ovoides, bipolares e multipolares.
A SNCV do A.planirostris possui neurônios ovoides, bipolares e multipolares. Em Tatera branstsii a SNCV é formada por neurônios triangulares e multipolares (Moon et al., 2007). No caso de Cryptomys hottentotus pretoriaie e Bathyergus suillus possui neurônios ovoides e bipolares (Bhagwandin et al., 2008). Em relação a SNCL, estudos anteriores encontraram neurônios triangulares (Gravett et al., 2009; Pieters et
al., 2010). No A. planirostris foi observado neurônios multipolares, ovoides, piriformes
e fusiformes.
Com relação a cSN, apenas dois estudos evidenciaram a sua existência como sendo uma subdivisão da SN (Nielsen et al., 2009; Cavalcanti et al., 2014). Os neurônios desta região apresentaram neurônios bipolares, ovoides e fusiformes. Cavalcanti e colaboradores, 2014 constataram a presença de neurônios fusiformes e ovoides na CSN.
5.3.Área Tegmental Ventral
Estudos anteriores apontam que as subunidades da VTA, PBP e VTAR, são constituídas por neurônios ovoides e bipolares (Dwarika et al., 2008; Moon et al., 2007). Cavalcanti e colaboradores, 2014 demonstraram que estas subdivisões possuem neurônios multipolares, arredondados e triangulares. No A.planirostris estas subdivisões apresentaram uma distribuição de neurônios ovoides, fusiformes, multipolares e bipolares.
Em relação ao IF, o A.planirostris apresentou neurônios ovoides, multipolares e bipolares. O PIF apresentou neurônios multipolares e arredondados. O PN exibiu neurônios multipolares, arredondados e triangulares. O RLi e o CLi apresentaram neurônios ovoides, multipolares e bipolares. Esses dados corroboram com o achado em
5.4.Zona Retrorubral
Em estudos com roedores, Cryptomys hottentotus pretoriaie e Bathyergus
suillus, demonstraram que os neurônios da RRF são do tipo ovoide, bipolares e
multipolares (Bhagwandin et al., 2008). No Tatera bratsii evidenciou neurônios fusiformes (Moon et al.,2007). A RRF do A. planirostris apresentou neurônios ovoides e bipolares.
5.5.Morfometria das células dopaminérgicas
Através dos resultados observados, verificou-se que os núcleos dopaminérgicos do mesencéfalo não possuem diferenças estatísticas na comparação de médias da área, perímetro e diâmetro. Fu e colaboradores, 2012 em um estudo com camundongo constatou diferença no comprimento do diâmetro dos núcleos SNC, VTA e RRF, onde a Zona Retrorubral apresentou diâmetro celular maior em relação a SNC e VTA.
5.6.Considerações finais
Níveis consistentes de dopamina são necessários para promover o
funcionamento adequado do circuito de controle motor (Alexander e Crutcher, 1990).
Em seres humanos alterações nos níveis de dopamina podem causar distúrbios na fala
(Darley et al., 1969). Em ratos lesões unilaterais de células dopaminérgicas da SN produzem sintomas semelhantes a Doença de Parkinson em humanos (Ciucci, et al.,
2007; Ciucci, et al., 2009). Os núcleos dopaminérgicos do mesencéfalo participam da
integração áudio-vocal em morcegos (Metzner e Schuller, 2007), mas também há
evidencias de uma rede cortical regulando a vocalização de morcegos (Gooler e O’Neill, 1986). Em 2011, Tressler e colaboradores induziram lesões em células dopaminérgicas através da neurotoxina 1-metil-4-fenilpiridina (MPTP) e observaram
mudanças na acústica dos pulsos de ecolocalização de morcegos (Tadarida brasiliensis
mexicana). Em conjunto estes dados suportam a concepção de que o sistema
dopaminérgico do mesencéfalo apresenta grande relevância funcional e uma forte
estabilidade filogenética entre os diversos grupos de vertebrados.
Manger, 2005 propôs que, apesar das diferenças de tamanho, fenótipo ou
hábitos de vida, o mesmo complemento de núcleos neuromoduladores existe para
mamíferos que pertencem à mesma ordem filogenética. Isto significa que cada ordem
dos mamíferos irá apresentar um complemento original de núcleos que é típico de todos
os seus membros. Esta proposta ganhou força após um estudo sobre os sistemas de
neuromoduladores no tronco encefálico do Cryptomys hottentotus (Da Silva et al.,
tem controvérsia na filogenia da ordem dos quirópteros, apresentando uma diferença entre as subordens (Pettigrew et al., 1989 e Simmons, 2000).
6. CONCLUSÃO
A8, A9 e A10 apresentam semelhanças citoarquitetônicas, bem como no
padrão de distribuição de neurônios imunorreativos a Tirosina-Hidroxilase quando comparado filogeneticamente.
O presente estudo comprova que os núcleos dopaminérgicos do
mesencéfalo do Artibeus planirostris não apresenta alterações filogenéticas, com exceção do aparecimento da CSN.
No presente estudo não foi possível observar diferença significativa entre
o comprimento da área, diâmetro e perímetro dos corpos neuronais da SN, VTA e RRF.
7. REFERÊNCIA**
Alexander, G.E., Crutcher, M.D. 1990. Preparation for movement: neural representations of intended direction in three motor areas of the monkey. J Neurophysiol. 1990 Jul;64(1):133-50.
Acosta-Garcia, J., Hernandez-Chan, N., Paz-Bermudez, F., Sierra, A., Erlij, D., Aceves, J., Floran, B. 2009. D4 and D1 dopamine receptors modulate [3H] GABA release in the substantia nigra pars reticulata of the rat. Neuropharmacology. 57, 725-730.
Altringham, J.D. 1996. Bats: Biology and Behaviour. Oxford, Oxford University Press, 262p.
Bhagwandin, A., Fuxe, K., Bennett, N.C., Manger, P.R. 2008. Nuclear organization and morphology of cholinergic, putative catecholaminergic and serotonergic neurons in the brains of two species of African mole-rats. J. Chem. Neuroanat. 35, 371–387.
Bentivoglio, M., Morelli, M. 2005. The organization and circuits of mesencephalic dopaminergic neurons and the distribution of dopamine receptors in the brain. In Dunnett, S.B. et al., Handbook of chemical Neuroanatomy. Vol 21, ed Elsevier, pp. 1-107.
Björkund, A., Dunnett, S., 2007a. Fifty Years of Dopamine Research. Trends Neurosc. 30, 185-187.
Björkund, A., Dunnett, S., 2007b. Dopamine Neuron Systems in the Brain: na update. Trends Neurosc. 30, 194-202.
Bux, F., Bhagwandin, A., Fuxe, K., Manger, P.R. 2010. Organization of cholinergic, putative catecholaminergic and serotonergic nuclei in the diencephalon, midbrain and pons of sub-adult male giraffes. J. Chem. Neuroanat. 39, 189– 203.
Carlsson, A., Lindqvist, M., Magnusson, T., Waldeck, B.1958. On the presence of 3-hydroxytyramine in brain. Science. 127, 471.
retrorubral field in the rock cavy (Kerodon rupestris). Journal of Chemical Neuroanatomy. 55, 58-66.
Cave, J.W., Baker, H. 2009. Dopamine Systems in the Forebrain. Adv Exp Med Biol. 651, 15-35.
Chen, X., Xu, L., Radcliffe, P., Sun, B., Tank, A.W. 2008. Activation of Tyrosine Hydroxilase mRNA Translation by c AMP in Midbrain Dopaminergic Neurons. Mol Pharmacol. 73(6), 1816-1828.
Chen, J.C., Chen, P.C., Chiang, Y.C. 2009. Molecular Mechanisms Psychostimulant addiction. Chang Gung Med J. 32, 148-154.
Ciucci, M.R., Ma, S.T., Fox, C., Kane, J.R., Ramig, L.O., Schallert, T. 2007. Qualitative changes in ultrasonic vocalization in rats after unilateral dopamine depletion or haloperidol: a preliminary study. Behav. Brain Res. 182, 284-289.
Ciucci, M.R., Ahrens, A.M., Ma, S.T., Kane, J.R., Windham, E.B., Woodlee, M.T., Schallert, T. 2009. Reduction of dopamine synaptic activity: degradation of 50 kHz ultrasonic vocalization in rats. Behav. Neurosci. 123, 328-336.
Dahlstrom, A., Fuxe, K. 1964. Evidence for the existence of monoamine containing neurons in the central nervous system. I. Demonstration of monoamines in the cell bodies of brain stem neurons. Acta Physiol Scand. Suppl. 232, 1-55. Da Silva, S.S.P., Guedes, P.G., and Peracchi, A.L. 2001. Levantamento preliminar dos
morcegos do Parque Nacional de Ubajara (Mammalia, Chiroptera), Ceara-Brasil. Revista Brasileira de Zoologia 18:139–144.
Da Silva, J.N., Fuxe, K., Manger, P.R. 2006. Nuclear parcellation of certain immunohistochemically identifiable neuronal systems in the midbrain and pons of the Highveld molerat (Cryptomys hottentotus). J. Chem. Neuroanat. 31, 37-50.
Darley, F.L., Aronson, A.E., Brown JR. 1969. Clusters of deviant speech dimensions in the dysarthrias. J Speech Hear Res. 12, 462-96.
Dell, L.A., Kruger, J.L., Bhagwandin, A., Jillani, N.E., Pettigrew, J.D., Manger, P.R. 2010. Nuclear organization of cholinergic, putative catecholaminergic and serotonergic systems in the brains of two megachiropteran species. J. Chem. Neuroanat. 40, 177–195.
De La Mora, M.P., Gallegos-Cari, A., Arizmendi-Garcia, Y., Marcellino, D., Fuxe, K. 2009. Role of dopamine receptor mechanisms in the amygdaloid modulation of fear and anxiety: Structural and functional analysis. Prog Neurobiol. 90(2), 198-216.
Doyon, J. 2008. Motor sequence learning and movement disorders. Curr Opin Neurol. 21, 478-483.
Dwarika, S., Maseko, B.C., Ihunwo, A.O., Fuxe, K., Manger, P.R. 2008. Distribution and morphology of putative catecholaminergic and serotoninergic neurons in the brain of the greater canerat, Thryonomys swinderianus. J. Chem. Neuroanat. 35, 108–122.
Fallon, J.H., Moore, R.Y. 1978. Catecholamine innervation of the basal forebrain. IV. Topography of the dopamine projection to the basal forebrain and neostriatum. J Comp Neurol. 180, 545-580.
François, C., Yelnik, D., Tandé, D., Agid, Y., Hirsh, E.C. 1999. Dopaminergic cell group A8 in the monkey: Anatominal organization and projections to the striatum. J comp Neurol. 180, 545-580.
Franklin, K.B.J., Paxinos, G. 2008. The mouse brain in stereotaxic coordinates, 3rd edn. Elsevier Academic Press, San Diego.
Fu, Y.H., Yuan, Y., Halliday, G., Rusznák, Z., Watson, C., Paxinos, G. 2012. A cytoarchitetonic and chemoarchitetonic analysis of the dopamine cell groups in the susbstantia nigra, ventral tegmental area, and retrorubral field in the mouse. Brain Struct. Funct. 217, 591–612.
Gerfen, C.R. 2003. D1 Dopamine Receptor supersensitivity in the dopamine-depleted striatum animal modelo of Parkinson’s disease. Neuroscientist. 9, 455-462. German, D.C., Manaye, K.F. 1993. Midbrain dopaminergic neurons (Nuclei A8, A9 e
A10): Three-dimensional reconstruction in the rat. J comp Neurol. 331, 297-309.
Gonzalez-Hernandez, T., Rodrıguez, M. 2000. Compartmental organization and chemical profile of dopaminergic and GABAergic neurons in the substantia nigra of the rat. J Comp Neurol. 421(1):107–135.
Goole, J., Amigui, K. 2009. Levodopa Delivery Systems for the Treatment of Parkinson’s disease: an overview, Int J Pharm. 380, 1-15.
echolocating bat, Pteronotus parnelli parnelli. In The Physiological Control of Mammalian Vocalization. New York: Plenum Press. pp. 153-184.
Gravett, N., Bhagwandin, A., Fuxe, K., Manger, P.R.,2009. Nuclear organization and morphology of cholinergic, putative catecholaminergic and serotonergic neu-rons in the brains of the rock hyrax, Procavia capensis. J. Chem. Neuroanat. 38, 57–74.
Grimm, J., Mueller, A., Hefti, F., Rosenthal, A. 2004. Molecular basis for catecholaminergic neuron diversity. Proc. Natl. Acad. Sci. USA 38, 13891-13896.
Halliday, G.M., Tork, I. 1986. Comparative anatomy of the ventrome- dial mesencephalic tegmentum in the rat, cat, monkey and human. J Comp Neurol. 252(4):423–445.
Halliday, G.M. 2004. Substania nigra and locus coeruleus. In: Paxinos G, Mai JK (eds) The human nervous system, 2nd edn. Elsevier Academic Press, San Diego, pp 449–463.
Hollis, L. 2005. Artibeus planirostris. Mammalian Species 775: 1-6.
Jones, G., Teeling, E.C. 2006. The evolution of echolocation in bats. Trends in Ecology & Evolution, 21(3): 149-156.
Jones, H. M., Pilowski, L. S. 2002. Dopamine and antipsychotic drug action revisited. Br J Psychiatri. 181, 271-275.
Kandel, E.R., Schwartz, J.H., Jessell, T.M. 2000. Disorders of mood: depression, mania and anxiety disorders. In: Kandel, E.R., Schwartz, J.H., Jessell, T.M., Principles of neural Science. 4ª ed. McGraw-Hill, New York, 1216-1219. Krunger, J.L., Dell, L.A., Bhagwandin, A., Jillani, N.E., Pettigrew, J.D., Manger, P.R.
2010. Nuclear organization of cholinergic, putative catecholaminergic and serotonergic systems in the brains of five microchiropteran species. J. Chem. Neuroanat. 40, 210-222.
Kruger, J.L., Patzke, N., Fuxe, K., Bennett, N.C., Manger, P.R. 2012.Nuclear organization of cholinergic, putative catecholaminergic, serotonergic and orexinergic systems in the brain of the African pygmy mouse (Mus
minutoides): organizational complexity is preserved in small brains. J. Chem.
Kunz, T.H., Lumsden, L.F. 2003. Ecology of cavity and foliage roosting bats. In: Kunz, T.H., Fenton, M.B., Bat Ecology. Chicago and London. The University of Chicago. 3-89.
Limacher, A.M., Bhagwandin, A., Fuxe, K., Manger, P.R., 2008. Nuclear organization and morphology of cholinergic, putative catecholaminergic and serotonergic neurons in the brain of the Cape porcupine (Hystrix africaeaustralis): increased brain size does not lead to increased organizational complexity. J. Chem. Neuroanat. 36, 33–52.
Loughlin, S.E., Fallon, J.H. 1984. Substantia nigra and ventral tegmental área projections to córtex: topography and collateralization. Neuroscience. 11, 425-435.
Lowlor, P.A., During, M.j. 2004. Gene Therapy in Parkinson’s disease. Expert Rev Mol Med. 6, 1-18.
Madras, B.K. 2013. History of the discovery of the antipsychotic dopamine D2 receptor: a basis for the dopamine hypothesis of schizophrenia. Journal of the History of the Neurosciences 22 (1), 62–78.
Manger, P.R., 2005. Stablishing order at the systems level in mammalian brain evolution. Brain Res. Bull. 66, 282–289.
Margolis, E.B., Lock, H., Hjelmstad, G.O., Fields, H.L. 2006. The ventral tegmental area revisited: Is there an electropysiological marker for dopaminergic neurons? J. Physiol. 577, 907-924.
Marín, F., Herrero, M.T., Vyas, S., Puelles, L. 2005. Ontogeny of tyrosine hydroxilase mRNA expressionin Mid- and forebrain: Neuromeric pattern and novel positive regions. Dev Dyn. 234(3), 709-717.
Maseko, B.C., Bourne, J.A., Manger, P.R. 2007. Distribution and morphology of cholinergic, putative catecholaminergic and serotonergic neurons in the brain of the Egyptian rousette flying fox (Rousettus aegyptiacus). J. Chem. Neuroanat. 34, 108–127.
Maseko, B.C., Manger, P.R. 2007. Distribution and morphology of cholinergic, catecholaminergic and serotonergic neurons in the brain of Schreiber’s long-fingered bat, Miniopterus schreibersii. J. Chem. Neuroanat. 34, 80–94.
McRitchie, D.A., Cartwright, H., Pond, S.M., Van der Schyf, C.J., Castagnoli Jr, N., Van der Nest, D.G., Halliday, G.M., 1988. The midbrain dopaminergic cell groups in the baboon papio ursinus. Brain Res. Bull. 47, 611-623.
Metzner, W., Schuller, G. 2007. Vocal control in echolocating bats. In Handbook of Mammalian Vocalizations. Amsterdam: Elsevier. pp. 403-415.
Moon, D.J., Maseko, B.C., Ihunwo, A.O., Fuxe, K., Manger, P.R. 2007. Distribution and morphology of catecholaminergic and serotonergic neurons in the brain of the highveld gerbil, Tatera braintsii. J. Chem. Neuroanat. 34, 134-144. Nagatsu, T., Levitt, M., Udenfriend, S. 1964. Conversion of L-tyrosine to
3,4-dihydroxyphenylalanine by cell-free preparations of brain and sympathetically innervated tissues. Biochem Biophys Res Commun. 14, 543-549.
Nagatsu, T., Ichinose, H. 1999. Molecular biology of catecholamine-related enzymes in relation to Parkinson’s disease. Cell Mol Nerobiol. 19, 57-66.
Neuweiler, G. 2000. The Biology of Bats. Oxford, Oxford University Press, 310p. Nielsen, M.S., Sorensen, J.C., Bjarkam, C.R. 2009. The substantia nigra pars compacta
of Göttingen minipig: an anatomical and stereological study. Brain Struct. Funct. 213, 481–488.
Oades, R.D., Halliday, G.M. 1987. Ventral tegmental (a10) system: neurobiology. 1. Anatomy and connectivity. Brain Res 434(2): 117–165.
Patzke, N., LeRoy, A., Ngubane, N.W., Bennett, N.C., Medger, K., Gravett, N., Kaswera-Kyamakya, C., Gilissen, E., Chawana, R., Manger, P.R. 2014. The distribution of doublecortin-immunopositive cells in the brains of four afrotherian mammals: the Hottentot golden mole (Amblysomus hottentotus), the rock hyrax (Procavia capensis), the eastern rock sengi (Elephantulus
myurus) and the four-toed sengi (Petrodromus tetradactylus). Brain Behav
Evol. 84, 227-41.
Paxinos, G., Watson, C. 2007. The rat brain in stereotaxic coordinates, 6 ed. Austrália. Pettigrew, J.D., Jamieson, B.G.M., Robson, S.K., Hall, L.S., McAnally, K.I., Cooper,
H.M. 1989. Phylogenetic Relations Between Microbats, Megabats and Primates (Mammalia: Chiroptera and Primates). Philosophical Transactions of the Royal Society B: Biological Sciences. 325, 489-559.
the eastern rock elephant shrew, Elephantulus myurus. J. Chem. Neuroanat. 39, 175–188.
Prakash, N., Wurst, W. 2006. Development of dopaminergic neurons in the mammalian brain. Cell. Mol. Life Sci. 63, 187-206.
Pritchard, A.L., Ratcliffe, F., Sorour, E., Haque, S., Holder, R., Bentham, P., Lendon, C.L. 2009. Investigation of dopamine receptors in susceptibility to behavioural and psychological symptoms in Alzheumer’s disease. Int. J. Geriatr. Psychiatry. 26, 257-260.
Puelles, L., Martinez-de-la-Torre, M., Paxinos, G., Watson, C., Martinez, S. 2007. The chick brain in stereotaxic coordinates. Elsevier Academic Press, San Diego. Reis, N.R., Fregonezi, M.N., Peracchi, A.L., Shibatta, O.A. 2013. Morcegos do Brasil –
Guia de Campo. Rio de Janeiro, Technical Books, 252p.
Scalia, F., Rasweiler, J.J. IV., Scalia, J., Orman, R., Stewart, M. 2013.Forebrain atlas of the short-tailed fruit bat, Carollia perspicillata, prepared by the methods of Nissl and NeuN immunohistochemistry. New York: Springer.
Seeman, P. 2010. Dopamine D2 receptors as treatment targets in schizophrenia. Clinical Schizophrenia and Related Psychoses April, 56–73.
Seeman, P. 2011. All roads to schizophrenia lead to dopamine supersensitivity and elevated dopamine D2High receptors. CNS Neuroscience and Therapeutics 17 (2), 118–132.
Seeman, P. 2013. Schizophrenia thalamus imaging: Low benzamide binding to dopamine D2 receptors suggests fewer D2Short receptors and less presynaptic terminals. Psychiatry Research: Neuroimaging.
Sesia, T., Bizup, B., Grace, A.A. 2013. Nucleus accumbens high-frequency stimulation selectively impacts nigrostriatal dopaminergic neurons. International Journal of Neuropsychopharmacology, 17, 1-7.
Siegel, G.J. 2006. Basic Neurochemistry: molecular, cellular and medical aspects. 7 ed. Elsevier, London.
Simmons, N.B. 1994. The case for chiropteran monophyly. American Museum Novitates, 3103: 1-54.
strategies in Microchiroptera. Bulletin of the American Museum of Natural History, 235: 1-182.
Simmons, N.B. 1998. A reappraisal of interfamilial relationships of bats. Pp. 3-26. In: T.H. Kunz & P.A. Racey (Eds.). Bat Biology and Conservation. Washington, Smithsonian Institution Press, 365p.
Simmons, N.B. 2000. Bat phylogeny: an evolutionary context for comparative studies. Pp. 9–58, in Ontogeny, functional ecology, and evolution of bats. Cambridge University Press, Cambridge, UK, 398 pp.
Smith, Y., Kieval, J.Z. 2000. Anatomy of the dopamine in the basal ganglia. Trends Neurosc. 23 (suppl), S28-S33.
Stochi, F. 2009. The hypothesis of genesis of motor complications and continuous dopaminergic stimulation in the treatment of Parkinson’s disease. Parkinsonism Relat Disord. 15, 9-15.
Swanson, L.W. 1982. The projections of the ventral tegmental area and adjacent regions: a combined fluorescent retrograde tracer and immunofluorescence study in the rat. Brain Res Bull. 9(1–6): 321–353.
Teeling, E.C., Springer, M.S., Madsen, O., Bates, P., O’Brien, S.J., Murphy, W.J. 2005. A Molecular Phylogeny for Bats Illuminates Biogeography and the Fossil Record. Science, 307: 580-584.
Teeling, E.C. 2009. Hear: the convergent evolution of echolocation in bats? Trends in Ecology & Evolution, 24(7): 351-354.
Teeling, E.C., Dool, S., Springer, M.S. 2012. Phylogenies, fossils and functional genes: The evolution of echolocation in bats, p. 1-21. In: Gunnell, G.F. & N.B. Simmons (Eds.). Evolutionary History of Bats: Fossils, Molecules, and Morphology. Cambridge, Cambridge University Press, 572p.
Tressler, J., Schwartz, C., Wellman, P., Hughes, S., Smotherman, M. 2011. Regulation of bat echolocation pulse acoustics by striatal dopamine. J Exp Biol. 214, 3238–3247.
Van Den Bussche, R.A., Hoofer, S.R. 2004. Phylogenetic relationships among recent Chiropteran families and the importance of Choosing appropriate out-group taxa. J Mammal 85(2): 321 – 330.
Willig, M.R. 1982. A comparative ecological study of Caatingas and Cerrado chiropteran communities: composition, structure, morphometrics, and reproduction. Ph.D. dissertation, University of Pittsburg, Pennsylvania, 324 pp.
Willig, M.R. 1985. Reproductive patterns of bats from Caatingas and Cerrado biomes in northeast Brazil. Journal of Mammalogy 66, 668–681.
Zortéa, M. 2007. Subfamília Stenodermatinae, p. 107-128. In: Reis, N.R., Peracchi, A.L., Pedro, W.A., Lima, I.P. (Eds). Morcegos do Brasil. Londrina, Nelio R. dos Reis, 256p.