Campus de São José do Rio Preto
CLÁUDIA APARECIDA PACHECO DE VASCONCELOS PENHA
ALTERAÇÕES MORFOFISIOLÓGICAS EM CÉLULAS DOS
TÚBULOS DE MALPIGHI DURANTE O DESENVOLVIMENTO DE
MYRMELEON SP (NEUROPTERA, MYRMELEONTIDAE)
Cláudia Aparecida Pacheco de Vasconcelos Penha
Alterações Morfofisiológicas em Células dos Túbulos de Malpighi
Durante o Desenvolvimento de Myrmeleon sp (Neuroptera,
Myrmeleontidae)
Tese apresentada como parte dos requisitos para obtenção do título de Doutor em Genética, junto ao Programa de Pós-Graduação em Genética, Área de Concentração Genética, do Instituto de Biociências, Letras e Ciências Exatas da Universidade Estadual Paulista “Júlio de Mesquita Filho”, Campus de São José do Rio Preto.
Orientadora: Profª. Drª. Maria Tercília Vilela de Azeredo-Oliveira
São José do Rio Preto
Penha, Cláudia Aparecida Pacheco de Vasconcelos.
Alterações morfofisiológicas em células dos túbulos de Malpighi durante o desenvolvimento de Myrmeleon sp (Neuroptera,
Myrmeleontidae) / Cláudia Aparecida Pacheco de Vasconcelos Penha. - São José do Rio Preto: [s.n.], 2011.
93 f. : il. ; 30 cm.
Orientador: Maria Tercília Vilela de Azeredo-Oliveira
Tese (doutorado) – Universidade Estadual Paulista, Instituto de Biociências, Letras e Ciências Exatas
1. Citogenética. 2. Órgãos excretores. 3. Células – Morfologia. 4. Células- Fisiologia. 5. Formiga-leão I. Azeredo-Oliveira, Maria Tercília Vilela de. II. Universidade Estadual Paulista, Instituto de Biociências, Letras e Ciências Exatas. III. Título.
CDU – 595.75:575
Cláudia Aparecida Pacheco de Vasconcelos Penha
Alterações Morfofisiológicas em Células dos Túbulos de Malpighi Durante o Desenvolvimento de Myrmeleon sp (Neuroptera, Myrmeleontidae)
Tese apresentada como parte dos requisitos para obtenção do título de Doutor em Genética, junto ao Programa de Pós-Graduação em Genética, Área de Concentração - Genética, do Instituto de Biociências, Letras e Ciências Exatas da Universidade Estadual Paulista “Júlio de Mesquita Filho”, Campus de São José do Rio Preto.
Banca Examinadora
Profª. Drª. Maria Tercília Vilela de Azeredo-Oliveira UNESP – São José do Rio Preto
Orientador
Profa. Dra. Patrícia Pasquale Parise Maltempi UNESP – Rio Claro
Profa. Dra. Grasiela Dias de Campos Aguiar UNIARARAS – Araras
Profa. Dra. Alba Regina de Abreu Lima Catelani FAMERP – São José do Rio Preto
Profa. Dra. Lílian Madi Ravazzi UNESP – São José do Rio Preto
São José do Rio Preto
17/Fevereiro/2011
O presente trabalho foi realizado no Laboratório de Microscopia e Microanálise do Departamento de Biologia do Instituto de Biociências, Letras e Ciências Exatas de São José do Rio Preto, da Universidade Estadual Paulista (IBILCE/UNESP), com apoio financeiro do CNPq (Processo n°140823/2003-4).
SUMÁRIO
Resumo Abstract
Introdução 1
1.1. Túbulos de Malpighi de Insetos: Características Morfofisiológicas 2
1.2. Sistema Criptonefridial 4
1.3. Especializações Secundárias em Túbulos de Malpighi 6
1.4. Ciclo Celular: Poliploidia Nuclear 11
1.5. Características Biológicas de Myrmeleon sp (Neurotptera,
Myrmeleontidae)
16
2. Objetivos 36
3. Artigos 37
3.1- “Caracterização Citoquímica das Células de Túbulos de Malpighi Durante o Desenvolvimento de Myrmeleon sp (Neuroptera,
Myrmeleontidae)”
39
3.2- “Aspectos Ultraestruturais em Células de Túbulos de Malpighi de
Myrmeleon sp (Neuroptera, Myrmeleontidae)”
72
4. Discussão 89
LISTA DE FIGURAS E FOTOS
Figura 1. Fases larvais L1, L2 e L3 de Myrmeleon sp (Neuroptera,
Myrmeleontidae).
Figura 2. Formiga-leão capturando uma presa por meio de suas mandíbulas.
Figura 3. Covas de Formiga-leão.
Figura 4. Casulo de Formiga-leão.
Figura 5. Adulto de Myrmeleon sp (Neuroptera,Myrmeleontidae).
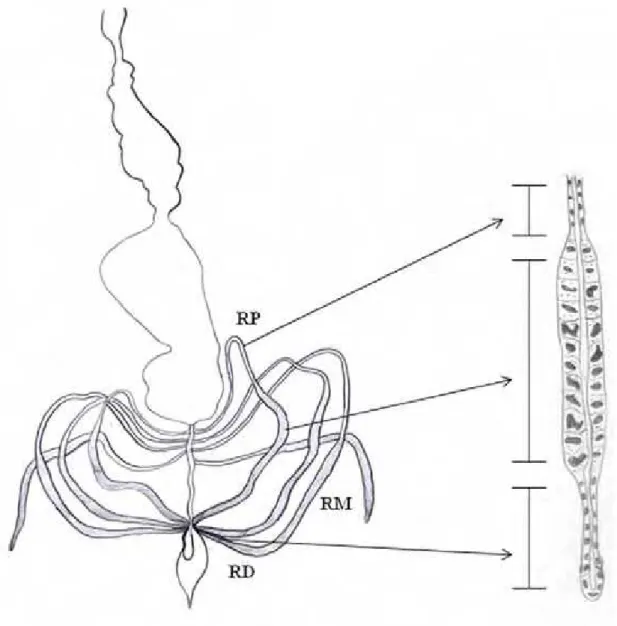
Figura 6. Trato digestório e túbulo de Malpighi de Myrmeleon sp (Neuroptera,
Myrmeleontidae). Legendas: SR = saco retal, RP = região proximal, RM =
região média, RD = região distal, ME = mecônio, IA = intestino anterior, IM =
intestino médio, IP = intestino posterior. Modificado de Van Zyl e Van Der Linde
(2000).
Figura 1. A. Esquema do trato digestório e túbulo de Malpighi de Myrmeleon sp
(Neuroptera, Myrmeleontidae). B. Detalhe das diferentes regiões dos túbulos.
rp=região proximal, rm=região média rd=região distal.
Figura 2. Túbulos de Malpighi de larvas L2 de Myrmeleon sp. A a D – Azul de
Toluidina: Núcleos com cromatina descompactada apresentando grânulos
fortemente metacromáticos ao redor da periferia nuclear e, às vezes, um
central (setas). Notar a basofilia citoplasmática. E a I – Xylidine Ponceau:
Observar grânulos de secreção no citoplasma (setas). No detalhe em F
observar o diâmetro da luz do túbulo maior e regular.
Figura 3. Túbulos de Malpighi de larvas L3 de Myrmeleon sp. A a E – Azul de Toluidina: Núcleos multilobulados (“estrelados”) altamente poliplóides, com
cromatina granulosa (setas). Observar a basofilia citoplasmática. F a I –
Xylidine Ponceau: Observar a acidofilia citoplasmática e nuclear. Destaca-se a
marcante presença dos grânulos de secreção no citoplasma (setas) e o
fenômeno de exocitose desses grânulos, próximo ao lúmen do túbulo
Figura 4. Túbulos de Malpighi de adultos de Myrmeleon sp A a F – Azul de
Toluidina: A e B – núcleos redondos com cromatina granulosa. C a F – núcleos
com cromatina altamente compactada.
Figura 5. Túbulos de Malpighi de Myrmeleon sp impregnados com íons prata.
A e B Larvas L2. A. núcleos redondos. B. os núcleos começam a se alongar. C.
Larvas L3 (núcleos multilobulados). D a F. Adulto. D. Observar a marcação de
proteínas citoplasmáticas. E. Notar a presença de várias marcações
nucleolares. Em F um único núcleo mostrando inúmeras marcações.
Figura 6. Hibridação “in situ” (FISH), com sonda de DNAr. A e B. Larvas L2.
Notar as marcações em lados opostos dos núcleos. C a F. Larvas L3. Núcleos
arredondados exibindo o mesmo padrão de marcação que a fase larval
anterior. D. Núcleos multilobulados, exibindo algumas marcações fluorescentes
do DNAr. E. Detalhe de uma região do núcleo multilobulado. Notar que as
marcações fluorescentes (sítios de hibridação) são em menor número, quando
comparadas às regiões impregnadas pelos íons prata. F. Adulto. Observar
núcleos maiores com inúmeras marcações e núcleos menores com menor
número de sítios de hibridação. Barra=10µm.
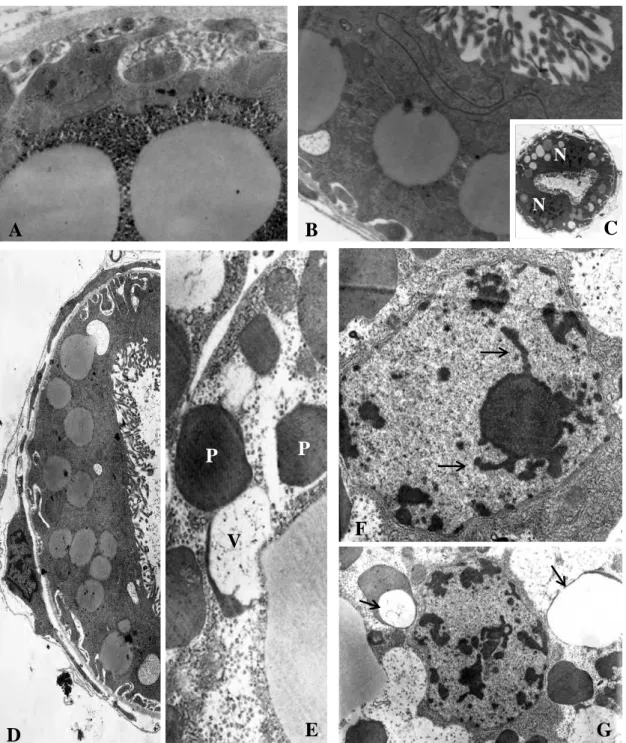
Figura 1A–B: Aspectos ultraestruturais dos túbulos de Malpighi de larvas L1. A.
Secção transversal do túbulo de Malpighi mostrando gotículas por toda a sua
extensão. B e C. Núcleo com blocos de cromatina condensada. D. Detalhe de
junção septada. E. Corte transversal do túbulo mostrando núcleo com
cromatina condensada. F. Detalhe de duas vesículas de secreção.
Mi=mitocôndrias; N=núcleo; JS=junção septada; GS=glicosaminoglicanas.
Aumentos: A=4.646X; B=10.000X; C a F= 12.930X.
Figura 2A-G: Ultraestrutura dos túbulos de Malpighi de larvas L2. A. Vesículas
de secreção ligadas a grânulos de glicogênio. B. Visão geral de um túbulo com
grande quantidade de microvilosidades e vesículas no citoplasma das células.
C. Detalhe de túbulo com dois núcleos. D. Região do túbulo apresentando
várias vesículas. Notar o lúmen do túbulo repleto de secreções. E. Citoplasma
heterocromatina associada ao nucléolo (setas). G. Citoplasma com inúmeras
gotículas lipídicas (seta). N=núcleo; P=peroxissomo; V=vesícula. Aumentos:
A=27.800X; B=21.560X; C=4.646X; D=16.700X; E=16.700X; F=12.930X;
G=10.000X.
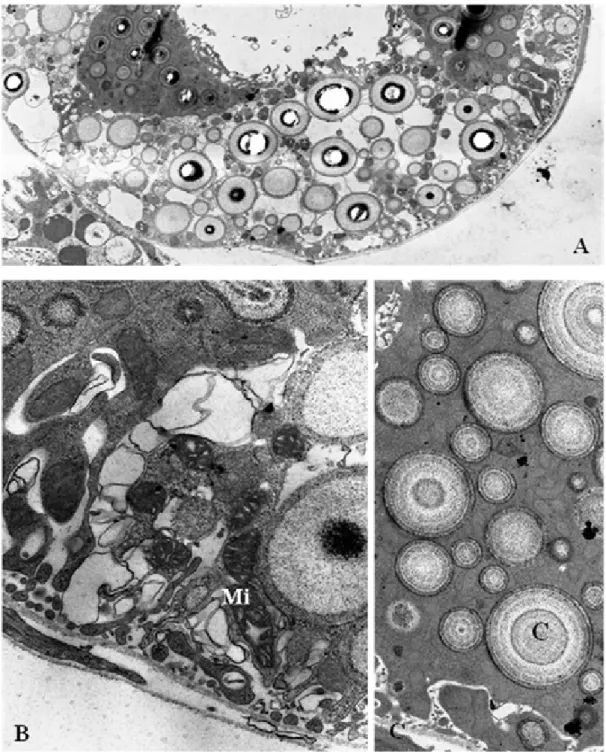
Figura 3A-C: Aspectos ultraestruturais dos túbulos de Malpighi de larvas L2. A.
Túbulo com grande quantidade de concreções citoplasmáticas. B. Região do
citoplasma contendo muitas mitocôndrias. C. Região do citoplasma rica em
concreções citoplasmáticas. Mi=mitocôndria; C=concreção. Aumentos:
A=4.646X; B=16.700X; C=21.560X.
Figura 4A–E: Aspectos ultraestruturais do túbulo de Malpighi de larvas L3. A.
Presença de uma grande vesícula de secreção. B. Célula com grande número
de microvilosidades. Notar as gotículas de secreção entre as vilosidades. C.
Núcleo multilobulado com cromatina descompactada e heterocromatina
associada a dois nucléolos. D. Célula apresentando o citoplasma repleto de
vesículas de secreção associadas a grânulos de glicogênio. E. Região do
citoplasma com concreções citoplasmáticas. VS=vesícula de secreção;
C=concreções; N=núcleo; Nu=nucléolo; L=luz do túbulo; M=microvilosidades.
Aumentos: A=21.560X; B=27.800X; C=6.000X D=7.750X; E=21.560X.
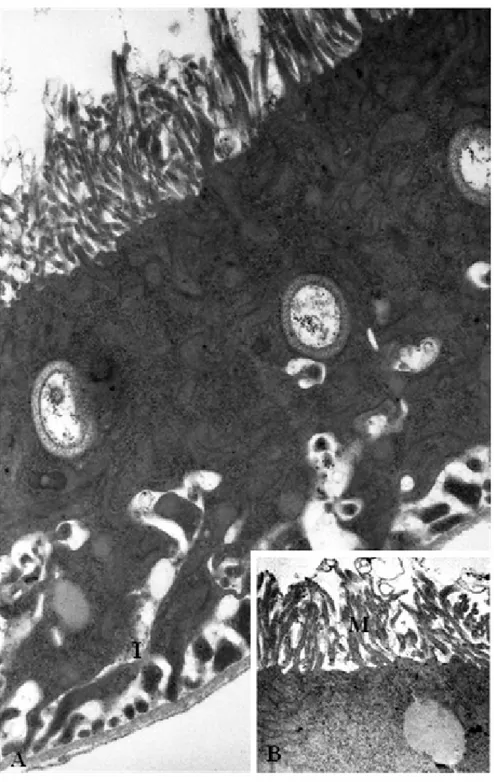
Figura 5A-B: Aspectos ultraestruturais de túbulo de Malpighi de indivíduo
adulto. A. Região do túbulo com grande quantidade de extensões
citoplasmáticas próximas à membrana basal. B. Detalhe do túbulo de adulto
com grande número de microvilosidades. I=invaginações da membrana
plasmática; M=microvilosidades. Aumentos: A=12.930X; B=27.800X.
Dedico à minha família, razão maior da minha vida...
A
AGRADECIMENTOS
Na vida sempre necessitamos do amparo das pessoas que nos cercam, assim agradeço de coração a todos os
companheiros de vida acadêmica, em especial...
À Profa. Dra. Maria Tercília Vilela de Azeredo-Oliveira, pela dedicação, orientação, amizade e paciência que sempre
demonstrou durante esses anos na pós-graduação.
Ao Prof. Dr. Sebastião Roberto Taboga pela disponibilidade do seu laboratório, auxílio e sugestões que foram fornecidas
durante todo o meu trabalho de doutorado. Assim como, amizade que temos desde os tempos de graduação.
Ao técnico do Laboratório de Microscopia e Microanálise do IBILCE/UNESP Luis Roberto Faleiros Júnior, pela sua
atenção, disponibilidade constante e pelo auxílio nas diversas etapas do processamento do material para análise histológica e
ultraestrutural.
À Profa. Dra. Shirlei Maria Recco-Pimentel pela disponibilidade, presteza e pelo livre acesso ao seu laboratório, para a
aprendizagem e realização da técnica de hibradação in situ fluorescente.
À técnica do Laboratório de Citogenética, do Departamento de Biologia Celular da UNICAMP, Klélia Aparecida de
Carvalho pela atenção e disponibilidade prestadas na execução da técnica de hibridação in situ fluorescente.
À Profa. Dra. Hermione Eli Melara de Campos Bicudo pelo carinho e incentivo sempre recebidos.
À Coordenadora da Pós-Graduação, Lilian Madi Ravazzi, pelas sugestões e pelo incentivo e para a vice-coordenadora
Profa. Dra. Cláudia Regina Bonini Domingos.
Aos funcionários da Seção de Pós-Graduação, em especial a Silvia Emiko Kazama pela atenção, dedicação e respeito
dispensados aos alunos.
A todos os funcionários da biblioteca pelo atendimento, pelo auxílio e pelos esclarecimentos prestados durante os anos
de desenvolvimento deste trabalho.
Ao órgão de fomento CNPq (Conselho Nacional de Desenvolvimento Científico e Tecnológico) que me forneceu apoio
necessário à realização desta Tese.
A todos os colegas de laboratório que já não estão mais no Campus, mas que deixaram saudades: Ana Maria Galvan
Custódio, Silvana Pegorin, Sabrina Rochel Maia, Fernanda de Alcântara, Maria Etelvina Pinto, Sérgio Marcelino, Renato
Simões Cordeiro, Danielle Lisboa, em especial à amiga Lara Sílvia Corradi Blanck, por acreditar e me dar a oportunidade de
iniciar a vida de professora.
À minha família, meus pais, João Batista Pacheco e Maria Francisca Sobrinho Pacheco, ao meu filho, Pedro Henrique
Pacheco e ao meu marido e amor da minha vida Márcio de Vasconcelos Penha, sempre me apoiando.
D DEUS
O Universo é obra inteligentíssima; obra que transcende a mais genial inteligência humana; e como todo efeito inteligente tem uma causa inteligente, é forçoso inferir que a do universo é superior a toda inteligência; é a inteligência das inteligências; a causa das causas; a lei das leis; o princípio dos princípios; a razão das razões; a consciência das consciências; É DEUS! Nome mil vezes santo que Newton jamais pronunciava sem se descobrir.
DEUS!
Vós que vos revelais pela natureza, vossa filha e nossa mãe, reconheço-vos eu, Senhor! Na poesia da criação, na criança que sorri no ancião que tropeça no mendigo que implora, na mão que assiste, na mãe que vela, no pai que instrui, no apóstolo que evangeliza!
DEUS!
Reconheço-vos eu, Senhor! No amor da esposa, no afeto do filho, na estima da irmã, na justiça do justo, na misericórdia do indulgente, na fé do ímpio, na esperança dos povos, na caridade dos bons, na inteireza dos íntegros!
DEUS!
Reconheço-vos eu, Senhor! No estro do vate, na eloquência do orador, na inspiração do artista, na santidade do moralista, na sabedoria do filósofo, nos fogos do gênio!
DEUS!
Reconheço-vos eu, Senhor! Na flor dos vergeis, na relva dos vales, no matiz dos campos, na brisa dos prados, no perfume das campinas, no murmúrio das fontes, no rumorejo das franças, na música dos bosques, na placidez dos lagos, na altivez dos montes, na amplidão dos oceanos, na majestade do firmamento!
DEUS!
Reconheço-vos eu, Senhor! Nos lindos antélios, no íris multicolor, nas auroras polares, no argênteo da luz, no brilho do sol, na fulgência das estrelas, no fulgor das constelações!
DEUS!
Reconheço-vos eu, Senhor! Na formação das nebulosas, na origem dos mundos, na gênese dos sóis, no berço das humanidades, na maravilha, no esplendor, no sublime do infinito!
DEUS!
Reconheço-vos eu, Senhor! Com Jesus, quando ora: “Pai nosso que estás nos céus...” ou com os anjos quando cantam: “Glória a Deus nas alturas... Aleluia!”.
RESUMO
O sistema de excreção em artrópodes terrestres é formado de estruturas denominadas túbulos de Malpighi. São órgãos extremamente importantes nos insetos, pois mantêm a osmorregulação. Encontram-se localizados na cavidade corporal, podendo apresentar-se livres ou inseridos na parede do reto, formando um arranjo conhecido como sistema criptonefridial. Os túbulos de Malpighi podem se apresentar com regiões morfologicamente diferentes, cada uma dessas regiões apresentando um determinado tipo celular. Em numerosas espécies pode ocorrer a existência de segmentos, cada qual com um tipo celular diferente. Especializações secundárias são observadas em túbulos de Malpighi, onde uma região do túbulo pode estar envolvida na produção de determinada substância, enquanto outra região é responsável pela produção de outro produto. Isto é o que ocorre com algumas espécies de insetos da ordem Neuroptera, cujos túbulos produzem o fio de seda do casulo durante a última fase larval. As células dos túbulos de Malpighi de Myrmeleon sp sofrem endorreplicação, durante o desenvolvimento larval, tornando-se altamente poliplóides no último estádio. Contudo, essa ploidia aumentada não se estabelece em todo o segmento do túbulo, mas apenas em determinadas regiões, fazendo com que se acredite que apenas determinados locais no túbulo sofram essas modificações para a produção da seda, sendo que as regiões restantes do túbulo permanecem com a função básica de osmorregulação. No presente estudo foram utilizadas técnicas citoquímicas (Azul de Toluidina, Xylidine Ponceau, Impregnação por Íons Prata) e de citogenética molecular (Hibridação in situ fluorescente - FISH). Estas técnicas permitiram a observação de alterações nucleares e citoplasmáticas e, também, evidenciaram um aumento na síntese de substâncias, que são secretadas por um tipo celular ao longo do desenvolvimento larval. Também foram realizadas análises ultraestruturais nas fases larvais e nos adultos, confirmando a existência de dois tipos celulares presentes nos túbulos de Malpighi.
ABSTRACT
The land arthropod secretory system is formed by structures called Malpighian tubules. These tubules are extremely important in insects because they maintain osmoregulation. They are located in the body cavity. They are either free or inserted in the rectum wall, forming an arrangement known as the cryptonephridial system. The Malpighian tubules may have morphologically different regions, with each one formed by a specific cell type. Secondary specializations are found in Malpighian tubules, in which a region of the tube may be involved in the production of some substances, while other regions are responsible for other products. This is what occurs in cases of certain species of the order Neuroptera, which utilize tubules to produce cocoon silk thread during the last larva stage. The cells of Malpighian tubules of Myrmeleon sp undergo endoreduplication during the species' larval development, and they become highly polyplodic in the last larvae stage. However, this increased ploidy does not establish itself in all parts of the tubule, but only in select regions, which suggests that only some parts of the tubule undergo these modifications for silk production while the other regions of the tubule are still used for basic functions of osmoregulation. In this study, the following cytochemical techniques were used: Toluidine Blue, Xylidine Ponceau, Impregnation by AgNOR and the molecular cytogenetic technique called Fluorescence
In Situ Hybridization (FISH). These techniques allowed us to see alterations on both the
cellular and cytoplasmic levels. These alterations were evidence of an increase in synthesis of the substances secreted by specific cell types during the course of larval development. Ultrastructural analyses were also performed in both the larval and adult stages, and these analyses confirmed the existence of the two cellular types present in the Malpighian tubes.
1. INTRODUÇÃO
1.1. Túbulos de Malpighi: Características Morfofisiológicas
O sistema excretor em insetos e artrópodes terrestres consiste de estruturas denominadas túbulos de Malpighi. Este órgão, assim como o intestino posterior, forma o sistema primário em insetos para a regulação iônica, osmótica e excretora, pelos quais são transportados produtos de excreção e compostos tóxicos. A fase final da excreção ocorre no reto, sendo que íons e água são reabsorvidos neste local. Assim, é no intestino grosso que a composição final da urina é formada. As substâncias removidas da urina, como água e íons, são transferidas através de íntimas conexões existentes entre o intestino posterior e os túbulos. Desta forma, esses órgãos são extremamente importantes nos insetos, pois mantém o meio interno constante através da eliminação ou segregação de substâncias desnecessárias, presentes na hemolinfa, e pela retenção ou reabsorção de substâncias úteis ao organismo (Wigglesworth, 1965).
Assim, a maior função dos túbulos de Malpighi em insetos é a excreção de produtos nitrogenados e outros restos de metabólitos. Os túbulos de Malpighi também secretam fluidos dentro do intestino posterior, onde certas substâncias são reabsorvidas e são transportadas dentro da hemolinfa (Maddrell, 1971).
Em inúmeras espécies, os túbulos são separados em regiões morfologicamente diferentes, cada uma homogênea para um dado tipo celular (Bradley, 1985).
O túbulo de Malpighi funciona da seguinte maneira: o potássio é ativamente secretado para a luz do túbulo e a água segue passivamente devido às forças osmóticas, resultando na formação de uma abundante quantidade de fluido rico em potássio. Esse fluido é isotônico em relação à hemolinfa, mas tem uma composição bastante diferente, que difere de forma surpreendente com o rim dos mamíferos, no qual o fluido urinário inicial é um ultrafiltrado do plasma sanguíneo.
Dentro do túbulo de Malpighi ocorre a modificação do fluido por processos secretórios, bem como reabsortivos e, a seguir, há a passagem do fluido para o intestino posterior, onde os solutos e grande parte da água são reabsorvidos, ocorrendo a precipitação de ácido úrico (que faz parte do fluido na forma de urato de potássio hidrossolúvel). Isso facilita a subseqüente retirada de água, pois o ácido úrico precipitado não contribui para a atividade osmótica do conteúdo retal. Finalmente, o conteúdo remanescente no reto é expelido como urina misturada às fezes (Saini, 1964).
1.2. Sistema Criptonefridial
Os túbulos de Malpighi são órgãos tubulares inseridos na região localizada entre o intestino médio e o intestino posterior que, frequentemente, encontram-se livres e soltos na cavidade corporal, sendo que em alguns insetos, como já foi mencionado, o final distal destes túbulos encontra-se em contato com a parede do reto, por meio da membrana perinéfrica, num arranjo conhecido como ‘complexo criptonefridial’. Este
sistema facilita a reabsorção de água e, portanto, é mais altamente desenvolvido em insetos que se alimentam de substâncias secas ou vivem em um ambiente relativamente seco e, por isso, precisam reter água (Bradley, 1985; Chapman, 1998).
Notadamente nos besouros que se alimentam de substâncias secas, ocorre um arranjo especial associado a uma extraordinária capacidade de retirar água do excremento. Nestes insetos, a extremidade em fundo cego do túbulo encontra-se em íntima associação com o reto, sendo toda a estrutura circundada por uma membrana chamada perinéfrica. O espaço formado por essa membrana é preenchido por um fluido, que circunda o túbulo de Malpighi e o epitélio retal, mas é separado da hemolinfa.
Em Tenebrio molitor (Coleoptera, Tenebrionidae) são encontradas quatro regiões morfologicamente diferentes (Green, 1980). Estes insetos apresentam um arranjo especial e uma extraordinária capacidade de retirar água dos excrementos, terminando o túbulo de Malpighi em fundo cego e em associação com o reto é toda circundada por uma membrana periretal (Meyran, 1982).
períodos de abundância de alimentos. Nessa fase, as larvas dos insetos dessa família são predadoras vorazes e a forma de digestão é muito especializada. Segundo Van Zyl e Van Der Linde (2000) a digestão é extra-intestinal, isto é, as enzimas digestivas são injetadas nas presas dissolvendo, dessa forma, os tecidos moles. O fluido é, então, sugado através de estreitos canais entre as mandíbulas e maxilas. O alimento ingerido fica retido em uma estrutura em forma de saco em fundo cego, sendo lentamente absorvido pelo epitélio interno altamente especializado. Esse órgão apresenta uma coloração amarelada na porção anterior tornando-se marrom na porção posterior, pela presença do mecônio, formado pelos resíduos alimentares. Essa porção do canal alimentar é descontínua com o intestino e as demais estruturas. O intestino, propriamente dito, é um tubo de diâmetro uniforme e de sua porção anterior saem oito túbulos de Malpighi, seis dos quais são criptonefridiais, isto é, conectam-se novamente com o intestino na porção posterior formando alças e os outros dois são livres. Esse ponto de ligação dos seis túbulos de Malpighi marca o início da bolsa retal, que, posteriormente, estreita-se para formar o reto. O trato digestório na fase de larva é incompleto, pois o ânus é imperfurado.
Esse arranjo dos túbulos de Malpighi conhecido como sistema criptonefridial está presente na maioria das larvas de Lepidoptera, Neuroptera, Diptera, Symphita e de adultos de Coleoptera, contudo, somente alguns Coleoptera e Diptera foram bem documentados (Bradley, 1985; Chapman, 1998).
constituir um local de armazenamento de nutrientes reabsorvidos pelo reto e utilizado por determinados segmentos dos túbulos de Malpighi.
Baseado nas investigações estruturais e fisiológicas do sistema criptonefridial de
Tenebrio molitor (besouro da farinha) foi proposto um mecanismo pelo qual o
complexo retal deverá funcionar na reabsorção de água (Grimstone et al., 1968).
1.3. Especializações Secundárias em Túbulos de Malpighi
Na maioria dos insetos os túbulos de Malpighi são todos iguais, embora, em alguns como Gryllotalpa (Orthoptera) há três tipos de túbulos que são completamente diferentes baseados na morfologia total. Há túbulos brancos, amarelos e embrionários, cada um parecendo ter uma função diferente. Contudo, diferentes funções para cada tipo de túbulo não têm sido demonstradas conclusivamente (Ryerse, 1979).
A existência de diversos segmentos, cada qual com uma estrutura diferente ao longo dos túbulos de Malpighi de insetos, foi estabelecida em numerosas espécies:
Vanessa urticae, Lepidoptera (Hensen, 1937); Jassidae, Homoptera (Saxena, 1955);
Mantis religiosa, Dictyoptera (Mazzi e Baccetti, 1957); Locusta migratoria, Orthoptera
(Martoja, 1959, apud Garaysa et al., 1992); Macrosteles, Homoptera (Smith e Littau, 1960); Gryllus domesticus, Orthoptera (Berkaloff, 1961); Rhodnius prolixus, Heteroptera (Wigglesworth, 1972); Drosophila melanogaster, Diptera (Wessing, 1965; Eichelberg e Wessing, 1975); Cenocorixa bifida, Homoptera (Jarial e Scudder, 1970);
Diptera (Green, 1979); Blatella germanica e Tenebrio molitor. O número de segmentos, porém, não é o mesmo em todas as espécies (Meyran, 1981).
No epitélio do túbulo de Malpighi do vagalume da Nova Zelândia,
Arachnocampa luminosa, há quatro regiões distintas, cada uma composta de diferentes
tipos celulares: as células da região proximal (Parte I), as células grandes e granulosas (Parte II), as pequenas células da estreita região distal (Parte III) e as células distais do órgão de luz luminescente (Parte IV) (Green, 1979).
Em túbulos de Malpighi de Solenopsis saevissima (Myrmicinae), três segmentos foram distinguidos: proximal, médio e distal, sendo que essa distinção é baseada na forma e estrutura das células epiteliais revestindo os diferentes segmentos dos túbulos (Arab, 2002).
Aedes aegypti tem cinco túbulos de Malpighi formados por células grandes e
pequenas, chamadas, respectivamente, de células principais (ou primárias) e células estreladas. Diferenças morfológicas envolvendo túbulos de Malpighi de machos e fêmeas também foram relatadas, sendo o diâmetro dos túbulos de fêmeas duas vezes maior que os de machos, assim como as células principais e seus respectivos núcleos também são maiores (Souza e Bicudo, 2000).
Em outra espécie, Aedes taeniorhynchus, os túbulos de Malpighi não apresentam
Larvas de um outro díptero, Ephydra hians, são encontradas em lagos hipersalinos do noroeste da América do Norte (Herbest, 1986). Segundo este autor especializações fisiológicas devem ocorrer para que essas larvas vivam num ambiente incomum como esse. Ephydra hians são larvas capazes de manter a osmorregularidade na hemolinfa com uma concentração osmótica dez vezes mais alta do que o sangue. Elas possuem um par de túbulos de Malpighi contendo grandes quantidades de uma substância branca, em comparação com o outro par que não contém esta substância. Observou-se que estes grânulos brancos dissolvidos em ácido úrico liberam bolhas de gás, sugerindo a possibilidade que os túbulos modificados têm de estocar carbonato (Herbest e Bradley, 1989).
Segundo Berridge e Oschman (1969), na mosca sugadora Calliphora
erythrocephala, de forma semelhante ao Aedes, ocorre um arranjo heterogêneo no qual
os túbulos de Malpighi apresentam células primárias e células estreladas, que são responsáveis pela secreção da urina primária que contém Na+, K+ e Cl- dentro do lúmen dos túbulos de Malpighi. Como já foi mencionado, esses autores propuseram que as células estreladas são sítios de reabsorção de Na+ da urina primária.
Regiões especiais dos túbulos de Malpighi de algumas larvas de Coleoptera e Neuroptera também produzem seda (Wigglesworth, 1972; Richards e Davies, 1977; Sehnal e Akai, 1990). Assim, a produção da seda em insetos não é exclusividade da glândula labial, outras glândulas e tecidos também podem produzir este material (Rudall e Kenchington, 1971; Kenchington, 1983).
1.4. Produção de Seda em Insetos
fibroína é secretada pela região posterior da glândula e é envolvida por uma camada de sericina secretada pela região média (Kikkawa, 1953).
Durante o desenvolvimento larval em abelhas, a divisão celular nessas glândulas não ocorre e o aumento que sofre é, essencialmente, baseado no crescimento de suas células, levando à poliploidia, característica de muitos tecidos de insetos nas fases larvais (Landim e Mello, 1969; Silva de Moraes, 1972; Silva de Moraes e Cruz-Landim, 1976). Segundo esses autores, os órgãos larvais que mostram histológica e histoquimicamente a polipolidia são as glândulas de seda, o ventrículo e os túbulos de Malpighi. Principalmente os tecido larvais que atingiram altos níveis de poliploidização são os que degeneram na transição para o indivíduo adulto. A poliploidização, frequentemente, está relacionada com o grau de diferenciação fisiológica dos tecidos, sendo estes tecidos poliplóides mais ativos durante a fase larval. As células destes tecidos não se dividem e parecem ser incapazes de sofrerem uma reestruturação quando ocorre a passagem para a fase adulta, sendo degradadas e substituídas, permanecendo as que crescem por divisão celular (Cruz-Landim e Mello, 1981).
Os túbulos de Malpighi estão quase que exclusivamente engajados em mecanismos secretores. Os produtos mais comumente encontrados no lúmen desses órgãos são ácido úrico, amônia, sais, riboflavinas, pterinas e íons (Wigglesworth, 1965). Contudo, são relatadas em poucas exceções, a elaboração de secreções especiais como glicoproteínas e glicosaminoglicanas.
produzem uma secreção glicoprotéica, possivelmente relacionada à produção da seda (Pesson, 1955; Ziegler e Ziegler, 1958 apud Mello, 1979).
De forma geral, as células dos túbulos de Malpighi possuem características especiais tais como: são binucleadas e altamente poliplóides, apresentando blocos heterocromáticos e corpúsculos nucleolares evidentes. Esse fenótipo celular incomum favorece a visualização de alguns fenômenos nucleares e, desta forma, podemos caracterizar esses órgãos como excelentes modelos para o entendimento de mecanismos biológicos (Mello, 1979).
1.5. Ciclo Celular: Poliploidia Nuclear
Todas as células que constituem um organismo sejam aquelas que se dividem ou aquelas já diferenciadas, estão sob algum tipo de controle genético. Durante o desenvolvimento, um dos controles mais importantes do sistema de regulação gênica é aquele que atua no ciclo celular normal, onde uma célula dá origem a outras duas. Contudo, em alguns tipos celulares, outro tipo de controle genético programado pode ocorrer, resultando em aumento do conteúdo nuclear sem divisão celular (Therman, 1995).
começando a emergir. A intérfase é uma fase de grande atividade, em que, além da replicação do DNA, ocorrem inúmeros fatos importantes, como por exemplo, a formação dos complexos ciclina-CDKs que são fundamentais para a progressão através do ciclo celular (De Boni e Park, 1999).
Uma vez iniciado o ciclo celular, as atividades das ciclinas que regulam a progressão do ciclo, limitam a célula a um ciclo de replicação. A degradação das ciclinas leva à inativação das quinases dependentes de ciclinas. As relações entre as fases S e M parecem, então, serem essenciais na manutenção do estado euplóide de uma célula (Basco et al., 1995).
Em eucariotos cada transição de uma fase do ciclo para outra é regulada por diferentes famílias de ciclinas; assim a transição da fase G1 para a fase S é regulada por
ciclinas G1, ciclina D e ciclina E em associação com as quinases CdK2, CdK4 e CdK6. A
transição da fase G2 para a fase M é controlada por ciclinas mitóticas, ciclinas A e B em
associação com quinases CdC2 ou CdK2 (Reed, 1992; Sherr, 1994).
Estudos citogenéticos têm mostrado que mesmo em células de tecidos diferenciados podem ocorrer, regularmente, uma variedade de mudanças cromossômicas. A mudança cromossômica mais frequente é a poliploidia, resultado de endorreplicações sucessivas. Este processo leva à formação de núcleos que podem ser de dois tipos principais: aqueles em que os cromossomos individuais estão arranjados de forma altamente ordenada, um em relação ao outro, como os cromossomos politênicos de alguns dípteros, e aqueles em que os cromossomos apresentam-se aparentemente sem ordem na disposição dos homólogos (Therman, 1995).
normal, principalmente a anáfase e a telófase e que ocorrem normalmente sem desorganização do envoltório nuclear e divisão do núcleo. Assim, uma mesma célula pode sofrer vários endociclos seguidos, resultando em uma quantidade de DNA que pode ser milhares de vezes superior àquela encontrada em uma célula gamética. Os núcleos resultantes são denominados poliplóides, isto é, apresentam não apenas dois conjuntos cromossômicos completos, como os diplóides, mas quatro, oito, dezesseis ou mais conjuntos, atingindo em alguns casos, a ordem de milhares deles (Therman, 1995).
Embora, a endorreplicação represente um ciclo celular incompleto, é um processo regulado e ordenado durante o desenvolvimento de vários organismos, variando de plantas a insetos e mamíferos (Brodsky e Uryvaeva, 1977; D’Amato, 1984;
De Rocher et al., 1990). Plantas e tecidos de mamíferos, via de regra, parecem ser mosaicos contendo núcleos diplóides e uma série de células com ploidias diferentes (Zybina, 1970; Hartman e Southern, 1995; Datta et al., 1996; Lilly e Sprading, 1996; Zhang et al., 1996).
Altos níveis de endorreplicação são típicos de células envolvidas em secreção ou produção intensa de proteínas; obviamente este processo está sob controle genético quando níveis de ploidia variam em tecidos específicos (Perdix-Gillot, 1979). Por exemplo, em espécies de crustáceos do gênero Daphnia, quase metade do DNA está em estado endopoliplóide com níveis de ploidia variando entre tecidos de 2C à 2.048C. A modulação dos níveis de ploidia está aparentemente mediada pela seleção natural favorecendo grandes volumes celulares, atrasando ciclos celulares ou aumentando doses de genes em certos tecidos (Gregory e Hebert, 1999).
da fibra. Um exemplo clássico é a lagarta do bicho-da-seda, Bombyx mori. A larva de quinto instar secreta o fio de seda através das glândulas salivares para construir o casulo de pupação. As glândulas salivares são grandes e ocupam a maior parte da região ventro-lateral do corpo das larvas e podem ser divididas em três regiões: anterior, mediana e posterior e são formadas por tecido altamente poliplóide. O número de células das glândulas salivares fica estabelecido nos estágios embrionários. Durante o desenvolvimento larval, embora as células não se dividam, a replicação de DNA continua sem a fase da mitose e, consequentemente, a quantidade de DNA é aumentada acentuadamente, chegando a um aumento de cerca de 400.000 vezes, apresentando núcleos grandes e multilobulados (Gage, 1974; Niranjakumari e Gopinathan, 1991).
Este mecanismo de replicação parece ser uma estratégia para a célula aumentar o número de cópias de genes provavelmente responsáveis pela síntese de proteínas que irão formar o casulo de seda. Assim, a função da glândula é a síntese e secreção de proteínas da seda. Estudos bioquímicos sobre a formação da seda em lagartas de
Bombyx mori demonstraram que a seda produzida por essas glândulas é constituída
principalmente de fibroína (cerca de 70 a 75%) e sericina (25 a 30%) (Fukuda et al., 1955).
As células poliplóides sobressaem-se por causa do grande tamanho dos núcleos, que são mais ou menos proporcionais ao grau de ploidia. Além do tamanho, a forma nuclear pode variar de tecido para tecido, de esférico até uma forma estrelada. Esta última forma pode ser observada, por exemplo, em núcleos altamente poliplóides de células de glândula salivar de Lepidoptera (Tashiro et al., 1968) e de túbulos de Malpighi de Neuroptera (Fenerich e Hosaki-Kobayashi, 1994). A forma estrelar tem uma razão de volume/superfície muito menor do que o núcleo esférico de mesmo valor C e a distância entre qualquer ponto de dentro do núcleo e a membrana nuclear é menor do que em um núcleo esférico de mesmo volume. Dessa forma, a difusão e transporte não devem constituir fatores limitantes para um núcleo com alto grau de poliploidia (Ashburner, 1980).
O funcionamento do ciclo celular em células exibindo alto grau de poliploidia também é pouco conhecido. Pesquisas nesse sentido, têm mostrado que a super expressão da ciclina E leva a um encurtamento do estágio G1 e dispara a fase S nos
tecidos endorreplicados (Dulic et al., 1992; Koff et al., 1992; Reed, 1992; Othsubo e Roberts, 1993; Knoblich et al., 1995; Sherr, 1994).
McAuley et al. (1998) observaram em trofoblastos de roedores que, durante o
endociclo, o início da fase S parece envolver sínteses sucessivas de ciclinas E e A e o término da fase S foi associado com abrupta perda das duas ciclinas. Ambas as ciclinas estavam ausentes nas fases G1 e G2 sugerindo que sua degradação pode ser necessária
A endorreplicação, levando à formação dos cromossomos politênicos, tem sido muito bem estudada em dípteros do gênero Drosophila, principalmente, em Drosophila
melanogaster. O processo ocorre em ciclos com definidas fases S separadas pelos
intervalos (fases G), sugerindo que a progressão do endociclo, como também o é no ciclo mitótico (Knoblich et al., 1995; Lilly e Spradling, 1996), na ausência das ciclinas A e B, a mitose não é iniciada. Mesmo em Drosophila, ainda não está suficientemente claro que mudanças nos mecanismos reguladores estão presentes na transição do ciclo celular mitótico para o endociclo.
Galitiski et al. (1999) analisaram RNAs mensageiros de todos os genes de Saccharomyces cerevisae, utilizando a tecnologia de ‘chip’ de DNA, em linhagens que
variam de n à 4n. Esses autores demonstraram que há muitas diferenças nas características de desenvolvimento, morfologia e fisiologia do genoma de ploidias diferentes.
O entendimento do processo da endorreplicação que, normalmente, ocorre em determinados tecidos somáticos seria muito importante, pois poderia ajudar a esclarecer os possíveis mecanismos pelos quais uma quebra do equilíbrio entre a fase S e a fase M poderia, por exemplo, levar ao aparecimento de aneuploidias associadas à tumorigênese (Pathak et al., 1994).
necessidades de produção de todos os tipos de RNA, tendo, especificamente, um ou poucos tipos de RNA mensageiro em um tempo reduzido (Nagl, 1976).
Segundo De Rocher et al. (1990), existe uma relação inversa de quanto mais alto o nível de ploidia, menor é o tamanho genômico basal, sugerindo que isto resulta de um processo evolutivo em que a pressão seletiva favorece períodos mais curtos em cada geração e um rápido desenvolvimento. Nessas espécies os genomas menores favorecem a manutenção de uma quantidade mínima de DNA em certas células.
1.6. Características Biológicas de Myrmeleon sp (Neuroptera, Myrmeleontidae)
Dentre os inúmeros organismos que apresentam células ou tecidos poliplóides somáticos, um inseto em particular, Myrmeleon sp (Neuroptera), reúne algumas condições para se efetuar inúmeros estudos envolvendo o fenômeno. O principal é que possui um órgão, os túbulos de Malpighi, no qual o fenômeno da poliploidia ocorre em fase específica do desenvolvimento. Além disso, o inseto na fase larval é facilmente coletado na natureza, sua manutenção requer apenas um frasco contendo areia e sua alimentação é constituída de pequenos artrópodes, tais como drosofilídeos.
espécies e à tribo Myrmeleontini, que apresenta 9 gêneros, sendo o gênero Myrmeleon, o maior deles.
Na forma larval a formiga-leão é uma predadora muito voraz, tem um corpo fusiforme, 3 pares de pernas e um longo pescoço delgado (Figura 1). A cabeça é pequena e comporta externamente um enorme par de mandíbulas com projeções semelhantes a vários dentes cortantes. As mandíbulas, juntamente com as maxilas, formam um encaixe semelhante a uma foice. Estas mandíbulas capturam a presa e sugam o fluido do seu corpo, através de canais estreitos presentes entre a mandíbula e as maxilas (Figura 2).
Em algumas espécies, as larvas escavam buracos no solo em forma de um cone com o vértice para baixo, os quais funcionam como armadilhas para a captura das presas (Figura 3). Essas armadilhas podem ser encontradas em terrenos arenosos ao lado de leitos de rios, mas também são vistas em abundância em lugares secos e próximos às árvores para se protegerem da chuva (Arnett, 1997).
substância pegajosa e o casulo toma uma forma esférica. Grãos de areia ficam aderidos ao casulo na superfície externa (Figura 4), a larva encerra-se dentro dele onde permanece por várias semanas (ou meses) até emergir como imago.
As formas adultas assemelham-se muito a libélulas (ordem Odonata), mas distinguim-se destas, pelo longo par de antenas, que são multisegmentadas. Apresentam dois pares de asas intensamente nervuradas que ficam dispostas ao longo do abdômen do inseto (Figura 5). Apesar de serem insetos alados não são bons voadores e são vistos ao redor de campos claros durante o verão e outono (Imms, 1957). Os adultos medem cerca de 4 cm de comprimento, mas a extensão das envergaduras das asas, pode variar de 2 a 16 cm, conforme a espécie, sendo a menor forma encontrada na Arábia e a maior encontrada na África.
O comportamento reprodutivo desses animais é muito interessante, sendo que Yasseri e Pazerfall (1996) descreveram a corte e a cópula entre os adultos. O adulto, logo após emergir do casulo, voa para as árvores e pousa sobre os galhos destas, ficando com suas asas levantadas. Esses insetos são de hábito noturno e descansam durante o dia. Assim que a fêmea pousa sobre um tronco, o macho une sua cauda à dela. Ele pendura-se abaixo dela e fica suspenso somente pelo seu aparelho genital. O tempo de cópula é de aproximadamente duas horas.
A longevidade de Myrmeleon é cerca de 20 a 25 dias, mas alguns indivíduos
podem sobreviver por mais que 45 dias. Ironicamente, as fêmeas emergem do casulo e depositam os ovos no solo próximos a uma armadilha da larva de Myrmeleon e, dessa forma, essas fêmeas podem ser capturadas e, consequentemente, devoradas por suas próprias larvas (Yasseri e Parsefall, 1996).
Em Myrmeleon sp foram observados oito túbulos de Malpighi (seis
criptonéfricos e dois livres). Os seis criptonéfricos ligam-se à região posterior do intestino. Em continuidade ao intestino, observa-se a presença do tubo retal que termina em uma estrutura em forma de funil, aparentemente livre, na cavidade abdominal (Figura 6) (Pacheco, 2002).
Ao longo do desenvolvimento larval, os túbulos de Malpighi sofrem diferenciação celular e nuclear. As ocorrências de endorreplicações sucessivas nas células dos túbulos levam à poliploidia, resultando em dois tipos nucleares morfologicamente distintos: núcleos arredondados e núcleos multilobulados. Ao longo do túbulo não há nenhuma estrutura visível marcando os limites entre as diferentes formas celulares e nucleares (Pacheco, 2002).
Myrmeleon sp apresenta-se como um sistema importante ao estudo de
Na fase larval este inseto apresenta características morfológicas e fisiológicas muito diferentes da fase adulta. O nicho ecológico onde as larvas se desenvolvem é completamente diferente daquele em que o adulto viverá, sendo assim, a adaptação dos indivíduos ao novo ambiente implica na utilização de diferentes programas genéticos. Portanto, estudos complementares sobre os diferentes tipos de túbulos (criptonéfricos e livres), assim como as células com diferentes níveis de ploidia que compõe estes túbulos, são importantes e necessários para se entender as diferenças morfológicas e fisiológicas de ambos os túbulos e, também, as diferenciações que ocorrem nessas células durante o desenvolvimento larval e na fase adulta, paralelamente aos diferentes níveis de ploidia.
Embora tenha sido estudado um grande número de espécies, que apresentam o fenômeno da poliploidia em células de estruturas com alta atividade celular durante o desenvolvimento, mas não secretam seda, em Myrmeleon sp pode ser inferido que a produção das proteínas da seda, para formar o casulo de pupação, seja responsável pelos níveis aumentados no conteúdo de DNA, ao longo do seu desenvolvimento. Como esse aumento no conteúdo do DNA ocorre tanto nos túbulos livres como nos túbulos que fazem parte do complexo criptonefridial, não podemos inferir que os diferentes arranjos de túbulos tenham diferentes funções, ou seja, que apenas determinados túbulos sejam os responsáveis pela produção das proteínas que farão parte do casulo do inseto (Pacheco, 2002).
Figura 4. Casulo de Formiga-leão.
(http://www.cnr.berkeley.edu/.../antlionspecifies.htm)
Figura 5. Adulto de Myrmeleon sp (Neuroptera,
Figura 6. Trato digestório e túbulo de Malpighi de Palpares annulatus (Neuroptera,
REFERÊNCIAS BIBLIOGRÁFICAS
ARAB, A.; CAETANO, F. H. Segmental specializations in the Malpighian tubules of the fire ant Solenopsis saevissima Forel 1904 (Myrmecinae): an electron microscopical study. Arthropode Structure & Development, v. 30, p. 281-292, 2002.
ARNETT, Jr. R. H. American insects: a handbook of the insects of America North
of Mexico-New York: Van Nostrand Reinhold Co, 1985.
ARNETT, Jr. R. H. American insects: a handbook of the insects of America North
of Mexico. Gainsville: Sandhill Crane P., 1997.
ASHBURNER, M. Some aspects of the structure and function of the polytene chromosome of Diptera. In: Insect cytogenetics, Ed. R. L. Blackman, C. M. Hewitt
and M. Ashburner, London, p. 278, 1980.
BASCO, R. D.; SEGAL, M. D.; REED, S. I. Negative regulation of G1 and G2 by
s-phase cyclins of Saccharomyces cerevisiae. Molecular Cell Biology, v. 15, p. 5030-5042, 1995.
BERRIDGE, M. J.; OSCHMAN, J. L. A structural basis for fluid secretion by Malpighian tubules. Tissue & Cell, v. 1, n. 2, p. 247-272, 1969.
BRADLEY, T. J.; STUART, A. M.; SATIR, P. The ultrastructure of the larval Malpighian tubules of a saline water mosquito. Tissue and Cell, v. 14, p. 759-773, 1985.
BRODSKY, W. Y.; URYVAEVA, I. V. Cell polyploidy: its relation to tissue growth and function. International Review Cytologie, v. 50, p. 275-332, 1977.
CHAPMAN, R. F. The insects: structure and function. Fourth Ed. Cambridge
CRUZ-LANDIM, C.; MELLO, M. L. S. Development of polyploidy in silk glands of
Melipona quadrifasciata anthidioides L. (Hymenopteran, Apoidea) during the larval
stage. Journal Experientia Zoology, v. 170, p. 149-156, 1969.
CRUZ-LANDIM, C.; MELLO, M. L. S. Development of polyploidy in silk glands of
Melipona quadrifasciata anthidioides Lep. (Hymenopteran, Apoidea) during the larval
stage. Journal Experientia Zoology, v. 170, p. 149-156, 1981.
D’AMATO, F. Role of polyploidy in reproductive organs and tissues. Embriology of
Angiosperms. B. M. Jhori, Ed. Springer-Verlag. New York, p. 523-566, 1984.
DATTA, N. S. et al. Novel alterations in CDK1/cyclin B1 kinase complex formation
occur during the acquisition of a polyploidy DNA content. Molecular Biology Cell, v. 7, p. 209-223, 1996.
DE BONI, U.; PARK P. C. Dynamics of structure-function relationships in interphase nuclei. Life Sciences, v. 64, n. 19, p. 1703-1718, 1999.
DE ROCHER, E. J. et al. Developmentally regulated systemic endoplyploidy in succulents with small genome. Science, v. 250, p. 99-101, 1990.
DULIC, V. et al. Association of human cyclin E with a periodic G1-S phase protein
kinases. Science, v. 250, p. 99-101, 1992.
FENERICH, P. C.; HOSAKI-KOBAYASHI, M. K. Aspectos do núcleo interfásico de túbulos de Malpighi de larvas e adultos de formiga-leão (Neuroptera, Myrmeleontidae). In: VI Congresso de Iniciação Científica da UNESP, 1994, São José do Rio Preto.
Resumo do IV Congresso de Iniciação Científica, São Paulo, 1994, p. 92.
GAGE, M. Poliploidization of the silk gland of Bombyx mori. Journal Molecular
Biology, v. 86, p. 97-108, 1974.
GRAFI, G. Cell cicle regulation of DNA replication: the endoreduplication perspective.
Experimental Cell Research, v. 244, n. 2, p. 372-378, 1998.
GALITSKI, T. et al. Ploidy regulation of gene expression. Science, v. 285, p. 251-254, 1999.
GREEN, L. F. B. Regional specialization in the Malpighian tubules of the new zealand glow-worm Arachnocampa luminosa (Diptera: Mycetophilidae). The structure and function of type I and II cells. Tissue & Cell, v. 11, n. 4, p. 673-702, 1979.
GREEN, L. F. B. Cryptonephridial Malpighian system in a dipteran larva, the new zealand glow-worm Arachnocampa luminosa (Diptera: Mycetophilidae): a structural study. Tissue & Cell, v. 12, n. 1, p. 141-151, 1980.
GREGORY, T. R.; HEBERT, P. D. The modulation of DNA content: proximate causes and ultimate consequences. Genome Research, v. 9 (4), p. 317-324, 1999.
HARTMAN, T. P.; SOUTHERN, D. I. Genome organization from polytene to polyploidy in the nurse cells found in onion fly (Dellia antiqua) and cabbage root fly (Della radicum) ovaries (Diptera, Anthomyiidae). Chromosome Research, v. 3, p. 271-280, 1995.
HERBEST, D. B. Comparative studies of the population ecology and life history patterns of an alkaline salt lake insect: Ephydra (Hydropyrus) hians (Diptera: Ephydridae). PhD Dissertation Oregon State University, v. 206, 1986.
HERBEST, D. B.; BRADLEY, A. Malphigian tubules lime gland in an insect inhabiting alkaline salt lakes. Journal Experimental Biology, v. 145, p. 63-78, 1989.
Secretion in the Malpighian tubes of a neotropical bumblebee, Bombus atratus Franklin.
Protoplasma, v. 99, p. 147-158, 1979.
IMMS, A. D. A general textbook of entomology: including the anatomy, physiology, development and classification of insets. 9 th Ed. London: Methuen and Co, 1957.
KENCHINGTON, W. The larval silk of Hypera spp (Coleoptera: Curculionidae). A new example of cross-β protein conformation in an insect silk. Journal Insect Physiology, v. 29, p. 355-361, 1983.
KIKKAWA, H. Biochemical genetics of Bombyx mori (silkworm). Advanced
Genetics, v. 5, p. 107, 1953.
KNOBLICH, J. A. et al. Distinct modes of cyclin E/cdc2c kinase regulation and s-phase control in mitotic and endoreduplication cycles of Drosophila embryogenesis. Genes &
Development, v. 9, p. 1327-1339, 1995.
KOFF, A. et al. Formation and activation of a cyclin E during CdK2 complex during the
G1 phase of the human cell cycle. Science, v. 257, p. 1689-1694, 1992.
LILLY, M.; SPRADLING, A. C. The Drosophila endocycle is controlled by cyclin E and lacks a checkpoint insuring s-phase completion. Genes Development, v. 10, p. 2514-2526, 1996.
LUCAS, F; RUDALL, K. M. Variety in composition and structure of silk fibroins: some new types of silk form the Hymenoptera. Symposium on Fibrous Proteins, Ed.
WG Crewther, New York Plenum, p. 45-55, 1967.
MCAULEY, A. et al. Reprogramming the cell cycle for endoreduplication in rodent trophoblast cells. Molecular Biology Cell, v. 9, p. 795-807, 1998.
MADDRELL, S. H. P. The mechanism of insect excretory systems. Advanced Insect
MARSHALL, A T. Spidle-production and tube-building by cercopoid nymphs (Homoptera). The cytology of the Malpighian tubules of spittle-bug nymphs. Quart.
Journal Microscopie Science, v. 105, p. 257-262, 1964 a.
MARSHALL, A. T. Spidle-production and tube-building by cercopoid nymphs (Homoptera). The citology and function of the granule zone of the Malpighian tubules of tube-building nymphs. Quart. Journal Microscopie Science, v. 105, p. 415-422, 1964 b.
MARSHALL, A T. Spidle-production and tube-building by cercopoid nymphs (Homoptera). The cytology and function of the fibril zone of the Malpighian tubules of tube-building nymphs Quart. Journal Microscopie Science, v. 106, p. 37-44, 1964 c.
MARSHALL, A. T. Protein synthesis and secretion by the Malpighian tubules of cercopoid larvae (Homoptera). Journal Insect Physiology, v. 19, p. 2317-2326, 1973.
MARSHALL, A. T. Golgi body function and mucocomplex secretion in the Malpighian tubules of cercopoid larvae (Insecta: Homoptera). Journal Ultrasctructural. Research, v. 47, p. 95-105, 1974.
MARTOJA, R. Donnés cytologiques et histochimiques sur lês tubes de Malpighi et leurs secretions muqueuses chez Locusta migratoria R et F (Orthoptera, Acrid), 1959, apud Garayoa, M. Journal of Morphology, v. 24, p. 159-171, 1992.
MAZZI, V.; BACCETTI, B. Prime ricerche is to chimiche comparative sui tubi Malpighian degli insect. Redia, v. 42, p. 383-389, 1957.
MEYRAN, J. C. Segmental variations of intercellular junctions in insect Malpighian tubules: a comparative study of two species. Journal Ultrastructure Research, v. 11, n. 2, p. 79-98, 1981.
NAGL, W. DNA endoreduplication and polyteny understood as evolutionary strategies.
Nature, v. 261, p. 614-615, 1976.
NIRANJANAKUMARI, S.; GOPINATHAN, K. P. Characterization of the DNA-polymerase-α-primase complex from the silk glands of Bombyx mori. European
Journal Biochemistry, v. 201, p. 431-438, 1991.
O’DONNELL, M. J.; SPRING, J. H. Modes of control of insect Malpighian tubules: synergism, antagonism, cooperation and autonomous regulation. Journal of Insect
Physiology, v. 46, p. 107-117, 2000.
OHTSUBO, M.; ROBERTS, J. M. Cyclin-dependent regulation of G1 in mammalian
fibroblasts. Science, v. 259, p. 1908-1912, 1993.
PACHECO, C. A. Estudo citogenético de tecido somático poliplóide em células dos
túbulos de Malpighi de Myrmeleon sp (Neuroptera, Myrmeleontidae). 2002. 97f.
Dissertação (Mestrado) - Departamento de Biologia, Instituto de Biociências, Letras e Ciências Exatas-UNESP, São José do Rio Preto, 2002.
PATHAK, S. et al. Chromosome alterations in cancer development and apoptosis.
Vivo, v. 8, p. 843-850, 1994.
PERDIX-GILLOT, S. DNA synthesis and endomitosis in the giant nuclei of the silk gland of Bombyx mori. Biochemie, v. 61, p. 171-204, 1979.
PESSON, P. Secretion d’une mucoproteine par les tubes de Malpighi dês larves de Cercopides. Son role dans la formation de l’abri spumox. Boll. Laboratorie Zool. Gen.
Agr., v. 33, p. 341-349, 1955.
PIATTI, S.; HUNTER, T. Cyclin-dependent kinases. A new cell cycle motif? Trends
PRUDHOMME, J. C. et al. Silk synthesis. Comprehensive Insect Physiology,
Biochesmistry and Pharmacology, v. 10, p. 571-594, 1985.
RAKITOV, R. A. Secretory products of the Malpighian tubules of Cicadellidae
(Hemiptera, Membracoidea): an ultrastructural study. Experimental Journal of Insect
Morphology & Embriology, n. 28, p. 179-193, 1999.
REED, S. I. The role of p34 kinases in the G1 to S phase transition. Annual Review
Cell Biology, v. 8, p. 529-561, 1992.
RICHARDS, O. W.; DAVIES, R. G. Hymenoptera (ants, bees, wasps, ichneumon flies, sawflies etc). Imm’s General Textbook of Entomology 10a Ed. London, Chapman and Hall, v. 2, p. 1175-1279, 1977.
RUDALL, K. M.; KENCHINGTON, W. Arthropod silks: the problem of fibrous proteins in animal tissues. Annual Review Entomology, v. 16, p. 73-96, 1971.
RYERSE, J. S. Development changes in Malpighian tubules cell structure. Tissue and
Cell, v. 11, n.3, p. 533-551, 1979.
SAINI, R. S. Histology and physiology of the cryptonephridial systems of insects.
Transactions of the Royal Entomological Society of London, v. 274B, p. 202-266,
1964.
SEHNAL, F.; AKAI, H. International Journal Insect Morphology Embryology, v. 19, p. 79-132, 1990.
SHERR, C. G1 phase progression: cycling on cue. Cell, v. 79, p. 551-555, 1994.
SILVA DE MORAES, R. L. M. Conteúdo de DNA e volume nuclear nas glândulas
de seda de Melipona quadrifasciata anthidioides Lepidoptera durante o desenvolvimento larval. 1972. 92f. Dissertação (Mestrado). Instituto de Biociências/
SILVA DE MORAES, R. L. M.; CRUZ-LANDIM, C. Estudos comparativos dos tubos de Malpighi de larva, pré-pupa e adulto de operárias de Melipona quadrifasciata
Anthidioides Lepidoptera (Apidae, Meliponinae). Papéis Avulsos de Zoologia, v. 29, n.
25, p. 249-257, 1976.
SMITH, D. S.; LITTAU, V. Cellular specialization in the excretory epithelia of an insect Macrosteles fascifrons Stal (Homoptera). The Journal of Biophysical and
Biochemical Cytology, v. 8, p. 103-133, 1960a.
SMITH, D. S.; LITTAU, V. C. Cellular specializations in the excretory epithelia of an insect, Macrosteles fasciform Sthäl (Homoptera). Journal Biophysical Biochesmistry
Cytologie, v. 8, p. 103-133, 1960b.
SOUZA, R. C.; BICUDO, H. E. M. C. Morphometric changes associated with sex and development in the Malpighian tubules of Aedes aegypti. Cytobios, v. 102, p. 173-186, 2000.
TASHIRO, Y. et al. Studies on the posterior silkworm Bombyx mori. Journal Cell
Biology, v. 23, p. 519, 1968.
THERMAN, E. Chromossome behaviour in cell differentiation: a field ripe for explorations? Genetics, v. 141, .p. 799-804, 1995.
VAN ZYL, A.; VAN DER LINDE, T. C. Anatomy and histology of the alimentary canals of the Palpares annulatus Stitz (Neuroptera, Myrmeleontidae) with reference to their feeding physiology. Africa Entomology, v. 8, n. 2, p. 179-188, 2000.
VOLLRATH, F. Biology of spider silk. International Journal of Biological
Macromolecules, v. 24, p. 81-88, 1999.
WALL, B. J. et al. Morphology and function of Malpighian tubules and associated structures in the cockroach, Periplaneta americana. Journal of Morphology, v. 146, p. 265-306, 1975.
WESSING, A. Die function der Malpighischen gufäbe. In: Funktionelle und Morphologische Organisation der Zelle. Sekretion und Excretion, 1965, apud in Green, L. F. B. Tissue & Cell, v. 12, p. 141-151, 1979.
Malpighian tubes of a neotropical bumblebee, Bombus atratus Franklin. Protoplasma, v. 99, p. 147-158, 1979.
WIGGLESWORTH, V. B. The principles of insect physiology. 6 th, Ed. Methuen and
Co Ltd., London, 1965.
WIGGLESWORTH, V. B. The principles of insect physiology. Chapman and Hall,
London, 1972.
YASSERI, A. M.; PARZEFALL, J. Life cycle and reproductive behavior of the antlion
Euroleon nostras (Geoffroy in Fourcroy, 1785) in northen Germany (Insecta:
Neuroptera: Myrmeleontidae). Pure and Apllied Research in Neuropterology, p. 269-288, 1996.
ZHANG, Y. et al. The cell cycle in polyploidy megakaryocytes is associated with reduced activity of cyclin B1-dependent cdc2 kinase. Journal Biology Chemistry, v.
271, p. 4266-4272, 1996.
ZYBINA, E. V. Characteristics of polyploization of trophoblast cells. Tsitologiia, v. 12, p. 1081-1094, 1970.
SITES CONSULTADOS:
http://www.google.com
http://www.worsleyscholl.net/…/page.html
http://www.antlionsfarms.com/amt_lion_pin
2. OBJETIVOS
1.1.Justificativa
Existem muitos estudos sobre a estrutura dos túbulos de Malpighi, e em geral, eles podem ser correlacionados com interpretações funcionais, porém há pouca informação disponível para o significado das subdivisões regionais que estes órgãos apresentam. Essas diferenças podem ser inferidas da morfologia externa existente nas regiões dos túbulos.
Podemos constatar pela literatura, que a necessidade de maiores estudos sobre os túbulos de Malpighi diz respeito à função das diferentes regiões destes órgãos, que apresentam regiões que diferem marcadamente em sua aparência e estrutura, o que torna importante essa investigação.
1.2.Objetivos
Caracterizar, com base em métodos citoquímicos e de citogenética molecular, as células das diferentes regiões dos túbulos de Malpighi de Myrmeleon sp, nas diversas fases e relacionar essas diferenças com possíveis funções distintas destas células.
ARTIGO I
Caracterização Citoquímica das Células dos Túbulos de Malpighi, Durante o
Desenvolvimento de Myrmeleon sp (Neuroptera, Myrmeleontidae).
Cytochemical Characterization Cells of Malpighian Tubules During Development
of Myrmeleon sp (Neuroptera, Myrmeleontidae).
Cláudia Aparecida Pacheco de Vasconcelos Penha, Sebastião Roberto Taboga e Maria Tercília de Azeredo-Oliveira
Correspondência para: Departamento de Biologia, IBILCE/UNESP – Rua Cristovão Colombo, 2265, Jardim Nazareth, CEP: 15054-000 - São José do Rio Preto, São Paulo, Brasil. Fax: +55 17 3221-2390.
RESUMO
Túbulos de Malpighi fazem parte do trato digestório de insetos com funções geralmente relacionadas à fisiologia da regulação osmótica, mas podem também ter funções de atividade secretora altamente especializada, sendo que em algumas ordens os túbulos de Malpighi apresentam-se modificados para produzir o fio de seda que formará o casulo. Em Myrmeleon sp (Neuroptera, Myrmeleontidae), ao longo do desenvolvimento larval, as células dos túbulos de Malpighi sofrem diferenciação, por meio da ocorrência de endorreplicações sucessivas que levam à poliploidia, que resulta em dois tipos nucleares morfologicamente distintos. Myrmeleon sp é um inseto holometábolo, que na fase larval apresenta características morfológicas e fisiológicas diferentes da fase adulta. O nicho ecológico onde as larvas se desenvolvem é completamente diferente daquele em que o adulto viverá, sendo assim, a adaptação dos indivíduos ao novo ambiente, implica na utilização de diferentes programas genéticos. No presente trabalho foram utilizadas técnicas citoquímicas e de citogenética molecular, para diferenciar as células dos túbulos de larvas e indivíduos adultos. As técnicas citogenéticas clássicas revelaram a presença de dois tipos celulares durante o ciclo de vida do inseto encontradas em diferentes regiões do túbulo de Malpighi, presentes nos três estádios larvais (L1, L2 e L3)
e, mostrando que ocorre um aumento da atividade sintética em alguns tipos celulares. A hibridazação fluorescente in situ (FISH), com sonda de DNAr, indicou um aumento dos sítios de hibridização destas regiões nas fases larvais e uma diminuição significativa na fase adulta do inseto. Todos estes resultados levam a conclusão que durante o desenvolvimento do inseto ocorrem alterações em determinadas células, sendo que as células que sofrem essas modificações, provavelmente, devem estar relacionadas com a produção da seda que será utilizada pelo inseto durante a fase de pupa.
ABSTRACT
Malpighian tubules are part of the digestive tract of insects, and their functions are usually involved in the physiology of osmotic regulation. However, they are also involved in highly specialized secretion activity, and in certain orders of insects, the Malpighian tubules are modified to produce the silk strand that will form the cocoon. In the Myrmeleon sp (Neuroptera, Myrmeleontidae), during the course of larval development, the Malpighian tubules cells undergo cellular and nuclear differentiation through successive endoreduplications leading to polyploidy. This process results in two morphologically distinct nuclear types. Myrmeleon sp is a holometabolous insect, which possesses morphological and physiological characteristics in the larval stage that are different from those in the adult stage. The ecological environment where the larvae develop is completely different from that in which the adult specimens live; therefore, the adaptation of the specimens to the new environment causes them to use different genetic programs. In this study, cytochemical and cytogenetic techniques were used in order to differentiate between the cells that were found in different regions of the Malpighian tubule. This tubule is present in the three larval stages (L1, L2 and L3), as
well as in adult specimens. Classic cytogenetic techniques revealed the presence of two cell types that are produced during the insect’s life cycle, and also showed that synthetic activity increased in some cell types. The molecular cytogenetic technique used was FISH with an rDNA probe, which indicated an increased of hybridization sites in these regions during the larval stages and a significant decrease during the insect’s growth stage. All of these results during the insect's development, alterations in certain cells occur, and the cells that undergo these changes must be involved in the production of the silk that the insect will use during the pupal stage.
1. INTRODUÇÃO
O sistema excretor em insetos e artrópodes terrestres consiste de estruturas denominadas túbulos de Malpighi, que são órgãos inseridos na região localizada entre o intestino médio e o intestino posterior. Sua extremidade distal frequentemente se livre na cavidade corporal, mas, em alguns insetos, essa região dos túbulos encontra-se em contato com a parede do reto, por meio da membrana perinéfrica, num arranjo conhecido como complexo criptonefridial. Esse sistema facilita a reabsorção de água e, portanto, é mais altamente desenvolvido em insetos que ingerem alimentos secos ou vivem em ambiente relativamente seco e, por isso, precisam reter água (Bradley, 1985; Chapman, 1998).
Em algumas espécies, os túbulos de Malpighi são diferenciados em regiões, como por exemplo, em Rhodnius prolixus (Salpeter, 1962; Bradley, 1983).
Os túbulos de Malpighi também podem ser divididos em segmentos distintos morfologicamente e funcionalmente, apresentando diferentes tipos celulares (Wigglesworth, 1974; Bradley, 1985).
A função primordial dos túbulos de Malpighi está relacionada à excreção de produtos residuais do metabolismo e à regulação do balanço de íons e água, contudo, numa variedade de insetos eles têm função acessória, que não estão relacionadas à excreção ou osmorregulação (Wigglesworth, 1965). Exemplos desses casos são
Crysopa flava (Neuroptera) e Hyptera sp (Coleoptera), cujas larvas formam pequenos
Ao longo do desenvolvimento larval (L1, L2 e L3) de Myrmeleon sp (Neuroptera,
Myrmeleontidae) os túbulos de Malpighi sofrem diferenciação celular e nuclear. Segundo Pacheco (2002), a ocorrência de endorreplicações sucessivas nas células dos túbulos leva à poliploidia, que resulta em dois tipos nucleares morfologicamente distintos: núcleos arredondados e núcleos multilobulados. Ao longo do túbulo não há nenhuma estrutura visível marcando os limites entre as diferentes formas celulares e nucleares. Os resultados desse estudo indicaram que Myrmeleon sp apresenta-se como um sistema adequado ao estudo de diferenciação celular. As células dos túbulos de Malpighi mostram-se poliplóides e com diferenciação durante todo o desenvolvimento larval, em relação à forma, tamanho e estrutura da cromatina, como constatado pelas técnicas citoquímicas que foram utilizadas. Também foi constatado que nos indivíduos adultos os núcleos multilobulados da fase anterior retornam à forma arredondada, mas ainda apresentando alto nível de poliploidia se comparados com as células das extremidades do túbulo (Pacheco e Kobayashi, 2000; Pacheco e Kobayashi, 2001 e Pacheco, 2002).
Myrmeleon sp é um inseto holometábolo, o qual, na fase larval, apresenta