PROGRAMAS DE EXERCÍCIOS FÍSICOS E NÍVEIS DE BIOMARCADORES INFLAMATÓRIOS EM MULHERES COM DISTÚRBIOS METABÓLICOS: UMA
REVISÃO SISTEMÁTICA
FABIANO HENRIQUE RODRIGUES SOARES
ii
FABIANO HENRIQUE RODRIGUES SOARES
PROGRAMAS DE EXERCÍCIOS FÍSICOS E NÍVEIS DE BIOMARCADORES INFLAMATÓRIOS EM MULHERES COM DISTÚRBIOS METABÓLICOS: UMA
REVISÃO SISTEMÁTICA
Dissertação apresentada ao Programa de Pós-Graduação em Ciências da Saúde da Universidade Federal do Rio Grande do Norte como requisito para obtenção do título de Mestre em Ciências da Saúde.
ORIENTADORA: Profa. Dra. Maria Bernardete Cordeiro de Sousa
iv
MINISTÉRIO DA EDUCAÇÃO
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS DA SAÚDE
Coordenadora do Programa de Pós-Graduação em Ciências da Saúde:
v
PROGRAMAS DE EXERCÍCIOS FÍSICOS E NÍVEIS DE BIOMARCADORES INFLAMATÓRIOS EM MULHERES COM DISTÚRBIOS METABÓLICOS: UMA
REVISÃO SISTEMÁTICA
Aprovada em: 06 de maio de 2013
Banca Examinadora:
Presidente da banca: MARIA BERNARDETE CORDEIRO DE SOUSA (Orientadora)
Membros da Banca TELMA MARIA ARAÚJO MOURA LEMOS (Membro Interno)
ALEXANDRE SÉRGIO SILVA (Membro Externo)
EDUARDO CALDAS COSTA (Suplente interno 1)
GEORGE DANTAS DE AZEVEDO
(Suplente Interno 2)
MARIA GORETTI DA CUNHA LISBOA
(Suplente Externo 1)
vi
DEDICATÓRIA
vii
AGRADECIMENTOS
À Professora Doutora Maria Bernardete Cordeiro de Sousa, pelo incentivo, orientação e compreensão.
À Professora Doutora Telma Lemos, pela grande contribuição intelectual e técnica a este estudo.
viii
RESUMO
ix
LISTA DE ABREVIATURAS E SIGLAS
ACSM American College of Sports Medicine
CAPES Coordenação de Aperfeiçoamento de Pessoal de Nível Superior CONSORT Consolidated Standards of Reporting Trials
CRP Proteína C Reativa
DAC Doença Arterial Coronariana
DM Diabetes Melitus
DMT2 Diabetes Melitus Tipo 2
FCR Frequência Cardíaca de Recuperação HUOL Hospital Universitário Onofre Lopes IL-1ra Receptor Antagonista da Interleucina 1 IL-6 Interleucina 6
IL-10 Interleucina 10
IMC Índice de Massa Corporal
LILACS Literatura Latino-Americana e do Caribe em Ciências da Saúde MEDLINE Medical Literature Analysis and Retrieval System Online
MeSH Medical Subject Heading MMP-9 Metaloproteinase 9
PAI-1 Inibidor Ativado do Plasminogênio 1 PEDro Physiotherapy Evidence Database
PUBMED Public MEDLINE
RI Resistencia à Insulina
RS Revisão Sistemática
SBE Saúde Baseada em Evidências SciELO Scientific Eletronic Library Online
SM Síndrome Metabólica
TI Treinamento Intervalado
TNF-α Fator de Necrose Tumoral-alfa
x
LISTA DE FIGURAS
FIGURE 1 – Summary of search results (artigo) 35
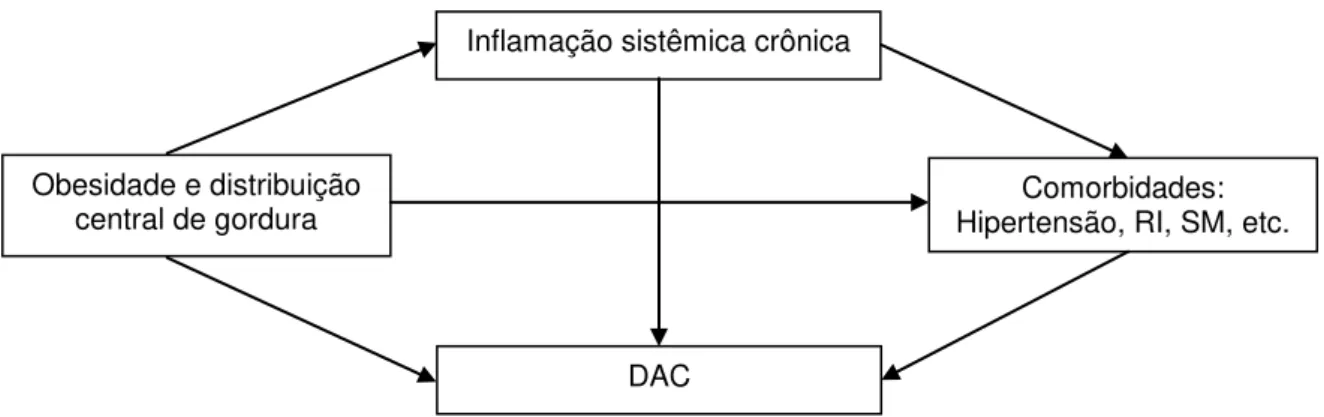
FIGURA 1 – Esquema ilustrativo da integração entre inflamação, obesidade,
comorbidades metabólicas e DAC 15
Figura 2 – Resistência à insulina mediana pelo TNF-α 16
Figura 3 – Liberação de IL-6 por macrófagos ativados 17
Figura 4 – Resistência à insulina mediana pela IL-6 18
Figura 5 – Liberação e funções da CRP 19
xi
LISTA DE TABELAS
TABLE 1 –Details of Included References (artigo) 37
TABLE 2– Percent Change in Inflammatory Biomarkers by Intervention Protocol (artigo) 41
TABELA 3 – Detalhes das referências incluídas (dados atualizados e corrigidos) 65
xii
SUMÁRIO
Resumo viii
Lista de Abreviaturas e Siglas ix
Lista de Figuras x
Lista de Tabelas xi
1. INTRODUÇÃO 13
1.1. OBESIDADE, INFLAMAÇÃO SISTÊMICA CRÔNICA E DAC 14
1.2. MENSAGEIROS BIOQUÍMICOS 15
1.2.1. Fator de necrose tumoral-α 15
1.2.2. Interleucina-6 16
1.2.3. Proteína C reativa 18
1.3. ESTRESSE, EXERCÍCIO E SISTEMA IMUNE 20
1.4. EXERCÍCIO FÍSICO COMO PREVENÇÃO E TERAPÊUTICA 22
2. JUSTIFICATIVA 24
3. OBJETIVOS 26
3.1. OBJETIVO GERAL 26
3.2. OBJETIVOS ESPECÍFICOS 26
4. MÉTODOS 27
4.1. DELINEAMENTO DO ESTUDO 27
4.2. FONTES DE DADOS 27
4.3. SELEÇÃO DE ESTUDOS 27
4.3.1. Avaliação crítica dos estudos 28
4.4. EXTRAÇÃO DOS DADOS 29
5. ARTIGO PRODUZIDO 30
6. COMENTÁRIOS, CRÍTICAS E CONCLUSÕES 51
7. REFERÊNCIAS BIBLIOGRÁFICAS 53
APÊNDICES 63
APÊNDICE 1 – FICHA DE EXTRAÇÃO DOS DADOS 64
1. INTRODUÇÃO
Distúrbios crônicos degenerativos têm se tornado o principal problema de saúde global, causando morbidade e morte prematura em homens e mulheres na maioria das nações desenvolvidas e em países em desenvolvimento. Em 1997 doenças crônicas não eram tão comuns quanto infecciosas e em 2002 elas eram a principal causa de morte (1). Neste ano a doença arterial coronariana (DAC) foi responsável por 17 milhões de óbitos, seguida pelo câncer com sete milhões, pelas doenças crônicas pulmonares, quatro milhões, e diabetes melitus (DM) com quase um milhão de mortes, um total 29 milhões ao redor do mundo (2). Os principais fatores de risco para esses distúrbios incluem fumo, estresse, consumo de álcool, dietas não saudáveis e falta de atividade física regular (2).
Tem sido sugerido que respostas imunes, estresse e inflamação estão interconectados desde o início do caminho evolutivo da espécie humana e que os genes humanos foram selecionados para possibilitar o metabolismo aeróbico e orquestrar a complexa integração metabólica necessária para atividade física, que possibilitaria a sobrevivência durante aquisição de comida, reprodução e defesa contra predadores (3).
Neste contexto, antígenos e estresse provocam uma cadeia de reações que incluem respostas de natureza imune e inflamatória (4). Estas respostas, mediadas por catecolaminas, citocinas, interferons e outros mensageiros bioquímicos (5) acabam por promover a resistência periférica à insulina que, por sua vez, preserva o suprimento de glicose para o cérebro (6).
1.1. OBESIDADE, INFLAMAÇÃO SISTÊMICA CRÔNICA E DAC
O desenvolvimento da obesidade é determinado pela interação entre predisposição genética e aspectos ambientais. Porém, as interações entre genes e entre gene e meio ambiente, que contribuem para a patogênese desse distúrbio tão complexo, não estão totalmente esclarecida (8).
A epidemiologia da DAC tem se modificado com a pandemia de obesidade (9-11), indicando que quantidades excessivas de gordura intra-abdominal, epicárdica e omental estão fortemente relacionadas com DAC (12, 13), além de contribuir diretamente com outros fatores de risco modificáveis, tais como hipertensão arterial sistêmica (HAS), dislipidemia e sedentarismo, criando um estado propício para o desenvolvimento de DAC (14, 15).
Além de ser um depósito de energia, o tecido adiposo é também um órgão endócrino (16, 17). Ele pode exacerbar a DAC por meio de vários mecanismos, incluindo inflamação sistêmica e hipercoagulabilidade (18).
Figura 01 – Esquema ilustrativo da integração entre inflamação, obesidade, comorbidades metabólicas e DAC
1.2. MENSAGEIROS BIOQUÍMICOS
1.2.1. Fator de necrose tumoral-α
Em 1985, Old e colaboradores (25) identificaram uma proteína sérica em coelhos tratados com endotoxina. Esta proteína era responsável pela necrose hemorrágica de alguns tumores e foi batizada de fator de necrose tumoral α, ou
TNF-α.
O TNF-α é inicialmente codificado gerando uma proteína de 26 kDa (26). A proteína é sintetizada e processada como uma proteína mambrano-associada que, após clivagem proteolítica, é liberada na circulação como um trimer de 51 kDa (27) que terá funções tanto endócrinas quanto parácrinas.
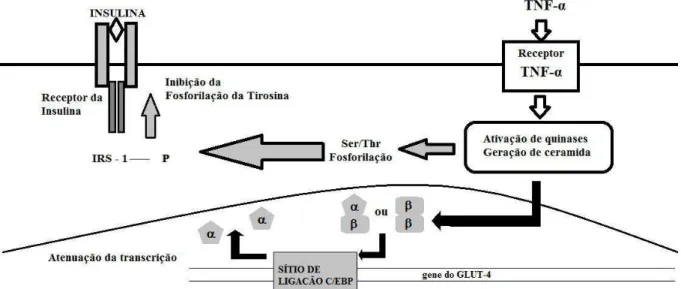
Quando cheios de gordura, os adipócitos produzem hormônios como a leptina, a adiponectina e a resistina (28), além de promover a produção e liberação de citocinas, como o TNF-α (Figura 2), por células fagocitárias do sistema imune. Esta citocina estimula febre, proteólise, lipólise (29, 30) e secreção de reagentes de fase
Inflamação sistêmica crônica
Obesidade e distribuição
central de gordura Hipertensão, RI, SM, etc. Comorbidades:
aguda, como a CRP, no fígado (31), além de estimular a lipase hormônio-sensível, resultando em níveis elevados de ácidos graxos livres na circulação. Ainda, inibe a lipoproteína lipase, que reduz a velocidade de depuração da lipoproteína de baixíssima densidade (VLDL) rica em triacilgliceróis da circulação.
O TNF-α também interfere nos níveis de HDL associados à obesidade e outras morbidades inflamatórias (32). Portanto, níveis elevados de TNF-α estão associados
com uma dislipidemia, caracterizada por elevados níveis de triglicerídeos e níveis reduzidos de HDL, resultando no incremento do risco cardiovascular (31).
O TNF-α induz RI (Figura 2) promovendo a fosforilação da serina do substrato receptor de insulina-1 (IRS-1) que impede a sinalização da insulina (33). Esta ação incrementa o risco cardíaco por agravar um quadro de hiperinsulinemia.
Figura 2 – Resistência à insulina mediana pelo TNF-α
1.2.2. Interleucina-6
anticorpos. Um desses fatores foi estudado como fator de diferenciação, de estimulação e de crescimento de células B e hoje é conhecido como interleucina-6, ou IL-6.
Esta citocina possui um grande leque de atividades, sendo considerada, ao mesmo tempo, reguladora metabólica, citocina pró-inflamatória e anti-inflamatória e indutora da diferenciação e ativação de osteoclastos in vitro (35). Também, estimula a expressão de moléculas de adesão endotelial (36).
A Figura 3 mostra esquematicamente a liberação da IL-6 por macrófagos em resposta a algum fator sinalizador.
Figura 3 – Liberação de IL-6 por macrófagos ativados
A IL-6 também é produzida no tecido adiposo tanto em repouso (40) quanto durante a atividade física (41) e esta produção é proporcional ao grau de obesidade (40). Em conjunto com o TNF-α agrava os quadros de RI (42), aumentando o risco cardíaco (Figura 4).
Figura 4 – Resistência à insulina mediana pela IL-6
1.2.3. Proteína C reativa
que tinha concentrações aumentadas em pacientes com alguns estímulos inflamatórios, como a miocardite e febre reumática.
Em meados dos anos 1980 John Volanakis, Mark Pepys, Irving Kushner, e outros identificaram a CRP como um produto hepático (Figura 5) não glicosilado que tinha afinidade, mediada pelo cálcio, com ligandos específicos, entre eles o LDL colesterol (47-49). Posteriormente, outros investigadores relataram que a produção hepática da CRP era regulada por citocinas inflamatórias, como a IL-6 e o TNF-α, que sua meia-vida plasmática era de aproximadamente 19h em condições basais e sob estresse, e que, portanto, a sua concentração plasmática era altamente determinada pela sua taxa de síntese (50, 51).
Outros achados demonstram a produção de CRP por adipócitos em resposta a IL-6, IL1 e a resistina, incrementando o corpo de evidências que associa entre si a obesidade, a inflamação sistêmica crônica e o risco cardíaco (52).
1.3. ESTRESSE, EXERCÍCIO E SISTEMA IMUNE
O corpo humano evidencia uma série de respostas neuroendócrinas quando ameaçado, incluindo secreção de glicocorticoides e catecolaminas da glândula adrenal e supressão dos eixos gonadais, do hormônio do crescimento e tireoidiano (53).
Geralmente o estresse é considerado imunossupressor, no entanto, algumas evidências apontam que o estresse agudo, subagudo ou crônico pode suprimir a imunidade celular, mas, em contraste, incrementar a imunidade humoral (54). Ainda, o estresse crônico tem efeitos deletérios no cérebro e, em particular, na estrutura e função hipocampal levando a distúrbios cognitivos e de mudanças de humor (17).
Este fenótipo induzido pelo estresse mobiliza substratos energéticos endógenos e induz a um estado de resistência insulinêmica no fígado e no tecido musculoesquelético. Esta energia mobilizada será então estocada no tecido adiposo visceral pela combinação entre hipercortisolismo e hiperinsulinemia. Na atual sociedade industrializada, esta reação será prolongada e não estará relacionada a um aumento na demanda energética, levando à expressão clínica de comorbidades como obesidade central, HAS, dislipidemia e disfunção endotelial, todos componentes da SM e fatores de risco cardiometabólicos (53).
Devido a estes mecanismos, o sedentarismo tem sido identificado com um fator preditivo mais forte do que outros fatores de risco como HAS, hiperlipidemia, DMT2 e obesidade para morte e morbidade relacionadas a doenças metabólicas (55) e que está envolvido no desenvolvimento de diversas doenças metabólicas. Neste contexto, exercícios físicos regulares ofereceriam proteção contra as doenças ligadas ao sedentarismo (56-59).
tais como maratonas. Isto leva a uma “janela aberta” de disfunção imune que pode
durar de três a 72 horas dependendo da medida (60).
Está bem documentado que os efeitos do exercício no sistema imune são mediados pelos hormônios do estresse e seus moduladores. Os efeitos cumulativos do estresse causado pelo exercício se manifestam em nível celular ameaçando a homeostase proteica (61). Esses efeitos são modulados pelo tempo de exposição ao fator estressante, pela controlabilidade percebida do fator estressante, pela medida de resposta imune e pelo estado fisiológico do organismo (62).
Robson-Ansley e colaboradores (2007) investigaram as relações entre níveis plasmáticos de IL-6, fontes e sintomas de estresse e o sistema imune inato em resposta a um período agudo de treinamento de corrida em atletas altamente treinados. O IL-6 plasmático e a atividade da creatina quinase foram elevados após o treino intensificado. A função dos neutrófilos foi reduzida, embora sua contagem, junto com a contagem total de leucócitos, tenha permanecido a mesma. Os níveis de cortisol plasmático e da imunoglobulina A salivar não mudaram e houve uma piora nos sintomas de estresse mesmo sem mudanças nas fontes estressoras durante a fase de treino intensa. Os pesquisadores concluíram que um período agudo de treinamento intensificado pode induzir a uma supressão do sistema imune inato e causar elevações crônicas de IL-6 (63).
Além disso, exercícios de curta duração e alta intensidade podem levar a uma prolongada e significante disfunção energética mitocondrial que é acompanhada pelo aumento da propensão a apoptose e aumento em mediadores pró-inflamatórios (64) e até redução na elasticidade de pequenas artérias (65).
1.4. EXERCÍCIO FÍSICO COMO PREVENÇÃO E TERAPÊUTICA
Como foi anteriormente mencionado, o exercício físico pode modular a expressão tanto de citocinas pró-inflamatórias quanto anti-inflamatórias (68). Estes efeitos opostos sugerem que o programa de exercícios físicos deve ser muito bem planejado, levando em conta as características individuais de forma a explorar seu papel positivo na prevenção e na terapêutica de doenças que tenham sua patogênese relacionada à inflamação sistêmica crônica.
Uma redução no percentual de gordura, na pressão arterial sistêmica e uma melhoria nos perfis lipídicos parecem ocorrer com ou sem perda de peso. Roberts e colaboradores (2007) estudaram os efeitos do exercício aeróbico de intensidade moderada em conjunto com mudanças nutricionais em alguns fatores de risco mais importantes para aterogênese. Encontraram evidências de que modificações no estilo de vida, com a inclusão de atividade física regular, por exemplo, podem provocar: 1) melhora nos perfis lipídicos e metabólicos, 2) redução no estresse oxidativo e aumento no óxido nítrico, 3) diminuição na inflamação, 4) redução na ativação de plaquetas e células endoteliais, 5) redução na adesão de monócitos e na atividade químico atrativa em monócitos e 6) diminuição de metaloproteinase 9 (MMP-9), um biomarcador de desestabilização plaquetária (69).
Além da redução dos fatores de risco cardiovascular gerais, o exercício físico regular pode exercer uma ação anti-inflamatória através de mecanismos que incluem a ativação do sistema nervoso parassimpático, do eixo hipotalâmico- pituitário-adrenal, efeitos diretos na pressão arterial (72) e ainda uma possível influência através do co-ativador transcricional PGC1α (73).
Kullo e colaboradores (2007) investigaram se biomarcadores inflamatórios, como IL-6, e reagentes de fase aguda, como CRP e fibrinogênio, além da contagem de células brancas, estavam associadas com VO2Máx em homens assintomáticos. Após ajustes com IMC, risco de DAC e outras variáveis de estilo de vida, os autores encontraram que os biomarcadores testados apresentaram uma relação inversa com VO2Máx (74). Uma possível razão foi estudada por Vieira e colaboradores (2007), que examinaram os efeitos do tônus parassimpático, avaliado pela medida de frequência cardíaca de recuperação (FCR) após o exercício, em níveis de CRP em 132 participantes. Foi encontrado que a FCR pós-exercício parece estar independentemente associada com menores níveis de CRP em indivíduos adultos sedentários, sugerindo que o sistema nervoso parassimpático exerce alguma influência na regulação da inflamação sistêmica crônica em adultos de mais idade (75).
2. JUSTIFICATIVA
A importância da atividade física na prevenção de doenças crônicas tem sido analisada por diversos estudos. Existe uma grande quantidade de informações geradas por estudos epidemiológicos e de coortes prospectivos sugerindo que doenças crônicas estejam fortemente associadas à inatividade física (3, 39, 56, 83). Exercícios de intensidade moderada e que envolvam grandes grupamentos musculares podem melhorar os perfis lipídicos e como consequência reduzir riscos de DAC (84).
Porém, os protocolos de treinamento físico variam dependendo do resultado esperado e lidam com variáveis como intensidade, duração e tipo de exercício utilizado. Aumentos na massa muscular, melhorias na captação e transporte de oxigênio aos grupamentos musculares ativos e aumentos na concentração mitocondrial poderiam atuar em conjunto para diminuir os sinais inflamatórios e de estresse associados ao exercício, como hipóxia, acidose e aumentos na temperatura central (85-87). No entanto, processos inflamatórios podem ser iniciados pelos desafios metabólicos impostos ao corpo humano, causados pelos estresses térmicos, bioquímicos e mecânicos do exercício. Por exemplo, neutrófilos se infiltram nos tecidos microlesionados após o exercício agudo (88). Estas células possuem funções específicas e inespecíficas no sistema imune. Podem causar ainda mais danos ao tecido de forma isolada, ou como sequela de outros danos teciduais. Neste ponto, pode-se inferir que limitar a ação dos neutrófilos seja benéfico, porém estas células também estão relacionadas ao início da regeneração tecidual. Embora alcançar um equilíbrio terapêutico entre inflamação e reparo seja importante, o papel duplo dos neutrófilos e, posteriormente, macrófagos cria um paradoxo fisiológico aos protocolos que tenham como objetivo a melhoria do condicionamento físico limitando a resposta inflamatória (88).
adaptações cardiorrespiratórias centrais quanto as periféricas, permitindo melhoras funcionais importantes (89, 90). Investigações comparando TI e treinamento contínuo com trabalhos mecânicos e duração idênticos garantiram melhorias no VO2Máx e no duplo produto. Porém, o TI parece estar relacionado a uma melhor cinética de consumo de oxigênio e na capacidade oxidativa das mitocôndrias musculares (91).
Com tantas variáveis em cena, a prescrição dos exercícios físicos como terapia deve se basear no entendimento dos riscos e benefícios da maneira mais completa possível, como um fármaco. Somente assim, o regime ideal de exercícios físicos pode ser alcançado. Neste contexto, um maior entendimento das relações entre a atividade física e os biomarcadores inflamatórios pode ser útil não apenas no contexto da fisiologia do exercício, mas também para esclarecer o papel do exercício físico nos processos inflamatórios que parecem estar por trás do mecanismo molecular que conecta o aumento do tecido adiposo às comorbidades associadas à obesidade (92-94).
3. OBJETIVOS
3.1. OBJETIVO GERAL
O presente estudo teve por objetivo principal investigar as relações entre biomarcadores inflamatórios e programas de exercícios físicos em mulheres com distúrbios metabólicos.
3.2. OBJETIVOS ESPECÍFICOS
a) Pesquisar criticamente o corpo de evidências a respeito da relação entre o exercício físico e a inflamação sistêmica crônica.
b) Elucidar a resposta de biomarcadores inflamatórios aos programas de exercícios físicos avaliados.
4. MÉTODOS
4.1. DELINEAMENTO DA PESQUISA
O presente estudo foi uma Revisão Sistemática (RS) que representa uma
“estratégia científica para limitar viés na coleta sistemática, na avaliação crítica e na
síntese de todos os estudos relevantes sobre determinado tópico” (95). A revisão
sistemática é de vital importância para aqueles que pretendem embasar suas decisões terapêuticas na melhor evidência científica disponível (96) e representa o grau mais elevado de validade e confiabilidade científica (97).
4.2. FONTES DE DADOS
Os dados foram coletados de acordo com as normas descritas pela Colaboração Cochrane em seu manual (98). As etapas da pesquisa foram as seguintes: a) formulação da pergunta de pesquisa onde se definem os participantes, a intervenção utilizada, o grupo controle e o desfecho desejado; b) a localização e a seleção dos estudos; c) avaliação crítica dos estudos; d) coleta dos dados contidos nos estudos selecionados; e) análise e apresentação dos dados; f) interpretação dos dados.
4.3. SELEÇÃO DOS ESTUDOS
treinamento intervalado, reabilitação cardíaca e gerenciamento/modificação terapêutica de estilo de vida.
Ensaios clínicos randomizados e não randomizados publicados em periódicos indexados foram incluídos se atingissem os seguintes critérios: ter como desfecho primário ou secundário medidas de biomarcadores pró ou anti-inflamatórios em mulheres saudáveis ou não, ter analisado atividade física ou gerenciamento terapêutico de estilo de vida para desordens metabólicas. Estudos observacionais não foram incluídos.
Foram excluídos estudos com animais, intervenções farmacológicas, estudos com participantes do sexo masculino, crianças ou adolescentes. Além disso, foram excluídos artigos que tivessem valores inferiores a três na escala PEDro (Physiotherapy Evidence Database). A escala PEDro é uma medida de avaliação da qualidade metodológica baseada na Delphi List desenvolvida por Verhagen e colaboradores (99). Outras variáveis consideradas para exclusão de estudos foram: falta de descrição adequada sobre supervisão das sessões de exercícios, dos protocolos de gerenciamento terapêutico de estilo de vida ou das sessões agudas de exercício, relato inadequado da modalidade ou método de exercício empregado como intervenção ou métodos inadequados para as análises dos biomarcadores inflamatórios.
4.3.1. Avaliação crítica dos estudos
4.4. EXTRAÇÃO DOS DADOS
5. ARTIGO PRODUZIDO
O artigo Different types of physical activity on inflammatory biomarkers in women with or without metabolic disorders: a systematic review foi publicado no periodico Women & Health que possui fator de impacto 1.0 e QUALIS B2 (em atualização) da CAPES para Medicina II.
02-Mar-2013
Dear Professor Soares:
Ref: DIFFERENT TYPES OF PHYSICAL ACTIVITY ON INFLAMMATORY BIOMARKERS IN WOMEN WITH OR WITHOUT METABOLIC DISORDERS: A SYSTEMATIC REVIEW
Our referees have now considered your paper and have recommended publication in Women & Health. We are pleased to accept your paper with the changes tracked in the attached version, which will now be forwarded to the publisher for copy editing and typesetting.
You will receive proofs for checking, and instructions for transfer of copyright in due course.
The publisher also requests that proofs are checked and returned within 48 hours of receipt.
Thank you for your contribution to Women & Health and we look forward to receiving further submissions from you.
Sincerely,
Dr. Ellen Gold
Editor in Chief, Women & Health womenandhealth@ucdavis.edu
6. COMENTÁRIOS, CRÍTICAS E CONCLUSÕES
Inicialmente o projeto de pesquisa iria englobar a medição de marcadores metabólicos, de estresse e de inflamação em resposta ao exercício aeróbico e neuromuscular agudos em mulheres entre 18 e 45 anos de idade portadoras da SM. Para execução deste projeto, no entanto, seria necessária a implantação de uma sala de exercícios físicos nas dependências do Hospital Universitário Onofre Lopes (HUOL). Embora tenha existido um grande esforço de pessoas como o Prof. Dr. George Dantas, de seu orientando na época Prof. Dr. Eduardo Caldas e da orientadora deste trabalho, a Dra. Maria Bernardete, não foi possível esta implantação. Esta situação gerou um obstáculo metodológico que impediu a execução do projeto inicial.
Paralelamente, como as atividades de revisão da literatura estavam em andamento, observou-se a oportunidade de preparar um artigo de revisão sistemática ( RS) nesta área que iria contribuir para sistematizar as bases teóricas do conhecimento. Este foi o artigo aceito para publicação. Devido à proximidade da data limite para o término do prazo final para conclusão do mestrado, e a constatação da importância de trabalhos de revisão, foi decidido que o projeto inicial seria modificado e incrementado com novas variáveis e seria desenvolvido plenamente no curso de doutorado em fluxo contínuo, situação esta prevista no Regimento do Curso de Pós-graduação em Ciências da Saúde.
Esta adequação metodológica está em total concordância com o projeto inicial pelo fato de buscar responder a mesma questão, porém, com um maior número de procedimentos. Destacam-se as mensurações do cortisol plasmático, de dano muscular e de outras variáveis hematológicas e metabólicas, em resposta ao exercício aeróbico agudo, com intensidade imposta e autosselecionada.
É importante ressaltar também a grande evolução intelectual nesta trajetória da realização do curso de mestrado, não apenas devido ao aumento nos conhecimentos acerca do papel dos exercícios físicos como terapia, mas, também, sobre o conhecimento de métodos de desenvolver e de aplicar os princípios da saúde baseada em evidências (SBE), tão conhecidos e valorizados na medicina, na área de Educação Física.
Estes conhecimentos melhoraram muito a atividade docente e de orientação em pesquisa, exercida nos cursos de Bacharelado e de Licenciatura em Educação Física no Centro Universitário do Rio Grande do Norte (UNI-RN). Como exemplo, a produção e execução do Mini-Curso intitulado Revisões Sistemáticas Cochrane, ministrado no XI Congresso de Iniciação Científica do UNI-RN no ano de 2012.
Ainda, as modificações metodológicas descritas anteriormente levaram ao desenvolvimento de um projeto de estudo mais amplo que está em execução e que continuará na expectativa do doutorado em fluxo contínuo que deverá ser iniciado imediatamente após a conclusão do mestrado, neste mesmo programa.
7. REFERÊNCIAS
1. Murray CJ, Lopez AD. Global mortality, disability, and the contribution of risk factors: Global Burden of Disease Study. Lancet. 1997;349(9063):1436-42.
2. Yach D, Hawkes C, Gould CL, Hofman KJ. The global burden of chronic diseases: overcoming impediments to prevention and control. Jama. 2004;291(21):2616-22.
3. Booth FW, Chakravarthy MV, Spangenburg EE. Exercise and gene expression: physiological regulation of the human genome through physical activity. The Journal of physiology. 2002;543(Pt 2):399-411.
4. Ottaviani E, Valensin S, Franceschi C. The neuro-immunological interface in an evolutionary perspective: the dynamic relationship between effector and recognition systems. Front Biosci. 1998;3:d431-5.
5. Commins SP, Borish L, Steinke JW. Immunologic messenger molecules: cytokines, interferons, and chemokines. The Journal of allergy and clinical immunology. 2010;125(2 Suppl 2):S53-72. Epub 2009/11/26.
6. Black PH. The inflammatory response is an integral part of the stress response: Implications for atherosclerosis, insulin resistance, type II diabetes and metabolic syndrome X. Brain Behav Immun. 2003;17(5):350-64.
7. Black PH. The inflammatory consequences of psychologic stress: relationship to insulin resistance, obesity, atherosclerosis and diabetes mellitus, type II. Med Hypotheses. 2006;67(4):879-91.
8. Fernandez-Real JM, Ferri MJ, Vendrell J, Ricart W. Burden of infection and fat mass in healthy middle-aged men. Obesity (Silver Spring). 2007;15(1):245-52.
9. Calza S, Decarli A, Ferraroni M. Obesity and prevalence of chronic diseases in the 1999-2000 Italian National Health Survey. BMC Public Health. 2008;8:140.
10. Ford ES, Zhao G, Li C, Pearson WS, Mokdad AH. Trends in obesity and abdominal obesity among hypertensive and nonhypertensive adults in the United States. Am J Hypertens. 2008;21(10):1124-8.
11. Patel SB, Reams GP, Spear RM, Freeman RH, Villarreal D. Leptin: linking obesity, the metabolic syndrome, and cardiovascular disease. Curr Hypertens Rep. 2008;10(2):131-7.
13. Pontiroli AE, Frige F, Paganelli M, Folli F. In morbid obesity, metabolic abnormalities and adhesion molecules correlate with visceral fat, not with subcutaneous fat: effect of weight loss through surgery. Obes Surg. 2008.
14. Trevisan M, Bahsas FB, Menotti A. Syndrome X and mortality: a population-based study. Risk factor and life expectancy research group. Am J Epidemiol. 1998;148:958-66.
15. Malik S, Wong ND, Franklin SS, Kamath TV, L'Italien GJ, Pio JR, et al. Impact of the metabolic syndrome on mortality from coronary heart disease, cardiovascular disease, and all causes in United States adults. Circulation. 2004;110:1245-50.
16. Garruti G, Cotecchia S, Giampetruzzi F, Giorgino F, Giorgino R. Neuroendocrine deregulation of food intake, adipose tissue and the gastrointestinal system in obesity and metabolic syndrome. J Gastrointestin Liver Dis. 2008;17(2):193-8.
17. Mujica-Parodi LR, Renelique R, Taylor MK. Higher body fat percentage is associated with increased cortisol reactivity and impaired cognitive resilience in response to acute emotional stress. Int J Obes (Lond). 2009;33(1):157-65. Epub 2008/11/19.
18. Sempere L, Martinez J, de Madaria E, Lozano B, Sanchez-Paya J, Jover R, et al. Obesity and fat distribution imply a greater systemic inflammatory response and a worse prognosis in acute pancreatitis. Pancreatology. 2008;8(3):257-64.
19. Diego VP, Rainwater DL, Wang XL, Cole SA, Curran JE, Johnson MP, et al. Genotype x adiposity interaction linkage analyses reveal a locus on chromosome 1 for lipoprotein-associated phospholipase A2, a marker of inflammation and oxidative stress. Am J Hum Genet. 2007;80(1):168-77.
20. Lavie CJ, Milani RV, Ventura HO. Untangling the heavy cardiovascular burden of obesity. Nat Clin Pract Cardiovasc Med. 2008;5(7):428-9.
21. Heilbronn LK, Campbell LV. Adipose tissue macrophages, low grade inflammation and insulin resistance in human obesity. Curr Pharm Des. 2008;14(12):1225-30.
22. Goossens GH. The role of adipose tissue dysfunction in the pathogenesis of obesity-related insulin resistance. Physiol Behav. 2008;94(2):206-18.
24. Creely SJ, McTernan PG, Kusminski CM, Fisher M, Da Silva NF, Khanolkar M, et al. Lipopolysaccharide activates an innate immune system response in human adipose tissue in obesity and type 2 diabetes. American journal of physiology Endocrinology and metabolism. 2007;292(3):E740-7.
25. Old LJ. Tumor necrosis factor (TNF). Science. 1985;230(4726):630-2. Epub 1985/11/08.
26. Shirai T, Yamaguchi H, Ito H, Todd CW, Wallace RB. Cloning and expression in Escherichia coli of the gene for human tumour necrosis factor. Nature. 1985;313(6005):803-6. Epub 1985/02/06.
27. Kriegler M, Perez C, DeFay K, Albert I, Lu SD. A novel form of TNF/cachectin is a cell surface cytotoxic transmembrane protein: ramifications for the complex physiology of TNF. Cell. 1988;53(1):45-53. Epub 1988/04/08.
28. Koerner A, Kratzsch J, Kiess W. Adipocytokines: leptin--the classical, resistin--the controversical, adiponectin--resistin--the promising, and more to come. Best practice & research Clinical endocrinology & metabolism. 2005;19(4):525-46. Epub 2005/11/29. 29. Tisdale MJ. Cancer anorexia and cachexia. Nutrition. 2001;17(5):438-42. Epub 2001/05/30.
30. Wray CJ, Mammen JM, Hasselgren PO. Catabolic response to stress and potential benefits of nutrition support. Nutrition. 2002;18(11-12):971-7. Epub 2002/11/15.
31. Chaney SG. Macronutrientes: efeitos metabólicos e implicações para a saúde. In: Devlin TM, editor. Manual de bioquímica com correlações clínicas. São paulo: Blucher; 2011. p. 1252.
32. Field FJ, Watt K, Mathur SN. TNF-alpha decreases ABCA1 expression and attenuates HDL cholesterol efflux in the human intestinal cell line Caco-2. Journal of lipid research. 2010;51(6):1407-15. Epub 2010/01/28.
33. Hotamisligil GS, Peraldi P, Budavari A, Ellis R, White MF, Spiegelman BM. IRS-1-mediated inhibition of insulin receptor tyrosine kinase activity in TNF-alpha- and obesity-induced insulin resistance. Science. 1996;271(5249):665-8. Epub 1996/02/02.
35. Andus T, Geiger T, Hirano T, Northoff H, Ganter U, Bauer J, et al. Recombinant human B cell stimulatory factor 2 (BSF-2/IFN-beta 2) regulates beta-fibrinogen and albumin mRNA levels in Fao-9 cells. FEBS letters. 1987;221(1):18-22. Epub 1987/08/31.
36. Romano M, Sironi M, Toniatti C, Polentarutti N, Fruscella P, Ghezzi P, et al. Role of IL-6 and its soluble receptor in induction of chemokines and leukocyte recruitment. Immunity. 1997;6(3):315-25. Epub 1997/03/01.
37. Febbraio MA, Pedersen BK. Contraction-induced myokine production and release: is skeletal muscle an endocrine organ? Exercise and sport sciences reviews. 2005;33(3):114-9. Epub 2005/07/12.
38. Hiscock N, Chan MH, Bisucci T, Darby IA, Febbraio MA. Skeletal myocytes are a source of interleukin-6 mRNA expression and protein release during contraction: evidence of fiber type specificity. FASEB journal : official publication of the Federation of American Societies for Experimental Biology. 2004;18(9):992-4. Epub 2004/04/03.
39. Petersen AM, Pedersen BK. The anti-inflammatory effect of exercise. J Appl Physiol. 2005;98(4):1154-62.
40. Mohamed-Ali V, Goodrick S, Rawesh A, Katz DR, Miles JM, Yudkin JS, et al. Subcutaneous adipose tissue releases interleukin-6, but not tumor necrosis factor-alpha, in vivo. The Journal of clinical endocrinology and metabolism. 1997;82(12):4196-200. Epub 1997/12/17.
41. Lyngso D, Simonsen L, Bulow J. Interleukin-6 production in human subcutaneous abdominal adipose tissue: the effect of exercise. The Journal of physiology. 2002;543(Pt 1):373-8. Epub 2002/08/16.
42. Kern PA, Ranganathan S, Li C, Wood L, Ranganathan G. Adipose tissue tumor necrosis factor and interleukin-6 expression in human obesity and insulin resistance. American journal of physiology Endocrinology and metabolism. 2001;280(5):E745-51. Epub 2001/04/05.
43. Tillett WS, Francis T. Serological Reactions in Pneumonia with a Non-Protein Somatic Fraction of Pneumococcus. The Journal of experimental medicine. 1930;52(4):561-71. Epub 1930/09/30.
Protein and Its Differentiation from Normal Blood Proteins. The Journal of experimental medicine. 1941;73(2):191-200. Epub 1941/01/31.
45. Macleod CM, Avery OT. The Occurrence during Acute Infections of a Protein Not Normally Present in the Blood : Ii. Isolation and Properties of the Reactive Protein. The Journal of experimental medicine. 1941;73(2):183-90. Epub 1941/01/31. 46. Abernethy TJ, Avery OT. The Occurrence during Acute Infections of a Protein Not Normally Present in the Blood : I. Distribution of the Reactive Protein in Patients' Sera and the Effect of Calcium on the Flocculation Reaction with C Polysaccharide of Pneumococcus. The Journal of experimental medicine. 1941;73(2):173-82. Epub 1941/01/31.
47. Pepys MB, Dash AC, Fletcher TC, Richardson N, Munn EA, Feinstein A. Analogues in other mammals and in fish of human plasma proteins, C-reactive protein and amyloid P component. Nature. 1978;273(5658):168-70. Epub 1978/05/11.
48. Volanakis JE, Kaplan MH. Specificity of C-reactive protein for choline phosphate residues of pneumococcal C-polysaccharide. Proceedings of the Society for Experimental Biology and Medicine Society for Experimental Biology and Medicine. 1971;136(2):612-4. Epub 1971/02/01.
49. Kushner I, Rzewnicki D, Samols D. What does minor elevation of C-reactive protein signify? The American journal of medicine. 2006;119(2):166 e17-28. Epub 2006/01/31.
50. Hutchinson WL, Noble GE, Hawkins PN, Pepys MB. The pentraxins, C-reactive protein and serum amyloid P component, are cleared and catabolized by hepatocytes in vivo. The Journal of clinical investigation. 1994;94(4):1390-6. Epub 1994/10/01.
51. Vigushin DM, Pepys MB, Hawkins PN. Metabolic and scintigraphic studies of radioiodinated human C-reactive protein in health and disease. The Journal of clinical investigation. 1993;91(4):1351-7. Epub 1993/04/01.
52. Calabro P, Chang DW, Willerson JT, Yeh ET. Release of C-reactive protein in response to inflammatory cytokines by human adipocytes: linking obesity to vascular inflammation. Journal of the American College of Cardiology. 2005;46(6):1112-3. Epub 2005/09/20.
54. Elenkov IJ, Chrousos GP. Stress hormones, Th1/Th2 patterns, pro/anti-inflammatory cytokines and susceptibility to disease. Trends Endocrinol Metab. 1999;10(9):359-68.
55. Myers J, Kaykha A, George S, Abella J, Zaheer N, Lear S, et al. Fitness versus physical activity patterns in predicting mortality in men. The American journal of medicine. 2004;117(12):912-8.
56. Hilberg T. Physical activity in the prevention of cardiovascular diseases. Epidemiology and mechanisms. Hamostaseologie. 2008;28(1-2):9-12, 4-5. Korperliche Aktivitat in der Pravention kardiovaskularer Erkrankungen. Epidemiologie und Mechanismen.
57. Silva TS, Longui CA, Faria CD, Rocha MN, Melo MR, Faria TG, et al. Impact of prolonged physical training on the pituitary glucocorticoid sensitivity determined by very low dose intravenous dexamethasone suppression test. Horm Metab Res. 2008;40(10):718-21.
58. Skilton MR, Sieveking DP, Harmer JA, Franklin J, Loughnan G, Nakhla S, et al. The effects of obesity and non-pharmacological weight loss on vascular and ventricular function and structure. Diabetes Obes Metab. 2008;10(10):874-84.
59. Smith DT, Carr LJ, Dorozynski C, Gomashe C. Internet-delivered lifestyle physical activity intervention: limited inflammation and antioxidant capacity efficacy in overweight adults. J Appl Physiol. 2008;106(1):49-56.
60. Nieman DC. Marathon training and immune function. Sports Med. 2007;37(4-5):412-5.
61. Whitham M, Fortes MB. Heat shock protein 72: release and biological significance during exercise. Front Biosci. 2008;13:1328-39.
62. Stranahan AM, Lee K, Mattson MP. Central mechanisms of HPA axis regulation by voluntary exercise. Neuromolecular Med. 2008;10(2):118-27.
63. Robson-Ansley PJ, Blannin A, Gleeson M. Elevated plasma interleukin-6 levels in trained male triathletes following an acute period of intense interval training. Eur J Appl Physiol. 2007;99(4):353-60.
well-trained cadets during three days extreme physical load: a pilot study. Physiol Meas. 2008;29(4):429-37.
66. Campbell JE, Rakhshani N, Fediuc S, Bruni S, Riddell MC. Voluntary wheel running initially increases adrenal sensitivity to adrenocorticotrophic hormone, which is attenuated with long-term training. J Appl Physiol. 2009;106(1):66-72. Epub 2008/11/15.
67. Sasse SK, Greenwood BN, Masini CV, Nyhuis TJ, Fleshner M, Day HE, et al. Chronic voluntary wheel running facilitates corticosterone response habituation to repeated audiogenic stress exposure in male rats. Stress. 2008;11(6):425-37. Epub 2008/12/10.
68. Pedersen BK, Toft AD. Effects of exercise on lymphocytes and cytokines. Br J Sports Med. 2000;34(4):246-51.
69. Roberts CK, Won D, Pruthi S, Kurtovic S, Sindhu RK, Vaziri ND, et al. Effect of a short-term diet and exercise intervention on oxidative stress, inflammation, MMP-9, and monocyte chemotactic activity in men with metabolic syndrome factors. J Appl Physiol. 2006;100:1657-65.
70. Nojima H, Watanabe H, Yamane K, Kitahara Y, Sekikawa K, Yamamoto H, et al. Effect of aerobic exercise training on oxidative stress in patients with type 2 diabetes mellitus. Metabolism. 2008;57(2):170-6.
71. Kim MK, Tomita T, Kim MJ, Sasai H, Maeda S, Tanaka K. Aerobic exercise training reduces epicardial fat in obese men. J Appl Physiol. 2008.
72. Edwards KM, Ziegler MG, Mills PJ. The potential anti-inflammatory benefits of improving physical fitness in hypertension. J Hypertens. 2007;25(8):1533-42.
73. Handschin C, Spiegelman BM. The role of exercise and PGC1alpha in inflammation and chronic disease. Nature. 2008;454(7203):463-9. Epub 2008/07/25. 74. Kullo IJ, Khaleghi M, Hensrud DD. Markers of inflammation are inversely associated with VO2 max in asymptomatic men. J Appl Physiol. 2007;102(4):1374-9. 75. Vieira VJ, Valentine RJ, McAuley E, Evans E, Woods JA. Independent relationship between heart rate recovery and C-reactive protein in older adults. J Am Geriatr Soc. 2007;55(5):747-51.
77. Aronson D, Avizohar O, Levy Y, Bartha P, Jacob G, Markiewicz W. Factor analysis of risk variables associated with low-grade inflammation. Atherosclerosis. 2008;200(1):206-12.
78. Artham SM, Lavie CJ, Milani RV, Ventura HO. The obesity paradox: impact of obesity on the prevalence and prognosis of cardiovascular diseases. Postgrad Med. 2008;120(2):34-41.
79. Bradley RL, Jeon JY, Liu FF, Maratos-Flier E. Voluntary exercise improves insulin sensitivity and adipose tissue inflammation in diet-induced obese mice. American journal of physiology Endocrinology and metabolism. 2008;295(3):E586-94. Epub 2008/06/26.
80. Keylock KT, Vieira VJ, Wallig MA, DiPietro LA, Schrementi M, Woods JA. Exercise accelerates cutaneous wound healing and decreases wound inflammation in aged mice. Am J Physiol Regul Integr Comp Physiol. 2008;294(1):R179-84.
81. Hoffman-Goetz L, Spagnuolo PA, Guan J. Repeated exercise in mice alters expression of IL-10 and TNF-alpha in intestinal lymphocytes. Brain Behav Immun. 2008;22(2):195-9.
82. Glund S, Krook A. Role of interleukin-6 signalling in glucose and lipid metabolism. Acta Physiol (Oxf). 2008;192(1):37-48.
83. Booth F, Roberts CK. Linking performance and chronic disease risk: indices of physical performance are surrogates for health. Br J Sports Med. 2008;42:950-2. 84. Helge JW, Damsgaard R, Overgaard K, Andersen JL, Donsmark M, Dyrskog SE, et al. Low-intensity training dissociates metabolic from aerobic fitness. Scand J Med Sci Sports. 2008;18(1):86-94.
85. Cooper DM, Radom-Aizik S, Schwindt CD, Zaldivar F. Dangerous Exercise --Lessons Learned from Dysregulated Inflammatory Responses to Physical Activity. J Appl Physiol. 2007.
86. Tjonna AE, Lee SJ, Rognmo O, Stolen TO, Bye A, Haram PM, et al. Aerobic interval training versus continuous moderate exercise as a treatment for the metabolic syndrome: a pilot study. Circulation. 2008;118(4):346-54.
88. Butterfield TA, Best TM, Merrick MA. The dual roles of neutrophils and macrophages in inflammation: a critical balance between tissue damage and repair. J Athl Train. 2006;41(4):457-65.
89. Schjerve IE, Tyldum GA, Tjonna AE, Stolen T, Loennechen JP, Hansen HE, et al. Both aerobic endurance and strength training programmes improve cardiovascular health in obese adults. Clin Sci (Lond). 2008;115(9):283-93.
90. Tambalis KD, Panagiotakos DB, Kavouras SA, Sidossis LS. Responses of blood lipids to aerobic, resistance, and combined aerobic with resistance exercise training: a systematic review of current evidence. Angiology. 2008.
91. Daussin FN, Zoll J, Dufour SP, Ponsot E, Lonsdorfer-Wolf E, Doutreleau S, et al. Effect of interval versus continuous training on cardiorespiratory and mitochondrial functions: relationship to aerobic performance improvements in sedentary subjects. Am J Physiol Regul Integr Comp Physiol. 2008;295(1):R264-72.
92. Lacasa D, Taleb S, Keophiphath M, Miranville A, Clement K. Macrophage-secreted factors impair human adipogenesis: involvement of proinflammatory state in preadipocytes. Endocrinology. 2007;148(2):868-77.
93. Lazar MA. How obesity causes diabetes: not a tall tale. Science. 2005;307(5708):373-5.
94. Bengmark S. Impact of nutrition on ageing and disease. Curr Opin Clin Nutr Metab Care. 2006;9(1):2-7.
95. Meta-Análise e Revisão Sistemática [database on the Internet]. Atheneu. 2010.
96. Clarke M, Horton R. Bringing it all together: Lancet-Cochrane collaborate on systematic reviews. Lancet. 2001;357(9270):1728.
97. Guyatt GH, Sackett DL, Sinclair JC, Hayward R, Cook DJ, Cook RJ. Users' guides to the medical literature. IX. A method for grading health care recommendations. Evidence-Based Medicine Working Group. Jama. 1995;274(22):1800-4.
98. Higgins JPT, Green S. Cochrane Handbook for Systematic Reviews of Interventions. Version 5.1.0 [updated March 2011] ed: The Cochrane Collaboration; 2011. Disponível em: www.cochrane-handbook.org.
[Internet]. 1998 J Clin Epidemiol; 51:[1235-41 pp.]. Available from: http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?cmd=Retrieve&db=PubMed&dopt=Cita tion&list_uids=10086815
APÊNDICE 1 – FICHA DE EXTRAÇÃO DOS DADOS
IDENTIFICAÇÃO DO ARTIGO
(autores, título, periódico, ano, volume, número e página)
MÉTODOS
Sequência de alocação Ocultação de alocação Cegamento
Características do controle Cálculo do tamanho da amostra
Número de participantes randomizados
Perdas amostrais
Análise da intenção de tratar Similaridades entre os grupos
PARTICIPANTES
Critérios de inclusão Critérios de exclusão Características
(idade [média e desvio padrão], gênero, etnicidade, outras)
INTERVENÇÃO
Intervenção no grupo experimental
(número de participantes, tipo de exercício, intensidade, volume, duração, outras)
Intervenção do grupo controle
(número de participantes, tipo de exercício, intensidade, volume, duração, outras)
MEDIDAS DE DESFECHOS
Redução de biomarcadores inflamatórios
Redução de peso
Redução de outras variáveis Aumento no condicionamento aeróbico
Aumento no condicionamento neuromuscular
Aderência ao tratamento Duração do follow-up
IDENTIFICAÇÃO DE VIESES E LIMITAÇÕES
APÊNDICE 2 – DADOS SUPLEMENTARES
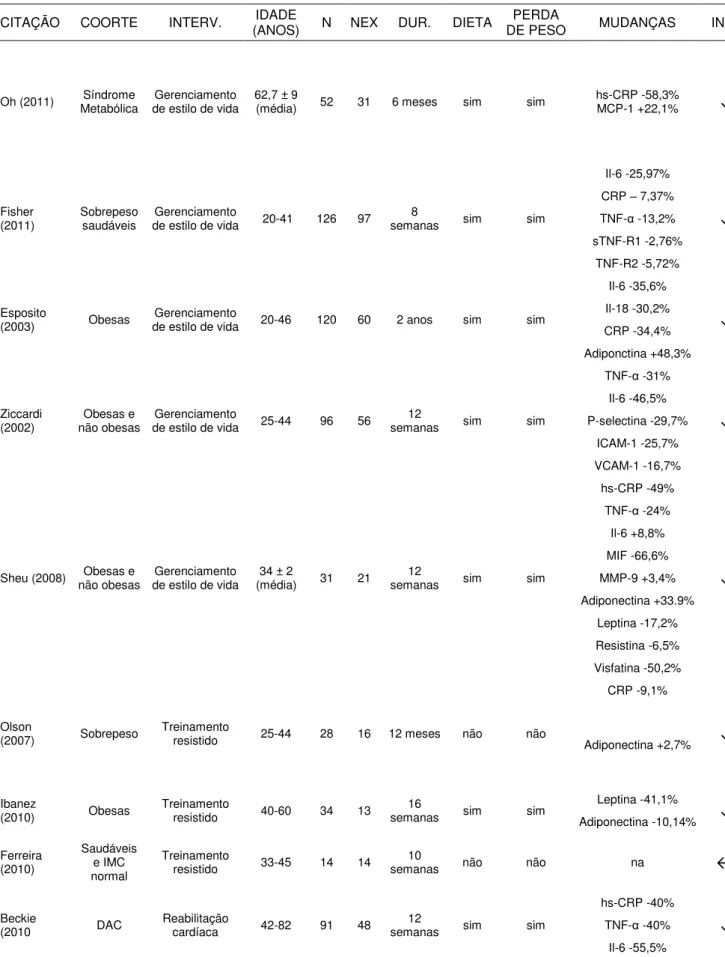
TABELA 3 – Detalhes das citações incluídas (dados atualizados e corrigidos)
CITAÇÃO COORTE INTERV. (ANOS) IDADE N NEX DUR. DIETA DE PESO PERDA MUDANÇAS INFL.
Oh (2011) Metabólica Síndrome de estilo de vida Gerenciamento 62,7 ± 9 (média) 52 31 6 meses sim sim hs-CRP -58,3% MCP-1 +22,1% ↓
Fisher
(2011) Sobrepeso saudáveis de estilo de vida Gerenciamento 20-41 126 97 semanas 8 sim sim
Il-6 -25,97%
↓
CRP – 7,37% TNF-α -13,2% sTNF-R1 -2,76%
TNF-R2 -5,72%
Esposito
(2003) Obesas de estilo de vida Gerenciamento 20-46 120 60 2 anos sim sim
Il-6 -35,6% ↓ Il-18 -30,2% CRP -34,4% Adiponctina +48,3% Ziccardi
(2002) não obesas Obesas e de estilo de vida Gerenciamento 25-44 96 56 semanas 12 sim sim
TNF-α -31% ↓ Il-6 -46,5% P-selectina -29,7% ICAM-1 -25,7% VCAM-1 -16,7%
Sheu (2008) não obesas Obesas e de estilo de vida Gerenciamento (média) 34 ± 2 31 21 semanas 12 sim sim
hs-CRP -49% ↓ TNF-α -24% Il-6 +8,8% MIF -66,6% MMP-9 +3,4% Adiponectina +33.9% Leptina -17,2% Resistina -6,5% Visfatina -50,2% Olson
(2007) Sobrepeso Treinamento resistido 25-44 28 16 12 meses não não
CRP -9,1%
↓
Adiponectina +2,7%
Ibanez
(2010) Obesas Treinamento resistido 40-60 34 13 semanas 16 sim sim
Leptina -41,1% ↓ Adiponectina -10,14% Ferreira (2010) Saudáveis e IMC normal Treinamento
resistido 33-45 14 14 semanas 10 não não na ↔
Beckie
(2010 DAC Reabilitação cardíaca 42-82 91 48 semanas 12 sim sim
hs-CRP -40%
↓
ICAM-1 -15%
Giraldo
(2009) Saudáveis aeróbico agudo Exercício 20-24 30 30 1 sessão não na
55% VO2Máx
↑
IFN-g +67,9% Il-1 +39%
Il-2 -10,5% Il-4 +46,5% Il-6 +60% Il-12 +11%
70% VO2Máx
IFN-g +117% Il-1 +24,7%
Il-2 -12,1% Il-4 -24,5% Il-6 +27% Il-12 +1,2%
Devries
(2008) não obesas Obesas e Treinamento aeróbico 20-50 24 23 semanas 12 não não na ↔
Polack
(2006) Obesas Treinamento aeróbico 40,4 ± 6,7 (média) 25 25 semanas 12 não sim Leptina -25,7% ↓
Hammet
(2006) Fumantes Treinamento aeróbico 18-65 152 88 semanas 12 não sim na ↔
Dvorakova-Lorenzova
(2006) Obesas
Treinamento
aeróbico 25-35 40 40 semanas 9 sim sim hsCRP -30% ↓
Okita (2004) Saudáveis Treinamento aeróbico 227 199 2 meses não sim CRP -34,9% ↓
Reed
(2010) Sobrepeso e normais Treinamento aeróbico 25-40 24 24 4 meses sim sim
Il-6 -23,1%
↓
Leptina -52,3%
IFN- -27,6%
Abreviações: INTERV., tipo de intervenção; N, número de participantes; Nex, número de participantes no grupo de
TABELA 4 – Mudanças percentuais comparativas entre estudos que isolaram exercício como única intervenção e estudos que incluíram dieta
INTERVENÇÃO DURAÇÃO Nex REDUÇÃO % BIOMARCADORES
Com dieta [76-85] 8 semanas até 2 anos 390 32,50%
Sem dieta [86-90] 10 semanas até 1 ano 365 17,40%