UNIVERSIDADE FEDERAL DE MINAS GERAIS
INSTITUTO DE CIÊNCIAS BIOLÓGICAS
DEPARTAMENTO DE BIOLOGIA GERAL
PROGRAMA DE PÓS-GRADUAÇÃO EM GENÉTICA
Tese de Doutorado
F
ILOGEOGRAFIA EE
VOLUÇÃO DET
RÊSE
SPÉCIESA
RBÓREASA
MPLAMENTED
ISTRIBUÍDAS NOC
ERRADO: Q
UALEA GRANDIFLORA, Q.
MULTIFLORA E
Q.
PARVIFLORA(V
OCHYSIACEAE)
Doutoranda: Renata Santiago de Oliveira Buzatti
Orientadora: Prof
a. Dr
a. Maria Bernadete Lovato
Coorientador: Prof. Dr. José Pires de Lemos-Filho
B
ELOH
ORIZONTERENATA SANTIAGO DE OLIVEIRA BUZATTI
F
ILOGEOGRAFIA EE
VOLUÇÃO DET
RÊSE
SPÉCIESA
RBÓREASA
MPLAMENTED
ISTRIBUÍDAS NOC
ERRADO: Q
UALEA GRANDIFLORA, Q.
MULTIFLORA E
Q.
PARVIFLORA(V
OCHYSIACEAE)
DEPTO. DE BIOLOGIA GERAL
INSTITUTO DE CIÊNCIAS BIOLÓGICAS
BELO HORIZONTE
2015
Tese apresentada ao Programa de Pós-graduação em Genética do Departamento de Biologia Geral do Instituto de Ciências Biológicas da Universidade Federal de Minas Gerais, como pré-requisito para obtenção do título de doutora em Genética.
Orientadora: Profª. Drª. Maria Bernadete Lovato
iii Agir, eis a inteligência verdadeira.
Serei o que quiser. Mas tenho que querer o que for.
O êxito está em ter êxito, e não em ter condições de êxito.
Condições de palácio tem qualquer terra larga,
mas onde estará o palácio se não o fizerem ali?
iv
v AGRADECIMENTOS
Agradeço à minha orientadora, Maria Bernadete Lovato, pela oportunidade de realizar o
doutorado no laboratório, pelo conhecimento compartilhado durante todo o processo e pela coleta
do material;
Agradeço ao meu coorientador, José Pires de Lemos-Filho, por todo o tempo dedicado ao
trabalho, pelas valiosas contribuições durante a escrita desta tese e por todo o esforço despendido
na realização das coletas;
Ao programa de pós graduação em Genética da UFMG que possibilitou a realização deste
doutorado;
Aos órgãos financiadores, CAPES pela concessão da minha bolsa e FAPEMIG pelo custeio do
projeto;
À todos do LBEM, LGEX, LGM e ao Juliano, pelos bons momentos compartilhados e pela
disponibilidade em ajudar;
Ao colegas do LDGH, por fazerem com que a nossa convivência não seja simplesmente por
dividirmos o espaço de trabalho. Vocês sempre foram muito atenciosos quando precisei e
conviver com cada um foi sempre muito agradável. Em especial agradeço ao Gil, à Moara, à
Marília e ao Thiago, pela ajuda com os softwares que às vezes travavam a minha caminhada;
Aos colegas do Genepop, com os quais compartilho ou compartilhei o dia-a-dia no laboratório
durante o mestrado e o doutorado: Helena, Rê Acácio, Rosangela, Jacque, Luciana, Mariana,
vi Andreia. Muito Obrigada por tudo! Em especial agradeço à Paula, por ter sido tão disponível em
ajudar com as dúvidas de inglês durante a escrita desta tese e por ter revisado os artigos ao final;
Às alunas de iniciação científica, que por algum período durante estes 4 anos se dedicaram para
que esse trabalho fosse concluído: Beatriz, Natália, Ana Emília e Aline;
À Priciane, à Moara e à Roxinha, que me acompanharam durante os 4 anos do doutorado,
agradeço imensamente pela amizade, pelas agradáveis e divertidas conversas, por dividir tanto as
angústias quanto os bons momentos e pela disponibilidade em ajudar: muito obrigada;
À querida Vilminha, por ter dividido comigo o seu conhecimento e ter pacientemente me dado
suporte durante o tempo no qual lecionei na UFMG e pelas palavras doces ditas em inúmeros
momentos difíceis;
Em especial, agradeço às pessoas que preenchem a minha vida e me estimulam a seguir: Meus
pais e Mateus, tão fundamentais, meus irmãos e meus sobrinhos queridos, Otávio, Lívia e Isabela.
A doce Flavinha, pelo carinho e pela boa vontade em ajudar sempre. A minha madrinha querida,
Tia Eneida. A todos os familiares que embora não citados, estão no meu coração. Aos amigos
vii SUMÁRIO
LISTA DE FIGURAS ...viii
LISTA DE TABELAS ...xi
APRESENTAÇÃO DA TESE ...1
RESUMO ...2
ABSTRACT ...4
I) INTRODUÇÃO I.1.OCERRADO I.1.1.CARACTERIZAÇÃO E ORIGEM ...6
I.1.2.MUDANÇAS CLIMÁTICAS DO QUATERNÁRIO E FILOGEOGRAFIA DO CERRADO ...8
I.1.3.OS ENCLAVES DE CERRADO NA AMAZÔNIA ...12
I.2.ESPÉCIES ESTUDADAS ...14
1.3.OBJETIVOS ...19
II) CAPÍTULOS CAPÍTULO 1 Artigo 1-Pleistocenic disjunctions between peripheral and central Cerrado: phylogeography and climatic niche modelling of two widely spread tree species ... 21
CAPÍTULO 2 Artigo 2 - Phylogeography of a tree species reveals Early/Middle Pleistocene connections between core Brazilian Cerrado and savannas of central Amazon ... 67
CAPÍTULO 3 Artigo 3 - Development of microsatellite markers in Qualea grandiflora (Vochysiaceae) and transferability to congeneric species, typical trees of the Brazilian savanna ... 105
III) CONCLUSÕES ...111
viii LISTA DE FIGURAS
INTRODUÇÃO
Figura 1 Qualea grandiflora com detalhes de flores e frutos ... 17
Figura 2Qualea multiflora com detalhes de flores e frutos ... 18
Figura 3 Qualea parviflora com detalhes de flores e frutos ... 18
ARTIGO 1
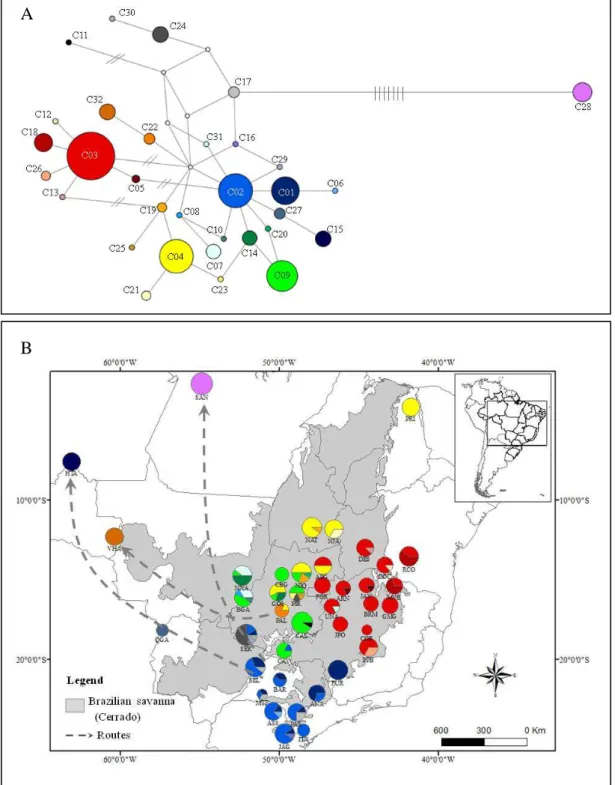
Figure 1. Geographic distribution of the cpDNA haplotypes across sampled area (A) and
median-joining network depicting the relationship between haplotypes in Q. multiflora based on
cpDNA regions (B). The map and network colors are equivalent and the size of the circles in (A)
and (B) are proportional to the number of individuals. Dashes in (B) represent the number of
mutations separating the haplotypes. Absence of dashes represents only one mutational step
between haplotypes (see Table S1 for details). ... 54
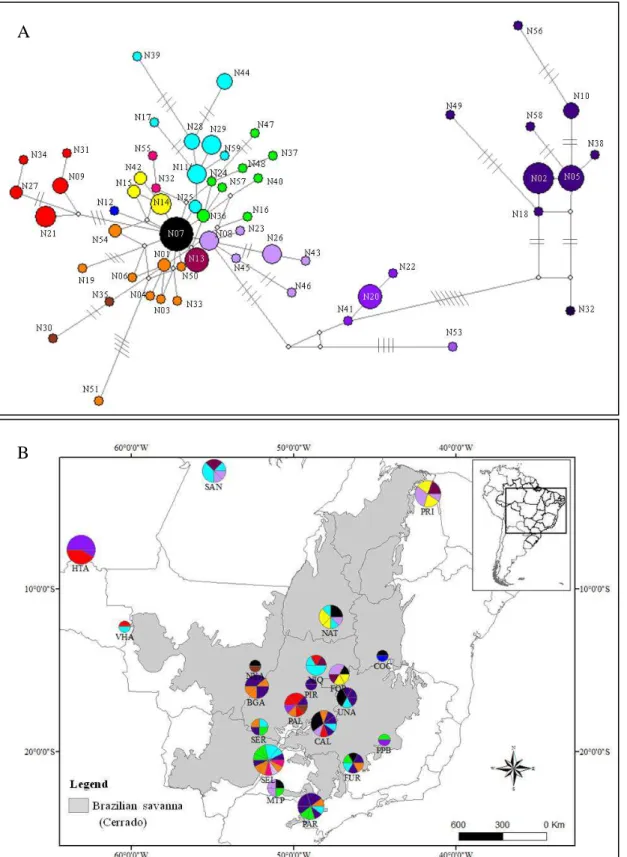
Figure 2. Geographic distribution of the cpDNA haplotypes across sampled area (A) and
median-joining network depicting the relationship between haplotypes in Q. parviflora based on
cpDNA regions (B). The map and network colors are equivalent and the size of the circles in (A)
and (B) are proportional to the number of individuals. Dashes in (B) represent the number of
mutations separating the haplotypes. Absence of dashes represents only one mutational step
between haplotypes (see Table S2 for details). ... 55
Figure 3. Phylogenetic relationship among haplotypes of congeneric species of Qualea.
Median-joining network showing the evolutionary relationship among the 36 haplotypes of Q. multifora
ix and Q. parviflora haplotypes. Dashes represent the number of mutation separating the haplotypes.
Absence of dashes represents only one mutational step between haplotypes. The size of each
circle is proportional to the number of individuals sampled. ... 56
Figure 4. Phylogenetic tree obtained from Bayesian-inference approach among 36 haplotypes of
Q. multiflora (initial capital letters M) and Q. parviflora (initial capital letters P) and two
haplotypes of Q. grandiflora (Qg). The time of split among the three species and among the
haplotypes of Q. multiflora e Q. parviflora are shown for two cpDNA mutation rates: one slow
(time scale in dark grey)and one fast (time scale in light grey), both in Ma. The bars in the tree
represent the time intervals between the smallest and the highest HPD 95% values based on slow
(dark grey) and fast (dark grey) rates recovered for bayesian skyline evolutionary model. The
bootstrap support are shown above the branches. ... 57
Figure 5. Result from population structure analyses of Q. multiflora populations and putative
barriers among them obtained with Monmonier's algorithm. ... 58
Figure 6. Predictions of suitable areas for the occurrence of tree species of Qualea multiflora and
Qualea parviflora under past and current environmental conditions: Last Interglacial (LIG. 120
ka); Last Glacial Maximum (LGM. 21 ka) and Current (0 ka pre-industrial). ... 59
ARTIGO 2
Figure 1. Median-joining network showing the relationships between haplotypes of Qualea
grandiflora based on concatenated cpDNA sequences (A) and geographic distribution of the
x size of the circles in (A) and (B) are proportional to the number of individuals. Dashes represent
the number of mutations separating the haplotypes. Absence of dashes represents only one
mutational step between haplotypes. ... 97
Figure 2. Median-joining network showing the relationships between haplotypes of Qualea
grandiflora based on nrDNA region (A) and geographic distribution of the nrDNA haplotypes
across sampled area (B). The network and map colors are equivalent and the size of the circles in
(A) and (B) are proportional to the number of individuals. Dashes represent the number of
mutations separating the haplotypes. Absence of dashes represents only one mutational step
between haplotypes. ... 98
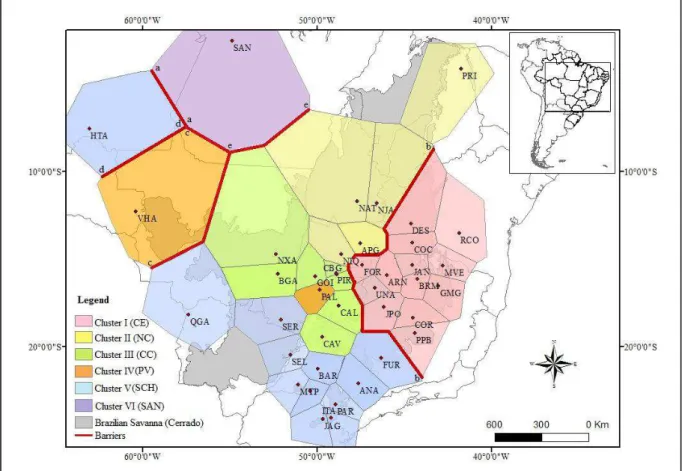
Figure 3. Population Population structure of Qualea grandiflora obtained from Spatial Molecular
Variance Analysis (SAMOVA) and putative barriers obtained with Monmonier’s algorithm
xi LISTA DE TABELAS
ARTIGO 1
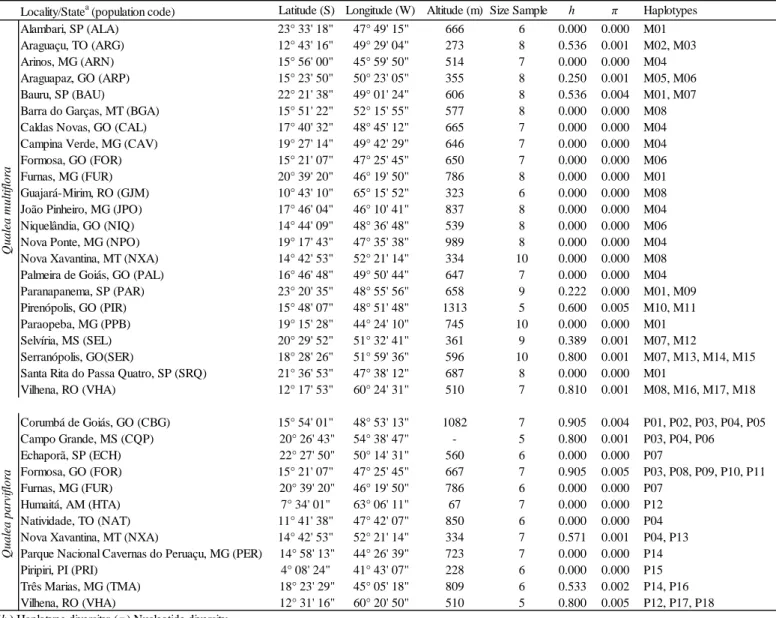
Table 1. Locations and diversity indices of 23 populations of Qualea multilora and 12 of Qualea
parviflora in the Brazilian savanna. ... 60
Table 2. Genetic diversity indices for the phylogeographic groups and all populations of Qualea
multiflora based on chloroplast DNA (cpDNA). ... 61
Table 3. Estimates of TMRCA (Ma) of the three sp (Qualea grandiflora, Q. multiflora and Q.
parviflora) and between two species (Q. multiflora and Q. parviflora) considering two
evolutionary models and slow (s: 1.01x10-3) and fast (f: 2.5x10-3) cpDNA mutation rates. ... 62
Table 4. Summary statistics and demographic and spatial expansion tests for Qualea parviflora
based on chloroplast DNA (cpDNA). ... 62
Table 5. Demographic and spatial analysis for phylogeographic groups and all populations of
Qualea multiflora based on chloroplast DNA (cpDNA). ... 63
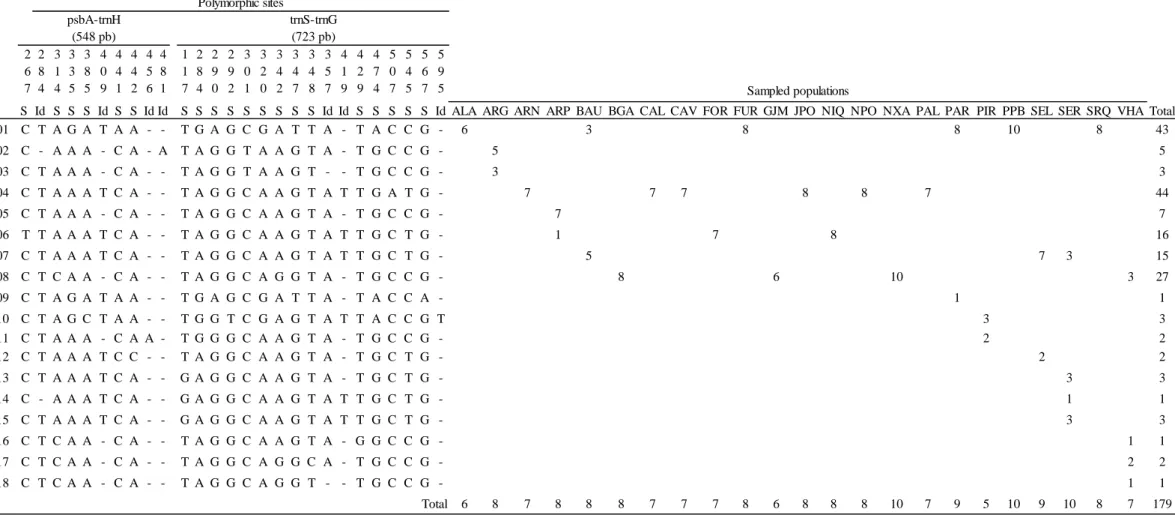
Table S1. Variable sites, distribution and frequency of 18 haplotypes generated from aligned
sequences of two regions of chloroplast DNA (cpDNA- psbA-trnH, trnS-trnG) for Qualea
multiflora. ... 64
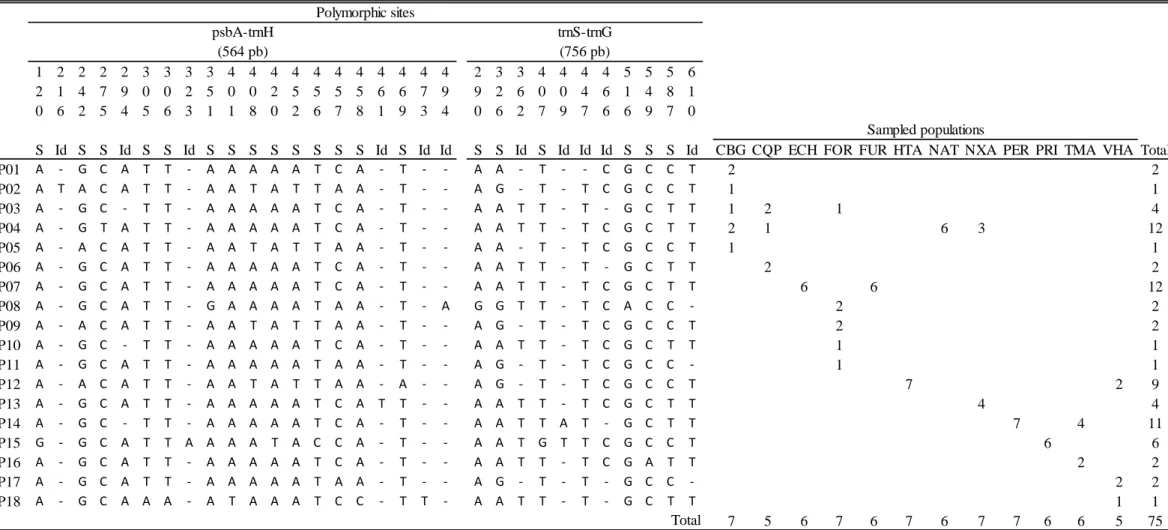
Table S2. Variable sites, distribution and frequency of 18 haplotypes generated from aligned
sequences of two regions of chloroplast DNA (cpDNA- psbA-trnH, trnS-trnG) for Qualea
parviflora. ... 65
Table S3. Fs statistics generated by Spatial Molecular Variance Analysis (SAMOVA) from
xii ARTIGO 2
Table 1. Locations of Qualea grandiflora populations in the Brazilian Cerrado biome, genetic
diversity indices and the distribution of the chloroplast DNA (cpDNA) and nuclear DNA
(nrDNA) haplotypes. ... 100
Table 2. Genetic diversity indices for the phylogeographic groups of Qualea grandiflora based
on chloroplast DNA (cpDNA) and for all populations based on cpDNA and nuclear DNA
(nrDNA) data. ... 102
Table 3. Mismatch distribution analysis (parameters of demographic and spatial expansion) for
phylogeographic groups of Qualea grandiflora based on chloroplast DNA (cpDNA) data and for
all population based on cpDNA and nuclear DNA (nrDNA) data. ... 103
Table S1 Fs statistics generated by Spatial Molecular Variance Analysis (SAMOVA) from
chloroplast DNA data for k (k = 2 until k = 9) groups. ... 104
ARTIGO 3
Table 1 Characterization of microsatellite loci in Qualea grandiflora, Q. multiflora and Q.
parviflora. ... 108
Table 2 Results of primer screening for ten microsatellite loci in two populations of Qualea
grandiflora. ... 108
Table 3 Results of primer screening for eight microsatellite loci in one populations of Qualea
1 APRESENTAÇÃO DA TESE
A tese é composta de uma introdução, subdividida em cinco tópicos, seguidos de três
capítulos redigidos no formato de artigo científico e ao final as conclusões. Os dois primeiros
artigos serão submetidos para publicação após a defesa desta tese e o terceiro já foi publicado. Os
tópicos introdutórios reúnem informações relevantes que embasam o conteúdo abordado nos
artigos apresentados, sendo apenas o primeiro tópico dividido em três subtópicos: (I.1) O Cerrado
abordando (I.1.1) Caracterização e origem, (I.1.2) Mudanças climáticas do Quaternário e
Filogeografia, (I.1.3) Os enclaves amazônicos; (I.2) Espécies estudadas; (I.4) Justificativa e (1.5)
Objetivos. Os capítulos foram intitulados: Artigo 1 - " Pleistocenic disjunctions between
peripheral and central Cerrado: phylogeography and climatic niche modelling of two widely
spread tree species"; Artigo 2 - " Phylogeography of a tree species reveals Early/Middle
Pleistocene connections between core Brazilian Cerrado and savannas of central Amazon";
Artigo 3 - "Development of microsatellite markers in Qualea grandiflora (Vochysiaceae) and
transferability to congeneric species, typical trees of the Brazilian savanna". Este terceiro trabalho
foi realizado com o intuito de fornecer novas ferramentas importantes para dar continuidade aos
estudos genéticos das três espécies de Qualea. Para Q. grandiflora um estudo de diversidade
genética utilizando estes marcadores e de morfologia de folhas está em andamento. Por fim são
2 RESUMO
O gênero Qualea é compreendido por aproximadamente 60 espécies, com uma
distribuição geográfica estendendo da América Central ao estado de Santa Catarina no Brasil.
Dentre estas espécies, Q. grandiflora, Q. multiflora e Q. parviflora são amplamente distribuídas
no Cerrado e destacam-se pela importância florística e fisionômica neste bioma. O Cerrado é a
maior e mais biodiversa savana tropical do mundo e está atualmente altamente ameaçada. Desse
modo, são prementes estudos que permitam melhorar a nossa compreensão dos fatores históricos
e evolutivos que moldaram esse bioma e a distribuição de sua diversidade. Os objetivos do
primeiro estudo foram investigar a história evolutiva de Q. multiflora e Q. parviflora através de
abordagem filogeográfica e de modelagem de nicho, buscando compreender as relações
filogenéticas e tempos de divergência no nível específico e de linhagens; avaliar a estruturação
genética em ambas as espécies e possíveis fatores que a moldaram e identificar possíveis
refúgios. Utilizando sequências plastidiais (cpDNA) foi encontrado que as mudanças climáticas
ocorridas durante o Pleistoceno podem ter desempenhado um importante papel na separação de
Q. multiflora e Q. parviflora e de suas linhagens. Uma clara estruturação foi obtida para ambas
espécies e a combinação dos resultados genéticos e de modelagem de nicho permitiram
identificar tanto um refúgio no core do bioma quanto outro pequenos refúgios não descritos
anteriormente. O segundo estudo objetivou, através de uma extensiva amostragem da espécies
arbórea mais comum do Cerrado Q. grandiflora, identificar possíveis conexões históricas entre o
core do bioma, as savanas Amazônicas e outras populações periféricas; verificar regiões de alta
diversidade que poderiam ter sido refúgio para a espécie; testar a hipótese de recolonização do sul
do Cerrado a partir de populações do norte após oscilações climáticas do Quaternário e estimar o
período no qual ocorreram conexões entre o core do Cerrado e os enclaves amazônicos. Para isto
3 diversidade na região central do core do bioma e expansão recente para ambos conjuntos de
dados. As relações filogenéticas obtidas com cpDNA revelaram conexões entre o core e as
savanas amazônicas. A primeira delas, localizada no centro do bioma, foi datada do início-meio
do Pleistoceno (1.8 - 0.74 Myr); a outra ocorreu através da Bolívia ligando sul do Cerrado e
sudeste da Amazônia e uma terceira, que sugere expansão a partir da região central do core do
bioma em direção à porção noroeste, em uma área de transição entre o Cerrado e a Floresta
Amazônica. O terceiro estudo foi realizado com o intuito de isolar marcadores microssatélites
para Q. grandiflora e caracterizá-los tanto para esta espécie quanto para Q. multiflora e Q.
parviflora. Esses marcadores apresentaram elevado número de alelos por locus e altos níveis de
4 ABSTRACT
The Qualea genus is comprised of approximately 60 species, with a geographic
distribution ranging from Central America to the state of Santa Catarina in Brazil. Among these
species, Q. grandiflora, Q. multiflora and Q. parviflora are widely distributed in the Cerrado and
stand out for their floristic and physiognomic importance in this biome. The Cerrado is the largest
and most biologically diverse tropical savanna in the world, and is currently highly threatened.
Thus the urgent need for studies that can improve our understanding of the historical and
evolutionary factors that shaped this biome and the distribution of its diversity. The aim of the
first study were to investigate the evolutionary history of Q. multiflora and Q. parviflora through
phylogeographic approach and niche modelling, trying to understand the phylogenetic
relationships and divergence times at both the species and lineage levels, to evaluate the genetic
structuring of both species and factors that possibly shaped it, and to identify possible refugia.
Using plastid sequences (cpDNA) was found that climatic changes during the Pleistocene may
have played an important role in the separation of Q. multiflora and Q. parviflora and their
lineages. A clear structuring was found for both species and the combination of genetic results
and niche modeling have identified a refugium in the core of the biome and other small refugia
not previously described. Our second study aimed, through extensive sampling of the most
common tree species in the Cerrado (Q. grandiflora), to identify possible historical connections
between the core of this biome, the Amazonian savannas and other peripheral populations; to
check for high diversity regions that could have been refugium for the species; to test the
hypothesis of recolonization of the southern Cerrado from northern populations after climatic
oscillations in the Quaternary, and to estimate the period in which there could have been
5 and nuclear sequences (nrDNA), for which found a high level of diversity in the central core of
the biome and a recent expansion was found for both datasets. The phylogenetic relationships
obtained with cpDNA revealed connections between the core and the Amazonian savannas. The
first one, located at the center of the biome, was dated from the Early-Middle Pleistocene (1.8 -
0.74 Ma); the other one, occurred through Bolivia, linking the southern Cerrado and southeastern
Amazon; and a third, which suggests expansion from the central core of the biome towards the
northwest portion, in an area of transition between the Cerrado and the Amazon rainforest. The
third study was carried out in order to isolate microsatellite markers for Q. grandiflora and
characterize them for this species as well for Q. multiflora and Q. parviflora. These markers
showed a high number of alleles per locus and high levels of heterozygosity, and they will be
6 I.INTRODUÇÃO
I.1.OCERRADO
I.1.1. CARACTERIZAÇÃO E ORIGEM
O Cerrado, savana tropical mais extensa e biodiversa do mundo, pode ser encontrado em
cerca de 22% do território brasileiro e em pequenas áreas da Bolívia e do Paraguai, ocupando
aproximadamente dois milhões de Km2 (Oliveira-Filho e Ratter 2002, Silva e Bates 2002). No
Brasil sua distribuição estende-se do sul da Floresta Amazônica até o norte do estado do Paraná,
sendo bastante coincidente com o Platô do Brasil Central (Oliveira-Filho e Ratter 2002). Pode ser
encontrado ainda como pequenas manchas disjuntas no interior da Floresta Amazônica (Eiten
1972). Esta distribuição entende-se por uma amplitude latitudinal de 3°S a 24°S, com altitudes
variando do nível do mar à aproximadamente 1.800 m (Oliveira-Filho e Ratter 2002). O bioma
forma, junto à Caatinga (nordeste do Brasil) e ao Chaco (Paraguai, Bolívia e Argentina), um
complexo corredor de vegetação aberta (Pennington et al. 2006). Este corredor é delimitado por
dois dos principais biomas de florestas tropicais da América do Sul: a Amazônia, ao nordeste, e a
Floresta Atlântica, ao sudeste.
No Cerrado ocorrem seis importantes bacias hidrográficas brasileiras: Amazônica,
Araguaia-Tocantins, Paraná-Paraguai, São Francisco, Atlântico Norte-Nordeste e Atlântico Leste
(Oliveira-Filho e Lima 2002). O solo é, em sua maioria, distrófico, bem drenado, profundo,
ácido, pobre em nutrientes e altamente saturado em alumínio e ferro, além de possuir cálcio e
magnésio (Furley e Ratter 1988, Scariot et al. 2005). O clima é caracterizado por estações secas
bem longas (abril a setembro), com precipitação em torno de 800 a 2000 mm e temperatura
7 topológicas e climáticas caracteriza o Cerrado e define variações fitofisionômicas de sua
vegetação. De acordo com Eiten (1972) e Silva e Bates (2002) são reconhecidos cinco tipos
estruturais principais de Cerrado: Cerradão, de maior densidade vegetacional, com árvores que
atingem até aproximadamente 15 m e formam um dossel contínuo; Cerrado stricto sensu, que
apresenta arbustos e árvores espaçados, com 5 a 8 m de altura, sem formação de dossel contínuo;
Campo Cerrado, constituído por um Cerrado aberto com poucas árvores de até 6 m; Campo Sujo,
composto por estrato gramíneo com arbustos de até 3 m distantes uns dos outros; e Campo
Limpo, onde predominam espécies herbáceas e ocorrem poucos ou nenhum arbusto ou árvore. As
diferenças da vegetação têm sido atribuídas principalmente à fertilidade e drenagem do solo, à
precipitação sazonal, aos regimes de fogo e ainda às oscilações climáticas do período Quaternário
(Eiten 1972, Furley e Ratter 1988, Oliveira-Filho e Ratter 1995, Furley 1999).
Considerado um dos mais importantes hotspots para a preservação da biodiversidade do
mundo, o Cerrado abriga aproximadamente 10.000 espécies de plantas, 161 espécies de
mamíferos, 837 espécies de aves, 120 espécies de répteis e 150 espécies de anfíbios (Myers et al.
2000). Entretanto, essa diversidade está ameaçada por ser pouco estudada e pelo crescimento das
atividades humanas. Estimativas apontam que mais da metade da cobertura vegetal nativa do
bioma já foi substituída por cultivos agrícolas e áreas de pastagem, com as taxas de
desmatamento podendo chegar a três milhões de hectares por ano (Machado 2004, Klink e
Machado 2005). O Cerrado, mesmo sendo um dos biomas mais ameaçados do continente
sul-americano, possui pouquíssimas áreas de preservação, que totalizam apenas 2,2% de seus
remanescentes (Myers et al. 2000, Klink e Machado 2005).
As poucas evidências fósseis documentadas indicam a presença de gramíneas típicas de
savana na América do Sul a partir do Terciário, sendo que durante o Neogeno, aproximadamente
8 passando a ocorrer em larga-escala (van der Hammen 1983, Gottsberger e
Silberbauer-Gottsberger 2006). Turcheto-Zolet et al. (2013), revisando estudos filogeográficos estimou que
43% da divergência de linhagens sul americanas ocorreu durante o Plioceno e/ou Mioceno e
57% ocorreu durante o Pleistoceno, sendo as oscilações climáticas deste período sugeridas como
fator determinante nesse processo de diversificação. Estimativas de tempo baseadas em estudos
filogenéticos sugerem que o início de sua diversificação ocorreu a menos que 10 milhões de anos,
sendo a maior parte desta diversificação coincidente com a origem de gramíneas do tipo C4 (4
milhões de anos ou menos - Jacobs et al. 1999, Simon et al. 2009). As gramíneas do tipo C4
diferenciam-se das plantas ancestrais (tipo C3) por serem bem adaptadas a ambientes quentes e
com escassez de CO2, tendo grande capacidade fotossintética sob estas condições (Ehleringer e
Björkman 1977). Durante períodos com elevadas quantidades de luz, calor e umidade, as
gramíneas C4 rapidamente acumulam biomassa e ao serem submetidas a extensos períodos secos
tornam-se inflamáveis (Scholes e Archer 1997, Bond e Keeley 2005). O fogo é um importante
fator na manutenção das áreas abertas características do Cerrado e várias espécies deste bioma
são bem adaptadas a ele (Bond e Keeley 2005, Gottsberger e Silberbauer-Gottsberger 2006). A
riqueza de espécies encontradas na América do Sul está fortemente ligada à eventos antigos como
vulcanismo, soerguimento de montanhas, mudança no curso de rios e flutuações climáticas do
Quaternário (Ratter et al. 1997, Rull 2011 e Turchetto-Zolet et al. 2013).
I.1.2.MUDANÇAS CLIMÁTICAS DO QUATERNÁRIO E FILOGEOGRAFIA DO CERRADO
O Quaternário é o período geológico iniciado há 2,58 milhões de anos (Ma) e se divide
em Pleistoceno, que terminou há 12.000 anos e Holoceno, período atual iniciado no fim do
Pleistoceno (Gibbard et al. 2010). Períodos glaciais e interglaciais alteraram a paisagem e
9 1996). De acordo com Hewitt (1996), no hemisfério sul os períodos glaciais foram menos
extensos que no norte, mas ainda assim ocorreram consideráveis alterações climáticas. As
mudanças paleoambientais na América tropical ainda são alvo de muitas discussões,
principalmente no que se refere à distribuição das formações vegetacionais durante o Quaternário
(Oliveira-Filho e Ratter 2002). Estudos palinologia, padrões de distribuição das espécies e
modelagem de nicho tem apontado que, em períodos nos quais o clima sul-americano tornou-se
mais seco e frio, as florestas úmidas perderam área em favor da expansão de formações abertas
(Behling e Lichte 1997, Behling 1998, Silva e Bates 2002, Werneck et al. 2012. Em relação à
dinâmica vegetacional do Cerrado, evidências palinológicas apontam que durante períodos
glaciais, em épocas nas quais a umidade e temperatura eram mais baixas, ocorreu uma expansão
deste bioma a leste, em direção ao Oceano Atlântico e ao norte (Behling e Lichte 1997, Behling
1998). Em contrapartida, a porção sul do bioma, ao sul de 20°S, teria sido substituída por
gramíneas subtropicais (Behling e Lichte 1997, Behling 1998). Essa dinâmica da distribuição do
Cerrado foi evidenciada em um estudo de modelagem de nichos, no qual Werneck et al. 2012
simularam ambientes adequados para a ocupação de espécies da ordem Squamata durante o
Último Interglacial (LIG - 120.000 anos atrás) e o Último Glacial Máximo (LGM - 21.000 anos
atrás) . Neste estudo os resultados apontaram área de estabilidade climática no centro-norte do
bioma, que seriam possível refúgio durante as glaciações. Essa área estável está associada às
áreas de alta diversidade de espécies do grupo no Cerrado (Werneck et al. 2012).
A abordagem filogeográfica tem sido utilizada no intuito investigar a distribuição das
espécies/populações num contexto geográfico e temporal, auxiliando na busca de respostas para
inúmeras questões evolutivas. A filogeografia objetiva relacionar linhagens genealógicas à
distribuição geográfica, baseando-se principalmente no estudo de genomas citoplasmáticos
10 história evolutiva das espécies, identificando eventos como expansões e retrações populacionais,
refúgios, rotas migratórias pós-glaciais, centros de diversidade, eventos de divergência,
hibridização e introgressão entre linhagens divergentes e zonas de contato secundário das
populações (Comes e Kadereit 1998, Hewitt 2001, Richardson et al. 2001, Ramos et al. 2007,
Beheregaray 2008, Ramos et al. 2009, Novaes et al. 2010). Beheregaray (2008) relatou, em uma
revisão que avaliou os 20 primeiros anos de existência da filogeografia (de 1987 a 2006), um
grande crescimento desta área de estudo, com aumento expressivo das publicações a partir de
1996. Classificando as publicações de acordo com a origem continental do organismo avaliado, a
Europa destaca-se como a mais estudada (31%), seguida da América do norte (30%).
Beheregaray (2008) evidencia que, embora a América do Sul seja considerada o continente mais
biodiverso da Terra, apenas 6,3% dos trabalhos avaliaram a dinâmica evolutiva de suas espécies.
Dentre estes, raros incluem espécies arbóreas do Cerrado (Collevatti et al. 2003, Ramos et al.
2007, Novaes et al. 2010, Collevatti et al. 2012, Novaes et al. 2013, Ribeiro et al. 2014).
Embora escassos, os resultados de estudos filogeográficos com espécies de plantas do
Cerrado tem mostrado a presença de uma clara estruturação dos haplótipos, atribuída
principalmente às mudanças climáticas do passado. Ramos et al. (2007) sugeriram que durante o
LGM as populações de Hymenaea stigonocarpa atualmente existentes no porção sul do Cerrado
se extinguiram. Somente após o restabelecimento de clima mais ameno esta região foi
recolonizada por linhagens mantidas no norte. Tais resultados corroboraram os encontrados para
a espécie do Cerrado Caryocar brasiliense (Collevatti et al. 2003). Para H. stigonocarpa, Ramos
et al. (2007) encontraram ainda uma disjunção longitudinal entre as populações estudadas. Tais
populações formaram três áreas geneticamente distintas, sendo uma delas composta por Bahia e
leste de Minas Gerais, outra pela porção oeste de Minas e a terceira por Goiás, Tocantins e São
11 porção centro-norte do estados de Minas Gerais e Goiás. Nestas regiões ocorreram 83% dos
haplótipos presentes em todas as áreas amostradas. Assim, sugeriu-se que a área é provavelmente
a mais antiga ocupada por Plathymenia reticulada, sendo um possível centro de diversidade da
espécie. Maior diversidade nas populações do norte de Minas Gerais e Goiás também foi
encontrada por Ramos et al. (2007). Estes resultados corroboram os descritos por Weneck et al.
(2012) no estudo de modelagem citado anteriormente, no qual a região central do core do
Cerrado foi apontada como possível refúgio por apresentar maior estabilidade durante as
oscilações climáticas no LIG e LGM. Collevatti e colaboradores (2012) avaliaram a
filogeografia de Tibuichina papyrus, uma espécie endêmica de campos rupestres. Este estudo
apresentou uma distribuição disjunta da espécie, proposta como provável reflexo de uma
contração em épocas frias e secas de populações que anteriormente eram amplamente
distribuídas. Em um estudo recente Novaes et al. (2013) encontraram uma estruturação
filogeográfica para a espécie arbórea de ampla distribuição Dalbergia miscolobim concordante
com províncias fitogeográficas descritas por Ratter et al. (2003) . Os resultados de Ratter et al.
(2003) foram obtidos a partir de dados de ocorrência de espécies de plantas e demonstraram que
o Cerrado, incluindo o core e as regiões disjuntas, delimitam grupos bem distintos. O core é
dividido em grupos oeste e leste, sendo este último subdividido em três grupos latitudinalmente
dispostos em norte, centro e sul (Ratter et al. 2003). Este padrão fitogeográfico foi atribuído
principalmente à estações secas e médias de temperatura, fertilidade e drenagem do solo, altitude
e oscilações climática do passado (Ratter et al. 2003). Além dos trabalhos de Ramos et al. (2007)
e Novaes et al. (2013), Ribeiro et al. (2014) também descreveram um padrão filogeográfico
longitudinal para Annona coriacea, dividindo o core do Cerrado em leste e oeste.
12 Fitofisionomias características do Cerrado podem ser observadas de forma disjunta tanto
em regiões limítrofes do bioma como em algumas áreas dentro da Floresta Amazônica (Eiten
1972). Estes enclaves de Cerrado, denominados Savanas Amazônicas, ocorrem nos estados do
Amazonas, Amapá, Pará, Rondônia e Roraima (Prance 1996, Ratter et al. 2003, IBGE 2004).
Eles possuem solo pobre e abrigam baixa diversidade em relação ao core do Cerrado, com
exceção de Alter do Chão (Pará) e um sítio localizado em Humaitá (Amazonas) (Ratter et al.
2003). Duas hipóteses biogeográficas distintas são propostas na tentativa de explicar a existência
dessas áreas disjuntas de Cerrado: a hipótese dispersiva e a hipótese vicariante. A hipótese
dispersiva se adequa principalmente às espécies com capacidade de dispersão a longas distâncias,
sendo a hipótese vicariante, de acordo com muitos estudos, a mais aplicável, uma vez que grande
similaridade biótica é observada entre enclaves e core do Cerrado (Sarmiento 1983, Silva e Bates
2002).
Segundo a hipótese vicariante, as Savanas Amazônicas podem representar remanescentes
de áreas alcançadas durante possíveis expansões da savana ocorridas no passado e que persistem
atualmente somente em regiões com características adequadas (Haffer 1967, Sarmiento 1983,
Prance 1996, Silva e Bates 2002). De acordo com Haffer (1969) durante Quaternário, em
períodos nos quais o clima foi extremamente frio e seco, grandes extensões da Floresta
Amazônica foram substituídas por savana ou outro tipo de vegetação similar. Desse modo
pequenos fragmentos de florestas teriam sido circundados por grandes extensões de vegetação
aberta. Entretanto, esta hipótese vicariante inicialmente aceita de forma ampla, denominada
Hipótese de Refúgios do Pleistoceno (PRH), tem sido alvo de muitas críticas e debates.
Colinvaux (1989) afirma que as conclusões que levaram à proposição desta hipótese não foram
baseadas em quaisquer dados paleopalinológicos. De acordo com Colinvaux et al. (2000) e Bush
13 modificações durante o Pleistoceno e a partir destes registros é improvável que a hipótese de
Haffer (1969) esteja correta. Por outro lado, Haffer e Prance (2001) e van der Hammen e
Hooghiemstra (2000) arguiram que os dados de pólen são insuficientes refutar a PRH para a
Amazônia como um todo, uma vez que foram obtidos a partir de pequenas áreas. Van der
Hammen e Hooghiemstra (2000) sugerem ainda que o curto espaço de tempo que os registros de
pólen representam (62.000 anos) não são suficientes para sugerir que refúgios jamais existiram.
Poucas evidências palinológicas corroboram a ideia de grande expansão do Cerrado na Amazônia
durante o LGM e no final do Pleistoceno (os últimos 18.000 – 50.000 anos) (Colinvaux et al.
1996, Colinvaux et al. 2001, Kastner e Goñi 2003), sendo assim não existem evidências que
apontam que esta expansão tenha ocorrido ou não durante períodos iniciais e intermediários do
Pleistoceno (Wüster et al. 2005).
Independente das controvérsias sobre a existência ou não de áreas mais extensas de
vegetação aberta substituindo áreas de Floresta Amazônica durante o Pleitoceno, existe a questão
das conexões florísticas entre os enclaves de Cerrado na Amazônia e o core do bioma. Haffer
(1967, 1974) e Webb (1991) propuseram três principais conexões entre o norte e o sul das regiões
savânicas: (1) Corredor Andino, ligando o bloco sul da savana diretamente com Lhanos e
Roraima, através dos Andes; (2) Corredor Central, que liga o bloco sul com alguns fragmentos
localizados no norte da Amazônia e (3) Corredor da Costa, que conecta os blocos do sul e norte
através de fragmentos de savana localizados próximo à costa Atlântica. A presença do corredor
Andino e do corredor da costa foi evidenciada pela padrão de distribuição de aves características
das savanas da América do Sul (Silva e Bates 2002). Estudos de paleomodelagem do Cerrado
realizado por Werneck et al. (2012) corroboraram a existência destes mesmos corredores e
14 Interglacial (LIG – cerca de 120.000 anos atrás). Estes três estudos não encontraram quaisquer
evidências de uma conexão através do centro, ou corredor central.
I.2.ESPÉCIES ESTUDADAS
Para os estudos desenvolvidos nesta tese foram selecionadas espécies características,
endêmicas e amplamente distribuídas no Cerrado, todas pertencentes ao gênero Qualea
(Vochysiacea): Q. grandiflora, Q. multiflora e Q. parviflora (Figuras 1, 2 e 3, respectivamente).
A família Vochysiaceae abrange seis gêneros e cerca de 200 espécies exclusivas de regiões
tropicais, distribuídas na região Guiano-Amazônica e no Planalto Central brasileiro e Floresta
Atlântica (Vianna 2006). As plantas pertencentes a essa família são acumuladoras de alumínio e
habitam solos pobres em minerais e com baixo pH (Shimizu 2009). O gênero Qualea, descrito
por Aublet em 1775, possui cerca de 60 espécies e é quase exclusivo de áreas tropicais ou
subtropicais da América do Sul, podendo ser encontrado da América Central ao estado de Santa
Catarina no Brasil, no Paraguai e na Bolívia (Stafleu 1953, species link). A maioria das espécies
ocorre na zona equatorial, predominantemente nas áreas montanhosas, em regiões de savanas do
escudo das Guianas (Lisboa 2000). Existem espécies de florestas pluviais e áreas alagáveis como
o Pantanal mato-grossense, embora em menor número (Lisboa 2000). As espécies possuem
folhas opostas, raramente verticiladas, pecioladas, com estípulas geralmente glandulosas, lâminas
simples e inteiras. As flores possuem uma única pétala e o fruto, capsular, libera várias sementes
aladas (Lisboa 2000). Q. grandiflora, Q. parviflora e Q. multiflora apresentam grande
importância florística e fisionômica no Cerrado, ocorrendo em mais que 50% dos sítios
amostrados do bioma (Ratter et al. 2003).
Q. grandiflora é popularmente conhecida como pau-terra, pau-terra-do-Cerrado ou ariauá
15 apresentando fissuras longitudinais, profundas e descamantes nos ramos terminais (Lorenzi 1992,
Shimizu 2009). As flores apresentam pétala amarela, a polinização é feita por mariposas e a
dispersão pelo vento (Shimizu 2009). Qualea grandiflora é a espécie lenhosa mais frequente no
Cerrado, presente em 85% desse bioma (Ratter et al. 2003). Possui registros de ocorrência em 16
estados brasileiros, incluindo aqueles da região norte que apresentam áreas disjuntas do Cerrado
(Acre, Amazonas, Bahia, Ceará, Distrito Federal, Goiás, Maranhão, Mato Grosso do Sul, Mato
Grosso, Minas Gerais, Pará, Piauí, Paraná, São Paulo, Tocantins, Rondônia) e também no
Paraguai, Bolívia e Peru (Shimizu 2009, Species link). Apresenta propriedades medicinais,
atuando no combate a úlceras gástricas, como analgésico e anticonvulsivo (Gaspi et al. 2006,
Hiruma-Lima et al. 2006).
Qualea multiflora, popularmente conhecida como pau-terra-liso ou pau-terra-do-campo,
atinge de 4 a 6 m de altura (Lorenzi 1992), possui flores brancas com linhas amarelas e manchas
rosadas, é polinizada por abelhas e dispersada pelo vento (Shimizu 2009). Pode ser diferenciada
das outras espécies do gênero por apresentar casca com fissuras horizontais e aspecto
aparentemente liso (Shimizu 2009). Esta espécie ocorre em aproximadamente 51% dos sítios
amostrados no Cerrado (Ratter et al. 2003) e possui registros de ocorrência no Distrito Federal,
Espírito Santo, Goiás, Maranhão, Minas Gerais, Mato Grosso do Sul, Mato Grosso, Pará, Paraná,
São Paulo, Tocantins, norte do Paraguai, leste da Bolívia e leste do Peru (Shimizu 2009, Species
link). De acordo com Souza et al. (1984), esta espécie apresenta compostos capazes de eliminar
tanto ovos quanto formas adultas de Schistosoma mansoni.
Qualea parviflora ou pau-terrinha, como é popularmente conhecida, é uma espécie de
altura entre 6-10 m (Lorenzi 1992), que apresenta caule com fissuras verticais, bem marcadas,
pequenas flores com pétala de cor violácea (Shimizu 2009). Sua polinização é feita por abelhas e
16 Cerrado, ocorrendo em 78% dos sítios amostrados do bioma (Ratter et al. 2003). A espécie foi
registrada no Amazonas, Bahia, Ceará, Distrito Federal, Goiás, Maranhão, Minas Gerais, Mato
Grosso do Sul, Pará, São Paulo, Tocantins, Bolívia e norte do Paraguai (Shimizu 2009, Species
link). Em estudos farmacológicos essa espécie demonstrou ter propriedades séptica,
anti-inflamatória, cicatrizante e adstringente (Silva et al. 2000).
A ampla distribuição destas três espécies as torna muito informativas em estudos
filogeográficos, auxiliando na compreensão de como processos históricos interferiram na
distribuição geográfica e na diversidade genética da flora do Cerrado. Tal conhecimento pode
ajudar, por exemplo, a prever possíveis respostas da vegetação à fragmentação e às atuais
mudanças climáticas globais e assim fornecer informações úteis para planos de manejo,
recuperação e/ou conservação mais efetivos do bioma. Apesar de terem sido realizados estudos
filogeográficos com algumas espécies de árvores nativas do Cerrado, o conhecimento de como as
flutuações climáticas passadas (como as que ocorreram no Pleistoceno) influenciaram os padrões
de variação genética deste bioma somente será alcançado quando um número maior de espécies
for analisado. O estudo realizado com Q. grandiflora, espécie arbórea mais representativa do
Cerrado e encontrada tanto no core do bioma quanto nas Savanas Amazônicas, trará importantes
contribuições sobre as controversas questões que envolvem a ocorrência dos enclaves de Cerrado
na Floresta Amazônica. A comparação destes três estudos genéticos, junto à paleomodelagem
climática realizada para Q. multiflora e Q. parviflora auxiliará tanto na verificação da ocorrência
de centros de diversidade genética e dos locais de linhagens raras já documentados para outras
17 Figura 1 – Qualea grandiflora com detalhes de flores e frutos
18 Figura 2 – Qualea multiflora com detalhes de flores e frutos
Figura 3 – Qualea parviflora com detalhes de flores e frutos
Harri Lorenzi Harri Lorenzi
Luciana Resende
19 I.3.OBJETIVOS
O presente trabalho analisou a filogeografia e a diversidade genética, isolou e caracterizou
marcadores moleculares de três espécies de Qualea (Vochysiaceae) amplamente distribuídas no
Cerrado, visando contribuir para o entendimento da evolução da flora do Cerrado e fornecer
subsídios para a sua conservação. Os seguintes objetivos foram propostos:
1) Investigar comparativamente a diversidade genética e estrutura filogeográfica de três
espécies de Qualea, Q. multiflora, Q. parviflora e Q. grandiflora;
2) Identificar, com base tanto no estudo filogeográfico quanto em modelagem de nicho, a
localização de possíveis refúgios de Q. multiflora e Q. parviflora, sob a hipótese de que por
apresentarem similares requerimentos ecológicos, áreas de alta diversidade genética e de
adequabilidade de nicho tendem a ser bastante coincidentes;
3) Identificar possíveis rotas de colonização de regiões que sofreram retrações
demográficas;
4) Testar a hipótese de divergência recente de linhagens de Q. multiflora e Q. parviflora,;
5) Investigar a demografia histórica das espécies;
6) Contribuir para o entendimento dos eventos que proporcionaram a ocorrência de
enclaves de Cerrado na Floresta Amazônica, identificando possíveis conexões entre o core do
20 7) Isolar e caracterizar marcadores microssatélites para Q. grandiflora e verificar a
aplicabilidade destes marcadores para Q. multiflora e Q. parviflora, fornecendo novas
21 II)CAPÍTULOS
CAPÍTULO 1
Artigo 1:
PLEISTOCENIC DISJUNCTIONS BETWEEN PERIPHERAL AND CENTRAL CERRADO:
PHYLOGEOGRAPHY AND CLIMATIC NICHE MODELLING OF TWO WIDELY SPREAD TREE
SPECIES
22 ORIGINAL ARTICLE
Pleistocenic disjunctions between peripheral and central Cerrado: phylogeography and
climatic niche modelling of two widely spread tree species
Renata Santiago de Oliveira Buzatti1, José Pires Lemos-Filho2, Marcelo Leonardo Bueno2,
Maria Bernadete Lovato1*
1
Universidade Federal de Minas Gerais, Departamento de Biologia Geral, Instituto de
Ciências Biológicas, Belo Horizonte, Brazil
2
Universidade Federal de Minas Gerais, Departamento de Botânica, Instituto de Ciências
Biológicas, Belo Horizonte, Brazil
*
corresponding author: Maria Bernadete Lovato, Universidade Federal de Minas Gerais, Belo
23 ABSTRACT
Aim Our aim was to investigate the evolutionary history of two species of the genus Qualea
using phylogeographic and niche modelling approaches in order to clarify species and
lineage-level relationships, divergence times and to identify putative refugia.
Location Brazilian Cerrado
Methods Two cpDNA regions (trnH-psbA and trnS-trnG) were sequenced for 175
individuals of Qualea multiflora and 75 individuals of Q. parviflora, sampled from 23 and 12
populations, respectively. Population genetic diversity, haplotype relationship using
Bayesian-inference and median-joining algorithm, structuring, putative barriers to gene flow
with Monmonier’s algorithm, and demographic history were verified. These species and
samples of Q. grandiflora were used to estimate the divergence time among species and
lineages using Bayesian approach. In addition, models to infer the palaeodistribution of Q.
multiflora and Q. parviflora in the Last Interglacial (LIG) and Last Glacial Maximum (LGM)
were produced via maximum entropy niche modelling methods.
Results A total of 18 haplotypes were found for each species and though none of them are
shared, some were genetically close. The central core area showed exclusive haplotypes and
high diversity, which decreased continuously from north to south and small areas not
documented in previous studies showed high diversity for Q. multiflora and Q. parviflora,
corroborating the results found with niche modelling. The mismatch distribution tests detected
demographic and spatial expansion for both species. Time to the Most Recent Common
Ancestor (TMRCA) among Q. grandiflora, Q. multiflora and Q. parviflora was estimated to
11.01 and 4.42 Ma whereas the TMRCA of Q. multiflora and Q. parviflora was dated to 3.5 -
1.4 Ma.
Main conclusions This study reveals ancient speciation of Q. grandiflora and more recent
24 changes, including Pleistocene climatic oscillations and the emergence of geographical
barriers may have played an important role in the differentiation process of these species and
their lineages. A clear structuring in both species was found. The combination of
phylogeographic, demographic history and niche modelling approaches points toward several
temporal disjunctions in the distribution of the species, which could have given rise to several
refugia during glacial times: a large one in the central Cerrado and other smaller ones,
geographically distant from the central core.
Keywords South America, Cerrado, evolution, biogeography, Vochysiaceae, Qualea
25 INTRODUCTION
The savannas are among the major biomes of the world, covering around 33 million
km2 of the Earth (Ramankutty & Foley, 1999; Sankaran et al., 2005). Among the tropical
savannas, the Cerrado stands out as the largest and richest one, and covers almost two million
km2 of Brazilian territory and parts of Bolivia and Paraguay (Simon et al., 2009). The Cerrado
harbors around 16,000 species, of which approximately 34% are endemic to the biome (Klink
& Machado, 2005), and the number of plant species is especially high (Klink & Machado,
2005). This biome is considered a conservation hotspot due its high diversity, endemism and
degree of threat (Myers et al., 2000). Despite its importance, more than 50% of its natural
vegetation has already been substituted by agriculture and cultivated pasture, with only 2.2%
of its extension under legal protection (Machado, 2004, Klink & Machado, 2005).
The Cerrado became established as a vegetation type during the Neogene (25 - 2 Ma)
(Gottsberger & Silberbauer-Gottsberger, 2006) and fully developed only after the rise of
flammable C4 grasslands about 4 Ma (Jacobs et al., 1999). The C4 grasslands leverage the
high availability of light during the hot, humid summers to rapidly accumulate biomass, and
become flammable during the long dry winters (Scholes & Archer, 1997; Bond & Keeley,
2005). Several species of flora endemic to the Cerrado are well adapted to fire (Gottsberger &
Silberbauer-Gottsberger, 2006), which is an important factor in maintaining the open areas
characteristic of the biome (Bond & Kelley, 2005). In a study about the Cerrado flora
evolution, Simon et al. (2009) highlighted the importance of fire and the expansion of
flammable grass in the diversification of this biome.
The timing and causes of diversification of Neotropical biomes has been the focus of
intense debate (Garzón-Orduña et al., 2014). Molecular phylogenetic studies dating
divergence times have showed that most of the lineage diversification occurred during the
26 rearrangements, such as the Andean uplift and shifts on the course of rivers are the main
drivers of diversification in Amazonia (Antonelli et al., 2009; Hoorn et al., 2010; Rull, 2011).
However, several authors have argued that estimates of diversification of lineages based on
crown group ages of major clades provide an overestimate of the timing of speciation (Rull,
2011; Ribas et al., 2012; Garzón-Orduña et al., 2014). Approaches based on diversification
time of sister species provide evidences about age of extant species (Garzón-Orduña et al.,
2014). Phylogeographic studies involving sister species can provide both time of
diversification between sister species and between intra-specific lineages. A recent review of
phylogeographic studies in South America (Turchetto-Zolet, 2013) revealed that 43% of
species lineage splits occurred during the Pliocene and/or Miocene, but for most of the species
(57%) the lineage divergences were dated to the Middle-Pleistocene, suggesting that climatic
fluctuations during the Pleistocene drove their diversification. The periods of diversification
of the Cerrado biota have not been very well studied so far. Simon et al. (2009), based on
time-calibrated phylogenies, suggested that the diversification of Cerrado plants started less
than 10 Ma, with most of it occurring approximately four Ma or later (Simon et al., 2009).
Pleistocene climatic fluctuations promoted changes in landscape occupation in tropical
South America. Based on palynological, geochemical and stable oxygen isotope data, Anhuf
et al. (2006) concluded that during the Last Glacial Maxima (LGM), the Amazon humid
forest area was reduced by 46% of its current extension. Using pollen records from south and
southeast Brazil, Behling (2002) suggested that during the LGM tropical semidecidous forest
and Cerrado were replaced by subtropical grassland that extended northwards over 750 km,
due to drier and colder climate in this area. Climatic modelling studies suggested a great
reduction of Cerrado area during the LGM and pointed toward the existence of a large
refugium in the center-north of the Cerrado (Werneck et al., 2012). This modelling study is
27 documented the existence of regions of high diversity in the central Cerrado core area
(Novaes et al., 2010, 2013), evidencing that this area was probably more stable during
Quaternary climatic fluctuations.
In this study, we assessed the geographic distribution of genealogical lineages of two
sister species, Qualea multiflora and Q. parviflora. The genus Qualea (Vochysiaceae family)
is composed of roughly 60 species that occur in Central and South America (Lisboa, 2000).
The studied species are typical components of the Cerrado, occurring respectively in 78% and
51% of the 376 sampled areas in a wide survey by Ratter et al. (2003). Their geographic
distribution ranges from the extreme south of the Cerrado (c. 24o S) to the extreme northeast
in ecotonal sites between dry vegetation (Caatinga) and savanna, including northern parts of
the biome in transition with the Amazon Forest, and also in the Amazonian savanna enclaves.
We performed a wide survey of these species, sampling populations in the core Cerrado and
northern and southern peripheral areas, and in the Occidental Amazonian savanna enclaves.
Due to the extensive sampling, the wide distribution of these species, and their close
relationship, we consider that phylogeographic data of them can be very informative to help
find answers to evolutionary questions about the Cerrado.
The present study using variation on cpDNA sequences and niche modelling was
conducted to test hypotheses and answer questions, which could shed light on the evolution of
the Cerrado. Based on the dating of lineage divergences in the South American
phylogeographic studies reviewed by Turchetto-Zolet et al. (2013), we hypothesize that
lineage divergences in Q. multiflora and Q. parviflora are recent, having most of them
occurred during the Pleistocene. Considering the close relationship between the species, their
similar wide distribution in the Cerrado and, thus, the sharing ecological requirements, we
hypothesize that the species would show similar genetic signatures shaped by past climatic
28 spatial localization of stability areas in the niche models, where they would show higher
genetic diversity. We also aimed to answer the following questions: (1) are the stability areas
located in the central Cerrado core, as suggested by the climatic modelling study (Werneck et
al., 2012) and phylogeographic data of other widely spread Cerrado trees (Novaes et al.,
2010, 2013)?; (2) would there be other stability areas to the north of the central core of the
Cerrado for the studied species? Considering that, to our knowledge, these northern areas
have not been sampled in phylogeographic studies with tree species from the Cerrado, we
predicted the existence of a refugium, which would be evidenced by niche modelling and high
levels of genetic diversity.
MATERIALS AND METHODS
Population sampling and DNA isolation
Thespecies used in this study are morphologically distinct and easily identified in the
field. The majority of material for DNA extraction was collected during the blooming period,
being this the main characteristic used to identify the species. Q. multiflora's flower has a
single white petal with yellow lines and pinkish dots in the central adaxial surface. These
flowers become slightly yellowish after pollination. Q. parviflora has small flowers with a
single violaceous petal, which has a central white line. When flowers are absent, the fruits
(which are scaly in Q. parviflora but not in Q. multiflora) and the trunk are used for correct
identification. The stem in Q. multiflora presents horizontal fissures and a smooth surface,
whereas in Q. parviflora it has vertical fissures and the bark is very thick (Shimizu, 2009).
Young leaves of 179 adult individuals were sampled from 23 populations of Q.
multiflora Mart., between latitudes 10° 43' and 23° 33' S and longitudes 44° 24' to 65° 15' W.
In Q. parviflora Mart., we sampled 75 adult individuals in 12 populations with latitudes
29 the sampling sites range from 273 to 1,313 m and from 67 to 1,082 m, for Q. multiflora and
Q. parviflora populations, respectively (Table 1). All samples were dried in silica gel and
stored at -20 °C. Voucher specimens of the collected populations, for both species, were
deposited in the Herbarium of the Departamento de Botânica of Universidade Federal de
Minas Gerais (BHCB). Total DNA was extracted using a modified CTAB (cetyl trimethyl
ammonium bromide) protocol (Doyle & Doyle, 1987). The quantity and quality of the DNA
were assessed by visualization on a 1% agarose gel and NanoDrop® spectrophotometer
(Thermo Scientific).
Plastid DNA amplification and sequencing
Polymerase chain reactions (PCR) were carried out in 25 μl final volume, containing
10 ng of template DNA, 1X PCR buffer [IC; Phoneutria; 2.0 mM of MgCl2, 10 mM Tris–
HCl (pH 8.4), 50 mM KCl, 0.1% Triton X-100], 0.2 ng of bovine serum albumin (BSA), 0.5
μg of each primer and 1 U Taq polymerase (Phoneutria). Amplification was performed using
Eppendorf thermocyclers under the following conditions: 94°C for 4 min, 29 cycles of
denaturation at 94°C for 1 min, annealing at 54°C (psbA-trnH; Azuma et al., 2001) and 56°C
(trnS-trnG; Hamilton, 1999) for 1 min and extension at 72°C for 2 min, and a final extension
at 72° for 7 min. The PCR products were visualized on 1% agarose gels stained with ethidium
bromide and purified with a polyethylene glycol (PEG 20%) precipitation protocol.
Sequencing was carried out using the ABI Big Dye version 3.1 terminators in an ABI3130XL
automated sequencer (Applied Biosystems, Foster City, CA).
Consensus sequences were assembled for each individual using the package
PHRED/PHRAP/CONSED (Ewing & Green, 1998; Ewing et al., 1998; Gordon et al., 1998).
30
et al., 2011) and edited manually to minimize software errors. The ends of the sequences were
removed due to low quality in some individuals, preserving only high confidence bases.
Phylogenetic and phylogeographic structure analyses
The cpDNA haplotypes were defined by analyzing sequences with DNAsp 5.10
(Librado & Rozas, 2009). All insertion/deletions (indels) were considered as fifth character
states and were coded as single mutations, regardless of their size. The relationship among the
three species (considering all lineages of Q. multiflora and Q. parviflora and two lineages of
Q. grandiflora, one of them considered as outgroup) was inferred using Bayesian-inference
(BI) approach implemented in MrBayes v.3.1.1 (Ronquist & Huelsenbeck, 2003). Two
simultaneous independent runs with four Markov chains were employed and monitored over
four million generations, under the GTR+I substitution model. This model was previously
selected using the Akaike Information Criterion (AIC - Kelchner & Thomas, 2007)
implemented in JModelTest v.2.1.5 5 (Darriba et al., 2012; Guidon & Gascuel, 2003). The
trees were sampled every 100 generations. The first 25% of all trees were discarded as
burn-in, and a majority-rule consensus tree was computed to obtain posterior probabilities (PP).
The final tree was visualized in Treeview v.1.6.6 (Page, 1996). In BI analysis, gaps were
considered as binary data. Additionally, intraspecific and interspecific relationships for Q.
multiflora and Q. parviflora were inferred by the construction of haplotype networks using
the median-joining (MJ) algorithm (Bandelt et al., 1999), implemented in the software
NETWORK 4.6.1.2 (fluxus-engineering.com).
Analyses of molecular variance (AMOVA) using pairwise differences to assess
population genetic structure in Q. multiflora and Q. parviflora based on cpDNA were
31 was employed to evaluate the relationship between genetic and geographic distances in both
species.
The best clustering for Q. multiflora and Q. parviflora was estimated with Bayesian
Analysis of Genetic Population Structure implemented in BAPS 6.0 (Corander et al., 2008)
and Spatial Molecular Variance Analysis performed by software SAMOVA (Dupanloup et
al., 2002). The BAPS analysis is performed considering each population as a single group and
using their respective geographical coordinates. SAMOVA defines the number (K) of groups
of population that are geographically homogeneous and maximally differentiated from each
other, using AMOVA approach and the geographic coordinates of each population. Different
K groups are simulated (herein, up to K = 8) and three F statistic tests (FSC, FST, FCT) are performed. The best value of K corresponds to the highest value of FCT (differentiation among
groups) in which no group is composed of a single population (according Huertz et al., 2004).
Putative barriers to gene flow were identified using Monmonier maximum difference
algorithm (Monmonier, 1973), implemented in BARRIER 2.2 (Manni & Guérard, 2004).
After defining the groups, diversity indices were estimated considering all populations
together for both species and each group delimited by BAPS and SAMOVA for Q. multiflora.
The number of groups was also estimated for Q. parviflora, but SAMOVA isolated one group
formed by a single population in the first run (i.e. when divided into two groups). Thus no
groups or barriers were considered for this species. Nucleotide diversity (π) and haplotype (h)
diversity were calculated using Arlequin ver. 3.5 (Excoffier et al., 2005) for each population
in both species and allelic richness after rarefaction was estimated only for Q. multiflora using
Contrib software (Petit et al., 1998). The rarefaction is used to correct for sample size (N),
standardizing allelic richness to the smallest N in a comparison (Petit et al., 1998). After