i
RENORBIO
Programa de Pós-Graduação em Biotecnologia
Desenvolvimento de Nanosistemas Farmacêuticos para
Terapia Gênica
Lourna Mafra Verissimo
Natal
–
RN
ii
RENORBIO
Programa de Pós-Graduação em Biotecnologia
Desenvolvimento de Nanosistemas Farmacêuticos para
Terapia Gênica
Tese de Doutorado apresentada ao Programa de
Pós-Graduação em Biotecnologia - PPG-B,
Área de concentração: Biotecnologia em Saúde
Lourena Mafra Verissimo
Orientador: Eryvaldo Sócrates Tabosa do Egito
iii
LOURENA MAFRA VERISSIMO
Desenvolvimento de Nanosistemas Farmacêuticos para Terapia Gênica
Defesa de Tese apresentada a Rede Nordeste de Biotecnologia (RENORBIO) para obtenção
do título de Doutor em Biotecnologia.
Área de Concentração: Biotecnologia em Saúde
Aprovada em 14 de março de 2011 por:
Presidente: Prof. Dr. Eryvaldo Sócrates Tabosa do Egito Rede Nordeste de Biotecnologia (RENORBIO)/ UFRN
_____________________________________
Vice-presidente: Prof a. Dr.a Lucymara Fassarela Agnez Lima Rede Nordeste de Biotecnologia (RENORBIO)/ UFRN
____________________________________
1 Examinador: Prof. Dr. Elias Fattal Université Paris Sud XI
____________________________________
2 Examinador: Prof. Dr. Helder Teixeira Universidade Federal do Rio Grande do Sul
____________________________________
3 Examinador: Prof. Dr. Matheus Freitas Universidade Federal do Rio Grande do Norte
____________________________________
4 Examinador: Profa. Dra. Selma Maria Bezerra Jeronimo Rede Nordeste de Biotecnologia (RENORBIO)/ UFRN
iv SUMÁRIO
1.0 INTRODUÇÃO... 2
2.0 REVISÃO DA LITERA TURA ...5
2.1 Terapia Gênica ...5
2.2 Vetores não virais ...7
2.2.1 Lipossomas...12
2.2.2 Nanoemulsões ... 15
3.0 REFERÊNCIAS BIBLIOGRÁFICAS...22
4.0 ARTIGOS DERIVADOS DA TESE... 30
4.1 PHARMACEUTICAL EMULSIONS: A NEW APPROACH FOR GENE THERAPY ... 32
ABSTRACT... 33
INTRODUCTION...34
GENE DELIVERY SYSTEMS ... 36
Viral vectors ...36
Nonviral vectors... 37
The drawbacks of liposomes ... 39
The use of pharmaceutical emulsions, nanoemulsions, and microemulsions ...41
CONCLUDING REMARKS ... 45
REFERENCES...47
FIGURE 1.Cationic emulsion system acting as a carrier for DNA. ... 55
TABLESLIST ...56
TABLE 1.Some advantages and disadvantages of currently used vectors. ...…56
4.2 CATIONIC NANOEMULSIONS AS A POSSIBLE STRATEGY FOR GENE DELIVERY IN THE TREATMENT OF XERODERMA PIGMENTOSUM: PRELIMINARY STUDIES...58
ABSTRACT ...59
INTRODUCTION ...60
MATERIALS AND METHODS ...61
RESULTS AND DISCUSSION... 63
CONCLUDING REMARKS ... 67
REFERENCES ...68
v
emulsion (ED) and Stearylamine containing emulsion (ES). ...71
TABLE 2: Characterization of Basic Emulsion (BE), DOTAP Emulsion (ED) and Stearylamine Emulsion (ES)...71
TABLE 3: Characterization of Stearylamine Emulsions incorporated in Aqueous Phase (AP) or Oily (Phase)...71
FIGURES LIST ...72
FIGURE 1.TEM micrographs of cationic nanoemulsions (A) DOTAP emulsion and (B) SA emulsion...72
FIGURE 2: Micro-emultocrit results showing creaming rate of nanoemulsions and lipoplexes. ...73
FIGURE 3: Agarose gel electrophoresis picture showing DNA compaction of ED (A) and ES (B) nanoemulsions. ...73
FIGURE 4: Agarose gel electrophoresis picture showing DNA compaction...74
(A) ES AP Nanoemulsions - Lane 1 shows the positive control: plasmid [0.46 μg] and lane 10 shows the negative control: nanoemulsion. Lanes 2 to 9 show the follow ratios of EC/DNA (nmol/μg): 25.81; 51.62; 64.53; 77.43; 90.34; 103.24; 116.15 and 129.05. OC: Open circular form; SC: Supercoiled form...74
(B) ES OP (B) nanoemulsions - Agarose gel electrophoresis picture showing DNA compaction of ES OP. Lane 1 shows the positive control: plasmid [0,46μg] and lane 8 shows the negative control: nanoemulsion. Lanes 2 to 7 show the follow ratios of EC/DNA (nmol/μg): 64.53; 77.43; 90.34; 103.24; 116.15 and 129.05. OC: Open circular form; SC: Supercoiled form…………... 74
4.3 PHYSICOCHEMICAL AND IN VIVO EVALUATION OF LIPOSOMES RECOVERED BY HYALURONIC ACID FOR TARGETING CD44 RECEPTOR OF RETINAL CELLULES ... 76
INTRODUCTION... 77
MATERIALS AND METHODS... 78
RESULTS AND DISCUSSION... 81
CONCLUSIONS... 83
REFERENCES... 84
TABLE LEGENDS... 86
FIGURE LEGENDS... 87
5.0 CONSIDERAÇÕES FINAIS... 91
vi
6.1 RESUMOS PUBLICADOS EM CONGRESSOS ... 94
6.2 ARTIGO PUBLICADO NO JOURNAL OF DRUG TARGETING ... 98
Keywords ... 98
6.3 ARTIGO ACEITO NO THE AMERICAN JOURNAL OF PATHOLOGY ………...………...109
MICROGLIA/MACROPHAGES MIGRATE THROUGH RETINAL EPITHELIUM BARRIER BY A TRANSCELLULAR ROUTE: INVOLVEMENT IN DIABETIC RETINOPATHY - ROLE OF PKCΖ IN MICROGLIA/MACROPHAGES TRAFFICKING DURING DIABETIC RETINOPATHY IN GOTO KAKIZAKI RATS... 109
ABSTRACT... 110
INTRODUCTION... 111
MATERIALS AND METHODS... 112
Animals... 112
Immunohistochemistry on cryostat ocular sections and on flat mounts of retina or RPE/ choroids... 112
Western Blotting analyses... 114
Intravitreal injection of PKCζ specific inhibitor (PKCζi)... 114
Intravitreal injection of rhodamine-liposome (Rh-Lip)... 115
Quantification of activated microglia/macrophages in the neuroretina... 115
Quantification of microglia/macrophages infiltrating the eye... 116
Quantification and criteria to identify transcellular pores... 116
Semi-thin and ultra-thin sections... 116
Statistics... 116
RESULTS... 117
Subretinal accumulation of microglia/macrophages and alteration of RPE in diabetic rats after 12 months of hyperglycemia ... 117
Trans-epithelial pores are evidenced in RPE cells of diabetic rats... 117
The pores: a transcellular route for microglia/macrophages through the RPE... 118
Pores density in RPE from diabetic and non-diabetic rats... 119
Intravitreal injection of the PKCζinhibitor in 12 months old diabetic rats deactivated microglia/ macrophages, blocked their migration and impaired pore formation…... 119
vii
ACKNOWLEDGMENTS... 124 REFERENCES... 125 FIGURE LEGENDS... 128 TABLE 1. Weight and blood glucose concentration in normoglycemic controls andhyperglycemic diabetic GK rats……... 128
FIGURE 1. Microglia/macrophages accumulation in the subretinal space of 12 monthsold diabetic GK rats... 128
FIGURE 2. ICAM-1, CAV-1 expression, actin recruitment and cell invaginationstrongly suggest the presence of a transcellular pore in diabetic
RPE………... 128 FIGURE 3. Involvement of PKCζin the pore formation... 129 FIGURE 4. Transcellular migration of microglia/macrophages through RPE pores
………..129
viii
LISTA DE ABREVIATURAS E SIGLAS
ADA: Adenosine desaminase ADN: Áácido desoxiribonucléico AH: Ácido hialurônico
ARVO: Association for Research in Vision and Ophthalmology CAV-1: caveolin-1
CI: Creaming Index
COX2: Cyclo-oxygenase 2
CTAB: Cetyltrimethylammonium bromide
DC-Chol: 3ß-[N-(N',N'-Dimetilaminoetano)-carbamoil]Colesterol
DOGS: 1,2-Dioleil-sn-Glicerol-3-{[ácido imidoacético N- (5-Amino-1-Carboxipentil)] Succinato}
DOPE: Dioleilfosfatidiletanolamina
DOTAP: N-[1-(2,3-Dioleoiloxi)propil]-N,N,Ntrimetilamonio metilsulfato DOTMA: (2,3-bis(oleyl)oxipropyl-trimethylammonium chloride)
DSPC: 1,2-diestearoil-sn-glicerol-3-fosfatidilcolina DSPEPEG: Fosfatidiletanolamina-N-monometoxi-[PEG] EA: Estearilamina
ED: DOTAP containing emulsion
ES AP: Aqueous phase stearylamine containing emulsion ES OP: Oily phase stearylamine containing emulsion ES: Stearylamine containing emulsion
EtBr: Ethidium bromide GCL: Ganglion cell layer GK: Goto Kakizaki
HA-DOPE: Ácido Hialurônico – DOPE INL: Inner retinal layers
iNOS: Inducible nitric oxide synthase NAN: Nucleic acid containing nanoparticles NER: Nucleotide excision repair
ix
OPL: Outer plexiform layer
OS: Outer segments of photoreceptors PC: Fosfatidilcolina
PE: Fosfatidiletanlamina PEG: Polietilenoglicol PEI: poly(ethylenimine)
PE-Rodamina: Rodaminafosfatidiletanolamine PI: Polidispersion Index
PKCζ: Protein kinase Cζ PLL: poly(L-lysine)
Rh-Lip: Rhodamine-liposomes RNA: Ribonucleic Acid
RPE: Retinal pigment epithelium SA: Stearylamine containing emulsion
SCID: Severe Combined Immunodeficiency Disease siRNA: RNA de interferência
TEM: Transmission electron microscopy TNF-α: Tumor necrosis factor α
VAA: Vírus adenoassociados
XP: Xeroderma Pigmentosum
x
AGRADECIMENTOS
Agradeço a Deus, sempre presente na minha vida dando a força necessária para superar todos os obstáculos.
Agradeço aos meus orientadores, Prof. Dr. Eryvaldo Sócrates Tabosa do Egito e Elias Fatal e as minhas co-orientadoras Profa. Dra. Lucymara Fassarela Agnez Lima e Profa. Dra. Amelie Bochot pela oportunidade, confiança, exemplo e, sobretudo pela amizade. Obrigada.
Ao Laboratório de Sistemas Dispersos (LASID) e ao Laboratório de Biologia Molecular e Genômica (LBMG) da Universidade Federal do Rio Grande do Norte, onde foi desenvolvido este trabalho, especialmente aos alunos de iniciação científica André Leandro Silva e Francisco Alexandrino Júnior, pela importante colaboração durante o curso deste trabalho, e pela amizade.
A Université Paris Sud XI, onde desenvolvi em estágio doutoral minha capacidade de adaptação a outros ambientes de trabalho e capacidade de aprendizado.
As minhas companheiras de Bureau na Faculté de Pharmacie em Chatenay Malabry: Amelie, Simona, Odille e Marion, que de alguma forma contribuíram para a conclusão deste trabalho.
Ao Laboratório de Cerâmicas e Materiais Especiais (Departamento de Física); ao Laboratório de Membranas e Colóides, ao Laboratório de Tecnologia de Tensoativos (Departamento de Química) e ao Laboratório Glicosaminoglicanos II (Departamento de Bioquímica), todos da Universidade Federal do Rio Grande do Norte, pela colaboração.
Aos meus amigos do LASID e LBMG, por toda colaboração e amizade; e aos colegas e amigos de pós-graduação pelos vários momentos compartilhados, convívio e amizade.
À Jussier Lourenço e aos meus amigos natalenses, pela paciência, apoio e contribuição durante boa parte do período de desenvolvimento deste trabalho.
À minha família da Maison du Brésil pelos momentos de descontração e de amizade desfrutados durante todo o ano de 2010, em especial a Vânia Oliveira, Eliana Kuster, Gladson Dalmonech, Alex Leite, Helena Stigger, Fernanda Bruxel, Ana Pernas, Isabela Gasparini, Estael Pereira, Paulo da Costa, Ramon e Fabiana Rached.
xi
À minha família, especialmente avós, irmãos e sobrinhos, pelo companheirismo e compreensão pelas minhas ausências em várias ocasiões.
xii
RESUMO
A terapia gênica é um dos maiores desafios propostos pela pesquisa pós-genômica e se baseia na transferência de material genético a uma célula, tecido ou órgão com o intuito de curar ou melhorar o estado clínico do paciente. Em sua forma mais simples, a terapia gênica consiste na inserção de genes funcionais em células com genes defeituosos objetivando substituir, complementar ou inibir esses genes causadores de doenças. Para que o DNA exógeno seja expresso em uma população celular faz-se necessária a sua
transferência até o local de ação. Assim, é necessário criar veículos, que transportem e protejam o DNA até que este chegue a uma população celular alvo. Os obstáculos encontrados com a utilização de vetores virais têm proporcionado o interesse no desenvolvimento de vetores não-virais, por serem fáceis de produzir, apresentarem estabilidade controlável e facilitarem a transfecção gênica. O objetivo deste trabalho foi avaliar dois diferentes vetores não virais, lipossomas e nanoemulsões catiônicos, e sua possível utilização na terapia gênica. Para isso, foram utilizados lipídeos catiônicos e co-tensoativos na produção dos dois sistemas. As nanoemulsões foram produzidas pelo método de sonicação e compostas por Captex® 355; Tween® 80; Spam® 80; lipídeo catiônico, Estearilamina (EA) ou N-[1-(2,3-Dioleoiloxi)propil]-N,N,Ntrimetilamonio metilsulfato (DOTAP); e água ultra-pura (Milli-Q®). Estes sistemas foram caracterizados quanto ao tamanho médio de gotícula, índice de polidispersão (PI) e potencial zeta. Avaliou-se ainda a estabilidade dos sistemas e suas capacidades de compactação do material genético. Os lipossomas foram preparados a partir do método de hidratação do filme e compostos por DOTAP, Dioleilfosfatidiletanolamina (DOPE), na presença ou ausência de Rodaminafosfatidiletanolamina (PE-Rodamina) e do conjugado Ácido Hialurônico – DOPE (HA-DOPE). Estes sistemas foram caracterizados da mesma forma que as nanoemulsões e também foram avaliados
estabilidade, influência do tempo, tamanho de material genético e presença ou ausência de endotoxinas na formação dos lipoplexos. Os resultados obtidos permitem afirmar que os sistemas são promissores para posterior utilização na terapia gênica e que esta área promete ser uma área fértil de pesquisa científica e clínica por muitos anos, e provavelmente se tornará uma prática clínica importante neste século. No entanto, da possibilidade à prática existe um longo caminho a percorrer.
xiii ABSTRACT
Gene therapy is one of the major challenges of the post-genomic research and it is based on the transfer of genetic material into a cell, tissue or organ in order to cure or improve
the patient’s clinical status. In general, gene therapy consists in the insertion of functional genes aiming substitute, complement or inhibit defective genes. The achievement of a foreigner DNA expression into a population of cells requires its transfer to the target. Therefore, a key issue is to create systems, vectors, able to transfer and protect the DNA until it reaches the target. The disadvantages related to the use of viral vectors have encouraged efforts to develop emulsions as non-viral vectors. In fact, they are easy to produce, present suitable stability and enable transfection. The aim of this work was to evaluate two different non-viral vectors, cationic liposomes and nanoemulsions, and the possibility of their use in gene therapy. For the two systems, cationic lipids and helper lipids were used. Nanoemulsions were prepared using sonication method and were composed of Captex® 355; Tween® 80; Spam® 80; cationic lipid, Stearylamine (SA) or 1,2-dioleoyl-3-trimethylammoniumpropane (DOTAP) and water (Milli-Q®). These systems were characterized by average droplet size, Polidispersion Index (PI) and Zeta Potential. The stability of the systems; as well as the DNA compaction capacity; their cytotoxicity and the cytotoxicity of the isolated components; and their transfection capacity; were also evaluated. Liposomes were made by hydration film method and were composed of DOTAP; 1,2-dioleoyl-sn-glycero-3-phosphoethanolamine (DOPE), containing or not Rhodaminephosphatidylethanolamine (PE- Rhodamine) and the conjugate Hyaluronic Acid – DOPE (HA-DOPE). These systems were also characterized as nanoemulsions. Stability of the systems and the influence of time, size of plasmid and presence or absence of endotoxin in the formation of lipoplexes were also analyzed. Besides, the ophthalmic biodistribution of PE-Rhodamine containing liposomes was studied after intravitreal injection. The obtained results show that these systems are promising non-viral vector for further utilization in gene therapy and that this field seems to be very important in the clinical practice in this century. However, from the possibility to the practice, there is still a long way.
______________________________
Capítulo 1
Introdução
INTRODUÇÃO
2 1.0 INTRODUÇÃO
A terapia gênica baseia-se no tratamento de doenças pela transferência do material genético a uma célula, tecido ou órgão com o intuito de curar ou melhorar o estado clínico do paciente. Em sua forma mais simples, a terapia gênica consiste na inserção de genes funcionais em células com genes defeituosos objetivando substituir, complementar ou inibir esses genes causadores de doenças (Verma e Weitzman, 2005).
Para que o ácido desoxiribonucléico (ADN) exógeno seja expresso em uma população celular faz-se necessária a sua transferência até o local de ação. Assim, é necessário criar veículos, que transportem e protejam o ADN até que este chegue a uma população celular alvo. O que ainda é um desafio para a ciência (Brown, Schatzlein et al., 2001).
Os obstáculos encontrados com a utilização de vetores virais têm proporcionado o interesse no desenvolvimento de vetores não-virais, por serem fáceis de produzir em quantidade e reprodutibilidade aceitáveis, apresentando baixa imunogenicidade, estabilidade controlável e baixo custo (Davis, 2002). As duas principais formas de desenvolvimento de vetores não virais para terapia gênica consistem na associação de lipídeos catiônicos ou polímeros catiônicos aos ácidos nucléicos, formando respectivamente, lipoplexos ou poliplexos (Hengge, 2005). Apesar do grande número de pesquisas relacionadas ao desenvolvimento destes vetores, existem vários problemas associados a eles, sobretudo com relação à baixa eficiência de transfecção e a dificuldade de vetorização do gene à área específica da doença.
Neste contexto, o presente trabalho tem como objetivo avaliar diferentes nanosistemas farmacêuticos como potenciais estratégias para utilização na terapia gênica. O primeiro sistema consistiu no desenvolvimento de nanoemulsões catiônicas contendo dois diferentes lipídeos catiônicos, Estearilamina (EA) ou o N-[1-(2,3-
INTRODUÇÃO
3 e poderiam conter ou não o lipídeo marcado PE-Rodamina e o conjugado HA-DOPE. Assim como para as nanoemulsões, as propriedades físico-químicas destes sistemas (granulometria, potencial zeta e IP) também foram analisadas. Além disso, a estabilidade dos sistemas e a influência do tempo, do tamanho do plasmídeo e a presença ou ausência de endotoxinas no plasmídeo utilizado, foi avaliada na formação dos complexos.
A presente tese será apresentada na seguinte forma:
______________________________
Capítulo 2
Revisão da Literatura
REVISÃO DA LITERATURA
5 2.0 REVISÃO DA LITERATURA
2.1 Terapia Gênica
A existência de doenças de origem genética e adquiridas, cujas terapias ainda são ineficientes nos dias atuais, abre espaço para a pesquisa e desenvolvimento de terapias alternativas que atuem na causa de origem da doença e não apenas nos seus sintomas, como a terapia gênica. A terapia gênica apresenta enorme potencial para o tratamento de doenças hereditárias e adquiridas e pode revolucionar o tratamento das doenças que têm um componente genético. As doenças monogênicas, também conhecidas como desordens mendelianas, são grandes candidatas à pesquisa na área de terapia gênica. Elas podem ser classificadas em autossômicas dominantes, autossômicas recessivas e doenças ligadas ao cromossomo X (Wong e Chiu, 2010). Analisadas separadamente, estas doenças são extremamente raras, porém, analisadas em conjunto, observa-se que os vários tipos de doenças monogênicas afetam substancialmente a população, em uma estimativa de 10 em cada 1000 nascimentos segundo a Organização Mundial de Saúde (OMS). Diversas outras doenças também têm sido objeto de estudo nesta área como: câncer, desordens genéticas, desordens imunológicas, desordens degenerativas e doenças infecciosas incluindo a SIDA (Síndrome da Imunodeficiência Adquirida)
(Nienhuis, 2008).
O princípio básico subjacente à terapia gênica consiste simplesmente na introdução de material genético no interior celular para que o produto da sua expressão possa curar ou retardar a progressão da doença. Para tal, é necessário fazer o gene chegar às células defeituosas, surgindo assim o conceito de transfecção, processo de entrega e expressão de material genético com sucesso (Verma e Weitzman, 2005).
REVISÃO DA LITERATURA
6 (Romano, Mitcheli et al., 2000); a inibição dirigida por expressão gênica, para o tratamento de doenças onde existe um novo produto gênico ou expressão inapropriada de um gene, como no caso de câncer e doenças infecciosas (Strachan e Read, 2002); e o desenvolvimento de vacinas inovadoras promovendo imunização gênica (Felgner, 1998).
É por esse motivo, que a terapia gênica apresenta-se bastante promissora como alternativa terapêutica para estas doenças, especialmente no que diz respeito aos
carreadores não virais.
Diferentes estratégias podem ser utilizadas no desenvolvimento da terapia gênica, podendo ser utilizada para substituir um gene defeituoso pelo gene correto; para inibir a expressão de um gene; ou ainda, para corrigir a expressão de um gene. Atualmente, pode-se dizer que a terapia gênica refere-se ao uso potencial dos ácidos nucléicos, incluindo ADN plasmidial, oligonucleotídeos antisenso ou RNA de interferência (siRNA), para modular a expressão gênica celular com propostas terapêuticas (Mountain, 2000; Wasungu e Hoekstra, 2006; Bhattacharya e Bajaj, 2009; Liu e Yu, 2010; Verissimo, Lima et al., 2010).
Várias doenças incuráveis pelos métodos terapêuticos convencionais representam perspectivas futuras para a aplicação da terapia gênica. Contudo, ainda existem limitações com relação à eficiência e direcionamento dos vetores de transferência gênica da geração atual. Para que o ADN exógeno seja expresso em uma população celular faz-se necessário a sua transferência até o local, uma vez que, poucas células recebem e expressam ADN exógeno (Mountain, 2000). Assim é necessário criar veículos que transportem e protejam o ADN até que este chegue a uma população celular alvo. Ao longo do tempo foram surgindo vetores que se encaixam em duas famílias, os vetores virais e os carreadores não virais. Dentro de cada tipo de vetor
REVISÃO DA LITERATURA
7 sua forma infecciosa e de poderem induzir resposta inflamatória e imunológica, além da dificuldade de obtenção e a capacidade de carrear ácidos nucléicos de tamanho limitado, têm promovido o desenvolvimento de sistemas do tipo não-viral como lipossomas, nanoemulsões e polímeros catiônicos (Brown, Schatzlein et al., 2001; Davis, 2002; Smyth Templeton, 2002; Verma e Weitzman, 2005; Tros De Ilarduya, Sun et al., 2010).
2.2 Vetores não-virais
Os vetores não virais apresentam-se como alternativas potenciais a utilização dos vetores. Os vetores não virais são mais seguros que os virais; apresentam capacidade de carrear moléculas maiores; são aplicáveis a todos os tipos de células; e são mais fáceis de serem produzidos. No entanto, apesar de todo o desenvolvimento que têm sido alvo, este sistema também possui algumas limitações, como o nível de transfecção inferior aos obtidos pelos vetores virais, a falta de especificidade para a célula alvo e algumas características físico-químicas que dificultam a sua utilização in vivo (Brown, Schatzlein et al., 2001; Davis, 2002; Miguel, Pais et al., 2003; Verma e Weitzman, 2005; Tros De Ilarduya, Sun et al., 2010).
Os carreadores catiônicos, lipoplexos e poliplexos, apresentam-se atualmente como a alternativa mais promissora em relação à utilização dos vetores virais (Abdallah, Sachs et al., 1995). As moléculas de ADN carregadas negativamente são normalmente condensadas e/ou complexadas com os reagentes catiônicos antes do seu transporte. O princípio utilizado é o mesmo para os polímeros e peptídeos catiônicos: os carreadores catiônicos interagem de uma forma eletrostática com os grupos fosfato do esqueleto do DNA carregados negativamente levando à formação do complexo (Miguel, Pais et al., 2003). A presença de surfactantes catiônicos nos lipossomas promove a formação de uma vesícula com superfície carregada positivamente, o que facilita as fortes interações
entre vesículas e plasmídeos (Bhattacharya e Mandal, 1997). Desta interação resulta a condensação do DNA em estruturas mais compactas capazes de ultrapassar membranas biológicas e de proteger da degradação pelas DNAses, dependendo da razão entre a quantidade de lipídeo e a quantidade de DNA (Miguel, Pais et al., 2003; Barut, Coskun Ari et al., 2005).
REVISÃO DA LITERATURA
8 ligam as superfícies celulares através de interações moleculares não específicas. Os complexos carregados positivamente e a carga da superfície celular negativa interagem eletrostaticamente, o que permite sua entrada nas células através dos mecanismos de
endocitose ou “endocitosis-like” após uma ligação aos receptores celulares mediada por cargas (De Lima, Simoes et al., 2001; Lechardeur e Lukacs, 2002).
Inicialmente, acreditava-se que a fusão entre as membranas lipossomais e celulares era a primeira etapa na ligação que permitia que lipossomas catiônicos e
aniônicos ultrapassassem a membrana para o interior celular. Tradicionalmente, após internalização do complexo policátion/ADN por endocitose, grande parte é vetorizado ao compartimento lisossomal. A liberação citosólica do ADN heterólogo é pré-requisito para a translocação nuclear e por isso, o aprisionamento e degradação do ADN plasmidial nos endolisossomos constituem um grande impedimento para uma eficiente transferência gênica. Apenas uma pequena fração do ADN plasmidial consegue penetrar no citoplasma. O ADN plasmidial encontra então, barreiras metabólicas e difusionais do citoplasma, o que resulta ainda em uma diminuição de moléculas de plasmídeo intactas que conseguem atingir o complexo do poro nuclear. A liberação do ADN no interior citoplasmático geralmente é atribuída à habilidade dos lipídeos catiônicos em desestabilizar a membrana do endossomo. Neste caso, a natureza da membrana do lipoplexo é essencial, pois permite a troca de lipídeos entre a membrana do endossomo e o lipoplexo, resultando em perturbações da membrana que são pré-requisitos para o escape do ADN. A translocação nuclear do ADN acontece ou devido à desmontagem do envelope nuclear, ou por transporte ativo nuclear via o complexo do poro nuclear (Tros De Ilarduya, Sun et al., 2010). Uma das razões para a baixa eficiência de transfecção dos lipídeos catiônicos tem sido relacionada à insuficiente proteção do ADN contra as nucleases intracelulares. A comparação entre vetores virais e o transporte celular de
plasmídeos deve revelar as estratégias utilizadas pelos vírus para solucionar estes problemas de barreiras que impedem o transporte do ADN através de sistemas não virais para terapia gênica.
REVISÃO DA LITERATURA
9 limitada eficiência que o próprio transporte do ADN na utilização dos vetores não virais (Wasungu e Hoekstra, 2006). Atingir o transporte celular eficiente depende de um grande número de fatores que incluem: a estrutura química dos reagentes catiônicos que poderão ser utilizados, a estrutura supramolecular dos lipoplexos e poliplexos, as interações com as membranas celulares, sua internalização e localização intracelular, a liberação do ADN pelos carreadores catiônicos e o papel dos lipídeos neutros (helper lipids) nos carreadores catiônicos (Tros De Ilarduya, Sun et al., 2010). A ligação de
radicais específicos aos sistemas como polietilenoglicol (PEG), polietilinoimina (PEI), poli-L-lisina (PLL), tem sido utilizada com moderado sucesso superando alguns dos problemas relacionados às barreiras enfrentadas por estes sistemas; enquanto que a ligação a peptídeos nucleares tem sido uma estratégia utilizada para superar os problemas relacionados ao escape do endossomo e ao transporte nuclear (Brown, Schatzlein et al., 2001).
Apesar de serem menos eficientes, especialmente se tratando de estudos in vivo, sabe-se que os lipoplexos e poliplexos são imunologicamente inertes e potencialmente mais seguros que os vetores virais. Por serem relativamente fáceis de produzir e poderem ser modificados quimicamente com o intuito de aperfeiçoar a transfecção, inúmeras pesquisas nessa área específica tem aumentado drasticamente nos últimos anos. Portanto, inúmeros dispositivos catiônicos têm sido sintetizados e modificações estruturais racionais têm sido desenvolvidas de maneira sistemática com o intuito de correlacionar estrutura e atividade de transfecção. Adicionalmente, o desempenho dos vetores não virais pode ser otimizado também através da sua vetorização a tipos celulares específicos e em um modelo de internalização celular distinto, considerando a possibilidade de que nem todo modelo é efetivamente igual em transportar o ADN ao citosol, importante passo para o evento de expressão gênica (Wasungu e Hoekstra,
2006).
REVISÃO DA LITERATURA
10 cadeias alifáticas simples são mais tóxicos e menos eficientes que os que apresentam cadeias duplas. De qualquer forma, existem casos em que os lipídeos com cadeia simples apresentam melhores resultados que os de dupla cadeia, tornando claro que não se pode abolir totalmente o uso dos lipídeos de cadeia simples na terapia gênica. Os efeitos de citotoxicidade estão associados a natureza catiônica dos vetores, que são determinados principalmente pela estrutura do grupo hidrofílico. A cabeça polar consiste de sais de amônio primários, secundários, terciários ou quaternários, mas os
grupos guanidino e imidazol também têm sido utilizados. A maioria das ligações nos lipídeos sintéticos são ligações éter, éster ou amida. Apesar dos compostos com ligação éter apresentarem melhor eficiência de transfecção, eles apresentam estabilidade exacerbada o que prejudica sua biodegradação, causando assim, toxicidade (Audouy e Hoekstra, 2001; Lv, Zhang et al., 2006). A Figura 1 mostra a estrutura dos dois lipídeos catiônicos utilizados no desenvolvimento deste trabalho, EA e DOTAP.
(A)
(B)
Figura 1. Estrutura química dos lipídeos catiônicos EA (A) e DOTAP (B).
REVISÃO DA LITERATURA
11 sérica dos sistemas, são mais adequados para o transporte de genes in vivo (Tros De Ilarduya, Sun et al., 2010).
(A)
(B)
O maior problema do uso de lipídeos catiônicos como carreadores gênicos é sua inadequada compatibilidade com o soro e outros fluidos biológicos o que os torna impróprios para estudos in vivo. A toxicidade dos sistemas e a reduzida eficiência de transfecção decorrente da instabilidade dos complexos formados com os ácidos nucléicos em presença de proteínas, também têm sido relatadas (Filion e Phillips, 1998; Yi, Yune et al., 2000; Choi, Kim et al., 2004). Adicionalmente, a expressão dos genes exógenos, provindos da vetorização não-viral, tende a ser passageira, e geralmente, as doenças cuja terapia gênica poderá ser indicada, requer alto nível de expressão do transgene (Mountain, 2000; Hung, Hwang et al., 2005; Verma e Weitzman, 2005).
Para solucionar este problema, grupos funcionais como PEG têm sido ligados aos fosfolipídeos para tornar o sistema furtivo. A presença destes grupos funcionais pode impedir interações excessivas entre os lipoplexos, impedindo assim, a formação de agregados. Como resultado, o tamanho médio das partículas de lipoplexos resultantes será menor e pode ser processado pelas células diferentemente dos grandes complexos. O tamanho e a carga dos vetores não virais são parâmetros importantes, mas seu papel
REVISÃO DA LITERATURA
12 sedimentação dos sistemas sobre as células. No entanto, o PEG também promove a formação de uma barreira estável que inibe fortemente a liberação dos ácidos nucléicos dos endossomos (Wasungu e Hoekstra, 2006).
Carreadores coloidais incluindo lipossomas, nanopartículas lipídicas sólidas, nanoemulsões e nanopartículas poliméricas são plataformas atrativas para a terapia gênica (Liu e Yu, 2010). Dentre estes vetores não virais, lipossomas e nanoemulsões têm particularmente, excelente potencial para aplicações no transporte de genes.
2.2.1 Lipossomas
O uso de lipossomas na terapia gênica é bastante promissor devido principalmente a sua não imunogenicidade e alta segurança e apresenta uma série de vantagens em relação aos vetores virais. A maior delas é a ausência de imunogenicidade após administração in vivo, particularmente após administração sistêmica. Por este motivo, os complexos lipossomas/ ácidos nucléicos podem ser re-administrados sem danos ao paciente e sem comprometer a eficácia da terapia gênica não viral (Smyth Templeton, 2002; Kwon, Nam et al., 2008; Bhattacharya e Bajaj, 2009).
Os lipossomas utilizados nos estudos de terapia gênica apresentam tipicamente ao menos dois componentes: um lipídeo catiônico e um lipídeo neutro. Eles oferecem a interface carregada positivamente que permite a efetiva complexação com os ácidos nucléicos via interações eletrostáticas resultando em nanosistemas que oferecem biocompatibilidade, baixa toxicidade e a possibilidade de produção em larga escala, o que é necessário para aplicações clínicas in vivo. Ao mesmo tempo, devido à natureza dos lipoplexos, eles interagem com as cargas negativas das superfícies celulares favorecendo e permitindo o transporte do ADN ao interior celular. Os lipossomas catiônicos também protegem o ADN contra o ataque de enzimas como as DNAses
(Smyth Templeton, 2002; Kwon, Nam et al., 2008; Bhattacharya e Bajaj, 2009; Tros De Ilarduya, Sun et al., 2010).
REVISÃO DA LITERATURA
13 terapêutico desses sistemas. Alguns desses estudos passam pela alteração da composição lipídica dos lipossomas (Bhattacharya e Mandal, 1997; De Lima, Simoes et al., 2001); pelo desenvolvimento de novas formulações farmacêuticas (Hara, Liu et al., 1997; Hung, Hwang et al., 2005); pela incorporação de radicais nos complexos, de forma a aumentar sua especificidade celular e pela incorporação de peptídeos fusogênicos (Kim, Chung et al., 2001); pela adição de polímeros catiônicos, que aumentem a taxa de transfecção (Feng, Ruan et al., 2004; Lee, Chun et al., 2005; Lee,
Zhang et al., 2007); e pela incorporação de polímeros hidrofílicos como o PEG, de modo a aumentar o tempo de circulação dos complexos na corrente sanguínea devido a um aumento da sua estabilidade física (Hong, Zheng et al., 1997; Teixeira, Rosilio et al., 2001; Choi, Mackay et al., 2003; Palmer, Chen et al., 2003; Salvati, Ciani et al., 2006; Bombelli, Faggioli et al., 2007; Buyens, Demeester et al., 2009; Hobel e Aigner, 2009).
Os complexos lipossomas catiônicos/ADN podem ser administrados por diversas vias in vivo. Estas vias incluem injeção direta (por exemplo: intra-tumoral), intravenosa, intraperitoneal, intra-arterial, intra-esplênica, mucosa (nasal, vaginal, retal), intramuscular, subcutânea, trans-dérmica, intra-dérmica, sub-retiniana, intravitreal, intra-traqueal, intra-cranial e outras (Smyth Templeton, 2002; Kwon, Nam et al., 2008; Bhattacharya e Bajaj, 2009).
Os fosfolipídios mais amplamente encontrados nas membranas biológicas são a fosfatidilcolina (PC) ou fosfatidiletanlamina (PE). A cabeça dos fosfolipídios naturais torna-os uma opção para diminuir a toxicidade dos lipídeos catiônicos (Bhattacharya e Bajaj, 2009). Em particular, o DOPE forma estruturas do tipo fase hexagonal invertida HII (não-bicamada) em pH neutro e temperatura fisiológica. No entanto, quando combinados aos lipídeos catiônicos eles podem participar da formação de bicamadas.
REVISÃO DA LITERATURA
14 células e a estrutura resultante (Tros De Ilarduya, Sun et al., 2010) .
Esses complexos são incorporados pelas células, por fusão ou endocitose, sendo a endocitose a sua principal forma de entrada, o que implica a subseqüente libertação do endossomo e tráfego do DNA até o núcleo (De Lima, Simoes et al., 2001; Simoes, Slepushkin et al., 2001). A liberação do DNA no citoplasma é geralmente atribuída à habilidade dos lipídeos catiônicos em desestabilizar a membrana do endossomo. Quando os ácidos nucléicos conseguem escapar do endossomo, eles o fazem em um
estágio anterior a endocitose acontecer. Neste caso, a natureza da membrana do lipoplexo é crucial e permite uma troca de lipídeos entre a membrana do endossomo e o lipoplexo, resultando em perturbações na membrana que são pré-requisitos para o escape do ADN do lipossoma. Este mecanismo não está bem esclarecido, mas quando o DOPE participa da formulação de lipossomas catiônicos, a liberação dos ácidos nucléicos pode ser beneficiada pela tendência do DOPE em promover mudanças polimórficas significativas na fase lipídica sob condição fisiológica. O DOPE particularmente promove prontamente a formação de uma fase hexagonal invertida (a temperatura ambiente e pH fisiológico) a partir da fase lamelar de líquido cristalino na maioria das membranas. Por isso, o DOPE proporciona o rompimento do endossomo devido à fusão da membrana. Uma vez em seu interior, o pH dos compartimentos do endossomo caem de 7 para 5,5 e parte dos ácidos nucléicos ligados escapa dos endossomos precoces para o citosol. O transporte citoplasmático dos endossomos tem um papel importante em trazer o material transfectado para perto da região perinuclear. O material genético então pode ser liberado e conseqüentemente transcrito. Tem sido demonstrado que o transporte nuclear é uma barreira significante no transporte genético e até o momento, não se conhece o mecanismo de transporte através da membrana nuclear. No entanto, sabe-se que a importação de ácidos nucléicos de grande tamanho
ao núcleo acontece devido a associação de ácidos nucléicos às proteínas requeridas para o transporte (Bhattacharya e Bajaj, 2009; Tros De Ilarduya, Sun et al., 2010).
REVISÃO DA LITERATURA
15 encapsulam de maneira eficiente tamanho variado de ácidos nucléicos; são vetorizados a tipos celulares específicos e órgãos alvos; penetram barreiras estreitas em vários órgãos e mesmo através do tecido alvo; podem ter a razão lipídeo: ácido nucléico otimizada em suspensões coloidais in vivo; podem ser fracionados para produzir uma população homogênea de complexos antes da injeção; e podem ser administrados repetidamente (Smyth Templeton, 2002).
2.2.2 Nanoemulsões
Emulsões são dispersões termodinamicamente instáveis cujo tamanho de gotículas tende a aumentar com o tempo culminando com a separação se fases. As nanoemulsões apresentam uma série de vantagens em relação às emulsões ordinárias, incluindo: maior área de superfície e energia livre, evitando os fenômenos de instabilidade de cremagem, floculação, coalescência e separação de fases (Solans, Izquierdo et al., 2005; Constantinides, Chaubal et al., 2008; Gutierrez, Gonzalez et al., 2008; Liu e Yu, 2010). As nanoemulsões utilizadas como sistemas de liberação de ácidos nucléicos são geralmente compostas por um núcleo oleoso de origem vegetal ou semi-sintético estabilizado na sua superfície por uma mistura binária de fosfolipídios, surfactantes e lipídeos catiônicos (Yi, Yune et al., 2000; Liu e Yu, 2010).
A seleção do núcleo oleoso é geralmente realizada com base na estabilidade das formulações e nas propriedades físico-químicas desejadas. Dentre os óleos de vegetais, o óleo de soja tem amplamente utilizado (Kim, Chung et al., 2000; Yi, Yune et al., 2000; Kim, Kim et al., 2003; Barut, Coskun Ari et al., 2005). O óleo de linhaça também tem sido objeto de estudo (Nam, Park et al., 2009). Atualmente, tem-se observado um interesse crescente no uso dos triglicerídeos sintéticos, especialmente os de cadeia média (TCM) no preparo de nanoemulsões (Teixeira, Dubernet et al., 1999; Teixeira,
Dubernet et al., 2001; Teixeira, Rosilio et al., 2001; Bivas-Benita, Oudshoorn et al., 2004; Martini, Fattal et al., 2008).
REVISÃO DA LITERATURA
16 oleosa das emulsões catiônicas utilizadas como sistemas de liberação de ácidos nucléicos varia de 5 a 35 % da composição final das formulações (Liu, Yang et al., 1996; Hara, Liu et al., 1997; Yi, Yune et al., 2000; Chung, Kim et al., 2001; Liu e Yu, 2010). No caso dos polinucleotídeos de elevado peso molecular, como o DNA, a presença dos surfactantes catiônicos, também chamados lipídeos catiônicos, na interface tem a função de associar e compactar o ácido nucléico visando a um efetivo transporte intracelular (Eastman, Siegel et al., 1997; Liu e Yu, 2010).
Os lipídeos utilizados na composição das emulsões podem ser monocatiônicos ou policatiônicos (Zhang, Xu et al., 2004). Os lipídeos monocatiônicos podem apresentar funções amina primárias (EA), secundárias, como o 1,2-Dioleil-sn-Glicerol- 3-{[ácido imidoacético N- (5-Amino-1-Carboxipentil)] Succinato} (DOGS), terciárias 3ß-[N-(N',N'-Dimetilaminoetano)-carbamoil] Colesterol (DC-Chol) ou ainda quaternárias (DOTAP). O grupamento amina é responsável pelas interações eletrostáticas que ocorrem entre os lipídeos catiônicos e os grupamentos fosfato, carregados negativamente, dos ácidos nucléicos. A utilização de lipídeos policatiônicos tem sido menos freqüentemente descrita na obtenção de emulsões, em comparação aos lipídeos monocatiônicos. Contudo, a maior densidade de cargas das membranas dos complexos devido à utilização dos novos lipídeos multivalentes, tem promovido um incremento na eficiência de transfecção em comparação com o DOTAP quando utilizados com uma pequena razão molar de lipídeos neutros. Isto é importante, pois minimiza os efeitos tóxicos conhecidos dos lipídeos catiônicos. Além dos lipídeos mono e polivalentes, lipídeos derivados da guanidina, imidazol, colesterol e peptídeos catiônicos também têm sido utilizados (Zhang, Xu et al., 2004).
Além da utilização dos lipídeos catiônicos, as emulsões catiônicas utilizadas na terapia gênica geralmente são obtidas a partir de misturas binárias com fosfolipídios
REVISÃO DA LITERATURA
17 2001). Os lipídeos catiônicos mais comumente utilizados na terapia gênica são o DC- Chol, a EA e o DOTAP. No entanto, novos lipídeos catiônicos formados por um núcleo aspartato ou glutamato, uma cabeça lisina e duas cadeiais alquil, têm demonstrado expressão gênica bastante eficiente e citotoxicidade inferior (Liu e Yu, 2010).
O uso de lipídeos catiônicos derivados do colesterol também tem sido descrito na literatura de sistemas emulsionados, com destaque para o lipídeo catiônico DC-Chol, que apresenta no seu domínio hidrofóbico um grupamento colesteril, que serve como
âncora hidrofóbica (Hara, Liu et al., 1997; Zhang, Xu et al., 2004).
Para incrementar a estabilidade física das formulações e reduzir as interações de proteínas com as emulsões catiônicas, os fosfolipídios podem ser ligados covalentemente ao PEG, como o fosfatidiletanolamina-N-monometoxi-[PEG] (DSPEPEG), e usados em associação com outros fosfolipídeos na composição de emulsões como veículo de ADN (Kim, Chung et al., 2000; Yi, Yune et al., 2000; Chesnoy, Durand et al., 2001) e oligonucleotídeos (Teixeira, Dubernet et al., 2001; Teixeira, Rosilio et al., 2001). De fato, tem sido demonstrado que a presença de lipídeos conjugados ao PEG na interface de sistemas coloidais cria uma barreira estérica ao acesso de proteínas, prevenindo assim a agregação das nanoestruturas. Ainda objetivando incrementar a estabilidade destes sistemas, alguns autores descrevem o uso de tensoativos não-iônicos na preparação de emulsões contendo ADN (Liu, Yang et al., 1996; Choi, Mackay et al., 2003; Hung, Hwang et al., 2005); (Liu, Yang et al., 1996; Hara, Liu et al., 1997; Kim, Chung et al., 2001; Choi, Kim et al., 2004). Os efeitos da adição de tensoativos não-iônicos na distribuição granulométrica, atividade de transfecção e sensibilidade sérica dos complexos emulsão/ADN foram avaliados (Liu, Yang et al., 1996). As emulsões foram preparadas com óleo de castor, DC-Chol e quatro tipos diferentes de co-tensoativos: Tween®, Span 60®, Brij® e Pluronic®. Foi
REVISÃO DA LITERATURA
18 emulsão composta de DOTAP/DOPE/Tween 80® apresentou atividade de transfecção bem superior à obtida com os lipossomas correspondentes em ensaios de transfecção em presença de soro. Os tensoativos propostos nessas formulações são geralmente os ésteres de ácidos graxos do sorbitano, como a série de Tween® e Span®, que são aprovados em várias farmacopéias para uso parenteral. Aos tensoativos como o Tween 80®, têm sido atribuída a formação de uma barreira estérica na interface através de suas cadeias de caráter hidrofílico, impedindo assim a aproximação e agregação das
emulsões com proteínas (Hara, Liu et al., 1997; Choi, Kim et al., 2004).
Os avanços alcançados com o desenvolvimento de novas tecnologias na formulação de nanoemulsões catiônicas para terapia gênica têm permitido o controle das suas propriedades de superfície como hidrofobicidade e carga da estrutura química. Quando as emulsões apresentam a superfície carregada positivamente, elas podem interagir eletrostaticamente como genes terapêuticos devido à formação espontânea do complexo emulsão catiônica/ADN. Esses complexos nanométricos apresentam potencial terapêutico, pois a compactação do ADN pode protegê-lo contra a degradação enzimática que ocorre nos fluidos biológicos e facilitam a entrada celular do ADN com posterior transporte ao núcleo. Contudo, para que as nanoemulsões catiônicas sejam utilizadas como promissores carreadores gênicos é imprescindível desenvolver sistemas reprodutíveis, estáveis e de formulação bem definida. Dentre as várias abordagens, tem sido demonstrado que as nanoemulsões catiônicas apresentam alto potencial como vetores não virais para terapia gênica devido: (1) a sua biocompatibilidade já que a maioria dos seus constituintes são óleos não tóxicos e lipídeos anfifílicos; (2) a sua capacidade de formação de nanocomplexos com o ADN carregado negativamente, promovendo proteção do material genético contra a degradação enzimática dos fluidos biológicos; (3) a sua estabilidade na corrente sanguínea devido ao meno reconhecimento
______________________________
Referências Bibliográficas
REFERÊNCIAS BIBLIOGRÁFICAS
22 3. REFERÊNCIAS BIBLIOGRÁFICAS
Abdallah, B., L. Sachs, et al. Non-viral gene transfer: applications in developmental biology and gene therapy. Biology of the cell / under the auspices of the European Cell
Biology Organization, v.85, n.1, p.1-7. 1995.
Audouy, S. e D. Hoekstra. Cationic lipid-mediated transfection in vitro and in vivo. Molecular Membrane Biology, v.18, n.2, Apr-Jun, p.129-143. 2001.
Barut, K. D., F. F. Coskun Ari, et al. Development and characterization of a cationic emulsion formulation as a potential pDNA carrier system. Turkish Journal of Chemistry, v.29, p.27-40. 2005.
Bhattacharya, S. e A. Bajaj. Advances in gene delivery through molecular design of cationic lipids. Chemical Communications, n.31, Aug 21, p.4632-56. 2009.
Bhattacharya, S. e S. S. Mandal. Interaction of surfactants with DNA. Role of hydrophobicity and surface charge on intercalation and DNA melting. Biochimica Et Biophysica Acta-Biomembranes, v.1323, n.1, Jan, p.29-44. 1997.
Bivas-Benita, M., M. Oudshoorn, et al. Cationic submicron emulsions for pulmonary DNA immunization. Journal of Controlled Release, v.100, n.1, Nov 5, p.145-155. 2004.
Bombelli, C., F. Faggioli, et al. PEGylated lipoplexes: Preparation Protocols affecting
DNA condensation and cell Transfection efficiency. Journal of Medicinal Chemistry, v.50, p.6274-6278. 2007.
Brown, M. D., A. G. Schatzlein, et al. Gene delivery with synthetic (non viral) carriers. International Journal of Pharmaceutics, v.229, n.1-2, Oct 23, p.1-21. 2001.
REFERÊNCIAS BIBLIOGRÁFICAS
23 Chesnoy, S., D. Durand, et al. Improved DNA/emulsion complex stabilized by poly(ethylene glycol) conjugated phospholipid. Pharmaceutical Research, v.18, n.10, Oct, p.1480-4. 2001.
Choi, J. S., J. A. Mackay, et al. Low-pH-sensitive PEG-stabilized plasmid-lipid nanoparticles: Preparation and characterization. Bioconjugate Chemistry, v.14, n.2, Mar-Apr, p.420-429. 2003.
Choi, W. J., J. K. Kim, et al. Low toxicity of cationic lipid-based emulsion for gene transfer. Biomaterials, v.25, n.27, Dec, p.5893-5903. 2004.
Chung, H., T. W. Kim, et al. Oil components modulate physical characteristics and function of the natural oil emulsions as drug or gene delivery system. Journal of Controlled Release, v.71, n.3, Apr, p.339-350. 2001.
Constantinides, P. P., M. V. Chaubal, et al. Advances in lipid nanodispersions for parenteral drug delivery and targeting. Advanced Drug Delivery Reviews, v.60, n.6, Mar 17, p.757-67. 2008.
Davis, M. E. Non-viral gene delivery systems. Current Opinion in Biotechnology, v.13, n.2, Apr, p.128-131. 2002.
De Lima, M. C. P., S. Simoes, et al. Cationic lipid-DNA complexes in gene delivery: from biophysics to biological applications. Advanced Drug Delivery Reviews, v.47, n.2-3, Apr, p.277-294. 2001.
Eastman, S. J., C. Siegel, et al. Biophysical characterization of cationic lipid: DNA complexes. Biochimica Et Biophysica Acta, v.1325, n.1, Apr 3, p.41-62. 1997.
Felgner, P. L. DNA vaccines. Current Biology, v.8, n.16, Aug, p.R551-R553. 1998.
REFERÊNCIAS BIBLIOGRÁFICAS
24 Filion, M. C. e N. C. Phillips. Major limitations in the use of cationic liposomes for DNA delivery. International Journal of Pharmaceutics, v.162, n.1-2, Mar, p.159-170. 1998.
Gutierrez, J. M., C. Gonzalez, et al. Nano-emulsions: New applications and optimization of their preparation. Current Opinion in Colloid & Interface Science, v.13,
n.4, p.245-251. 2008.
Hara, T., F. Liu, et al. Emulsion formulations as a vector for gene delivery in vitro and in vivo. Advanced Drug Delivery Reviews, v.24, n.2-3, Mar, p.265-271. 1997.
Hengge, U. R. Progress and prospects of skin gene therapy: a ten year history. Clinics in Dermatology, v.23, n.1, Jan-Feb, p.107-114. 2005.
Hobel, S. e A. Aigner. Nonviral delivery platform for therapeutic RNAi: pegylated siRNA/cationic liposome complexes for targeting of the proto-oncogene bcl-2. Future Oncology, v.5, n.1, p.13-17. 2009.
Hong, K. L., W. W. Zheng, et al. Stabilization of cationic liposome-plasmid DNA complexes by polyamines and poly(ethylene glycol)-phospholipid conjugates for efficient in vivo gene delivery. Febs Letters, v.400, n.2, Jan, p.233-237. 1997.
Hung, C. F., T. L. Hwang, et al. Physicochemical characterization and gene transfection efficiency of lipid,emulsions with various co-emulsifiers. International Journal of
Pharmaceutics, v.289, n.1-2, Jan, p.197-208. 2005.
Kim, T. W., H. Chung, et al. In vivo gene transfer to the mouse nasal cavity mucosa using a stable cationic lipid emulsion. Molecules and Cells, v.10, n.2, Apr 30, p.142-7. 2000.
REFERÊNCIAS BIBLIOGRÁFICAS
25 Kim, Y. J., T. W. Kim, et al. The effects of serum on the stability and the transfection activity of the cationic lipid emulsion with various oils. International Journal of Pharmaceutics, v.252, n.1-2, Feb, p.241-252. 2003.
Kwon, S. M., H. Y. Nam, et al. In vivo time-dependent gene expression of cationic lipid-based emulsion as a stable and biocompatible non-viral gene carrier. Journal of Controlled Release, v.128, n.1, May 22, p.89-97. 2008.
Lambert, G., E. Fattal, et al. Polyisobutylcyanoacrylate nanocapsules containing an aqueous core for the delivery of oligonucleotides. International Journal of Pharmaceutics, v.214, n.1-2, Feb, p.13-16. 2001.
Lechardeur, D. e G. L. Lukacs. Intracellular barriers to non-viral gene transfer. Current Gene Therapy, v.2, n.2, May, p.183-94. 2002.
Lee, D., W. Zhang, et al. Thiolated chitosan/DNA nanocomplexes exhibit enhanced and sustained gene delivery. Pharmaceutical research, v.24, n.1, Jan, p.157-67. 2007.
Lee, M. K., S. K. Chun, et al. The use of chitosan as a condensing agent to enhance emulsion-mediated gene transfer. Biomaterials, v.26, n.14, May, p.2147-2156. 2005.
Liu, C. H. e S. Y. Yu. Cationic nanoemulsions as non-viral vectors for plasmid DNA delivery. Colloids Surf B Biointerfaces, v.79, n.2, Sep 1, p.509-15. 2010.
Liu, F., J. Yang, et al. Effect of non-ionic surfactants on the formation of
DNA/emulsion complexes and emulsion-mediated gene transfer. Pharmaceutical Research, v.13, n.11, Nov, p.1642-6. 1996.
Lv, H., S. Zhang, et al. Toxicity of cationic lipids and cationic polymers in gene delivery. Journal of Controlled Release, v.114, n.1, Aug 10, p.100-9. 2006.
REFERÊNCIAS BIBLIOGRÁFICAS
26 Miguel, M. G., A. Pais, et al. DNA-cationic amphiphile interactions. Colloids and Surfaces A-Physicochemical and Engineering Aspects, v.228, n.1-3, Nov, p.43-55. 2003.
Mountain, A. Gene therapy: the first decade. Trends in Biotechnology, v.18, n.3, Mar, p.119-128. 2000.
Nam, H. Y., J. H. Park, et al. Lipid-based emulsion system as non-viral gene carriers. Archives of Pharmacal Research, v.32, n.5, p.639-646. 2009.
Nienhuis, A. The growing clinical impact of gene therapy. Molecular Therapy, v.16, n.6, Jun, p.995-6. 2008.
Palmer, L. R., T. Chen, et al. Transfection properties of stabilized plasmid-lipid particles containing cationic PEG lipids. Biochimica Et Biophysica Acta- Biomembranes, v.1611, n.1-2, Apr, p.204-216. 2003.
Romano, G., P. Mitcheli, et al. Latest developments in gene transfer technology: Achievements, perspectives, and controversies over therapeutic applications. Stem Cells, v.18, n.1, p.19-39. 2000.
Salvati, A., L. Ciani, et al. Physico-chemical characterization and transfection efficacy of cationic liposomes containing the pEGFP plasmid. Biophysical Chemistry, v.121, n.1, Apr 20, p.21-9. 2006.
Simoes, S., V. Slepushkin, et al. On the mechanisms of internalization and intracellular delivery mediated by pH-sensitive liposomes. Biochimica Et Biophysica Acta- Biomembranes, v.1515, n.1, Nov, p.23-37. 2001.
Smyth Templeton, N. Liposomal delivery of nucleic acids in vivo. DNA and Cell Biollogy, v.21, n.12, Dec, p.857-67. 2002.
REFERÊNCIAS BIBLIOGRÁFICAS
27 Science, v.10, n.3-4, p.102-110. 2005. Strachan, T. e A. P. Read. Genética Molecular Humana. Porto Alegre: Atmed. 2002
Tamilvanan, S. Oil-in-water lipid emulsions: implications for parenteral and ocular delivering systems. Progress in Lipid Research, v.43, n.6, p.489-533. 2004.
Teixeira, H., C. Dubernet, et al. Cationic emulsions improves the delivery of oligonucleotides to leukemic P388/ADR cells in ascite. Journal of Controlled Release,
v.89, n.3, p.473-482. 2003.
______. Submicron Cationic Emulsions as a New Delivery System for Oligonucleotides. Pharmaceutical Research, v.V16, n.1, p.30-36. 1999.
______. Factors influencing the oligonucleotides release from O-W submicron cationic emulsions. Journal of Controlled Release, v.70, n.1-2, p.243-255. 2001.
Teixeira, H., V. Rosilio, et al. Characterization of oligonucleotide/lipid interactions in submicron cationic emulsions: influence of the cationic lipid structure and the presence of PEG-lipids. Biophysical Chemistry, v.92, n.3, p.169-181. 2001.
Tros De Ilarduya, C., Y. Sun, et al. Gene delivery by lipoplexes and polyplexes. Eur J Pharm Sci, v.40, n.3, Jun 14, p.159-70. 2010.
Verissimo, L. M., L. F. Lima, et al. Pharmaceutical emulsions: a new approach for gene therapy. J Drug Target, v.18, n.5, Jun, p.333-42. 2010.
Verma, I. M. e M. D. Weitzman. GENE THERAPY: Twenty-First Century Medicine. Annual Review of Biochemistry, v.74, p.711-38. 2005.
Wasungu, L. e D. Hoekstra. Cationic lipids, lipoplexes and intracellular delivery of genes. J Control Release, v.116, n.2, Nov 28, p.255-64. 2006.
REFERÊNCIAS BIBLIOGRÁFICAS
28 Wong, G. K. e A. T. Chiu. Gene therapy, gene targeting and induced pluripotent stem cells: Applications in monogenic disease treatment. Biotechnol Adv, Jul 22. 2010. Yi, S. W., T. Y. Yune, et al. A cationic lipid emulsion/DNA complex as a physically stable and serum-resistant gene delivery system. Pharmaceutical Research, v.17, n.3, Mar, p.314-20. 2000.
Zhang, S., Y. Xu, et al. Cationic compounds used in lipoplexes and polyplexes for gene
______________________________
Capítulo 4
Artigos Derivados da Tese
ARTIGOS DERIVADOS DA TESE
30
4. ARTIGOS DERIVADOS DA TESE
A seguir serão apresentados os quatro artigos derivados da tese, submetidos para
periódicos na área.
______________________________
Artigo publicado no Journal of Drug Targeting
ARTIGOS DERIVADOS DA TESE
32 4.1 PHARMACEUTICAL EMULSIONS: A NEW APPROACH FOR GENE
THERAPY
Lourena Mafra Verissimo1
Lucymara Fassarela Agnez Lima2 Lucila Carmem Monte Egito2 Anselmo Gomes de Oliveira3 E. Sócrates Tabosa do Egito1
1
Universidade Federal do Rio Grande do Norte (UFRN), Laboratório de Sistemas Dispersos (LASID), Natal/RN, Brazil
2
UFRN, Departamento de Biologia Celular e Genética, Laboratório de Biologia Molecular e Genômica (LBMG), Centro de Biociências, Natal/RN, Brazil
3
Departamento de Fármacos e Medicamentos, Faculdade de Ciências Farmacêuticas, UNESP, Araraquara, São Paulo, Brasil.
* Corresponding author:
Prof. E. Sócrates Tabosa do Egito
Rua Praia de Areia Branca, 8948, Nata-RN – 509094-450, Brazil.
Fone: 55 84 9431 8816
Fax: 55 84 3215 4346
ARTIGOS DERIVADOS DA TESE
33
ABSTRACT
The concept of gene therapy involves the experimental transfer of a therapeutic gene
into an individual’s cells and tissues to replace an abnormal gene aiming to treat a disease, or to use the gene to treat a disease just like a medicine, improving the clinical status of a patient. The achievement of a foreigner nucleic acid into a population of cells requires its transfer to the target. Therefore, it is essential to create carriers (vectors) that transfer and protect the nucleic acid until it reaches the target. The obvious disadvantages of the use of viral vectors have directed the research for the development of a nonviral organized system such as emulsions. In fact, recently, there has been an increase of interest in its use in biotechnology as a nonviral vector for gene therapy. This review focuses on the progress of cationic emulsions and the improvement of the formulations, as a potential delivery system for gene therapy.
Keywords: Cationic emulsions; gene transfection; gene therapy; carrier systems;
ARTIGOS DERIVADOS DA TESE
34
INTRODUCTION
The aim of gene therapy is to modify the genetic material of living cells for therapeutic purposes. The experimental procedure involves the insertion of a functional gene into a cell to achieve a therapeutic effect (Verma, 2000). This process is commonly called transfection. Transfection intends basically to replace, amplify, suppress, or correct a defective gene, promoting either a cure or a slowdown of the progression of a disease. In fact, the transfection process permits the selective introduction of a genetic material for protein synthesis as well as its selective inhibition (antisense or gene silencing) (Sokolova & Epple, 2008). The development of recombinant DNA technology, including the ability to clone disease-related genes, the development of efficient techniques for transfection into cells, the huge interest of an understanding of the mechanism regulating gene expression, and the ethical reflection about early human experiments were responsible for the appearance of the concept of gene therapy (Verma, 2000; Nienhuis, 2008). Q11However, the beginning of gene therapy faced several failures and deceptions because of the little knowledge about gene diseases, inefficient techniques for transfection, and ethical problems (Walters, 1991; Friedmann,1990, 1992).
ARTIGOS DERIVADOS DA TESE
35
to develop alternative methods for gene delivery (Niidome & Huang, 2002; Armelini et al., 2005).
Currently, the importance of nanotechnology in delivery systems has been continuously demonstrated and has been extensively used as a carrier not only for the pharmacological active compounds, but also for gene delivery (Egito et al., 1994, 1996, 2004; Bessis, Garcia Cozar, & Boissier, 2004). Moreover, the conclusion of the
―Human Genome Project‖ prompted the hope of new opportunities for gene therapy, keeping this field as a great novel potential therapeutic modality (Verma& Gage, 2000). Advances against many of the inherited and acquired diseases were targeted for gene therapy, including metabolic diseases (Brunetti-Pierri & Lee, 2005); cancer (Cross & Burmester, 2006; Morille et al., 2008); genetic disorders, such as hemophilia (Roth et al., 2001) and cystic fibrosis (Hara et al., 1997); immunologic disorders; infectious diseases, including AIDS; neurological disorders; and various muscle diseases (Raper, 2005; Nienhuis, 2008).
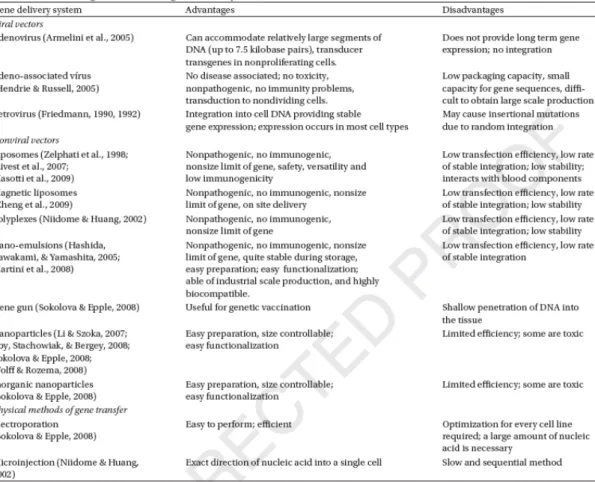
Several viral and nonviral vectors are currently under investigation. Although viral systems are highly efficient in transfection, the serious side effects related to its safety, as well as the host immune and inflammatory responses, have limited its use in clinical applications. On the other hand, nonviral systems, in which plasmid DNA or oligonucleotide can be complexed with cationic liposomes, polymers, peptides, cationic emulsions, or other carriers, provide an attractive alternative route for gene delivery (Kim et al., 2002). Furthermore, gene therapeutics composed of artificial reagents can be standardized and regulated or safety use. However, each of the gene delivery strategies has its own advantages and disadvantages. Table 1 shows the main advantages and disadvantages of some gene vectors.
ARTIGOS DERIVADOS DA TESE
36
GENE DELIVERY SYSTEMS
Because of their strong negative charge, nucleic acids (DNA, RNA, and oligonucleotides) alone are not able to penetrate the cell wall in a concentration range necessary for gene therapy. Therefore, efficient carriers are necessary to introduce them into the cells. Nanoparticles, which represent any particles with a diameter below the micron, by their small size, can easily deliver biomolecule drugs into living systems, usually for a therapeutic purpose (Sokolova & Epple, 2008). Gene delivery systems are generally divided into two categories: viral and nonviral.
Viral vectors
Viral systems work by the same mechanisms as natural viruses that cause infectious diseases. They are the most effective but rather dangerous method because of the risk of recombination, leading to the generation of viruses capable of replication. In spite of that, the knowledge that some viruses integrate their genetic information into the genomes of infected cells suggested that it would be possible to mimic the transformation of cells by these agents to design and construct virus-like particles that could serve as vectors for introducing therapeutic normal genes into defective cells, restoring their normal activity. The use of viruses as gene carriers exploits their ability to deliver genes to the nucleus of a cell and their expression through integration into the host genome. These recombinant viruses are genetically modified to eliminate their pathogenicity while retaining their infectivity (Verma &Weitzman, 2005).
The viral vector is the oldest method used for transfection and was first demonstrated in 1952, by Zinder and Lederberg on a Salmonella model (Zinder &Lederberg, 1952). With that method, gene therapy was carried out using retroviral vectors (Friedmann, 1990, 1992). More recently, adenovirus (Armelini et al., 2005), adeno-associated (Hendrie & Russell, 2005), and herpes virus (Glorioso, DeLuca, & Fink, 1995) and other viruses have been introduced as viral vectors for gene therapy (Verma & Weitzman, 2005).
ARTIGOS DERIVADOS DA TESE
37
carcinogenicity were also attributed to such delivery system (Burand, Summers, & Smith, 1980; Crystal, 1995; Tripathy et al., 1996; Bessis, Garcia Cozar, & Boissier, 2004). At present, there are nonviral-based vectors which would be safe and efficient on gene transfection for therapeutical use (Schatzlein, 2001). Therefore, alternative systems such as hybrid viral vectors (Wagner, 2008), hybrid viral/nonviral vectors, like magnetic cationic liposomes and retrovirus (Ito et al., 2009), and other innovative techniques, such as small interfering RNA (siRNA) (Watanabe et al., 2007; Buyens et al., 2009), transposons, genetic insulators, and new nonviral vectors, are being explored (Friedmann, 1990,1992; Smyth Templeton, 2002).
Nonviral vectors
Despite the great advances in knowledge of the genetic constitution of man and the methodologies for gene manipulation, the clinical application of gene therapy presents several problems in the technical field. It is, therefore, important that more efforts should be directed toward research and development of new carrier systems that are safe and able to improve the gene therapy efficiency.