MARCOS ANTÔNIO DE SOUZA LIMA GUERRA
AVALIAÇÃO DE INDICADORES BIOLÓGICOS E FÍSICO-QUÍMICOS NO COMPOSTO ORGÂNICO PRODUZIDO A PARTIR DE RESÍDUOS DA
INDÚSTRIA DE CELULOSE
Dissertação apresentada à Universidade Federal de Viçosa, como parte das exigências do Programa de Pós-Graduação em Ciência Florestal, para obtenção do título de Magister
Scientiae.
VIÇOSA
MARCOS ANTÔNIO DE SOUZA LIMA GUERRA
AVALIAÇÃO DE INDICADORES BIOLÓGICOS E FÍSICO-QUÍMICOS NO COMPOSTO ORGÂNICO PRODUZIDO A PARTIR DE RESÍDUOS DA
INDÚSTRIA DE CELULOSE
Dissertação apresentada à Universidade Federal de Viçosa, como parte das exigências do Programa de Pós-Graduação em Ciência Florestal, para obtenção do título de Magister
Scientiae.
À minha noiva Juliane, meu pilar, que me apoiou em todos os momentos, que mesmo a distância em alguns instantes, me deu muita força e incentivo, e aos seus pais Julinho e Carminha, pelo incentivo e torcida.
Aos meus pais Marcos e Marilene, pela boa educação e ensinamentos.
AGRADECIMENTOS
São tantos a agradecer, que se torna impossível falar para todos. Primeiramente agradeço a DEUS pelas experiências conquistadas.
À Universidade Federal de Viçosa e ao Departamento de Engenharia Florestal por terem me proporcionado esta oportunidade, pelo suporte físico e material, e ao excelente corpo docente.
À empresa Celulose Nipo-Brasileira – CENIBRA, pelo apoio.
Ao Alexandre Landim e Sebastião Tomas, grandes incentivadores e quem tornou real esta oportunidade.
A todos os colegas da Cenibra, em especial ao Leandro Dalvi, Marcela Vitorino, João Inácio, Humberto, Felipe Cacique, Thiago Iwanaga, os estagiários do ASMIF e os colegas do DEQUA, pelas boas idéias, auxílio e paciência.
Às professoras Ana Augusta, Ann Mounteer e Maria Cristina, por todos os conselhos e sugestões.
À professora Mônica Azevedo pelo apoio e por aceitado fazer parte do comitê como co-orientadora.
À professora Maria Cristina por auxiliar na utilização do sistema VIDAS® no Laboratório de Microbiologia de Alimentos, e a Adriana por todo apoio na execução das análises de microbiologia.
Ao professor Fabyano pelo auxílio nas análises estatísticas.
A todos os colegas e funcionários do Laboratório de Celulose e Papel pelo auxilio e amizade, em especial aos colegas Hygor Rossoni, Ismarley Lage, Valeria Rodrigues e Ana Paula pelos “galhos quebrados”, auxílio e execução da pesquisa.
Às colegas Suzana e Adriana do DESA/UFMG pela boa vontade em auxiliar na execução das análises de helmintos.
Ao professor Edson Elias pela execução das análises de vírus. Ao tio Mauro Miranda companheiro das viagens.
BIOGRAFIA
MARCOS ANTÔNIO DE SOUZA LIMA GUERRA, filho de Marcos Antônio Martins Guerra e Marilene de Souza Lima Guerra, nasceu à 12 de março de 1982, em Belo Horizonte - Minas Gerais.
Em agosto de 2000, iniciou o curso de Engenharia de Materiais no Centro Universitário do Leste de Minas Gerais, diplomando-se, em julho de 2005. Durante o curso, desenvolveu pesquisa de iniciação científica vinculada a empresa Celulose Nipo-Brasileira – CENIBRA, em março de 2004 a julho de 2005.
SUMÁRIO
RESUMO ...vi
ABSTRACT ...vii
1. INTRODUÇÃO GERAL ...1
2. REVISÃO BIBLIOGRÁFICA ...3
2.1. Geração de resíduos sólidos durante o processo de produção de celulose ...3
2.2. Reaproveitamento dos resíduos da indústria de celulose ...6
2.3. Caracterização dos riscos ambientais e sanitários na utilização do composto orgânico ...8
2.3.1. Compostos organoclorados nas indústrias de celulose kraft ...9
2.3.2. Microrganismos patogênicos ... 12
2.3.3. Metais Pesados ... 16
2.4. Referências Bibliográficas ... 20
3. AVALIAÇÃO DOS INDICADORES MICROBIOLÓGICOS E PATOGÊNICOS NO LODO BIOLÓGICO E DURANTE OS PROCESSOS DE COMPOSTAGEM .23 3.1 Introdução ... 24
3.2 Material e Métodos ... 25
3.3 Resultados e Discussão ... 29
3.4 Conclusões ... 36
3.5 Referência Bibliográfica... 37
4. AVALIAÇÃO DE ORGANOCLORADOS E METAIS PESADOS NO LODO BIOLÓGICO E NO COMPOSTO ORGÂNICO E O PONTENCIAL DE ABSORÇÃO DESTES COMPOSTOS PELA Brassica juncea...39
4.1 Introdução ... 40
4.2 Material e Métodos ... 41
4.3 Resultados e Discussão ... 46
4.4 Conclusões ... 57
4.5 Referências Bibliográficas ... 58
RESUMO
GUERRA, Marcos Antônio de Souza Lima, M.Sc., Universidade Federal de Viçosa, julho de 2007. Avaliação de indicadores biológicos e físico-químicos no composto orgânico produzido a partir de resíduos da indústria de celulose. Orientador: Cláudio Mudado Silva. Co-orientadoras: Ann Honor Mounteer e Mônica de Abreu Azevedo.
ABSTRACT
GUERRA, Marcos Antônio de Souza Lima, M.Sc., Universidade Federal de Viçosa, July of 2007. Evaluation of biological and physico-chemical quality of the compost produced from pulp mill residues. Adviser: Cláudio Mudado Silva. Co-Advisers: Ann Honor Mounteer e Mônica de Abreu Azevedo.
1. INTRODUÇÃO GERAL
Nos últimos anos, a indústria de celulose no Brasil vem expandindo consideravelmente a sua produção. Em 2006, a produção brasileira de celulose alcançou 11,1 milhões de toneladas/ano, e estima-se que até 2012 deverá chegar a 14,5 milhões de toneladas de celulose produzidas por ano. Com estes resultados, em 2006, o Brasil ultrapassou o Japão como produtor mundial de celulose, passando da sétima para a sexta posição.
No entanto, apesar das perspectivas de crescimento para os próximos anos, existe uma preocupação crescente com a gestão dos resíduos sólidos do setor de celulose no Brasil. Para cada tonelada de celulose produzida gera-se 800 kg de resíduos sólidos. Grandes indústrias de celulose no Brasil já se conscientizaram deste fato e desenvolvem projetos ambientais para destinar e reutilizar seus resíduos, aumentando inclusive a vida útil dos seus aterros industriais.
Os principais resíduos sólidos gerados no processo de fabricação de celulose são: lenhosos (casca da madeira e serragem), lodos primário e biológico, alcalinos (dregs, grits e lama de cal), rejeitos de celulose no processo e as cinzas das caldeiras de biomassa.
Os resíduos de cascas da madeira são mais gerados no processo. Em virtude disso, as empresas do setor vêm adotando estratégias de descascamento das toras de madeira no campo e a queima de biomassa nas caldeiras para geração de energia. Outro importante resíduo gerado é o lodo biológico proveniente da estação de tratamento de efluente.
No entanto, existem dúvidas quanto à segurança ambiental no uso do composto orgânico, devido ao histórico de formação dos organoclorados no setor de branqueamento da polpa celulósica das indústrias que utilizam cloro ou compostos clorados no processo industrial.
Existem, também, dúvidas quanto à segurança sanitária na produção e utilização do composto orgânico, devido à presença de patógenos no lodo biológico da estação de tratamento de efluentes nas fábricas onde os esgotos sanitários são tratados juntamente com o efluente da fábrica.
O presente trabalho tem por objetivo geral, avaliar a viabilidade ambiental e sanitária da produção e aplicação do lodo biológico da estação de tratamento de efluente e do composto orgânico gerado a partir dos resíduos orgânicos de uma fábrica de celulose kraft branqueada. Os objetivos específicos compreendem-se: i) avaliar a presença de organoclorados e metais no lodo biológico e no composto orgânico produzido dos resíduos de casca de eucalipto e lodo biológico; ii) determinar a capacidade de absorção destes compostos pela mostarda lisa
(Brassica juncea); iii) avaliar a presença de patógenos no lodo biológico e no
2. REVISÃO BIBLIOGRÁFICA
2.1. Geração de resíduos sólidos durante o processo de produção de celulose
O processo de produção de celulose consiste na separação das fibras de celulose dos demais componentes constituintes da estrutura da madeira, em particular a lignina, que atua ligando as fibras entre si e proporcionando rigidez à madeira (Britt, 1965).
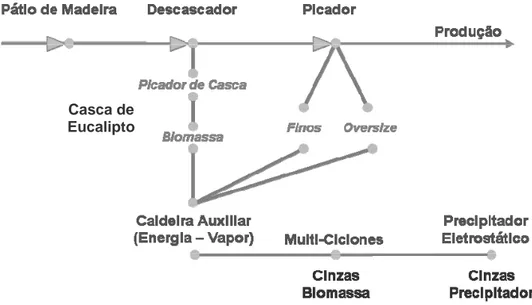
O processo se inicia no pátio de madeira, onde a matéria-prima é recebida na forma de toras de madeiras. As toras são processadas em descascadores, para obtenção de uma madeira sem cascas e sem sujeiras. Depois de descascadas, as toras são encaminhadas aos picadores, onde são transformados em cavacos com dimensões apropriadas para a polpação (Figura 2.1).
Figura 2.1 - Fluxograma Caldeiras Auxiliares
Nesta etapa, são gerados alguns resíduos lenhosos (Figura 2.1) como: as cascas de madeira no descascamento, a serragem e os cavacos super dimensionados, rejeitados no peneiramento após os picadores, e que podem
caldeiras auxiliares, para geração de energia. Durante a queima, são geradas as cinzas. No Brasil, muitas empresas de celulose descascam suas toras de madeiras na área florestal, com o objetivo de minimizar o envio de casca da madeira para o processo industrial e ao mesmo tempo, deixar nos plantios florestais nutrientes e materiais orgânicos existentes na casca de madeira.
Os cavacos provenientes dos picadores são, então, enviados para o processo de separação das fibras conhecido por polpação ou cozimento, sendo efetuado por meios químicos-mecânicos, semi-mecânicos, mecânicos e químicos. Existem vários processos químicos de produção de celulose a partir de madeiras. Entretanto, o mais utilizado em todo o mundo é o processo kraft. Nesse processo os cavacos de madeira são aquecidos em um vaso de pressão (digestor) juntamente com licor de cozimento (licor branco), solução aquosa constituída de hidróxido de sódio e sulfeto de sódio, que sob efeito de pressão e temperaturas entre 160 e 180 ºC levam à despolimerização e dissolução das moléculas de lignina (Morais, 2006).
Durante o cozimento ocorre a separação das fibras de celulose e hemicelulose de outros componentes presentes na madeira, como a lignina e os extrativos. A polpa marrom é separada do licor de cozimento, agora chamado de licor negro, através de lavagens nos depuradores, e enviada para a etapa de branqueamento (Philipp, 1988). Os cavacos não cozidos (nós), normalmente, são separados, podendo ser reciclados no cozimento ou retirados do processo.
As técnicas atuais de branqueamento, no entanto, utilizam um processo denominado de deslignificação com oxigênio ou pré-branqueamento, que permite reduzir o teor de lignina da polpa, antes de receber os químicos, principalmente o cloro, que não podem ser queimados na caldeira de recuperação.
utiliza principalmente dióxido de cloro, e estágios alcalinos, nos quais se utiliza hidróxido de sódio combinado ou não com oxigênio e/ou peróxido de hidrogênio. No branqueamento é gerado o maior volume de efluentes líquidos com alta carga orgânica, devido à presença de materiais oriundos da própria matéria-prima, a madeira (MacDonald, 1970).
Depois de branqueada, a polpa é seca nas máquinas de secagem e, posteriormente, embalada ou enviada para a máquina de papel, quando é o caso das fábricas integradas. A celulose branqueada pode ser utilizada para diversos fins, inclusive na fabricação de papéis para imprimir e escrever, papéis especiais e papéis sanitários.
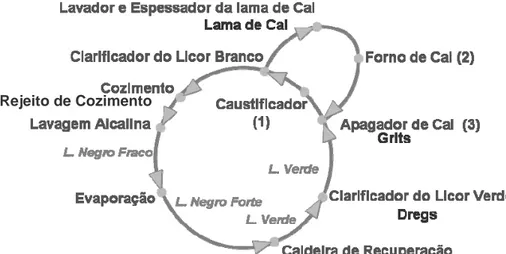
O licor negro, extraído da etapa de cozimento e pré-branqueamento, é enviado para o sistema de recuperação dos químicos, com a finalidade de reaproveitar estes produtos e utilizar os sólidos orgânicos dissolvidos da madeira como fonte de energia nas caldeiras de recuperação (Casey, 1980). Na recuperação química são gerados três resíduos sólidos durante o processo (Figura 2.2), o dregs (impurezas insolúveis do licor), o grits (cal não reagida na caustificação) e a lama de cal (quando o forno de cal está em manutenção).
Figura 2.2 - Fluxograma da Recuperação Química
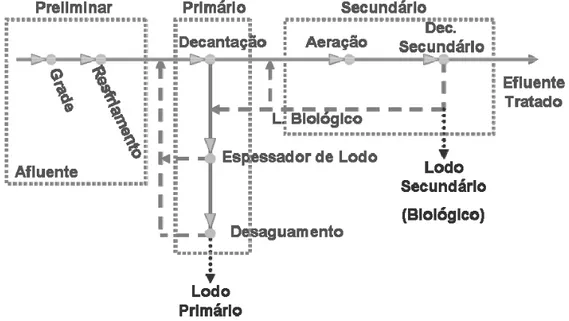
composto de tratamento primário e secundário, e as etapas de branqueamento e secagem contribuem com o maior volume. Os resíduos gerados durante o tratamento de efluentes são (Figura 2.3): o lodo do tratamento primário (fibras perdidas no processo de celulose) e o lodo do tratamento secundário (biológico).
Figura 2.3 - Fluxograma Estação de Tratamento de Efluente
2.2. Reaproveitamento dos resíduos da indústria de celulose
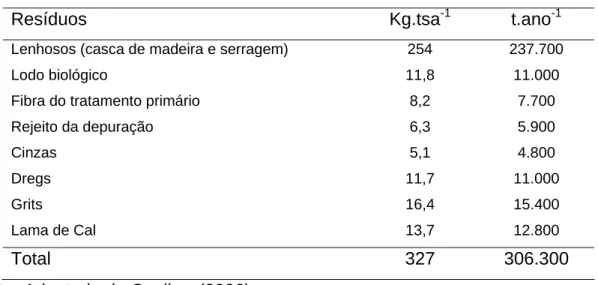
Tabela 2.1 – Geração de resíduos sólidos (base seca)
Resíduos Kg.tsa-1 t.ano-1
Lenhosos (casca de madeira e serragem) 254 237.700
Lodo biológico 11,8 11.000
Fibra do tratamento primário 8,2 7.700
Rejeito da depuração 6,3 5.900
Cinzas 5,1 4.800
Dregs 11,7 11.000
Grits 16,4 15.400
Lama de Cal 13,7 12.800
Total 327 306.300
Fonte: Adaptado de Cenibra (2006)
É neste contexto que têm surgido diversos trabalhos de investigação no sentido de procurar soluções alternativas para utilização destes resíduos, que permitam o seu aproveitamento e a diminuição do impacto ambiental. Entre as soluções preconizadas, a compostagem posiciona-se como uma alternativa interessante, dado a seu baixo custo e a sua simplicidade em termos tecnológicos, permitindo ainda a obtenção de fertilizantes orgânicos naturais, cuja aplicação devolverá devolver ao campo os nutrientes retirados pelos plantios.
Segundo Carvalho et al. (2006), as indústrias de celulose e papel possuem materiais essenciais para o processo de compostagem como fontes de carbono e nitrogênio. Os vários tipos de resíduos como: resíduos lenhosos como a casca da madeira e serragem, os resíduos fibrosos como os rejeitos de celulose do processo e o lodo primário e o lodo biológico, apresentam características de fertilizantes. Os resíduos alcalinos como os dregs, grits e lama de cal, as cinzas das caldeiras auxiliares, apresentam características de correção do solo.
de humificação, resultando num composto estável que possui características apropriadas para a utilização como fertilizante orgânico. As propriedades do composto final dependem do grau de humificação alcançado durante o processo que, em regra, não termina completamente na unidade de compostagem. Segue, então, uma fase de maturação à temperatura ambiente, por vezes no próprio solo, após a aplicação do fertilizante (Kiehl, 1985).
No entanto, apesar do composto orgânico conter quantidades significativas de matéria orgânica e macro e micronutrientes essenciais para o crescimento das plantas, o composto poderá conter contaminantes potenciais provenientes das matérias-primas utilizadas no processo de compostagem, tais como compostos orgânicos persistentes, microrganismos patogênicos e metais pesados.
2.3. Caracterização dos riscos ambientais e sanitários na utilização do composto orgânico
O composto orgânico de resíduos sólidos, para ser utilizado de maneira segura e eficiente deve, ser corretamente estabilizado. Isto significa que a matéria orgânica original deve ser convertida a uma forma que seja mais resistente à degradação, contenha quantidades mínimas de componentes tóxicos e seja livre de patógenos (Barreira, 2006). Portanto, pelo seu risco ambiental e sanitário, os componentes podem ser genericamente agrupados em: poluentes orgânicos variados, microrganismos patogênicos e metais pesados.
A avaliação dos efeitos fisiológicos no homem causados por diversos poluentes perigosos é muito complexa, depende de diversos fatores como: das características individuais de cada indivíduo, das vias de exposição, das concentrações e características do poluente ao qual foi exposto e dos efeitos provocados pela presença de outros poluentes no meio (USEPA, 1995).
Alguns contaminantes orgânicos são reconhecidamente cancerígenos, como por exemplo, os hidrocarbonetos aromáticos polinucleares (HAPs). As dioxinas e os furanos estão entre os compostos mais agudamente tóxicos já identificados (USEPA, 2000). Recentemente, descobriu-se que alguns compostos orgânicos afetam a saúde reprodutiva de organismos superiores, levando à infertilidade e, possivelmente, ao aumento de câncer (Baird, 1999).
2.3.1. Compostos organoclorados nas indústrias de celulose kraft
O uso de um parâmetro global para quantificar o material organoclorado elimina a necessidade de se medir individualmente as concentrações dos compostos. O parâmetro global que mede o teor total de material organoclorado em efluentes líquidos é o AOX (halôgenos orgânicos adsorvíveis em carbono ativado). Em polpas branqueadas e lodos (amostras sólidas) adota-se o OX (halôgenos orgânicos) (McKague et al.,1998).
Figura 2.4 – Classes de compostos clorofenólicos formados durante o branqueamento.
As dibenzodioxinas policloradas (PCDDs) e os dibenzofuranos policlorados (PCDFs) estão dentre os compostos organoclorados mais tóxicos e persistentes já conhecidos. O mais estudado e mais tóxico dentre este grupo de compostos é o 2,3,7,8-tetraclorodibenzo-p-dioxina (TCDD), muitas vezes chamada simplesmente de dioxina, e este representa a referência para o grupo. Estes compostos são hidrofóbicos, resistem ao metabolismo, persistem no meio ambiente, e são propensos a bioacumular em tecidos adiposos de animais. As propriedades físico-químicas de cada composto individual variam de acordo com o grau de cloração e a posição dos átomos de cloro no anel aromático (USEPA, 2000).
Tabela 2.2 - Fatores de equivalência de toxicidade adotados pela USEPA e pelo OTAN/CCMS (I-EqT).
Composto Usepa I-EqT Composto Usepa I-EqT
Congêneres 2,3,7,8 - substituídos
2,3,7,8-TetraCDD 1 1 2,3,7,8-TetraCDF 0,1 0,1
1,2,3,7,8-PentaCDD 0,5 0,5 1,2,3,7,8-PentaCDF 0,1 0,05
2,3,4,7,8-PentaCDF 0,1 0,5
1,2,3,4,7,8-HexaCDD 0,04 0,1 1,2,3,4,7,8-HexaCDF 0,01 0,1
1,2,3,6,7,8-HexaCDD 0,04 0,1 1,2,3,6,7,8-HexaCDF 0,01 0,1
1,2,3,7,8,9-HexaCDD 0,04 0,1 1,2,3,7,8,9-HexaCDF 0,01 0,1
1,2,3,4,6,7,8-HexaCDF 0,01 0,1
1,2,3,4,5,7,8-HeptaCDD 0,001 0,01 1,2,3,4,5,7,8-HeptaCDF 0,001 0,01
1,2,3,4,7,8,9-HeptaCDF 0,001 0,01
1,2,3,4,6,7,8,9-OctaCDD 0 0,01 1,2,3,4,6,7,8,9-OctaCDF 0 0,001
Fonte: Assunção (1999)
As principais fontes de compostos clorados em fábricas de celulose kraft branqueada são os estágios iniciais do branqueamento realizados com reagentes a base de cloro. A formação de AOX, incluindo clorofenóis e PCDD/Fs, é diretamente proporcional à quantidade de cloro consumida, tanto na forma de Cl2
como de ClO2, no primeiro estágio de branqueamento (Heimberger et al., 1988;
Berry et al., 1989; Earl & Reeve, 1989).
Uma maneira eficaz de se reduzir à formação de AOX é pela substituição de Cl2 por ClO2 no primeiro estágio de branqueamento. Tanto a concentração
como a variedade de compostos organoclorados diminui quando o Cl2 é
substituído por ClO2 (McKague et al., 1998).
Concentrações de dioxinas encontradas em composto orgânico
acima do valor aceitável pela legislação alemã de 17 ng EqT.kg-1, com algumas amostras apresentando valores bastante elevados 138, 130, 112 e 99 ng EqT.kg-1.
Em outra pesquisa (Grossi, 1998), foram avaliadas 21 usinas de compostagem de lixo urbano, em várias regiões do Brasil, e os resultados variaram de 3 a 163 ng EqT.kg-1. Neste mesmo trabalho, foi avaliado o composto orgânico produzido com lodo biológico de uma fábrica de celulose kraft que utiliza branqueamento com cloro, apresentando valores de 3 ng EqT.kg-1.
Uma pesquisa realizada no Canadá por Groeneveld e Hebert (2003) avaliou concentrações de dioxinas e furanos em composto orgânico a partir de várias matérias-primas. O composto orgânico de lixo urbano apresentou valores médios de 31,1 ng EqT.kg-1. Para o composto orgânico de resíduos de jardinagem os valores foram 6,2 ng EqT.kg-1. O composto orgânico produzido com resíduos da indústria de celulose e papel apresentaram valores de 0,9 a 4,9 ng EqT.kg-1. Analisando estes resultados, os autores propuseram ao governo da Província de Quebec no Canadá, o mesmo limite alemão de 17 ng EqT.kg-1 para utilização agrícola do composto orgânico.
2.3.2. Microrganismos patogênicos
De acordo com Pinto (2001), a origem da contaminação microbiológica do lodo de esgoto apresenta grande variabilidade e pode estar relacionada, principalmente, às condições sócio-econômicas da população; às condições sanitárias; à região geográfica; à presença de agroindústrias; e do tipo de tratamento ao qual o lodo foi submetido.
Estudos epidemiológicos têm demonstrado que vírus, ovos de helmintos e cistos de protozoários representam o maior risco para a saúde humana e animal pela utilização do lodo (Lelis & Brasil, 2003).
O principal indicador de patógenos é o coliforme termotolerante e os principais patógenos são: Salmonella, vírus entéricos e os ovos viáveis de helmintos. A Tabela 2.3 apresenta uma comparação entre os diversos limites de concentração destes microrganismos utilizados por alguns países para que o lodo seja considerado seguro para a utilização irrestrita na agricultura, e que, portanto, os processos de higienização devem atingir. Entretanto, manusear e utilizar lodos provenientes de estações de tratamento de esgoto (ETEs) sem um tratamento prévio, que permita a estabilização e a higienização destes produtos, pode apresentar riscos à saúde do homem e de animais (Pinto, 2001).
Tabela 2.3 – Limites de concentração de microrganismos indicadores de patógenos e os patógenos
Microrganismo EUA
(40 CFR 503)
África do Sul
(WRC 1997) Com. Européia
Coliformes Termotolerantes < 1000 UFC/g ST < 1000 UFC/ 10g ST Redução de 6 unid. log.
Salmonella < 3 NMP/ 4g ST 0 NMP/ 10g ST 0 NMP/ 50g ST (massa
úmida)
Enterovírus < 1 NMP / 4g ST n.d. n.d.
Ovos Viáveis de Helmintos < 1ovo viável/ 4g ST 0 ovos viáveis/ 10g ST n.d.
* Os critérios estão expressos em base seca, salvo quando explicitados; n.d. - não disponíveis; UFC – Unidade formadora de colônia; NMP – Número mais provável; ST – Sólidos totais
Fonte: Adaptado de Pinto, 2001
Gerenciamento e tratamento do lodo visando a remoção de microrganismos
patogênicos
produto seguro e confiável, do ponto de vista de contaminação bacteriológica (Matos & Brasil, 2003).
De acordo com Pinto (2001), o objetivo de se introduzir um processo de higienização dos lodos de esgoto é de garantir a qualidade para disposição no solo, onde não venha causar riscos à saúde da população, aos trabalhadores que irão manuseá-lo, e evitar impactos negativos ao meio ambiente. Portanto, a necessidade de se implantar um sistema de higienização complementar de lodos dependerá da alternativa de disposição final que será utilizada.
As tecnologias utilizadas na higienização do lodo incluem processos biológicos (digestão aeróbia e anaeróbia), químicos (adição de produtos químicos que promovem a estabilização) e térmicos (por meio da adição de calor a massa de lodo). Os principais processos de higienização empregados são apresentados no Tabela 2.4.
Tabela 2.4 – Processos avançados de redução de patógenos
Compostagem Revolvimento de leiras: 55 ºC por 15 dias com revolvimento
mecânica durante 5 dias
Secagem por calor Temperatura > 80 ºC nas partículas do lodo e redução da
umidade a 10 % ou menos.
Tratamento térmico Temperatura >180 ºC por 30 minutos para o lodo líquido.
Digestão aeróbia termofílica 10 dias de digestão à temperatura de 55-60 ºC.
Redução de sólidos voláteis > 38 %
Irradiação Raios Beta: 1 megarad a 20 ºC
Raios Gama: 1 megarad a 20 ºC
Pasteurização Temperatura >70 ºC por 30 minutos
Outras tecnologias Redução de patógenos e sólidos voláteis a taxas
equivalentes às tecnologias adicionais listadas acima
Fonte: Adaptado de USEPA (1993)
da matéria orgânica, a temperatura eleva-se, geralmente, na faixa de 60 a 65 ºC nos primeiros dias do processo. Essa elevação da temperatura é responsável pela redução dos microrganismos patogênicos e seus indicadores presentes no lodo (Simoneti, 2006).
Os principais objetivos da compostagem são a conversão biológica da matéria orgânica para uma forma estabilizada, destruição de patógenos, redução da umidade do lodo e produção de um produto que pode ser utilizado na agricultura.
A Resolução do CONAMA nº 375, de 29 de agosto de 2006 (Brasil, 2006) adotou como padrão de controle e garantia de segurança à saúde da população, com respeito a microrganismos patogênicos, duas classes de qualidade microbiológicas de lodo, estabelecendo os limites para a presença de patógenos para aplicação na agricultura (Tabela 2.5). O lodo Classe A permite o uso do lodo de modo irrestrito, sendo produzido através de processos que garantam uma concentração de microrganismos abaixo do limite de detecção, ou seja, lodos que tenham passado por um processo de higienização. Já o lodo Classe B, produzido através de processos convencionais de estabilização, possui algumas restrições e recomendações para sua utilização agrícola.
Tabela 2.5 – Limites de tolerância de microrganismos indicadores e patógenos Classe A
Coliformes Termotolerantes ...< 103 NMP.g-1 de sólidos totais Ovos viáveis de helmintos ...< 0,25 ovo.g-1 sólidos totais
Salmonella ...ausência em 10 g de sólidos totais
Vírus ...< 0,25 UFP ou UFF.g-1 de sólidos totais Classe B
Coliformes Termotolerantes ...< 106 NMP.g-1 de sólidos totais Ovos viáveis de helmintos ...< 10 ovos.g-1 sólidos totais Fonte: Brasil (2006)
De acordo com a Resolução do CONAMA nº 375 (Brasil, 2006), é proibida a utilização de qualquer classe de lodo de esgoto em pastagens a menos que estas sejam implantadas após 24 meses da última aplicação de lodo e cultivo de culturas de oleícolas, tubérculos e raízes, e demais culturas cuja parte comestível entre em contato com o solo, assim como culturas inundadas estas só podem ser implantas após 48 meses após a última aplicação do lodo. Os lodos enquadrados na Classe A poderão ser utilizados para qualquer cultura respeitando as restrições citadas. Para o lodo Classe B, seu uso é restrito no cultivo de café, cana-de-açúcar, silvicultura, culturas para produção de fibras e óleos, com a aplicação mecanizada, em sulcos ou covas, seguida de incorporação, respeitadas as restrições locacionais e a restrição de acesso público nas áreas de aplicação.
2.3.3. Metais Pesados
Segundo Sousa (1998), os metais pesados que contaminam o ambiente derivam de inúmeras fontes, que podem ser classificadas em aerossóis urbano-industriais, rejeitos líquidos e sólidos de animais e homens, mineração e industrias, e pesticidas agrícolas. Traços de metais pesados tais como Ni, Mn, Pb, Cr, Zn, Fe e Hg aparecem constantemente em alguns despejos industriais, e a presença deles compromete a qualidade da água.
Embora se saiba que o setor de celulose e papel não é fonte geradora de metais pesados, pois esta tipologia industrial transforma a madeira em polpa celulósica, estando presentes, os metais contidos na estrutura da madeira.
De acordo com Silva et al. (2001), metais pesados podem ser entendidos que em determinadas concentrações e tempo de exposição, oferecem risco à saúde humana e ao ambiente, prejudicando a atividade dos organismos vivos.
Concentrações de metais no composto orgânico
O composto orgânico provenientes dos resíduos indústrias, urbanos e rurais, são classificados segundo a Instrução Normativa nº 23 de 31/08/2005 (Brasil, 2005), em quatro classes de acordo com as matérias primas utilizadas na sua produção como:
• Classe “A”: fertilizante orgânico que, em sua produção, utiliza matéria-prima de origem vegetal, animal ou de processamentos da agroindústria, onde não sejam utilizados no processo o sódio (Na+), metais pesados, elementos ou compostos orgânicos sintéticos potencialmente tóxicos;
• Classe “B”: fertilizante orgânico que, em sua produção, utiliza matéria-prima oriunda de processamento da atividade industrial ou da agroindústria, onde o sódio (Na+), metais pesados, elementos ou compostos orgânicos sintéticos potencialmente tóxicos são utilizados no processo;
• Classe “C”: fertilizante orgânico que, em sua produção, utiliza qualquer quantidade de matéria-prima oriunda de lixo domiciliar, resultando em produto de utilização segura na agricultura; e
• Classe “D”: fertilizante orgânico que, em sua produção, utiliza qualquer quantidade de matéria-prima oriunda do tratamento de despejos sanitários, resultando em produto de utilização segura na agricultura.
Tabela 2.6 – Especificações das garantias nas classes de composto orgânico. Garantia Classe A Classe B Classe C Classe D
Umidade (% máx.) 50 50 50 70
N total (% mín.) 1 1 1 1
* Carbono orgânico (% mín.) 15 15 15 15
* CTC Conforme declarado
pH (mín.) 6,0 6,0 6,5 6,0
Relação C:N (máx.) 18 18 18 18
* Relação CTC:C (mín.) 20 20 20 30
Soma NPK, NP, NK, PK Conforme declarado
* valores expressos em base seca, umidade determinada a 65 ºC.
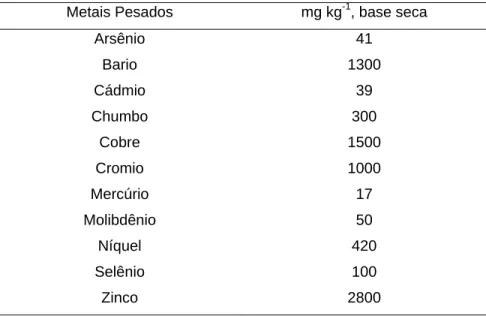
Atualmente, a Resolução do Resolução do CONAMA nº 375 (Brasil, 2006), estabelece os limites máximos de metais pesados presentes no biossólido (lodo estabilizado proveniente de tratamento de esgoto) e seus derivados (destinado à produção de composto orgânico) para aplicação no solo, conforme apresentado na Tabela 2.7.
Tabela 2.7 – Limites de metais pesados para aplicação de biossólido e seus derivados no solo, em.
Metais Pesados mg kg-1, base seca
Arsênio 41
Bario 1300
Cádmio 39
Chumbo 300
Cobre 1500
Cromio 1000
Mercúrio 17
Molibdênio 50
Níquel 420
Selênio 100
Zinco 2800
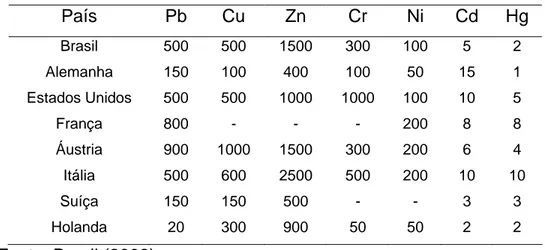
em países como: Brasil, Alemanha, Estados Unidos, França, Áustria, Itália, Suíça e Holanda (Brasil, 2002).
Tabela 2.8 – Teores permissíveis de metais pesados (mg.kg-1) no composto orgânico em alguns países, base seca à 65 °C.
País Pb Cu Zn Cr Ni Cd Hg
Brasil 500 500 1500 300 100 5 2
Alemanha 150 100 400 100 50 15 1 Estados Unidos 500 500 1000 1000 100 10 5
França 800 - - - 200 8 8
Áustria 900 1000 1500 300 200 6 4
Itália 500 600 2500 500 200 10 10
Suíça 150 150 500 - - 3 3
Holanda 20 300 900 50 50 2 2
Fonte: Brasil (2002)
Nos Estados Unidos, a Agência de Proteção Ambiental Norte-Americana (USEPA), regulamenta as doses máximas de metais em lodo de esgoto, e é baseada no conceito de rotas de exposição, o mesmo empregado pelo Brasil. Esse conceito permite o acúmulo de metais pesados no solo, até um limite máximo previamente estabelecido pela legislação (Brasil, 2002).
2.4. Referências Bibliográficas
ASSUNÇÃO, J. V. PESQUEIRO, C. R. Dioxinas e furanos. Revista Saúde Pública, v.33, n.5, 1999.
BAIRD, C. Química Ambiental. Porto Alegre: Bookman, 1999
BARREIRA, L. P. JUNIOR, A. P. RODRIGUES, M. S. Usinas de compostagem do estado de São Paulo: Qualidade dos compostos e processos de produção. Engenharia Sanitária Ambiental. v.11, n.4, p. 385-393, out/dez, 2006.
BELLOTE, A. F. J. SILVA, H. D. FERREIRA, C. A. ANDRADE, G. C. Resíduos da indústria de celulose em plantios florestais. Boletim de Pesquisa Florestal, Colombo, v. 37, p. 99-106, Jul./Dez. 1998.
BERRY, R. M.; FLEMING, B. I.; VOSS, R. H.; LUTHE, C. E.; WRIST, P. E. Toward preventing the formation of dioxins during chemical pulp bleaching. Pulp and Paper. v.90, n.8: p.279-289, 1989.
BRASIL. Ministério da Agricultura Pecuária e Abastecimento e Empresa Brasileira de Pesquisa Agropecuária (Embrapa). Circular Técnica nº 03 – Recomendações Técnicas para o Uso Agrícola do Composto de Lixo Urbano no Estado de São Paulo. Campinas – SP, Novembro, 2002.
BRASIL. Ministério de Meio Ambiente. Instrução Normativa nº 23, de 31/08/2005. Aprova as Definições e Normas Sobre as Especificações e as Garantias, as Tolerâncias, o Registro, a Embalagem e a Rotulagem dos Fertilizantes Orgânicos Simples, Mistos, Compostos, Organominerais e Biofertilizantes Destinados à Agricultura. Diário Oficial da União. 2005
BRASIL. Conselho Nacional de Meio Ambiente. Resolução nº 375, de 29/08/2006. Define critérios e procedimentos, para o uso agrícola de lodos de esgoto gerados em estações de tratamento de esgoto sanitário e seus produtos derivados, e dá outras providências. Diário Oficial da União. 2006.
BRITT, K. H . Handbook of pulp and paper technology. New York : Reinhold Publishing Corporation, 1965.
CASEY, J. P. Pulp and Paper. Chemistry and chemical technology. New York : John Wiley & Sons, 1980.
CENIBRA. Relatório Anual 2006. Belo Oriente: 2007.
EARL, P. F.; REEVE, D. W. Chlorinated organic matter in bleached chemical pulp production. The effect of chlorination stage variables on chlorinated organic matter in effluent. Tappi: v.72, n.10, p.183-187. 1989.
GOUVEA, l. C. Estudo e avaliação da distribuição química de metais pesados na compostagem de lodo de esgoto. Dissertação (Mestrado em Agroquímica) - Departamento de Química, Universidade Federal de Viçosa. 256p. 1996.
GROENEVELD, E.; HEBERT, M. Dioxins, furans, PCBs and PAHs in eastern Canada compost. Ministério de Meio Ambiente na Província de Quebec no Canadá. 2003.
GROSSI, G. LICHTIG, J. KRAUB, P. PCDD/F, PCB and PAH content of Brazilian compost. Chemosphere. v.37, n.9- 12, p. 2153-2160. 1998.
HEIMBURGER, S. A.; BLEVINS, D. S.; BOSTWICK, J. H.; DONNI, G. P. Kraft mill bleach plant effluents: recent developments aimed at decreasing their environmental impact, Part 2. Tappi. v.71, n.11, p.69-78, 1988.
KIEHL, Edmar José, Fertilizantes Orgânicos. São Paulo, Ed. Agronômica Ceres Ltda. 492 p. 1985.
LELIS, M. N.; BRASIL, M. S.; MOUNTEER, A. H. Reciclagem de biossólidos: gerenciamento, tratamento e normatização. In: III Encontro de Preservação de Mananciais da Zona da Mata Mineira. Anais... Viçosa: Universidade Federal de Viçosa - UFV, 392p. 2003.
MACDONALD, Ronald G. Papermaking and paper board making. New York : McGraw – Hill, 1970.
MATOS, A. T.; BRASIL, M. S. Aproveitamento agrícola de biossólidos. In: III Encontro de Preservação de Mananciais da Zona da Mata Mineira. Anais... Viçosa: Universidade Federal de Viçosa - UFV, 2003. 392p.
MORAIS, A. A. Uso de ozônio como pré e pós-tratamento de efluentes da indústria de celulose kraft branqueada. Dissertação (Mestrado) – Departamento de Engenharia Civil, Universidade Federal de Viçosa. 2006. 97p.
PHILIPP, Paul. Celulose e Papel – Tecnologia de fabricação da pasta celulósica. São Paulo : IPT, 1988.
PINTO, M. T. Higienização de lodos. In: Princípios do tratamento biológico de águas residuárias. Lodo de esgotos: tratamento e disposição final. Belo Horizonte: Departamento de Engenharia Sanitária e Ambiental - UFMG; Companhia de Saneamento Básico do Paraná - SANEPAR, v.6. 1.ed. 2001.
SILVA, S. M. C. P. FERANDES, F. SOCCOL, V. T. MORITA, D. M. Principais contaminantes do lodo. In: Princípios do tratamento biológico de águas residuárias. Lodo de esgotos: tratamento e disposição final. v.6. 1.ed. Belo Horizonte: Departamento de Engenharia Sanitária e Ambiental - UFMG; Companhia de Saneamento Básico do Paraná - SANEPAR, 2001.
SIMONETI, M. de F. Inativação térmica de ovos de helmintos em água e em biossólidos: cinética em reator batelada e modelagem matemática em reator tubular. Tese (Doutorado) – Escola Politécnica, Universidade de São Paulo. 2006. 251 p.
SOUZA, H. A.. Estudo da contaminação ambiental na área do aterro sanitário da BR-40, da Prefeitura Municipal de Belo Horizonte - MG. Dissertação (Mestrado em Geologia) - Escola de Minas, Universidade Federal de Ouro Preto. 1998. 145p.
USEPA – United States Environmental Protection Agency. Standards for the use or disposal of sewage sludge: 40 CFR Parts 503. Washington: EPA, 1993. 26p. USEPA – United States Environmental Protection Agency. Standards for the use or disposal of sewage sludge: 40 CFR Parts 403 and 503. Washington: EPA, 1995. 28p.
USEPA – United States Environmental Protection Agency. Draft exposure and human health reassessment of 2,3,7,8 – tetrachlorodibenzo-p-dioxin (TCDD) and related compounds. EPA/600/P-00/001. National Center for Environmental Assessment, Washington. D.C., September, 2000.
3. AVALIAÇÃO DOS INDICADORES MICROBIOLÓGICOS E PATOGÊNICOS NO LODO BIOLÓGICO E DURANTE OS PROCESSOS DE COMPOSTAGEM
Resumo
3.1 Introdução
A indústria de celulose gera uma grande quantidade de resíduos sólidos. Há grande incentivo por parte das fábricas em reaproveitá-los, buscando obter maiores rendimentos de seus processos produtivos e, conseqüentemente, gerar menos resíduos, minimizando os custos de disposição final.
Uma maneira de reaproveitar os resíduos orgânicos de uma forma ambientalmente correta é por meio do processo de compostagem. A compostagem pode ser definida como uma decomposição aeróbia controlada de substratos orgânicos. O resultado deste processo é um produto estabilizado, rico em matéria orgânica e microrganismos essenciais para o solo.
A aplicação deste composto orgânico está condicionada ao controle da sua qualidade, destacando-se a presença de microrganismos patogênicos, as concentrações de metais pesados e o grau de estabilidade da matéria orgânica.
Há uma tendência na indústria de celulose, de produzir composto orgânico a partir do lodo biológico da estação de tratamento de efluentes misturado com as cascas de eucalipto. No entanto, existem dúvidas quanto à segurança sanitária, devido à presença de esgotos sanitários da fábrica que são tratados juntamente com os efluentes industriais na estação de tratamento de efluentes.
3.2 Material e Métodos
Resíduos utilizados no experimento
A casca de eucalipto e o lodo biológico foram fornecidos pela empresa Celulose Nipo-Brasileira - CENIBRA, as cascas são provenientes de descascadores a tambor. São geradas 1.700 t.dia-1 de cascas na fábrica, sendo que 66 % são encaminhados para a queima na caldeira de biomassa e 22 % para a compostagem, o restante é comercializado.
São geradas 220 t.dia-1 a 12 % de consistência de lodo biológico na estação de tratamento de efluentes (ETE) pelo processo de lodos ativados, todo lodo gerado é utilizado no processo de compostagem. A ETE trata 5.100 m3.h-1 de efluentes, que são provenientes sobretudo do setor de branqueamento (contribuição de 90% de efluente na ETE) e 150 m3.h-1 de esgoto sanitário.
Instalação e monitoramento do experimento
O experimento foi conduzido em uma área de compostagem da empresa Cenibra, durante 90 dias. O teste de compostagem constituiu da montagem de cinco pilhas em formato cônico, com uma formulação de 50 % de lodo biológico (proveniente do tratamento secundário da estação de tratamento de efluentes) e 50 % de casca de eucalipto, em peso, correspondendo cada pilha a um volume inicial de 15 m3, esta relação é a mesma adotada pela empresa Cenibra. As pilhas foram revolvidas três vezes por semana durante o primeiro mês de teste, duas vezes por semana durante o segundo mês e uma vez por semana no último mês de teste.
casca de eucalipto, no lodo biológico “in natura” e no material das pilhas de composto orgânico no final do experimento.
A temperatura nas pilhas de compostagem foi medida com termômetro digital, inserindo-se a sonda a 40 cm da superfície de cada leira.
Análises dos parâmetros físico-químicos
O pH foi determinado na suspensão de 10 g da mistura em 30 ml de água destilada, após agitação e homogeneização. A umidade foi determinada por secagem em estufa a 105 ºC até peso constante (24 h). Para a determinação dos sólidos voláteis, 2,0 g calcinadas à 550 ºC durante 2 horas. O nitrogênio total foi determinado pelo método Kjeldahl a partir de uma amostra triturada, da qual foi tomada uma alíquota de 0,5 g em peso seco. O carbono orgânico foi determinado pelo Método Walkley & Black que utiliza o dicromato em meio ácido como oxidante dos compostos orgânicos contidos em amostra de 0,1 g (Camargo, 1996).
As análises de macro e micronutrientes foram realizadas conforme o método USEPA 3050b, da Agência de Proteção Ambiental dos EUA (USEPA, 1998). Após a digestão em ácido HNO3 e HCl concentrado, foram determinadas
as concentrações de macronutrientes (P, K, Ca, Mg) e micronutrientes (Fe, Mn, Zn, Cu, B, Mo, Al, Na Co, Ba), por espectrofotômetro por emissão de plasma, e os parâmetros de Na e K foram determinados em fotômetro de chama (Micronal – B462).
Análises microbiológicas
(teste presuntivo para a presença de coliformes) foi repicada para caldo EC, contido em tubos. Esses tubos foram incubados a 45 ± 0,1 ºC por 24 h. A produção de gás no caldo EC confirmou a presença de coliformes termotolerantes.
A análise da presença de Salmonella spp. foi conduzida segundo a metodologia descrita no Método 996.08 (AOAC, 1996). Inicialmente, 25 g da amostra fresca diluída em 225 ml de água peptonada tamponada foram incubados por 18 h a 35 ºC, em etapa de pré-enriquecimento. A seguir, alíquotas dessa cultura foram transferidas para o caldo Rappaport, e selenito-cistena, para o enriquecimento seletivo de Salmonella e incubadas por 24 h a 35 ºC, determinado pelo sistema de reações imunoenzimáticas VIDAS® (BIOLAB-MERIEUX S.A.)
Ovos viáveis de helmintos nas amostras de lodo foram quantificados pelo método descrito por Meyer et al. (1978) e modificado por Paulino et al. (2001). Setenta e cinco gramas de amostra fresca foram tratados com água sanitária (225 ml, 50 min) e depois lavados com água destilada contendo Tween 80 (1 %), até que o sobrenadante ficasse clarificado. O sedimento foi coletado entre as lavagens por centrifugação (2800 rpm, 3 min). Após a etapa de lavagem, 75 ml de ZnSO4 (densidade 1,18 kg.m-3) foram adicionados ao sedimento, e a mistura
centrifugada novamente. O sobrenadante, contendo ovos flotados, foi filtrado em membrana com poro de 0,45 µm e o material retirado na membrana transferido para um placa de Petri contendo 15 ml de H2SO4, 0,1 N. Para verificar a
viabilidade dos ovos, a placa de Petri foi incubada em estufa a 28 ºC durante 28 dias. Após esse período, um alíquota da amostra foi transferida para um câmara de Sedgewick-Rafter e os ovos contendo larvas e apresentando mobilidade contados no microscópio.
Para os vírus entéricos (adenovírus e enterovírus (Poliovírus, Echovírus, Coxsackievírus)), as amostras foram enviadas para laboratório especializado, utilizando-se ensaios de detecção rápida com PCR (Santos et al., 2004; Formiga-Cruz et al., 2005).
secagem até peso constante a 103± 2 ºC, conforme o método 2540 G (APHA, 1995).
Analises estatísticas
Os parâmetros de monitoramento avaliados nas pilhas de compostagem foram submetidos à análise de variância em um esquema fatorial 5 x 4 ( 5 pilhas de compostagem e 4 períodos amostrais), no delineamento em blocos ao acaso com três repetições.
3.3 Resultados e Discussão
Controle do Processo de Compostagem
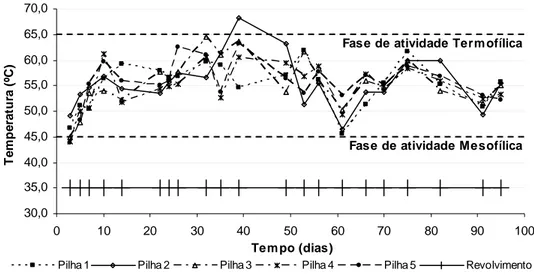
Durante os 90 dias do experimento, houve desenvolvimento apenas de temperaturas termofílicas na faixa de 50 a 65 ºC em todas as pilhas (Figura II-1), garantindo uma série de vantagens como o aumento da taxa de decomposição da matéria orgânica e a eliminação de microrganismos patogênicos. Segundo Pereira Neto (2004), a temperatura é o fator mais indicativo do equilíbrio biológico, o que reflete a eficiência do processo.
Com 60 dias, foram adicionados 3.000 m3 de água, em cada pilha, com o objetivo de aumentar a umidade, promovendo um decréscimo temporário da temperatura (Figura 3.1).
30,0 35,0 40,0 45,0 50,0 55,0 60,0 65,0 70,0
0 10 20 30 40 50 60 70 80 90 100 Tem po (dias)
T
em
p
er
at
u
ra (
ºC
)
Pilha 1 Pilha 2 Pilha 3 Pilha 4 Pilha 5 Revolvimento
Fase de atividade Term ofílica
Fase de atividade Mesofílica
Figura 3.1 – Variação de temperatura nas pilhas de compostagem.
Na Tabela 3.1, estão apresentados os resultados das análises químicas do lodo biológico e casca de eucalipto “in natura” e dos compostos orgânico produzidos.
Tabela 3.1 – Resultados das análises químicas do lodo biológico e casca de eucalipto “in natura” e das pilhas de compostagem no final de 90 dias.
pH Umidade
105 ºC SV C N P K
H2O - - - - dag.kg -1
- - - -
Relação C/N
dag.kg-1 - - - g.dm-3 - - -
Lodo Bio. 7,3 86,9 87,1 5,6 31,4 56,26 114,4 1,70
Casca de Euc. 8,5 59,2 95,2 389,8 99,1 2,55 6,61 0,91
Pilha 1 8,5 49,1 42,2 28,0 29,9 10,78 27,44 1,06
Pilha 2 8,3 53,1 64,2 51,7 50,4 9,76 19,15 1,14
Pilha 3 8,6 44,1 52,2 38,5 42,1 10,93 25,38 1,04
Pilha 4 8,5 46,5 50,4 44,9 44,3 9,90 20,96 1,06
Pilha 5 8,8 46,9 51,8 35,7 41,9 11,75 24,94 1,01
Limites 6 a 8,6 1 < 40 1 < 21 1 > 11,0 1 > 7,0 1 > 7,0 1
Ca Mg Al Na Fe Mn Cr Ni
- - - cmolc.dm-3 - - - - - - mg.dm-3 - - -
Lodo Bio. 43,06 10,10 16,62 3.724,9 4.775,9 456,1 44,88 22,40
Casca de Euc. 27,90 3,00 5,05 195,0 2.308,5 211,2 7,26 1,50
Pilha 1 46,22 10,97 41,61 969,5 21.501,0 1.406,6 100,4 6,74
Pilha 2 26,91 3,54 33,33 748,5 13.221,9 345,3 35,21 5,70
Pilha 3 52,62 10,07 41,55 1.229,0 19.671,7 1.495,8 81,85 6,27
Pilha 4 27,92 3,47 41,11 784,8 15.466,7 306,8 50,12 6,34
Pilha 5 37,59 4,51 42,92 1.629,8 17.130,0 457,9 54,84 6,92
Limites > 128 1 > 12,8 1 < 1000
2
< 200 3
< 420 2 < 70 3
Cd B Mo Zn Pb Cu Co Ba
- - - mg.dm-3 - - -
Lodo Bio. nd 53,40 2,46 80,69 4,55 23,05 1,21 54,80
Casca de Euc. nd 11,41 0,34 5,22 0,41 1,49 0,06 14,58
Pilha 1 nd 195,4 1,39 27,09 4,89 8,29 1,47 26,57
Pilha 2 nd 74,61 0,94 28,01 3,53 7,19 0,61 22,79
Pilha 3 nd 117,8 0,99 22,97 4,46 8,38 1,49 26,12
Pilha 4 nd 92,43 0,92 21,31 4,85 8,28 0,85 19,48
Pilha 5 nd 103,7 0,84 24,63 4,80 8,99 1,02 23,09
Limites < 39
2
< 3 3 < 50
2
< 2.800 2 < 300
2
< 150 3 < 1.500
2
< 1.300 2
Resultados expressos em matéria seca a 105 ºC. 1
Requisitos mínimos para que o composto orgânico maturado possa ser utilizado na agricultura, segundo Magalhães (2002).
2
Limites de metais pesados, segundo Brasil (2006a). 3
De acordo com os resultados obtidos nas pilhas de compostagem, a partir do aproveitamento dos resíduos de casca de eucalipto e lodo biológico da indústria de celulose, pode-se afirmar que o composto orgânico produzido apresentou boa qualidade quanto às concentrações de macro e micronutrientes, bem como no que se refere às concentrações de metais pesados. Embora, tenha a necessidade de ser compostado por mais tempo, para que a relação C:N e o teor de umidade alcance valores estabelecidos pela legislação (Brasil, 2002).
Os resultados da análise de variância da umidade, pH, sólidos voláteis, relação C:N, carbono orgânico e nitrogênio total, durante o processo de compostagem são apresentados na Tabela 3.2. Observou-se que, apesar de terem as mesmas formulações iniciais (50 % de casca de eucalipto + 50 % de lodo biológico em peso), as pilhas não apresentaram comportamentos semelhantes.
Tabela 3.2 - Análise de variância dos resultados de massa seca foliar e número de folhas, nos tratamentos propostos.
Quadrados Médios Fontes de
Variação GL Umidade 105 ºC pH Sólidos Voláteis
Relação C/N
Carbono Org.
Nitrogênio Total Pilhas 4 63,09 ** 0,22 ** 124,6 ** 7211,7 ** 182,7 ** 0,118 ** Período 3 1354,3 ** 1,54 ** 4141,2 ** 73843,8 ** 5543,5 ** 1,068 **
Pilhas X Período
12 26,11 ** 0,049 ns 86,13 ** 3694,8 ** 71,5 ** 0,018 **
Resíduo 38 2,1 0,028 13,12 234,4 10,07 0,0058
CV1/(%) 2,5 1,9 5,2 17,0 5,0 8,5
1/ coeficiente de variação de médias; ns F não significativo a 1% e 5%; ** F significativo a 1%; * F significativo a 5%.
Tabela 3.3 – Médias dos parâmetros de umidade 105 ºC, pH, sólidos voláteis, relação C/N, carbono orgânico, nitrogênio total durante o período de compostagem.
Pilhas 3dias 49dias 66dias 91dias
Umidade 105 ºC
1 72,6 A a 55,6 AB b 57,5 A b 49,1 B c
2 69,8 AB a 58,7 A b 59,0 A b 53,1 A c
3 72,2 A a 56,0 AB b 53,8 B b 44,1 C c
4 66,8 B a 54,3 B b 52,2 B b 46,5 BC c
5 70,2 AB a 57,4 AB b 45,7 C c 46,9 BC c
pH
1 8,7 ns 9,1 ns 8,9 ns 8,5 ns
2 8,1 ns 8,8 ns 8,8 ns 8,3 ns
3 8,4 ns 9,1 ns 9,0 ns 8,6 ns
4 8,1 ns 9,0 ns 8,7 ns 8,5 ns
5 8,3 ns 9,1 ns 8,8 ns 8,8 ns
Sólidos Voláteis (%)
1 92,4 A a 74,5 AB b 72,7 A b 42,2 C c
2 94,1 A a 80,2 A b 61,8 B c 64,2 A c
3 88,6 A a 68,3 B b 65,0 AB b 52,2 B c
4 90,5 A a 67,6 B b 56,8 B c 50,4 BC c
5 91,6 A a 75,1 AB b 62,0 B c 51,8 B d
Relação Carbono:Nitrogênio
1 118,6 C a 70,6 A b 46,0 A bc 28,0 A c
2 260,5 A a 83,6 A b 75,6 A b 51,7 A b
3 165,9 B a 66,9 A b 49,9 A b 38,5 A b
4 287,9 A a 68,5 A b 56,2 A b 44,9 A b
5 134,1 BC a 66,0 A b 48,9 A b 35,7 A b
Carbono Orgânico (%)
1 84,6 AB a 78,5 AB a 49,6 B b 29,9 C c
2 85,0 AB a 81,6 A a 61,5 A b 50,4 A c
3 78,2 B a 65,8 C b 53,2 B c 42,1 B d
4 86,9 A a 71,0 C b 50,7 B c 44,3 AB c
5 84,1 AB a 72,7 BC b 48,6 B c 41,9 B c
Nitrogênio Total (%)
1 0,73 A b 1,11 A a 1,08 A a 1,08 AB a
2 0,33 BC b 0,98 A a 0,82 B a 0,98 B a
3 0,50 B b 0,98 A a 1,07 A a 1,09 AB a
4 0,30 C b 1,04 A a 0,90 AB a 0,99 AB a
5 0,64 A c 1,11 A ab 0,99 AB b 1,17 A a
Médias seguidas de pelo menos uma mesma letra maiúscula na coluna, e minúscula na linha para cada tipo de análise não diferem entre si ao nível de 5% de probabilidade pelo teste de Tukey, valores médios de três repetições.
Os resultados de pH apresentaram-se dentro da faixa considerada ideal por Kiehl (1985) e Pereira Neto (2004), estando entre 8,1 e 9,1 durante todo o processo de compostagem.
Observou-se através dos dados apresentados na Tabela 3.3, que nos primeiros dias de compostagem as pilhas apresentaram teor de umidade próximo de 70%. Esta umidade inicial alta se deve a adição do lodo biológico cujo percentual de umidade “in natura” é de 87 %. No decorrer do processo de compostagem perdeu-se umidade por evaporação, principalmente durante os revolvimentos, chegando na faixa de 45 à 55 %, considerada ideal por Kiehl (1985).
No campo experimental, observou-se que as pilhas 1 e 2 recebiam menos luz solar, o que poderia influenciar no percentual de umidade. Entretanto, estatisticamente esta diferença pôde ser observada somente a partir da nona semana (Tabela 3.3).
O parâmetro de sólidos voláteis, utilizado para se avaliar o grau de degradação (transformação do material orgânico em inorgânico), apresentou um percentual de redução satisfatória durante a compostagem em todas as pilhas, variando de 31 a 50 %. Segundo Mota et al. (2002), um processo de compostagem eficiente deve apresentar uma redução média de 40 % do teor inicial de sólidos voláteis.
A relação carbono/nitrogênio apresentou redução em todas as pilhas, variando de 25 % a 43 %, embora nenhuma pilha tenha atingido a relação de 21:1 recomendada para aplicação na agricultura (Brasil, 2002). Observou-se a necessidade de mais tempo de compostagem, para adequar à legislação.
Análise microbiológica durante o processo
As análises de coliformes termotolerantes foram realizadas inicialmente na estação de tratamento da empresa. Devido ao tratamento do esgoto sanitário junto
coliformes termotolerantes, considerando o intervalo de confiança de 95 %, o que indica que a chance do número real presente na amostra estar incluído no intervalo de valores entre 0 a 95 NMP.g-1 é de 95 %. Acredita-se que, as características do efluente tenham influenciado no baixo valor encontrado, em decorrência dos químicos utilizados no processo.
Os resultados das análises de coliformes termotolerantes das amostras de composto orgânico durante o processo de compostagem são apresentados no Tabela 3.4. Apesar de ter sido utilizado o lodo biológico, pode-se observar que o processo de compostagem foi eficiente na eliminação destas bactérias indicadoras, devido à elevada temperatura na fase termofílica por um período longo de 90 dias, apresentando valores menores que 3,0 NMP.g-1, inferior ao limite permissível de 1.000 NMP.g-1 para aplicação na agricultura (Brasil, 2006a). Apenas uma amostra da pilha 5 com 45 dias apresentou valores de 75 NMP.g-1 de coliformes termotolerantes.
Tabela 3.4 – Resultados das análises de coliformes termotolerantes nas amostras de composto orgânico.
Composto Orgânico (45 dias de compostagem)
Composto Orgânico (90 dias de compostagem)
NMP.g-1 NMP.g-1
Pilha 1 < 3,0 < 3,0
Pilha 2 < 3,0 < 3,0
Pilha 3 < 3,0 < 3,0
Pilha 4 < 3,0 < 3,0
Pilha 5 75 < 3,0
vírus entéricos, que mantenham a infectividade por um período superior a 30 dias de digestão a 50 °C.
Os resultados obtidos não apresentaram nenhuma unidade formadora de vírus entéricos (Adenovírus e Enterovírus “Poliovírus, Echovírus, Coxsachievírus”) nas amostras de lodo biológico e nas pilhas de compostagem. O limite estabelecido pelo CONAMA nº 375 é menor que 0,25 unidades formadoras de placa por grama de sólidos secos.
Durante o processo de compostagem não foi encontrado nenhuma a presença de Salmonella spp, em alíquotas de 25 g da amostra, exceto na amostra inicial de lodo biológico bruto da Pilha 4. A metodologia utilizada para detecção de
Salmonella spp incluiu uma etapa de pré-enriquecimento, seguindo de um
enriquecimento seletivo e posteriormente, o teste imunoensaio automatizado, no intuito de maximizar as chances de acusar sua presença em um tempo mais curto que o especificado no método padrão. Entretanto, é importante lembrar que a legislação, estabelece ausência em 10 g de amostras e analisou-se em 25 g, com isso, a analise foi mais rigorosa do que solicitado pela legislação.
A quantidade de ovos viáveis de helmintos no composto orgânico é outro indicador importante para a qualidade sanitária. Foi constatada a presença da viabilidade de ovos de Ancylostoma sp. no lodo biológico bruto foi de 0,5 à 3,9 ovo viável por grama de sólidos secos, e posteriormente não foi observado nenhum ovo (viável ou não viável) no composto orgânico produzido, demonstra a eficiência do processo de compostagem.
O gênero Ancylostoma é um dos agentes causadores da ancilostomíase, uma infestação de vermes nematódeos no intestino delgado e pulmões. Esses vermes desenvolvem todo seu ciclo de vida em seres humanos e outros animais de sangue quente, sem outros reservatórios (Britton, 1994).
3.4 Conclusões
Numa avaliação geral, o composto produzido apresentou um conjunto de características desejáveis para este tipo de produto, tais como: coloração do material, cheiro, pH, concentrações de metais pesados, composição de macro e micronutrientes, embora o período de 90 dias de compostagem não ter sido suficiente para se adequar a legislação com base na relação C:N e teor de umidade, necessitando de mais tempo de compostagem.
O processo de compostagem foi eficiente, em termos de eliminação de microrganismos indicadores e patogênicos como: coliformes termotolerantes,
Salmonella, ovos viáveis de helmintos e vírus entéricos, e o composto orgânico
3.5 Referência Bibliográfica
AOAC International. AOAC Official Method 996.08. Official methods of analysis of the association of official analytical chemists (16th ed.). AOAC International, Gaithersburg, MD. 1996.
APHA. American Public Health Association. Standard Methods for Examination of Water and Wastewater, 19. Washington: APHA, AWWA, WEF, 1995.
BIOLAB-MERIEUX S. A. Manual sistema VIDAS® e MINI-VIDAS® , Estrada do Mapuá 491, Jacarepaguá, Rio de Janeiro, Brasil.
BRITTON, G. Wastewater microbiology. New York: Wiley-Liss, 1994.
BRASIL. Conselho Nacional de Meio Ambiente. Resolução nº 375, de 29/08/2006. Define critérios e procedimentos, para o uso agrícola de lodos de esgoto gerados em estações de tratamento de esgoto sanitário e seus produtos derivados, e dá outras providências. Diário Oficial da União. 29/08/2006, 2006a.
BRASIL. Secretaria de Defesa Agropecuária. Instrução Normativa nº 27, de 09/06/2006. Referem-se às concentrações máximas admitidas para agentes fitotóxicos, patogênicos ao homem, animais e plantas, metais pesados tóxicos, pragas e ervas daninhas. Diário Oficial da União. 09/06/2006, 2006b.
BRASIL. Secretaria de Defesa Agropecuária. Instrução Normativa nº 62 de 26/08/2003. Oficializa os Métodos Analíticos Oficiais para Análises Microbiológicas para Controle de Produtos de Origem Animal e Água. Diário Oficial da União. 26/08/2003, 2003.
BRASIL, Ministério da Agricultura Pecuária e Abastecimento e Empresa brasileira de Pesquisa Agropecuária (Embrapa). Circular Técnica nº 03 – Recomendações Técnicas para o Uso Agrícola do Composto de Lixo Urbano no Estado de São Paulo. Campinas – SP, Novembro, 2002.
CAMARGO, O.A.; MONIZ, A.C.; JORGE, J. A.; VALADARES, J. M. A. S. Métodos de analise química, mineralógica e física de solos do Instituto agronômico. Boletim Técnico nº 106. Instituto Agronômico de Campinas, 1996.
CETESB. Coliformes fecais - Determinação em amostras de água pela técnica de tubos múltiplos com meio A1 - Método de ensaio. Norma Técnica CETESB L5-406, 1992, 20 p.
detection of human enteric víruses in shellfish and sewage. Journal Virology Method, v.125 p.111-118, 2005.
KIEHL, E. J. Fertilizantes orgânicos. São Paulo: Ed. Agronômica Ceres Ltda. 1985. 492 p.
MAGALHAES, M. A. Parâmetros para projeto e operação de filtros orgânicos utilizados no tratamento de águas residuárias da suinocultura. Tese (Mestrado) – Universidade Federal de Viçosa: Viçosa, 2002.
MEHNERT, D.U.; STEWEIN, K.E. Detection and distribution of rotavirus in raw sewage and creeks in São Paulo, Brazil. App. Environmental Microbial, v. 59, p. 140-143. 1993.
MEYER, K. B., MILLER, K. D & KANESHIRO, E. S. Recovery of Ascaris eggs from sludge. Journal Parasitology. v.64 n.2, p.380 – 383, 1978.
METCALF, T. G.; MELNICK, J.L., ESTES, M.K. Environmental virology: from detection of vírus in sewage and water by isolation to identification by molecular biology – a trip of over 50 years. Annu Rev. Microbial, v. 49, p. 461-487. 1995. MOTA, J. P., PEREIRA NETO, J. T., CABALLOS, B. S. O., SOUZA, F. C. Utilização da compostagem para o tratamento de resíduos de madeira e aparas de grama. In: XXVIII Congreso Interoamericano de Ingeniería Sanitária y Ambiental. Anais... Cancun, México. 2002.
PEREIRA NETO, J. T. Produção de composto orgânico. In: I SICOM - SIMPÓSIO SOBRE COMPOSTAGEM - "CIÊNCIA E TECNOLOGIA", Anais... Botucatu (SP). Botucatu: Universidade Estadual Paulista. p. 1-27, 2004.
SANTOS, F.M.; VIEIRA, M. J.; MONEZI, T.A.; HÁRSI, C.M.; MEHNERT, D.U. Discrimination of adenovírus types circulating in urban sewage and surface polluted waters in São Paulo city, Brazil. Water Science Technologies, Water Supply v.4, n.2, p.79-85. 2004.
4. AVALIAÇÃO DE ORGANOCLORADOS E METAIS PESADOS NO LODO BIOLÓGICO E NO COMPOSTO ORGÂNICO E O PONTENCIAL DE ABSORÇÃO DESTES COMPOSTOS PELA Brassica juncea
Resumo
4.1 Introdução
A indústria de celulose kraft branqueada passou nos últimos anos por transformações tecnológicas importantes, principalmente na etapa de branqueamento.
A pré-deslignificação com oxigênio após a polpação permite diminuir a carga orgânica destinada a estação de tratamento de efluentes. A substituição de seqüências de branqueamento “Standard”, onde se utilizava o cloro elementar como agente de branqueamento, foram substituídas por seqüências denominadas ECF (elemental chlorine free) que utilizam o dióxido de cloro. Tais práticas minimizaram muito a formação de compostos organoclorados na polpa de celulose e no efluente da fábrica. No Brasil, praticamente todas as fábricas adotaram seqüências de branqueamento ECF.
Atualmente, o Brasil ocupa a sexta posição no cenário mundial, como produtor de celulose. O setor de celulose gera grandes quantidades de resíduos sólidos, que precisam ser destinados de uma forma ambientalmente correta.
O lodo biológico proveniente da estação de tratamento de efluentes e a casca de eucalipto estão entre os resíduos de maior geração no processo, e uma forma de tratamento pode ser o processo de compostagem, que agrega valor e dispõe de uma forma correta, quando aplicado em plantios agrícolas.
No entanto, existem dúvidas quanto à segurança ambiental no uso do composto orgânico devido ao histórico de formação dos compostos organoclorados, embora se saiba que a formação destes compostos está associada à utilização do cloro elementar no branqueamento de celulose.
4.2 Material e Métodos
Materiais utilizados como substratos
O solo utilizado no experimento foi retirado no município de Viçosa, MG, sendo classificado como Latossolo Vermelho-Amarelo. As amostras de solo retiradas foram secas ao ar e passados por uma peneira de malha de 4,0 mm de abertura.
O composto orgânico e o lodo biológico foram fornecidos pela empresa Celulose Nipo-Brasileira - CENIBRA, o composto orgânico foi produzido por um processo de compostagem aeróbio em leiras estáticas a partir dos resíduos sólidos industriais (casca de eucalipto triturada e lodo biológico a uma proporção 1:1 em peso), por um período de 150 dias, apresentando uma relação C:N menor que 21:1.
As cascas são provenientes de descascadores a tambor. São geradas 1.700 t.dia-1 de cascas na fábrica, sendo que 66 % são encaminhados para a queima na caldeira de biomassa e 22 % para a compostagem, o restante é comercializado.
São geradas 220 t.dia-1 a 12 % de consistência de lodo biológico na estação de tratamento de efluentes (ETE) pelo processo de lodos ativados, todo lodo gerado é utilizado no processo de compostagem. A ETE trata 5.100 m3.h-1 de efluentes, que são provenientes sobretudo do setor de branqueamento (contribuição de 90% de efluente na ETE) e 150 m3.h-1 de esgoto sanitário. O branqueamento utiliza a seqüência * Dht (EOP) D P e o consumo total de ClO2 na
produção é de 35 t.dia-1.
O lodo biológico utilizado no experimento foi retirado da linha de recirculação de lodo biológico do processo de tratamento secundário da ETE, passando por um processo de filtragem em laboratório para ganhar uma consistência de 15 % de sólidos.
Montagem do experimento
O experimento foi conduzido em estufa do Departamento de Engenharia Florestal, durante 73 dias na Universidade Federal de Viçosa (UFV). O experimento consistiu de 13 tratamentos com diferentes substratos e três repetições (Tabela 4.1).
Tabela 4.1 - Dosagens dos substratos misturados com solo, utilizados em cada tratamento (% peso/peso).
Substratos 0 % 1 % 10 % 25 % 50 % 75 % 100 %
Composto Orgânico T2 T3 T4 T5 T6 T7
Lodo Biológico T1 T8 T9 T10 T11 T12 T13
Obs: T – tratamento
Exemplo: T1 – 0 % de substrato (composto orgânico ou lodo biológico) + 100 % solo
O delineamento experimental foi inteiramente casualizado. Utilizou-se no experimento vasos de polietileno rígido (PE) com capacidade para 0,63 dm3, onde foram cultivadas mudas de mostarda lisa (Brassica juncea).
Obtenção das Mudas
(a) (b)
Figura 4.1 – (a) mudas em germinação; (b) mudas a serem transplantadas após 22 dias.
Utilizou-se como testemunha, uma planta comercializada no município de Viçosa, para os parâmetros analisados.
Cultivo da B. juncea
O experimento foi conduzido em uma estufa localizada no viveiro do Departamento de Engenharia Florestal da Universidade Federal Viçosa. A estufa possui uma área de 10 m x 20 m (Figura 4.2 (a)), e é coberta por uma lona plástica transparente, tendo aberturas laterais. Os vasos foram colocados a um espaçamento de 10 cm x 10 cm em bancadas de 1 m x 10 m (Figura 4.2 (b)).
Após o período de incubação dos substratos e da etapa de germinação das sementes de mostarda, foi realizado o transplante das mudas em cada um dos vasos plásticos. Os vasos foram distribuídos aleatoriamente na bancada, com o objetivo de aplicar os princípios básicos de casualização e repetição, necessários na condução de experimentos científicos.
Sob cada um dos vasos foram colocados pratos coletores, para que, caso ocorresse à percolação de água, o lixiviado fosse devolvido ao vaso, não garantindo dessa forma perdas de água no sistema por evaporação.
A temperatura da estufa foi medidas por meio de leituras diárias em um termômetro acoplado a bancada. As temperaturas médias de máxima e mínima durante a condução do experimento foram de 38 e 22 ºC, respectivamente.
O piso da estufa, bem como os arredores, foram umidecidas de duas a três vezes por dia, quando necessário, para que a temperatura e umidade relativa do ar permanecessem, tanto quanto possível, mais uniformes.
A colheita foi realizada aos 51 dias após o transplante, nas primeiras horas da manhã, quando a maioria das plantas já haviam atingido o máximo crescimento nas condições experimentais, cortando-as rente a superfície dos substratos.
Análises químicas
A matéria seca da parte aérea foi obtida após secagem em estufa de circulação forçada de ar à temperatura de 60 °C, até atingir peso constante. Posteriormente foram moídas em moinho tipo Wiley, com peneira de 20 mesh.
A extração das plantas foi feita via úmida usando-se 0,5 g de amostra com ácido nítrico p.a. (65 %) e ácido perclórico p.a. (70 %) em uma relação 3:1, onde foram determinados as concentrações totais de: Fe, Mn, Pb, Ni, Cu, Zn e Cr em espectrofotômetro por emissão de plasma (EMBRAPA, 1999).
Os substratos foram secos em uma estufa a 105 ºC, e posteriormente moídos. Para a extração dos substrato utilizou-se as metodologias apresentados em EMBRAPA – CNPS (1997), para os parâmetros mencionados.
contidos em 0,1 g de amostra. A extração de Fe, Mn, Cu e Zn trocáveis (disponível) utilizou a solução extratora Mehlich (HCl 0,05 mol.l-1 + H2SO4 0,0125
mol.l-1 ). Já a extração do Cr, Ni, e Pb trocáveis (disponíveis) foi feita com extrator Mehlich modificado (HCl 0,05 mol.l-1 + H2SO4 0,025 mol.l-1) e a sua leitura foi feita
por espectrofotometria de absorção atômica.
As concentrações de Cl- foram determinadas no extrato de saturação por titulação com nitrato de prata (AgNO3) em presença de dicromato de potássio
(K2CrO4) como indicador. As concentrações de OX foram determinadas segundo a
Norma SCAN – W 9:89.
Para as análises de dioxinas e furanos dos substratos, foram retiradas amostras acondicionando em frascos âmbar previamente lavados com ácido acético (10 %), com o objetivo de eliminar interferentes a base de cloro. Após este procedimento, as amostras foram enviadas para o laboratório especializado em caixas de isopor, mantendo a temperatura das amostras abaixo de 4 ºC. Para as análises foliar, as amostras foram mantidas em sacos lacrados de polipropileno (PP). As determinações de dioxinas e furanos foram feitos por cromatografia gasosa acoplada à uma espectrometria de massa de alta resolução de diluições isotrópicas, utilizando-se as metodologia USEPA 8290 e 1613 (USEPA 1994a e USEPA 1994b). As análises foram feitas no laboratório da Analytical Solutions S.A (Rio de Janeiro).
Análises estatísticas