UNIVERSIDADE FEDERAL DE MINAS GERAIS
INSTITUTO DE CIÊNCIAS EXATAS
DEPARTAMENTO DE QUÍMCA
FABIANE ASSIS CARVALHO
SÍNTESE E CARACTERIZAÇÃO DE COMPLEXOS
N,N’-DIETILDITIOCARBAMATO DE Bi(III), Sn(IV), Ga(III), In(III) E Zn(II);
E DE SEUS PRODUTOS DE DECOMPOSIÇÃO TÉRMICA
BELO HORIZONTE
UFMG/ICEx.DQ. 777ª
D. 454ª
Fabiane Assis Carvalho
SÍNTESE E CARACTERIZAÇÃO DE COMPLEXOS
N,N’-DIETILDITIOCARBAMATO DE Bi(III), Sn(IV), Ga(III), In(III) E
Zn(II); E DE SEUS PRODUTOS DE DECOMPOSIÇÃO TÉRMICA
Dissertação apresentada ao Departamento de
Química do Instituto de Ciências Exatas da
Universidade Federal de Minas Gerais como
requisito parcial para a obtenção do grau de
Mestre em Química – Físico-Química.
BELO HORIZONTE
Dedico este trabalho ao grande tesouro
Agradecimentos
A Deus, pelo dom da vida, alegria, presença, acolhida, pela grande graça de
recomeçar e por cada manhã.
A meus pais, Geraldo e Lourdes, por serem meus primeiros mestres e me ensinarem
as lições mais importantes da vida. Amo-vos muito.
A meus irmãos, Maxwel e Tatiane, e a meu cunhado, Cléber, por todo apoio e
compreensão.
Ao professor Dr. Geraldo Magela e a professora Drª. Arilza Porto por toda orientação,
disponibilidade e por confiarem em meu trabalho. Sou muito grata a vocês dois.
Aos professores José Domingos Ardisson, Walter e Max Passos (CDTN) e Daniel e
ao professor Roberto Paniago (Departamento de Física/UFMG) por todo apoio técnico na
realização e discussão das análises Mössbauer, DRX, UV-Vis e XPS.
A Daniele Cristiane por toda presença e pelas valiosas instruções. Muito obrigada.
Ao técnico do laboratório de Química de Coordenação do Estanho, Wellerson, pela
grande colaboração e a todos os amigos do laboratório: Márcio, Fabrício, Rogério,
Guillherme, Camila, Amanda, Lucianas (França e Duarte) e Fabiana. Foi muito bom contar
com a presença de vocês.
Ao Guilherme por toda disponibilidade em me ajudar mais de uma vez. Obrigada
Guilherme por ser amigo e ‘porto seguro’, é muito bom saber que existem pessoas como
você. Que Deus te abençoe sempre.
Aos amigos do Departamento de Química: Marcelo, Isabella, Raquel, Liliane,
Patrícia, Vinícius, Marco Túlio, Filipe, Taiane, Alessandra, Jessé, Reginaldo, Júlio, Magno,
Sérgio, e todos, por partilharem dos meus dias e fazerem parte deste trabalho. A presença
de vocês foi essencial para mim. Muito obrigada.
A Viviane Faria e Karyne, por formamos o trio das ‘Meninas Superpoderosas’.
Ao professor Fabiano, a Ana Flávia e ao Bernardo, por acreditar e incentivar muitas
vezes o meu trabalho.
A todos funcionários administrativos e técnicos do Departamento de Química da
UFMG, especialmente a secretária da pós-graduação e suas auxiliares.
A Beatriz, Naiara e Gabrieli minhas irmãs do coração, por seus ouvidos e por me
A queridíssima Renata que, apesar de ser preciso voar milhas e milhas para nos
vermos, sempre se fez presente. Com certeza sua amizade estará sempre bem guardada.
À Sara, Ana e Joyce, obrigada pela presença.
Ao meu tio Joaquim e tia Sandra e todos seus filhos, noras e netos, por me
acolherem sempre. E a todos os outros que são igualmente importantes para mim. Amo
todos vocês.
Aos amigos de minha saudosa Ipatinga e região, que não permitiram que a distância
apagasse nossa amizade, em especial à Vanessa e Keila.
Aos amigos cultivados à sombra da “Árvore da Vida” por terem sido sustento e me
mostrarem que “Deus sempre nos leva além” e caminha ao nosso lado. Obrigada sempre.
Aos amigos do Centro de Estudos da Doutrina Social da Igreja Católica – Robert
Shumam, por compartilharem comigo da grande aventura de conciliar Fé e Razão.
“O pequeno príncipe foi rever as rosas:
– Vós não sois absolutamente iguais à minha rosa,
vós não sois nada ainda. Ninguém ainda vos cativou,
nem cativastes ninguém.
Sois como era a minha raposa.
Era uma raposa igual a cem mil outras. Mas eu a tornei
minha amiga. Agora ela é única no mundo.
E as rosas ficaram desapontadas.
– Sois belas, mas vazias – continuou ele. – Não se pode
morrer por vós. Um passante qualquer sem dúvida
pensaria que a minha rosa se parece convosco.
Ela sozinha é, porém, mais importante que todas vós,
pois foi ela quem eu reguei. Foi ela quem pus sob a redoma.
Foi ela quem abriguei com o pára-vento. Foi nela que eu matei
as larvas (exceto duas ou três por causa das borboletas).
Foi ela quem eu escutei queixar-se ou gabar-se,
ou mesmo calar-se algumas vezes.
Já que ela é a minha rosa.
(...) disse a raposa:
– Foi o tempo que perdeste com tua rosa que a fez tão importante.”
RESUMO
Devido às propriedades apresentadas pelo grupo dos ligantes ditiocarbamatos,
utilizou-se neste trabalho o ligante N,N-dietilditiocarbamato como agente complexante para
obtenção de complexos de bismuto, estanho, gálio, índio e zinco, com o objetivo de explorar
suas potencialidades como precursores de fonte única para obtenção de sulfetos.
O trabalho foi estruturado em duas etapas, sendo que a primeira consiste na síntese
do sal N,N-dietilditiocarbamato de sódio, empregado como fonte do ligante e a rota de
síntese dos complexos metálicos, bem como suas caracterizações através de suas faixas de
temperatura de fusão, solubilidade, espectroscopia de ressonância magnética nuclear,
absorção na região do infravermelho e análise termogravimétrica.
A segunda etapa compreende a decomposição térmica dos complexos e a
caracterização dos produtos obtidos. Para tanto, fez-se o estudo do comportamento térmico
dos complexos como uma pré-etapa de pirólise, onde foram estabelecidas as melhores
condições de trabalho. Posteriormente, realizou-se a decomposição térmica dos precursores
em forno tubular e caracterizou-se os produtos obtidos.
As técnicas empregadas para caracterização dos produtos foram difração de raios-X
de pó, espectroscopia de fotoelétrons emitidos por raios-X (exceto para o produto do
complexo de estanho, para o qual se utilizou a espectroscopia Mössbauer) e espectroscopia
ABSTRACT
The literature reports several interesting properties of dithiocarbamate ligands.
Therefore, N,N-dietyldithiocarbamate anion has been employed in this work to produce
Bi(III), Ga(III), In(III), Zn(II) and organotin complexes, in order to explore its ability as single
source precursors of inorganic sulfides, in pyrolysis experiments.
The work was divided into two parts. The first one comprised the synthesis of the
ligand as sodium salt and the preparation of the complexes. All the compounds have been
characterized by NMR, IR, and melting points. Also the thermal behavior of each complex
has been studied by thermogravimetric analysis.
In the second part of the work the complexes were thermally decomposed and the
corresponding products were characterized by X-ray powder diffraction, X-ray photoelectron
spectroscopy (except the organotin complex which was characterized by 119Sn Mössbauer
ÍNDICE DE FIGURAS
Figura 1.1– Fórmula estrutural do sal N,N-dietilditiocarbamato de sódio. _______________________________ 8 Figura 1.2 – Representação estrutural de ligantes de precursores de fonte única. ________________________ 9 Figura 1.3 – Esquema de formação de bandas de energia para materiais sólidos. _______________________ 13 Figura 1.4– Estruturas das bandas eletrônicas para: a) metais, b) isolantes e c) semicondutores. ___________ 13 Figura 2.1 – Reação de formação do ligante N,N-dietilditiocarbamato de sódio. ________________________ 24 Figura 2.2 – Expansão do espectro de RMN de 1H na região de δ/ppm 1,0 a 4,0 para o complexo
[Bi{S2CN(C2H5)2}3]. __________________________________________________________________________ 28
Figura 2.3 – Espectro de RMN de 13C para o complexo [Bi{S2CN(C2H5)2}3]. ______________________________ 29
Figura 2.4 – Expansão do espectro de RMN de 1H na região de δ/ppm 1,0 a 8,0 para o complexo
[SnPh3S2CN(C2H5)2]. _________________________________________________________________________ 29
Figura 2.5 – Espectro de RMN de 13C para o complexo [SnPh3S2CN(C2H5)2]. _____________________________ 30
Figura 2.6 – Expansão do espectro de RMN de 1H na região de δ/ppm 1,0 a 4,0 para o complexo
[Ga{S2CN(C2H5)2}3]. __________________________________________________________________________ 30
Figura 2.7 – Espectro de RMN de 13C para o complexo [Ga{S2CN(C2H5)2}3]. _____________________________ 31
Figura 2.8 - Expansão do espectro de RMN de 1H na região de δ/ppm 1,0 a 4,0 para o complexo
[In{S2CN(C2H5)2}3]. __________________________________________________________________________ 31
Figura 2.9 – Espectro de RMN de 13C para o complexo [In{S2CN(C2H5)2}3]. ______________________________ 32
Figura 2.10 – Expansão do espectro de RMN de 1H na região de δ/ppm 1,0 a 4,0 para o complexo
[Zn{S2CN(C2H5)2}2]. __________________________________________________________________________ 32
Figura 2.11 – Espectro de RMN de 13C para o complexo [Zn{S2CN(C2H5)2}2]. _____________________________ 33
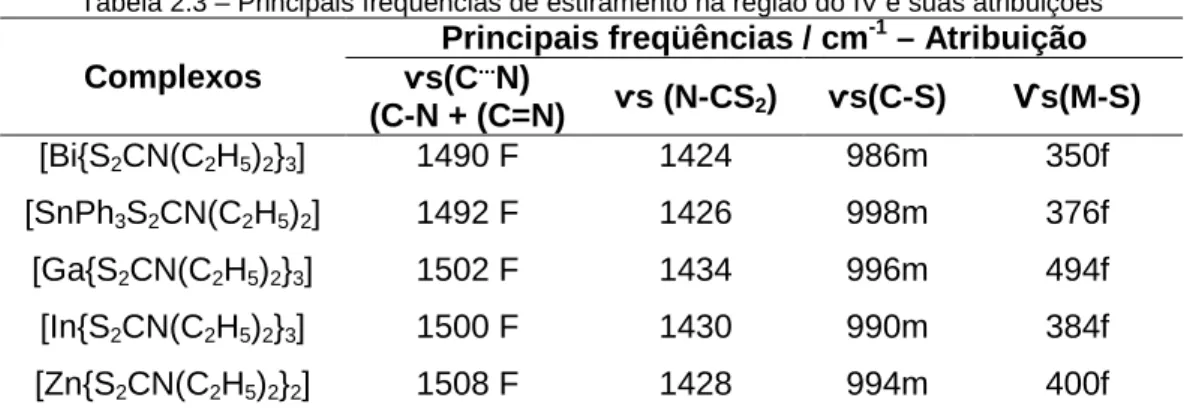
Figura 2.12 – Espectro de absorção na região do infravermelho obtido para o complexo [Bi{S2CN(C2H5)2}3]. __ 35
Figura 2.13 – Espectro de absorção na região do infravermelho obtido para o complexo [SnPh3S2CN(C2H5)2]. _ 35 Figura 2.14 – Espectro de absorção na região do infravermelho obtido para o complexo [Ga{S2CN(C2H5)2}3]. __ 36
Figura 2.15 – Espectro de absorção na região do infravermelho obtido para o complexo [In{S2CN(C2H5)2}3]. __ 37
Figura 2.16 – Espectro de absorção na região do infravermelho obtido para o complexo [Zn{S2CN(C2H5)2}2]. __ 37
Figura 2.17 – [Bi{S2CN(C2H5)2}3]. _______________________________________________________________ 39
Figura 2.18 – [SnPh3S2CN(C2H5)2]. ______________________________________________________________ 39
Figura 2.19 – [Ga{S2CN(C2H5)2}3]. ______________________________________________________________ 39
Figura 2.20 – [In{S2CN(C2H5)2}3]. _______________________________________________________________ 39
Figura 2.21– [Zn{S2CN(C2H5)2}2]. _______________________________________________________________ 39
Figura 2.22 – Curvas TG e DTG obtidas para o complexo [Bi{S2CN(C2H5)2}3]. ____________________________ 41
Figura 2.23 – Difratograma do produto de decomposição térmica do complexo [Bi{S2CN(C2H5)2}3]. _________ 42
Figura 2.24 – Espectro de XPS do produto de decomposição térmica do complexo [Bi{S2CN(C2H5)2}3], antes do
“sputtering”. _______________________________________________________________________________ 43 Figura 2.25 – Espectro de XPS do produto de decomposição térmica do complexo [Bi{S2CN(C2H5)2}3], após o
“sputtering”. _______________________________________________________________________________ 44 Figura 2.26 – Espectro de XPS para Bi-4f com resolução de 1 eV. _____________________________________ 44 Figura 2.27 – Espectro UV-Vis do produto obtido decomposição térmica do complexo [Bi{S2CN(C2H5)2}3] ____ 45 Figura 2.28 – Determinação do “band gap” para o produto da decomposição térmica do complexo
[Bi{S2CN(C2H5)2}3] __________________________________________________________________________ 46
Figura 2.29 – Curvas TG e DTG obtidas para o complexo [SnPh3S2CN(C2H5)2] ___________________________ 47
Figura 2.30 - Difratograma do produto de decomposição térmica do complexo [SnPh3S2CN(C2H5)2] ________ 48
Figura 2.31 – Espectro do precursor [SnPh3{S2CN(C2H5)2}] _________________________________________ 48
Figura 2.32 – Produto da decomposição térmica do complexo [SnPh3S2CN(C2H5)2] ______________________ 49
Figura 2.33 – Espectro UV-Vis obtido para o produto da decomposição térmica do complexo [SnPh3{S2N(C2H5)2}] .
_________________________________________________________________________________________ 50 Figura 2.34 – Determinação do “band gap” para o produto da decomposição térmica do complexo
[SnPh3{S2N(C2H5)2}] .
_________________________________________________________________________ 51 Figura 2.35 – Curvas TG e DTG obtidas para o complexo [Ga{S2CN(C2H5)2}3] ___________________________ 52
Figura 2.36 – Difração do produto de decomposição térmica do complexo [Ga{S2CN(C2H5)2}3] antes do
tratamento térmico _________________________________________________________________________ 53 Figura 2.37 – Difração do produto de decomposição térmica do complexo [Ga{S2CN(C2H5)2}3] após o
Figura 2.38 – Espectro de XPS do produto de decomposição térmica do complexo [Ga{S2CN(C2H5)2}3], com fonte
de irradiação Al-Kα. _________________________________________________________________________ 54
Figura 2.39 – Espectro de XPS do produto de decomposição térmica do complexo [Ga{S2CN(C2H5)2}3], com fonte
de irradiação Mg-kα. ________________________________________________________________________ 55 Figura 2.40 – Espectro XPS para Ga-3p com resolução de 1 eV com fonte de irradiação Al-Kα. ______________ 56
Figura 2.41 – Espectro de absorção do UV-Vis para o produto da decomposição térmica do complexo
[Ga{S2N(C2H5)2}3]. ___________________________________________________________________________ 57
Figura 2.42 – Curva para determinação do “band gap” do produto da decomposição térmica do complexo [Ga{S2NEt2}3] ______________________________________________________________________________ 57
Figura 2.43 – Curvas TG e DTG obtidas para o complexo [In{S2CN(C2H5)2}3] ____________________________ 59
Figura 2.44 – Difratograma do produto de decomposição térmica do complexo [In{S2CN(C2H5)2}3] antes do
tratamento térmico _________________________________________________________________________ 60 Figura 2.45 – Difratograma do produto de decomposição térmica do complexo [In{S2CN(C2H5)2}3] após
tratamento térmico a 600oC __________________________________________________________________ 60 Figura 2.46 – Espectro de XPS do produto de decomposição térmica do complexo [In{S2CN(C2H5)2}3], antes do “sputtering”. _______________________________________________________________________________ 61 Figura 2.47 – Espectro de XPS do produto de decomposição térmica do complexo [In{S2CN(C2H5)2}3], após o
“sputtering”. _______________________________________________________________________________ 62 Figura 2.48 – Espectro XPS para In-3d com resolução de 1 eV. _______________________________________ 63 Figura 2.49 - Espectro de absorção do UV-Vis para o produto da decomposição térmica do complexo
[In{S2N(C2H5)2}3] ____________________________________________________________________________ 63
Figura 2.50 – Curva para determinação do “band gap” do produto da decomposição térmica do complexo [In{S2N(C2H5)2}3] ____________________________________________________________________________ 64
Figura 2.51 – Curvas TG e DTG obtidas para o complexo [Zn{S2CN(C2H5)2}2] ____________________________ 65
Figura 2.52 - Difratograma do produto de decomposição térmica do complexo [Zn{S2N(C2H5)2}2] antes do
tratamento térmico _________________________________________________________________________ 66 Figura 2.53 – Difratograma do produto de decomposição térmica do complexo [Zn{S2N(C2H5)2}2] após
tratamento térmico a 600oC __________________________________________________________________ 66 Figura 2.54 – Espectro de XPS do produto de decomposição térmica do complexo [In{S2CN(C2H5)2}3], antes do
“sputtering”. _______________________________________________________________________________ 67 Figura 2.55 – Espectro de XPS do produto de decomposição térmica do complexo [Zn{S2CN(C2H5)2}2], após o “sputtering”. _______________________________________________________________________________ 67 Figura 2.56 – Espectro XPS para Zn-2p com resolução de 1 eV. _______________________________________ 68 Figura 2.57 – Espectro de absorção do UV-Vis para o produto da decomposição térmica do complexo
[Zn{S2N(C2H5)2}2] ____________________________________________________________________________ 69
Figura 2.58- Curva para determinação do Band Gap do produto da decomposição térmica do complexo
ÍNDICE DE TABELAS
ÍNDICE DE SÍMBOLOS E ABREVIATURAS
Hex – hexano
Dmpy – 3,5-dimetilpiridina
Thd – 2,2,6,6-tetrametil-3,5-heptanodiona
RMN – Ressonância Magnética Nuclear
IV – Espectroscopia de absorção na região do Infravermelho
TG – Análise Termogravimétrica
DRX – Difração de raios-X
UV-Vis – Espectroscopia de absorção na região do Ultravioleta e Visível
ÍNDICE
1
INTRODUÇÃO ___________________________________________________________ 8
1.1 REFERÊNCIAS BIBLIOGRÁFICAS _______________________________________________ 16
2
PARTE EXPERIMENTAL ___________________________________________________ 21
2.1 Materiais e técnicas ________________________________________________________ 21
2.2 Sínteses __________________________________________________________________ 24
2.2.1 2íntese do ligante N,N-dietilditiocarbamato de sódio [Na{22CN(C2H5)2}] ____________________ 24
2.2.2 2íntese dos complexos metálicos ___________________________________________________ 24 2.2.2.1 Complexo tris(N,N-dietilditiocarbamato) de bismuto (III) [Bi{22CN(C2H5)2}3] ______________ 24
2.2.2.2 Complexo N,N-dietilditiocarbamato de trifenilestanho (IV) [2nPh322CN(C2H5)2] ___________ 25
2.2.2.3 Complexo tris(N,N-dietilditiocarbamato) de gálio (III) [Ga{22CN(C2H5)2}3] ________________ 25
2.2.2.4 Complexo tris(N,N-dietilditiocarbamato) de índio (III) [In{22CN(C2H5)2}3] ________________ 25
2.2.2.5 Complexo bis(N,N-dietilditiocarbamato) de zinco (II) [Zn{22CN(C2H5)2}2] ________________ 25
2.3 Caracterização dos complexos metálicos _______________________________________ 26
2.3.1 Ponto de fusão e solubilidade ______________________________________________________ 26 2.3.2 Espectroscopia de ressonância magnética nuclear _____________________________________ 28 2.3.3 Espectros de absorção na região do infravermelho _____________________________________ 34 2.3.4 Propostas das estruturas químicas dos complexos sintetizados ___________________________ 39
2.4 Decomposição térmica dos precursores dietilditiocarbamatos ______________________ 40
2.4.1 Análise térmica e pirólise do complexo [Bi{22N(C2H5)2}3] _________________________________ 41
2.4.2 Caracterização dos produtos de pirólise obtidos _______________________________________ 41 2.4.2.1 Difração de raios-X ___________________________________________________________ 41 2.4.2.2 Espectroscopia de fotoelétrons emitidos por raios-X ________________________________ 42 2.4.2.3 Espectroscopia de absorção na região de UV-Vis ___________________________________ 45 2.4.3 Análise térmica e pirólise do complexo [2nPh3{22N(C2H5)2}] ______________________________ 47
2.4.4 Caracterização do produto de pirólise obtido _________________________________________ 47 2.4.4.1 Difração de raios-X ___________________________________________________________ 47 2.4.4.2 Espectroscopia de Mössbauer de 1192n ___________________________________________ 48 2.4.4.3 Espectroscopia de absorção na região UV-Vis _____________________________________ 50 2.4.5 Análise térmica e pirólise do complexo [Ga{22N(C2H5)2}3] ________________________________ 52
2.4.6 Caracterização do produto de pirólise obtido _________________________________________ 52 2.4.6.1 Difração de raios-X ___________________________________________________________ 52 2.4.6.2 Espectroscopia de fotoelétrons emitidos por raios-X ________________________________ 54 2.4.6.3 Espectroscopia de absorção na região de UV-Vis ___________________________________ 56 2.4.7 Análise térmica e pirólise do complexo [In{22N(C2H5)2}3] _________________________________ 59
2.4.7.1 Difração de raios-X ___________________________________________________________ 59 2.4.7.2 Espectroscopia de fotoelétrons emitidos por raios-X ________________________________ 61 2.4.7.3 Espectroscopia de absorção na região de UV-Vis ___________________________________ 63 2.4.8 Análise térmica e pirólise do complexo [Zn{22N(C2H5)2}2] ________________________________ 65
2.4.8.1 Difração de raios-X ___________________________________________________________ 65 2.4.8.2 Espectroscopia de fotoelétrons emitidos por raios-X ________________________________ 66 2.4.8.3 Espectroscopia de absorção na região de UV-Vis ___________________________________ 68
2.5 REFERÊNCIAS BIBLIOGRÁFICAS _______________________________________________ 70
3
CONCLUSÕES E PERSPECTIVAS ____________________________________________ 73
1 INTRODUÇÃO
Dentre os diversos ligantes que compõem a química de coordenação está o grupo de
ânions ditiocarbamatos, de fórmula geral R2NCS2- (em que R é um grupo alquil), cujos
átomos de enxofre são potenciais doadores de elétrons, o que lhes confere a possibilidade
de se coordenarem ao centro metálico de forma unidentada, bidentada ou como ligante de
ponte (BAUER, 1997). Em sua forma ácida, R2NS2H, observa-se pouca estabilidade, que é
superada por sua forma salina em que o sódio, o potássio e o amônio compõem a classe
dos cátions mais comuns destes sais (FERNÁNDEZ, 2008). O sal N,N-dietilditiocarbamato
de sódio, Figura 1.1, foi empregado neste trabalho como fonte de obtenção do ligante
dietilditiocarbamato; apresenta grande estabilidade química e pode ser obtido
comercialmente (FU, 2007).
N
S
-S C
H3
C
H3 Na+
Figura 1.1– Fórmula estrutural do sal N,N-dietilditiocarbamato de sódio.
Este ligante é utilizado amplamente como agente coagulante (CHANG, 2007) e na
determinação e extração de metais pesados, como Hg, Pb, Au, Cu, Fe e Ni, em diversos
meios, compondo novas técnicas para a química analítica e ambiental (FU, 2007;
BURGUERA, 2007; SHPHERD, 2003; PIECH, 2007). Também é utilizado de forma
extensiva na aplicação clínica para o tratamento de envenenamento crônico por metais
pesados, em especial, o cobre (doença de Wilson) (LI, 2007). Ainda no âmbito medicinal,
este ligante é um importante agente antitumoral, com excelentes resultados no tratamento
de câncer na presença de radiação ionizante, onde reduz, através de alquilação, o DNA da
célula cancerígena à nitrosamina (GARJE, 2003). Possui ação biocida como antifúngico,
antibacteriano e antiviral (LI, 2007; MENEZES, 2008) e é empregado tanto na medicina
quanto na área agrícola, sendo um dos principais componentes de inseticidas e herbicidas
(CHAUHAN, 2005; LI, 2007). Na indústria observa-se o seu crescente emprego em função
de suas propriedades catalíticas na vulcanização da borracha natural (DEROUET, 2007) e
em aditivos de lubrificantes (GARJE, 2003). Contudo, os ditiocarbamatos apresentam ações
inibidoras em oxidação de hidrocarbonetos (FERNÁNDEZ, 2008). Os complexos obtidos a
partir deste ligante compõem a classe dos conhecidos precursores de fonte única e são
empregados para a obtenção de sulfetos dos respectivos metais complexados (FAN, 2007).
Precursores de fonte única são compostos metalorgânicos que possuem em suas
mais comuns são utilizados como fonte de sulfetos, selenetos e teluretos (FAN, 2007),
Figura 1.2.
R
N
R
S
S
-X X P P
X X
R
R
R
R N
+
Et Et Et
H Se
P -Se R
R
a) b) c)
Figura 1.2 – Representação estrutural de ligantes de precursores de fonte única, onde R = alquila; a) dialquilditiocarbamato; b) dialquilcalcogenofosfato (onde X = Se ou Te) e c) sal iônico dialquildiselenofosfinato.
Fonte: FAN, 2007
São muitas as vantagens de se utilizar tais precursores para a obtenção de sulfetos,
selenetos e teluretos, dentre as quais se destacam sua estabilidade ao ar, o que facilita sua
manipulação e caracterização, e a simplicidade dos processos que, na maioria das vezes
ocorrem em apenas uma etapa, em relação aos processos que requerem mais de um
precursor. Quando empregados na técnica de deposição química de vapor (CVD) ou
deposição química de vapores metalorgânicos (MOCVD), as condições de fluxo de gases
que compõem a atmosfera de deposição tornam-se simplificadas e as temperaturas mais
amenas. Tem sido observado o crescimento de cristais com formação de uma fase meta
estável ou seletiva, que, muitas vezes, é difícil de ser obtido através das técnicas de
sínteses convencionais. Uma grande vantagem que vem impulsionando novas pesquisas
está relacionada à redução do impacto ambiental no processamento de materiais a partir de
precursores deste tipo por gerar uma quantidade mínima de produtos no seu processo de
decomposição (FU, 2007; FAN, 2007).
São cinco os precursores utilizados neste trabalho, sendo todos complexados pelo
mesmo ligante (N,N-dietilditiocarbamato (Et2NCS2-)). O que difere entre eles é o centro
metálico, sendo este o Bismuto (Bi, Z=83), Estanho (Sn, Z=50), Gálio (Ga, Z=31), Índio (In,
Z=49) e Zinco (Zn, Z=30). Dentre estes metais, os quatro primeiros são representativos
(famílias IIIA, IVA e VA) e o último pertence à classe dos metais de transição (família IIB).
Todos foram complexados a partir de seus sais comuns, como nitratos e acetatos, onde
apresentam-se com estado de oxidação estável possuindo os subníveis de valência
completamente preenchidos (Bi (III) – 6s, Sn (IV) – 4d, Ga(III) – 3p, In(III) – 4p e Zn(II) – 3d).
Testes in vitro de complexos ditiocarbamatos de bismuto (III) mostraram que estes
compostos são potentes agentes contra sete linhas de células tumorais humanas e estudos
in vivo indicam significantes efeitos contra câncer em células dos ovários e cólon (LI, 2007).
De forma especial, o {Bi(S2CN(C2H5)2)3} vem sendo empregado em drogas padrões para o
tratamento de câncer, exceto no medicamento Paclitaxel®, e se apresenta tão tóxico quanto
quimioterapia, no tratamento de infecções bacterianas, incluindo sífilis, e no tratamento e
prevenção de gastrite e úlcera duodenal (LI, 2007).
Em outras áreas encontram-se diversas aplicações deste complexo, como, por
exemplo, na determinação de Hg, Cu, Fe, Co e Ni, bem como na extração do mercúrio da
água do mar; como aditivo em lubrificantes; como estabilizador para melhorar o tempo de
vida de resinas fotossensíveis sem abaixar sua sensibilidade e, em especial, na obtenção de
sulfetos de bismuto em filmes finos e nanopartículas (GARJE, 2003).
O grupo de pesquisa no qual este trabalho foi desenvolvido apresenta vasta
experiência no estudo da química do estanho, seguindo três linhas específicas: síntese de
complexos com ligantes variados, decomposições térmicas em fornos tubulares sob
diferentes atmosferas (obtendo-se sulfetos e óxidos) e o estudo das atividades biocidas dos
complexos, especialmente antifúngicas e antibacterianas. Dentre eles destacam-se a
obtenção de sulfetos de estanho por decomposição térmica a partir de precursores
organometálicos contendo enxofre, como Sn4R4S6 e Sn3R6S3, onde R = metila, butila e fenila
(COSTA, 2000) e pós nanométricos de ɣ-Sn2S3 pela mesma técnica (LIMA, 2008), derivados
de pirrolidino ditiocarbamatos de estanho empregados como precursores de fonte única
para obtenção de sulfetos de estanho em pó (SnS e Sn2S3) (MENEZES, 2008). Óxidos de
estanho foram obtidos pela pirólise de óxidos de organoestanho, Sn3O3Bu6 e Sn4O6Bu4
(PEREIRA, 2002; PORTO, 2004), e um estudo para avaliar a influência do grupo R na
estabilidade térmica do composto Sn4R4O6, em que R = metil, butil e fenil, também foi
realizado (PEREIRA, 2003a e 2003b).
A química estrutural dos compostos de estanho, em particular os sulfetos de
estanho, é muito rica o que é atribuída ao variado número de coordenação que este metal
possui (2 a 9), gerando sulfetos de estanho (por exemplo SnS, Sn2S3 e SnS2) com
estruturas uni, bi e tridimensionais, que têm despertado grandes interesses devido às suas
propriedades óticas e elétricas, e tem sido aplicados em dispositivos eletro-eletrônicos
(CRUZ, 2003).
Complexos de gálio são utilizados como fonte de obtenção de sultetos e nitretos,
como o ((t-Bu)GaS)4 que forma o GaS cúbico e o ((t-Bu)2Ga(S-t-Bu))2 com a formação de
filmes de GaS com estrutura hexagonal distorcida e filmes amorfos de Ga2S3 obtidos através
da técnica de deposição de vapor químico (CVD) (POWER, 1992). O’Brien (O’BRIEN, 1999)
e colaboradores utilizaram os precursores Ga(SONEt2)3 e Ga(S2CNMeHex)3 e obtiveram
filmes de GaS cúbico e α-Ga2S3, respectivamente, que foram crescidos sobre substratos de
vidro e GaAs (111) por CVD. Estes sulfetos foram obtidos também por outros grupos de
pesquisa que utilizaram precursores como Ga(SCOMe)2Me(dmpy), GaEt3 e Ga(thd)3
enxofre apresentada no sulfeto formado tende a obedecer à mesma razão estequiométrica
presente no complexo de origem (MÎINEA, 2001), por exemplo:
[(t-Bu)2Ga(S-t-Bu)]2 GaS
[Ga(S-i-Pr)2( -S-i-Pr)]2 α-Ga2S3 e ɣ-Ga2S3
Os precursores mais comuns para obtenção de GaN são aqueles que apresentam
em suas estruturas hidretos, como exemplos (H2GaNH2)3 (JANIK, 1997), (H2GaN3)n
(MCMURRAN, 1998a) e (HClGaN3)4 (MCMURRAN, 1998b) decompostos em autoclave com
solvente apropriado e em tratamentos térmicos sob fluxo de gás NH3. Em 2008, Kim e
colaboradores (KIM, 2008) publicou um trabalho em que relata a obtenção de GaN a partir
do tris (N,N-dimetilditiocarbamato) de gálio (III) disperso sobre a superfície de óxido de
alumínio (Al2O3) com orientação (0001). Neste trabalho, uma camada de solução deste
complexo em clorofórmio foi submetido a variadas rampas de aquecimento, sendo a
primeira 65 °C para a evaporação do solvente, em se guida 600 °C onde observou-se a
formação de ɣ-Ga2S3 e por último a 850 °C por 10 minutos sob atmosfera de NH3/N2,
resultando na formação de GaN.
O gálio, em especial, é muito utilizado na medicina para identificação de tecidos
danificados pelo câncer, como agente antitumoral (LEMOS, 2007) e na indústria como
semicondutor (GONZALÉZ, 2004).
O primeiro complexo tris (N,N-dietilditiocarbamato) de índio (III) foi isolado em 1942 a
partir da reação ácida de um sal de índio (como, por exemplo, InCl3) com Na(Et2NCS2)
(OLIVEIRA, 1999). A análise termogravimétrica deste complexo revelou perda de massa
muito acentuada entre 265 e 378 °C, e o espectro de absorção na região do infravermelho
apresentou uma banda intensa em 1499 cm-1, correspondente ao estiramento da ligação C–
N. De acordo com a literatura, este ligante coordena-se de forma bidentada ao centro
metálico que, devido à presença de três ligantes, se apresenta hexacoordenado (OLIVEIRA,
1999). Este complexo é utilizado para a fabricação de microesferas de In2S3 através de sua
decomposição a 500 °C (CHEN, 2005).
Estudos mostraram que o complexo Zn(S2CN(C2H5)2)2 apresenta-se
pentacoordenado no estado sólido a partir de ligações intermoleculares formando dímeros
com estrutura bipiramidal trigonal distorcida, devido ao alongamento de uma das ligações
com o centro metálico (BAUER, 1997). Outros estudos utilizando a técnica de difração de
raios-X revelaram uma estrutura monoclínica para o complexo (ZHANG, 2005). Este
composto é um excelente precursor de fonte única que tem sido muito utilizado para a
obtenção de sulfeto de zinco com estrutura cristalina hexagonal, com alto grau de pureza
(LIU, 2006).
Existem várias rotas de obtenção dos precursores metalorgânicos de fonte única,
a síntese do sal alquilditiocarbamato através da reação de sulfeto de carbono (CS2) com
excesso de alquilamina (R2NH) e hidróxido de sódio (NaOH) ou de potássio (KOH) a baixa
temperatura. Na segunda etapa complexa-se o metal com o ligante em solução alcoólica ou
aquosa, utilizando um sal do metal em questão (CHAUHAN, 2005).
Os sulfetos, selenetos e teluretos formados a partir dos precursores moleculares de
fonte única compõem a classe dos materiais semicondutores. De acordo com Callister
(CALLISTER, 2007), os materiais são assim classificados:
Metais – metais e ligas metálicas;
Cerâmicas – argilas, cimentos e vidros;
Polímeros – plásticos e borrachas.
Contudo, duas novas classes de materiais têm despertado muito interesse são os
compósitos e os semicondutores. Compósitos correspondem à classe dos materiais
formados pela junção de dois ou mais tipos de materiais, por exemplo, as “Fiberglass” que
são fibras de vidro embutidas dentro de um material polimérico.
Os semicondutores recebem esta classificação de acordo com as propriedades
elétricas dos materiais, capacidade que possuem em conduzir ou não a corrente elétrica,
estimulada por um fator exógeno, o campo elétrico. Materiais que conduzem bem são
classificados como condutores, que são os metais e as ligas metálicas. Os materiais que
não conduzem são denominados isolantes e pertencem à classe das cerâmicas e dos
polímeros. Já os semicondutores são materiais que apresentam uma capacidade condutora
intermediária entre estes dois grupos.
A explicação para a ocorrência ou não de condução elétrica de um determinado
material está na estrutura de bandas eletrônicas que o compõe. Estas bandas de energia
são formadas como resultado de uma série de estados eletrônicos estreitamente espaçados
no sólido, que é ocasionado por ações ou perturbações de elétrons e núcleos de outros
átomos vizinhos. Lembrando que os átomos que constituem um sólido possuem a mesma
configuração eletrônica e níveis de energia atômicos como se eles estivessem isolados.
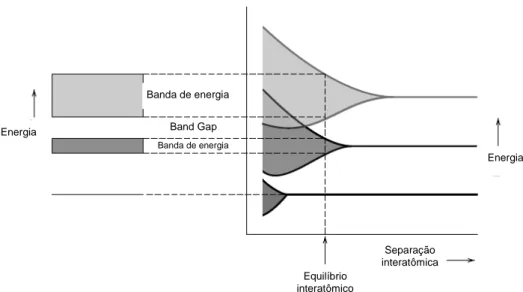
Dentro de cada banda, os níveis de energia são discretos e a diferença de energia entre
estados adjacentes é pequena. No espaçamento de equilíbrio, a formação de bandas de
energia para as subcamadas eletrônicas próximas ao núcleo pode não ocorrer. Da mesma
forma podem existir lacunas entre bandas (Band Gap), que possuem energias que não são
disponíveis para a ocupação de elétrons. A Figura 1.3 apresenta um esquema de formação
Figura 1.3 – Esquema de formação de bandas de energia para materiais sólidos. Fonte: Callister, 2007.
As propriedades elétricas são uma conseqüência da estrutura de bandas de um
material em questão, que consiste no arranjo das bandas eletrônicas mais externas e a
forma pela qual elas estão preenchidas por elétrons. Assim sendo, a banda que contém os
elétrons de mais alta energia ou elétrons de valência é denominada banda de valência e a
próxima banda de maior energia é a banda de condução, que é sob muitas circunstâncias,
não ocupadas por elétrons. O material conduzirá bem a medida que ocorrer a passagem de
elétrons da banda de valência à banda de condução. Na Figura 1.4 encontram-se as
estruturas de disposição das bandas de valência e bandas de condução para as três classes
de materiais classificados de acordo com as propriedades elétricas. Desta forma é possível
perceber a diferença básica entre materiais condutores, semicondutores e isolantes. Para os
materiais condutores, a distância entre banda de valência e banda de condução é
inexistente. Neste caso, a passagem de elétrons de uma banda para outra é facilitada. Mas,
tanto para os materiais semicondutores quanto para os isolantes, existe uma lacuna entre as
bandas, que dificulta a passagem de elétrons entre elas. A diferença primordial entre um
material semicondutor e um material isolante está relacionada com o tamanho desta lacuna,
sendo que, para os isolantes, esta é maior que para os semicondutores.
a) b) c)
Figura 1.4– Estruturas das bandas eletrônicas para: a) metais, b) isolantes e c) semicondutores. Fonte: Callister, 2007.
Banda de energia
Band Gap
Banda de energia
Equilíbrio interatômico
Separação interatômica
Banda de condução vazia
Banda de condução vazia
Banda de condução vazia
Banda de valência preenchida Band Gap
Band Gap Banda de
valência preenchida
Banda de valência preenchida
Para o elétron passar da banda de valência à banda de condução em materiais
isolantes e semicondutores ele precisa receber uma energia igual ou superior à energia de
“band gap”. Callister define que os materiais que possuem energias de “band gap” inferiores
a 2,0 eV são classificados como semicondutores e os que possuem energia maior que este
valor são isolantes. Contudo, em diversas fontes literárias encontram-se materiais com
energia de “band gap” superior a este valor (por exemplo ZnS 3,8 eV) que são classificados
como semicondutores (ZHANG, 2005; LIU, 2006).
Os materiais semicondutores são formados por ligações covalentes fracas entre seus
elementos constituintes. Os dois semicondutores elementares são o Silício (Si) e o
Germânio (Ge), com valores de “band gap” de 1,1 e 0,7 eV, respectivamente. Outro
subgrupo mais conhecido é formado por elementos da família IIIA e IIB com elementos das
famílias VA e VIA, sendo os sulfetos e selenetos metálicos os mais comuns.
Os materiais semicondutores obtidos neste trabalho são sulfetos de bismuto,
estanho, gálio, índio e zinco. Estes sulfetos, de forma geral, apresentam aplicações em
dispositivos termoelétricos, fotovoltáicos em células solares, diodos fotoemissores e
amplificadores óticos para trabalhos em telecomunicações (BANISHOEIB, 2008; SHEN,
2006; CHEN, 2005; CAIZHANG, 2005). O GaS apresenta, além destas propriedades, uma
grande utilização como protetor superficial do GaAs, que é também um excelente
semicondutor (YÜZER, 2000; TAKEBE, 1999).
A busca de novas rotas para materiais semicondutores têm atraído considerável
atenção devido à grande revolução dos dispositivos eletrônicos (FU, 2007; LIU, 2006).
Destaca-se também a evolução de materiais nanodimensionais (com pelo menos uma de
suas dimensões menores que 100 nm) como forma de aprimorar suas propriedades.
Materiais nanométricos e nanocristalinos, que possuem, pelo menos, uma de suas
dimensões nanométricas, apresentam grandes alterações em suas propriedades químicas e
físicas que tem atraído grande atenção ultimamente devido às suas inúmeras aplicações.
Os semicondutores nanodimensionais apresentam um aumento no “band gap” em relação
ao material “bulk” (material original, com dimensões maiores) que é resultado do
confinamento quântico que influencia diretamente as estruturas eletrônicas por ter sua
função de onda eletrônica na dimensão de partícula, devido ao seu tamanho ser muito
próximo ao de uma partícula. Outro fator considerável é o aumento da área superficial, que
melhora muito as propriedades catalíticas de um material (LIMA, 2008; FAN, 2007; LIU,
2006).
Neste contexto, o desenvolvimento de novas rotas para obtenção de materiais
semicondutores e, em geral, nanocristalinos são de muita importância. São várias as rotas
para obtenção dos sulfetos microcristalinos, nanoparticulados e filmes finos. Algumas destas
apropriado, no estado sólido, ou por MOCVD e CVD, por decomposição solvotérmica sob
alta pressão, interfase de água e tolueno e decomposição térmica – pirólise (GOUDARZI,
2008; ATES, 2007).
A decomposição térmica em forno tubular foi a metodologia escolhida para decompor
os precursores metalorgânicos sintetizados. Uma proposta para a reação sob o sistema de
pirólise foi desenvolvida por OLIVEIRA (1999):
1.1 REFERÊNCIAS BIBLIOGRÁFICAS
ATES, A. et al. Annealing and light effect on optical and electrical properties of ZnS thin films
grown with the SILAR method. Materials Science in Semiconductor Processing. V. 10, n.
6, p. 281– 286, 2007.
BANISHOEIB, F. et al. Synthesis of poly (2,5-Thienylene Vinylene) and its derivatives: Low
“band gap” materials for photovoltaics. Thin Solid Films. V. 516, n. 12, p. 3978–3988, 2008.
BAUER, G.; NIKOLOV, G. S.; TRENDAFILOVA, N. Molecular structure and vibrational
spectra of bis-N,N-diethyldithiocarbamate compounds with closed-shell metal ions. Journal
of Molecular Structure. V. 415, n. 1-2, p. 123-134, Aug. 1997.
BURGUERA, M.; BURGUERA, J. L. On-line electrothermal atomic absorption spectrometry
configurations: recent developments and trends. Spectrochimica Acta Part B. V. 62, n. 9,
p. 884–896, Sept. 2007.
CALLISTER, W. D. Materials science and engineering: An introduction. 7a ed. p. cm. United
States of America, 2007
CAIZHANG, Y. et al. Shape-controlled synthesis of PbS microcrystallites by mild
solvothermal decomposition of a single-source molecular precursor. Journal of Crystal
Growth. V. 277, n. 1/4, p. 518–523, Apr. 2005.
CHANG, Q.; WANG, G. Study on the macromolecular coagulant PEX which traps heavy
metals. Chemical Engineering Science. V. 62, n. 17, p. 4636 – 4643, Sept. 2007.
CHAUHAN, H. P. S.; SHAIK, N. M. Synthetic, spectral, thermal and antimicrobial studies on
some mixed 1,3-dithia-2-stannacyclopentane derivatives with dialkyldithiocarbamates.
Journal of Inorganic Biochemistry. V. 99, n. 2, p. 538–545, 2005.
CHEN, X. et al. Single-source approach to the synthesis of In2S3 and In2O3 crystallites and
COSTA, G. A. A. et al. Thermal decomposition of sulfur-containing organotin molecular
precusors to produce phase-pure SnS.
Physical Chemistry Chemical Physics. V. 2, n.
24, p. 5708 – 5711, Nov. 2000.
CRUZ, M. et al. XRD, XPS and 119Sn NMR studies of tin sulfites obtained by using chemical
vapor transport methods. Journal of Solid State Chemistry. V. 175, n. 2, p. 359–365, June
2003.
DEROUET, D.; TRAN, Q. N.; THUC, H. H. Synthesis of N,N-diethyldithiocarbamate
functionalized 1,4-polyisoprene, from natural rubber and synthetic 1,4-polyisoprene.
European Polymer Journal. V. 43, n. 5, p. 1806–1824, May 2007.
FAN, D. et al. Review - Using coordination chemistry to develop new routes to
semiconductor and other materials. Coordination Chemistry Reviews. V. 251, n. 13/14, p.
1878–1888, July 2007.
FERNANDÉZ, E.; J. LAGUNA, A.; OLMOS, M. E. Perfluoroarylgold complexes.
Coordination Chemistry Reviews. V. 252, n. 15/17, p. 1630–1667, Aug. 2008.
FU, F. Effective removal of coordinated copper from wastewater using a new
dithiocarbamate-type supramolecular heavy metal precipitant. Chemosphere. V. 69, n. 11,
p. 1783 –1789, 2007.
GARJE, S. S.; JAIN, V. K. Chemistry of arsenic, antimony and bismuth compounds derived
from xanthate, dithiocarbamate and phosphorus based ligands. Coordination Chemistry
Reviews. V. 236, n. 11, p. 35 – 56, Jan. 2003.
GONZÁLEZ, M. J. G. et al. Determination of gallium by adsorptive stripping voltammetry.
Talanta. V. 62, n. 3, p. 457– 462, Feb. 2004.
GOUDARZI, A. et al. Ammonia-free chemical bath deposition of nanocrystalline ZnS thin
film buffer layer for solar cells. Thin Solid Films. V. 516, n. 15, p. 4953 – 4957, 2008.
JANIK, F. J.; WELL, R. L. An Alternative Synthesis of Cyclotrigallazane, [H2GaNH2]3, a
Precursor to Nanocrystalline, Phase-Inhomogeneous Gallium Nitride, GaN. Inorganic
KIM, D. H. et al. GaN epitaxial layers grown by the solution-cast seed layer HVPE technique:
Effect of reactor heating method on structural and optical quality. Materials Letters. V. 62, p.
1859–1862, 2008.
KIM, S. K. Preparation of CuGaS2 thin films by two-stage MOCVD method. Solar Energy
Materials & Solar Cells. V. 92, p. 1311– 1314, 2008.
LEMOS, V. A. et al. Application of polyurethane foam as a sorbent for trace metal
pre-concentration — A review. Spectrochimica Acta Part B. V. 62, n.1, p. 4–12, 2007.
LI, HONGYU. Cytotoxicity, qualitative structure–activity relationship (QSAR), and anti-tumor
activity of bismuth dithiocarbamate complexes. Journal of Inorganic Biochemistry. V. 101,
n. 5, p. 809–816, 2007.
LIMA, G. M. Fundamentals in Tin Chemistry. In: Alwyn G. Davies. Tin Chemistry:
Fundamentals, Frontiers an Applications. 1ndEd. A John Wiley and Sons, Ltd, Publication,
2008. Capítulo 2, p. 283.
LIU, Wei. Low temperature synthesis of hexagonal phase ZnS nanocrystals by thermolysis
of an air-stable single-source molecular precursor in air. Materials Letters. V. 60, n. 4, p.
551–554, Feb. 2006.
MCMURRAN, J. et al. H2GaN3 and Derivatives: a facile method to gallium nitride. Inorganic
Chemistry, [S.l.], v. 37, n. 26, p. 6638-6644, Dec. 1998a.
MCMURRAN, J. et al. Formation of a Tetrameric, Cyclooctane-like, Azidochlorogallane,
[HClGaN3]4, and Related Azidogallanes. Exothermic Single-Source Precursors to GaN
Nanostructures. Journal of the American Chemical Society, [S.l.], v. 120, n. 21, p.
5233-5237, May 1998b.
MENEZES, D. C. Síntese e caracterização de complexos ditiocarbamatos de Sn(IV),
In(III), Ga(III) e metais de transição: Decomposição térmica e perfil farmacológico in
vitro. 2008. 145 f. Tese (Doutorado em Química) – Departamento de Química, Universidade
MÎIENA, L. A.; HOFFMAN, D. M. Amine adducts of tert-butylthiolate gallium hydrides –
synthetic and X-ray crystallographic studies. Polyhedron. V. 20, n. 18, p. 2425–2430, Aug.
2001.
O’BRIEN, P., LAZELL, M. R. Deposition of Thin Films of Gallium Sulfide from a Novel
Single-Source Precursor, Ga(S2CNMeHex)3, by Low-Pressure Metal-Organic Chemical Vapor
Deposition. Chemistry of. Materials. V. 11, n. 12, p. 3430-3432, Oct. 1999
OLIVEIRA, M. M. et al. N,N-Dialkyldithiocarbamate chelates of indium(III): alternative
synthetic routes and thermodynamics characterization. Thermochimica Acta. V. 328, n. 1/2,
p. 223–230, 1999.
PEREIRA, A. G. et al. Pyrolysis of organotin compounds: A preparative method for
nanometric tin dioxide powders.
Physical Chemistry Chemical Physics. V. 4, n. 18, p.
4528 – 4532, Aug. 2002.
PEREIRA, A.G. et at. 119Sn Mösbauer spectroscopic study of nanometric tin dioxide powders
prepared by pyrolysis of organotin oxides. Solid State Communications. V. 127, n. 3, p.
223 – 227, April 2003a.
PEREIRA, A. G. et al. The influence of the R group in thermal stability of Sn4R4O6 (R =
methyl, n-butyl or phenyl). Materials Research Bulletin. V. 38, n. 14, p. 1805 – 1817, Sept.
2003b.
PIECH, R.; KUBIAK, W. W. Determination of arsenic trace with DDTC-Na by cathodic
stripping voltammetry in presence of copper ions. Journal of Electroanalytical Chemistry.
V. 599, n. 1, p. 59–64, 2007.
PORTO, A. O. et al. Organotin sulfides as precursors for nanometric ɣ-Sn2S3 powders: a
study by 119Sn Mössbauer spectroscopy and X-Ray powder diffraction. Applied
Organometallic Chemistry. V. 18, p. 39 – 42, 2004.
POWER, M. B. et al. Topological Reorganization of Gallium-Sulfido Clusters
Organometallics. V. 11, n. 8, p. 2783-2790, March 1992.
SHEN, X. P. et al. Synthesis and characterization of Bi2S3 faceted nanotube bundles. Solid
SHEPHERD, R. E. Chromatographic and related electrophoretic methods in the separation
of transition metal complexes or their ligands. Coordination Chemistry Reviews. V. 247, n.
1, p. 147–184, Dec. 2003.
TAKEBE, H. et al. Thermal properties of Ga2S3-based glass and their consideration during
fiber drawing. Journal of Non-Crystalline Solids. V. 258, n. 1, p. 293 – 243, Nov. 1999.
YÜZER, H. et al. Analysis of sulfide layer on gallium arsenide using X-ray photoelectron
spectroscopy. Spectrochimica Acta Part B. V. 55, n.7, p. 991 – 996, 2000.
ZHANG, C.Y. et al. Phase-controlled synthesis of ZnS nanocrystallites by mild solvothermal
decomposition of an air-stable single-source molecular precursor. Journal of Crystal
2 PARTE EXPERIMENTAL
2.1 Materiais e técnicas
Reagentes e solventes
Os reagentes utilizados na síntese do sal N,N-dietilditiocarbamato de sódio foram
dietilamina [(C2H5)2NH], dissulfeto de carbono (CS2) e hidróxido de sódio (NaOH). Para as
sínteses dos complexos metálicos foram empregados nitrato de bismuto pentaidratado
[Bi(NO3)3.5H2O], cloreto de trifenilestanho [SnPh3Cl], nitrado de gálio [Ga(NO3)3], acetato de
índio [In(CH3COO)3] e acetato de zinco diidratado [Zn(CH3COO)2.2H2O]. Todos estes
reagentes e solventes utilizados nas sínteses e nos testes de solubilidade são PA e de
marcas Quimex, Synth, Vetec, Aldric, Strem chemicals, Merck, Fluka e CIL.
Gases e vidrarias
Os experimentos de pirólise e os tratamentos térmicos foram realizados sob
atmosfera inerte de nitrogênio e argônio, respectivamente, da companhia White Martins S/A.
Todas as sínteses foram realizadas em condições brandas de temperatura e, portanto,
foram empregadas vidrarias comuns como balões, béqueres, funis simples e erlenmeyers.
Pontos de fusão
As faixas de fusão dos compostos sintetizados foram medidas em um equipamento
de marca Mettler FP90, com célula de aquecimento FP82HT e microscópio Olympus,
modelo CH-2, com controlador digital de temperatura, pertencente ao Laboratório de
Química de Coordenação e Organometálica do Estanho, no Departamento de Química da
Universidade Federal de Minas Gerais, UFMG.
Ressonância magnética nuclear
Os espectros de ressonância magnética nuclear de 1H e de 13C foram obtidos em um
equipamento da marca Bruker Advance modelo DPX 200, com tratamento de dados através
da transformada de Fourier. O clorofórmio deuterado (CDCl3) foi utilizado como solvente
para a obtenção dos espectros e TMS, como padrão interno. O equipamento pertence ao
Departamento de Química da Universidade Federal de Minas Gerais.
Espectroscopia de absorção na região do infravermelho
O espectrofotômetro utilizado foi do tipo Perkin-Elmer modelo 283. As medidas
pastilhas de KBr, e as medidas obtidas na região de 700 a 100 cm-1 empregou-se polietileno
na preparação das pastilhas. O equipamento pertence ao Departamento de Química da
Universidade Federal de Minas Gerais.
Análise térmica
As medidas foram realizadas no analisador TA INSTRUMENTS SDT 2960 TG/DTA
simultâneo, com aquecimento entre temperatura ambiente (25 oC) e 900 oC, com razão de
aquecimento de 5 oC/min e sob atmosfera de nitrogênio, com fluxo de gás de 50 mL/min. A
quantidade de amostra analisada foi cerca de 5 mg, utilizando cadinho de alumina. Este
equipamento pertence ao Laboratório de Materiais Poliméricos Multicomponentes no
Departamento de Química da Universidade Federal de Minas Gerais.
Pirólises e tratamento térmico
As pirólises dos precursores organometálicos e o tratamento térmico dos compostos
obtidos foram realizados em forno tubular da marca Lindberg/Blue M, com tubo de quartzo,
sob fluxo constante de 100 mL/min de gás nitrogênio e argônio, respectivamente, a
temperaturas variadas com razão de aquecimento de 10 ºC/min, no Laboratório de Filmes
Finos e Materiais Policristalinos do Departamento de Química da Universidade Federal de
Minas Gerais.
Espectroscopia de Mössbauer de 119Sn
Os espectros Mössbauer foram obtidos a 77 K, no modo de transmissão em um
sistema convencional, com matriz radioativa de CaSnO3 mantida a temperatura ambiente.
As análises foram realizadas no Centro de Desenvolvimento em Tecnologia Nuclear –
CDTN – em Minas Gerais, pelo Dr. José Domingos Ardisson.
Difração de raios-X
Os difratogramas dos produtos obtidos através das pirólises foram realizados em um
aparelho de marca Rigaku Geigerflex com filtro de níquel, monocromador de grafite e
radiação Kα do cobalto (ʎ = 1,78897 Å), pertencente ao Departamento de Química da Universidade Federal de Minas Gerais, UFMG. Alguns materiais apresentaram-se muito
amorfos necessitando de tratamento térmico para melhorar a cristalinidade. Após os
tratamentos térmicos, obtiveram-se os difratogramas em um difratômetro de raios-X Rigaku,
modelo D\MAX ÚLTIMA automático, com fonte de radiação Kα do cobre (ʎ = 1, 54056 Å). Este equipamento pertence ao Centro de Desenvolvimento em Tecnologia Nuclear – CDTN.
Espectroscopia de fotoelétrons emitidos por raios-X (XPS)
Os espectros XPS foram obtidos em um equipamento do tipo VG-Escalab 220-IXL
com anodo duplo (Mg e Al). A pressão base de trabalho foi 2,0x10-10 mbar. As medidas
foram tomadas com o anodo operando a 14 kV e 10 mA de emissão, o que resulta em uma
potência com ordem de grandeza de 140 W. O analisador de elétrons operou no modo de
energia de passagem constante, sendo que, para os espectros "survey", a energia de
passagem foi de 50 eV (0 – 1100 eV de Energia de ligação) que origina uma resolução de
cerca de 2 eV, e, para os demais espectros, a energia de passagem utilizada foi de 20 eV,
resolução de cerca de 1 eV. A limpeza das superfícies das amostras foi realizada por
bombardeamento com íons de argônio (sputtering). Estas análises foram realizadas no
Departamento de Física da Universidade Federal de Minas Gerais, pelo professor Roberto
2.2 Sínteses
2.2.1 Síntese
do
ligante
N,N-dietilditiocarbamato
de
sódio
[Na{S
2CN(C
2H
5)
2}]
Em um balão foram adicionados 6,60 g (9 x 10-2 mol) de dietilamina, (C2H5)2NH, em
éter dietílico, sob agitação constante e banho de gelo. Em seguida adicionaram-se 6,84 g (9
x 10-2 mol) de dissulfeto de carbono, CS2, que originou uma suspensão branca. Após 5 min
foi acrescentado hidróxido de sódio, NaOH, previamente solubilizado em uma quantidade
mínima de água destilada, sob agitação por 15 min. A equação de formação do ligante está
apresentada na Figura 2.1. Houve a formação de um sólido branco que foi filtrado e
recristalizado em água destilada e etanol, apresentando rendimento de 90%.
C H3
C H3
N
S
-S
+
S C SC
H3 NH CH3
+
H2O Na HO-Na+
Figura 2.1 – Equação de formação do ligante N,N-dietilditiocarbamato de sódio
2.2.2 Síntese dos complexos metálicos
Todas as sínteses foram realizadas a temperatura ambiente e sob agitação
constante por 1 h. Em todas, o ligante utilizado foi N,N-dietilditiocarbamato de sódio,
[Na{S2CN(C2H5)2}], previamente sintetizado, na quantidade de 1,0 g (5,85 x 10-3mol) em
meio etanólico.
2.2.2.1
Complexo
tris(N,N-dietilditiocarbamato)
de
bismuto
(III)
[Bi{2
2CN(C
2H
5)
2}
3]
Em um béquer pequeno contendo 0,95 g (1,95 x 10-3mol) de nitrato de bismuto
pentaidratado [Bi(NO3)3.5H2O] em meio etanólico, foi adicionado lentamente 1,00 g (5,85 x
10-3mol) do ligante. Não houve formação de precipitado imediatamente, mas uma solução
com coloração amarela. Essa foi deixada em repouso por 7 dias e observou-se a formação
de cristais. Esses foram separados por filtração, em seguida purificados.
Para a purificação fez-se teste de solubilidade destes cristais em álcool etílico, álcool
metílico, acetona, clorofórmio, diclorometano, dimetilsulfóxido e hexano. Sendo que a
melhor solubilidade foi obtida em diclorometano. Os cristais foram, então, solubilizados
Lavou-se o precipitado em hexano que, em Lavou-seguida, foi filtrado com celite, sêco e armazenado em
frasco âmbar.
2.2.2.2
Complexo
N,N-dietilditiocarbamato
de
trifenilestanho
(IV)
[2nPh
32
2CN(C
2H
5)
2]
Fez-se primeiro uma solução etanólica de cloreto de trifenilestanho [SnPh3Cl]
utilizando-se 2,25 g (2 x 10-2 mol). Em seguida, adicionou-se lentamente o ligante
N,N-dietilditiocarbamato de sódio. Houve formação de um precipitado branco que foi filtrado,
sêco e armazenado em frasco âmbar. O rendimento foi de 87%.
2.2.2.3
Complexo tris(N,N-dietilditiocarbamato) de gálio (III) [Ga{2
2CN(C
2H
5)
2}
3]
Pesou-se 0,49 g (1,95 x 10-3mol) de nitrado de gálio [Ga(NO3)3], solubilizando-o em
etanol. Em seguida adicionou-se o ligante, sob as condições já descritas anteriormente.
Houve formação de sólido branco, que foi filtrado, sêco e armazenado em frasco âmbar. O
rendimento foi de 90%.
2.2.2.4
Complexo tris(N,N-dietilditiocarbamato) de índio (III) [In{2
2CN(C
2H
5)
2}
3]
Preparou-se uma solução etanólica de acetado de índio [In(CH3COO)3] contendo
0,57 g (1,95 x 10-3mol) do referido sal. O ligante em etanol foi então adicionado. Um sólido
branco foi formado, filtrado, sêco e armazenado em frasco âmbar. Obtendo-se rendimento
de 95%.
2.2.2.5
Complexo bis(N,N-dietilditiocarbamato) de zinco (II) [Zn{2
2CN(C
2H
5)
2}
2]
Uma solução de acetato de zinco di-hidratado [Zn(CH3COO)2.2H2O] em etanol foi
preparada utilizando 0,64 g (2,95 x 10-3mol) do sal. Fez-se a adição do ligante, seguindo as
condições anteriormente descritas. Houve precipitação de um sólido branco que foi filtrado,
2.3 Caracterização dos complexos metálicos
As técnicas empregadas na caracterização dos complexos metálicos foram ponto de
fusão, solubilidade, espectroscopia de ressonância magnética nuclear de 1H e de 13C e de
absorção na região do infravermelho.
2.3.1 Ponto de fusão e solubilidade
Os complexos apresentaram estreitas faixas de fusão e valores próximos aos
encontrados na literatura, Tabela 2.1.
Tabela 2.1 - Faixa de fusão dos complexos
Complexos Faixa de temperatura de fusão / °C
Determinados Dados da literatura
[Bi{S2CN(C2H5)2}3] (1) 190,8 – 194,1 201 (LI, 2007)
[SnPh3{S2CN(C2H5)2}3] (2) 132,0 – 134,0 132 (MENEZES, 2008)
[Ga{S2CN(C2H5)2}3] (3) 244,1 – 245,7 245 (KIM, 2008)
[In{S2CN(C2H5)2}3] (4) 256,0 – 258,0 250 (SOUZA, 2000)
[Zn{S2CN(C2H5)2}2] (5) 178,5 – 178,8 181 (RATHORE, 2008)
Todos os complexos são completamente insolúveis em água, metanol ou etanol. O
complexo tris (N,N-dietilditiocarbamato) de índio (III), [In{S2CN(C2H5)2}3], apresentou boa
solubilidade em acetona e o tris (N,N-dietilditiocarbamato) de bismuto (III),
[Bi{S2CN(C2H5)2}3], foi razoavelmente solúvel. Os demais complexos apresentaram-se
insolúveis neste solvente. Em tolueno somente o complexo N,N-dietilditiocarbamato de
trifenilestanho (IV), [SnPh3S2CN(C2H5)2], é solúvel. Todos os complexos são bastante
solúveis em clorofórmio e diclorometano, exceto o complexo bis (N,N-dietilditiocarbamato)
de zinco (II), [Zn{S2CN(C2H5)2}2], que apresentou uma solubilidade razoável. Contudo, este
se solubilizou muito bem em DMSO, ao lado de [In{S2CN(C2H5)2}3], que possui uma
Tabela 2.2 – Teste de solubilidade dos complexos
Complexo Solubilidade
[Bi{S2CN(C2H5)2}3] Acetona, clorofórmio e diclorometano
[SnPh3{S2CN(C2H5)2}] Tolueno, clorofórmio e diclorometano
[Ga{S2CN(C2H5)2}3] Clorofórmio e diclorometano
[In{S2CN(C2H5)2}3] Acetona, clorofórmio, diclorometano e DMSO
2.3.2 Espectroscopia de Ressonância Magnética Nuclear
A espectroscopia de Ressonância Magnética Nuclear é uma ferramenta muito útil na
caracterização de compostos orgânicos e metalorgânicos. Dados da literatura revelam que
complexos metálicos formados pelo ligante N,N-dietilditiocarbamato apresentam em seus
espectros de RMN de 1H sinais na região de deslocamentos (δ) em, 3,80 ppm (quartetos) e na região de δ/ppm 1,30 (tripletos), aproximadamente, que correspondem aos átomos de hidrogênio do grupo etila (CH2 e CH3, respectivamente). E o espectro de RMN de 13C com
sinais próximos de δ/ppm 200,0 para o carbono do grupo NCS2, δ/ppm 50,0 e 12,0 para os
carbonos do grupo etila (CH2 e CH3, respectivamente) (LI, 2007; OLIVEIRA, 1999). Os
espectros obtidos para os complexos sintetizados neste trabalho apresentaram seus sinais,
com valores nas regiões de deslocamentos (δ) em ppm, coerentes com os valores encontrados na literatura, e são apresentados a seguir. O solvente utilizado é clorofórmio
deuterado (CDCl3) com padrão interno TMS para calibração.
O espectro de RMN de 1H do complexo [Bi{S2CN(C2H5)2}3], Figura 2.2, apresenta um
quarteto compreendido entre δH 3,69 e 3,72 que é atribuído aos dois átomos de hidrogênio
do grupo etila (CH2CH3) e um tripleto entre δH 1,34 e 1,37, atribuído aos outros três átomos
de hidrogênios do mesmo grupo (CH2CH3). O sinal em 1,65 é atribuído a moléculas de água
presentes no clorofórmio. O espectro de RMN de 13C deste complexo, Figura 2.3, apresenta
sinais em δ/ppm 12,3, 48,7 e 198,5, atribuídos aos carbonos CH3, CH2 e C (NCS2),
respectivamente.
7.0 6.5 6.0 5.5 5.0 4.5 4.0 3.5 3.0 2.5 2.0 1.5 1.0 0.5 0
Chemical Shift (ppm) 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1.0 In te n s it y 0.59 0.25 0.16 0.04 0.01
7.27 3.72 3.69 1.37 1.34 0.00
CDCl3 TSM CH3 CH2 O H2
Figura 2.2 – Espectro de RMN de 1H para o complexo [Bi{S2CN(C2H5)2}3]. CH3 CH3 N S S C H3 C H3 N S S CH3 CH3
N
S S
Bi
Forma estrutural do complexo
200 180 160 140 120 100 80 60 40 20 0 Chemical Shift (ppm)
0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1.0 In te n s it y 0.00 12.27 48.72 76.39 77.03 198.49 TMS CDCl3
NCS2 CH2
CH3
Figura 2.3 – Espectro de RMN de 13C para o complexo [Bi{S2CN(C2H5)2}3].
O complexo N,N-dietilditiocarbamato de trifenilestanho (IV) apresentou em seu
espectro de RMN de 1H, Figura 2.4, dois quartetos entre δ/ppm 7,37 a 7,77 correspondentes aos átomos de hidrogênio dos grupos fenilas, um quarteto entre δ/ppm 3,82 a 3,85 e um tripleto entre δ/ppm 1,26 a 1,29 que correspondem aos átomos de hidrogênio dos CH2 e CH3
pertencentes aos grupos etilas, respectivamente. O sinal que aparece na região δ/ppm de 1,37 é atribuído a traços de água presentes no clorofórmio. O espectro de RMN 13C, Figura
2.5, apresenta sinais em δ/ppm 128,4; 136,7 e 142,7 que correspondem aos carbonos dos grupos fenilas, os sinais em δ/ppm 195,1; 50,5 e 12,1 correspondem aos carbonos C (do grupo NCS2), CH2 e CH3 (dos grupos etilas), respectivamente.
7.5 7.0 6.5 6.0 5.5 5.0 4.5 4.0 3.5 3.0 2.5 2.0 1.5 1.0 0.5 0
Chemical Shift (ppm) 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1.0 In te n s it y
0.41 0.10 0.15 0.23
0.00 1.26 1.29 3.82 3.85 7.34 7.37 CH3 CH2 O H2
C6H5
TMS
CDCl3
Figura 2.4 – Espectro de RMN de 1H para o complexo [SnPh3{S2CN(C2H5)2}].
N S S C H3 C H3 Sn
200 180 160 140 120 100 80 60 40 20 0 Chemical Shift (ppm)
0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1.0 In te n s it y 0.00 12.14 50.55 76.38 77.02 128.45 136.73 195.12 NCS2 CH2 CH3 TMS CDCl3
C6H5
Figura 2.5 – Espectro de RMN de 13C para o complexo [SnPh3{S2CN(C2H5)2}].
O espectro de RMN de 1H para o composto [Ga{S2CN(C2H5)2}3], Figura 2.6,
apresenta um quarteto compreendido entre δ/ppm 3,73 a 3,77 que é atribuído aos átomos de hidrogênio do CH2 do grupo etila e um tripleto entre δ/ppm 1,27 a 1,30, atribuído aos
átomos de hidrogênio do CH3 desse mesmo grupo. O sinal que aparece na região de δ/ppm
de 1,75 é atribuído a água presente no clorofórmio. O espectro de RMN 13C, Figura 2.7,
apresenta sinais em δ/ppm 201,2; 49,5 e 12,1 correspondentes aos átomos de carbono C (do grupo NCS2), CH2 e CH3 (dos grupos etilas), respectivamente.
7.5 7.0 6.5 6.0 5.5 5.0 4.5 4.0 3.5 3.0 2.5 2.0 1.5 1.0 0.5 0
Chemical Shift (ppm) 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1.0 In te n s it y 0.39 0.25 0.12 0.04 0.01 0.00 1.27 1.30 1.75 3.73 3.77 7.27 O H2 CDCl3 TMS CH2 CH3
Figura 2.6 – Espectro de RMN de 1H para o complexo [Ga{S2CN(C2H5)2}3] CH3 CH3 N S S C H3 C H3 N S S CH3 CH3
N
S S
Ga
Forma estrutural do complexo
![Figura 2.12 – Espectro de absorção na região do infravermelho obtido para o complexo [Bi{S 2 CN(C 2 H 5 ) 2 } 3 ]](https://thumb-eu.123doks.com/thumbv2/123dok_br/15777118.130656/42.892.156.756.146.349/figura-espectro-absorção-região-infravermelho-obtido-para-complexo.webp)
![Figura 2.14 – Espectro de absorção na região do infravermelho obtido para o complexo [Ga{S 2 CN(C 2 H 5 ) 2 } 3 ]](https://thumb-eu.123doks.com/thumbv2/123dok_br/15777118.130656/43.892.147.771.407.623/figura-espectro-absorção-região-infravermelho-obtido-para-complexo.webp)
![Figura 2.15 – Espectro de absorção na região do infravermelho obtido para o complexo [In{S 2 CN(C 2 H 5 ) 2 } 3 ]](https://thumb-eu.123doks.com/thumbv2/123dok_br/15777118.130656/44.892.144.771.149.360/figura-espectro-absorção-região-infravermelho-obtido-para-complexo.webp)
![Figura 2.24 – Espectro de XPS do produto de decomposição térmica do complexo [Bi{S 2 CN(C2H5) 2 } 3 ], antes do](https://thumb-eu.123doks.com/thumbv2/123dok_br/15777118.130656/50.892.211.619.674.971/figura-espectro-xps-produto-decomposição-térmica-complexo-antes.webp)
![Figura 2.25 – Espectro de XPS do produto de decomposição térmica do complexo [Bi{S 2 CN(C2H5) 2 } 3 ], após o](https://thumb-eu.123doks.com/thumbv2/123dok_br/15777118.130656/51.892.205.622.165.466/figura-espectro-xps-produto-decomposição-térmica-complexo-após.webp)
![Figura 2.27 – Espectro UV-Vis do produto obtido decomposição térmica do complexo [Bi{S 2 CN(C2H5) 2 } 3 ]](https://thumb-eu.123doks.com/thumbv2/123dok_br/15777118.130656/52.892.282.622.661.927/figura-espectro-vis-produto-obtido-decomposição-térmica-complexo.webp)
![Figura 2.28 – Determinação do “band gap” para o produto da decomposição térmica do complexo [Bi{S 2 CN(C2H5) 2 } 3 ]](https://thumb-eu.123doks.com/thumbv2/123dok_br/15777118.130656/53.892.263.644.335.623/figura-determinação-band-para-produto-decomposição-térmica-complexo.webp)
![Figura 2.33 – Espectro UV-Vis obtido para o produto da decomposição térmica do complexo [SnPh 3 {S 2 N(C 2 H 5 ) 2 }]](https://thumb-eu.123doks.com/thumbv2/123dok_br/15777118.130656/57.892.271.637.363.636/figura-espectro-obtido-produto-decomposição-térmica-complexo-snph.webp)