INSTTUTO DE BIOCIÊNCIAS – RIO CLARO
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS BIOLÓGICAS BIOLOGIA CELULAR E MOLECULAR
AVALIAÇÃO
IN VIVO
E
IN VITRO
DO POTENCIAL
CITOTÓXICO, GENOTÓXICO E MUTAGÊNICO DA
ÁGUA E DO SEDIMENTO DO RIO CORUMBATAÍ –
SÃO PAULO, BRASIL
LIVIA LOUREIRO DE SOUZA
Dissertação apresentada ao
Instituto de Biociências do
Câmpus
de
Rio
Claro,
Universidade Estadual Paulista,
como parte dos requisitos para
obtenção do título de Mestre em
Ciências Biológicas, área de
Biologia Celular e Molecular.
AVALIAÇÃO
IN VIVO
E
IN VITRO
DO POTENCIAL
CITOTÓXICO, GENOTÓXICO E MUTAGÊNICO DA
ÁGUA E DO SEDIMENTO DO RIO CORUMBATAÍ –
SÃO PAULO, BRASIL
LIVIA LOUREIRO DE SOUZA
Dissertação apresentada ao
Instituto de Biociências do
Câmpus
de
Rio
Claro,
Universidade Estadual Paulista,
como parte dos requisitos para
obtenção do título de Mestre em
Ciências Biológicas, área de
Biologia Celular e Molecular.
Rio Claro - SP
2014
Orientação: Profa. Dra. Maria Aparecida Marin Morales
Dedico este trabalho a todos que me deram apoio e
incentivo para fazer sempre o melhor, especialmente:
Meus pais, Neide e José Roberto, que tornam a minha
vida extremamente feliz, em todos os sentidos, e que
nunca medem esforços para que eu possa realizar meus
objetivos.
Minha avó, Maria Aurora, pelo carinho e amor em todos os
momentos da minha vida.
Meu namorado, Rafael, pela constante atenção,
compreensão e dedicação para me ajudar a realizar essa
conquista.
ii
“… I could have been a dreamer
I could have been a shooting star
I could have been a dreamer
Cause dreams are what we are…”
AGRADECIMENTOS
À minha orientadora, Profa. Dra. Maria Aparecida Marin Morales, pela oportunidade de fazer parte do seu grupo de pesquisa, pela amizade, dedicação, apoio e pela orientação.
À minha coorientadora, Dra. Paula Suares Rocha, pelo constante apoio, dedicação e pela amizade durante a realização deste trabalho.
Ao Programa de Pós Graduação em Biologia Celular e Molecular à Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) pelo suporte financeiro. À Refinaria de Paulínia (REPLAN) por prestar suporte financeiro ao Laboratório de Mutagênese Ambiental, onde foi desenvolvida a maior parte do trabalho.
À Profa. Dejanira Francheschi de Angelis, pelo apoio e auxílio ao trabalho e por ser um verdadeiro exemplo de pessoa.
Às químicas Luciana Polese e Mirtis Ariza Malagutti, do Laboratório de Estudo de Bacias (LEBAC) e ao em convênio com o UFZ - Helmholtz Centre for Environmental Research GmbH, Leipzig, Alemanha, pelas análises químicas.
Ao Centro de Análise de Planejamento Ambiental (CEAPLA) do Instituto de Geociências da UNESP de Rio Claro por fornecerem os dados climáticos necessários para o desenvolvimento do trabalho.
Ao Prof. Dr. Fernando Carlos Pagnocca, à Dra. Bibiana Souza e ao técnico Samuel do CEIS, pelo auxílio durante os processos de liofilização das amostras.
Aos Profs. Dr. Niel C. Bols e Dra. Lucy Lee da Universidade de Waterloo do Canadá; Prof. Dr. Thomas Braunkbeck da Universidade de Heidelberg da Alemanha, Prof. Dr. Henner Hollert e Dr. Steffen Keiter da Universidade de Aachen, por cultivarem e fornecerem as culturas de células RTL-W1 que foram utilizadas nas análises realizadas neste trabalho.
À Dra. Thais Fernandes e Profa. Dra. Grasiela Severi Aguiar por prontamente aceitarem o convite de compor a banca de defesa deste trabalho.
A todo o pessoal do Departamento de Bioquímica, especialmente Eduardo, Dilza, Zito, Márcio (os dois!), Beto, Fátima e Carmen por sempre prestarem auxílio quando precisei e pelo ótimo humor de todos.
Às secretárias do Departamento de Biologia, Lucila, Cris e Mônica por sempre me ajudarem e pelas risadas.
Ao técnico Gerson por sempre me ajudar quando precisei e por espalhar muita alegria e glamour pelo Departamento de Biologia.
iv
À técnica Roberta por sempre me ajudar, e também pelo grande carinho e amizade. À Profa. Dra. Carmen Christofoletti e à Dra. Márcia Hoshina por terem composto a banca de qualificação deste trabalho.
Aos Profs. Dr. do Departamento de Biologia, Maria Izabel Camargo, Sanae Kasahara, Patrícia Maltempi, Karen Moraes, Diogo Cavalcanti, Amilton Ferreira e Flávio Caetano, pelo apoio, suporte e companheirismo no ambiente de trabalho. A todo o pessoal do Departamento de Biologia, Cintya, Júlia, Janaína, Cleiton, Luiz, Bairral, Cris, Matraca, Allison, Daniela, Diovani, Thiago, Mão, Keteryne, Yadira, Jorge, Diogo, Emygdio, Viviane e Tamaris, por terem um ótimo humor e transformarem o ambiente de trabalho em um lugar mais gostoso de trabalhar.
Aos mutagênicos, Verônica, Nádia, Laís, Bruna, Márcia, Michele, Raquel, Maria Tereza, Franco, Leonardo, Matheus, Cris, Jaque pira, Jaque Bianchi, Dânia, Paula, Thaís, Yali e Carol, pela amizade, ajuda constante, risadas, confraternizações e pela alegria de ter vocês como companheiros de laboratório.
Agradeço especialmente aos amigos de laboratório, Paula, Cris, Nádia, Verônica, Raquel, Maria Tereza e Leonardo, que me ajudaram muito durante a execução dos meus experimentos, mesmo que fosse aos feriados ou finais de semana, eu não sei o que teria sido sem a ajuda de vocês.
À Cris, Paula, Raquel, meu pai, José Roberto e meu tio, Dito, por me ajudarem muito durante as coletas das amostras usadas neste trabalho, pois não é nada fácil.
Aos meus pais, Neide e José Roberto, por serem lindos e maravilhosos, por me darem todo e qualquer tipo de ajuda, apoio e suporte em tudo na minha vida, por me ouvirem, pelos conselhos e pelo amor, carinho e pela amizade! Amo vocês!
Ao meu namorado, Rafael, pelo amor, carinho, atenção, dedicação, pela compreensão e por às vezes até ter “trabalhado” junto comigo! Você deu um novo sentido à minha vida, te amo!
À minha avó, Maria Aurora, à minha tia, Maria Aurea e à minha prima, Rafaela, por sempre se interessarem pelo meu trabalho, por me ajudarem quando preciso e por me aconselhar, serei eternamente grata!
Aos meus amigos, Lídia, Natalia, Telma, Débora, Mariana, Gustavo, Marcos, Lilian e Fabi pelo bom humor e momentos de descontração, por sempre me apoiarem e acreditaram em mim!
RESUMO
Os ecossistemas aquáticos são os ambientes mais comprometidos pela poluição derivada de emissões de substâncias tóxicas presentes em efluentes industriais e domésticos e em resíduos agrícolas. Essa contaminação pode atingir tanto a água quanto os sedimentos dos ambientes aquáticos e induzir diversos efeitos adversos aos organismos vivos expostos. A bacia do rio Corumbataí, localizada no interior do estado de São Paulo (Brasil), apresenta grande importância econômica e ambiental para estado. As águas deste rio sofrem diversos impactos ambientais caracterizados pelo descarte de efluentes urbanos e industriais das cidades localizadas próximas à sua margem, bem como da ação de atividades agrícolas, principalmente da cultura de cana-de-açúcar. Sendo assim, este rio recebe uma quantidade considerável de substâncias potencialmente tóxicas, que vêm comprometendo a qualidade de suas águas e de seus sedimentos. O presente estudo teve como objetivo avaliar a citotoxicidade, genotoxicidade e mutagenicidade de amostras de águas e de sedimentos do rio Corumbataí – SP, em pontos situados entre as cidades de Rio Claro e Piracicaba. Foram realizadas duas coletas, uma na estação chuvosa e quente e outra na estação seca e fria, em quatro pontos distintos do rio: P1) à montante da cidade de Rio Claro; P2) à jusante da cidade de Rio Claro; P3) à jusante de Santa Gertrudes e da confluência do rio Corumbataí com o Ribeirão Claro; P4) à montante da cidade de Piracicaba. As avaliações foram realizadas por meio de bioensaios desenvolvidos com os organismos testes Allium cepa e com
cultura de hepatócitos de truta arco-íris da linhagem RTL-W1. Para os bioensaios realizados com A. cepa, foram realizados testes de índice mitótico (IM), de
aberrações cromossômicas (AC) e de indução de micronúcleos (MN), em células meristemáticas e testes de indução de MN em células F1. Para os bioensaios realizados com cultura de células RTL-W1, foi realizado o teste de citotoxicidade, pela incorporação do vermelho neutro, e o teste do MN. Os resultados obtidos neste trabalho, com os dois bioindicadores testados, sugerem que as águas e os sedimentos do rio Corumbataí apresentam características genotóxicas e mutagênicas. Os resultados mais expressivos de toxicidade foram registrados para os pontos P2 e P3, localizados próximos às cidades de Rio Claro e Santa Gertrudes, respectivamente. Nossos resultados indicaram, ainda, que as amostras coletadas em P3 apresentam um maior comprometimento, resultados estes, provavelmente, relacionados ao recebimento de efluentes industriais, da cidade de Santa Gertrudes, que é considerada o maior polo cerâmico da América.
Palavras- chave: aberrações cromossômicas, micronúcleos, biomonitoramento ambiental, rio Corumbataí, efluentes urbanos, efluentes industriais, Allium cepa,
vi
ABSTRACT
Aquatic ecosystems are the most affected by pollution from toxic waste emissions of industrial, domestic and agricultural effluents. This contamination may occur in both water and sediments of aquatic environments and induce many adverse effects to the living organisms. The Corumbataí river basin, located within the state of São Paulo (Brazil), has great economic and environmental importance to the state. The waters of this river suffer from various environmental impacts characterized by the disposal of municipal and industrial effluents from cities located close to its border. Thus, this river receives a considerable amount of potentially toxic substances. Due to its importance for public water supply in the region this study aimed to evaluated the cytotoxic, genotoxic and mutagenic effects of water and sediments samples from this water resource, by means of bioassays. For this study, two sampling campaigns were performed, one in the warm and rainy season and the other in the cold and dry season. Samples were collected in Corumbataí River, in four different sites: P1) upstream the municipality of Rio Claro, P2) downstream the municipality of Rio Claro; P3) downstream the confluence of Corumbataí River and Ribeirão Claro; P4) upstream the municipality of Piracicaba. The evaluations were performed through bioassay with the Allium cepa test organisms and culture of hepatocytes from
rainbow trout RTL - W1. According to obtained results in this work, it was possible to observed that water and sediments Corumbataí have genotoxic and mutagenic characteristics. The most significant results were recorded for the points P2 and P3, located near the cities of Rio Claro and Santa Gertrudes. Our results also indicated that samples collected at P3 were more affected, probably due to influence of discharges of industrial and domestic effluents from the city of St. Gertrudes , which is considered the largest ceramic hub of America.
SUMÁRIO
1. INTRODUÇÃO... 08
2. OBJETIVOS... 09
3. REVISÃO DA LITERATURA... 10
3.1. Poluição ambiental... 10
3.2. Contaminação das águas e dos sedimentos aquáticos... 11
3.3. Mutagênese ambiental... 13
3.4. Bioensaios... 15
3.4.1. Allium cepa... 16
3.4.2. Testes in vitro e cultura de células RTL-W1... 17
3.4.3. Ensaio de incorporação do vermelho neutro... 20
3.4.4. Teste do micronúcleo... 20
3.5. Classificação das águas... 21
4. MATERIAIS E MÉTODOS... 25
4.1. Materiais biológicos... 25
4.2. Área de estudo e pontos de coleta... 25
4.3. Coleta das amostras... 26
4.3.1. Dados térmicos e pluviométricos das coletas... 26
4.4. Preparo das amostras... 26
4.4.1. Extração de fase sólida e eluição dos extratos de água... 27
4.4.2. Preparação dos extratos de sedimentos... 27
4.5. Análises físico-químicas e químicas... 28
4.6. Ensaios... 28
4.6.1. Ensaios de citotoxicidade, genotoxicidade e mutagenicidade em Allium cepa... 29
4.6.2. Ensaios com células RTL- W1... 30
4.6.2.1. Manutenção das culturas de células... 30
4.6.2.2. Ensaio de incorporação do vermelho neutro... 31
4.6.2.3. Teste do micronúcleo... 32
5. RESULTADOS... 34
ARTIGO I: Avaliação citotóxica, genotóxica e mutagênica da água e do sedimento do rio Corumbataí (região entre Rio Claro e Piracicaba), por meio do sistema teste de Allium cepa... 35
ARTIGO II: Avaliação da mutagenicidade da água e do sedimento do rio Corumbataí (região entre Rio Claro e Piracicaba), por meio de ensaios realizados com células RTL-W1... 73
6. CONCLUSÃO GERAL... 113
Introdução 8
1. INTRODUÇÃO
O estilo de vida das populações humanas vem sofrendo grandes alterações ao longo da história, como resposta das crescentes necessidades humanas, do avanço tecnológico e do desenvolvimento socioeconômico. Essas transformações, contudo, não afetam só a população humana, mas também o ambiente como um todo.
Os eventos como a Revolução Agrícola e a Revolução Industrial foram determinantes para a modificação do modo de vida da humanidade, tanto pela prática e desenvolvimento de novas tecnologias para a produção de alimentos, como pelos processos de manipulação de matéria prima.
Apesar do grande avanço econômico e social vivenciado nas últimas décadas, decorrentes do uso das novas tecnologias, houve um correspondente agravamento da poluição, que vem interferindo diretamente nos ecossistemas naturais e consequentemente na biota endêmica do local contaminado. Dentre os ecossistemas afetados pela poluição, os mais comprometidos são os ecossistemas aquáticos, tanto por receberem descartes diretos, como por ser o destino final de todo poluente despejado nos diversos ambientes físicos. Como a água é o constituinte básico de todos os organismos, os ambientes aquáticos acabam também sendo responsáveis pela manutenção da vida no planeta. A água, por sua vez, também é de extrema importância para o desenvolvimento das mais diversas atividades humanas.
A depreciação dos ambientes aquáticos como os de água doce, que vem ocorrendo em escala mundial, tem gerado uma grande preocupação ambiental. No Brasil, muitas cidades crescem e se desenvolvem próximas aos recursos hídricos, pela facilidade de abastecimento das cidades. Porém, estes recursos hídricos também recebem efluentes contendo contaminantes decorrentes da própria urbanização destes locais.
2. OBJETIVOS
Considerando que existe uma potencialidade de contaminação dos cursos d’água e dos sedimentos da bacia do Corumbataí, cuja água serve para o abastecimento de várias cidades do interior do estado de São Paulo, este estudo teve como objetivo:
- Avaliar os possíveis contaminantes químicos presentes nas amostras de água e de sedimentos do rio Corumbataí por meio de análises químicas;
- Avaliar os efeitos citotóxicos, genotóxicos e mutagênicos de amostras de águas e de sedimentos coletadas em pontos de possíveis impactos do rio Corumbataí, por meio de bioensaios de índices mitóticos, de aberrações cromossômicas e de indução de micronúcleo, antes e após período de recuperação, por 48 horas em água ultra pura, em células meristemáticas e F1 do organismo teste
Allium cepa;
- Concentrar o conjunto de possíveis contaminantes presentes neste recurso hídrico, por meio de extrações específicas, tanto de amostras de água (Extração de Fase Sólida), como de amostras de sedimentos (Extração Cetônica), coletadas em pontos de possíveis impactos do rio Corumbataí;
- Avaliar os efeitos citotóxicos dos extratos de amostras de sedimentos, coletadas em pontos de possíveis impactos do rio Corumbataí, por meio do Ensaio de Incorporação do Vermelho Neutro em células RTL-W1;
- Avaliar os efeitos mutagênicos dos extratos de amostras de água e do sedimento, coletadas em pontos de possíveis impactos do rio Corumbataí, por meio de bioensaios de indução de micronúcleos em células RTL-W1;
- Correlacionar os dados obtidos nas análises químicas com os resultados das análises biológicas, para estabelecer uma possível relação de causa e efeito dos contaminantes presentes nas amostras com os efeitos biológicos observados;
Revisão da literatura 10
3. REVISÃO DA LITERATURA
3.1. Poluição ambiental
Atualmente as atividades humanas promovem diversos impactos no meio ambiente. Tais atividades incluem as industriais, as agrícolas e o intenso processo de urbanização, que são caracterizados, principalmente, pelo lançamento de efluentes industriais e domésticos, que podem contaminar o ar, a água e o solo (CHASIN; PEDROZO, 2003).
A contaminação ambiental pode ocorrer tanto em áreas rurais como em áreas urbanas; por disposições contínuas ou eventuais; por fontes localizadas ou por transportes a longas distâncias. Desta forma, os impactos podem promover severas alterações nos ecossistemas e danos graves aos organismos vivos, como por exemplo: acúmulo de poluentes orgânicos nos tecidos dos organismos de locais muito distantes da fonte poluidora, contaminação de corpos d’água superficiais e subterrâneos ou ainda contaminação de solos florestais por poluentes lançados nas regiões industrializadas (EUGRIS, 2013).
É importante salientar que a poluição ambiental pode ter diversas origens, como químicas, físicas ou biológicas. Assim, é de extrema importância se investir no desenvolvimento de estudos que avaliem os efeitos que a poluição pode causar sobre os ecossistemas (PEREIRA, 2004).
doenças; (8) Contaminação por elementos com propriedades radioativas, que gera grande preocupação pelos efeitos danosos e persistentes em longo prazo.
3.2. Contaminação das águas e dos sedimentos aquáticos
Os ecossistemas aquáticos são os que mais sofrem os impactos das ações humana, pois estes recebem grandes quantidades de poluentes que contaminam águas subterrâneas e corpos d’água.
Dentre os principais poluentes químicos lançados no meio aquático estão os agrotóxicos (TREPÓS et al., 2012), os fertilizantes (MIRLEAN et al. 2002), os químicos industriais (HENDRYX et al., 2012), os hidrocarbonetos policíclicos aromáticos (HPAs) (CELINO et al. 2010), os metais (VENKATRAMREDDY et al., 2009) e os efluentes urbanos (CHEN et al 2013), sendo que muitos desses contaminantes atingem o ambiente aquático por meio de lançamento de efluentes que não recebem o tratamento adequado, antes de serem lançados nos corpos hídricos (KNIE; LOPES, 2004).
Quando os poluentes atingem os corpos d’água, eles estão sujeitos à ação de diversas variantes ambientais, tanto físicas quanto biológicas, como: fator diluição (que pode provocar um aumento ou uma diminuição dos poluentes no meio); ação hidrodinâmica (que pode promover o transporte desses poluentes); ação da gravidade (que pode auxiliar na sedimentação dos poluentes); e ação da luz, da temperatura e de microorganismos (que podem promover degradação das moléculas dos poluentes) (PEREIRA, 2004).
A contaminação dos ambientes aquáticos é difícil de controlar, pois, na maioria das vezes, ela ocorre a partir de fontes não pontuais, ou também chamadas de difusas, que são aquelas fontes que não permitem a identificação do ponto de lançamento dos contaminantes (MOZETO; ZAGATTO, 2006). As cargas poluidoras difusas se devem ao escoamento rural e urbano, distribuído ao longo das bacias hidrográficas. Essa poluição pode ainda ser de origem orgânica ou inorgânica, sendo que as orgânicas têm origem nos restos e dejetos humanos e animais e na matéria orgânica vegetal e as inorgânicas no uso de produtos químicos, nos efluentes industriais não pontuais e na lavagem pelo escoamento de superfícies contaminadas como as áreas urbanas (TUCCI, 2001).
Revisão da literatura 12
Este fato vem ocorrendo em escala mundial e, por isso, chama a atenção da comunidade científica, visto que o ser humano ainda não dispõe de ferramentas suficientes para a completa reversão destes poluentes. Segundo Lima (2001), mais de 97% da água do planeta está concentrada nos oceanos e mares e menos de 3% pertencem às reservas de água doce. A princípio, apenas a água doce é adequada para o consumo humano, embora apenas uma pequena parcela dessa porcentagem seja viável para este consumo.
Pela própria propriedade da água ser um solvente considerado universal, o ambiente aquático possui uma alta capacidade de solubilização de compostos orgânicos e inorgânicos, que ficam dispersos na coluna d’água, sujeitos a diversos tipos de reações químicas. Tais reações ocorrem a partir da formação de um gradiente vertical, entre as regiões mais superficiais e as regiões mais profundas do meio aquático, onde existe uma distribuição desigual na quantidade de luz, nutrientes, temperatura e dos gases do meio aquático (ESTEVES, 1998).
As regiões profundas do meio aquático são caracterizadas por acúmulo de sedimentos, originados a partir de processos de erosão, que podem ser transportados pelos rios, tendo, desta maneira, um papel importante na qualidade d’água destes ambientes (WALLING, 2009).
Os sedimentos aquáticos são formados por uma matriz complexa composta por uma mistura da argila, areia, sais minerais e matéria orgânica, depositada logo abaixo da coluna d’água dos recursos hídricos (ARAÚJO et al., 2006), sendo considerados os locais mais importantes para a acumulação e transformação da matéria orgânica presente no meio aquático(CANFIELD et al., 1993; WAINRIGHT et al., 1992; VILLAR et al., 1999). Os sedimentos desempenham um papel importante no meio aquático, pois mediam trocas químicas entre a fase particulada e a fase biológica do meio aquático (PELUSO et al., 2013).
Contudo, esses contaminantes podem retornar a coluna d’água, por meios de processos como bioturbação e/ou ressuspensão dos sedimentos (FILGUEIRAS et al., 2002; SPROVIERI et al., 2007), caracterizando-se, assim, em fontes secundárias de poluição (LEE et al., 2000; BURTON; LANDRUM, 2003).
As mudanças ambientais derivadas das ações humanas, que não incluem o lançamento direto de agentes químicos ao ambiente, também podem impactar o meio aquático. Algumas atividades humanas como, por exemplo, as navegações e as dragagens podem também promover a remobilização dos sedimentos nos rios, redisponibilizando os poluentes para a coluna d’água (WETZEL et al., 2013). Outras condições, como as tempestades (KUUSISTO-HJORT; HJORT, 2013) e enchentes, também podem promover o retorno desses poluentes à fase dissolvida na coluna d’água (DENNIS et al., 2003; HOLLERT et al., 2003; SCHWARTZ et al., 2006; WALLING, 2009; BELLAS et al., 2011; WETZEL et al., 2013).
A maioria dos contaminantes adsorvidos nos sedimentos é persistente e pode induzir diversos efeitos adversos nos organismos expostos, mesmo quando os níveis de contaminantes da coluna da água são baixos (CHAPMAN, 1989, WETZEL et al., 2013). Desta maneira, os organismos aquáticos podem ser contaminados pela água, pelos sedimentos ou pela alimentação, dependendo do tipo contaminante considerado e da ecologia desses organismos (WANG et al., 2004). Deve-se levar em consideração que, mesmo que os contaminantes estejam restritos aos sedimentos e não disponibilizados na coluna d’água, a comunidade bentônica estará associada a esta contaminação. Uma vez que esta comunidade serve de base para a alimentação de outras comunidades, essa contaminação pode comprometer a qualidade de todo o ecossistema, tanto por via direta quanto por via trófica (YI et al., 2008). Desta maneira, a contaminação dos sedimentos pode levar a processos de bioacumulação e biomagnificação (BURTON, 2002), que se caracteriza em um perigo para os organismos aquáticos que tendem a bioacumular poluentes orgânicos persistentes em seus tecidos, quanto para os seres humanos que podem se alimentar desses organismos (BARÓN et al., 2013).
3.3. Mutagênese ambiental
Revisão da literatura 14
aumentando o surgimento de mutações que, quando acumuladas, podem desencadear o aparecimento de doenças degenerativas e de processos neoplásicos nos organismos expostos (RIBEIRO; MARQUES, 2003).
As alterações que ocorrem na molécula de DNA podem ser passíveis ou não de correção pelo sistema de reparo celular. Quando são passíveis de correção, o agente promotor é chamado de agente genotóxico, mas quando tais alterações não são corrigidas pelo sistema de reparo da célula, o agente promotor é chamado de mutagênico. Desta forma, as alterações no DNA resultantes de erros ocasionais, ocorridos durante a divisão celular, podem resultar no aparecimento de mutações (RIBEIRO; MARQUES, 2003).
As mutações ocorrem ao longo da vida de todos os organismos vivos, sendo um evento fundamental para a evolução e, consequentemente, um processo importante para o aumento da diversidade biológica do planeta. Muitas mutações passam despercebidas, por não acarretarem danos aos organismos. Entretanto, embora a ocorrência de mutações seja um processo natural e necessário para a vida, em determinadas situações, elas podem resultar em alterações danosas ao organismo (RIBEIRO; MARQUES, 2003).
Um agente mutagênico tem a capacidade de promover uma alteração no material genético de uma célula, a partir de diversos modos de ação. Tal agente pode promover a adição, substituição ou deleção de bases no DNA nuclear, que podem alterar a sequência de codificação de aminoácidos, caracterizando, assim, uma mutação gênica; pode promover também alterações na estrutura ou no número de cromossomos de uma determinada célula, o que caracteriza as mutações conhecidas como cromossômicas. As mutações cromossômicas se dividem ainda em: estruturais, que podem promover duplicação, translocação, inversão e deleção de fragmentos cromossômicos; e numéricas, que, por sua vez, alteram o número de cromossomos presentes nas células, a partir da ocorrência de aneuploidias e poliploidias cromossômicas (BURNS; BOTTINO, 1991). A ocorrência de quaisquer destas mutações podem alterar os ciclos mitóticos e/ou meióticos das células, levando a uma divisão celular incorreta (MATSUMOTO; MARIN-MORALES, 2004; MATSUMOTO et al.,2006), que podem levar a instabilidade celular e ao desenvolvimento de processos carcinogênicos (FERNANDES, 2005).
cromossômicas estruturais ou numéricas; na formação de micronúcleos; na ocorrência de trocas entre cromátides-irmãs; e na avaliação da ocorrência de danos no DNA. Os danos relacionados ao DNA podem ser caracterizados como mutações de ponto; alterações no gene; danos clastogênicos (alterações na estrutura cromossômica, que podem resultar em quebras cromossômicas); danos aneugênicos (como por exemplo, os derivados de alterações nos microtúbulos) (FERNANDES, 2005) e aneuploidias (ganho ou perda de cromossomos) (HOUK, 1992).
Desta forma, as respostas apresentadas pelos organismos expostos, comparadas com as de um grupo controle, permitem avaliar, de maneira mais ampla, rápida e eficaz, o efeito que os contaminantes ambientais têm sobre os sistemas biológicos (RIZZO, 2011). É importante salientar que, se os agentes causam danos diretamente ao DNA de um organismo teste, o potencial genotóxico deste agente pode, em alguns casos, ser extrapolado para outros tipos celulares (RAMEL, 1983).
3.4. Bioensaios
A qualidade de um dado ambiente aquático é dada, de modo geral, a partir de duas formas de análises, consideradas complementares: as análises químicas, que identificam e quantificam as substâncias químicas presentes na água; e as análises biológicas, que qualificam os efeitos que podem ser induzidos nos organismos vivos por essas substâncias.
A prática de usar organismos vivos para testar comprometimento ambiental surgiu no século XIX, ainda com metodologias rudimentares, onde animais e plantas começaram a ser usados para avaliação dos efeitos negativos de ambientes contaminados, especialmente dos ambientes aquáticos. Essas avaliações são chamadas, atualmente, de bioensaios. Os ensaios biológicos podem ser desenvolvidos com vários grupos de organismos vivos, incluindo desde bactérias até mamíferos (KNIE; LOPES, 2004).
Revisão da literatura 16
as diferenças e peculiaridades dos organismos, que podem diferir entre si em aspectos como sensibilidade, mecanismos de reparo do DNA e atividade metabólica (RAMEL, 1983). Assim, os bioensaios são extremamente importantes, uma vez que análises químicas podem ser muito limitadas, pois apenas identificam e/ou quantificam as possíveis substâncias tóxicas, sem levar em consideração seus efeitos sobre os organismos expostos. Além disso, considerando a imensa quantidade de compostos químicos que podem chegar às águas, torna-se impossível a qualificação, com exatidão, de todos estes compostos (KNIE; LOPES, 2004). Ademais, as diferentes substâncias presentes no meio aquático, podem apresentar características e efeitos diferentes sobre os organismos, a partir do efeito combinados dessas substâncias (JAGER et al., 2007).
Nesse contexto, o monitoramento ambiental dos ecossistemas aquáticos representa uma ferramenta importante na análise da qualidade de água, tendo como principais objetivos estudar os tipos de contaminações (poluentes naturais ou sintéticos), resultantes das atividades humanas, além de identificar quais os mecanismos de ação desses poluentes e seus consequentes efeitos sobre o conjunto de seres vivos que habitam a biosfera (ZAGATTO, 2006).
3.4.1. Allium cepa
Os vegetais superiores vêm sendo amplamente recomendados pelo Programa Ambiental das Nações Unidas (UNEP), pelo Programa Internacional de Segurança Química (IPCS, OMS) e pela Organização Mundial da Saúde (OMS), para avaliar efeitos genotóxicos e mutagênicos de amostras ambientais e de substâncias químicas (BAGATINI et al., 2007; LAUGHINGHOUSE IV et al., 2012).
Dentre as plantas utilizadas para tais análises, destaca-se a espécie Allium cepa, pela sua eficiência de resposta a diversos agentes ambientais (GRANT, 1994;
1999), sendo, por isso, considerada um modelo eficiente para avaliação da contaminação ambiental terrestre e aquática (LEME; MARIN-MORALES, 2008; HOSHINA; MARIN-MORALES, 2009).
Os bioensaios realizados com A. cepa, quando comparados com bioensaios
realizados com animais, são considerados mais sensíveis para avaliações ambientais e de mais fácil execução (LEME; MARIN-MORALES, 2008), uma vez que a espécie A. cepa possui uma alta taxa de germinação e um comportamento
consistentes (ALVIM et al., 2011). Os bioensaios com a espécie A. cepa podem,
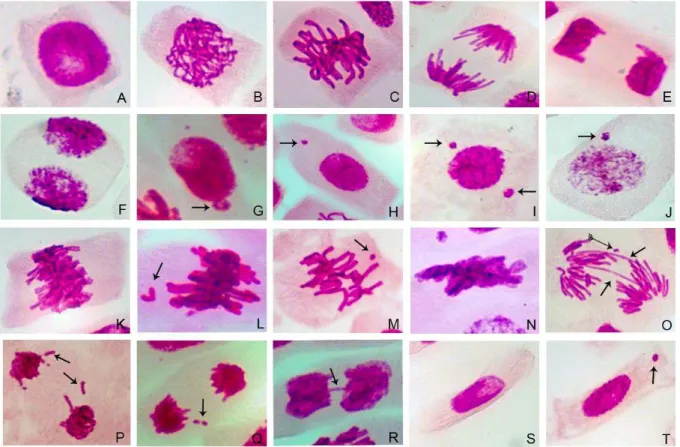
ainda, ser realizados em um curto período, visto que o tempo, desde o processo de germinação até a coleta das raízes, é de cerca de cinco dias. A espécie possui determinadas características que auxiliam no desenvolvimento das análises, como por exemplo, cromossomos grandes e em pequeno número (2n=16), podendo ser facilmente visualizados em microscopia de luz, facilitando também a avaliação da presença de possíveis aberrações cromossômicas (GRANT, 1982).
Apesar dos organismos vegetais apresentarem diferenças metabólicas em relação aos animais, existem ainda muitas similaridades entre esses grupos, podendo haver uma correlação de até 82% entre os ensaios realizados com A. cepa
e com animais (FISKESJO, 1993, 1994; RANK; NIELSEN 1994). Os ensaios com A. cepa foram também considerados mais sensíveis que o teste de Ames (RANK;
NIELSEN, 1994) e com outros vegetais superiores como, por exemplo, a espécie
Vicia faba (MA et al., 1995; MIGID et al., 2007). Essa espécie pode ser utilizada para
analisar diferentes parâmetros de avaliação (endpoints), como: (1) avaliação de citotoxicidade - obtida a partir de parâmetros como índice mitótico (IM) e parâmetro de proliferação celular (GADANO et al., 2002); (2) genotoxicidade - obtida a partir da ocorrência de aberrações cromossômicas (AC) e de alterações nucleares; e (3) mutagenicidade – obtida a partir da ocorrência de micronúcleos celulares e fragmentos cromossômicos (LEME; MARIN-MORALES, 2009).
3.4.2. Testes in vitro e cultura de células RTL-W1
O controle do uso de animais como organismos testes tem se tornado cada vez mais rigoroso, uma vez que os comitês de ética do mundo todo tentam minimizar (ou até mesmo exterminar) o sofrimento de animais utilizados em testes biológicos (ROGERO et al., 2003; UBELS; CLOUSING, 2005). Desta maneira, tem sido necessário o desenvolvimento e a padronização de ensaios in vitro, realizados com
diferentes sistemas testes, que apresentem as características e as interações celulares dos tecidos originais, para poder, assim, simular as respostas biológicas obtidas em experimentos in vivo (ZUCCO et al., 2004). os bioensaios realizados com
Revisão da literatura 18
Muitos pesquisadores têm utilizado, como sistemas teste, células mantidas em cultura (ROCHA et al., 2009; BOETTCHER et al., 2010; BARON et al., 2012; KIENZLER et al., 2012; 2013; MALHÃO, 2013). Nos ensaios in vitro, essas culturas
são expostas a um agente a ser testado, para se verificar possíveis alterações celulares que possam ocorrer nestas células. Tais ensaios apresentam algumas vantagens em relação aos testes in vivo, como, por exemplo: (1) a possibilidade de
limitação do número de variáveis experimentais; (2) a maior facilidade de obtenção de dados significativos; (3) a alta reprodutibilidade; (4) a realização do experimento em um curto período de tempo; (5) a alta sensibilidade em relação a outros testes e (6) aos baixos custos, quando comparados com os testes in vivo (ROGERO et al.,
2003).
As culturas de células que podem ser utilizadas nos bioensaios envolvem, basicamente, linhagens de cultivos primários e linhagens de cultivos permanentes. A obtenção das linhagens de cultivo primário pode ser dar a partir de células recentemente isoladas de tecidos, sendo que essas linhagens possuem um tempo de cultivo limitado (culturas finitas). A obtenção das linhagens de cultivo permanente, ou imortais, se dá pela transformação de células que tem capacidade de crescimento ilimitado em cultura (culturas infinitas). Alguns exemplos de culturas de células amplamente utilizadas em bioensaios são as Culturas de Fibroblastos 3T3, células HeLa e Células de Ovário de Hamster chinês (CHO) (SACHANA; HARGREAVES, 2007).
Existe um grande número de tipos celulares que podem ser empregados nos bioensaios in vitro, sendo que culturas celulares também são muito utilizadas para a
avaliação dos efeitos da ação de xenobiontes presentes nos ambientes.
Os bioensaios in vitro realizados com cultura de células de peixes são muito
importantes para o monitoramento ambiental, sendo eficientes para a avaliação do potencial tóxico tanto de substâncias isoladas quanto de misturas ambientais complexas, como as amostras de água e de sedimentos (CHEN; WHITE, 2004). Estudos indicam que as culturas de células de peixe podem substituir, ou complementar, os estudos in vivo realizados com animais (BABICH;
BORENFREUND, 1986; 1987; CASTANO et al., 1994; JHA, 2004; ROCHA et al., 2009; BOLS et al., 1985).
(KNASMÜLLER et al., 2004), quanto da avaliação da ação de compostos xenobiontes (PESONEN; ANDERSSON, 1997; SEGNER, 1998), visto que as células do fígado possuem a capacidade de metabolização e biotransformação dos xenobiontes, sendo indicadas para a avaliação dos efeitos da ação direta dos contaminantes, bem como da ação dos seus metabólitos (LEE et al., 1993; KNASMÜLLER et al., 2004).
Dentre as linhagens de culturas de células de peixes, destaca-se a linhagem RTL-W1 (LEE et al., 1993), que tem sido utilizada em diversos bioensaios para a avaliação de diferentes endpoints. Essa linhagem celular foi obtida a partir do isolamento de células do fígado de um macho adulto de truta arco-íris (Oncorhynchus mykiss). A partir da cultura primária inicial, algumas células
continuaram a crescer lentamente até que, após 5 meses, foi atingida a confluência dessas células. Neste período, foram preparadas subculturas destas células, a partir de procedimentos de tripsinização (passagens). Após 14 meses de cultivo, Lee et al. (1993) desenvolveram testes com essas linhagens, onde os autores observaram que, após 100 passagens destas células (replicações celular), o tempo entre as passagens foi reduzido para um período de 7 a 10 dias. As células RTL-W1, provavelmente, adquiriram uma imortalidade espontânea, mesmo não sendo células neoplásicas. Essa linhagem celular é considerada uma linhagem celular normal de hepatócitos, pois mantem a sua característica celular, independente do número de passagens necessárias para os experimentos (MALHÃO et al., 2013).
Culturas de células RTL-W1 apresentam uma alta eficiência na detecção dos efeitos citotóxicos e genotóxicos dos poluentes presentes no meio aquático (NEHLS; SEGNER, 2001; ROCHA et al., 2009; BOETTCHER et al., 2010). No entanto, a maioria dos estudos realizados com esta linhagem celular se concentra em estudos que avaliam a atividade enzimática desta célula, tendo poucos estudos relacionados com a avaliação de amostras ambientais de ecossistemas aquáticos. Dentre os poucos estudos ambientais realizados com essas células, a maioria se concentra na avaliação da genotoxicidade (teste do cometa) e uma pequena parte para avaliar a mutagenicidade (indução de micronúcleos) de amostras aquáticas (MALHÃO et al., 2013).
Revisão da literatura 20
Esta linhagem celular também se mostrou adequada para a detecção do potencial genotóxicos (ensaio do cometa) de extratos de sedimento (BOETTCHER et al., 2010; ROCHA et al., 2009). Além disso, Kosmehl et al. (2004) comprovaram que as células RTL-W1 possuem uma alta capacidade de biotransformação de compostos químicos, quando comparadas com outras linhagens de células de peixe, como, por exemplo, as células RTG-2.
3.4.3. Ensaio de incorporação do vermelho neutro
Foram desenvolvidos muitos ensaios in vitro, realizados com cultura de
células, para avaliar citoxicidade. Esses testes consistem em verificar, por diferentes métodos, entre eles o de incorporação de corantes vitais ou pela inibição da formação de colônias celulares, a presença de alterações em células expostas a agentes tóxicos. (ROGERO et al., 2003).
O corante vermelho neutro tem sido muito utilizado como um dos indicadores de citotoxicidade de células mantidas em cultura, dentre elas as de hepatócitos, sendo também usado para avaliar viabilidade celular. O ensaio de citotoxicidade com o vermelho neutro caracteriza-se em um teste de incorporação do corante por células viáveis (FOTAKIS; TIMBRELL, 2006), a partir da sua absorção pela membrana celular, por difusão passiva não iônica. O corante se concentra nos lisossomos das células, fixando-se nestas estruturas através de ligações eletrostáticas com grupos aniônicos e fosfatos hidrofóbicos da matriz lisossomal (MELO, 2000). Desta maneira, muitas substâncias tóxicas danificam as membranas celulares, resultando no decréscimo de captura e ligação do vermelho neutro, tornando possível distinguir células vivas das danificadas ou mortas, pela medida de intensidade de cor da cultura celular (CIAPETTI et al., 1996).
3.4.4. Teste do micronúcleo
O teste do micronúcleo é frequentemente utilizado na detecção da indução de danos nos cromossomos ou no aparato mitótico das células. Este teste se baseia na ocorrência de fragmentos de cromossomos ou de perdas de cromossomos inteiros, que não foram reincorporados ao núcleo principal da célula durante a divisão celular, sendo, então, transformados em pequenos núcleos (JENSSEN; RAMEL, 1980; GRISOLIA, 2002; NORPPA; FALCK, 2003). Desta forma, os micronúcleos são estruturas circulares envolvidas por membrana, semelhantes ao núcleo principal, mas de tamanho muito menor, equivalentes a 1/3 a 1/16 do tamanho do núcleo (RODRIGUES et al., 1997; FERETTI et al., 2008), que possuem mesma refringência, sendo facilmente reconhecidos por microscopia de luz (AL SABTI; METCALFE, 1995).
Dentre as vantagens da realização deste teste, incluem-se a facilidade de análise e a possibilidade de sua aplicação em qualquer população celular em proliferação (HAYASHI et al.,1998).
A indução de micronúcleos pode predizer efeitos clastogênicos e/ou aneugênicos de diversos agentes. Sendo assim, a formação dos micronúcleos por fragmentos cromossômicos, derivados de quebras cromossômicas, caracteriza uma ação clastogênica, e a formação dos micronúcleos por perdas de cromossomos inteiros, durante a divisão celular, caracteriza uma ação aneugênica, dos agentes testados (LEME et al., 2008).
Este teste tem sido um dos métodos mais utilizados na avaliação de danos cromossômicos (FENECH, 2006; FENECH et al., 2003), sendo considerados eventos chave no desenvolvimento do câncer e do envelhecimento celular (FENECH, 2000). Desta forma, o teste do micronúcleo tem sido aplicado em diversas áreas biológicas e da saúde, na identificação do potencial genotóxico de novos produtos farmacêuticos, agrotóxicos, agentes físicos em geral e amostras ambientais (KIRSCH-VOLDERS, 1997). O teste do micronúcleo tem também sido muito utilizado, tanto para avaliações in situ (ROCHA et al., 2009), quanto para
avaliações in vitro de contaminantes presentes em amostras ambientais
Revisão da literatura 22
3.5. Classificação das águas
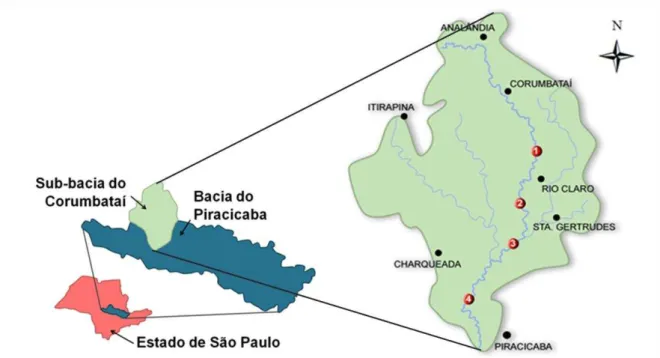
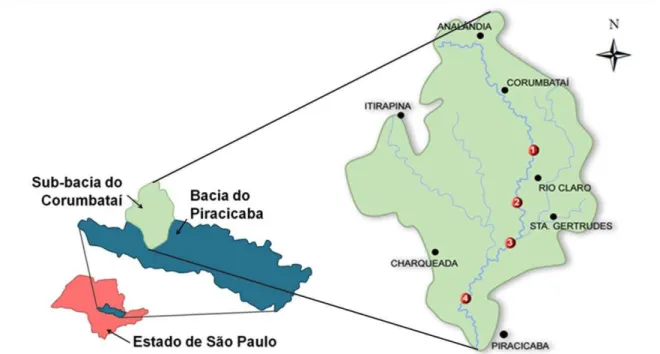
O rio Corumbataí constitui uma sub-bacia da bacia do rio Piracicaba, que pertence a Unidade de Gerenciamento de Recursos Hídricos das Bacias do Piracicaba, Capivari e Jundiaí – UGRHI PCJ. Este corpo hídrico nasce no município de Analândia, passando pelos municípios de Corumbataí, Itirapina, Ajapi, Rio Claro, Santa Gertrudes, Ipeúna, Charqueada e Piracicaba, todos localizados no interior do estado de São Paulo. Sua bacia compreende uma área de 1.679,19 Km², totalizando 13,4 % da área da sua bacia principal (IRRIGART, 2005) e recebe os afluentes: ribeirão Claro, o ribeirão Passa Cinco, o rio Cabeça e o córrego da Servidão.
Figura 1: Esquema ilustrativo da localização geográfica da sub-bacia do rio Corumbataí (SP).
O uso das águas da bacia do Corumbataí é dividido, basicamente, em 54% para o abastecimento da população urbana, dentre elas as cidades de Rio Claro e Piracicaba, 22% para abastecimento industrial e 14% para irrigação agrícola, sendo uma sub-bacia de grande interesse econômico e ambiental (PALMA-SILVA, 1999; CARMONA et al., 2004).
Esta região possui diversos problemas ambientais, decorrentes da falta de planejamento de ocupação, com grandes áreas ocupadas por monocultura de cana-de-açúcar e por pastagens, além de ter um alto desenvolvimento industrial e uma concentração urbana intensa, atividades estas consideradas potencialmente poluidoras (FREDERICE et al., 2010).
poluidora e um consequente aumento dos custos dos tratamentos de água das cidades que fazem uso deste recurso hídrico para abastecimento (CETESB, 2009).
As áreas da bacia do Corumbataí destinadas ao plantio de cana-de-açúcar estão próximas às margens do rio, fator este bastante preocupante, pois os agrotóxicos e outros produtos agrícolas podem ser facilmente carregados pelas águas da chuva para a calha do rio (CELLA, 2009).
Desta forma, de acordo com Palma-Silva (1999), os principais problemas ambientais que podem ser encontrados na região da Bacia do Rio Corumbataí podem ser resumidos em:
- Lançamento de esgotos domésticos e de efluentes industriais; - Disposição inadequada de resíduos sólidos;
- Crescimento desordenado das áreas urbanas;
- Erosão e assoreamento do rio, devido ao desmatamento das matas ciliares; - Degradação da paisagem para extração mineral;
- Realização de queimadas, aplicação de vinhaça, herbicidas e fertilizantes nas atividades agrícolas realizadas no entorno da bacia;
- Pilhas de rejeitos de lixo próximos aos rios.
O rio Corumbataí é classificado, de acordo com a resolução CONAMA, como de Classe 2 (MESSIAS et al.,2008). As águas de rios com esta classificação são destinadas: (1) ao abastecimento para consumo humano, após tratamento convencional; (2) à proteção das comunidades aquáticas; (3) à recreação; (4) à irrigação de hortaliças, plantas frutíferas, parques, jardins que possam vir a ter contato direto com o público e (5) à aquicultura e pesca.
As condições dos mananciais, de acordo com Tucci (2001) e definidas na Resolução CONAMA 357/05, dispõe que os requisitos mínimos para as águas de Classe 2 proíbe, nestas bacias, atividades como as relacionadas a: (1) Indústrias: incluindo as atividades de indústrias sucroalcooleiras, metalúrgicas, de galvanoplastia, químicas em geral, matadouros, de artefatos de amianto e processadoras de material radioativo; (2) Hospitais, sanatórios e leprosários; (3) Depósitos de lixo; (4) Parcelamento do solo de alta densidade: lotes, desmembramento e conjuntos habitacionais.
Revisão da literatura 24
Público (IAP), que reflete a contaminação dos corpos hídricos por atividades urbanas e industriais e Índice de Qualidade das Águas para a Proteção da Vida Aquática (IVA), que reflete a qualidade das águas para fins de proteção da fauna e flora em geral. Tais índices possuem classificações que variam de: ótima, boa, regular, ruim e péssima.
Os dados obtidos pelo comitê PCJ, em seu relatório mais recente, para os IAP e IVA de alguns pontos do Rio Corumbataí estão representados no quadro 1:
Quadro 1: Dados da avaliação da qualidade da água do Rio Corumbataí pelo comitê PCJ.
ÁREA DE AVALIAÇÃO IAP IVA
TRECHO À MONTANTE DE RIO CLARO REGULAR REGULAR TRECHO À JUSANTE DE RIO CLARO BOA ÓTIMA TRECHO À JUSANTE DE SANTA GERTRUDES BOA PÉSSIMA
TRECHO À MONTANTE DE PIRACICABA RUIM REGULAR
4. MATERIAIS E MÉTODOS
4.1. Materiais biológicos
Neste estudo, foram utilizadas, para o desenvolvimento de bioensaios os, sistemas testes A. cepa (variedade Baia-Periforme), células RTL-W1 mantidas em
cultura (LEE et al., 1993), derivadas do fígado de truta arco-íris (Oreochromis mykiss).
4.2. Área de estudo e pontos de coleta
As coletas das amostras de água e sedimentos do rio Corumbataí foram realizadas em quatro pontos distintos, localizados no Médio e no Baixo Corumbataí, próximos às cidades de Rio Claro, Santa Gertrudes e Piracicaba, como segue na figura 1 e tabela 1:
(P1) ponto à montante do município de Rio Claro; (P2) ponto à jusante de município de Rio Claro;
(P3) ponto à jusante do município de Santa Gertrudes e da confluência do rio Corumbataí com o ribeirão Claro;
(P4) ponto à montante da confluência do rio Corumbataí com o rio Piracicaba.
Figura 1: Esquema ilustrativo dos quatro pontos de coleta. (1) P1 - ponto à montante do município de
Materiais e Métodos 26
Tabela 1: Coordenadas geográficas dos pontos de coleta.
PONTOS DE COLETA LATITUDE (S) LONGITUDE (W)
P1 22º23.205’ 47º32.753’
P2 22º25.343’ 47º35.614’
P3 22º29.076’ 47º35.600’
P4 22º30.917’ 47º37.467’
P1 - ponto à montante do município de Rio Claro; P2 - ponto à jusante de município de Rio Claro; P3 - ponto à jusante do município de Santa Gertrudes e da confluência do rio Corumbataí com o Ribeirão Claro; P4 - ponto à montante da confluência do rio Corumbataí com o Rio Piracicaba.
4.3. Coleta das amostras
Foram realizadas duas coletas durante o estudo, sendo uma durante a estação chuvosa e quente (fevereiro de 2013) e outra durante a estação seca e fria (julho de 2013). Estas coletas procuraram englobar as estações climáticas que melhor determinam o clima da região de estudo.
Para cada ponto amostrado do rio Corumbataí foram coletadas amostras de água e de sedimento. As amostras de água foram coletadas com o auxílio de baldes de aço inoxidável e frascos de vidro, enquanto que as amostras dos sedimentos foram realizadas com o auxílio de uma draga de Ekman-birge (coleta da camada de sedimento mais superficial).
Tanto as amostras de água quanto as de sedimentos foram homogeneizadas para a retirada de uma amostra composta, cujo volume final foi de 4 L para a água e de 2 Kg, para o sedimento. Os volumes finais de água e sedimento foram acondicionado em frasco escuro, mantido sob refrigeração, para serem, posteriormente, transportado para o laboratório, onde as amostras foram mantidas a 4°C, até serem utilizadas nos bioensaios.
4.3.1. Dados térmicos e pluviométricos dos meses das coletas
Os dados térmicos e pluviométricos da região em estudo, para os períodos considerados, foram obtidos junto Centro de Análise de Planejamento Ambiental (CEAPLA) do Instituto de Geociências da UNESP de Rio Claro.
4.4. Preparo das amostras
Os ensaios realizados com a espécie A. cepa não necessitaram de um
natura. No entanto, para a realização dos ensaios com culturas de células RTL-W1, as amostras de água e de sedimento dos pontos amostrados (P1, P2, P3 e P4), para as duas coletas realizadas, passaram por um processo de extração orgânica.
4.4.1. Extração de fase sólida e eluição dos extratos de água
O procedimento de extração de fase sólida foi realizado conforme o estudo desenvolvido por Silva (2013), e consistiu, basicamente, em passar as amostras de água por cartuchos poliméricos capazes de reter os contaminantes presentes nas amostras. Assim, para a realização da extração de fase sólida, neste estudo, primeiramente, as amostras de água foram filtradas, por duas vezes, em sistema de filtração a vácuo, com filtros de fibra de vidro de 47 mm (Sartorius Stedim Biotech®). Posteriormente, para o procedimento de extração, foram preparados cartuchos com resinas poliméricas Strata-X 200 mg/3 mL (Phenomenex®), adicionando-se 6 mL de metanol em cada cartucho, para a abertura de suas cadeias poliméricas. Em seguida foram adicionados 6 ml de água ultra pura para a retirada dos resíduos de metanol.
Após a preparação dos cartuchos, estes foram conectados a um sistema de filtração a hidrovácuo, por onde foi passado 1 L de amostra, em cada cartucho, no seguinte sentido: (1) colunas de vidro; (2) mangueiras de silicone; (3) manifold conectado a uma bomba de hidrovácuo. Desta maneira, os contaminantes presentes nas amostras ficaram todos retidos nos polímeros dos cartuchos e o restante de água, isenta de contaminantes, foi descartada no recipiente de descarte do manifold. Posteriormente, os cartuchos foram conectados diretamente ao manifold, para secagem, e depois armazenados em freezer a -20 ºC, até a sua utilização nos ensaios.
Para a eluição dos cartuchos, foi adicionado 10 mL de metanol em cada cartucho. O extrato obtido (metanol + contaminantes que estavam retidos nos cartuchos) foi seco em nitrogênio gasoso, até obter um volume de 1 mL de extrato, ou extratos mil vezes concentrado (1 mL de extrato/1 L de amostra). Os extratos obtidos foram mantidos a 4ºC, até a sua utilização nos ensaios.
4.4.2. Preparação dos extratos de sedimentos
Materiais e Métodos 28
extrator Soxhlet. Primeiramente, as amostras de sedimentos (previamente congeladas a - 80ºC), foram liofilizadas, até a retirada total do conteúdo aquoso, por reação de sublimação da água. Posteriormente, foram colocados em filtros de celulose 20 g de cada amostra, sendo um filtro para cada amostra. Os filtros, contendo as amostras de sedimentos foram colocados em colunas de extração (Soxhlet), sendo uma para cada amostra. As colunas foram conectadas, em uma de suas extremidades, a um condensador de refluxo (contendo água gelada), e na outra extremidade, a um balão volumétrico (aquecido por uma fonte de calor), contendo 100 mL de acetona – P.A. (solvente orgânico).
Desta forma, formou-se um sistema fechado, onde o solvente foi aquecido até a sua evaporação. O vapor deste solvente foi condensado na coluna de extração, ao entrar em contato com o condensador de refluxo, gotejando, assim, na coluna de extração, até preencher toda a coluna. Ao encher a coluna de extração e entrar em contato com as amostras de sedimento, o solvente retornou ao balão volumétrico por sifonação e o processo de refluxo se repetiu automaticamente. Este processo foi realizado durante 16 horas, extraindo os possíveis contaminantes do sedimento, transferindo-os para o solvente orgânico. Os extratos de sedimentos foram concentrados no próprio aparelho de Soxhlet, eliminando-se o solvente, antes do seu retorno ao balão volumétrico.
Posteriormente, os extratos foram secos em nitrogênio gasoso, e redissolvidos em 1 mL de dimetilsulfóxido (DMSO), obtendo-se um extrato equivalente a 20 g de sedimento em 1 mL de DMSO (20 g SEQ/mL DMSO).
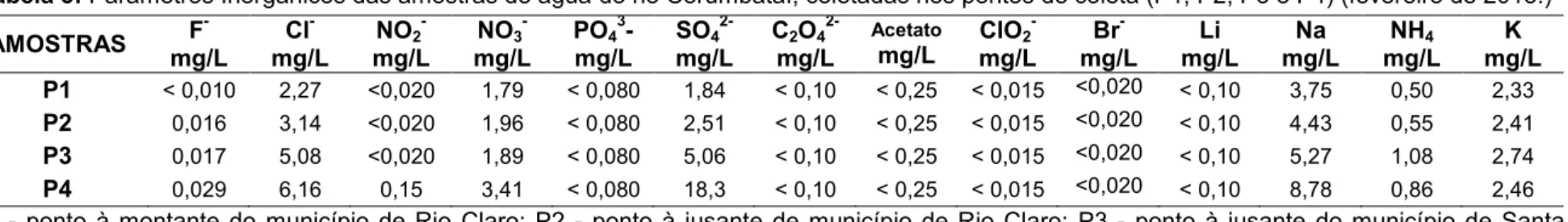
4.5. Análises físico-químicas e químicas
As análises físico-químicas foram realizadas com o auxílio do equipamento Horiba®, considerando os parâmetros: pH, temperatura, salinidade, condutividade, turbidez e oxigênio dissolvido.
4.6. Ensaios
4.6.1. Ensaios de citotoxicidade, genotoxicidade e mutagenicidade em Allium cepa
As sementes de A. cepa foram submetidas à germinação em dois tipos de
ensaios: um em amostras de água e o outro em amostras de sedimento coletados no rio Corumbataí. O controle positivo foi realizado com sementes expostas à germinação em metil-metanosulfonato (MMS – 4 x 10-4 M) e o controle negativo em água ultra pura. Todos os ensaios foram realizados em estufa a 20 ºC.
Para todos os ensaios realizados com A. cepa, foram feitos testes de
recuperação, colocando as raízes previamente expostas nas amostras de água e de sedimento, em água ultra pura por 48 horas, para avaliar a persistência da ação dos contaminantes presentes nas amostras (água e sedimento) do rio Corumbataí.
Após a germinação das sementes, as raízes foram coletadas e fixadas em Carnoy 3:1 (etanol: ácido acético - v/v), por 6 a 18 horas, em duas situações: após 120 horas de exposição às amostras de água e de sedimento, e após o período de recuperação de 48 horas em água ultra pura.
Para a realização das análises de índice mitótico (IM), aberrações (AC) cromossômicas e de micronúcleo (MN), as raízes, previamente fixadas, foram submetidas a uma hidrólise ácida (HCl 1N a 60º C) por 8-9 minutos, seguido de tripla lavagem em água destilada. Após a hidrólise, as raízes foram submetidas à reação de Feulgen, utilizando o reativo de Schiff por 2 horas em local escuro. Após lavagem das raízes, até a total retirada do corante, foram confeccionadas lâminas pela técnica de esmagamento suave, utilizando tanto as regiões meristemáticas como as F1 das raízes (1 mm acima da região meristemática). As lamínulas foram retiradas
em nitrogênio líquido e, após secagem por 24 horas, as lâminas foram montadas em resina Enthellan®. As lâminas foram analisadas em microscopia de luz, aumento de
400 vezes.
Para as análises de citotoxicidade, realizada para todos os ensaios, foi avaliado o índice de divisão celular, segundo a fórmula a seguir:
Materiais e Métodos 30
Para as análises de genotoxicidade, foi avaliada a ocorrência de aberrações cromossômicas, por meio da contabilização das células que apresentaram anormalidades celulares do tipo aderências cromossômicas, C-metáfase, pontes cromossômicas, anáfases multipolares e perdas cromossômicas, segundo a fórmula a seguir:
Para as análises de mutagenicidade em células meristemáticas, foi avaliada a ocorrência de micronúcleos e de quebras cromossômicas, pela contabilização das células que apresentaram tais anormalidades celulares. Para as análises de mutagenicidade em células F1, foi avaliada a ocorrência de micronúcleos, pela
contabilização das anormalidades nessas células, conforme as fórmulas a seguir:
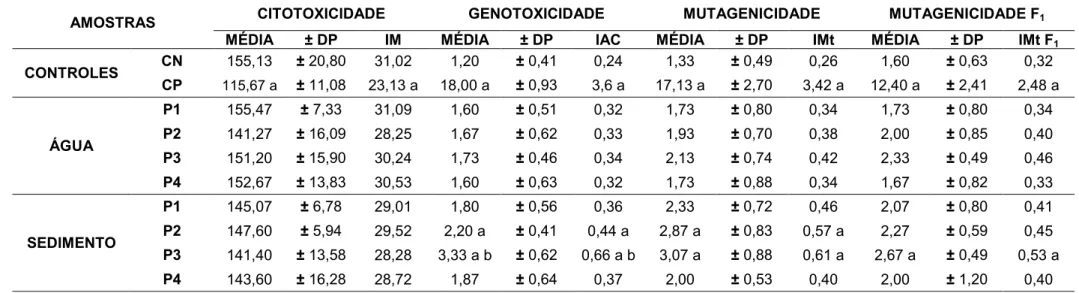
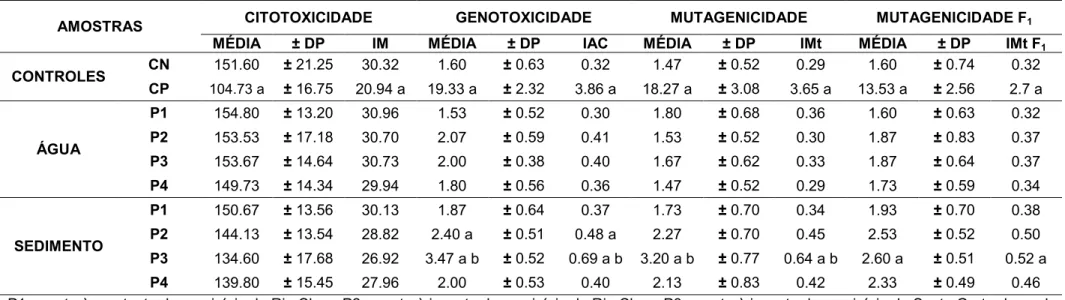
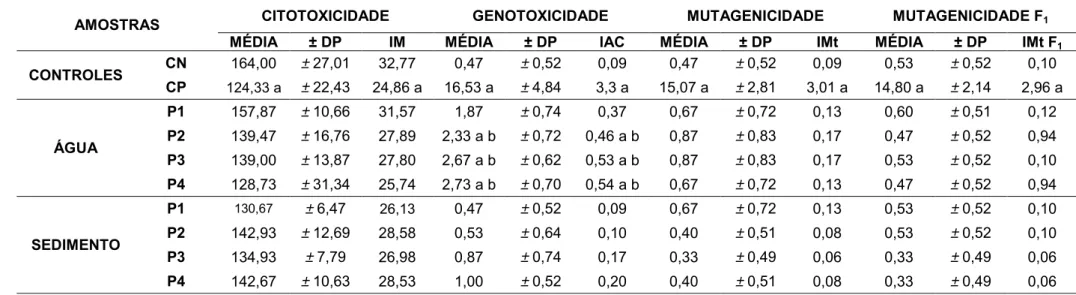
Para todos os tratamentos, foram realizadas 3 réplicas, sendo analisadas 5 lâminas por réplica, contabilizando 2.500 células por réplica, totalizando 7.500 células por tratamento. As comparações estatísticas foram feitas entre os resultados dos testes e os resultados do controle negativo (CN) e entre as amostras de água e sedimento de um mesmo ponto. Foi aplicado o teste estatístico não paramétrico de Kruskal-Wallis (p<0,05).
4.6.2. Ensaios com células RTL-W1
4.6.2.1. Manutenção das culturas de células
As células foram mantidas em frascos de cultura de 25 cm2 (TPP®), contendo
Para a realização das passagens, as células foram lavadas duas vezes com 5 mL de PBS (Phosphate Buffered Saline), depois tripsinizadas com 1 mL de tripsina 0,5%, durante 1 minuto. Posteriormente, a tripsina foi neutralizada com 5 mL de meio L15 suplementado e a suspensão celular foi resuspendida, para a obtenção de células isoladas. Foi adicionado mais meio aos frascos e a suspensão celular foi então aliquotada em novos frascos, sendo 10 mL para cada frasco.
4.6.2.2. Ensaio de incorporação do vermelho neutro
O ensaio de incorporação do vermelho neutro foi utilizado para avaliar o potencial citotóxico dos extratos de sedimentos (toxicidade aguda), assim como para determinar os volumes de extratos de sedimentos que continham as concentrações mais elevadas e não tóxicas de sedimentos, que foram utilizadas nos experimentos
in vitro, em endpoints específicos.
Para a realização deste ensaio, os extratos de sedimentos foram diluídos em meio L15, a uma concentração inicial de 200 mg de extrato por mL de meio. Foram adicionados 100 µL dos extratos em poços de placas de 96 poços (TPP®), onde foram realizadas as diluições em série a partir destes volumes (1:1 a 1:64), totalizando 6 réplicas por placa. Em seguida, foram adicionados 200 µL de suspensão celular em cada poço. O controle positivo foi realizado com 3,5-Diclorofenol, a uma concentração de 80mg/L de meio, e o controle negativo apenas com meio L15 suplementado. A exposição foi realizada por 48 horas, a 20 ºC.
Após a exposição, os extratos foram descartados e as células foram incubadas com o corante vermelho neutro (2-metil-3-amino-7-dimetilaminofenazona) a 1% por 3 horas. Após esse período o corante foi descartado e as células foram expostas a uma solução de extração (490 mL de etanol 99%, 10 mL de ácido acético, 500 mL de água destilada), por 30 minutos, para serem posteriormente observadas em espectrofotômetro.
Para a determinação de citotoxicidade, a incorporação de vermelho neutro foi medida a 540 nm, com um comprimento de onda de referência de 690 nm. A viabilidade das células foi expressa em porcentagem e os dados foram avaliados com o software Prism 4.0 (GraphPad®).
O potencial citotóxico dos extratos foi calculado como NR85 e, desta forma, os
Materiais e Métodos 32
utilizadas nos ensaios, foram aqueles que induziram 15% de mortalidade das células, após 48 horas de exposição.
4.6.2.3. Teste do micronúcleo
Para os testes realizados com os extratos das amostras de água, as células RTL-W1 foram expostas a 5 mL dos extratos diluídos (1:1000) em meio L15, em frascos de 25 cm2 (TPP®), sendo um frasco para cada amostra, totalizando 2
réplicas por frasco.
Para os testes realizados com os extratos das amostras de sedimentos, primeiramente, as células foram incubadas em placas de 6 poços (TPP®) e depois expostas a 2 mL de diluições seriadas de extratos (1:1, 1:2, 1:4 e 1:8) em meio L 15, a partir dos volumes de extratos que continham as concentrações máximas de sedimentos, definidas pelos valores de NR85, para os extratos de cada ponto, como
segue:
Quadro 2: Volume dos extratos de sedimentos utilizadas nos ensaios do MN.
PONTOS FEVEREIRO/2013 JULHO/2013
P1 5,5 µL DE EXTRATO 3,25 µL DE EXTRATO P2 2,50 µL DE EXTRATO 2,50 µL DE EXTRATO P3 1,25 µL DE EXTRATO 0,95 µL DE EXTRATO P4 2,20 µL DE EXTRATO 6,70 µL DE EXTRATO
Para todos os tratamentos, o controle positivo foi realizado com metil-metanosulfonato (MMS – 2 x 10-4 M) e o controle negativo foi realizado com o meio
L15 suplementado.
As exposições aos tratamentos foram realizadas por 48 horas (para todos os extratos) a 20 ºC. Após esse período, o meio com os extratos foi descartado e substituído por um novo meio suplementado, por mais 72 horas, para permitir a proliferacão celular. Após esse período, as células foram lavadas duas vezes com PBS, tripsinizadas (tripsina 0,5%) e neutralizadas com meio L 15 suplementado.
fixador Carnoy 3:1 (metanol: ácido acético - v/v), diluído em PBS (1:1), para a primeira etapa de fixação. Após esse procedimento, as células foram centrifugadas novamente por 10 minutos a 1500 RPM. O primeiro fixador foi descartado, as células foram resuspendidas, sendo adicionada uma nova solução de fixador Carnoy 3:1 (metanol: ácido acético - v/v) aos tubos (2 mL em cada tubo falcon). As células fixadas foram armazenadas a -20 ºC, até sua posterior utilização.
Para a confecção das lâminas, as células foram centrifugadas por 10 minutos a 1500 RPM, formando um pellet celular. A solução de fixação foi descartada e 0,5 mL de uma nova solução de fixação foi adicionada em cada tubo. Em seguida, as células (pellet) foram ressuspendidas. Esta suspensão foi gotejada em lâminas previamente lavadas, cobertas com um filme de água ultra pura, e mantidas a 4 ºC.
Posteriormente, as lâminas foram submetidas a uma hidrólise ácida (HCl 1N a 60º C) por 5 minutos, seguida de lavagem em água destilada. Após a hidrólise, as lâminas foram submetidas à reação de Feulgen, utilizando o reativo de Schiff por 2 horas em local escuro. Em seguida, as lâminas foram contracoradas com Giemsa a 0,2% por 5 minutos.
Para os testes realizados com extratos de água (CN), foram contabilizadas 2.000 células por frasco, com 2 réplicas, totalizando 4.000 células por tratamento.
Para os testes realizados com extratos de sedimentos foram contabilizadas 1.000 células por lâmina, onde foram analisadas 2 lâminas, totalizando 2.000 células por diluição.
Resultados 34
5. RESULTADOS
ARTIGO I: Avaliação do potencial citotóxico, genotóxico e mutagênico da água e do sedimento do rio Corumbataí (São Paulo – Brasil), por meio do sistema teste de
Allium cepa
Livia Loureiro de Souza; Paula Suares Rocha; Maria Aparecida Marin-Morales.
ARTIGO II: Avaliação do potencial citotóxico e mutagênico da água e do sedimento do rio Corumbataí (São Paulo - Brasil), por meio de ensaios realizados com células RTL-W1
ARTIGO I:
AVALIAÇÃO DO POTENCIAL CITOTÓXICO, GENOTÓXICO
E MUTAGÊNICO DA ÁGUA E DO SEDIMENTO DO RIO
CORUMBATAÍ (SÃO PAULO - BRASIL), POR MEIO DO
SISTEMA TESTE DE
Allium cepa
Livia Loureiro de Souza
1; Paula Suares Rocha
1;
Maria Aparecida Marin-Morales
11Departamento de Biologia, Instituto de Biociências, Universidade Estadual Paulista
Resultados: Artigo I 36
RESUMO
As substâncias potencialmente tóxicas que são lançadas no meio ambiente são o principal fator de contaminação dos corpos d’água. Tais substâncias podem interagir com a coluna d’água, acumular e contaminar também os sedimentos. Tal contaminação pode causar efeitos nocivos a organismos expostos e representar um perigo, não só para organismos aquáticos, mas para o ecossistema como um todo. A bacia do rio Corumbataí é de grande importância econômica para o interior do estado de São Paulo-Brasil, pois suas águas são utilizadas no abastecimento de várias cidades. Entretanto, este rio recebe uma quantidade significativa de descartes de efluentes urbanos, industriais e resíduos agrícolas, que vêm comprometendo a qualidade de suas águas. Dentre os vegetais superiores, a espécie Allium cepa tem
sido muito utilizada em avaliações do potencial tóxico de amostras ambientais, principalmente de ambientes aquáticos. Devido a grande importância do rio Corumbataí para o abastecimento público da região, o presente estudo avaliou os efeitos citotóxicos, genotóxicos e mutagênicos de amostras de água e de sedimentos deste recurso hídrico, por meio de bioensaios de índice mitótico, aberrações cromossômicas e micronúcleos, tanto em células meristemáticas como F1 de A. cepa. Também foi avaliada a persistência dos efeitos dos contaminantes
das águas e sedimentos sobre o organismo teste, após um período de recuperação de 48 horas em água ultra pura. Foram realizadas duas coletas, sendo uma na estação chuvosa e quente e outra na estação seca e fria. As amostras foram coletadas em quatro pontos distintos do rio Corumbataí: P1) à montante da cidade de Rio Claro; P2) à jusante da cidade de Rio Claro; P3) à jusante do município de Santa Gertrudes e da confluência do rio Corumbataí com o Ribeirão Claro; P4) à montante da cidade de Piracicaba. Foi observado que as sementes expostas às amostras de água in natura tiveram a inibição quase completa de germinação e de
crescimento das raízes, evidenciando a alta toxicidade das amostras. Todavia, as amostras de água diluídas na proporção 1:2 (v:v, amostra de água/água ultra pura, respectivamente) não apresentaram alterações para os testes de germinação. O mesmo ocorreu para as amostras de sedimento, onde as sementes somente germinaram quando essas amostras foram misturadas com areia de sílica na proporção 1:1. Para as análises com a água, foram observados resultados significativos de genotoxicidade para as amostras coletadas na estação seca, nos pontos P2, P3 e P4. Para as amostras de sedimentos, foram evidenciados resultados significativos de genotoxicidade e mutagenicidade para as amostras coletadas na estação chuvosa, nos pontos P2 e P3. Os resultados sugerem que existe um comprometimento da água do rio a partir das cidades de Rio Claro e Santa Gertrudes, provavelmente ao fato do P2 e P3 se localizarem próximos a lançamentos de efluentes industriais e domésticos destas cidades.