Leonardo de Sá Costa
Síntese e Caracterização de compostos de coordenação do Ácido
4-cloro-2-(2-furilmetilamino)-5- sulfamoil-benzóico
com os íons níquel, cobalto e zinco.
_______________________________________
Dissertação de Mestrado
Natal/RN, fevereiro de 2014
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE
CENTRO DE CIÊNCIAS EXATAS E DA TERRA
Leonardo de Sá Costa
Síntese e Caracterização de compostos de coordenação do Ácido 4-cloro-2-(2-furilmetilamino)-5- sulfamoil-benzóico com os íons níquel, cobalto e zinco.
Dissertação apresentada ao Programa de Pós-Graduação em Química da Universidade Federal do Rio Grande do Norte, em cumprimento às exigências para obtenção do Título de Mestre em Química.
Orientadora: Profa Dra. Maria de Fátima Vitória de Moura.
Co-orientador: Profº Dr. Ótom Anselmo de Oliveira.
Divisão de Serviços Técnicos
Catalogação da Publicação na Fonte. UFRN Biblioteca Setorial do Instituto de Química
Costa, Leonardo de Sá.
Síntese e Caracterização de compostos de coordenação do Ácido 4-cloro-2-(2-furilmetilamino)-5- sulfamoil-benzóico com os íons níquel, cobalto e zinco. / Leonardo de Sá Costa. - Natal, RN, 2014.
88 f. : il.
Orientadora: Maria de Fátima Vitória de Moura. Co-orientador: Ótom Anselmo de Oliveira.
Dissertação (Mestrado em Química) - Universidade Federal do Rio Grande do Norte. Centro de Ciências Exatas e da Terra. Programa de Pós-Graduação em Química. Afetividade. Química. Aulas experimentais.
1. Furosemida - Dissertação. 2. Compostos de Coordenação - Dissertação. 3. Análise Térmica - Dissertação. 4. Síntese – Dissertação. I. Moura, Maria Fe Fátima Vitória de. II. Oliveira, Ótom Anselmo. III. Universidade Federal do Rio Grande do Norte. III. Título.
Dedico este Trabalho a minha mãe Cynthia, a minha
AGRADECIMENTOS
Primeiramente a Deus por estar sempre comigo, fazendo com que não desista e dando
a possibilidade de compreender coisas maravilhosas com esta ciência.
À Profa. Dra. Maria de Fátima Vitória de Moura pelo carinho, compreensão, amizade, apoio e pela orientação no desenvolvimento dessa dissertação.
Ao Profº. Dr. Ótom Anselmo de Oliveira, pelas orientações nas correções e revisões.
Compartilhando gentilmente dos seus conhecimentos no desenvolvimento desta dissertação.
Também agradeço pelo incentivo a dar continuidade a este trabalho e ao exemplo de
profissional a ser seguido.
À minha namorada Elaine Aguiar por todo amor, compreensão e auxílio nesta etapa da
vida.
A minha mãe Cynthia Maria e a minha família por sempre me incentivar a alcançar
caminhos mais distantes e entender a importância deste sonho. Dando todo apoio moral e
financeiro.
A toda equipe do NUPPRAR que me recebeu de braços abertos e onde pude adquirir
experiências que levarei em toda a minha vida.
Ao Profº. Dr. Ademir Oliveira da Silva pela participação na banca de qualificação e
defesa, contribuindo para a elaboração desta dissertação.
Aos meus companheiros de laboratório Genikson Borges, Joadir Junior, Franciel e
Beatriz pela amizade, apoio e companheirismo.
Ao Prof. Dr. Cicero Flavio Soares Aragão, professor do departamento de farmácia da
Universidade Federal do Rio Grande do Norte que gentilmente contribui para a elaboração
Ao Professor Dr. Severino Alves Junior da Faculdade de Química Fundamental (DQF)
da UFPE, que contribuiu para obter os resultados das amostras de análise elementar.
Ao Professor Dr. Henrique Eduardo Bezerra da Silva por compor a banca de defesa
desta dissertação.
À Universidade Federal do Rio Grande do Norte e ao Programa de Pós-Graduação em
Química.
Ao Programa de Aperfeiçoamento de Pessoal do Ensino Superior (CAPES) pelo apoio
“A melhor maneira que o homem dispõe para se aperfeiçoar.
É aproximar-se de Deus”
Pitágoras
RESUMO
Este trabalho teve a finalidade de promover a síntese, caracterização e de propor uma
estrutura molecular para os compostos de coordenação envolvendo a furosemida (Ácido
4-cloro-2-(2-furilmetilamino)-5-sulfamoil-benzóico), com os íons metálicos Ni+2, Zn+2 e Co+2. Os compostos foram obtidos em meio metanóico por evaporação do solvente após o
procedimento da síntese. Para caracterização dos compostos de coordenação, foram feitas as
determinações dos teores de metais por complexometria com EDTA, espectroscopia na região
do infravermelho (FTIR), solubilidade dos compostos em diversos solventes, análise
termogravimétrica (TG), calorimetria exploratória diferencial (DSC), análise térmica
diferencial (DTA) e a determinação dos teores de carbono, nitrogênio e hidrogênio (CHN). Os
resultados da espectroscopia na região do infravermelho sugerem que o ligante se coordene de
forma bidentada, com os íons metálicos. As interações com os centros metálicos ocorrem pela
coordenação do átomo de nitrogênio do grupo amino e pelo átomo de oxigênio do ácido
carboxílico da estrutura da furosemida. Com os resultados dos teores de metais, análise
elementar (CHN) e análise térmica, foram possíveis propor as estruturas dos complexos. Os
valores de condutividade molar em acetonitrila indicam que os complexos apresentam
comportamento de não eletrólito em solução. Os compostos apresentam alta solubilidade em
metanol e acetonitrila, já em água são parcialmente insolúveis. Através dos resultados das
análises térmicas (TG, DSC, DTA), obteve-se o comportamento térmico dos compostos
como: etapas de desidratação, estabilidade térmica, decomposição e as energias envolvidas.
ABSTRACT
This work aimed to promote the synthesis, characterization and propose a plausible
molecular structure for coordination compounds involving furosemide
(4-Chloro-2-(2-furylmethylamino)-5-sulfamoyl-benzoic acid) with the metal ions Ni+2, Zn+2 and Co+2. The compounds were obtained in methanoic medium by evaporation of the solvent after the
synthesis procedure. For characterization of coordination compounds determining the levels
of metals by EDTA complexometry, infrared spectroscopy (FTIR), solubility of compounds
in various solvents, thermogravimetry (TG), differential scanning calorimetry (DSC),
differential thermal analysis were made (DTA), determination of the carbon , hydrogen and
nitrogen (CHN). The results of infrared spectroscopy in the region suggest that the organic
ligand is coordinated in a bidentate fashion to the metal ions, the metal center interactions to
occur by the coordination of the nitrogen atom of the amino group and the oxygen atom of the
carboxylic acid of the structure of furosemide. With the results of the levels of metal,
elemental analysis (CHN) and thermal analysis has been possible to propose the structure of
the ligand. The values of the molar conductivity of the complex in acetonitrile behavior
suggest the non acetonitrile electrolyte solution. With the solubility tests it was found that the
compounds have high solubility in methanol and acetonitrile, as are partially insoluble in
water. From the results of thermal analysis (TG, DSC, DTA), it was possible to obtain the
thermal behavior of the compounds as stages of dehydration, thermal stability, decomposition
and the energies involved.
Keywords: Furosemide. Coordination Compounds. Thermal Analysis. Synthesis.
LISTA DE FIGURAS
Figura 3.1 - Imagem de um paciente com acúmulo de água nas pernas causado por edema... 23
Figura 3.2 - Representação de um rim, em corte longitudinal, e um nefrón desembocando em um ducto coletor... 26
Figura 3.3 - Representação das estruturas moleculares dos principais diuréticos de alça... 26
Figura 3.4 - Estrutura molecular da Furosemida... 27
Figura 3.5 - Etapas da síntese da Furosemida (FUR)... 27
Figura 3.6 - Representação da estrutura do complexo
[Co(NH3)6]Cl3... 29
Figura 3.7 – Representação das estruturas, dos quelantes que apresentam um ou mais sítios de coordenação... 30
Figura 3.8 - Representação da interação da cis[Pt(NH3)2Cl2] com as bases
Guanina e Adenina... 31
Figura 3.9 - Representação da estrutura do complexo cis[Pt(NH3)2Cl2], conhecida
como Cisplatina... 32
Figura 3.10 - Estrutura do complexo [Pd(FUR)2Cl2] proposto por Cuxia e
colaboradores... 32
Figura 3.11 - Projeção da estrutura molecular do complexo [Cu(FUR)2.(MeOH)2].
Os íons cloretos foram omitidos para maior clareza... 34
Figura 3.12 - Projeção da estrutura abaixo do eixo u. As ligações de hidrogênio são representadas por linhas tracejadas e os átomos de oxigênio indicados pela cor preta... 35
Figura 3.13 - Empacotamento cristalino das moléculas do complexo
CuFUR2.2MeOH... 36
Figura 3.14 - Representação estrutural da molécula da vitamina B12... 38
Figura 3.16 - Tipos de vibrações moleculares na região do espectro do
infravermelho... 40
Figura 3.17 - Esquema do interferômetro de Michelson... 41
Figura 3.18 - Esquema de um analisador térmico diferencial... 43
Figura 3.19 - Esquema do equipamento para análises DSC... 44
Figura 3.20 - Estrutura do EDTA com seus possíveis sítios de coordenação... 47
Figura 5.21 - Espectros vibracionais na região do infravermelho da Furosemida livre... 58
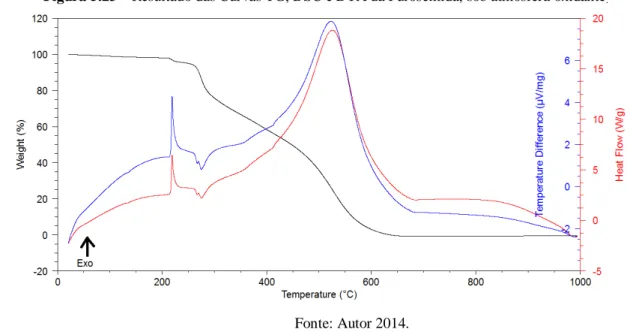
Figura 5.22 - Resultado das curvas TG/DTG da Furosemida sob atmosfera de oxidante... 60
Figura 5.23 - Resultado das Curvas TG, DSC e DTA da Furosemida, sob atmosfera oxidante... 60
Figura 5.24 – Espectros vibracionais na região do infravermelho FUR-Co, em pastilha de KBr na temperatura ambiente... 62
Figura 5.25 - Espectros vibracionais na região do infravermelho FUR-Ni, em pastilha de KBr na temperatura ambiente... 64
Figura 5.26 - Espectros vibracionais na região do infravermelho FUR-Zn, em pastilha de KBr... 65 Figura 5.27 - Resultados das curvas TG/DTG do composto de coordenação com os íons cobalto... 67
Figura 5.28 - Resultados das curvas TG/DSC/DTA do composto de coordenação com cobalto... 68
Figura 5.29 - Resultado das curvas TG/DTG do composto de coordenação com níquel. ... 69 Figura 5.30 - Resultados das curvas TG/DSC/DTA do composto de coordenação com zinco... 70
Figura 5.32 - Resultados das curvas TG/DSC/DTA do composto de coordenação
com zinco... 72
Figura 5.33 - Estrutura proposta através dos resultados obtidos com a
caracterização do complexo de cobalto... 76
Figura 5.34 Estrutura proposta através dos resultados obtidos com a
LISTA DE TABELAS
Tabela 3.1 - Tabela obtida por Geary de diversos solventes, para determinar o tipo de
eletrólito através da condutividade molar... 46 Tabela 4.2 - Reagentes utilizados... 50
Tabela 5.3 - Resultados da análise elementar da Furosemida... 57
Tabela 5.4 - Bandas de absorção e as principais atribuições da estrutura da FUR na
região do espectro do infravermelho... 59 Tabela 5.5 - Os resultados das temperaturas, eventos e energia das curvas
TG/DTG/DSC da Furosemida... 61 Tabela 5.6 - Número de onda (cm-1) e atribuições espectroscópicas na região do
infravermelho dos complexos FUR- Co... 63
Tabela 5.7 - Número de onda (cm-1) e atribuições espectroscópicas na região do infravermelho dos complexos FUR- Ni...
64
Tabela 5.8 - Número de onda (cm-1) e atribuições espectroscópicas na região do infravermelho do complexo FUR-Zn ... 66
Tabela 5.9 - Os resultados das temperaturas, eventos e energia das curvas TG/DTG/DSC do complexo com cobalto... 68
Tabela 5.10 - Os resultados das temperaturas, eventos e energia das curvas
TG/DTG/DSC do complexo com níquel... 70
Tabela 5.11 - Os resultados das temperaturas, eventos e energia das curvas
TG/DTG/DSC do complexo com zinco...,,,, 72
Tabela 5.12 - Solubilidade dos compostos de coordenação com a
FUR... 73
Tabela 5.13 - Resultados de CHN para os complexos FUR-Co, FUR-Ni e FUR-Zn... 73
Tabela 5.14 - Resultados dos teores de metais propostos teoricamente e os obtidos
titulometria com EDTA. ... 74
Tabela 5.15 Condutividades molares ( M) obtidas para soluções dos complexos da
LISTA DE SIGLAS, ABREVIAÇÕES E SÍMBOLOS
TG Curvas Termogravimétrica
DTA Análise Térmica Diferencial
IV Infravermelho
FUR Furosemida
CHN Análise Elementar de Carbono, Hidrogênio e Nitrogênio
DTG Termogravimetria Derivativa
DSC Calorimetria Exploratória Diferencial
Condutividade Específica
M Condutividade Molar
C Concentração
Ta Temperatura da amostra
Tr Temperatura da referência
FTIR-MID Espectroscopia na Região do Infravermelho Médio com Transformada de
Fourier
MeOH Metanol
NKCC2 Transportador de sódio, potássio e cloreto
TG-MS Análise termogravimétrica acoplada à espectroscopia de massa
TG-FTIR Análise termogravimétrica acoplada à espectroscopia na região do
infravermelho
ΔT Variação de Temperatura
M
L
Metal
Ligante
EDTA Ácido Etilenodiamina Tetra-Ácetico
FUR-Co Complexo Furosemida Cobalto
FUR-Ni Complexo Furosemida Níquel
SUMÁRIO
1 INTRODUÇÃO... 18
2 OBJETIVO... 21
2.1 GERAIS... 21
2.2 ESPECÍFICOS... 21
3 REVISÃO DA LITERATURA... 23
3.1 EDEMA... 23
3.2 DIÚRETICOS... 25
3.3 FUROSEMIDA (FUR)... 27
3.4 COMPOSTOS DE COORDENAÇÃO... 32
3.5 COMPLEXOS METÁLICOS COM A FUROSEMIDA... 32
3.6 CENTROS METÁLICOS... 36
3.6.1 Níquel... 37
3.6.2 Cobalto... 37
3.6.2 Zinco... 38
3.7 PRINCÍPIOS BÁSICOS DAS TÉCNICAS ANALÍTICAS ABORDADAS.... 39
3.7.1 Espectroscopia na Região do Infravermelho (IV)... 39
3.7.2 Análise Térmica... 41
3.7.2.1 Termograviometria (TG)... 41
3.7.2.2 Análise Térmica Diferencia (DTA)... 42
3.7.2.3 Calorimetria Exploratória Diferencial (DSC)... 43
3.7.3 Condutividade Mol... 44
4 PARTE EXPERIMENTAL... 49
4.1 REAGENTES... 49
4.2 MATERIAIS... 51
4.3 SÍNTESE DOS COMPOSTOS DE COORDENAÇÃO... 51
4.3.1 Síntese dos Complexos com os íons metálicos... 51
4.4 ANÁLISE TÉRMICA... 53
4.5 ESPECTROSCOPIA NA REGIÃO DO INFRAVERMELHO MÉDIO... 53
4.6 ANÁLISE ELEMENTAR... 53
4.7 TESTES DE SOLUBILIDADE... 54
4.8 TEORES DE METAIS... 54
4.9 CONDUTIVIDADE MOLAR... 55
5 RESULTADOS E DISCUSSÃO... 57
5.1 CARACTERIZAÇÃO DOS LIGANTES... 57
5.1.1 Análise Elementar... 57
5.1.2 Espectroscopia na região do Infravermelho... 58
5.1.3 Análise Térmica da Furosemida... 59
5.2 CARACTERIZAÇÃO DOS COMPOSTOS DE COORDENAÇÃO... 61
5.2.1 Espectros na Região do infravermelho... 62
5.2.1.1 Complexos com Cobalto (FUR-Co)... 62
5.2.1.2 Complexos com Níquel (FUR-Ni)... 63
5.2.1.3 Complexos com Zinco (FUR-Zn)... 65
5.3.1 Análises térmica do [Co(FUR)(H2O)2Cl2]2H20... 66
5.3.2 Análises térmica do [Ni(FUR)(H2O)2Cl2]2H20... 69
5.3.3 Análises térmica do [Zn(FUR)Cl2]2H20... 71
5.4 SOLUBILIDADE DOS COMPLEXOS... 73
5.5 RESULTADOS DA ANÁLISE ELEMENTAR... 73
5.6 TEORES DE METAIS DOS COMPLEXOS... 74
5.7 CONDUTIVIDADE DOS COMPLEXOS... 75
5.8 ESTRUTURA DOS COMPLEXOS... 75
6 CONCLUSÃO... 79
1. Introdução 18
Leonardo de Sá Costa
1 INTRODUÇÃO
A química é uma ciência que estuda os fenômenos na natureza, podendo estes serem
encontrados em ambientes naturais ou reproduzidos em laboratórios. O desenvolvimento das
diversas áreas da sociedade moderna, se da principalmente pelo aprimoramento e utilização
da química, sendo uma ciência estreitamente ligada à vida.
Nas últimas décadas, esta ciência vem se desenvolvendo cada vez mais com o avanço
tecnológico, o surgimento de novas áreas derivadas das tradicionais química orgânica,
inorgânica e físico-química. As utilizações de técnicas específicas fizeram surgir ramos na
química como: bioquímica, analítica, engenharia química, biológica e a química dos
compostos de coordenação.
A química dos compostos de coordenação ou química dos complexos é uma parte da
química inorgânica que estuda a interação entre centros metálicos com ligantes. Os elementos
metálicos são componentes essenciais para o bom funcionamento do organismo humano,
participando de processos fundamentais para garantir uma boa qualidade de vida. Desde 1965
vem aumentando a investigação da coordenação de metais a fármacos, com o descobrimento
por Rosenberg e colaboradores da capacidade antitumoral do complexo de cisplatina
[PtCl2(NH3)2], amplamente utilizados nos tratamentos de câncer de próstata e ovário
(GUERRA, 2011).
Existe uma vasta utilização de compostos de coordenação, onde os ligantes que fazem
parte da esfera de coordenação interna são fármacos. Segundo o trabalho de Guerra et, al.,
(2011) a coordenação de centros metálicos a fármaco, pode ser uma estratégia para combater
a resistência a bactéria. A furosemida, ligante orgânico escolhido para desenvolver o trabalho
de coordenação com os íons metálicos Ni+2, Co+2, Zn+2, amplamente utilizado no tratamento de edemas, devido a sua alta capacidade diurética.
Os íons metálicos Co+2, Ni+2, Zn+2 foram escolhidos por apresentarem funções essenciais no corpo humano. O cobalto encontra-se presente no organismo na vitamina B12
armazenada no fígado, já o níquel circula no sangue ligado à proteína niqueloplasmina e o
Zinco aparece na composição de várias enzimas, como a anidrase carbônica e peptidase,
participando na síntese de RNA e no desenvolvimento do esqueleto (BRASILEIRO FILHO,
2009).
Com o desenvolvimento deste trabalho, foi possível obter a coordenação e
caracterização dos compostos de coordenação do ligante (FUR), com os cloretos dos metais
1. Introdução 19
Leonardo de Sá Costa
região do infravermelho médio, com a finalidade de obter os modos de vibrações das
moléculas dos complexos e do ligante livre, determinação dos teores de metais, condutividade
molar e solubilidade. Com os resultados das análises térmicas (TG, DSC, DTA), foi possível
conhecer o comportamento térmico dos complexos. A estequiometria dos compostos foi
2. Objetivos 21
2 OBJETIVOS
2.1 GERAL
Sintetizar e caracterizar compostos de coordenação entre a furosemida e os íons
metálicos Ni+2, Co+2, Zn+2. Propor a estequiometria entre os compostos e as suas propriedades como; solubilidade, condutividade molar e estabilidade térmica.
2.2 ESPECÍFICOS
Sintetizar complexos entre os íons metálicos Ni+2, Co+2, Zn+2 e o ácido 4–
cloro-2-(2-furilmetilamino)-5-sulfamoil-benzóicoico (FUR), através da junção das soluções previamente
dissolvidas em metanol.
Verificar a formação dos complexos, utilizando a espectroscopia na região do infravermelho
médio, observando as mudanças nas bandas de absorção no espectro dos complexos,
deslocamentos, aparecimentos ou desaparecimentos de bandas de absorção.
Determinar as estequiometrias dos complexos formados entre os íons metálicos, através dos
resultados da condutividade molar, análise termogravimétrica, dos teores de carbono,
hidrogênio e nitrogênio (análise elementar).
Definir os perfis de decomposição térmica dos complexos, utilizando à análise
termogravimétrica (TG), análise térmica diferencial (DTA) e calorimetria exploratória
diferencial (DSC). Através dos resultados obtidos, observar a estabilidade térmica dos
compostos, as energias envolvidas em cada processo e propor mecanismos de decomposição
3. Revisão da Literatura 23
Leonardo de Sá Costa 3 REVISÃO DA LITERATURA
3.1 EDEMA
Edema (do grego oídema = inchaço, tumefação) é o acúmulo de líquidos nos
espaços teciduais intercelulares ou em cavidades do corpo, estes líquidos podem ser
constituídos de sais, água e proteínas. Na Figura 3.1 é apresentado um caso clássico de
acúmulo de líquidos nas pernas de um paciente. O edema pode ser classificado em
função de sua localização ou da composição. Em relação a sua localização, os
generalizados são os mais graves, causando inchaço de todos os tecidos e órgãos, são
chamados de anasarca. Os que ocorrem nas cavidades recebem o prefixo hidro, seguido
do local do edema, como hidrotórax, hidropericárdio (BRASILEIRO FILHO, 2009;
STANLEY; RAMIZ, 1983). Segundo Stanley (1983), a classificação em relação à
composição do edema pode ser transudato, aqueles que apresentam baixa quantidade de
proteínas, constituídos por um líquido claro e seroso, está ligado a edemas não
inflamatórios, como os causados por insuficiência cardíaca, problemas renais e cirrose
hepática. Os que apresentam grande quantidade de proteínas estão relacionados aos
casos inflamatórios. Estes apresentam um líquido turvo e com densidade maior que
1.020 g/mL, são chamados de edemas Exsudato (STANLEY; RAMIZ, 1983).
Dentre a grande variedade de edemas existentes, Criales et al, (1987), comenta
sobre os edemas pulmonares agudos, que afetam as populações que vivem em alturas
acima de 3.500 metros, fatores como: as condições ambientais, geográficas e orgânicas,
as quais são submetidas, afetam o mecanismo dos edemas. Segundo o autor é necessário
ampliar os estudos em relação às condições geográficas, no tratamento de edemas, pois
o alto índice de casos é considerado um problema de saúde publica.
Segundo Stanley (1983) e Filho (2009) o edema pode ser formado pelos
seguintes mecanismos:
Aumento da pressão hidrostática intravascular;
Diminuição da pressão oncótica do plasma;
Aumento da impermeabilidade capilar, com saída de líquidos e proteínas para o
interstício;
3. Revisão da Literatura 24
Leonardo de Sá Costa Os principais fatores que causam os edemas são a insuficiência cardíaca congestiva,
cirrose hepática, inflamações, parasitas, desnutrição, queimaduras e traumas. Existe uma
série de tratamentos para os casos de edemas, podendo ser encontrados inúmeros tipos
de procedimentos para o tratamento, através de medicamentos ou não. Davini et al,
(2005), em seus estudos demostrou que os tratamentos de edemas e úlceras, feitos
através da estimulação elétrica de alta voltagem com correntes excitomotoras.
Apresentaram resultados satisfatórios no tratamento de edemas, quando comparados a
outros trabalhos. No trabalho de Silva et al, (1989), é demostrado a utilização da técnica
craniotomia no tratamento de edemas cerebrais, feito por meio de uma abertura craniana
no paciente, com a finalidade de combater o edema (SILVA; SOUSA, 1976).
Os tratamentos comumente utilizados para combater os edemas são feitos com
diuréticos, que tem a capacidade de causar a eliminação dos líquidos que se encontram
retidos no paciente.
Figura 3.1 – Imagem de um paciente com acúmulo de água nas pernas causado por edema.
3. Revisão da Literatura 25
Leonardo de Sá Costa 3.2 DIÚRETICOS
São drogas indicadas nos tratamentos de doenças causadas pela retenção de água
e sais. Como nos casos de edemas, insuficiência cardíaca, hipertensão e glaucoma.
Atuam modificando a excreção de íons como Cl-, Na+ e HCO-3 em diferentes partes do néfron, diminuindo a reabsorção de íons nos segmentos tubulares (KOROLKOVAS,
1982; LIEF, 1978; TERESA, 2007; OLIVAS, 2008).
Segundo Korolkovas, (1982) os antigos utilizavam herbáceos contendo óleos
voláteis e cafeína como função diurética, nos quais apresentam uma série de
classificações, podendo ser em relação a sua estrutura química, ação excretora de íons e
mecanismo de ação.
Em função do mecanismo de ação, os diuréticos são classificados como:
inibidores de anidrase carbônica, tiazídicos, poupadores de potássio, osmóticos e
diuréticos de alça (KATZUNG, 2010).
Os diuréticos de alça estão entre os diuréticos mais potentes utilizados no
tratamento de edema, são capazes de provocar a excreção de 15 a 25% do sódio
existente, inibindo o transportador de Na+/K+/2Cl- na membrana lumial no segmento espesso da alça ascendeste de Henle. Na Figura 3.2 é mostrada a representação de um
rim com o corte longitudinal, sendo possível verificar a alça de Henle, onde atua os
3. Revisão da Literatura 26
Leonardo de Sá Costa Figura 3.2 – Representação de um rim, em corte longitudinal e um nefrón desembocando em um ducto
coletor.
Fonte: Cheida, (2003).
Na Figura 3.3 é apresentada a estrutura dos principais diuréticos de alça, que
são: o ácido etacrínico, piretamida, bumetamida e a furosemida que será utilizada como
ligante no referente trabalho.
Figura 3.3 – Representação das estruturas moleculares dos principais diuréticos de alça.
3. Revisão da Literatura 27
Leonardo de Sá Costa 3.3 FUROSEMIDA (FUR)
A furosemida é um fármaco amplamente utilizado como diurético no tratamento
de edemas, conhecida quimicamente como Ácido
5-(aminossulfonil)-4-cloro-2-[(2-furanilmetil)amino]-benzoico, é um pó cristalino, branco, praticamente insolúvel em
água e clorofórmio, solúvel em solventes orgânicos como acetona, dimetilformamida e
metanol. Sua formula estrutural é apresentada na Figura 3.4.
Figura 3.4 - Estrutura molecular da furosemida.
Fonte: Farmacópeia Brasileira
O fármaco é classificado como diurético de alça em virtude do seu grande
potencial inibidor de NaCl, atuando sobre o segmento espesso da alça de Helen,
inibindo o transportador de Na+/K+/2Cl- na membrana lumial, interrompendo o transporte de cloreto de sódio para fora do túbulo e para o interior tecido intersticial
(RANG; DALE; RITTER, 1993). A inibição pelo transportador NKCC2, além de
reduzir a reabsorção de NaCl, diminui o potencial positivo de reciclagem do K+, ocorrendo a elevação da excreção de Ca+2 e Mg+2 devido a falta deste potencial (KATZUNG, 2010).
A droga derivada das sulfonamidas é sintetizada tratando o ácido
2,4-diclorobenzóico (I), com ácido clorossulfônico a 150°C e submetendo o cloreto de
3. Revisão da Literatura 28
Leonardo de Sá Costa obtido, ao reagir com seis equivalentes de furfurilamina a 130°C durante 4 horas, forma
a furosemida, por deslocamento aromático nucleofílico do cloro altamente ativado na
posição 2 (KOROLKOVAS, 1982). Na Figura 3.5 é apresentado o esquema
representativo da reação de obtenção da furosemida.
Figura 3.5 – Etapas da síntese da furosemida (FUR).
Fonte: KOROLKOVAS, (1982)
O medicamento apresenta elevada farmacocinética, quando consumida por via
oral, sendo absorvido pelo trato intestinal, em aproximadamente uma hora. Quando
administrada por injeção intravenosa, sua ação atua no máximo em trinta minutos, com
seu efeito persistindo de duas a três horas. O tempo de meia vida da furosemida é de
cerca de noventa minutos em pacientes normais, prolongando-se nos que apresentam
insuficiência renal. A furosemida é indicada nos tratamentos de edemas pulmonares
agudo, insuficiência cardíaca crônica, síndrome nefrótica, cirrose hepática e doenças
renais crônicas.
As principais reações adversas dos diuréticos estão ligadas a excreção renal dos
íons. No entanto, com o uso prologado é muito comum o surgimento de
3. Revisão da Literatura 29
Leonardo de Sá Costa 3.4 COMPOSTOS DE COORDENAÇÃO
Os primeiros estudos em relação aos compostos de coordenação que se tem
registro se deram antes da teoria proposta por Werner, em 1893, fato que o fez ser
considerado o pai da química de coordenação, pela teoria que explica as ligações e
estruturas dos compostos de coordenação, com este feito conquistou em 1913 o premio
Nobel em química (JAMES, 2005).
Compostos de coordenação ou complexos são átomos metálicos que atuam
como ácidos de Lewis recebendo densidade eletrônica de um conjunto de ligantes, onde
estes agem como uma base de Lewis, doando elétrons para a formação das ligações.
Apesar da falta de instrumentos avançados disponíveis nos dias atuais, Werner com a
sua teoria de coordenação descobriu que os metais apresentam dois tipos possíveis de
ligações, podendo ser direta com o centro metálico ou de forma eletrostáticas. As
ligações eletroestáticas entre os complexos e os ligantes aniônicos são conhecidas como
esfera de coordenação externa. As possíveis ligações diretas com os centros metálicos
formam a esfera de coordenação interna, sendo que as quantidades de ligações entre o
átomo central e os ligantes são chamadas de número de coordenação. Na Figura 3.6 é
demostrado a estrutura do composto [Co(NH3)6]Cl3, através desta é possível verificar
que o cobalto apresenta coordenação com seis grupos NH3 formando a esfera de
coordenação interna, os três átomos de Cl contribuem para a formação da esfera de
coordenação externa (ATKIS,2008;KAUFFMAN,1974).
Figura 3.6 - Representação da estrutura do complexo [Co(NH3)6]Cl3
3. Revisão da Literatura 30
Leonardo de Sá Costa Os ligantes podem ser classificados em função da quantidade de átomos da sua
estrutura, que se encontram ligados ao centro metálico. Os monodentados são ligantes
que apresentam somente um átomo da sua estrutura ligado ao centro metálico, já os
ligantes polidentados podem apresentar dois ou mais átomos de sua estrutura ligada ao
metal (VOGEL, 2002; ATKINS, 2008).
O EDTA é um dos ligantes polidentados mais conhecidos e amplamente
utilizados no ramo da química, pois apresenta grande capacidade de coordenação com
os metais. Na Figura 3.7 são mostrados ligantes que apresentam na sua estrutura, mais
de um átomo capaz de promover ligações com o centro metálico do complexo
(PHERSON, 2010).
Figura 3.7 – Representação das estruturas dos quelantes que apresentam um ou mais sítios de coordenação.
Fonte: LEE, (1999).
Os compostos de coordenação apresentam inúmeras aplicações de análises
químicas à aplicações medicinais. Estudos mostram que a descoberta das propriedades
do complexo cis[Pt(NH3)2Cl2] conhecido por cisplatina, foi considerado um marco na
3. Revisão da Literatura 31
Leonardo de Sá Costa antitumorais dos complexos metálicos. Os primeiros estudos mostraram que a cisplatina
apresentava eficiência nos casos de tumores de testículos e ovários. Nos pacientes
tratados com o complexo, cerca de 80% apresentaram cura. Antes dos tratamentos os
casos de câncer de testículos eram quase sempre fatais. O mecanismo de atuação do
composto cisplatina ocorre através de lesões a nível molecular nas fitas de DNA,
dificultando o funcionamento normal de replicação e transcrição do DNA. A platina
liga-se ao DNA pelo átomo de nitrogênio da guanina ou da adenina, sendo que a ligação
com o átomo de nitrogênio da guanina é mais estável devido uma possível interação do
grupo NH3 da cisplatina com o átomo de oxigênio da estrutura. Na Figura 3.8 é
apresentada a interação da cis[Pt(NH3)2Cl2] com as bases guanina e adenina (FONTES,
CESAR, BERALDO, 2005).
Figura 3.8 – Representação da interação da cis[Pt(NH3)2Cl2] com as bases guanina e adenina.
Fonte: Fontes, (2005).
A capacidade da cisplatina de se ligar ao DNA causando a distorção da estrutura,
pode ser atribuída a sua propriedade antitumoral, ao inibir a capacidade de replicação da
molécula de DNA, o complexo causa a morte das células cancerígenas, bloqueando a
formação de DNA que é essencial para a formação de novas moléculas na divisão
3. Revisão da Literatura 32
Leonardo de Sá Costa Figura 3.9 – Representação da estrutura tridimensional do complexo cis[Pt(NH3)2Cl2], conhecida como
cisplatina.
Fonte: Serviço de toxicologia Facudade de farmacia do Porto, 2008.
3.5 COMPLEXOS METÁLICOS COM A FUROSEMIDA
XIAOLI e colaboradores (2010), relataram em seus estudos um complexo
mononuclear neutro, de fórmula [Pd(FUR)Cl2]. O composto de coordenação da
furosemida com paládio (II), foi obtido em uma solução tampão Britton-Robinson com
pH 5,6. Os autores concluíram que a coordenação da furosemida (FUR), se deu de
forma bidentada ao centro metálico, através do átomo de oxigênio do grupo -COOH e o
nitrogênio do grupo –NH, formando um quelato aniônico. A espécie violeta de etila é
representado na estrutura por EV+. Na Figura 3.10 é mostrada a estrutura molecular
proposta no estudo.
Figura 3.10 – Estrutura do complexo [Pd(FUR)2Cl2] proposto por Cuxia e colaboradores.
3. Revisão da Literatura 33
Leonardo de Sá Costa BONTCHEV et al, (1992) relataram em seus estudos a síntese dos compostos
cuja fórmula estrutural é [Cu(FUR)2.(MeOH)2]. O íon metálico central apresenta uma
geometria bipiramidal tetragonal distorcida e a coordenação ocorre com quatro átomos
de oxigênio, sendo dois da molécula de metanol (MeOH) e dois provenientes da
coordenação do grupo carboxilato do ligante, que se coordena de forma monodentado.
A coordenação da molécula de furosemida, pode ser verificada no espectro de absorção
na região do infravermelho, através do deslocamento da banda na região em 1669 cm-1 atribuída ao grupo -COOH. A estrutura do complexo [Cu(FUR)2.(MeOH)2] é
3. Revisão da Literatura 34
Leonardo de Sá Costa Figura 3.11 – Projeção da estrutura molecular do complexo [Cu(FUR)2.(MeOH)2]. Os íons
cloretos foram omitidos para maior clareza.
Fonte: BONTCHEV et al, (1992).
Na Figura 3.12 é apresentada através da projeção da estrutura do complexo
[Cu(FUR)2.(MeOH)2] a existência de interações de hidrogênio intermoleculares. Os
átomos de oxigênio O(2) e O(3) provenientes do grupo sulfonil de uma das estruturas e
o O(5) do grupo carbonila de outra, contribuem nas interações dos átomos de
hidrogênio. Contudo, vale ressaltar que os grupos imino, amida e hidroxi também
interagem nas ligações intermoleculares com os átomos de hidrogênio. Os autores
concluíram que o excesso de carga negativa do O(5) do grupo carboxilato é distribuída
ao longo de duas ligações de hidrogênios intermoleculares bastante fortes, devido a
3. Revisão da Literatura 35
Leonardo de Sá Costa Figura 3.12 – Projeção da estrutura abaixo do eixo u. As ligações de hidrogênio são representadas por
linhas tracejadas e os átomos de oxigênio indicados pela cor preta.
Fonte: BONTCHEV et al, (1992).
A estrutura do composto é formada por moléculas planas dispostas em pilhas. Os
grupos carboxilatos atuam em forma de pontes com dois oxigênios no plano equatorial
em relação os átomos de cobre (II) e os outros dois em posições apicais. Na Figura 3.13
é apresentada a estrutura de empacotamento das moléculas distribuídas em duas células
3. Revisão da Literatura 36
Leonardo de Sá Costa Figura 3.13 – Empacotamento cristalino das moléculas do complexo CuFUR2.2MeOH.
Fonte: BONTCHEV et al, (1992).
3.6 CENTROS METÁLICOS
Os metais são elementos que podem ser encontrados em abundância na crosta
terrestre, onde suas propriedades químicas e físicas apresentam inúmeras aplicações,
desde a indústria, ao funcionamento hormonal humano. Propriedades como a
condutividade elétrica e térmica, faz com que os metais sejam essências para o
desenvolvimento da sociedade. Nos compostos de coordenação, onde os ligantes são
fármacos é possível verificar modificações nas propriedades dos novos compostos. Para
3. Revisão da Literatura 37
Leonardo de Sá Costa 3.6.1 Níquel
O elemento níquel é um metal duro, resistente, branco prateado e funde-se a
1445°C, este pode ser encontrado na forma de sais solúveis como os cloretos, nitratos e
sulfatos, ou em formas menos solúveis como os óxidos e metais. O níquel encontra-se
no grupo 10 do bloco d na tabela periódica, apresenta configuração eletrônica [Ar] 3d8 4s2, podendo apresentar os estados de oxidação +1 (I), +2 (II), +3 (III), +4 (IV). A maior parte dos complexos é formada pelos íons níquel no estado de oxidação bivalente,
que geralmente são octaédricos ou quadrado planar. A literatura também reporta
complexos com a estrutura de pirâmides de base quadrada, trigonais e tetraédricos.
O níquel é amplamente utilizado, tendo uma vasta aplicação e valor comercial.
A maior parte do níquel é empregada na fabricação de ligas e revestimentos metálicos,
como esferas de rolamento, próteses cardíacas e articuladas. Também fazem parte da
composição de fitas magnéticas, tintas, corantes e plásticos (KRISHAN; BAIJU;
SREEJALESKCHMI, 2011).
No corpo humano o níquel é encontrado em baixas concentrações, sendo
distribuído pelo pâncreas, coração, pulmões, rins e fígado. Atua como cofator em
diferentes reações enzimáticas e como componente de várias metaloenzimas, são
encontrados em diversos alimentos como nozes, chocolates, cereais e alimentos de
origem animal. Apresentam grande poder cancerígeno nas vias respiratórias,
aumentando em cinco vezes o risco de câncer pulmonar e 150 vezes o de câncer na
laringe (MELO; CUAMATZI, 2007; PARI; AMUDHA, 2011).
3.6.2 Cobalto
Cobalto é um elemento químico metálico que está inserido na classe dos metais
de transição, localizado no grupo nove e no 4° período da tabela periódica, possui
configuração [Ar]3d74s2, numero atômico 27 e massa atômica 58,93. Seu nome é derivado do alemão “Kobald” sendo considerado um metal raro. Pode ser encontrado
nos estados de oxidação 1+, 2+, 3+ e 4+ (MELO, V; CUAMATZI, O, 2007).
A Vitamina B12 é uma dos complexos de cobalto essenciais para o
funcionamento do organismo humano, conhecida como cobalamina, é uma molécula
3. Revisão da Literatura 38
Leonardo de Sá Costa metálico, unidos pelos átomos de nitrogênios da molécula de pirrol da corrina. Na
Figura 3.14 é apresentada a estrutura da vitamina B12 (MELO; CUAMATZI, 2007).
Figura 3.14 - Representação estrutural da molécula da vitamina B12.
Fonte: Murray et al.( 2008).
3.6.2 Zinco
É um dos elementos essenciais para o funcionamento do organismo humano,
participam nos metabolismos energéticos, metabólicos, na degradação de proteínas e
transporte celular. Auxiliam no sistema imunológico, atuando como cofator em
inúmeras reações enzimáticas do organismo, agindo nos processos de cicatrização,
percepção do gosto, produção da vitamina A e no desenvolvimento estrutural. A
deficiência do zinco no organismo humano causa a dificuldade nos processos de
cicatrização, crescimento e alteração no desenvolvimento sexual (BAYNES, J. W.;
DOMINICZACK, M. H. 2005; SINZER, F. S.; WHITNEY, E, 2000).
O zinco apresenta configuração [Ar]3d104s2 e seu principal estado de oxidação é o +2. É encontrado na crosta terrestre em elevadas quantidades, comumente na forma de
sulfeto. Suas principais aplicações comercias são nos processos de revestimento de
ferro, fabricação de ligas metálicas, eletrodos de pilhas e nos processos anticorrosivos.
3. Revisão da Literatura 39
Leonardo de Sá Costa N e S. Geralmente os complexos formados pelos íons zinco são incolores, tetraédricos
ou octraédricos.
3.7 PRINCÍPIOS BÁSICOS DAS TÉCNICAS ANALÍTICAS ABORDADAS
3.7.1 Espectroscopia na Região do Infravermelho (IV)
A espectroscopia na região do infravermelho baseia-se na emissão de radiação
eletromagnética, em uma amostra, localizada entre as regiões do visível e micro-ondas.
O espectro do infravermelho pode ser divido em três partes, sendo estas o infravermelho
próximo, referente às regiões harmônicas; o infravermelho médio, onde podem ser
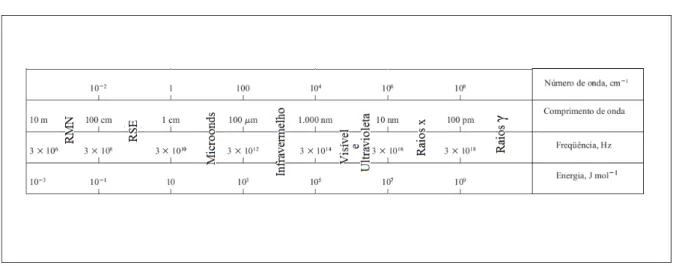
verificadas as rotações e vibrações das moléculas, abrangendo a faixa de 4000 cm-1 a 200 cm-1 e o infravermelho distante, na faixa de 200 cm-1 a 10 cm-1, onde pode ser verificado as rotações moleculares. Na Figura 3.15 são apresentadas as regiões do
espectro eletromagnético.
Figura 3.15 - Faixa de radiação eletromagnética com seus tipos de espectroscopia.
Fonte:Skoog at al., (2009).
O principio das análises na região do infravermelho médio, baseia-se na emissão
de radiação eletromagnética na faixa de 4000 cm-1 a 400 cm-1. A energia emitida é convertida em rotação e vibração, ao entrar em contato com as moléculas do analito. A
radiação do infravermelho não tem energia suficiente para promover transições
3. Revisão da Literatura 40
Leonardo de Sá Costa caracterizando possíveis grupos de átomos, estas informações são fundamentais para
identificar estruturas mais complexas.
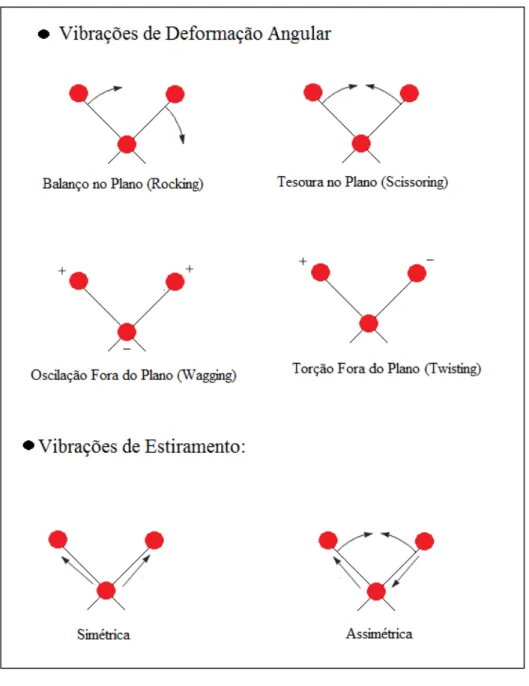
Na Figura 3.16 são apresentadas as vibrações moleculares que dão origem as
bandas de absorção região do infravermelho.
Figura 3.16 – Tipos de vibrações moleculares na região do espectro do infravermelho.
Fonte: Adapatdo de Skoog, (2009).
As vibrações podem ser classificadas em estiramentos simétricos e assimétricos.
Os movimentos que ocorrem ao longo do eixo da ligação, fazem com que a distância
interatômica aumente e diminua de forma alternada. As alterações no ângulo das
3. Revisão da Literatura 41
Leonardo de Sá Costa assimétrica, quando ocorre no plano, à deformação é angular simétrica, e fora do plano
assimétrica.
Os espectrofotômetros utilizados para análises na região do infravermelho
podem ser do tipo dispersivo ou com transformada de Fourier. A diferença entre o
espectrofotômetro dispersivo e o FTIR é o interferômetro de Michelson, que tem a
finalidade de dividir a radiação da fonte, utilizando um espelho prateado posicionado a
45°, gerando dois feixes perpendiculares. Na Figura 3.17 é apresentado o esquema de
um espectrofotômetro FTIR (VOGEL, 2002).
Figura 3.17 – Esquema do interferômetro de Michelson.
Fonte: VOGEL, (2002).
3.7.2 Análise Térmica
As análises térmicas utilizadas no trabalho foram a termogravimetria (TG),
análise térmica diferencial (DTA) e a calorimetria exploratória diferencial (DSC). Nas
próximas secções serão apresentados os princípios básicos das técnicas, tendo em vista
a grande importância que cada uma contribui para a caracterização das substâncias.
3.7.2.1 Termogravimetria (TG)
A termogravimetria é uma técnica na qual a variação de massa de uma
substância é medida em função do aquecimento ou resfriamento da amostra em uma
3. Revisão da Literatura 42
Leonardo de Sá Costa de alta precisão capaz de registrar a variação na massa das amostras em função do
tempo ou temperatura (IONASHIRO, 2005).
Os resultados das curvas termogravimétricas fornecem informações sobre o
comportamento térmico das amostras, como estabilidade térmica, composição,
comportamento cinético, estequiometria e mecanismos de decomposição. Atualmente é
muito comum a utilização de outras técnicas acopladas à termograviometria, para
estudar os mecanismos de decomposição, como a TG-MS e TG-FTIR.
Os fatores que podem alterar as características das curvas termogravimétricas
podem ser instrumentais ou referentes às características das amostras. Os principais
fatores instrumentais são a razão de aquecimento do forno, atmosfera, geometria e o
suporte de amostras. Em relação a razão do aquecimento do forno, MATOS e
colaboradores, relatam em seus estudos, os resultados das curvas TG do
Sm(CH3SO3)3.2(3-picNO), obtidos sob à atmosfera de ar, em diferentes razões de
aquecimento, verificou-se que as mudanças podem deslocar os eventos para
temperaturas maiores ou menores, além de influenciar nos números de etapas do
comportamento térmico das amostras. Os fatores que podem influenciar as curvas
termogravimétricas em relação às características das amostras são as quantidades e
tamanhos das partículas, condutividade térmica da amostra, calor de reação,
solubilidade dos gases liberados e a natureza das amostras (IONASHIRO, 2004;
MATOS et al, 2000).
3.7.2.2 Análise Térmica Diferencial (DTA)
Na análise térmica diferencial à amostra e o material de referência são aquecidos
ou resfriados em condições cuidadosamente controladas de tempo e temperatura. Se a
amostra sofrer uma alteração física, como mudança de estado ou uma reação química,
sua temperatura vai mudar, podendo diminuir ou aumentar, enquanto que a temperatura
do material de referência não sofrerá alteração.
Quando à amostra e a referência são aquecidas ou resfriadas em uma
temperatura controlada constante, as transições de fases ou reações químicas são
observadas por absorção (processos endotérmicos) ou liberação de calor (processos
exotérmicos), gerando as curvas DTA, apresentando o comportamento térmico das
3. Revisão da Literatura 43
Leonardo de Sá Costa Os aparelhos utilizados para as análises DTA variam dependendo de cada
fabricante. Geralmente as análises DTA encontram-se acoplada a outras técnicas como
DSC e TG, obtendo informações importantes para os estudos. Na Figura 3.18 é
apresentado o aparelho de análise térmica diferencial, no qual a amostra e a referência
são colocadas sob uma fonte de aquecimento constante.
Figura 3.18 – Esquema de um analisador térmico diferencial.
Fonte: IONASHIRO, (2004).
As análises DTA tem uma série de aplicações, tendo em vista que através dos
picos de liberação ou absorção de energia é possível obter eventos importantes da
amostra analisada. Em estudos Silva e colaboradores, mostram a eficiência das análises
DTA para caracterizar as propriedades térmicas e físicas de cosméticos nas indústrias
farmacêuticas, que é essencial para caracterizar os compostos (OLIVEIRA, 2011).
3.7.2.3 Calorimetria Exploratória Diferencial (DSC)
A calorimetria exploratória diferencial é uma técnica termoanalítica que mede a
diferença da energia fornecida a uma amostra e a um material de referência, em função
da variação da temperatura controlada.
Durante o processo de aquecimento ou resfriamento, uma amostra pode sofrer
alterações de temperatura, ganhando ou perdendo energia, devido à ocorrência de
3. Revisão da Literatura 44
Leonardo de Sá Costa casos é registrado o fluxo de calor necessário para manter a amostra com mesma
temperatura da referência. Os principais parâmetros analisados são: a cristalinidade,
estabilidade térmica, oxidação e grau de pureza.
As análises de DSC podem ocorrer por compensação de potência ou com fluxo
de calor. Nos equipamentos que as análises são feitas por compensação de potência, a
amostra e a referência são mantidas na mesma temperatura. Na ocorrência de algum
evento com a amostra, a potência tende a restaurar o equilíbrio da temperatura entre a
amostra e a referência. Neste método mede-se a diferença de calor transmitida entre
referência e amostra. Nos DSC com fluxo de calor, a energia é transferida para a
amostra e a referência através de discos de metais, enquanto termopares medem a
variação de temperatura, calor específico e entropia. Este método depende do
comportamento da amostra e do contato entre a amostra e a panela. Na Figura 3.19 é
apresentado o esquema do equipamento para analises DSC.
Figura 3.19 - Esquema do equipamento para análises DSC com fluxo de calor.
Fonte: Cavalheiro et al., (2002).
3.7.3 Condutividade Molar
A condutrometria é uma parte dos métodos analíticos que investiga as
propriedades elétricas das soluções, que não dependem da ocorrência de reações nos
eletrodos. As medidas de condutividade em solventes orgânicos e inorgânicos permitem
investigar o comportamento eletrolítico das soluções contendo complexos, contribuindo
3. Revisão da Literatura 45
Leonardo de Sá Costa Para medir o movimento de íons nas soluções é utilizada a condutância (C).
Quando um potencial é aplicado a uma solução contendo íons, a tendência é que estes se
movimentem para o eletrodo de carga oposta, onde a mobilidade dependerá do solvente.
A condutância é expressa pela seguinte Equação 3.1.
(3.1)
A condutância da amostra quando atravessada pela corrente (ι), diminui o seu
comprimento e aumenta com á área (A) da secção transversal. Sabendo que as
dimensões da célula são fixas A/ pode ser substituído por KC que é a constante de
célula. Através da Equação 3.2 podemos obter a condutividade ) da solução:
(3.2)
Como a condutividade da solução encontra-se estreitamente ligado as
quantidades de íons presentes é mais comum utilizar a condutividade molar ( m).
Representada na equação 3.3.
M
=
(3.3)
Com os ajustes na equação 3.4, foi possível obter a condutividade molar ( M)
expressa em relação às influências sofridas pela condutividade do solvente,
concentração molar da solução (Cm) e pela constante de cela (KC). A Equação 3.4
apresenta a expressão:
M
=
(
-
)
(3.4)
M Condutividade Molar (Ω-1. cm2. mol-1);
Rsolução =Resistência da Solução (Ω);
Rsolvente Resistência do Solvente (Ω);
KC = Constante da Cela (cm-1);
Cm = Concentração Molar da Solução (mol. L-1).
Segundo Geary, com os resultados da condutividade molar dos complexos
obtidos através da equação 3.4 é possível propor o comportamento dos compostos de
3. Revisão da Literatura 46
Leonardo de Sá Costa características como: constante dielétrica, viscosidade, condutividade específica e
capacidade doadora referente aos íons metálicos.
Tabela 3.1 – Tabela obtida por Geary em diversos solventes, para determinar o tipo de eletrólito através da condutividade molar.
Solventes Tipo de Eletrólito
1-1 2-1 3-1 4-1
Nitrometano 75 – 95 150 – 180 220 – 260 290 – 330
Nitrobenzeno 20 - 30 50 – 60 70 – 82 90 – 100
Acetona 100 – 140 160 – 200 270 ? 360?
Acetonitrila 120 – 160 220 – 300 340 – 420 500?
Dimetilformamida 65 – 90 130 – 170 200 – 240 300?
Metanol 80 – 115 160 -220 290 – 350 450?
Etanol 35 - 45 70 – 90 120? 160?
Fonte:GEARY(1971).
3.8.4 Determinação de Metais por Titulações de Complexação
A volumetria de complexação é uma técnica analítica utilizada para a
determinação de metais através da formação de complexos, envolvendo reações de
coordenação entre um centro metálico M e um ligante L estável. Nas titulações por
complexação é possível construir gráficos representados pela concentração do metal em
função da quantidade em volume do agente complexante adicionado. O ponto de
equivalência da reação pode ser verificado através de um ponto de inflexão
característico nas curvas do gráfico (BACCAN, et al, 1979).
Nas análises de metais por titulações de complexação são utilizados ligantes para
se coordenar ao centro metálico, eles podem ser monodentado ou polidentado. O ligante
mais utilizado nas determinações de metais é o ácido etilenodiaminotetracético (EDTA).
A molécula apresenta 6 possíveis sítios de coordenação capazes de atuar como doares
de pares de elétrons, sendo 4 átomos de oxigênio provenientes dos grupos carboxílicos
3. Revisão da Literatura 47
Leonardo de Sá Costa Figura 3.20 – Estrutura do EDTA com seus possíveis sítios de coordenação.
4. Procedimento Experimental 49
Leonardo de Sá Costa 4 PROCEDIMENTO EXPERIMENTAL
Neste capítulo serão mostrados os materiais, reagentes e todos os procedimentos
adotados para a síntese e caracterização dos compostos de coordenação do ligante FUR,
com os íons metálicos Co+2, Ni+2 e Zn+2.
4.1 REAGENTES
Para estudos do comportamento do ligante utilizado na síntese, foram feitos análises
termogravimétrica (TG), calorimetria exploratória diferencial (DSC), análise térmica
diferencial (DTA), análise elementar de carbono, hidrogênio, oxigênio (CHN) e
espectroscopia no infravermelho (FTIR). Com análise dos resultados obtidos, não foi
necessário fazer nenhum tratamento prévio para o ligante, tendo em vista o alto teor de
pureza na sua composição.
Para a síntese dos compostos foram utilizados de cloretos dos cátions Co+2, Ni+2 e Zn+2. Para o cloreto de zinco e níquel hexahidratado, foi necessário fazer a secagem com o auxílio de uma bomba a vácuo para diminuir os teores de água adsorvida.
Todos os reagentes utilizados na síntese e caracterização dos compostos de
4. Procedimento Experimental 50
Leonardo de Sá Costa Tabela 4.2 - Reagentes utilizados.
Reagente Formula
Molecular
Fabricante Pureza (%)
Cloreto de Níquel
Hexahidratado
P.A
NiCl2. 6H2O Merck 99
Cloreto de
Cobalto
Hexahidratado
P.A
CoCl2. 6H2O Vetec 98
Cloreto de Zinco ZnCl2 Dinâmica 99,8
EDTA C10H14N2O8Na2 Synth 99
Brometo de
Potássio
KBr
Hidróxido de
amônio P.A
NH4OH Isofar 99
Cloreto de
Amônia P.A
NH4Cl
Álcool Metílico
P.A
CH4O Neon 99,9
Éter Metílico P.A C4H10O
Acetonitrila P.A C2H3N Vetec 99,8
Acetona P.A C3H6O Vetec 99,5
Negro de
Eriocromo T
Isofar 98
Carbonato de
Calcio
CaCO3 Merck 99
Furosemida C12H11N2ClO5S IPCA 99,9
Ácido Nítrico HNO3 Proquimios 65
4. Procedimento Experimental 51
Leonardo de Sá Costa 4.2 MATERIAIS
Bastão de vidro Barra magnética
Vidro de relógio Almofariz de ágata
Estufa Maçarico
Papel de filtro (quantitativo) Micro cadinhos de platina
Balão volumétrico Placa Petri
Bureta Agitador magnético
Dessecador Bomba de vácuo
Espátulas Prensador
Proveta
Funil analítico
4.3 SÍNTESES DOS COMPOSTOS DE COORDENAÇÃO
Para obtenção dos compostos de coordenação foi dissolvido o ligante em uma
solução metanoica contendo NaOH, na preparação da solução do metal foi
dissolvido uma certa quantidade previamente calculada do sal em metanol, em
seguida adicionava-se na solução do ligante, esta mistura era agitada para obtenção
dos complexos.
4.3.1 Síntese dos Complexos Com os Íons Metálicos
Para a síntese dos complexos de FUR com os íons metálicos (Ni+2, Co+2, Ni+2), foram utilizados 0,04 g de NaOH, dissolvidos em 20 mL de metanol resultando em uma
solução incolor. Foram pesados aproximadamente 1mmol de massa do ligante FUR
(0,330 g) e transferido para o Becker, onde se encontrava a solução de NaOH. A
solução foi homogeneizada com o auxílio de um agitador magnético durante 20
minutos. Na preparação da solução do metal, pesou-se massa suficiente para preparar
uma solução com concentração de 1mmol, dissolvidos em 20 mL de metanol. À solução
4. Procedimento Experimental 52
Leonardo de Sá Costa permanecendo durante 4 horas sob agitação para a sua homogeneização. Após este
período a solução foi transferida para uma placa Petri, ficando durante cinco dias em
repouso na temperatura ambiente. No final deste procedimento observou-se um
composto sólido, que foi triturado com o auxilio de um almofariz de ágata,
posteriormente lavado com 25 mL de éter metílico e transferido para um dessecador.
4. Procedimento Experimental 53
Leonardo de Sá Costa 4.4 ANÁLISE TÉRMICA
As análises TG, DTA e DSC foram feitas de forma simultânea em uma única
corrida. O equipamento utilizado foi o analisador térmico simultâneo SDT Q600 da
marca TA Instruments. Para cada análise foram utilizados cerca de 5mg de amostra em
uma cadinho de platina com capacidade de 5 litros. As amostras foram aquecidas da
temperatura ambiente até 1000°C, com razão de aquecimento de 20°C/mim. Todas as
análises foram feitas em atmosfera oxidante com vazão de 50mL/mim. O aparelho
encontrava-se devidamente calibrado. Para manipulação dos resultados foi utilizado o
software TA Universal Analysis.
4.5 ESPECTROSCOPIA NA REGIÃO DO INFRAVERMELHO MÉDIO
Para as análises de infravermelho foram utilizadas pastilhas de KBr
(previamente seco na estufa durante 1 hora na temperatura de 105°C para a eliminação
de umidade), adicionou-se 1% da amostra em um almofariz contendo o KBr triturado.
Após homogeneização, parte desta mistura foi utilizada para a preparação das pastilhas
com o auxílio de uma prensa. Os espectros foram obtidos na região do infravermelho
médio na faixa de 4000cm-1 a 400cm-1, com o aparelho Fourier Transform Infrared Spectrophotometer IR Affinity-1 da marca Shimadzu.
4.6 ANÁLISES ELEMENTARES
As análises elementares foram realizadas utilizando um microanalisador
elementar CHN, da marca Perkin Elmer, modelo 2400, série 2, capaz de obter as
quantidades em percentual de carbono, hidrogênio e nitrogênio. Com precisão de
4. Procedimento Experimental 54
Leonardo de Sá Costa 4.7 TESTES DE SOLUBILIDADE
Para a solubilidade relativa dos compostos, foram feitos teste qualitativos em
diversos solventes, com os compostos de coordenação sintetizados. Adicionou-se em
um tudo de ensaio 5 mL do solvente e uma pequena quantidade de amostra. No final do
processo de agitação, pode-se observar a solubilidade dos compostos.
4.8 TEORES DE METAIS
Os teores de metais foram determinados pela técnica de complexometria por
EDTA. Para preparar a solução dos metais foram pesados com o auxilio da
termobalança, as massas 4,8543, 4,9927 e 4,1087 mg, para os complexos dos íons Co+2, Ni+2 e Zn+2 respectivamente. A massa foi dissolvida em um Becker e transferida para um balão volumétrico de 50 mL, completando com água deionizada.
Para a determinação dos metais Ni+2 e Co+2 foi utilizada a técnica de retrotitulação com cloreto de zinco. À coordenação entre o metal e o indicador geram
uma estabilidade na ligação provocando alterações no ponto de viragem, quando
titulados com EDTA. Para evitar um possível erro experimental na determinação do
metal é adicionado excesso de EDTA na solução a ser analisada. O EDTA que não
reagiu é titulado com o cloreto de zinco. Para estes metais foram retiradas uma alíquota
de 5 mL da solução e transferida para um Erlenmyer onde foram acrescentados 5 mL
de EDTA 0,0110 Mol/L, o indicador negro de eriocromo T e 5 gotas de tampão
amoníaco pH = 10, apresentando uma solução de coloração azul. O excesso de EDTA
que não se coordenou com os metais foi titulada com ZnCl2 0,009 M, até a solução
passar de azul para violeta. Com os resultados dos volumes foi possível obter a
concentração dos metais.
Para a determinação dos íons Zn+2, adicionou-se em um Erlenmyer 5 mL da solução, o indicador negro de Eriocromo T e 5 gotas de tampão amoníaco pH=10,
obtendo uma coloração azul. A solução obtida foi titulada de forma direta com EDTA
4. Procedimento Experimental 55
Leonardo de Sá Costa 4.9 CONDUTIVIDADE MOLAR
As medidas de condutividade molar dos compostos de coordenação foram
obtidas em acetolitrila na temperatura ambiente, utilizando um condutivímetro da marca
Tecnopon, modelo mCA-150. Para preparar a solução pesou-se massa necessária para
5. Resultado e Discussão 57
Leonardo de Sá Costa 5 RESULTADO E DISCUSSÃO
Neste capítulo serão mostrados os resultados obtidos experimentalmente, através dos
métodos instrumentais citados no capitulo 4, onde serão feitas as discussão dos resultados
obtidos.
5.1 CARACTERIZAÇÃO DO LIGANTE
Para compreender o comportamento do ligante, foram feitas análises dos teores de
carbono, nitrogênio, hidrogênio (CHN), análise termogravimétrica (TG), análise térmica
diferencial (DTA), calorimetria exploratória diferencial (DSC) e espectroscopia na região do
infravermelho.
5.1.1 Análise Elementar
Com os resultados das análises de carbono, hidrogênio e nitrogênio, foi possível
verificar a pureza do ligante comparando com os valores teóricos calculados. Na Tabela 5.3
são apresentados os resultados das análises de CHN.
Tabela 5.3 – Resultados da análise elementar da furosemida Elemento % Calculado % Experimental
Carbono 43,5 43,9
Hidrogênio 3,3 3,2
Nitrogênio 8,4 8,4
Fonte: Autor (2013)
Analisando os resultados dos teores de carbono, nitrogênio e oxigênio (Tabela 5.3),
podemos verificar que os valores obtidos experimentalmente apresentam concordância
quando comparados com os calculados teoricamente. Os resultados obtidos podem ser

![Figura 3.8 – Representação da interação da cis[Pt(NH 3 ) 2 Cl 2 ] com as bases guanina e adenina](https://thumb-eu.123doks.com/thumbv2/123dok_br/15577192.102412/33.892.134.760.505.813/figura-representação-interação-cis-pt-bases-guanina-adenina.webp)
![Figura 3.9 – Representação da estrutura tridimensional do complexo cis[Pt(NH 3 ) 2 Cl 2 ], conhecida como](https://thumb-eu.123doks.com/thumbv2/123dok_br/15577192.102412/34.892.212.683.164.444/figura-representação-estrutura-tridimensional-complexo-cis-conhecida-como.webp)