Atividade anti-leishmania e imunomodulatória in vitro
da melitina natural na infecção experimental por
Leishmania (L.) infantum chagasi
Departamento de Doenças Tropicais e Diagnóstico por Imagem
Programa de Pós-Graduação em Doenças Tropicais
Atividade anti-leishmania e imunomodulatória in vitro
da melitina natural na infecção experimental por
Leishmania (L.) infantum chagasi
Botucatu/SP 2013
Tese apresentada ao Programa de
Pós-Graduação em Doenças Tropicais da
Faculdade de Medicina de Botucatu,
Universidade
Estadual
Paulista
–
UNESP, para a obtenção do título de
Doutor em Doenças Tropicais.
Aluno: Andréia Vieira Pereira
Orientador: Prof. Dr. Benedito Barraviera
Atividade anti-leishmania e imunomodulatória in vitro da melitina natural na infecção experimental por Leishmania (L.) infantum chagasi / Andréia Vieira Pereira. - Botucatu, 2013
Tese (doutorado) - Universidade Estadual Paulista, Faculdade de Medicina de Botucatu
Orientador: Benedito Barraviera
Coorientador: Rui Seabra Ferreira Junior Capes: 40101096
1. Antiparasitários. 2. Agentes anti-inflamatórios. 3. Leishmania. 4. Citocinas.
DEDICATÓRIA
Ao Deus todo poderoso, pela força e saúde que sempre me proporcionou nesta caminhada e em toda minha vida, pelos momentos felizes durante esses
anos e também pelos não tão bons, que me fizeram crescer.
A minha filha Andressa Vieira, meu presente de Deus, por todo amor, compreensão e força para superar a distância que nos separa.
A minha mãe e irmãs, pelo carinho e incentivo em todas as etapas desta busca pelo conhecimento.
Este espaço que reservo para lembrar tantas pessoas que fazem parte da minha História, talvez seja o melhor momento de toda minha tese, pois faço uma retrospectiva de minha vida e descubro quantas oportunidades tive de conhecer pessoas, de viver momentos, de superar dificuldades.
À minha mãe Maria Nazareth Vieira por ser simplesmente o que é: força, determinação, coragem e amor;
Às minhas queridas irmãs Maria do Socorro Vieira e Jozinete Vieira por serem tão batalhadoras e acreditarem em mim, por estarem sempre do meu lado me apoiando e me encorajando nessa caminhada e, sobretudo pelos ensinamentos de profissão tão importantes para minha formação acadêmica e profissional, que de maneira nobre e sábia estendem a todos que as cercam;
Ao meu orientador Prof. Dr. Benedito Barraviera, agradecimentos são poucos para demonstrar a sua importância em minha vida;
Ao Prof. Dr. Rui Seabra Ferreira Junior pela contribuição na minha formação profissional;
À Profa. Dra. Sueli Aparecida Calvi pela grande colaboração, apoio, confiança, amizade, respeito ao meu trabalho;
obrigado por partilhar seus conhecimentos e disponibilidade;
Ao Prof. Dr. Daniel Pimenta por sua generosidade em me ajudar nas etapas iniciais desta pesquisa, pelos valiosos esclarecimentos e correções.
À Profa. Dra. Ângela Maria Victoriano de Campos Soares pela contribuição para o desenvolvimento desse estudo.
Ao Prof. Dr. André Gustavo Tempone pela atenção, colaboração e disposição em ensinar;
À Erika Gracielle pela imensa dedicação em aprender e ajudar, além de sua amizade e alegria contagiante;
Às amigas Vivian Scalon, Aline Ropeli, Patrícia Rocha, Letícia Pontes, Isabel Paiva, Priscila Silvestre, Priscila Zacarias, Francilene Capel, Eliana Peresi, Cristiane Melissa, Patrícia Orsi, Daniela Fossato e aos amigos Gustavo Adolfo, James Venturini e Helan Balderramas que sempre me deram força, principalmente nos momentos difíceis, e que com certeza levarei no meu coração por toda minha vida;
Em especial a Ebivaldo Gonçalves pela convivência e principalmente pelas boas risadas;
A todos aqueles que de alguma maneira me ajudaram e não estou citando individualmente.
O valor das
coisas não está no tempo que elas duram,
mas na intensidade com que acontecem. Por isso
existem momentos inesquecíveis, coisas inexplicáveis e
pessoas incomparáveis
Figura 2. Resposta imune celular na Leishmaniose. 15 Figura 3. Estrutura primária da melitina de Apis mellifera constituída por
26 resíduos de aminoácidos. 18
Figura 4. Perfil cromatográfico do veneno bruto obtido por cromatografia
liquida de fase reversa. 30
Figura 5. Espectro de massa da melitina obtido por ESI em tensão de
pulverização de 1,8 kV, mostrando íons [M +H]. 31
Figura 6. Efeito do veneno total de Apis mellifera, melitina e droga
padrão sobre parasitas de L. (L.) infantum chagasi.
32 Figura 7. Efeito da melitina isolada e do veneno total de Apis mellifera
sobre macrófagos peritoniais de camundongos BALB/c. 33
Figura 8. Efeito da melitina isolada e do veneno total de Apis mellifera
sobre macrófagos peritoniais de camundongos BALB/c infectados com a forma amastigota de L. (L.) infantum chagasi
34 Figura 9. Efeito da melitina em diferentes concentrações sobre
macrófagos peritoniais de camundongos BALB/c infectados com a forma amastigota de L. (L.) infantum chagasi.
36 Figura 10. Produção de IL-12 em sobrenadante de cultura de macrófagos
desafiados ou não com o parasita, tratados e ou não com
melitina. 37
Figura 11. Produção de IFN- em sobrenadante de células totais desafiados ou não com o parasita, tratados ou não com
melitina. 39
Figura 12. Produção de TNF-α em sobrenadante de cultura de
macrófagos desafiados ou não com o parasita, tratados ou
não com melitina. 41
Figura 13. Produção de IL-10 em sobrenadante de cultura de macrófagos desafiados ou não com o parasita, tratados ou não com
melitina. 43
Figura 14. Produção de TGF- em sobrenadante de cultura de macrófagos ou não com o parasita, tratadas ou não com
melitina. 44
Figura 15. Produção de NO em sobrenadante de cultura de macrófagos desafiados ou não com o parasita, tratadas e não-tratadas
com melitina. 46
Figura 16. Produção de H2O2 em sobrenadante de cultura de macrófagos
desafiados ou não com o parasita, tratadas e não-tratadas
com melitina. 48
Figura 17. Esquematização do mecanismo modulador da melitina sobre
macrófagos infectados com o parasita L. (L.) infantum chagasi 59
Figura 18. Quadro resumo do mecanismo modulador da melitina sobre
FMVZ– Faculdade de Medicina Veterinária e Zootecnia
ELISA– Enzyme Linked Immunossorbent Assay
SFM – Sistema Mononuclear Fagocitário LV– Leishmaniose Visceral
LVC– Leishmaniose Visceral Canina
LVH– Leishmaniose Visceral Humana
NNN– Neal, Novy, Nicolle
LIT – Liver Infusion Tryptose
OMS– Organização Mundial de Saúde
FC – Fragmento cristalizável
PBS– Solução tampão de fosfato
IL-12– Interleucina 12
IL-10 – Interleucina 10
IFN- – Interferon gama
Th1 – Linfócitos T auxiliares tipo 1
Th2 – Linfócitos T auxiliares tipo 2
TNF α– Fator de Necrose Tumoral alfa
WHO – World Human Organization
NADPH oxidase – Nicotinamida-adenina-dinucleótido-fosfato-oxidase
PLA2– Fosfolipase A2
LPS– Lipopolissacarídeo
T[SH]2– Tripanotiona
TryR– Enzima tripanotiona redutase
NF-k
ᵝ
– Fator nuclear kappa betaDO– Densidade óptica
SFB – Soro bovino fetal
SDS – Dodecil sulfato de sódio
CE50 – Concentração efetiva
NEED – N-(1Naphthyl) ethyl-enediamine
H2O2 – Peróxido de hidrogênio
RESUMO ABSTRACT
1 – INTRODUÇÃO 13
2 – OBJETIVOS 20
3 – MATERIAL E MÉTODOS 21
4 – RESULTADOS 30
5 – DISCUSSÃO 49
6 – CONCLUSÕES 61
7 – REFERÊNCIAS 63
experimental por Leishmania (L.) infantum chagasi, bem como seu efeito sobre a produção de citocinas pró e antinflamatórias e metabólitos do oxigênio e do nitrogênio. O fracionamento do veneno foi realizado por meio de cromatografia líquida de alta eficiência (HPLC-RP) usando-se colunas C8 e C18. As frações foram identificadas por sequenciamento peptídico pela química degradativa de Edman e espectrometria de massas do tipo eletrospray. A determinação da atividade anti-leishmania, contra formas promastigotas foi realizada de forma seriada partindo-se de uma concentração inicial de melitina de 100 µg/mL observando-se o valor de CE50 de 28,29 µg/mL. Foi realizado estudo de
citotoxicidade em macrófagos peritoniais isolados de camundongos BALB/c, obtendo-se um valor de CE50 de 5,73 µg/mL. A viabilidade celular de ambos os
ensaios foi avaliada por meio do estudo da atividade oxidativa mitocondrial (MTT). Os estudos em formas amastigotas intracelulares demostraram um valor de CE50 de 1,47 µg/mL. Quanto a produção de citocinas por celulas
desafiadas com o parasita e tratados com a melitina observou-se que houve tendência de aumento para as citocinas inflamatórias IL12 e TNF-α nas concentrações utilizadas e nos respectivos períodos de tempo. A melitina não interferiu na produção de IFN- e TGF- , porém observamos diminuição significativa nos níveis de IL-10, fato semelhante observado na produção de H2O2 e NO. Conclui-se que a melitina demonstrou eficácia in vitro contra a
espécie Leishmania (L.) infantum chagasi, podendo ter atuado de forma direta contra o parasita intracelular e/ou por meio da modulação da resposta imune levando a ativação de macrófagos, em que estes produziram outras substâncias que não NO e H2O2, proporcionando uma redução da carga
parasitária dentro do macrófago, sem causar danos à célula. Estes resultados encorajam a realização de novos estudos por sugerir que a melitina seja uma possível molécula candidata ao tratamento da Leishmania spp.
extracted and purified from the venom of Apis mellifera over an in vitro infection with Leishmania (L.) infantum chagasi, well as their effects on the production of proinflammatory and anti-inflammatory, and metabolites of oxygen and nitrogen. The fractionation of the venom was accomplished by high-performance liquid chromatography system (RP-HPLC) using C18 and C8 columns. These fractions were determined by peptide sequence using a combination of Edman degradation sequence analysis and electrospray ionization (ESI) mass spectrometry. The ascertainment of anti-leishmania activity against promastigote forms was conducted in a seriate form, beginning with an initial melittin concentration of 100µg/mL, noting an EC50 value of 28.29 µg/mL.
Cytotoxicity study was conducted in isolated peritoneal macrophages from BALB/c mice, obtaining an EC50 value of 5.73µg/mL. The cell viability of both
trials was assessed by means of the study of mitochondrial oxidative activity (MTT). The studies demonstrated an EC50 value of 1.47µg/mL on intracellular
amastigotes. As the cytokines production by cells challenged with parasite and treated with melittin, was observed that there was an increased tendency for inflammatory cytokines IL-12 and TNF-α at used concentrations and in the respective periods of time analyzed. The melittin did not interfered in the IFN- and TGF- production, however were observed a significant decrease in the IL-10 levels, which was similarly observed in the H2O2 and NO production. It is
concluded that melittin has shown in vitro efficacy against Leishmania (L.) infantum chagasi and may have a directly behavior against the intracellular parasite and/or by the immune response modulation, leading to an macrophages activation, and after, a production of other substances than NO and H2O2, providing a reduction in parasite load within the macrophage, without
damaging the cell. These results aid further studies, by the suggestion that melittin is a possible candidate molecule for the treatment of Leishmania spp.
1 INTRODUÇÃO
A relevância epidemiológica das leishmanioses como doenças negligenciadas aumentou significativamente nos últimos anos. Como decorrência está havendo maior interesse e relacionamento entre os profissionais da saúde que atuam na área1. Além disso, despertou-se grande preocupação quanto à carência de tratamentos eficientes para seres humanos e praticamente inexistentes para os animais. Por outro lado, a prospecção de novos fármacos exige estudos prévios tanto por meio de ensaios in vitro como in vivo. No tocante às leishmanioses, as ações das principais moléculas candidatas estão sendo investigadas tanto nos mecanismos diretos no parasita, quanto na inibição de vias metabólicas vitais e específicas2. O interesse pelo estudo da ação imunomodulatória entre o parasita, a droga candidata e o hospedeiro também está na ordem do dia dos pesquisadores do mundo todo.
1.1 Leishmanioses
São zoonoses transmitidas por dípteros da família Psychodidae, seu agente etiológico um protozoário dimórfico da família Trypanosomatidae, gênero
Leishmania3,4. A importância das leishmanioses reside não somente na sua elevada incidência e ampla distribuição geográfica, mas principalmente pela sua capacidade de assumir formas graves e letais5.
No homem ocorrem sinais específicos que variam desde longos períodos febris até a caquexia em seu estágio final. Em cães as manifestações clínicas da leishmaniose visceral são variáveis, desde a presença, a gravidade ou ausência de sintomas6.
Estima-se que cerca de 350 milhões de pessoas estejam expostas ao risco de contrair a doença e aproximadamente dois milhões de novos casos ao ano são registrados dentre as diferentes formas clínicas7. No Brasil, a distribuição da leishmaniose visceral canina (LVC) apresenta-se em franco crescimento8.
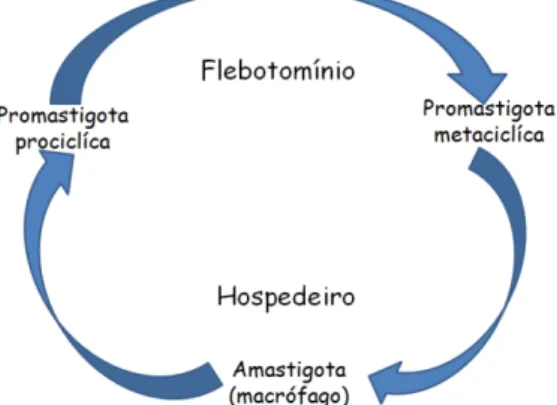
Transmitidos por meio do repasto sanguíneo de flebotomínios, estes protozoários são organismos unicelulares que apresentam um ciclo de vida heteroxênico, apresentando-se sob duas formas evolutivas básicas: a promastigota que está presente no vetor, e a amastigota que é forma intracelular obrigatória no hospedeiro vertebrado10,11 (Figura 1).
Figura 1. Ciclo evolutivo das espécies de Leishmania spp. FONTE: Adaptado de
Descoteaux e Turco12.
As formas promastigotas metacíclicas inoculadas na derme do hospedeiro mamífero são internalizadas por células fagocíticas residentes. Dentro do fagolisossomo se transformam em amastigotas que se multiplicam por divisão binária, rompendo a célula hospedeira e infectando outras células fagocíticas13. As
formas amastigotas disseminam-se por meio dos sistemas linfático e vascular e, ocasionalmente se infiltram na medula óssea, fígado e baço 14.
1.2 Imunopatologia e resposta imune na leishmaniose visceral
Durante o processo de diferenciação do parasita em formas promastigotas não infectantes para as formas promastigotas metacíclicos infectantes, ocorre uma série de modificações bioquímicas, tornando estes capazes de evadir do sistema de defesa do hospedeiro vertebrado, produzindo uma infecção persistente15. No entanto, pode ocorrer opsonização dos metacíclicos com os receptores C3b ou C3bi promovendo ativação das células fagocitárias pela ligação com receptores do complemento. Isto facilita a ligação do parasita com os receptores CR1 e CR3, respectivamente, e sua adesão ao macrófago hospedeiro16,17. Uma vez dentro do
de estratégias para controlar a infecção parasitária. Uma delas é a produção do estresse oxidativo por macrófagos após a fagocitose, em que neste processo são produzidos importantes oxidantes como radicais do oxigênio e do nitrogênio, que atuam no controle da infecção por meio da interação com os fosfolipideos de membrana do patógeno 18.
Após a fagocitose da forma promastigota, os monócitos e células dendríticas liberam a IL-12, que estimula os linfócitos T CD4+ a secretarem o
IFN-precocemente. Em combinação com esta citocina, a IL-12 induz a diferenciação e proliferação de células Th1, as quais produzirão mais IFN- . Macrófagos infectados secretam TNF-α, que age em sinergismo com o IFN- para ativar ou induzir a atividade antiparasitária desta célula, por meio da produção dos reativos intermediários do oxigênio 18-20 (Figura 3).
Figura 2. Resposta imune celular na Leishmaniose. Adaptado de Hernández-Ruiz (2006).
1.3 Terapia anti-leishmaniose e investigação de novos fármacos
Para o tratamento de quadros clínicos de Leishmania visceral, são usados antimoniais pentavalentes, (PVAs), cuja ação curativa foi descoberta pelo brasileiro Gaspar Vianna em 191223. Destacam-se o glucantime e o pentostan que são
administrados por via parenteral além da pentamidina e anfoterincina B. Essas drogas vêm sendo utilizadas há mais de seis décadas e apresentam efeitos adversos, tais como: dores articulares, musculares e abdominal, cefaleia, dispinéia, erupção cutânea, edema facial, alterações das funções renal, hepática e pancreática 6, 24.
Considerando a gravidade desses efeitos, outras drogas como a miltefonisa, paromomicina, azóis, sitamaquina e análogos a nucleosídeos vem sendo testadas. Além disso, têm sido desenvolvidos estudos visando encontrar tratamentos alternativos para as leishmanioses humanas. Porém, o uso desses medicamentos não é considerado uma medida recomendada para cães pois não propiciam a cura parasitológica 25,26.
Tendo em vista estes fatos, alvos moleculares vêm sendo estudados para identificação de substâncias capazes de modular as atividades do parasita24. Um
bom alvo de drogas deve ser expresso em um estágio relevante do ciclo de vida do parasita e preencher um ou mais dos seguintes critérios: ser exclusivo do parasita; ser essencial para sua sobrevivência, inibir as vias metabólicas vitais e específicas do parasita; atuar inibindo o metabolismo de folatos, a síntese de poliaminas e tubulinas, a biossíntese de esteróides, do DNA topoisomerases, dos complexos organometálicos e por fim da via do óxido nítrico 2,27,28.
Estudos utilizando produtos naturais têm sido realizados para encontrar uma terapia eficaz contra a leishmaniose, na tentativa de contornar os mecanismos de escape do parasita, bem como minimizar a exposição a drogas potencialmente tóxicas29. Extratos de varias palntas medicinais coletadas nas regiões tropicais da
India, Guiana Francesa, Sudão, Espanha entre outros países, foram eficazes em camundongos infectados com L. amazonensis, assim com a forma amastigota in vitro de L. infantum e L. donovani 29-34.
1.4 Melitina e seus mecanismos de ação
O veneno de abelha Apis mellifera tem sido usado há décadas para aliviar a dor e tratar doenças inflamatórias, incluindo a artrite reumatoide36. Também tem
sido utilizado na experimentação animal 37. O veneno bruto é um conjunto de
moléculas biologicamente ativas tais como melitina, fosfolipase A2 (PLA2),
histamina, hialuronidases, dopamina e noradrenalina 38. Trata-se de excelente
ferramenta de estudo na busca por moléculas candidatas.
A melitina, principal componente tóxico do veneno, é um peptídeo citolítico composto por 26 resíduos de aminoácidos, formada por uma hélice anfipática altamente carregada com um terminal carboxila 39,40. A figura 4 mostra sua estrutura secundária constituída por duas alfa-hélice ligadas por um segmento flexível.
De acordo com Papo & Shai,41 a melitina é uma molécula muito sensível e pode adotar diferentes conformações e estados de agregação dependendo da solução em que está diluída. Assim, em meio aquoso apresenta uma conformação não estruturada e uma forma α-hélice na ligação com membranas lipídicas, em concentrações com baixa carga iônica apresenta-se como um monômero com conformação helicoidal aleatória, e em concentrações salinas apresenta-se como um tetrâmero de estrutura α-hélice 42-44.
Figura 3. Estrutura primária da melitina constituída por 26 resíduos de aminoácidos.
A melitina apresenta um papel importante como surfactante, pois aumenta a permeabilidade de membranas plasmáticas, principalmente de hemácias 45. Tem a capacidade de interagir e extravasar células do tipo leucócitos e mastócitos e nas concentrações micromolares, induz a liberação de histamina 46. Causa também hemólise em diferentes espécies de mamíferos além de possuir atividade antibacteriana, antifúngica, antiviral e antiprotozoário 47.
GIGAVLKVLTTGLPALISWIKRKRQQ-NH2
1 10 2
Além disso, apresenta uma excelente atividade anti-inflamatória, atua inibindo os lipopolissacarídeos (LPS) e ativa o fator nuclear kappa B (NF-kB) impedindo a translocação por meio da interação melitina-proteína 48.
Estudos realizados por Kwon et al,49 confirmam que a melitina também
suprime reações inflamatórias induzidas por lipopolissacarídeo (LPS), assim como, inibe a produção de TNF-α em vários tipos de células. Promove também a inibição da enzima óxido nítrico sintetase induzível (iNOS) e consequentemente a produção de óxido nítrico.
Vários estudos foram realizados avaliando a interação da melitina com as membranas lipídicas. Verificou-se que a ação deste peptideo depende da sua concentração, da solução em que foi diluído, composição lipídica, nível de hidratação e do potencial das membranas 50-58.
De acordo com Batenburg et al,44 e Gonçalves et al,59 a melitina apresenta uma maior afinidade com membranas carregadas negativamente e compostas por fosfolipidios tipo POPC (palmitoil oleoil fosfatidilcolina), ressaltando que nesse processo ocorrem interações hidrófobicas e electrostáticas 51,59. Tais interações formam poros ou canais que atravessam a camada lipídica da membrana.
O processo de formação de poros ocorre da seguinte forma: primeiro o peptideo forma um tapete sobre a membrana, na qual vai se inserindo de forma perpendicular formando complexos com os grupos lipídicos. O peptideo possui carga positiva e no momento da interação com a membrana, que possui carga negativa, ocorre uma repulsão entre seu monômero possibilitando ou causando o dobramento desta e consequentemente formação de poros toroidais 56,60. No
entanto a melitina, pode também formar poros do tipo barril, onde a região hidrofóbica dos peptídeos se alinha com a região lipídica da bicamada e a parte hidrofílica dos peptídeos forma a região interior do poro 56,60.
A membrana das células eucarióticas são compostas por colesterol, que influencia diretamente na atividade da melitina sobre estas células 67. Isto ocorre
porque a melitina é composta de aminoácidos entre eles o triptofano que é responsável pela formação de um complexo estável com o colesterol, potencializando o mecanismo de ação da melitna sobre estas células, porém este aminoácido também inibe a atividade lítica da melitina 60,67. Além disso, ainda pode
causar agregação, fusão de membranas e “budding” 68,69.
No entanto a melitina apresenta outros mecanismos de ação, podendo este ser usado como um coadjuvante auxiliando em outras terapias contra as leishmanioses como relatado por Velasco et al.,70 assim como também pode exercer a sua atividade anti-leishmania por modulação do processo de morte celular semelhante a apoptose ou acidental (necrose) 71.
Tendo em vista a dificuldade de novas alternativas terapêuticas que atuem sobre os sistemas de transdução de sinais envolvidos na viabilidade, proliferação e diferenciação em tripanossomatídeos, os estudos científicos procuram desvendar os diferentes mecanismos de escape dos parasitas à resposta imune do hospedeiro e principalmente a capacidade deste em se manter por longo tempo na célula hospedeira 27.
Desta forma, torna-se necessário também o conhecimento dos mecanismos de ação de novos fármacos, frente à forma intracelular deste parasita, no sentido de contribuir para a utilização racional, traçando novas estratégias terapêuticas para o seu uso no tratamento das Leishmanioses.
2OBJETIVOS 2.1 GERAIS
Avaliar o efeito da melitina natural sobre a atividade anti-leishmania, produção de citocinas pró e antinflamatórias e metabólitos do oxigênio e do nitrogênio na infecção experimental por Leishmania (L.) infantum chagasi.
2.2 ESPECÍFICOS
1- Extrair o veneno de abelhas africanizadas Apis mellifera;
2- Purificar e identificar a melitina por meio de cromatografia líquida de fase reversa (HPLC-RP) e espectrometria de massas (ESI)
3- Determinar a concentração efetiva da melitina (CE50);
4- Determinar in vitro a atividade anti-leishmania contra as formas promastigota e amastigota de Leishmania (L.) infantum chagasi;
5- Avaliar em macrófagos peritoniais de camundongos Balb/c a citotoxicidade do veneno total e da melitina;
6- Determinar os níveis das citocinas IL-12, IFN- , IL-10, TNF- α e TGF- em sobrenadantes de culturas de macrófagos e células totais obtidas de camundongos Balb/c desafiados ou não com o parasita, e tratadas ou não com a melitina, por meio da técnica de Elisa;
7- Determinar a produção de óxido nítrico (NO) e peróxido de oxigênio (H2O2) em
3 MATERIAL E MÉTODOS
Trabalho aprovado pela Comissão de Ética em Experimentação Animal da Faculdade de Medicina de Botucatu – UNESP no dia 28/07/2011 sob protocolo CEEA 8932011.
3.1 Veneno
O veneno foi extraído de abelhas africanizadas Apis mellifera com idade entre 30 e 40 dias, por meio de estimulação elétrica79, duas vezes por semana, no período de Dezembro de 2010 a Junho de 2011. As colméias do apiário localizado no Núcleo de Ensino, Ciência e Tecnologia em Apicultura Racional (NECTAR) da Faculdade de Medicina Veterinária e Zootecnia (FMVZ) localizado na Fazenda Experimental Edgárdia, da UNESP, campus de Botucatu, com as seguintes coordenadas geográficas: ββº49’ de latitude Sul; 48ºβ4’ de longitude Oeste e altitude média de 623m foram gentilmente cedidas pelo professor Dr. Ricardo de Oliveira Orsi para extração de veneno.
3.2 Isolamento e purificação das frações por cromatografia líquida de alta pressão (HPLC)
química degradativa de Edman por meio do em um sequenciador automático de proteínas (marca Shimadzu, modelo PPSQ-23A) para a identificação das moléculas biológicas isoladas.
3.2.1 Espectrometria de massas
As análises de espectrometria de massas foram realizadas realizados no Laboratório Bioquímica e Biofísica – Butatan/ São Paulo, pelo pesquisador Dr. Daniel Carvalho Pimenta. As análises foram realizadas em um espectrômetro de massas de ESI (LCQDuoTM, ThermoFinnigan, EUA), equipado com uma fonte de nanospray e conectado ao sistema de nano HPLC (Ultimate Sistema HPLC, LC Packings, Dionex, EUA). As amostras foram diluídas em ACN a 5% contendo 0,2% de ácido fórmico e foram introduzidas no espectrômetro, a uma taxa de fluxo de 1 mL min-1. A tensão de pulverização foi mantida a 1,8 kV, a tensão capilar a 46 V, a temperatura capilar a 180◦C. Os espectros de massas foram coletados na faixa de 50-2000 m/z. Instrumento de controle, aquisição de dados e processamento de dados foram realizadas com o software Suite Xcalibur.
3.3 Cepas de Leishmania (L.) infantum chagasi
Foram utilizadas formas promastigotas, gentilmente cedidas pela Fundação Oswaldo Cruz – Fiocruz sob numero 579. E mantidas no Laboratório Experimental de Pesquisa de Doenças Tropicais (LEPDT), do Departamento de Doenças Tropicais e Diagnóstico por Imagem da Faculdade de Medicina de Botucatu - UNESP.
Estas formas são mantidas neste laboratório, por passagem a cada 21 dias, em meio bifásico Agar-sangue, Novy- MacNeal- Nicolle- NNN associado ao meio LIT (Liver Infusion Tryptose) suplementado com 10% (v/v) de soro bovino fetal (SFB), 10 mg/mL de gentamicina, incubados em estufa BOD (Biologic Oxygen Demond TE-381) a 25°C, em tensão de 5% de CO2 74,75.
3.4 Avaliação da sensibilidade in vitro da forma promastigota de Leishmania
(L.) infantum chagasi frente ao veneno total e melitina
Antiparasitários, Instituto Adolfo Lutz, São Paulo, SP, sob a coordenação do professor Dr. André Gustavo Tempone.
A sensibilidade in vitro das formas promastigotas de L. (L.) infantum chagasi tratadas com a melitina e com o veneno total de Apis mellifera foi determinada pelo método colorimétrico, por meio do estudo da atividade oxidativa mitocondrial empregando o sal de tetrazólio MTT [3- (4,5- dimetthythiazol-2-yl) – 2,5 diphenyltetiazoliumbromide] na concentração de 5 mg/mL diluído em PBS, filtrado com membrana de metilcelulose de poro 0,22 µM (Millipore)76.
As promastigotas em fase logarítmica tardia de crescimento foram lavadas três vezes em tampão de fosfato (PBS), e a concentração foi ajustada para 106/mL, a partir da contagem em câmara de Newbauer. Após a contagem, a cultura contendo o parasita foi aplicada em microplacas de 96 orifícios com meio LIT suplementado com 10% de SFB.
A melitina e o veneno total foram dissolvidos em PBS, e diluídos de forma seriada a partir da concentração inicial de 100 µg/mL para a melitina e de 300 µg/mL para o veneno total76. A seguir foram adicionadas individualmente às culturas. Para garantir a eficácia do ensaio, foi utilizado a Anfotericina B como controle positivo e o PBS sem fármaco como controle negativo.
As microplacas foram incubadas em estufa BOD (Biologic Oxygen Demond TE-381) a 25°C, e realizadas duas leituras no período de 24 e 48 horas em Microscópio invertido (Nikon- Eclipse- TS100). Posteriormente a última leitura, em capela de fluxo laminar, foi acrescentado 20 µL/orifício de MTT/mL diluído em PBS em cada orifício. A placa foi incubada por um período de 4 horas a 37°C para conversão do sal de tetrazólio em formazan. A reação enzimática foi paralisada e o precipitado de formazam foi solubilizado pela adição de 80 µL de SDS a 10% diluído em água Milli-Q. Em seguida a densidade óptica (DO) foi mensurada em um MS Multiskan (UNISCIENCE) a 550 nm e desta foi subtraído o valor da absorbância do branco.
A porcentagem de inibição para cada concentração das frações do veneno testadas foi determinada pela relação entre a absorbância da cultura tratada com as frações do veneno e a absorbância do controle não tratado. A concentração da melitina que reduziu em 50% a sobrevivência do parasita (CE50) foi determinada
software Prism Pad versão 5.0, e expressa com média ± desvio padrão. Este ensaio foi realizado em triplicata. A diferença de sensibilidade da fração isolada foi determinada pelo teste estatístico Mann-Whitney (GraphPad Prism versão 5.0) para comparação de medianas e nível de significância (P<0,05).
3.5 Obtenção de células totais e macrófagos peritoniais de camundongos Balb/c
Para obtenção de células totais e macrófagos peritoniais de camundongos BALB/c, cinco animais foram submetidos à eutanásia, em câmara de CO2.
Posteriormente, foi injetado RPMI-1640 completo com soro fetal bovino a 10% com vermelho fenol gelado ou meio de cultura de células completo (MCCC), na cavidade abdominal na região intraperitonial, de modo a não atingir nenhum órgão ou vaso sanguíneo, usando uma agulha 25G com o bisel virado para cima. Foi realizada massagem abdominal durante um a dois minutos para facilitar a remoção dos macrófagos peritoniais para esta região. Após a massagem, foi realizada a coleta do líquido com seringas descartáveis de três mL, com agulhas 19G e bisel virado para cima. Para o isolamento das células totais e macrófagos o líquido recolhido da cavidade peritonial dos animais foi centrifugado a 400 g, durante 10 minutos, a 4oC.
Após a centrifugação, foi descartado o sobrenadante e o pellet foi ressuspenso com a adição de MCCC77. As células foram avaliadas quanto a sua integridade em microscópio óptico e aliquotados em placas de 96 orifícios na proporção de (4x105 células/mL). Para obtenção de macrófagos, após duas horas
de incubação as células não aderentes foram retiradas em seguida as células aderentes e células totais foram desafiadas com o veneno total e melitina nas concentrações citadas no item 3.4.
3.6 Avaliação da citotoxicidade em macrófagos peritoniais de camundongos Balb/c
Após a obtenção dos macrófagos peritoniais, estes foram incubados com o veneno total e melitina, que foram diluídas de forma seriada e incubados a 37°C, em tensão de 5% de CO2, por períodos de 24 e 48 horas78.
Após estes períodos foram retirados de cada orifício 200 µL de meio e acrescentado a 200 µL de novo meio de cultura sem vermelho de fenol e na ausência de gentamicina. Após cada período, em capela de fluxo laminar foram acrescidos 20µL/ orifício de MTT/mL diluído em PBS em cada orifício por um período de 4 horas a 37°C para conversão do sal de tetrazólio em formazan. A reação enzimática foi paralisada e o precipitado de formazam foi solubilizado pela adição de 80 µL de SDS a 10% diluído em água Milli-Q. Em seguida a densidade óptica (DO) foi mensurada em um MS Multiskan (UNISCIENCE) a 550 nme desta foi subtraído o valor da absorbância do branco.
A concentração das frações do veneno que reduziu em 50% a sobrevivência das células (CE50) foi determinada por meio de análise de regressão
não-linear (curva dose-resposta), utilizando o software Prism Pad versão 5.0, e expressa com média ± desvio padrão. Este ensaio foi realizado em triplicata. A diferença de sensibilidade às frações isoladas foi determinada pelo teste estatístico Mann-Whitney (GraphPad Prism versão 5.0) para comparação de medianas e nível de significância (P <0,05).
3.7 Avaliação da sensibilidade in vitro de formas amastigotas de Leishmania
(L.) infantum chagasi frente à melitina
A avaliação da sensibilidade in vitro da forma amastigota frente à melitina foi realizada no Laboratório de Toxinologia Aplicada a Fármacos Antiparasitários, Instituto Adolfo Lutz, São Paulo, SP, sob a coordenação do professor Dr. André Gustavo Tempone.
A forma amastigota de L (L) infantum chagasi, foi gentilmente cedida pelo professor Dr. André Gustavo Tempone. Esta cepa é mantida no Laboratório de Toxinologia Aplicada a Fármacos Antiparasitários, Instituto Adolfo Lutz em São Paulo, em hamsters sírio dourado (Mesocricetus auratus).
As amastigotas de L. (L) infantum chagasi isoladas do baço de hamster foram submetidas à análise de susceptibilidade à melitina in vitro utilizando ensaios de infecção em macrófagos.
Para tanto, após a eutanásia desses animais, o baço foi retirado de forma cirúrgica, e em seguida, foi feito imprints do baço, fixados em metanol por 5 minutos, e coradas pelo método panótico rápido (Bioclin, Brasil), pesquisando-se a presença de formas amastigotas por exame microscópio direto (Nikon E-200).
Confirmado a infecção, o baço foi pesado e macerado com 5 mL de PBS, centrifugado a 100g por 5 minutos, após este processo o sobrenadante foi recolhido e transferido para outro tubo Falcon. Em seguida o sobrenadante foi centrifugado novamente a 1200g por 10 minutos e o pellet resultante dessa centrifugação foi ressuspenso em 5 mL de PBS estéril, que foi reservado até a realização da infecção em estufa a 37°C em tensão de 5% de CO2 por um período
de 24 horas.
As células peritoniais foram obtidas de camundongos BALB/c, conforme o item 3.5, e a concentração celular foi ajustada para 8×104 células/mL, em seguida, a suspensão celular foi aliquotada nesta proporção em placas de microcultura de 16 orifícios Nunc (Lab-Tek® Chamber Slide™ System, USA), e incubadas em estufa a 37°C em tensão de 5% de CO2 por um período de 24 horas.
Os macrófagos foram incubados com as formas amastigotas de L. (L) infantum chagasi na razão de 1:10 (macrófagos: amastigotas) diluída em RPMI-164076. A cultura foi mantida em estufa a 37°C em tensão de 5% de CO
2 por um
período de 24 horas76.
Após esse período, os parasitas extracelulares foram removidos da cultura por lavagem das células com MCCC em seguida, foi acrescentada a melitina diluída em PBS, a partir da concentração determinada no ensaio de citotoxicidade, descrita no item 3.6.
Culturas tratadas com o Glucantime® (SbV) foram utilizadas como controle positivo e culturas com PBS como controle negativo. A placa foi incubada em estufa a 37°C em tensão de 5% de CO2 por um período de 24 a 120 horas76. Os
minutos, consecutivamente. Em seguida a placa foi lavada com água e removido o plástico e silicone que é colado na lâmina, para posterior leitura em microscópio ótico. A carga parasitaria foi verificada pelo número de macrófagos infectados em 200 células78.
3.8 Determinação da produção de citocinas IFN- , IL-12, IL-10, TGF- e
TNF-α
As células peritoniais foram coletadas de camundongos Balb/c sadios, conforme o item 3.5. Centrifugadas a 400g por 10 minutos a 4°C e quantificadas em câmara de Newbauer. Posteriormente, alíquotas de 8 x 104 células/ mL de meio de cultura RPMI-1640 sem soro fetal bovino, foram distribuídas em triplicatas em placa de microcultivo com 96 orifícios (LabTech, Melbourn, Inglaterra). As células foram incubadas em novo MCCC por 24 horas em estufa a 37°C, em tensão de 5% de CO2. Após este período as células totais e macrófagos foram infectados com as
formas promastigotas de L. (L) infantum chagasi na razão de 1:10 (macrófagos: promastigotas)diluída em RPMI-1640, por um período de 24 horas76. Em seguida, foi acrescentada a melitina diluída em PBS, a partir das concentrações determinadas no ensaio de citotoxicidade, em que T1 ( 2,5 µg/mL); T2 (1,47 µg/mL); T3 (0,7 µg/mL). Os sobrenadantes foram recolhidos nos períodos de 24, 48 e 72 horas, mantidos a -80°C, em que escolhemos o tempo de 72 horas como período máximo para avaliação dos níveis de citocinas, pois a produção destas pelas células é reduzida ou mesmo perdida em períodos maiores. Posteriormente foi realizado a dosagem das citocinas IFN- , IL-12, IL-10, TGF- e TNF-α, utilizando-se o kit Quantikine® HS, R&D Systems, conforme as instruções do fabricante.
3.9 Determinação da produção de óxido nítrico (NO)
A avaliação das concentrações do óxido nítrico foi realizada pela medida de nitritos (NO2) e nitratos (NO3-)79. A dosagem de nitrito foi feita por meio da reação
de Griess80,81.
mesmo volume do reagente de Griess, que contém NEED 0,1% (m/v) (N-(1Naphthyl) ethyl-enediamine – Sigma Co. USA) diluído em água destilada e sulfanilamida a 1% (v/v) (Sigma Co. USA), diluída em ácido fosfórico (H3PO4) a 5%
(v/v). Os dois reagentes foram misturados em volumes iguais no momento da reação e as amostras foram lidas em leitor automático de ELISA, com filtro de 540 nm, comparado a um branco constituído por reagente de Griess.
Todas as medições foram realizadas em triplicata, e os resultados foram expressos em micromoles de NO/8x104 células, a partir de curva padrão
estabelecida em cada ensaio, constituída com concentrações molares conhecidas de NO2- variando de 200 a 0,39 M.
3.10 Determinação da produção de água oxigenada (H2O2)
A produção de H2O2 foi determinada segundo o método descrito por Pick e
Keisari,82 e adaptado por Pick e Mizel83.
Após os períodos de incubação com os diferentes tratamentos descritos no item 3.7, os sobrenadantes das microculturas foram retirados e aos macrófagos aderidos nos orifícios da placa foram acrescentados 100L de solução tampão (vermelho fenol contendo: 140 mM de NaCl;10 mM de tampão fosfato pH 7; 5,5 mM de dextrose; 0,56 mM de vermelho fenol; 0,01 mg/mL de peroxidade de raiz forte tipo II - Sigma Chemical Co, ST Louis, MO,USA), contendo 10% de soro autólogo fresco. Após 4 horas, a reação foi interrompida pela adição de 0,01 mL de NaOH 1N. A absorbância foi determinada em leitor automático de ELISA, com filtro de 620 nm, contra um branco constituído de solução vermelho fenol e NaOH a 1N. Todas as medições foram realizadas em triplicado, e os resultados da dosagem de H2O2 foram expressos em nanomoles de H2O2 /8x104 células, a partir de
curva-padrão estabelecida em cada ensaio, constituída de concentrações molares conhecidas de H2O2 em tampão vermelho fenol. Em nossas condições
3.11 ANÁLISE ESTATÍSTICA
4 RESULTADOS
4.1 Isolamento e purificação das frações por cromatografia líquida de alta pressão (HPLC)
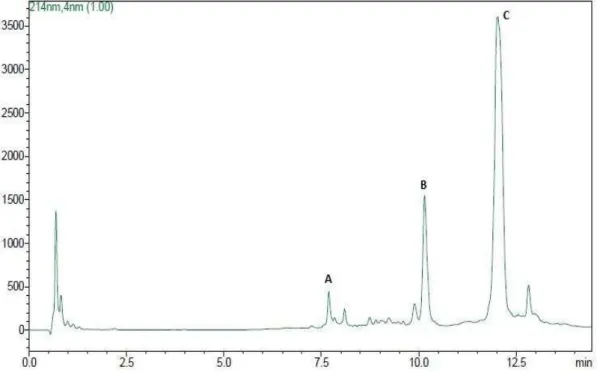
O isolamento da fração melitina extraídas do veneno bruto foi realizado por meio da cromatografia liquida de fase reversa. Vinte picos foram detectados e submetidos ao sequenciamento peptídico N-terminal para auxiliar na localização das frações de interesse.
A figura 4 representa o perfil cromatográfico do veneno bruto identificando-se as frações apamina (A), fosfolipaidentificando-se A2 (B) e melitina (C), respectivamente
Figura 4. Perfil cromatográfico do veneno bruto obtido por cromatografia liquida de fase reversa. Picos: A (apamina); B (fosfolipase A2) e C (melitina).
A massa molecular e a pureza da fração foi analisada por espectrometria de massas ESI, onde para a melitina foi evidenciada pelo íon [M+3H]3+ (950,30);
Figura 5. Espectro de massas da melitina obtido por ESI em tensão de pulverização de 1,8 kV mostrando íons [M +H].
4.2 Efeito da melitina na sobrevida da forma promastigota de Leishmania (L.) infantum chagasi
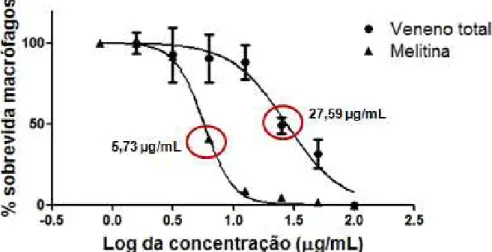
A curva de crescimento das culturas de promastigotas de Leishmania (L.) infantum chagasi desafiadas com o veneno total, melitina e anfotericina B está representada na figura 6. Observou-se que a melitina é tóxica para formas promastigotas de Leishmania apresentando uma CE50 28,29 µg/mL (intervalo de
confiança 95% = 23,97- 33,39 μg/mL) nos tempos de exposição de 24 e 48 horas. O veneno total apresentou valor de CE50 87 µg/mL (intervalo de confiança 95% =
76,91- 99,22 μg/mL) sendo que a diferença entre ambos os tratamentos foi significativa (p< 0,05). A anfotericina B apresentou valor de CE50 0,089 µg/mL
Figura 6. Efeito do veneno total, melitina e anfotericina B sobre parasitas de L. (L.)
infantum chagasi.
4.3 Efeito da melitina sobre a citotoxicidade em macrófagos
Para a determinação da citotoxicidade da melitina sobre macrófagos, estas células foram expostas a diferentes concentrações nos tempos de 24 e 48 horas, em que a viabilidade celular foi avaliada por meio de ensaio colorimétrico MTT. O resultado obtido está representado na figura 7.
Para o período de 48 horas de exposição pode-se observar que houve citotoxicidade, o qual não diferiu estatisticamente do período de 24 horas, onde a melitina apresentou uma CE50 5,73 µg/mL (intervalo de confiança 95% = 5,08 –
6,44 μg/mL) sem afetar os macrofagos, sendo considerada esta mais tóxica que o veneno total (Figura 7). No entanto o veneno total apresentou valor de CE50 27,59
Figura 7. Efeito da melitina isolada e do veneno total de Apis mellifera sobre macrófagos
peritoniais de camundongos BALB/c.
4.4 Efeito da melitina sobre a sensibilidade in vitro de formas amastigotas de Leishmania(L.) infantum chagasi
Para avaliar a ação da melitina sobre a atividade anti- leishmania de macrófagos peritoniais de camundongos BALB/c contra a Leishmania (L.) infantum chagasi, inicialmente foi necessário a realização de ensaios para se definir a relação macrófagos/ amastigota, períodos de infecção, concentração de melitina em μg/mL, para uso na atividade leishmania, tempo ideal para a ação anti-leishmania da melitina e as concentrações em μg/mL, respeitando os limites de citotoxicidade da melitina, segundo os resultados dos ensaios de MTT.
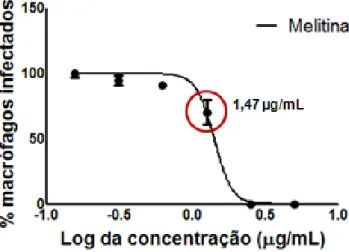
Em macrófagos infectados, a melitina na concentração de 1,47 µg/mL no período de 120 horas é capaz de reduzir significativamente a taxa de infecção, em comparação ao controle (p < 0,05) (Figura 8).
Figura 8. Efeito da melitina isolada e do veneno total de Apis mellifera sobre macrófagos
peritoniais de camundongos BALB/c infectados com a forma amastigota de L. (L.)
Microscópio biológico trinocular Nikon E 200 (100x)
Figura 9. Efeito da melitina em diferentes concentraçõessobre macrófagos peritoniais de
camundongos BALB/c infectados com a forma amastigota de L. (L.) infantum chagasi. A e
B: Tratamento com dose de 2,5 µg/mL (T1); C e D: Tratamento com dose de 1,47 µg/mL (T2); E: Tratamento com dose de 0,7 µg/mL (T3); F: Tratamento como glucantime; G:
Controle PBS.
Observou-se claramente uma redução do número de amastigotas intracelulares, bem como a visualização de membrana dos macrófagos, vacuolização e núcleo definido, no tratamento com a dose de 1,47 µg/mL (Figura 9). Este efeito foi ligeiramente inferior ao observado em culturas tratadas com o glucantime quanto ao crescimento dos parasitas intracelulares.
Apresentando efeito significativo na concentração de 1,47 µg/mL, quando comparado com o controle negativo (PBS) células infectadas não tratadas, em que encontramos um percentual de infecção das células de 98%.
4.5 Efeito da melitina sobre a produção de citocinas inflamatórias (IL-12, IFN- e TNF- α)
Nas culturas de macrófagos desafiados com a forma promastigota de L. (L.) infantum chagasi, que se tornaram amastigotas intracelulares (infecção), observou-se menores níveis de IL-12, em relação às culturas de macrófagos observou-sem tratamento (Figura 10 A).
As culturas de macrófagos desafiados com a forma promastigota de L. (L.) infantum chagasi, observou-se menores níveis de IL-12, em relação às culturas submetidas aos tratamentos com a melitina (Figura 11 C). Verificou-se uma tendência de aumento tanto com a dose de 1,47 µg/mL (T2) no período de 72 horas quanto para a dose 0,7 µg/mL (T3) nos três períodos de tempo avaliados em relação ao controle (Figura 10 C). Esta tendência não foi considerada significativa.
Figura 10. Produção de IL-12 em sobrenadante de cultura de macrófagos desafiados ou
não com o parasita, tratadas e ou não com melitina. As médias referem-se a três experimentos independentes. Figura A: controles = Cultura de macrófagos sem tratamento; Infecção = culturas de macrófagos infectados com promastigotas sem tratamento com a melitina. Os resultados são apresentados como média ± desvio padrão da média. Onde: Tr = Tratamento; Tr 1 ( 2,5 µg/mL); Tr 2 (1,47 µg/mL); Tr 3 (0,7 µg/mL).
Análise estatística: Teste de Tukey
Figura A - A controle (24, 48 e 72 hr) > A infecção (24, 48 e 72 hr) = p<0,05
Nas culturas de células totais desafiadas com a forma promastigota de L. (L.) infantum chagasi (infecção), que se tornaram amastigotas intracelulares, observou-se maior nível de IFN- no período de 72 horas, em relação às culturas de células totais sem tratamento em todos os períodos (Figura 11 A).
Em relação à produção do IFN- os resultados mostram que nas culturas de células totais tratadas apenas com a melitina nas doses e nos períodos testados foi observado uma tendência de aumento na produção desta citocina no período de 48 horas, em relação às culturas não tratadas (Figura 11 B).
Figura 11. Produção de IFN- em sobrenadante de cultura de células totais desafiados ou não com o parasita, tratadas ou não com melitina. As médias referem-se a três experimentos independentes. Figura A: controles = Cultura de macrófagos sem tratamento; Infecção = culturas de macrófagos infectados com promastigotas sem tratamento com a melitina. Os resultados são apresentados como média ± desvio padrão da média. Onde: Tr = Tratamento; Tr 1 ( 2,5 µg/mL); Tr 2 (1,47 µg/mL); Tr 3 (0,7 µg/mL).
Análise estatística: Teste de Tukey
Figura A - A controle 72 hr < A infecção 72 hr = p<0,05
As culturas de macrófagos sem tratamento em todos os períodos produziram maiores níveis de TNF-α, diferindo significativamente do período de 72 horas em relação à cultura de macrófagos desafiados com a forma promastigota de L. (L.) infantum chagasi (infecção) (Figura 12 A).
submetidas ao tratamento na dose de 2,5 µg/mL, em relação às culturas não tratadas com a melitina (Figura 12 B).
Figura 12.Produção de TNF-α em sobrenadante de cultura de células totais desafiados ou não com o parasita, tratadas ou não com melitina. As médias referem-se a três experimentos independentes. Figura A: controles = Cultura de macrófagos sem tratamento; Infecção = culturas de macrófagos infectados com promastigotas sem tratamento com a melitina. Os resultados são apresentados como média ± desvio padrão da média. Onde: Tr = Tratamento; Tr 1 ( 2,5 µg/mL); Tr 2 (1,47 µg/mL); Tr 3 (0,7 µg/mL).
Análise estatística: Teste de Tukey
Figura A – A Controle (24, 48 e 72 hr) > A infecção 72 hr = p<0,05
Figura B–B Controle (24, 48 e 72 hr) < B Tr 1 24hr = p<0,05
Figura C –C Infecção (24, 48 e 72 hr) > C Tr 1 (24 hr, 48 e 72hr) = p<0,05
4.6 Efeito da melitina sobre a produção de citocinas antinflamatórias (IL-10 e TGF- ) por macrófagos
Nas culturas de macrófagos sem tratamento observou-se níveis substanciais de IL-10, não diferindo das culturas de macrófagos desafiados com a forma promastigota de L. (L.) infantum chagasi (infecção) (Figura 13 A).
Após o desafio com a melitina, os macrófagos liberaram níveis significativamente menores de IL-10 em todas as doses nos períodos de 48 e 72 horas. No entanto, observou-se aumento significativo nos níveis de IL-10 liberados por macrófagos em todos os tratamentos nos períodos de 24 horas, quando comparados aos liberados pelas culturas não tratadas, como observado na figura 13 B.
Figura 13. Produção de IL-10 em sobrenadante de cultura de células totais desafiados ou não com o parasita, tratadas ou não com melitina. As médias referem-se a três experimentos independentes. Figura A: controles = Cultura de macrófagos sem tratamento; Infecção = culturas de macrófagos infectados com promastigotas sem tratamento com a melitina. Os resultados são apresentados como média ± desvio padrão da média. Onde: Tr = Tratamento; Tr 1 ( 2,5 µg/mL); Tr 2 (1,47 µg/mL); Tr 3 (0,7 µg/mL).
Análise estatística: Teste de Tukey
Figura B–B Controle (48 e 72 hr) < B Tr 1 48hr e 72hr = p<0,05
Figura B–B Controle (24, 48 e 72 hr) < B Tr 2 24hr = p<0,05
Figura B–B Controle (24, 48 e 72 hr) < B Tr 3 24hr = p<0,05
Figura C –C Infecção (24, 48 e 72 hr) > C Tr 1 (24 hr, 48 e 72hr) = p<0,05
Figura C –C Infecção (24, 48 e 72 hr) > C Tr 2 (24 hr, 48 e 72hr) = p<0,05
Figura C –C Infecção (24, 48 e 72 hr) > C Tr 3 (24 hr, 48 e 72hr) = p<0,05
parasita. Os resultados relativos à produção de TGF- podem ser analisados na figura 14 A; B; C.
Figura 14. Produção de TGF- em sobrenadante de cultura de macrófagos desafiados ou
não com o parasita, tratadas ou não com melitina. As médias referem-se a três experimentos independentes. Figura A: controles = Cultura de macrófagos sem tratamento; Infecção = culturas de macrófagos infectados com promastigotas sem tratamento com a melitina. Os resultados são apresentados como média ± desvio padrão da média. Onde: Tr = Tratamento; Tr 1 ( 2,5 µg/mL); Tr 2 (1,47 µg/mL); Tr 3 (0,7 µg/mL).
4.7 Efeito da melitina sobre a produção de óxido nítrico pelos macrófagos
Nas culturas de macrófagos sem tratamento observou-se níveis menores de NO, diferindo das culturas de macrófagos desafiados com a forma promastigota de
L. (L.) infantum chagasi (infecção) os quais produziram quantidades substanciais deste metabólito (Figura 15 A).
Após o tratamento com a melitina na dose de 1,47 µg/mL, os macrófagos liberaram níveis significativamente menores do metabólito, no período de 48 e 72 horas quando comparados aos liberados pelas culturas não tratadas nos mesmos períodos (Figura 15 B).
Figura 15. Produção de NO em sobrenadante de cultura de células totais desafiados ou não com o parasita, tratadas ou não com melitina. As médias referem-se a três experimentos independentes. Figura A: controles = Cultura de macrófagos sem tratamento; Infecção = culturas de macrófagos infectados com promastigotas sem tratamento com a melitina. Os resultados são apresentados como média ± desvio padrão da média. Onde: Tr = Tratamento; Tr 1 ( 2,5 µg/mL); Tr 2 (1,47 µg/mL); Tr 3 (0,7 µg/mL).
Análise estatística: Teste de Tukey
Figura A– A Controle (24, 48 e 72 hr) < A infecção (24, 48 hr e 72hr) = p<0,05
Figura B–B Controle (48 e 72 hr) > B Tr 2 48 e 72hr = p<0,05
Figura C –C Infecção (24, 48 e 72 hr) > C Tr 1 (24 hr, 48 e 72hr) = p<0,05
Figura C –C Infecção (24, 48 e 72 hr) > C Tr 2 (24 hr, 48 e 72hr) = p<0,05
4.8 Efeito da melitina sobre a produção de água oxigenada (H2O2) por macrófagos
Os resultados referentes à dosagem de H2O2 mostram que, nas culturas de
macrófagos sem tratamento níveis menores de H2O2 foramliberados, diferindo das
culturas de macrófagos desafiados com a forma promastigota de L. (L.) infantum chagasi (infecção) os quais produziram quantidades substanciais deste metabólito (Figura 16 A). No entanto, a produção deste metabólito foi semelhante para as culturas de macrófagos tratadas com a melitina, em relação às culturas não tratadas nos respectivos períodos de tempo analisados em nossa pesquisa (Figura 16 B).
Figura 16. Produção de H2O2 em sobrenadante de cultura de células totais desafiados ou
não com o parasita, tratadas ou não com melitina. As médias referem-se a três experimentos independentes. Figura A: controles = Cultura de macrófagos sem tratamento; Infecção = culturas de macrófagos infectados com promastigotas sem tratamento com a melitina. Os resultados são apresentados como média ± desvio padrão da média. Onde: Tr = Tratamento; Tr 1 ( 2,5 µg/mL); Tr 2 (1,47 µg/mL); Tr 3 (0,7 µg/mL).
Análise estatística: Teste de Tukey
Figura A– A Controle (24, 48 e 72 hr) < A infecção (24, 48 hr e 72hr) =p<0,05
Figura C –C Infecção (24, 48 e 72 hr) > C Tr 1 (24 hr, 48 e 72hr) = p<0,05
Figura C –C Infecção (24, 48 e 72 hr) > C Tr 2 (24 hr, 48 e 72hr) = p<0,05
5 DISCUSSÃO
A melitina é o principal componente tóxico do veneno de Apis melífera. Trata-se de um peptídeo de cadeia longa, contendo 26 resíduos de aminoácidos, apresentando atividade hemolítica e um amplo espectro antimicrobiano, possivelmente devido a sua capacidade de romper membranas celulares40-42, 45, 47.
Neste estudo avaliou-se o efeito da melitina natural sobre a atividade anti-leishmania, produção de citocinas pró e antinflamatórias e metabólitos do oxigênio e do nitrogênio na infecção experimental por Leishmania (L.) infantum chagasi.
Avaliou-se a atividade anti-leishmania da melitina por meio de ensaios de viabilidade celular, utilizando-se uma dose que não fosse tóxica para o macrófago e que reduzisse ou eliminasse o parasita no interior da célula.
Klocek e Seelig,84 relataram que a melitina foi capaz de se ligar rapidamente às membranas celulares em concetração sub-micromolar induzindo por osmose a perda de cátions e ganho de ânions. Este processo provoca um edema celular e com consequente lise devido a ação citotóxica da molécula. Segundo estes autores, a concentração efetiva (CE50) da melitina, determinada por ensaio de
viabilidade celular, frente a células de ovário de hamsters (CHO) e células com deficiência de glicosaminoglicanos (CHO-745) foram de 9 e 15 µg/mL respectivamente. Da mesma forma Maher e McClean,85 investigaram a
citotoxicidade da melitina em células epiteliais do intestino HT29 e Caco-2 encontrando uma CE50 de 3,6 µg/mL e 5,4 µg/mL respectivamente. Apesar de não
evidenciarmos estudos quanto a atividade da melitina nativa em macrófagos, os nossos resultados corroboram os trabalhos descritos anteriormente. Em nossa pesquisa a melitina apresentou valor de CE50 de 5,73µg/mL o que diferiu
estatisticamente do observado nos resultados com o veneno total que apresentou valor de CE50 27,59µg/mL. Estes resultados permitem considerar que a melitina
isolada é mais citotoxica que o veneno total.
oxidação de residuos de aminoácidos que compõe a melitina foram realizados, na tentativa de encapsula-la em lipossomos, sem causar lise 86-88. No entando
observaram degradação da membrana, assim como, vazamento em 50% das vesículas lipossomais. Porém, outro fato importante observado foi 100% de inibição da atividade hemolítica após esta modificação no veneno, assim como redução potencial no mecanismo de ação da melitina 50-56; 86-88.
Esta interação da melitina com membranas vem sendo descritas a várias décadas, como efeito de ancoragem do péptido sobre a superfície da membrana43, 89. Estudos sobre o mecanismo de ação da melitina em superfícies de membranas
biológicas, demonstraram que em baixas concentrações esta forma poros nas membranas, e que o aumento de sua concentração promove a destruição das membranas em micelas mistas43. Mecanismo este, responsável pela atividade hemolítica, anti-tumoral e microbicida da melitina.
A melitina tem mostrado forte atividade inibitória contra parasitas como Leishmanias e Tripanosoma cruzi 90-95. Como em estudos realizados por Diaz-Achirica,91 onde foi avaliada a atividade leishmanicida da melitina contra Leishmania donovani, verificou-se que esta foi toxica para o parasita principalmente nas concentrações que variaram entre 6 e 15 µg/mL. Apesar das concentrações serem consideradas baixas pelo autor, foram observados danos e bolhas na membrana plasmática do parasita. Estes resultados não são condizentes com os dados obtidos em nossa pesquisa, na qual evidenciamos a morte do parasita em uma CE50 de 28,29 µg/mL. O mesmo autor não encontrou resultado significativo
com a forma amastigota. Porém, quando avaliou a melitina sintética contra o parasita intracelular, observou que a atividade desse peptídeo foi 15 vezes maior que o peptídeo natural, apresentando CE50 de 0,9 µg/mL, evidenciando lise nas
células infectadas. Em contrapartida a CE50 para o peptídeo nativo em nosso
estudo foi de 1,47 µg/mL, nesta dose o parasita intracelular foi eliminado, e foi observado que esta não interferiu na viabilidade dos macrófagos.
Pérez-Cordero,94 avaliaram a atividade anti-leishmania da melitina contra as
espécies Leishmania panamensis e Leishmania major. Estes autores utilizaram a melitina sintética, que possui 24 aminoácidos e uma forma hibrida da mesma denominada cecropina A. Observaram que ambas foram citotóxicas apresentando CE50 de 74,01 µg/mL e CE50 de 100 µg/mL respectivamente. Salienta-se que
ambas não apresentaram atividade contra a forma intracelular de Leishmania
major. Os referidos autores observaram que, dependendo do local da cadeia do peptídeo em que foi realizada a acilação do resíduo de lisina, este provocou reações que variaram desde a potencialização da atividade, bem como inativação do seu mecanismo de ação. Este fato também foi reportado para outros microorganismos95-97.
É interessante ressaltar que, nas células eucariotas há predominância de lipídeos neutros (colesterol), que influencia diretamente na atividade da melitina. Este peptídeo possui em sua cadeia um resíduo de aminiácido triptofano que forma um complexo estável com o colesterol. Este promove uma interação eletrostática com a membrana, favorecendo a inserção do peptídeo e causando lise e morte do parasita. Tendo como resultado a formação de poros, com consequente perda de eletrólitos, e por fim a completa dissolução da membrana com extravasamento do conteúdo intracelular 60, 67, 98, 99. Neste sentido, a melitina pode destruir o parasita
por mecanismos diretos sobre a forma promastigota, ou mesmo estar associada ao efeito imunomodulador capaz de induzir a ativação de fagócitos com capacidade de atuar diretamente sobre a forma amastigota, inibindo ou restringindo o processo de reinfecção destas em novas células, após lise.
O efeito de venenos animais sobre o sistema imune tem sido amplamente investigado. Estes tem capacidade de modular a resposta imune inata e adaptativa35,100,101. Neste trabalho objetivamos investigar se a melitina apresenta papel imunomodulador, atuando sobre macrófagos quanto à produção de citocinas e metabólitos do oxigênio e do nitrogênio.
por estar envolvida na ativação de células natural killer e linfócitos T. Ambos processos são fundamentais na produção de IFN- e consequentemente na regulação da resposta imunológica102,103.
De acordo com Puentes e colaboradores,104 durante a fagocitose as
leishmanias se aderem aos macrófagos por meio do receptor CR3 do sistema complemento. Estas induzem a supressão da síntese da IL-12, além de inibir o estresse oxidativo no interior da célula fagocítica. Esta diminuição dos níveis de IL-12 em culturas de macrófagos desafiados com a forma promastigota de L. (L.) infantum chagasi foi observada em nossa pesquisa, corroborando com as observações de Peuentes e colaboradores104. Em contrapartida, houve uma tendência de aumento na produção de IL-12 nas culturas de macrófagos infectados submetidas aos tratamentos com a melitina nas doses de 1,47 µg/mL e 0,7 µg/mL. Esta tendência de aumento na produção da IL-12, quando as culturas de macrófagos infectadas com o parasita foram tratadas com a melitina, possivelmente está envolvida na destruição do parasita intracelular.
Nas leishmanioses o IFN- desempenha um papel essencial no controle do crescimento do parasita e na progressão da doença. Entretanto, em nossos resultados, observamos também que a melitina promoveu uma tendência de aumento na produção de IFN- na dose de 1,47 µg/mL período de 48 horas, em culturas de células totais não parasitadas. Porém, não detectamos produção significativa de IFN- nas culturas desafiadas com o parasita e tratadas com a melitina nas concentrações usadas neste projeto e nos respectivos períodos de tempo.
O TNF-α é uma citocina pró-inflamatória que desempenha papel chave na resposta imune, tanto na defesa contra microrganismos, quanto no processo inflamatório. É uma das citocinas envolvidas na ativação de macrófagos na leishmaniose o qual, juntamente com IFN- , contribui com a atividade antimicrobiana das células105.

![Figura 5. Espectro de massas da melitina obtido por ESI em tensão de pulverização de 1,8 kV mostrando íons [M +H]](https://thumb-eu.123doks.com/thumbv2/123dok_br/15776802.130609/32.892.128.758.148.536/figura-espectro-massas-melitina-obtido-tensão-pulverização-mostrando.webp)