VENENOS NATIVOE IRRADIADO COM COBALTO-60DE SERPENTES Crotalus durissus terrificus, Bothrops jararaca, Bothrops jararacussu E Bothrops moojeni
Dissertação apresentada ao Programa de Pós-Graduação em Doenças Tropicais da Faculdade de Medicina de Botucatu, da Universidade Estadual Paulista – UNESP, para obtenção do Título de Mestre em Doenças Tropicais (Modalidade Biologia Tropical)
Orientador: Prof. Dr. Domingos Alves Meira Co-Orientador: Prof. Dr. Benedito Barraviera
2 Objetivos 8 3 Material e Métodos 9
3.1 Material 9
3.1.1. Animais utilizados nos experimentos 9 3.1.2. Peçonhas utilizadas nos experimentos 9 3.1.3. Reagentes e fonte de irradiação 10
3.3 Métodos 10
3.2.1. Irradiação das peçonhas 10 3.2.2. Atividade tóxica das peçonhas 10 3.2.3. Processo de imunização dos camundongos 11 3.2.4 Titulação dos anticorpos séricos produzidos 11 3.2.5. Neutralização e potência do soro produzido 13 3.2.5.1 Capacidade neutralizante “in vitro” do antiveneno nativo e irradiado 13 3.2.5.2 Potência “in vitro” do antiveneno nativo e irradiado 13 3.2.5.3 Capacidade neutralizante “in vivo” 14 3.2.6. Avaliação clínica dos animais 14 3.2.7. Análise estatística 14
4 Resultados 16
4.1 Método de ensaio imunoenzimático (ELISA) 16 4.1.1 Resultados do método de ELISA para o soro produzido a partir de veneno nativo e irradiado de Crotalus durissus terrificus
16
4.1.2 Resultados do método de ELISA para o soro produzido a partir de veneno nativo e irradiado de Bothrops jararaca
27
4.1.3 Resultados do método de ELISA para o soro produzido a partir de veneno nativo e irradiado de Bothrops jararacussu
38
6. Considerações finais 105
7. Resumo 106
8. Summary 107
9. Referências bibliográficas 108
Trabalho desenvolvido nos Laboratórios do Centro de Estudos de Venenos e Animais Peçonhentos - CEVAP Universidade Estadual Paulista, Campus de Botucatu, São Paulo e no Instituto de Pesquisa Energéticas e Nucleares – IPEN/CNEN
Sonhei que estava andando na praia com o Senhor, E através do Céu, passavam cenas da minha vida.
Para cada cena que passava, percebi pegadas na areia. Uma era minha e a outra do Senhor.
Quando a última cena da minha vida passou diante de nós, Olhei para as pegadas na areia,
Notei que, muitas vezes no caminho da minha vida, Havia apenas um par de pegadas na areia,
Notei também que isso aconteceu Nos momentos mais difíceis da minha vida.
(...) – Senhor, não compreendo... Por que nas horas em que eu mais necessitava Vós me deixastes?
O Senhor respondeu:
Meu filho, Eu te amo e jamais te deixaria Nas horas da tua prova e do teu sofrimento.
À minha esposa, Ana Silvia, amor da minha vida, pelo incentivo durante esta fase e as minhas desculpas pelos atrasos e momentos ausentes.
Aos meus pais, Rui e Maria Emília, pela minha formação, caráter e incansável estímulo durante toda vida.
Aos meus irmãos, Milena e Danilo, pelo amor e confiança depositados em mim.
Ao meu avô, Joaquim Luís Neto (In memorian) por acreditar.
Ao meu sogro, Benedito e minha sogra, Silvia, pelo apoio e auxílio durante este período.
Aos meus cães, Alf (Bigodão), Estrelinha (Vaca), Dolly (Lula) e Kika (Chico Amigo) pelo ouvido amigo nas horas difíceis.
Vencedores nascem antes de qualquer vitória.
Vencedores nascem da motivação, Nascem da dedicação e do esforço.
Vencedores não nascem vencedores.
Vencedores se tornam vencedores, Porque tiveram quem acreditasse neles, Torcesse por eles e lutasse por eles.
É preciso não relaxar nunca, mesmo tendo chegado tão longe.
Dr. Rinaldo Pôncio Mendes, Prof. Dr. Benedito Barraviera, Prof. Dr. Paulo Câmara Marques Pereira e Prof. Dra. Lenice Rosário de Souza, pela enorme contribuição na minha formação.
Ao Prof. Dr. José Carlos Martinez, pelos ensinamentos transmitidos e discussões “estatísticas”.
À amiga Janaína Baptista Alves, pela paciência, participação e confiança.
Ao Prof. Dr. Carlos Alberto Magalhães Lopes, pelo incentivo e conselhos.
Ao Prof. Dr. Sony Dimas Bicudo, pelas sugestões e contribuições.
Ao Prof. Dr. Hélio Langoni, pelas primeiras orientações na minha carreira acadêmica.
Ao Dr. Patrick J. Spencer, pela amizade e prestação.
Aos amigos do CEVAP, Paulo, Marcos, Fernanda e Thomaz pelo total auxílio.
À Fabiana Custódio e André Trombeta, pela disponibilidade constante cooperação diária.
À Heloísa Pardini, pela amizade e inglês sempre perfeito.
Aos amigos Camilo e Guilherme, pelo companheirismo e amizade
Ao amigo Edmílson, pela atenção e dedicação.
Aos amigos Cláudio e Fábio, pela paciência durante este período.
Aos funcionários do CEVAP e do IPEN, pela atenção nos serviços prestados.
Ao Biotério da UNESP, pela prontidão em fornecer os animais utilizados.
Aos funcionários da seção de Pós-Graduação da FMB, pelos auxílios prestados sempre com muita dedicação.
Aos funcionários da Biblioteca do Campus de Botucatu pela elaboração da ficha catalográfica.
proteínas, peptídeos e em pequenas proporções carboidratos, lipídeos, nucleotídeos, aminoácidos e componentes orgânicos. Os principais componentes tóxicos são proteínas e enzimas, as quais estão diretamente relacionadas com a alimentação e defesa da serpente (2).
O tratamento adequado dos indivíduos acidentados por serpentes peçonhentas é um desafio que o homem tenta solucionar há muito tempo.
Assim, antes da descoberta do soro antiofídico, os indivíduos picados eram tratados por curandeiros que os submetiam a simpatias, aplicações de soluções preparadas a partir de um grande número de vegetais e álcool e também pelo uso de pedras porosas cuja função era de retirar o veneno contido na ferida (3).
Trabalhos desenvolvidos por Behring e Kitasato (1894) a partir da soroterapia contra difteria e tétano, mostraram que o soro dos animais “vacinados” contra a peçonha possuía também uma substância antitóxica capaz de neutralizar os efeitos do veneno e de transmitir imunidade passiva a outro animal não imunizado (4).
Ainda em 1894, Calmette, Phisalix e Bertrand, também demonstraram a possibilidade de transferência de resistência de um animal imunizado, para outro não imunizado conferindo proteção passiva às peçonhas (4).
Descoberta e estabelecida a possibilidade de animais serem imunizados contra o veneno ofídico, estava lançada a base da soroterapia aplicada ao tratamento das picadas por serpentes venenosas.
inoculação do veneno, em cobaias e foi observado que os animais morriam no mesmo espaço de tempo que as testemunhas que não haviam recebido qualquer medicação (3). Como o soro havia sido preparado dois anos antes, Vital Brazil teve o cuidado de não tirar conclusões sobre a ineficiência na neutralização dos venenos das serpentes brasileiras.
Em maio de 1899, após nova experiência sem sucesso com o soro de Calmette, Vital Brazil resolveu testar o soro obtido de cães e cabritos, que ele havia imunizado utilizando veneno de jararacas e cascavéis. Observou que o soro destes animais conferia proteção específica para cada um destes venenos e que eles não apresentavam sintomas de envenenamento (5).
Em uma conferência na Escola de “Pharmácia” de São Paulo, Vital Brazil apresentou cientificamente os resultados de seus experimentos, tendo ainda descrito os sintomas provocados por mordeduras das serpentes brasileiras classificando o envenenamento em crotálico e botrópico. Dessa forma o soro específico para o tratamento de cada caso poderia ser escolhido (5).
Na seqüência dos experimentos, Vital Brazil constatou que, misturando os soros anticrotálico e antibotrópico em doses iguais, esta mistura conferia proteção tanto nos acidentes causados por serpentes do gênero Bothrops quanto serpentes do gênero Crotalus. Isto possibilitava o tratamento quando não era conhecida a espécie de serpente causadora do acidente (5).
Outra constatação de Vital Brazil foi a de que, a quantidade de soro a ser utilizada deveria ser proporcional à quantidade de veneno inoculada (3).
No tratamento dos acidentes por picadas de serpentes são utilizados soros heterólogos obtidos a partir do plasma de animais, geralmente eqüídeos e ovinos, hiperimunizados com venenos de serpentes (6).
Os antivenenos preparados a partir de plasmas hiperimunizados de cavalos são considerados como o único tratamento específico para o envenenamento por serpentes no Brasil (7, 8).
Para obtenção de plasmas hiperimunes antibotrópicos e anticrotálicos, os cavalos são inoculados com diversas doses de venenos dessecados que normalmente possuem atividade tóxica elevada. Com relativa freqüência são observadas reações locais e sistêmicas que podem levar, inclusive o animal à morte (13).
Segundo os mesmos autores, as reações locais e sistêmicas observadas nos cavalos foram consistentemente reduzidas ou ausentes, nos animais que receberam os venenos tratados com glutaraldeido quando comparadas com aquelas dos animais imunizados com venenos não tratados.
Por outro lado, o título de anticorpos no soro de todos os animais foi praticamente o mesmo, concluíndo-se, portanto, que o glutaraldeido reduziu a atividade tóxica dos venenos sem alterar a sua imunogenicidade.
A inoculação do veneno bruto fornece títulos elevados; entretanto, o veneno total é freqüentemente mal tolerado pelo animal. Como resultado, toxóides tem sido preparados por destoxicação biológica do veneno a qual preserva sua imunogenicidade (14).
O alto custo, tanto do cavalo como o da sua manutenção, estimula a pesquisa de esquemas de hiperimunização que visam obter títulos elevados de anticorpos específicos nesses animais a partir da imunização (15).
Os venenos podem perder a sua atividade tóxica, conservando, entretanto as suas características antigênicas e imunogênicas, com capacidade de quando introduzido num organismo, induzir a formação de anticorpos. Com a perda da fração tóxica este produto recebe o nome de anaveneno (16)ou toxóide (17).
Em alguns destes estudos, as toxinas obtidas ainda mantiveram certa toxicidade e apresentaram baixa imunogenicidade. Como exemplos podemos citar o estudo de Costa et al. (21), no qual foi comparada a ação imunogênica do veneno de Crotalus durissus terrificus destoxicado pelo tratamento com formaldeido e pela ação térmica, com o veneno nativo. Neste estudo os autores verificaram que o veneno submetido ao tratamento por calor ainda se apresentava tóxico e com baixa imunogenicidade quando comparado ao veneno submetido ao tratamento por formaldeido; e que, embora este último tenha apresentado bons resultados, ao final do esquema de imunização ele não foi tão eficiente quanto o veneno nativo. Entretanto, algumas metodologias mostraram-se bem sucedidas; como exemplos podemos citar os trabalhos de Daniel et al. (22), que obtiveram um toxóide com o tratamento do veneno crotálico pela iodação que se apresentou cerca de 100 vezes menos tóxico que o veneno não tratado e mantendo a imunogenicidade.
Rogero et al. (25), Nascimento et al. (26); Clissa et al. (27), trabalhando com a radiação gama, demonstraram que esta vem sendo bastante eficiente na atenuação de venenos ofídicos, sendo capaz de diminuir a toxicidade, sem alterar a imunogenicidade e sem adicionar nenhuma substância ao veneno.
A radiação gama, produzida por uma fonte de Cobalto-60, é uma radiação eletromagnética de alta energia associada à ausência de massa. Esta possui grande poder de penetração e capacidade de promover ionização e excitação no meio onde se propaga. Dentro do espectro eletromagnético, os raios cósmicos, a radiação gama e os raios X são classificados como radiações ionizantes (28).
(25), entre outros.
No Instituto de Pesquisas Energéticas e Nucleares (IPEN/CNEN-SP), com a crise na produção de soros antiofídicos instalada no país no início da década de 80, iniciaram-se os estudos sobre a radiação ionizante como ferramenta na destoxicação de venenos ofídicos. Entre os estudos realizados nos últimos quinze anos destacam-se os trabalhos de Murata (33); Nascimento (34); Murata et al. (35); Guarnieri (36); Souza-Filho et al. (37); Spencer (38); Andriani (39); Cardi (40); De Paula (41); Rogero et al. (25); Nascimento et al. (26); Clissa et al. (27); Boni-Mitake et al. (42), entre outros.
Todos estes experimentos têm sido avaliados pelas mais modernos técnicas imunobiológicas.
Historicamente, Theakston et al. (43) foram os primeiros pesquisadores a descreverem o uso da técnica imunoenzimática de ELISA para a detecção de veneno de serpentes e de anticorpos antivenenos, baseado no método duplo sanduíche, usando IgG fracionada na fase fixa em placa de microtitulação.
Barbosa et al. (44) consideram que o uso do teste de ELISA para determinar a potência de soros antiofídicos, produzidos em eqüinos, se mostram mais vantajosos em relação ao custo e reprodutibilidade quando comparado aos testes em camundongos.
Barraviera et al. (45) usaram a técnica de ELISA para detecção sensível e específica de níveis de antígenos e anticorpos no soro e líquido cerebroespinhal de pacientes picados por Crotalus durissus terrificus no Brasil.
Heneine et al. (46) relataram uma correlação significante entre a técnica de ELISA e a potência de antiveneno testada in vivo.
humanos provocados por animais peçonhentos (47).
O sistema de produção de antivenenos no Brasil vinha passando por uma crise desde o início dos anos 80s, que culminou em maio de 1986 com o óbito de uma criança, atribuído à “falta de soro”. Esta situação levou o Ministério da Saúde a implantar um Programa Nacional de Ofidismo na antiga Secretaria de Ações Básicas em Saúde. Tal programa é formado por grupos de Trabalho (GTs) composto por técnicos de diversas instituições científicas brasileiras, responsáveis por áreas específicas (47).
A instalação deste programa tornou obrigatória a notificação dos acidentes ofídicos ao Ministério da Saúde a partir de 1986, possibilitando assim estabelecer parâmetros quanto à ocorrência, mortalidade e evolução clínica dos acidentes, uma vez que estes possuem grande importância médica e epidemiológica no Brasil (48, 49).
Entre os quatro gêneros responsáveis por acidentes ofídicos no Brasil, as serpentes do gênero Bothrops causam o maior número de acidentes (88,3%), seguido pelas do gênero Crotalus (8,3%), Lachesis (2,7%) e Micrurus (0,7%) (48). Sendo assim, as serpentes pertencentes ao gênero Bothrops e Crotalus se destacam das demais por causarem o maior numero de acidentes (88%) e o maior índice de letalidade (72% nos casos não tratados com soro e 11% nos casos tratados) respectivamente, representando os envenenamentos ofídicos de maior gravidade em nosso meio.
A ocorrência dos acidentes ofídicos, que pode ser considerado um acidente de trabalho, está geralmente associada ao aumento da atividade do homem no campo. A maioria dos acidentes ocorre na região Sudeste com 43%, seguidos pelas regiões Nordeste (17%), Centro-Oeste (16%), Sul (15%) e Norte (9%) (49, 50).
Os objetivos do presente trabalho foram:
1- Avaliar, acompanhar e comparar a resposta imune humoral de camundongos inoculados com veneno obtido de Crotalus durissus terrificus, Bothrops jararaca, Bothrops jararacussu e Bothrops moojeni
na forma nativa e irradiada com 60Co, utilizando o ensaio imuno enzimático de ELISA;
2- Determinar e comparar a potência e a capacidade de neutralização do soro obtido dos camundongos inoculados com veneno de Crotalus durissus terrificus, B. jararaca, B. jararacussu e B. moojeni na forma nativa e irradiado com 60Co utilizando método “in vitro”;
3- Avaliar a imunidade obtida pelos camundongos inoculados com veneno nativo e irradiado com 60Co mediante desafio “in vivo” com veneno nativo de Crotalus durissus terrificus, B. jararaca, B. jararacussu e B. moojeni, após o processo de hiperimunização;
Foram utilizados camundongos Swiss, com peso entre 18-22 gramas, criados e mantidos no Biotério do Centro de Estudos de Venenos e Animais Peçonhentos, CEVAP-UNESP, no Campus de Botucatu, São Paulo.
Durante a realização dos experimentos, os animais foram mantidos em caixas de polipropileno com oito animais por caixa. Para a forração ou cama nas caixas foi utilizada maravalha de pinho. A alimentação e a água foram disponibilizadas ad libitum.
3.1.2. Peçonhas utilizadas nos experimentos
Foram utilizadas peçonhas obtidas de serpentes adultas das espécies
Crotalus durissus terrificus, Bothrops jararaca, Bothrops jararacussu e Bothrops moojeni mantidas no serpentário do Centro de Estudos de Venenos e Animais Peçonhentos (CEVAP), localizado na UNESP, Campus de Botucatu, São Paulo.
A extração do veneno foi realizada segundo metodologia desenvolvida pela equipe técnica do Laboratório de Extração de Venenos do CEVAP (1). Os venenos foram liofilizados após a extração e mantidos em freezer a -20 ºC.
preparo das soluções foi utilizada água destilada.
A irradiação realizada foi feita por meio de uma fonte de 60Co (Gama Cell 220, Atomic Energy Agency of Canadá), disponível no Departamento de Aplicações de Técnicas Nucleares do IPEN/CNEN-SP.
3.2 Métodos
A metodologia empregada incluiu a irradiação das peçonhas, a atividade tóxica das peçonhas, o processo de imunização dos camundongos, a titulação dos anticorpos, a neutralização e a avaliação da potência do soro, a avaliação clínica dos animais e por fim a análise estatística.
3.2.1. Irradiação das peçonhas
Dos venenos liofilizados retiraram-se alíquotas de 2 mg que foram diluídas com solução salina acidificada (NaCl 150 mM, pH 3,0) alcançando a concentração final de 2mg/ml. A seguir, as amostras foram irradiadas com uma dose de 2000 Gy (taxa de dose 5,25 KGy/h) em uma fonte de 60Co.
A irradiação das amostras ocorreu sempre na presença de oxigênio, na temperatura ambiente e de forma homogênea e ininterrupta (26).
3.2.2. Atividade tóxica das peçonhas
A determinação da toxicidade das amostras nativas foi realizada pelo cálculo da dose letal capaz de matar 50% dos animais do experimento (DL50), segundo
Spearman-Karber (54).
Os valores das DL50 dos venenos nativos utilizados neste experimento foram
previamente realizados pelo Instituto de Pesquisa Energéticas e Nucleares – IPEN/CNEN-SP, e descritos a seguir:
• Crotalus durissus terrificus : 0,148 µg/g de camundongo
• Bothrops jararaca : 2,4 µg/g de camundongo
• Bothrops jararacussu: 4,4 µg/g de camundongo
Os inóculos ocorreram no dia um, utilizando Adjuvante Completo de Freund por via intradérmica; dia 15 utilizando Hidróxido de Alumínio por via subcutânea e nos dias 21, 30, 45 utilizando PBS por via intraperitonial.
3.2.3.2. Bothrops jararaca, Bothrops jararacussu e Bothrops moojeni
Os inóculos ocorreram no dia um, utilizando Adjuvante Completo de Freund por via intradérmica; dia 15 utilizando Adjuvante Incompleto de Freund por via subcutânea e nos dias 21, 30, 45 utilizando PBS por via intraperitonial.
O grupo controle recebeu inóculos nos mesmos dias somente com os adjuvantes.
Todos animais foram inoculados com 200 µl de uma solução contendo 100 µl do excipiente e 100 µl de uma mistura do respectivo veneno diluído em solução salina. O grupo controle recebeu 200 µl de uma solução contendo 100 µl do excipiente e 100 µl de solução salina.
Antes de cada inóculo, os animais foram sangrados pelo plexo retro-orbital, uma amostra de 100 µl de sangue foi retirado, o soro foi separado e feito um “pool” de cada grupo. O soro foi mantido congelado a – 20 oC.
3.2.4 Titulação dos anticorpos séricos contra os venenos inoculados
por meio do Ensaio imuno enzimático (Enzyme linked
immunosorbent assay – ELISA)
A- Reagentes
a) Placas de microtitulação Hemobag de 96 poços
e) Soro IgG de carneiro anti-IgG de camundongo, conjugado com peroxidase (SIGMA®)
f) Orto fenilenodiamina g) Água oxigenada
h) Tampão citrato/fosfato 0,05M pH 5,0 i) Ácido cítrico 0,2M
B- Procedimento
Foram sensibilizadas, por 12 horas a 4 oC em câmara úmida, placas plásticas de 96 poços com 100 µl por poço com uma solução de antígeno a 10
µg/ml (1µg/poço), diluídos em tampão carbonato/bicarbonato de sódio 0,05M e pH 9,6. A placa foi lavada 4 vezes com solução salina 0,15M contendo 0,05% de Tween 20®. Foram aplicados 200µl por poço de solução de bloqueio (5g de Molico® q.s.p. 100ml de PBST) e deixado por 1 hora a 37oC, em câmara úmida.
Foram aplicados, nos poços, 100 µl de soro de camundongos previamente imunizados, diluídos a partir de 1/200 em solução de bloqueio e aplicadas na placa, em duplicata.
Após a incubação por 1 h a 37oC, em câmara úmida, as placas foram lavadas 4 vezes com PBST 0,15M, e iniciou-se a revelação com adição de 100µl de soro de carneiro anti IgG de camundongo conjugado com peroxidase (SIGMA®), diluído 1/2000 da fração aliquotada (Sigma), em solução de bloqueio; aplicou-se 100µl por poço. Após a incubação durante 1 hora a 37OC, em câmara úmida, as placas foram lavadas 4 vezes com PBST 0,15M.
A reação foi revelada pela adição de uma solução de OPD (O-phenylenediamine) 0,5mg/ml e H2O2 (30%) 0,5mg/ml em tampão citrato de
sódio/ácido cítrico (0,05M e pH 5,0); foram aplicadas 100µl por poço e deixadas durante 20 minutos, a temperatura ambiente, no escuro e então foi interrompida com a adição de 50µl (por poço) de ácido cítrico 0,2M.
A leitura de cada poço foi feita em leitor automático de microplaca (DYNATECH MR 4000®), utilizando-se filtro de comprimento de onda de 450nm.
jararacussu e B. moojeni, no 60º dia após a primeira inoculação, uma alíquota contendo 100 µl do “pool” de cada soro foi incubado com 100 µl de uma solução contendo quantidades de veneno nativo diluídos em PBS equivalentes a: 1, 3, 5, 10 e 15 DL50. A incubação foi feita em tubos tipo “eppendorf”
mantidos em estufa a 37 ºC, por um período de trinta minutos (55). Posteriormente, 200 µl de cada solução foram inoculados individualmente em quatro camundongos por via intraperitoneal. Para efeito de controle, foram inoculados em outros quatro camundongos 200 µl de uma solução contendo uma DL50 de veneno diluída em PBS para comprovação da sua toxicidade.
Outros quatro camundongos receberam apenas 100 µl de uma alíquota de soro diluída em 100 µl de PBS para avaliação da sua inocuidade. Após 24 e 48 horas a taxa de mortalidade foi registrada.
3.2.5.2 Avaliação da potência “in vitro” do antiveneno nativo e
irradiado
Para a avaliação da potência dos soros obtidos dos camundongos inoculados com veneno nativo ou com veneno irradiado de serpentes das espécies Crotalus durissus terrificus, Bothrops jararaca, B. jararacussu e B. moojeni, no 60º dia após a primeira inoculação, uma alíquota do “pool” de cada soro foi diluída em PBS nas seguintes concentrações: 1:5, 1:10, 1:20, 1:40, e 1:80. Uma alíquota de soro puro também foi incluída no teste. Uma alíquota de 100 µl de cada solução foi incubada com 100 µl de uma solução contendo cinco DL50 de veneno nativo diluído em PBS. A incubação foi feita em tubos
horas a taxa de mortalidade foi registrada.
A capacidade neutralizante do “pool” dos soros (em µg de toxina/ml de anti-soro) foi calculada conforme KAISER et al. (56), utilizando-se a seguinte equação:
Capacidade neutralizante da toxina (CNT) = (D – DL50) x 1 x 105 X (1/V50)
Sendo D = Dose total da toxina (µg/g); DL50 em µg/g; V50 = Volume
antiveneno que reduz a letalidade de 1 ml da solução de injeção da toxina a 50%. A letalidade de 50% significará que o antiveneno foi capaz de reduzir a dose efetiva para 1 DL50.
3.2.5.3 Avaliação da capacidade neutralizante “in vivo”
Ao final do processo de imunização, a fim de se verificar a capacidade neutralizante ”in vivo” dos anticorpos produzidos pelos animais, quatro camundongos de cada grupo foram pesados e desafiados individualmente com cinco DL50 do veneno nativo respectivo diluído em PBS. Cada animal recebeu
200 µl dessa solução via intraperitoneal. Após 24 e 48 horas a taxa de mortalidade foi registrada.
3.2.6. Avaliação clínica dos animais
Os animais foram observados durante todo o processo de hiperimunização. A presença de alterações locais na pele e/ou subcutâneo como edema, fístulas, abscessos e necroses, e o número de animais que vieram a óbito durante o processo foram relatados. Para isto, foi utilizada uma análise descritiva das observações.
3.2.7. Análise estatística
4.1. Método de Ensaio Imunoenzimático (ELISA)
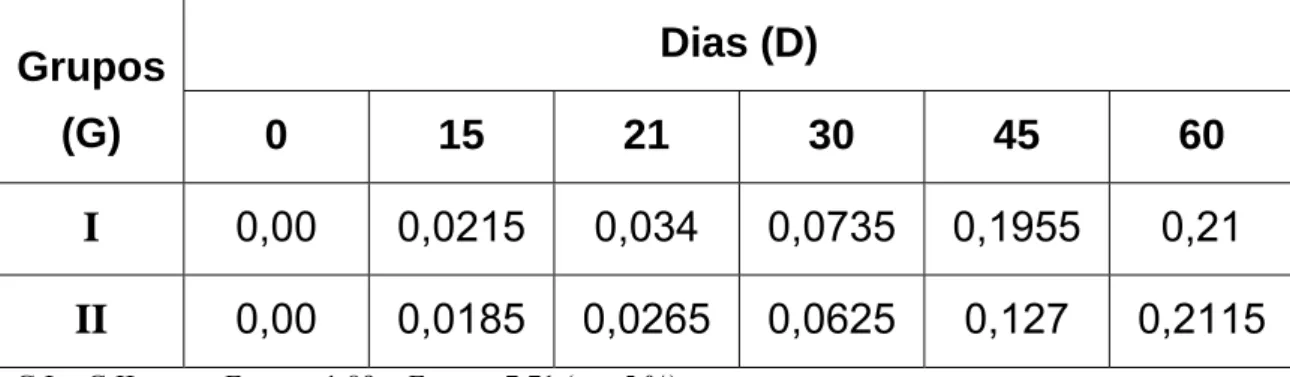
4.1.1 Resultados do método de ELISA para o soro produzido a partir
de veneno nativo e irradiado de Crotalus durissus terrificus
I
0,00 0,0215 0,034 0,0735
0,1955 0,21
II
0,00 0,0185 0,0265 0,0625 0,127 0,2115
G I = G II; como FLinhas = 1,89 < Fcrítico = 7,71 (α = 5 %),
D0 ≠ D15 ≠ D21 ≠ D30 ≠ D45 ≠ D60; como FColunas = 34,16 > Fcrítico = 6,39 (α = 5 %)
Figura 01: Valores médios de densidade óptica (450 nm) obtidos por ensaio
Snedecor, na diluição de 1:200, mostrou que não houve diferença estatística ao nível de 5% de significância (FCalculado = 1,89 < Fcrítico =
7,71);
I
0,00 0,014 0,026 0,0595 0,129 0,167
II
0,00 0,011 0,0215 0,051 0,0895 0,1695
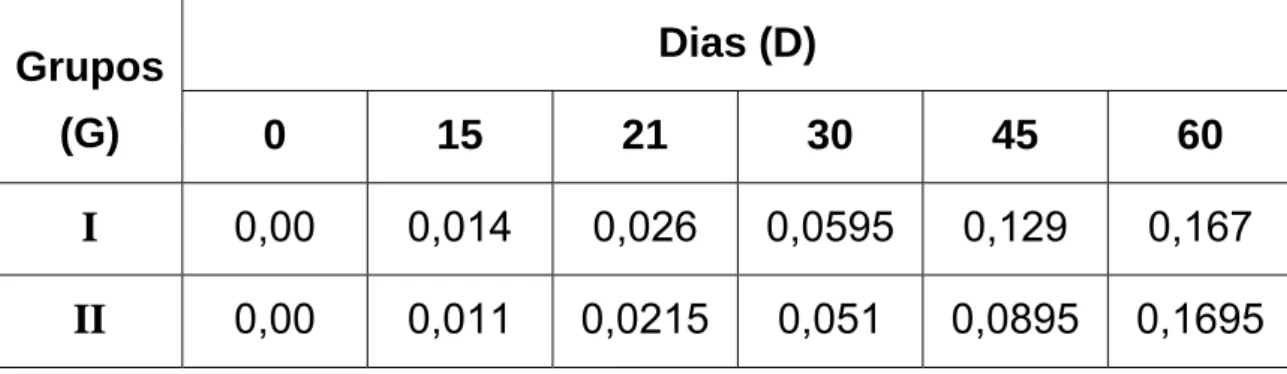
G I = G II; como FLinhas = 2,04 < Fcrítico = 7,71 (α = 5 %).
D0 ≠ D15 ≠ D21 ≠ D30 ≠ D45 ≠ D60; como FColunas = 60,81 > Fcrítico = 6,39 (α = 5 %).
Figura 02: Valores médios de densidade óptica (450 nm) obtidos por ensaio
Snedecor, na diluição de 1:400, mostrou que não houve diferença estatística ao nível de 5% de significância (FCalculado = 2,04 < Fcrítico =
7,71);
I
0,00 0,0031 0,02 0,0425
0,0945 0,134
II
0,00 0,0075
0,0125 0,033 0,073 0,141
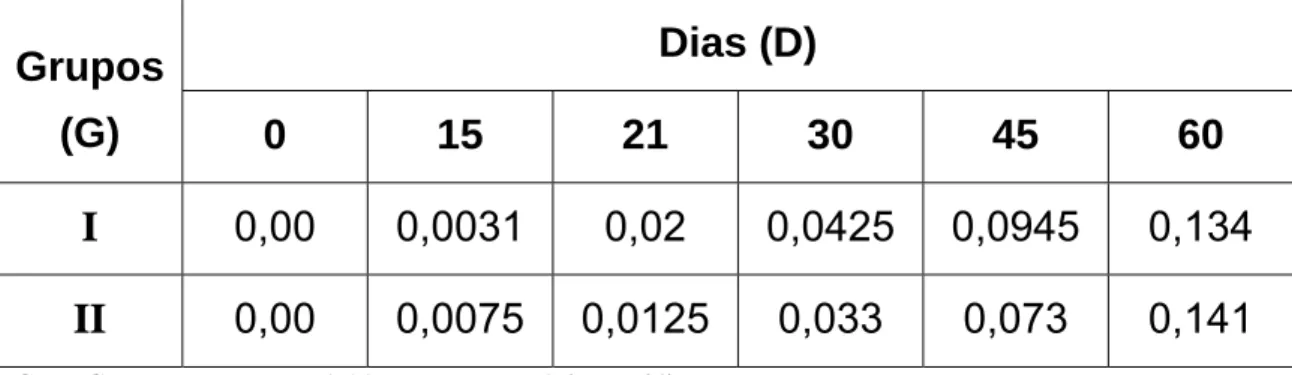
G I = G II; como FLinhas = 1,11 < Fcrítico = 7,71 (α = 5 %).
D0 ≠ D15 ≠ D21 ≠ D30 ≠ D45 ≠ D60; como FColunas = 89,71 > Fcrítico = 6,39 (α = 5 %).
Figura 03: Valores médios de densidade óptica (450 nm) obtidos por ensaio
Snedecor, na diluição de 1:800, mostrou que não houve diferença estatística ao nível de 5% de significância (FCalculado = 1,11 < Fcrítico =
7,71);
I
0,00 0,00 0,014 0,029 0,0685 0,121
II
0,00 0,00 0,004 0,018 0,035 0,1315
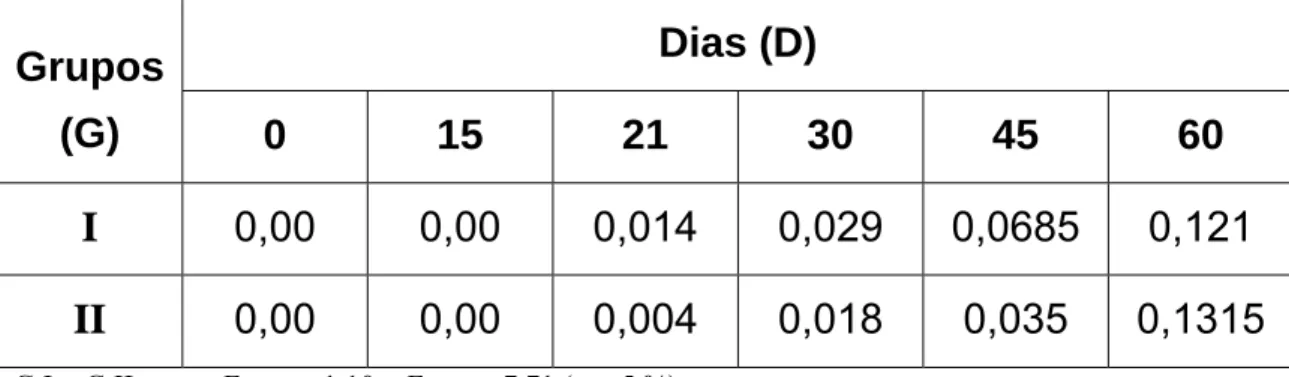
G I = G II; como FLinhas = 1,10 < Fcrítico = 7,71 (α = 5 %).
D0 ≠ D15 ≠ D21 ≠ D30 ≠ D45 ≠ D60; como FColunas = 29,34 > Fcrítico = 6,39 (α = 5 %).
Figura 04: Valores médios de densidade óptica (450 nm) obtidos por ensaio
Snedecor, na diluição de 1:1600, mostrou que não houve diferença estatística ao nível de 5% de significância (FCalculado = 1,10 < Fcrítico =
7,71);
2- A análise comparativa entre os títulos de anticorpos em diferentes momentos (dia zero, 15, 21, 30, 45 e 60), realizada pelo teste F de Snedecor, na diluição de 1:1600, mostrou que houve diferença estatística ao nível de 5% de significância (FCalculado = 29,34 > Fcrítico =
I
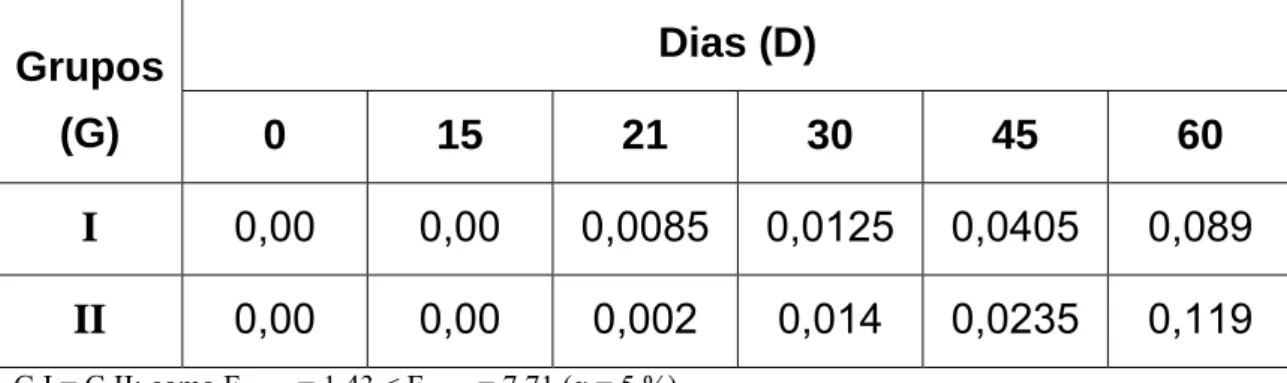
0,00
0,00 0,0085 0,0125 0,0405 0,089
II
0,00 0,00 0,002 0,014 0,0235 0,119
G I = G II; como FLinhas = 1,43 < Fcrítico = 7,71 (α = 5 %).
D0≠ D15≠ D21≠ D30≠ D45≠ D60; como FColunas = 23,91 > Fcrítico = 6,39 (α = 5 %).
Figura 05: Valores médios de densidade óptica (450 nm) obtidos por ensaio
Snedecor, na diluição de 1:3200, mostrou que não houve diferença estatística ao nível de 5% de significância (FCalculado = 1,43 < Fcrítico =
7,71);
2- A análise comparativa entre os títulos de anticorpos em diferentes momentos (dia zero, 15, 21, 30, 45 e 60), realizada pelo teste F de Snedecor, na diluição de 1:3200, mostrou que houve diferença estatística ao nível de 5% de significância (FCalculado = 23,91 > Fcrítico =
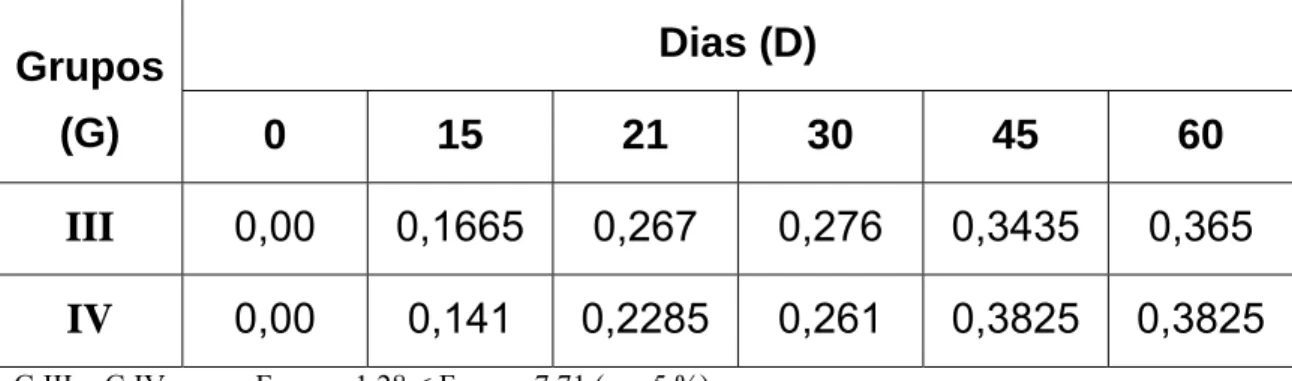
experimento (dia zero), aos 15, 21, 30 e 45 dias com veneno de Bothrops jararaca nativo (Grupo III) e irradiado com 60Co (Grupo IV).
Dias (D)
Grupos
(G)
0 15 21 30 45 60
III
0,00 0,1665 0,267 0,276 0,3435 0,365
IV
0,00 0,141 0,2285 0,261 0,3825 0,3825
G III = G IV; como FLinhas = 1,28 < Fcrítico = 7,71 (α = 5 %).
D0≠ D15≠ D21≠ D30≠ D45≠ D60; como FColunas = 155,03 > Fcrítico = 6,39 (α = 5 %).
Figura 06: Valores médios de densidade óptica (450 nm) obtidos por ensaio
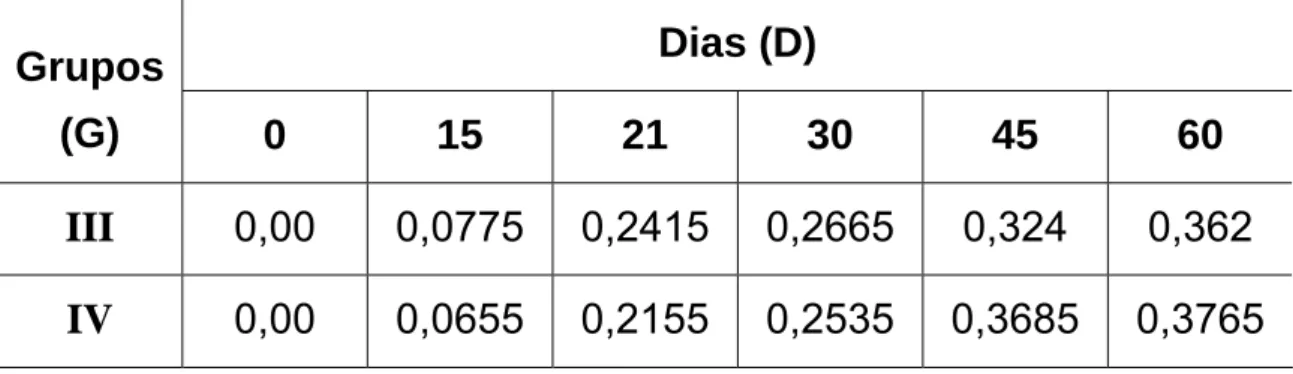
experimento (dia zero), aos 15, 21, 30 e 45 dias com veneno de Bothrops jararaca nativo (Grupo III) e irradiado com 60Co(Grupo IV).
Dias (D)
Grupos
(G)
0 15 21 30 45 60
III
0,00 0,0775
0,2415
0,2665 0,324 0,362
IV
0,00 0,0655 0,2155 0,2535 0,3685 0,3765
G III = G IV; como FLinhas = 2,87 < Fcrítico = 7,71 (α = 5 %).
D0 ≠ D15 ≠ D21 ≠ D30 ≠ D45 ≠ D60; como FColunas = 121,26 > Fcrítico = 6,39 (α = 5 %).
Figura 07: Valores médios de densidade óptica (450 nm) obtidos por ensaio
experimento (dia zero), aos 15, 21, 30 e 45 dias com veneno de Bothrops jararaca nativo (Grupo III) e irradiado com 60Co (Grupo IV).
Dias (D)
Grupos
(G)
0 15 21 30 45 60
III
0,00 0,041
0,2165
0,256 0,32 0,3525
IV
0,00 0,0455 0,2045 0,249 0,3575 0,3755
G III = G IV; como FLinhas = 1,01 < Fcrítico = 7,71 (α = 5 %).
D0 ≠ D15 ≠ D21 ≠ D30 ≠ D45 ≠ D60; como FColunas = 154,4 > Fcrítico = 6,39 (α = 5 %)
Figura 08: Valores médios de densidade óptica (450 nm) obtidos por ensaio
experimento (dia zero), aos 15, 21, 30 e 45 dias com veneno de Bothrops jararaca nativo (Grupo III) e irradiado com 60Co (Grupo IV).
Dias (D)
Grupos
(G)
0 15 21 30 45 60
III
0,00 0,019 0,197 0,2415 0,3145 0,341
IV
0,00 0,018
0,1725
0,2465
0,356 0,359
G III = G IV; como FLinhas = 1,37 < Fcrítico = 7,71 (α = 5 %).
D0 ≠ D15 ≠ D21 ≠ D30 ≠ D45 ≠ D60; como FColunas = 49,64 > Fcrítico = 6,39 (α = 5 %)
Figura 09: Valores médios de densidade óptica (450 nm) obtidos por ensaio
Snedecor, na diluição de 1:1600, mostrou que houve diferença estatística ao nível de 5% de significância (FCalculado = 49,64 > Fcrítico =
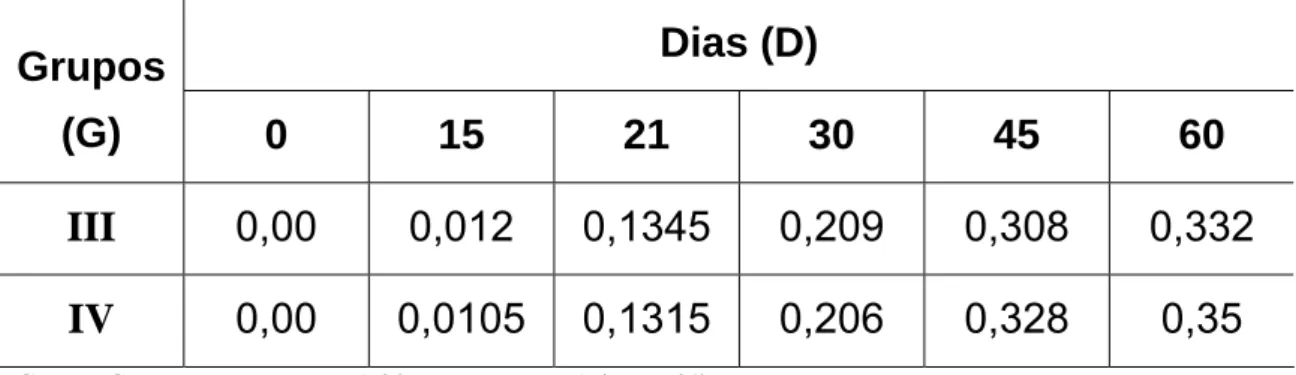
experimento (dia zero), aos 15, 21, 30 e 45 dias com veneno de Bothrops jararaca nativo (Grupo III) e irradiado com 60Co (Grupo IV).
Dias (D)
Grupos
(G)
0 15 21 30 45 60
III
0,00 0,012 0,1345 0,209 0,308 0,332
IV
0,00 0,0105
0,1315 0,206 0,328 0,35
G III = G IV; como FLinhas = 1,32 < Fcrítico = 7,71 (α = 5 %).
D0 ≠ D15 ≠ D21 ≠ D30 ≠ D45 ≠ D60; como FColunas = 52,45 > Fcrítico = 6,39 (α = 5 %).
Figura 10: Valores médios de densidade óptica (450 nm) obtidos por ensaio
Snedecor, na diluição de 1:3200, mostrou que houve diferença estatística ao nível de 5% de significância (FCalculado = 52,45 > Fcrítico =
V
0,00 0,155 0,2135 0,245 0,3555 0,389
VI
0,00 0,107 0,244 0,251 0,475 0,3445
G V = G VI; como FLinhas = 2,81 < Fcrítico = 7,71 (α = 5 %).
D0 ≠ D15 ≠ D21 ≠ D30 ≠ D45 ≠ D60; como FColunas = 18,01 > Fcrítico = 6,39 (α = 5 %).
Figura 11: Valores médios de densidade óptica (450 nm) obtidos por ensaio
Snedecor, na diluição de 1:200, mostrou que não houve diferença estatística ao nível de 5% de significância (FCalculado = 2,81 < Fcrítico =
7,71);
V
0,00 0,1125 0,202 0,2295 0,3405 0,3605
VI
0,00 0,0505 0,2145 0,231 0,3755 0,3355
G V = G VI; como FLinhas = 2,08 < Fcrítico = 7,71 (α = 5 %).
D0 ≠ D15 ≠ D21 ≠ D30 ≠ D45 ≠ D60; como FColunas = 37,07 > Fcrítico = 6,39 (α = 5 %).
Figura 12: Valores médios de densidade óptica (450 nm) obtidos por ensaio
Snedecor, na diluição de 1:400, mostrou que não houve diferença estatística ao nível de 5% de significância (FCalculado = 2,08 < Fcrítico =
7,71);
V
0,00 0,0595 0,1885 0,2215 0,3385 0,3475
VI
0,00 0,0265 0,1825 0,2225 0,3685 0,3325
G V = G VI; como FLinhas = 1,97 < Fcrítico = 7,71 (α = 5 %).
D0 ≠ D15 ≠ D21 ≠ D30 ≠ D45 ≠ D60; como FColunas = 120,01 > Fcrítico = 6,39 (α = 5 %).
Figura 13: Valores médios de densidade óptica (450 nm) obtidos por ensaio
Snedecor, na diluição de 1:800, mostrou que não houve diferença estatística ao nível de 5% de significância (FCalculado = 1,97 < Fcrítico =
7,71);
V
0,00 0,036 0,1725 0,215 0,339 0,3235
VI
0,00 0,0115 0,1695 0,205 0,3625 0,314
G V = G VI; como FLinhas = 3,92 < Fcrítico = 7,71 (α = 5 %).
D0 ≠ D15 ≠ D21 ≠ D30 ≠ D45 ≠ D60; como FColunas = 219,91 > Fcrítico = 6,39 (α = 5 %).
Figura 14: Valores médios de densidade óptica (450 nm) obtidos por ensaio
Snedecor, na diluição de 1:1600, mostrou que não houve diferença estatística ao nível de 5% de significância (FCalculado = 3,92 < Fcrítico =
7,71);
2- A análise comparativa entre os títulos de anticorpos em diferentes momentos (dia zero, 15, 21, 30, 45 e 60), realizada pelo teste F de Snedecor, na diluição de 1:1600, mostrou que houve diferença estatística ao nível de 5% de significância (FCalculado = 219,91 > Fcrítico =
V
0,00 0,0255 0,147 0,2015 0,28 0,313
VI
0,00 0,0045 0,1105 0,158 0,3555 0,296
G V = G VI; como FLinhas = 1,56 < Fcrítico = 7,71 (α = 5 %).
D0 ≠ D15 ≠ D21 ≠ D30 ≠ D45 ≠ D60; como FColunas = 27,52 > Fcrítico = 6,39 (α = 5 %).
Figura 15: Valores médios de densidade óptica (450 nm) obtidos por ensaio
Snedecor, na diluição de 1:3200, mostrou que não houve diferença estatística ao nível de 5% de significância (FCalculado = 1,56 < Fcrítico =
7,71);
experimento (dia zero), aos 15, 21, 30 e 45 dias com veneno de Bothrops moojeni nativo (Grupo VII) e irradiado com 60Co (Grupo VIII).
Dias (D)
Grupos
(G)
0 15 21 30 45 60
VII
0,00 0,1055 0,186 0,1965 0,3705 0,3705
VIII
0,00 0,061 0,178 0,203
0,3775
0,3885
G VII = G VIII; como FLinhas = 1,49 < Fcrítico = 7,71 (α = 5 %).
D0≠ D15≠ D21≠ D30≠ D45≠ D60; como FColunas = 113,01 > Fcrítico = 6,39 (α = 5 %).
Figura 16: Valores médios de densidade óptica (450 nm) obtidos por ensaio
experimento (dia zero), aos 15, 21, 30 e 45 dias com veneno de Bothrops moojeni nativo (Grupo VII) e irradiado com 60Co (Grupo VIII).
Dias (D)
Grupos
(G)
0 15 21 30 45 60
VII
0,00 0,065 0,1745 0,1935 0,3505 0,357
VIII
0,00 0,031
0,1405
0,1835
0,362 0,371
G VII = G VIII; como FLinhas = 1,01 < Fcrítico = 7,71 (α = 5 %).
D0 ≠ D15 ≠ D21 ≠ D30 ≠ D45 ≠ D60; como FColunas = 134,81 > Fcrítico = 6,39 (α = 5 %).
Figura 17: Valores médios de densidade óptica (450 nm) obtidos por ensaio
experimento (dia zero), aos 15, 21, 30 e 45 dias com veneno de Bothrops moojeni nativo (Grupo VII) e irradiado com 60Co (Grupo VIII).
Dias (D)
Grupos
(G)
0 15 21 30 45 60
VII
0,00 0,035 0,154 0,1665 0,339 0,3555
VIII
0,00 0,014 0,0955 0,158 0,338 0,3545
G VII = G VIII; como FLinhas = 2,80 < Fcrítico = 7,71 (α = 5 %).
D0 ≠ D15 ≠ D21 ≠ D30 ≠ D45 ≠ D60; como FColunas = 140,05 > Fcrítico = 6,39 (α = 5 %).
Figura 18: Valores médios de densidade óptica (450 nm) obtidos por ensaio
experimento (dia zero), aos 15, 21, 30 e 45 dias com veneno de Bothrops moojeni nativo (Grupo VII) e irradiado com 60Co (Grupo VIII).
Dias (D)
Grupos
(G)
0 15 21 30 45 60
VII
0,00 0,0195 0,132 0,147 0,323 0,3475
VIII
0,00 0,009 0,0745 0,14 0,3261 0,345
G VII = G VIII; como FLinhas = 1,87 < Fcrítico = 7,71 (α = 5 %).
D0 ≠ D15 ≠ D21 ≠ D30 ≠ D45 ≠ D60; como FColunas = 140,24 > Fcrítico = 6,39 (α = 5 %).
Figura 19: Valores médios de densidade óptica (450 nm) obtidos por ensaio
Snedecor, na diluição de 1:1600, mostrou que houve diferença estatística ao nível de 5% de significância (FCalculado = 140,24 > Fcrítico =
experimento (dia zero), aos 15, 21, 30 e 45 dias com veneno de Bothrops moojeni nativo (Grupo VII) e irradiado com 60Co (Grupo VIII).
Dias (D)
Grupos
(G)
0 15 21 30 45 60
VII
0,00 0,012 0,106
0,1135
0,3085 0,33
VIII
0,00 0,006 0,0395 0,11 0,3095
0,3365
G VII = G VIII; como FLinhas = 1,05 < Fcrítico = 7,71 (α = 5 %).
D0 ≠ D15 ≠ D21 ≠ D30 ≠ D45 ≠ D60; como FColunas = 94,74 > Fcrítico = 6,39 (α = 5 %).
Figura 20: Valores médios de densidade óptica (450 nm) obtidos por ensaio
Snedecor, na diluição de 1:3200, mostrou que houve diferença estatística ao nível de 5% de significância (FCalculado = 94,74 > Fcrítico =
As Tabelas 21 a 24 apresentam as médias de densidades ópticas resultantes da diluição dos títulos de anticorpos obtidos pela inoculação de veneno nativo e veneno irradiado com 60Co e os resultados da análise estatística dos ensaios imunoenzimáticos (ELISA) do “pool” de soro dos animais no 60º dia após a primeira inoculação.
61
0,0005
0,0035
0,0035
0,0095
0,0065
0,0105
0,01
0,0115
0,019
0,0215
0,082
0,067
0,089
0,119
0,121
0,1315
0,134
0,141
0,167
0,1695
0,21
0,2115
I
II
G I = G II; como FLinhas = 2,36 < Fcrítico = 4,96 (α = 5 %).
diferença estatística ao nível de 5% de significância (FCalculado = 202,86 >
64
1:2048
0,052
0,0955
1:1024
0,101
0,1305
1:512
0,106
0,2025
1:256
0,178
0,299
1:128
0,2495
0,3195
1:64
0,2835
0,33
1:32
0,332
0,35
1:16
0,341
0,359
1:8
0,3525
0,3755
1:4
0,362
0,3765
Diluições (D) x 10
21:2
0,365
0,3825
Grupos
(G)
III
IV
G III ≠ G IV; como FLinhas = 17,42 > Fcrítico = 4,96 (α = 5 %).
Snedecor, mostrou que houve diferença estatística ao nível de 5% de significância (FCalculado = 17,42 > Fcrítico = 4,96);
2- A análise comparativa entre os títulos de anticorpos em diferentes diluições (1:2; 1:4; 1:8; 1:16; 1:32; 1:64; 1:128; 1:256; 1:512; 1:1024; 1:2048), realizada pelo teste F de Snedecor, mostrou que houve diferença estatística ao nível de 5% de significância (FCalculado = 36,82 >
67
0,022
0,055
0,0315
0,113
0,0535
0,146
0,0845
0,211
0,1195
0,2665
0,1545
0,2765
0,313
0,296
0,3235
0,314
0,3475
0,3325
0,3605
0,3355
0,389
0,3445
V
VI
G V = G VI; como FLinhas = 4,33 < Fcrítico = 4,96 (α = 5 %).
diferença estatística ao nível de 5% de significância (FCalculado = 11,48 >
70
1:2048
0,024
0,025
1:1024
0,0385
0,0465
1:512
0,079
0,087
1:256
0,1175
0,122
1:128
0,168
0,1875
1:64
0,2345
0,3185
1:32
0,33
0,3365
1:16
0,3475
0,345
1:8
0,3555
0,3545
1:4
0,357
0,371
Diluições (D) x 10
21:2
0,3705
0,3775
Grupos
(G)
VII
VIII
G VII = G VIII; como FLinhas = 3,45 < Fcrítico = 4,96 (α = 5 %).
de Snedecor, mostrou que não houve diferença estatística ao nível de 5% de significância (FCalculado = 3,45 < Fcrítico = 4,96);
2- A análise comparativa entre os títulos de anticorpos em diferentes diluições (1:2; 1:4; 1:8; 1:16; 1:32; 1:64; 1:128; 1:256; 1:512; 1:1024; 1:2048), realizada pelo teste F de Snedecor, mostrou que houve diferença estatística ao nível de 5% de significância (FCalculado = 132,72 >
Crotalus durissus terrificus, por exemplo, o cálculo foi realizado da seguinte maneira:
CNA = (0,74 – 0,148) x 1 x 105 x (1/100)
CNA = 592 µg de veneno/ml de soro
Para um camundongo de 20 g, por exemplo, uma DL50 do veneno de
Crotalus durissus terrificus é 2,96 µg de veneno. Portanto, 592/2,96 = 200 DL50.
capacidade de neutralização de um “pool” dos soros antiveneno crotálico, obtidos no 60º dia após a primeira inoculação dos dois grupos inoculados com veneno nativo e irradiado com 60Co, estão representados nas Tabelas 25 e 26 respectivamente.
Tabela 25: Determinação da capacidade de neutralização de um “pool” dos soros antiveneno Crotálico obtidos no 60º dia após a primeira inoculação, de oito camundongos hiperimunizados com veneno nativo, inoculados via intraperitoneal em quantidades variáveis de DL50 do veneno nativo.
Observações
mortos / vivos
Soro
(µl)
Veneno
DL
5024 horas
48 horas
Mortalidade
(%)
100 1
0:4 0:4 0
100 3
0:4 0:4 0
100 5
2:2 2:2 50
100 10
4:0 4:0 100
100 15
4:0 4:0 100
100 ---
0:4
0:4
0
---- 1
4:0 4:0 100
Tabela 26: Determinação da capacidade de neutralização de um “pool” dos soros antiveneno Crotálico obtidos no 60º dia após a primeira inoculação, de oito camundongos hiperimunizados com veneno irradiado com 60Co, inoculados via intraperitoneal em quantidades variáveis de DL50 do veneno nativo.
Observações
mortos / vivos
Soro
(µl)
Veneno
DL
5024 horas
48 horas
Mortalidade
(%)
100 1
0:4 0:4 0
100 3
0:4 0:4 0
100 5
1:3 1:3 25
100 10
3:1 3:1 75
100 15
4:0 4:0 100
100 ---
0:4
0:4
0
nativo.
Observações
mortos / vivos
Soro
(µl)
Veneno
DL
5024 horas
48 horas
Mortalidade
(%)
100 1
0:4 0:4 0
100 3
0:4 0:4 0
100 5
1:3 1:3 25
100 10
4:0 4:0 100
100 15
4:0 4:0 100
100 ---
0:4
0:4
0
---- 1
4:0 4:0 100
Tabela 28: Determinação da capacidade de neutralização de um “pool” dos soros antiveneno Bothrops jararaca obtidos no 60º dia após a primeira inoculação, de oito camundongos hiperimunizados com veneno irradiado com
60
Co, inoculados via intraperitoneal em quantidades variáveis de DL50 do
veneno nativo.
Observações
mortos / vivos
Soro
(µl)
Veneno
DL
5024 horas
48 horas
Mortalidade
(%)
100 1
0:4 0:4 0
100 3
0:4 0:4 0
100 5
1:3 1:3 25
100 10
4:0
4:0
100
100 15
4:0 4:0 100
100
--- 0:4 0:4 0
inoculados com veneno nativo e irradiado com 60Co, estão representados nas Tabelas 29 e 30 respectivamente.
Tabela 29: Determinação da capacidade de neutralização de um “pool” dos soros antiveneno Bothrops jararacussu obtidos no 60º dia após a primeira inoculação, de oito camundongos hiperimunizados com veneno nativo, inoculados via intraperitoneal em quantidades variáveis de DL50 do veneno
nativo.
Tabela 30: Determinação da capacidade de neutralização de um “pool” dos soros antiveneno Bothrops jararacussu obtidos no 60º dia após a primeira inoculação, de oito camundongos hiperimunizados com veneno irradiado com
60
Co, inoculados via intraperitoneal em quantidades variáveis de DL50 do
veneno nativo.
Observações
mortos / vivos
Soro
(µl)
Veneno
DL
5024 horas
48 horas
Mortalidade
(%)
100 1
0:4 0:4 0
100 3
0:4 0:4 0
100 5
2:2 2:2 50
100 10
3:1 3:1 75
100 15
4:0 4:0 100
100
--- 0:4 0:4 0
---- 1
4:0 4:0 100
Observações
mortos / vivos
Soro
(µl)
Veneno
DL
5024 horas
48 horas
Mortalidade
(%)
100 1
0:4 0:4 0
100 3
0:4 0:4 0
100 5
1:3 1:3 25
100 10
3:1
3:1
75
100 15
4:0 4:0 100
100
--- 0:4 0:4 0
nativo.
Tabela 32: Determinação da capacidade de neutralização de um “pool” dos soros antiveneno Bothrops moojeni obtidos no 60º dia após a primeira inoculação, de oito camundongos hiperimunizados com veneno irradiado com
60
Co, inoculados via intraperitoneal em quantidades variáveis de DL50 do
veneno nativo.
Observações
mortos / vivos
Soro
(µl)
Veneno
DL
5024 horas
48 horas
Mortalidade
(%)
100 1
0:4 0:4 0
100 3
0:4 0:4 0
100 5
1:3 1:3 25
100 10
3:1
3:1
75
100 15
4:0 4:0 100
100 ---
0:4
0:4
0
---- 1
4:0 4:0 100
Observações
mortos / vivos
Soro
(µl)
Veneno
DL
5024 horas
48 horas
Mortalidade
(%)
100 1
0:4 0:4 0
100 3
0:4 0:4 0
100 5
2:2 2:2 50
100 10
3:1 3:1 75
100 15
4:0 4:0 100
100
--- 0:4 0:4 0
no 60º dia após a primeira inoculação dos dois grupos inoculados com veneno nativo e irradiado com 60Co, estão representados nas Tabelas 33 e 34 respectivamente e Figura 25.
Tabela 33: Determinação da potência de neutralização do “pool” de soros
antiveneno crotálico, obtidos de oito camundongos hiperimunizados com veneno nativo, inoculados via intraperitoneal em concentrações variáveis de soro e fixada a concentração do veneno em 5 DL 50 do veneno nativo.
O “pool” dos soros obtidos de camundongos hiperimunizados com veneno nativo de Crotalus durissus terrificus neutralizaram 0,592 mg/ml, equivalente a 200 DL50 do veneno nativo.
Diluição Soro Veneno DL50 Mortos/Vivos 24 horas Mortos/Vivos 48 horas Mortalidade (%)
Puro 5 2:2 2:2 50
1:5 5 4:0 4:0 100
1:10 5 4:0 4:0 100
1:20 5 4:0 4:0 100
1:40 5 4:0 4:0 100
1:80 5 4:0 4:0 100
Puro --- 0:4 0:4 0
O “pool” dos soros obtidos de camundongos hiperimunizados com veneno irradiado de Crotalus durissus terrificus neutralizaram 5,92 mg/ml, equivalente a 2000 DL50 do veneno nativo.
1:5 5 2:2 2:2 50
1:10 5 2:2 2:2 50
1:20 5 3:1 3:1 75
1:40 5 3:1 3:1 75
1:80 5 4:0 4:0 100
Puro --- 0:4 0:4 0
de soro e fixada a concentração do veneno em 5 DL 50 do veneno nativo.
O “pool” dos soros obtidos de camundongos hiperimunizados com veneno nativo de Bothrops jararaca neutralizaram 48 mg/ml, equivalente a 1000 DL50
do veneno nativo.
Diluição Soro
Veneno DL50
Mortos/Vivos 24 horas
Mortos/Vivos 48 horas
Mortalidade (%)
Puro 5 1:3 1:3 25
1:5 5 2:2 2:2 50
1:10 5 3:1 3:1 75
1:20 5 3:1 3:1 75
1:40 5 4:0 4:0 100
1:80 5 4:0 4:0 100
Puro --- 0:4 0:4 0
concentrações variáveis de soro e fixada a concentração do veneno em 5 DL50 do veneno nativo.
O “pool” dos soros obtidos de camundongos hiperimunizados com veneno irradiado de Bothrops jararaca neutralizaram 48 mg/ml, equivalente a 1000 DL50 do veneno nativo.
Diluição Soro Veneno DL50 Mortos/Vivos 24 horas Mortos/Vivos 48 horas Mortalidade (%)
Puro 5 1:3 1:3 25
1:5 5 2:2 2:2 50
1:10 5 3:1 3:1 75
1:20 5 3:1 3:1 75
1:40 5 4:0 4:0 100
1:80 5 4:0 4:0 100
Puro --- 0:4 0:4 0
inoculados com veneno nativo e irradiado com 60Co, estão representados nas Tabelas 37 e 38 respectivamente e Figura 27.
Tabela 37: Determinação da potência de neutralização do “pool” de soros
antiveneno Bothrops jararacussu, obtidos de oito camundongos hiperimunizados com veneno nativo, inoculados via intraperitoneal em concentrações variáveis de soro e fixada a concentração do veneno em 5 DL50 do veneno nativo.
O “pool” dos soros obtidos de camundongos hiperimunizados com veneno nativo de Bothrops jararacussu neutralizaram 352 mg/ml, equivalente a 4000 DL50 do veneno nativo.
Diluição Soro Veneno DL50 Mortos/Vivos 24 horas Mortos/Vivos 48 horas Mortalidade (%)
Puro 5 2:2 2:2 50
1:5 5 2:2 2:2 50
1:10 5 2:2 2:2 50
1:20 5 2:2 2:2 50
1:40 5 3:1 3:1 75
1:80 5 4:0 4:0 100
Puro --- 0:4 0:4 0
O “pool” dos soros obtidos de camundongos hiperimunizados com veneno irradiado de Bothrops jararacussu neutralizaram 176 mg/ml, equivalente a 2000 DL50 do veneno nativo.
1:5 5 2:2 2:2 50
1:10 5 2:2 2:2 50
1:20 5 3:1 3:1 75
1:40 5 3:1 3:1 75
1:80 5 4:0 4:0 100
Puro --- 0:4 0:4 0
de soro e fixada a concentração do veneno em 5 DL 50 do veneno nativo.
O “pool” dos soros obtidos de camundongos hiperimunizados com veneno nativo de Bothrops moojeni neutralizaram 176 mg/ml, equivalente a 2000 DL50
do veneno nativo.
Diluição Soro
Veneno DL50
Mortos/Vivos 24 horas
Mortos/Vivos 48 horas
Mortalidade (%)
Puro 5 2:2 2:2 50
1:5 5 2:2 2:2 50
1:10 5 2:2 2:2 50
1:20 5 3:1 3:1 75
1:40 5 3:1 3:1 75
1:80 5 4:0 4:0 100
Puro --- 0:4 0:4 0
concentrações variáveis de soro e fixada a concentração do veneno em 5 DL50 do veneno nativo.
O “pool” dos soros obtidos de camundongos hiperimunizados com veneno irradiado de Bothrops moojeni neutralizaram 176 mg/ml, equivalente a 2000 DL50 do veneno nativo.
Diluição Soro Veneno DL50 Mortos/Vivos 24 horas Mortos/Vivos 48 horas Mortalidade (%)
Puro 5 1:3 1:3 25
1:5 5 2:2 2:2 50
1:10 5 2:2 2:2 50
1:20 5 3:1 3:1 75
1:40 5 3:1 3:1 75
1:80 5 4:0 4:0 100
Puro --- 0:4 0:4 0
veneno de Crotalus durissus terrificus, Bothrops jararaca, Bothrops jararacussu
e Bothrops moojeni, realizado no 60º dia após a primeira inoculação dos grupos inoculados com veneno natural e irradiado com 60Co, mostraram que não houve óbito em nenhum dos grupos estudados após 24 e 48 h de observação.
Para se verificar a toxicidade do veneno, um grupo de animais não hiperimunizados recebeu cinco DL50 de veneno nativo de Crotalus durissus
terrificus, sendo observado 100% de mortalidade. O mesmo fenômeno foi observado para os venenos de Bothrops jararaca, Bothrops jararacussu e
hiperimunização.
Grupo III – inoculado com veneno nativo de Bothrops jararaca
Foi notada presença de necrose no local das inoculações em seis dos oito animais inoculados. O edema no local das inoculações era extenso em todos os animais. Ocorreram três mortes durante o processo de hiperimunização.
Grupo IV – inoculado com veneno irradiado de Bothrops jararaca
Um pequeno edema no local das inoculações foi notado em três animais. Isto ocorreu somente na primeira inoculação ao longo do processo de hiperimunização.
Grupo V – inoculado com veneno nativo de Bothrops jararacussu
Foi notada presença de necrose no local das inoculações em três dos oito animais inoculados. O edema no local das inoculações era extenso em todos os animais. Ocorreram duas mortes durante o processo de hiperimunização.
Grupo VI – inoculado com veneno irradiado de Bothrops jararacussu
Um pequeno edema no local das inoculações foi notado em dois animais somente na primeira inoculação ao longo do processo de hiperimunização.
Grupo VII – inoculado com veneno nativo de Bothrops moojeni
Foi notada presença de necrose no local das inoculações em dois dos oito animais inoculados. O edema no local das inoculações era extenso em todos os animais. Ocorreram duas mortes durante o processo de hiperimunização.
Grupo VIII – inoculado com veneno irradiado de Bothrops moojeni
Um pequeno edema no local das inoculações foi notado em três animais. Isto ocorreu somente na primeira inoculação ao longo do processo de hiperimunização.
Grupo IX - controle
aplicação intradérmica de veneno nativo de Bothrops jararaca
caracterizam por reações locais intensas acompanhadas de necrose, fístulas, hemorragias (13) culminando com o afastamento destes animais da linha de produção. Segundo Ângulo et al. (58), poucos estudos têm sido realizados sobre as alterações clínicas e fisiológicas dos animais imunizados com venenos para a produção de antivenenos.
No intuito de reduzir a extensão destas alterações, a destoxicação dos venenos de serpentes por vários métodos têm sido sugeridas (13, 18-27, 59). Assim, os objetivos deste trabalho foram delineados com intuito de investigar a eficiência da técnica de irradiação de venenos com 60Co na produção de soros antivenenos em camundongos. Além disso, a técnica de ELISA previamente padronizada, foi utilizada para detectar e acompanhar o título de anticorpos durante o processo de hiperimunização. Por fim, foram avaliadas a capacidade de soroneutralização e a potência dos soros obtidos por meio de métodos “in vitro” e “in vivo” e os efeitos colaterais do processo de imunização foram registrados.
O presente trabalho foi realizado com venenos nativos e irradiados, cuja DL50 utilizada mostrou-se dentro dos valores observados na literatura (27, 33,
60-64).
Para se avaliar a atividade imunogênica de venenos, toxinas e anticorpos vários métodos foram desenvolvidos nos últimos anos (65). Dessa forma, os testes de radioimunoensaios, de hemaglutinação, de imunoeletroforese, de enzyme-linked immunosorbent assay (ELISA) e imunoensaios fluorescentes foram avaliados (45, 65).
método de ELISA para quantificar a crotamina do veneno de Crotalus durissus terrificus. Barral-Neto et al. (67), avaliaram experimentalmente a detecção de veneno de Bothrops jararaca por esta técnica.
Clissa et al. (27) avaliaram a atividade imunogênica do veneno nativo e irradiado de Crotalus durissus terrificus em coelhos por meio de ensaio imunoenzimático (ELISA).
Por outro lado, com a crise na produção de soros antiofídicos ocorrida no Brasil na década de 80, pesquisadores do Instituto de Pesquisas Energéticas e Nucleares (IPEN/CNEN-SP), iniciaram estudos sobre o uso da radiação ionizante como ferramenta na destoxicação de venenos (25-27, 33-42, 68).
Guarnieri et al. (68) analisando os efeitos de doses crescentes de radiação no veneno de Bothrops jararaca em solução salina a uma concentração de 2,0 mg/ml não observaram precipitação, mas verificaram que ocorreu a formação de agregados protéicos solúveis nas amostras irradiadas, proporcionalmente ao aumento da dose. Quando o veneno de Bothrops jararacussu foi irradiado nas mesmas condições, também não foi observada a precipitação das proteínas, mas sim a formação de agregados em solução (38).
Posteriormente, Nascimento et al. (26) avaliaram a influência da radiação ionizante sobre a crotoxina do veneno de Crotalus durissus terrificus. A seguir, utilizando o método de ELISA verificaram seus aspectos imunológicos.
De Paula (41) utilizando o ensaio imunoenzimático (ELISA), avaliou qualitativa e quantitativamente o nível de anticorpos antiveneno de Crotalus durissus terrificus e de crotoxina irradiada em fonte de 60Co produzidos em camundongo. Verificou que os soros produzidos foram capazes de reconhecer as toxinas nativas.
Nesta pesquisa, o teste de ELISA foi utilizado para detectar, monitorar e comparar os títulos de anticorpos nos grupos experimentais de camundongos que receberam os diferentes venenos de Crotalus durissus terrificus, Bothrops jararaca, Bothrops jararacussu e Bothrops moojeni na forma nativa e irradiada com 60Co.
estatística entre os dois grupos estudados, e os níveis de anticorpos se mantiveram elevados até a diluição de 1:6400.
Observamos, pelos títulos de anticorpos produzidos tanto no grupo de camundongos hiperimunizados com veneno nativo quanto no grupo de camundongos hiperimunizados com veneno irradiado de Crotalus durissus terrificus que ambos venenos foram imunogênicos e induziram a formação de anticorpos capazes de reconhecer o veneno nativo de Crotalus durissus terrificus.
Os valores de densidade óptica no teste de ELISA para as diversas diluições do veneno nativo e irradiado de Bothrops jararaca demonstraram que não houve diferença estatística entre os dois grupos estudados.
Os resultados observados mostraram um nível maior de anticorpos nos dias 15, 21 e 30 no grupo inoculado com veneno nativo. Entretanto, a partir do dia 45, o grupo inoculado com veneno irradiado desenvolveram títulos maiores.
Os anticorpos já são formados a partir do primeiro inóculo e o pico foi alcançado no dia 45, mantendo-se praticamente o mesmo no dia 60. Neste último realizamos uma titulação dos níveis de anticorpos de 1:200 até 1:204800. Houve diferença estatística entre os dois grupos estudados. Os níveis de anticorpos do grupo que recebeu veneno irradiado foram maiores que os do grupo que recebeu veneno nativo praticamente em todas as diluições. Estes títulos se mantiveram elevados até a diluição de 1:102400.
Os resultados observados mostraram um número maior de anticorpos nos dias 15 e 60 no grupo inoculado com veneno nativo, e maiores nos dias 21, 30 e 45 no grupo com veneno irradiado.
Os anticorpos já são formados a partir do primeiro inóculo e o pico foi alcançado no dia 60 para o grupo com veneno nativo e no dia 45 no grupo com veneno irradiado, tendo este último uma pequena queda no dia 60. No dia 60, realizamos uma titulação dos níveis de anticorpos de 1:200 até 1:204800. Não houve diferença estatística entre os dois grupos estudados. Os níveis de anticorpos do grupo que recebeu veneno nativo foram maiores que os do grupo que recebeu veneno irradiado até a diluição de 1: 3200. A partir desta diluição, o grupo com veneno irradiado mostrou maiores títulos mantendo níveis elevados até a diluição de 1:204800. No grupo inoculado com veneno nativo os títulos permaneceram elevados até a diluição de 1: 51200.
Observamos, pelos títulos de anticorpos produzidos tanto no grupo de camundongos hiperimunizados com veneno nativo quanto no grupo de camundongos hiperimunizados com veneno irradiado de Bothrops jararacussu
queambos venenosforam imunogênicos e induziram a formação de anticorpos capazes de reconhecer o veneno nativo de Bothrops jararacussu.
Os valores de densidade óptica no teste de ELISA para as diversas diluições do veneno nativo e irradiado de Bothrops moojeni demonstraram que não houve diferença estatística entre os dois grupos estudados.
Os resultados observados mostraram um número maior de anticorpos nos dias 15 e 21 no grupo inoculado com veneno nativo, e maiores nos dias 30, 45 e 60 no grupo com veneno irradiado.