ANGÉLICA DA SILVA OLIVEIRA
AVALIAÇÃO DE TRÊS ANESTÉSICOS PARA ESPÉCIES DE
PEIXES REPRODUTORES UTILIZANDO O MÉTODO DE
IMERSÃO
VIÇOSA
MINAS GERAIS – BRASIL 2009
ANGÉLICA DA SILVA OLIVEIRA
AVALIAÇÃO DE TRÊS ANESTÉSICOS PARA ESPÉCIES DE
PEIXES REPRODUTORES UTILIZANDO O MÉTODO DE
IMERSÃO
APROVADA: 04 de dezembro de 2009
________________________________ ___________________________________ Dr. Rodrigo Diana Navarro Prof. José Teixeira de Seixa Filho
(Co-orientador)
________________________________ ___________________________________ Profª. Ita de Oliveira e Silva Prof. Luiz Carlos dos Santos
(Co-orientador)
_____________________________________ Prof. Oswaldo Pinto Ribeiro Filho
(Orientador)
À minha mãe, Ângela Maria de Oliveira, por me ajudar em TUDO sem medir esforços.
À memória de meu pai, Eli de Oliveira (sempre presente em meu coração), por sempre ter me apoiado nos estudos.
À minha irmã Érika Flávia de Oliveira pelo apoio, conselhos, amizade.
Ao meu eterno “bebê”, presente de Deus, meu irmão Bruno Oliveira.
À memória da minha tia Dalva (sempre presente em meu coração), que Deus levou há tão pouco tempo, por sempre demonstrar orgulho pela minha
caminhada acadêmica.
AGRADECIMENTOS
OBRIGADA meu DEUS. Exaltado e Engrandecido seja Teu nome por esta bênção concedida.
Agradeço ESPECIALMENTE a minha mãe. Muito obrigada pelo apoio, sem você nada seria possível!
Agradeço aos meus irmãos Érika Flávia de Oliveira e Bruno Oliveira por estarem sempre ao meu lado me ajudando.
Às minhas avós, Anália Rosa da Silva e Nair Alzira de Oliveira pelo carinho.
Aos queridos tios, tias e meus primos “amigos”, pelas orações, apoio e carinho.
À Christiane de Oliveira Valente, companheira desde a graduação, amiga de todas as horas e momentos.
Rodrigo Yutaka Dichoff Kasai, agradeço por sua contribuição aqui em Viçosa.
À Universidade Federal de Viçosa, em especial ao Programa de Pós-Graduação em Biologia Animal pela oportunidade para obtenção do título de mestre.
Ao Prof. Oswaldo Pinto Ribeiro Filho, pela orientação.
Aos professores José Teixeira de Seixas Filho e Ita de Oliveira e Silva, e, ao Dr. Rodrigo Diana Navarro, muito obrigada por aceitarem o convite para participarem da banca.
Ao professor Paulo Cecon pela contribuição nas análises estatísticas dessa dissertação.
Ao Dr. João Batista Teixeira, por conceder os peixes e as instalações do laboratório de seu sítio para a realização do experimento.
Ao Marcelo, Gabriel e Marcelo Maia pela contribuição para e realização deste trabalho.
BIOGRAFIA
ANGÉLICA DA SILVA OLIVEIRA, filha de Eli de Oliveira (in memorian) e Angela Maria de Oliveira, nasceu em 02 de outubro de 1978, na cidade de Ipatinga, Minas Gerais.
Em 2005, graduou-se em Ciências Biológicas, pelo Centro Universitário do Leste de Minas Gerais (Unileste-MG), em Coronel Fabriciano, Minas Gerais.
SUMÁRIO
Página
LISTA DE TABELAS ...vii
LISTA DE FIGURAS ...ix
RESUMO ...xi
ABSTRACT ...xiii
1. INTRODUÇÃO...1
2. OBJETIVOS ...4
3. REVISÃO BIBLIOGRÁFICA ...5
4. MATERIAL E MÉTODOS ...16
5. RESULTADOS E DISCUSSÃO ...23
6. CONCLUSÃO...53
7. CONSIDERAÇÕES FINAIS ...54
LISTA DE TABELAS
Página
TABELA 1. Estágios de anestesia em peixe...21 TABELA 2. . Estágios de recuperação anestésica...22 TABELA 3. Resumo da análise de variância do tempo de indução (TI)
e Tempo de Recuperação (TR), dos Anestésicos (A) e das
Concentrações (C) para o pacu (Piaractus mesopotamicus)...27
TABELA 4. Valores médios do tempo de indução e do tempo de recuperação para as respectivas combinações de anestésicos e concentrações para o pacu
(Piaractus mesopotamicus)...28
TABELA 5. Equações de regressão ajustadas das variáveis Tempo de Indução (TI) e Tempo de recuperação (TR) em
função das concentrações (C) dos respectivos anestésicos e os coeficientes de determinação para o pacu
(Piaractus mesopotamicus)...30
TABELA 6. Resumo da análise de variância do tempo de indução (TI) e Tempo de Recuperação (TR) dos anestésicos (A) e das Concentrações(C), para a tilápia-do-nilo
(Oreochromis niloticus) tailandesa ...37
TABELA 7. Valores médios de TI e TR para as respectivas combinações de anestésicos e concentrações para a tilápia-do-nilo
(Oreochromis niloticus) tailandesa...38
TABELA 8. Equações de regressão ajustadas das variáveis Tempo de Indução (TI) e Tempo de recuperação (TR) em função das concentrações (C) dos respectivos anestésicos e os coeficientes para a tilápia-do-nilo
LISTA DE TABELAS
Página
TABELA 9. Resumo da análise de variância do Tempo de Indução (TI) e Tempo de Recuperação (TR) dos anestésicos (A) mentol e benzocaína e das Concentrações (C) para o matrinxã
(Brycon cephalus)...48
TABELA 10. Valores médios de TI (Tempo de indução) em segundos do mentol (AN1) e benzocaína (AN2)
para o matrinxã (Brycon cephalus)...48
TABELA 11. Equações de regressão ajustadas das variáveis: Tempo de Indução (TI) e Tempo de recuperação
(TR) em função das concentrações (C) do mentol e da benzocaína e os coeficientes de determinação
para o matrinxã (Brycon cephalus)...49
TABELA 12. Médias estimadas para o Tempo de Indução (TI) e o Tempo de Recuperação (TR), em função da concentração (C) para o eugenol utilizado
LISTA DE FIGURAS
Página FIGURA 1. Exemplar de Pacu (Piaractus mesopotamicus)
imerso em solução anestésica...18
FIGURA 2. Medida do comprimento padrão (cm) de um exemplar de pacu (Piaractus mesopotamicus),
com o uso de uma trena...19
FIGURA 3. Determinação de peso de um exemplar de pacu
(Piaractus mesopotamicus)...19
FIGURA 4. Acondicionamento de um exemplar de pacu (Piaractus
mesopotamicus),no tanque de recuparação da anestesia ...25
FIGURA 5. Exemplar de Tilápia-do-nilo tailandesa (Oreochromis niloticus), no tanque de
recuperação da anestesia...25
FIGURA 6. Exemplar de Matrinxã (Brycon cephalus)
no tanque de recuperação da anestesia...26
FIGURA 7. Tempo de indução de pacus (Piaractus mesopotamicus)
Submetidos a diferentes concentrações de benzocaína...32
FIGURA 8. Tempo de recuperação de pacus (Piaractus mesopotamicus)
submetidos a diferentes concentrações de benzocaína...33
FIGURA 9. Tempo de indução de pacus (Piaractus mesopotamicus)
Submetidos a diferentes concentrações de óleo de cravo...34
LISTA DE FIGURAS
Página FIGURA 10.Tempo de recupeção de pacus (Piaractus mesopotamicus)
submetidos a diferentes concentrações de óleo de cravo...35
FIGURA 11. Tempo de recuparação de tilápias-do-nilo (Oreochromis niloticus) tailandesas, submetidas
a diferentes concentrações de mentol...41
FIGURA 12. Tempo de indução de tilápias-do-nilo
(Oreochromis niloticus) tailandesas, submetidas a
diferentes concentrações de benzocaína...42
FIGURA 13. Tempo de recuperação de tilápias-do-nilo (Oreochromis niloticus) tailandesas, submetidas a diferentes
concentrações de benzocaína...43
FIGURA 14. Tempo de indução de tilápias-do-nilo
(Oreochromis niloticus) tailandesas, submetidas
a diferentes concentrações de óleo de cravo...44
FIGURA 15. Tempo de recuperação de tilápias-do-nilo (Oreochromis niloticus) tailandesas, submetidas
a diferentes concentrações de óleo de cravo...46
FIGURA 16. Tempo de indução dos matrinxãs (Brycon cephalus) submetidos à anestesia de mentol e benzocaína
em diferentes concentrações...50
RESUMO
OLIVEIRA, Angélica da silva, M.Sc., Universidade Federal de Viçosa, dezembro de 2009. Avaliação de três anestésicos para espécies de peixes reprodutores utilizando o método de imersão. Orientador: Oswaldo Pinto Ribeiro Filho. Co-orientadores: Luiz Carlos dos Santos, José Cola Zanuncio e José Teixeira de Seixas Filho.
ABSTRACT
OLIVEIRA, Angélica da silva, M.Sc., Universidade Federal de Viçosa, December of 2009. Evaluation of three anaesthetics for species of reproductive fish using the immersion method. Adviser: Oswaldo Pinto Ribeiro Filho. Co-Advisers: Luiz Carlos dos Santos and José Cola Zanuncio.
1. INTRODUÇÃO
A piscicultura é uma atividade em grande expansão nacional (ANTUNES et al., 2008). Em pisciculturas, os peixes são submetidos a diversos fatores estressantes como, por exemplo, manejo, transporte, biometria e reprodução induzida (SINGLEY e CHAVIN, 1971; FRYER, 1975; DONALDSON, 1981; WEDEMEYER e MCLEAY, 1981; VIDAL et al., 2008).
O uso de agentes anti estresse é uma prática comum na aqüicultura moderna (VELÍŠEK et al., 2009). Os anestésicos são utilizados para induzir os peixes à anestesia durante o manejo, transporte, seleção, marcação, cirurgias e procedimentos para a reprodução artificial (MCFARLAND, 1960; WESTERFIELD, 1993; GUNN, 2000; WAGNER et al., 2002; ACERATE et al., 2004; ROUBACH et al., 2005; KIESSLING et al., 2009; WEBER et al., 2009). Dessa forma, o uso de anestésicos não somente ajuda a impedir danos aos peixes, mas também atenua os níveis de estresse (MCFARLAND, 1960; WESTERFIELD, 1993; GUNN, 2000; WAGNER et al., 2002; PIRHONEN e SCHRECK, 2003; ACERATE et al., 2004; ROUBACH et al., 2005; ROSS e ROSS, 2008; KIESSLING et al., 2009; WEBER et al., 2009).
A anestesia deve ser realizada de forma eficiente tanto do ponto de vista biológico quanto econômico. Biologicamente, a operação tem por objetivo anestesiar os peixes sem causar nenhum problema no crescimento e na reprodução. Do ponto de vista econômico, a utilização de uma dose correta de anestésico é fundamental para evitar desperdícios do produto ou a morte dos peixes por “overdose” (ROUBACH e GOMES, 2001).
(ROSS e ROSS, 2008). Porém, os peixes anestesiados com MS-222 e benzocaína nos EUA precisam de um período de depuração da droga de 21 dias, antes de serem destinados ao consumo; no Reino Unido e na Nova Zelândia, para o MS-222 são necessários dez dias de depuração; e, não existe período específico de depuração para a benzocaína na Nova Zelândia (ROSS e ROSS, 2008).
No Brasil, não existem leis específicas regularizando o uso de substâncias químicas para anestesiar peixes (FAÇANHA e GOMES, 2005; DELBON, 2006). Deste modo, também são adotadas as recomendações da FDA (FAÇANHA e GOMES, 2005; DELBON, 2006).
A escolha de um anestésico dever estar relacionada com sua viabilidade econômica, disponibilidade, praticidade no uso, eficácia e segurança para o usuário (CHO e HEATH, 2000). Substâncias químicas como o metanosulfonato de tricaína (MS-222) são utilizadas amplamente em anestesia, porém, além de ser um anestésico importado e de alto custo (ROUBACH e GOMES, 2001), apresenta muitas inconveniências como inchaço dos eritrócitos, hipóxia e hiperglicemia (ROSS e ROSS, 2008), irritação das brânquias, danos córneos e também alguns transtornos aos trabalhadores pela necessidade de utilização de luvas (CUNHA, 2007). Atualmente, estudos têm reportado anestésicos alternativos naturais com boa disponibilidade no mercado e baixo custo, como o eugenol (CUNHA, 2007) e o mentol (GONÇALVES, et al., 2008). Produtos químicos como a benzocaína, também têm sido utilizados recentemente como anestésicos para peixes, por reunir características relevantes como: eficácia, baixo custo (OKAMOTO et al., 2009), baixa toxicidade para os manipuladores e que possuam boa margem segurança para os peixes (ROSS e ROSS, 2008).
submetidos ao processo de extrusão, as chances deles de espalharem os ovos são minimizadas (WOYNAROVICH e HORVÁTH, 1989).
2. OBJETIVOS
2.1 Objetivo Geral
Avaliar os efeitos dos anestésicos do óleo de cravo, benzocaína e mentol em reprodutores de pacu (Piaractus mesopotamicus), matrinxã (Brycon cephalus) e tilápia-do-nilo (Oreochromis niloticus) tailandesa, utilizando o método de imersão.
2.2 Objetivos Específicos
Avaliar os tempos de indução à anestesia e de recuperação do pacu (Piaractus mesopotamicus), do matrinxã (Brycon cephalus) e da tilápia-do-nilo (Oreochromis niloticus) tailandesa, utilizando óleo de cravo, benzocaína e mentol como anestésicos.
Determinar os efeitos anestésicos do óleo de cravo, benzocaína e mentol nas espécies estudadas.
Comparar o tempo de indução à anestesia e o tempo de recuperação entre os anestésicos testados, para cada espécie estudada.
3. REVISÃO BIBLIOGRÁFICA
3.1 Anestesia em Peixes
A anestesia é um processo reversível que provoca perda de sensação de todo ou em parte do corpo e que resulta em depressão da função nervosa, causada por um fármaco (WILLIAMS e WILKINS COMPANY, 1982).
Os anestésicos são agentes químicos ou físicos, que com o aumento da exposição ou concentração, primeiro acalmam (sedam) um animal e depois causam perda de mobilidade, equilíbrio, consciência e finalmente das reações reflexas (COYLE et al., 2004), por evitarem o início e condução do impulso nervoso (SUMMERFELT e SMITH, 1990). Um anestésico deve apresentar ação rápida sobre o sistema nervoso, sem complicações posteriores para o peixe, além de ser econômico e de fácil manipulação (SYLVESTER, 1975; PIRHONEN e SCHERECK, 2003). Podem ser solúveis ou insolúveis em água; os insolúveis são primeiramente dissolvidos em um solvente orgânico e posteriormente diluídos na água (BOWSER, 2001).
Os anestésicos podem ser injetados no peixe, embora a maioria seja administrada na água (BOWSER, 2001; ROUBACH e GOMES, 2001). Quando administrado na água, o anestésico entra através das brânquias e da pele no sistema circulatório do peixe, bloqueando algumas ações reflexas (SUMMERFELT e SMITH, 1990). Segundo ROSS e ROSS (2008), a solução da droga é absorvida pelas brânquias dos peixes, suas moléculas se difundem rapidamente para o espaço sanguíneo na lamela secundária, que drena para o sangue da artéria eferente, sendo esta uma rota muito curta para o sistema nervoso central.
Alguns agentes anestésicos reúnem características desejáveis: facilidade de administração, eficaz a baixas doses, fornece previsivelmente sedação ou anestesia, induzi rapidamente o estado desejado, recuperação rápida e tranqüila, boa margem de segurança para o peixe, seguro para os operadores, baixo custo, fáceis de serem obtidos (ROSS e ROSS, 2008).
anestesia, com perda parcial do equilíbrio e o peixe não reage a estímulo por toque; (3) anestesia cirúrgica, com a perda total do equilíbrio e o peixe não reage a estímulo por toque e (4) morte, em que ocorre parada da respiração e dos batimentos cardíacos. No entanto ROUBACH e GOMES (2001) caracterizaram seis estágios de indução à anestesia: (1) sedação leve, caracterizado por perda de reação aos estímulos visuais e ao toque; (2) anestesia leve, em que ocorre perda parcial do equilíbrio; (3) anestesia profunda, caracterizada pela perda total do equilíbrio; (4) anestesia cirúrgica I, em que ocorre a diminuição dos movimentos operculares; (5) anestesia cirúrgica II, com mínimo movimento opercular, e o peixe fica estático e (6) colapso medular, caracterizado por overdose ou tempo excessivo de anestesia. Geralmente, a maioria dos peixes passa por todas as fases de anestesia. Entretanto, podem ocorrer variações nas diferentes espécies, no tipo de anestésico empregado e na dose aplicada (DELBON, 2006). Algumas dessas fases podem não ocorrer no processo anestésico de certos peixes (BROWN, 1993). A avaliação dos diferentes estágios de anestesia que um agente anestésico para peixes pode induzir é bastante subjetiva, e, muitas vezes, é difícil diferenciar o momento da passagem de um estágio de anestesia para outro (GILDERHUS e MARKING, 1987). Essa depende de uma série de fatores, como por exemplo, a habilidade de quem está manipulando os peixes e dos procedimentos a serem realizados (BURKA et al., 1997).
Para realizar a biometria e o manejo de peixes reprodutores, normalmente utiliza-se o estágio de anestesia profunda o qual deve ser atingido em três minutos. Para avaliações de sanidade e intervenções cirúrgicas o estágio desejado é o de anestesia cirúrgica, e este deve ser alcançado entre 3 a 5 minutos (ROUBACH e GOMES, 2001).
HIKASA et al. (1986) estabeleceu cinco os estágios de recuperação à anestesia dos peixes: (1) reaparecimento dos movimentos operculares; (2) retorno parcial do equilíbrio e da capacidade de nado; (3) recuperação total do equilíbrio; (4) nado e reação para estímulos externos ainda vacilantes e (5) total recuperação do equilíbrio e capacidade normal de nado.
Peixes submetidos à anestesia devem se recuperar rapidamente; tempos inferiores a cinco minutos são considerados adequados (ROUBACH e GOMES, 2001). Para COYLE al. (2004), a recuperação inicial do peixe pode levar de alguns segundos a vários minutos, e a completa recuperação pode ocorrer de minutos a horas, ambas dependendo do anestésico administrado e da espécie utilizada. GILDERHUS e MARKING (1987), SON et al. (2001) e PARK et al. (2003) consideram 10 minutos o limite máximo para o tempo de recuperação.
De acordo com BROWN (1993), COYLE et al., (2004) e ROSS e ROSS (2008), se o peixe não se recuperar da anestesia, ou não apresentar movimentos operculares, devem ser realizados os seguintes procedimentos: aumentar o fluxo de água livre de anestésico sobre as brânquias para acelerar e normalizar o batimento cardíaco; mover o peixe para frente e para traz no tanque de recuperação ou delicadamente passar água sobre as brânquias com uma mangueira. Esses procedimentos levam ao aumento do fluxo de sangue nas brânquias e elimina a droga mais rapidamente.
podem ser solúveis na gordura, conseqüentemente, em peixes maiores e mais velhos, que possuem maior deposição de gordura nos corpos, ou em fêmeas grávidas, a duração da anestesia pode ser prolongada e a recuperação pode ser mais lenta, porque a droga é removida aos poucos das reservas lipídicas através das brânquias ou do rim ou por degradação metabólica (COYLE et al., 2004; ROSS e ROSS, 2008).
BROWN (1993), ROUBACH e GOMES (2001), COYLE et al. (2004) e ROSS e ROSS (2008) também relatam que pH e a temperatura como um dos principais fatores ambientais que afetam a anestesia de peixes. ROUBACH e GOMES (2001) citaram que a temperatura determina a taxa metabólica do peixe e, que em temperaturas mais altas, essa taxa metabólica é mais alta e conseqüentemente a indução à anestesia é mais rápida. De acordo com HOSKONEN e PIRHONEN (2004), temperaturas mais elevadas aceleram o metabolismo, reduzindo o tempo de recuperação à anestesia. Segundo COYLE et al. (2004), em baixas temperaturas da água, altas doses ou longo período de exposição são exigidos com MS-222 e benzocaína, presumidamente porque a taxa de absorção diminui a baixas temperaturas. Sendo assim, a passagem físico-química da droga dentro do peixe está também relacionada com a temperatura (COYLE et al., 2004; ROSS e ROSS, 2008) . De acordo com HOSKONEN e PIRHONEN (2004), a temperatura apresenta forte influência sobre o efeito anestésico do óleo de cravo nos peixes. Eles observaram que, testando as temperaturas de 5, 10, 15 e 20ºC, o aumento da temperatura provocou diminuição no período necessário para indução e recuperação anestésica em seis espécies de peixes. Segundo VIDAL et al. (2006), a temperatura da água deve ser considerada, uma vez que esse parâmetro possui forte influência na velocidade com que os animais atingirão os diferentes estágios anestésicos.
3.2 Anestésicos utilizados em peixes
3.2.1 Óleo de Cravo
O óleo de cravo recentemente tem sido apontado como um anestésico potencial para peixe (HAJEK et al., 2006). É destilado das flores, hastes e folhas de Syzygium aromaticum (isto é, Eugenia aromaticum) ou Eugenia caryophyllata (ROSS e ROSS, 2008). Também tem sido bastante divulgado por ser um produto natural (HONCZARYK e INOUE, 2009).
O eugenol (2-Methoxy-4-prop-2-enyl-phenol), com fórmula molecular (C10-H12-O2) (ROSS e ROSS, 2008), é o componente ativo do óleo de cravo (ANDERSON et al., 1997; BRESSLER e RON, 2004; HAJEK et al., 2006). Sua concentração varia de 70 a 95% da composição total do óleo essencial do cravo (MAZZAFERA, 2003).
O óleo de cravo é usado como anestésico na medicina humana e odontologia e é aprovado para uso como um anestésico local em humanos nos Estados Unidos pela Federal Drug Administration (FDA) (NAGABABU e LAKSHMAIAH, 1992; SOTO e BURHANUDDIN, 1995). Possui propriedades antifúngica, antiviral, analgésica, antibacteriana e antimicótica (HUSSAIN et al., 2000).
Além de apresentar ampla disponibilidade no mercado, eficácia e baixo custo, o eugenol é considerado seguro para o meio ambiente, para os peixes e para o manipulador (ROUBACH et al., 2005; CUNHA, 2007). Este anestésico também possui como vantagem ser metabolizado e excretado rapidamente no organismo do animal, não requerendo tempo de carência (WAGNER et al., 2002; KANG et al., 2005). De acordo com KILDEA et al. (2004), o eugenol é completamente eliminado do tecido do peixe 48 h após a exposição. Portanto, o eugenol não causa risco à saúde do consumidor (CHO e HEATH, 2000; BRESSLER e RON, 2004).
Vários estudos têm reportado a eficácia do óleo de cravo: juvenis de tilápia-do-nilo, Oreochromis niloticus (VIDAL et al., 2008), juvenis de piavuçu, Leporinus macrocephalus (VIDAL et al., 2007c), juvenis de matrinxã, Brycon cephalus (VIDAL et al., 2007a), Catfish europeu, Silurus glanis L. (VELÍŠEK et al., 2006), carpa comum, Ciprinus carpio (HAJEK et al., 2006), juvenis de dourado, Salminus brasiliensis (HISANO et al., 2008).
3.2.2 Benzocaína
A benzocaína (Ethyl 4-aminobenzoate), com fórmula molecular (C9-H11-N-O2) (ROSS e ROSS, 2008), é um cristal branco, quimicamente similar ao MS-222 (COYLE et al., 2004; ROSS e ROSS, 2008). Assim como o MS-222 (3-aminobenzoic acid ethyl ester methanesulfonate), a benzocaína é derivada do ácido p-aminobenzoico (BOLASINA, 2006) e, por isso, provoca redução da ventilação nas brânquias devido a depressão dos centros medulares respiratórios, tendo a hipóxia como conseqüência (DELBON, 2006). Por ser um anestésico sintético, tem como característica a possibilidade de causar efeitos adversos nos peixes, tais como perda de muco, irritação das brânquias e danos nas córneas (INOUE et al., 2003). De acordo com ROUBACH e GOMES (2001) e COYLE et al. (2004), a benzocaína é uma solução neutra, dessa forma, causa menos agitação e irritação aos peixes do que o MS-222.
Por ter baixa solubilidade na água, a benzocaína deve primeiramente ser dissolvida em etanol ou acetona (BURKA et al., 1997; COYLE et al. 2004; ROSS e ROSS, 2008). O parâmetro usado é preparar uma solução estoque em etanol ou acetona (geralmente 100 g/L) podendo ser mantida por mais de um ano quando fechada em uma garrafa escura (COYLE et al., 2004).
De acordo com MEINERTZ (1999), a benzocaína é utilizada como anestésico geral para peixes pelo método de imersão. ROUBACH e GOMES (2001) reportaram que a benzocaína é um anestésico seguro para os peixes, pois ocorre mortalidade somente quando eles são expostos a uma dose três vezes maior do que a ideal, e que peixes anestesiados com uma dose considerada ideal por até 30 minutos não morrem.
1989; ROUBACH e GOMES, (2001) e baixo risco aparente de intoxicação aos operadores (ALLEN, 1988; GOMES et al., 2001; ROUBACH e GOMES, 2001, ROSS e ROSS, 2008). ANTUNES et al. (2008) observaram que a indução à anestesia com benzocaína ocorre entre dois a quatro minutos, e a recuperação em tempo inferior a dez minutos. A exposição a este anestésico não prejudica o crescimento ou a capacidade reprodutiva das espécies de peixes testadas (ROSS e ROSS, 2008; ROUBACH e GOMES, 2001). A dureza e o pH da água não afetam a eficácia deste fármaco (IVERSEN et al., 2003; ROSS e ROSS, 2008). Por ser um anestésico solúvel em gordura, o tempo de recuperação à anestesia pode ser prolongado em animais mais velhos ou em fêmeas grávidas, ou seguido de longa exposição (ROSS e ROSS, 2008).
A benzocaína é aprovada para uso na aqüicultura dos EUA e da Nova Zelândia, e, seguindo as recomendações da FDA, o período de depuração para os peixes anestesiados com esse fármaco nos EUA é de 21 dias, e na Nova Zelândia não existe um tempo específico de retirada da droga (ROSS e ROSS, 2008).
Vários estudos têm relatado a ação da benzocaína como um anestésico eficaz em diferentes espécies de peixes, como por exemplo, em lambari-do-rabo-amarelo, Astyanax altiparanae (GIMBO et al., 2008); juvenis de matrinxã, Brycon caphalus (INOUE et al., 2004); juvenis de tambaqui, Colossoma macropomum (GOMES et al., 2001); juvenis do pampo, Trachinotus marginatus (OKAMOTO et al., 2009); Juvenis de tilápia, Oreochromis niloticus (DELBON, 2006).
3.2.3 Mentol
Entre os anestésicos naturais produzidos no Brasil, encontramos o eugenol e o mentol (GONÇALVES et al., 2008).
antiúlceras e antivirais, sendo de grande importância econômica na indústria farmacêutica (LORENZO et al., 2002) e também na alimentícia e de cosméticos (SIMÕES e GOMES, 2009).
O mentol tem várias características que o qualificam como um anestésico adequado para peixes: eficácia e boa margem de segurança para o peixe (GONÇALVES et al., 2008) e para o operador na concentração utilizada (ROUBACH e GOMES, 2001). Este anestésico também é utilizado em farmácias de manipulação, sendo facilmente encontrado no mercado local a baixo custo (FAÇANHA e GOMES, 2005).
Embora o mentol seja procedente de uma planta medicinal, ainda não se sabe sobre a existência de resíduos na carcaça ou de alteração do sabor, bem como sobre as alterações fisiológicas nos peixes decorrentes do uso deste produto (GONÇALVES et al., 2008). Sendo assim, para o mentol ser aprovado como anestésico para uso pelas autoridades competentes, é necessário conhecer o tempo residual desta substância no tecido do peixe (FAÇANHA e GOMES, 2005).
3.3 Características das espécies
3.3.1 Tilápia-do-nilo da linhagem chitralada
A tilápia-do-nilo, Oreochromis niloticus, (Linnaeus, 1758), pertence à Classe Osteichtyes, Ordem Perciformes e Família Cichlidae (NAKATANI, 2001). É a espécie mais cultivada no Brasil e está entre as mais importantes na piscicultura mundial (FAO, 2007), especialmente devido a algumas características como: a alta taxa de crescimento, a rusticidade, o hábito alimentar onívoro, pela facilidade de obtenção de larvas (FURUYA et al., 2004), a fácil aceitação de ração e a grande resistência às doenças, além de serem tolerantes à baixa concentração de oxigênio na água (SIMÕES e GOMES, 2009), uma vez que suportam valores inferiores a 1,0 mg/L (EL-SAYED ALI et al., 2003). Além disso, a tilápia possui carne de ótima qualidade a boa aceitação pelo mercado consumidor (BORGES et al., 2005).
NAKATANI (2001), a desova da tilápia nilótica é parcelada e elas não realizam migrações reprodutivas. Segundo este mesmo autor, esta espécie de peixe constrói ninhos junto ao sedimento para depositar seus ovos, incubando-os na boca.
A tilápia-do-nilo da linhagem Chitralada, mais conhecida como Tailandesa, foi desenvolvida no Japão e melhorada no Palácio Real de Chitralada, na Tailândia (ZIMMERMANN, 2000). Foi introduzida oficialmente no Brasil no ano de 1996, com 20.800 exemplares importados do Agricultural and Aquatic Systems, do Asian Institute of Technology (AIT), com sede na Tailândia (ZIMMERMANN, 1999).
A tilápia-do-nilo, Oreochromis niloticus, linhagem chitralada, é a mais utilizada na produção comercial (KUBITZA, 2000). Essa variedade destaca-se por apresentar desempenho de crescimento superior em relação às outras espécies de tilápia (ZIMMERMANN, 2000).
A tilápia-do-nilo é uma espécie que apresenta espinhos ósseos nas nadadeiras, que freqüentemente provocam machucados nos técnicos. Dessa forma, o uso de anestésicos nesta espécie ajuda não somente reduzir o estresse do animal durante o manejo, mas também aumenta a segurança dos operadores durante práticas de rotina em pisciculturas (VIDAL et al., 2008).
3.3.2 Matrinxã
O Matrinxã, Brycon cephalus, (Gunther, 1869), pertence à ordem Characiformes, família Characidae e subfamília Bryconinae (NAKATANI, 2001). É uma espécie de peixe originária da bacia Amazônica que desperta grande interesse em pesquisadores, piscicultores, pesque-pague e agroindústria de pescado de todo o Brasil (PIZANGO-PAIMA, 2001; IZEL e MELO, 2003).
(GOULDING, 1980). Em condições de cultivo, essa espécie aceita rações artificiais, bem como subprodutos agroindustriais (GRAEF et al., 1987).
A crescente procura por essa espécie para criação em ambientes controlados se deve, principalmente, à sua fácil adaptação ao cativeiro, aceitação de alimentos tanto de origem vegetal quanto animal, seu rápido crescimento e elevado valor comercial (PIZANGO-PAIMA, 1997; IZEL, 2000; SOARES, 2000; CARNEIRO e URBINATE, 2001; PIZANGO-PAIMA, 2001).
O matrinxã movimenta-se em excesso durante o manejo e transporte, o que pode causar ferimentos e perdas de escamas, e, conseqüentemente, resultar na manifestação de doenças provocadas por microrganismos e/ou a morte (KUBITZA, 2003; INOUE et al., 2004; BARBOSA et al., 2007). Além do mais, os movimentos bruscos dos animais também podem colocar em risco a segurança dos trabalhadores, principalmente ao manusearem equipamentos como, por exemplo, bisturis, agulhas e balanças eletrônicas. Esse risco aumenta quando os peixes são de grande porte (BARBOSA et al., 2007).
3.3.3 Pacu
O pacu, Piaractus mesopotamicus, (Holmberg, 1887), pertence à ordem Characiformes e à subfamília Myleinae, e é originário da Bacia do Prata (NAKATANI, 2001). É uma espécie considerada de grande potencial para a piscicultura, principalmente na região Centro-Oeste e Sudeste do Brasil, pela excelência de sua carne e importância na pesca comercial em suas regiões de origem, além de seu potencial zootécnico e rusticidade (QUEIROZ et al., 2005). Também é uma espécie importante para a aqüicultura por apresentar hábito alimentar onívoro e por ter boa aceitação pelo consumidor (URBINATI e GONSALVES, 2005). Segundo VIEGAS et al. (2008), o pacu também uma espécie muito utilizada para pesca esportiva no Brasil. Recebe nomes diferentes de região para região, como caranha, pacu-caranha ou pacu-guaçu (REIS NETO, 2007). É um peixe de grande porte, com o corpo robusto e arredondado e apresenta o dorso cinza-escuro e o ventre amarelo-dourado (VAZ et al., 2000).
4. MATERIAL E MÉTODOS
O presente trabalho foi realizado no Laboratório da piscicultura do Dr. João Batista Teixeira, localizado na zona rural do município de Viçosa, Minas Gerais em junho de 2009. Foram utilizados peixes reprodutores de pacu (2,73 ± 0,51 kg e 46,44 ± 3,26 cm), matrinxã (1,38 ± 0,11 Kg e 41,07 ± 1,14 cm) e tilápia tailandesa (0,122 ± 0,04 Kg e 16,66 ± 1,63 cm), oriundos desta piscicultura.
Vinte e quatro horas antes do início do experimento, o arraçoamento foi suspenso. A despesca dos peixes foi realizada às 9h da manhã. Os pacus e os matrinxãs foram capturados dos tanques de terra com rede de arrasto em malha grossa de 5 cm. Já as tilápias foram capturadas com tarrafa, pois são animais menores e de fácil captura. Após captura, os peixes foram transportados através de baldes com capacidade para 60 L de água para o laboratório da piscicultura e acondicionados em tanques de alvenaria com capacidade para 300 L, com fluxo constante de água corrente.
Foram utilizados 12 peixes para cada tratamento dos anestésicos, sendo três animais para cada concentração. Os anestésicos testados foram o óleo de cravo, benzocaína e mentol. Para todos os tratamentos, utilizou-se as seguintes concentrações em mg/L: 100, 150, 200, 250. Matrinxãs reprodutores são peixes pouco encontrados na região, portanto, não foi possível completar o número necessário de exemplares para realizar os testes com as concentrações de 200 e 250 mg/L de eugenol.
Os três anestésicos foram previamente diluídos em etanol na concentração de 1g/ 10 mL, devido às suas características hidrofóbicas (INOUE et al., 2003), na proporção 1:9. A solução mãe do mentol e da benzocaína foram adquiridas por uma farmácia de manipulação, e o óleo de cravo foi comprado por um fornecedor e sua solução mãe foi preparada no laboratório da ranicultura da UFV.
mL, 45 mL, 60 mL e 75 mL, respectivamente para as concentrações 100 mg/L, 150 mg/L, 200 mg/L e 250 mg/L.
Para cada anestésico testado, utilizou-se uma caixa de isopor, previamente reforçada com fita adesiva, com capacidade para 80 L. O isopor é um isolante térmico, e o intuito foi manter a temperatura da água constante para evitar que esta não comprometesse a eficácia do anestésico, interferindo nos resultados. Para o teste, cada concentração da solução anestésica a ser testada foi colocada na caixa de isopor, após, foi adicionada água até completar 30 L. Após cada teste, as caixas foram lavadas com água corrente para evitar a contaminação das dosagens.
As temperaturas da água do tanque onde os peixes foram acondicionados antes dos testes, da caixa de indução e a do tanque de recuperação da anestesia foram aferidas com termômetro digital a laser.
FIGURA 1. Exemplar de Pacu (Piaractus mesopotamicus) imerso em solução anestésica.
FIGURA 2. Medida do comprimento padrão (cm) de um exemplar de pacu (Piaractus mesopotamicus), com o uso de uma trena.
FIGURA 3. Determinação de peso de um exemplar de pacu (Piaractus mesopotamicus).
retorno à alimentação dos animais, e a ocorrência da mortalidade por um período de 72 horas.
Os testes foram registrados por máquina fotográfica digital.
Análise estatística
O experimento foi disposto segundo o esquema de parcelas subdivididas, tendo nas parcelas as concentrações e nas subparcelas o tempo de avaliação no delineamento inteiramente casualizado com três repetições.
TABELA 1. Estágios de anestesia em peixes
Estágio Descrição Resposta comportamental em peixes
0 Normal Reativos a estímulos externos; batimentos operculares normais; reação muscular normal.
I Sedação leve Reativos a estímulos externos; movimentos
reduzidos, batimentos operculares mais lentos; equilíbrio normal.
II Sedação profunda Perda total da reatividade aos estímulos externos,
exceto forte pressão; leve queda do movimento opercular; equilíbrio normal.
III Narcose Perda parcial do tônus muscular; natação errática, aumento dos movimentos operculares; reativos apenas a forte estímulo tátil ou vibração.
IV Anestesia profunda Perda total de tônus muscular; perda total de
equilíbrio; batimento opercular lento, porém regular.
V Anestesia cirúrgica Ausência total de reação, mesmo a forte estímulo; movimentos operculares lentos e irregulares;
batimentos cardíacos lentos; perda total de todos os reflexos.
VI Colapso medular Parada da ventilação; parada cardíaca; morte eventual.
TABELA 2. Estágios de recuperação anestésica
_______________________________________________________________________________________________
Estágio Resposta comportamental
______________________________________________________________________________________________
I Reaparecimento dos movimentos operculares
II Retorno parcial do equilíbrio e da capacidade de nado
III Recuperação total do equilíbrio
IV Nado e reação a estímulos externos ainda vacilantes
V Total recuperação do equilíbrio e capacidade normal de nado
_______________________________________________________________________________________________
5. RESULTADOS E DISCUSSÃO
Todos os pacus, matrinxãs e tilápias tailandesas, para os três anestésicos testados, em todas as concentrações avaliadas, ao serem acondicionados nas caixas de isopor contendo os fármacos e suas respectivas concentrações, inicialmente ficaram hiperativos. Devido a essa hiperatividade, assim que os peixes foram acondicionados nas caixas, estas foram imediatamente fechadas para evitar o desperdício das concentrações anestésicas. Após a tranquilização dos animais, as tampas das caixas foram retiradas, para posterior observação do comportamento, o qual foi evidenciado pela perda dos movimentos das nadadeiras até que os peixes ficassem sem equilíbrio, posicionando-se para um lado. Devido à necessidade de fechar as caixas logo que os peixes foram acondicionados para serem induzidos à anestesia, os movimentos operculares destes animais não foram observados nesta etapa. VIDAL et al. (2007a) e VIDAL et al. (2008) ao estudarem, respectivamente, juvenis de matrinxã com 3,31 ± 0,57 g e juvenis de tilápia-do-nilo, com peso médio de 5,34 g, também observaram essa hiperatividade utilizando o eugenol como anestésico. Segundo Collins (1978), essa hiperatividade é o primeiro comportamento observado em um animal submetido à anestesia geral.
Em todos os peixes testados, para todas as concentrações anestésicas avaliadas, após serem anestesiados e aplicados os procedimentos de biometria e marcação, observou-se que quando acondicionados no tanque de recuperação, todos os animais primeiramente normalizaram os movimentos operculares, e aos poucos começaram a movimentar as nadadeiras até recuperarem totalmente o equilíbrio e a capacidade de nado.
durante a biometria e marcação, ficaram estáticos, sem reação alguma que pudesse interferir no trabalho do manipulador. Isto evidencia que os três anestésicos testados mostraram segurança para o operador durante os procedimentos rotineiros em piscicultura, uma vez que não ocorreu nenhum acidente, além de diminuir o tempo que o animal ficou fora de seu ambiente.
As tilápias manuseadas sem tratamento anestésico, durante o manejo eriçam suas nadadeiras e ficam hiperativas, e mesmo sendo de pequeno porte, os raios contidos em suas nadadeiras podem ferir os operadores. Durante os procedimentos executados, esses peixes, após serem anestesiados, foram facilmente manejados, evidenciando que o mentol, o óleo de cravo e a benzocaína apresentaram segurança para o operador.
O mentol, a benzocaína e o óleo de cravo apresentaram-se seguros para os pacus, matrinxãs e as tilápias tailandesas, pois durante o manejo esses animais não correram o risco de quedas, perdas de escamas devido a movimentos excessivos do corpo, e nenhuma morte.
A figura 4 mostra o acondicionamento de um exemplar de pacu (Piaractus mesopotamicus), no tanque de recuperação da anestesia. As figuras 5 e 6, mostram, respectivamente, um exemplar de tilápia-do-nilo tailandesa (Oreochromis niloticus) e um exemplar de matrinxã (Brycon cephalus), acondicionados no tanque de recuperação da anestesia.
Não foi observada nenhuma mortalidade de pacus, matrinxãs e tilápias tailandesas durante e 72 h após o teste de indução à anestesia.
FIGURA 4. Acondicionamento de um exemplar de pacu (Piaractus mesopotamicus), no tanque de recuperação da anestesia.
FIGURA 6. Exemplar de matrinxã (Brycon cephalus) no tanque de recuperação da anestesia.
5.1 Pacu
As temperaturas médias (em °C) da água do tanque onde os pacus foram acondicionados antes da anestesia, da caixa de indução e a do tanque de recuperação da anestesia foram, em média, 18,13 ± 1,95; 18,11 ± 0,97 e 17,54 ± 1,93, respectivamente.
As concentrações de 100 e 150 mg/L de óleo de cravo, e todas as dosagens do mentol e da benzocaína testadas, induziram os pacus à anestesia profunda. Todos os animais que atingiram o estágio de anestesia profunda perderam totalmente o equilíbrio e apresentaram movimento opercular lento e regular durante a biometria.
Nas concentrações de 200 e 250 mg/L de óleo de cravo, os peixes atingiram o estágio de anestesia cirúrgica. Todos os animais que atingiram esse estágio, durante a biometria não apresentaram movimento opercular.
observaram que o eugenol nas concentrações de 25, 50 e 100 mg/L também induziu os animais à anestesia profunda. GIMBO et al. (2008) observaram que as concentrações de 100 e 125 mg/L de benzocaína induziram o lambari-do-rabo-amarelo, Astyanax altiparanae, (peso médio de 3,5 ± 1,7 g e comprimento total médio de 6,0 ± 1,0 cm), ao estágio de anestesia profunda.
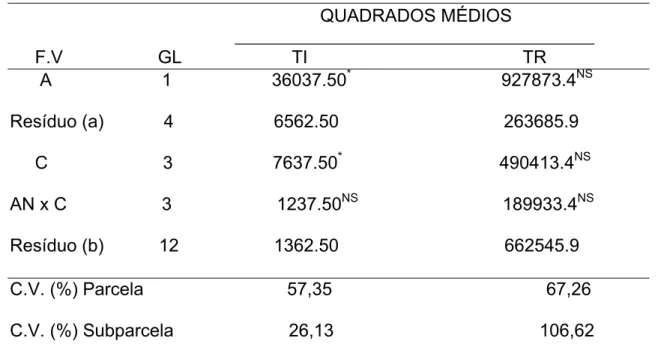
A Tabela 3 apresenta os valores do tempo de indução e do tempo de recuperação para os anestésicos e as concentrações. Verifica-se que para o tempo de indução, somente os anestésicos não apresentaram significância. Todas as fontes de variação tiveram efeito significativo para o tempo de recuperação.
TABELA 3.
QUADRADOS MÉDIOS
______________________________________________ F.V GL TI TR
AN 2 8456.58NS 1888612,00** Resíduo (a) 6 8266,38 79273,64 C 3 16898,92** 897745,30** AN x C 6 9979,25* 579893,10** Resíduo (b) 18 2922,72 59226,79
C.V. (%) Parcela 45,59 68,47 C.V. (%) Subparcela 27,10 59,18
** F significativo ao nível de 1% de probabilidade. * F significativo ao nível de 5% de probabilidade.
NS. F não F significativo ao nível de 5% de probabilidade.
Na tabela 4 encontram-se as médias das variáveis tempos de indução (TI) e de recuperação (TR) para as concentrações (C) e tipo de anestésicos (AN).
TABELA 4.
TI TR
________________________ ________________________________ C AN1 AN2 AN3 AN1 AN2 AN3 100 220ab 260a 140b 180a 100a 280a
150 200a 220a 240a 180a 140a 460a
200 300a 180b 223ab 140.3b 160b 660.3a
250 198.6a 60.0b 51.3ab 197b 360b 2076.3a
As médias com pelo menos uma mesma letra na linha para cada variável não diferem entre si ao nível de 10% de probabilidade pelo teste de TUKEY;
TI = tempo de indução (s); TR = tempo de recuperação (s); C= concentração em mg/L; AN1= Mentol; AN2= Benzocaína; AN3= Eugenol.
Na concentração de 100 mg/L, o Tempo de Indução (TI) médio dos pacus anestesiados com eugenol (AN3) apresentou redução significativa em relação ao TI médio dos pacus tratados com a benzocaína (AN2). O mesmo foi encontrado por WALSH e PEASE (2002), avaliando o óleo de cravo como anestésico para enguia (Anguilla reinhardtii), com tamanhos de 433-1065 mm, ao compararem o tempo médio de indução dos animais expostos ao óleo de cravo e à benzocaína. Estes autores observaram que na concentração de 60 mg/L, a 25°C, e salinidade de 18 g/L, o tempo de indução para o óleo de cravo foi significativamente menor do que o tempo de indução para a benzocaína. Nesta mesma concentração, o mentol (AN1) não se diferiu estatisticamente do AN2 e do AN3.
As respostas obtidas para o Tempo de Recuperação (TR), dos pacus anestesiados com AN1, AN2 e AN3, na concentração de 100 mg/L, não apresentaram diferenças significativas. Por outro lado, GONÇALVES et al., 2008, avaliando e eficiência do mentol, do eugenol e da benzocaína na indução à anestesia de juvenis de pacu, observaram que ocorreu diferença estatística no tempo de recuperação entre as concentrações de 100 mg/L de benzocaína e de eugenol. No entanto, para esta mesma concentração, não observaram diferença significativa para a mesma variável, entre o mentol e a benzocaína.
Na concentração de 150 mg/L, tanto o TI quanto o TR dos pacus anestesiados com AN1, AN2 e AN3 não foram diferentes estatisticamente.
Para a concentração de 200 mg/L, o TI dos pacus tratados com AN1 apresentou um aumento significativo em ralação ao TI dos peixes anestesiados com AN2. O TI dos animais anestesiados com AN3 não se diferiu estatisticamente dos que foram tratados com AN1 e AN2. Nessa mesma concentração, o TR dos pacus anestesiados com AN3 apresentou aumento significativo em relação ao TR dos animais tratados com AN1 e AN2. No entanto, o TR dos peixes tratados com AN1 não foi diferente estatisticamente do TR dos que foram tratados com AN2.
Para a concentração de 250 mg/L o TI dos peixes anestesiados com AN2 apresentou redução significativa em relação ao TI dos pacus anestesiados com o AN1. O TI dos animais tratados com AN3 não diferiu estatisticamente do TI dos que foram anestesiados com o AN1 e o AN2. O TR dos peixes anestesiados com o AN3, na dosagem de 250 mg/L, foi significativamente maior do que o TR dos pacus tratados com AN1 e AN2. Nessa mesma dosagem o TR do AN1 e do AN2 não se diferiram estatisticamente.
prolongado e um aumento do risco de mortalidade. Nessa mesma tabela, as dosagens de 100 e 150 mg/L, mesmo não havendo diferença estatística do AN3 em relação ao AN1 e o AN2, observa-se que há um aumento do TR do eugenol comparado aos outros anestésicos. A recuperação pode ser prolongada devido à natureza persistente do óleo de cravo na superfície das brânquias, aumentando efetivamente o tempo de exposição (SLADKY et al. 2001).
Na tabela 5 encontram-se as equações de regressão ajustadas das variáveis TI e TR em função das concentrações para os respectivos anestésicos.
TABELA 5.
ANESTÉSICOS VARIÁVEL EQUAÇÕES AJUSTADAS R2
AN1 TI Ŷ = 229, 6 -
AN2 TI Ŷ = 404, 0 – 1, 28C 0, 9142
AN3 TI Ŷ = - 1695, 06 + 298, 75 √C – 11, 515 C 0, 9960 ____________________________________________________________________________
AN1 TR Ŷ = 147, 33 -
AN2 TR Ŷ = 350 – 4 C + 0, 016 C2 0, 9505
AN3 TR Ŷ = 2311, 9 – 32,081 C + 0, 1236 C2 0, 9645
AN1 = MENTOL; AN2= BENZOCAÍNA; AN3 = EUGENOL; TI (tempo de indução em segundos); TR (tempo de recuperação em segundos).
recuperação (TR) dos peixes anestesiados com AN1, também foi uma constante, e seu valor é igual à média, 147,33 segundos (2,4 minutos).
Como as quatro concentrações de mentol avaliadas apresentaram a mesma eficiência para anestesiar os pacus, ou seja, todos os animais atingiram o mesmo estágio anestésico, e, uma vez que não houve diferença para o TI e o TR dentre essas dosagens testadas, 100 mg/L de mentol é a melhor para anestesiar pacu com 2,73 ± 0,51 kg. Esta concentração além de ser a mais segura para animal, é a mais rentável para o piscicultor ou produtor, em termos lucrativos.
GONÇALVES et al. (2008), observaram que as concentrações 50, 100, 150 e 200 mg/L de mentol levaram juvenis de pacu (110,5 ± 21,6 g) à anestesia profunda, e também concluíram que 100 mg/ L é a concentração ideal para anestesiar esses animais.
FIGURA 7.
O TR dos pacus anestesiados com benzocaína apresentou um comportamento quadrático (Figura 8). Para a concentração igual a 125 mg/L, o tempo mínimo de recuperação encontrado, através da equação de regressão ajustada, foi de 100 segundos. Os tempos de recuperação encontrados, através da equação de regressão ajustada, foram 110 s (para 100 e 150 mg/L), 190 s (para 200 mg/L) e 350 s (para 250 mg/L). Mesmo nas maiores dosagens (200 e 250 mg/L) de benzocaína, em que os pacus levaram maior tempo para se recuperarem, não ocorreu nenhuma complicação para estes animais. Os animais recuperados estavam visualmente saudáveis, sem nenhum sinal de injúria pelo corpo ou nadadeiras.
Como a recuperação prolongada de peixes submetidos à anestesia pode lhes trazer conseqüências ou danos fisiológicos, é desejável que esses animais se recuperem mais rapidamente. Os pacus anestesiados com 100 e 150 mg/L de benzocaína apresentaram o menor tempo de recuperação, sendo portanto mais seguro para esses peixes a utilização de 100 mg/L deste fármaco. Além disso, esta dosagem possui custo mais baixo para o piscicultor ou produtor.
Tempo de indução de pacus (Piaractus mesopotamicus) submetidos a diferentes concentrações de benzocaína.
Equação de Regressão Ajustada
Coeficiente deFIGURA 8.
Na Figura 9, observa-se que o TI dos animais anestesiados com óleo de cravo (AN3), demonstrou um comportamento raiz quadrada. Encontrou-se a concentração de 168,22 mg/L correspondente ao tempo máximo de indução igual a 242,66 segundos. Os tempos de indução encontrados através da equação de regressão ajustada, para as concentrações (100, 150, 200 250 mg/L) foram, 140,9 s; 236,6 s; 226,9 s e 149,8 s, respectivamente. O aumento das concentrações do óleo de cravo, não influenciou os tempos de indução dos pacus submetidos à anestesia com esse fármaco.
Segundo HISANO et al. (2008), as menores dosagens de óleo de cravo tendem a aumentar o tempo de indução. CUNHA e ROSA (2006), analisando o óleo de cravo em sete espécies de peixes tropicais, do mesmo modo, notaram que o tempo de indução para a menor concentração testada (20 mg/L) foi o maior (127,33 s).
Tempo de recuperação de pacus (Piaractus mesopotamicus) submetidos a diferentes concentrações de benzocaína.
Equação de Regressão Ajustada
Coeficiente deDeterminação
P = Ponto correspondente ao tempo mínimo de recuperação igual a 100 s, para a concentração igual a 125 mg/L.
FIGURA 9.
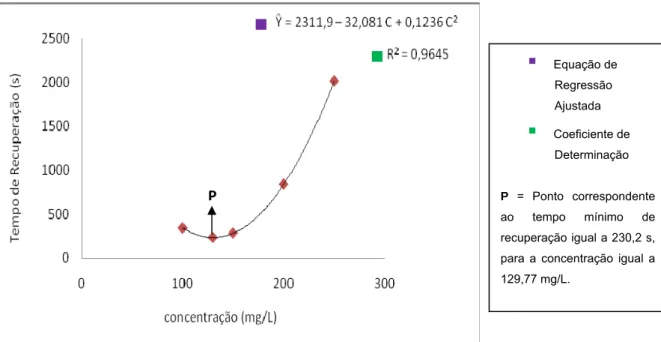
O TR dos pacus anestesiados com óleo de cravo apresentou um comportamento quadrático (Figura 10). A concentração de 129,7 mg/L, está relacionada ao TR mínimo igual a 230,20 segundos. Os pacus anestesiados com 200 e 250 mg/L de óleo de cravo apresentaram tempos de recuperação prolongados (839,7 s e 2016,6 s, respectivamente) em relação aos tempos de recuperação das concentrações de 100 e 150 mg/L (339,8 s e 280,7 s, respectivamente).
SLADKY et al. (2001) observaram que pacus, (Piaractus brachypomus), com 603.3 ± 61 g, submetidos à anestesia com eugenol nas concentrações de 100 e 200mg/L, apresentaram tempo de recuperação acima de 10 minutos e alguns foram reanimados com auxílio de oxigenação extra próximo da cavidade opercular. Segundo este mesmo autor, a recuperação pode ser prolongada devido à natureza persistente do óleo de cravo na superfície das brânquias, aumentando efetivamente o tempo de exposição. Neste trabalho, os animais submetidos às concentrações de 200 e 250 mg/L recuperam sem nenhum auxílio. Portanto, nessas dosagens, onde a concentração do óleo de cravo foi maior, provavelmente este pode ter se aderido por mais tempo na superfície Tempo de indução de pacus (Piaractus mesopotamicus) submetidos a diferentes concentrações de óleo de cravo.
P
Equação de Regressão Ajustada
Coeficiente deDeterminação
das brânquias, aumentando também o tempo de exposição e prolongando a recuperação dos pacus.
GONÇALVES et al. (2008), estudando juvenis de pacu com 110,5 ± 21,6 g, também observaram um tempo de recuperação prolongado nas concentrações mais elevadas de eugenol.
VIDAL et al. (2006) avaliou o eugenol como anestésico para juvenis de pintado (Pseudoplatystoma corruscans) com 27,76 ±7,7 g, e observaram que os tratamentos de 50, 75 e 100 mg/L levaram os animais ao estágio de anestesia profunda. Estes autores relataram que o tempo de recuperação dos animais anestesiados com de 75 e 100 mg/L, foi maior do que 10 minutos.
Como as dosagens de 100 e 150 mg/L de óleo de cravo apresentaram a mesma eficiência, pois induziram os pacus ao mesmo estágio anestésico (anestesia profunda), 100 mg/L apresentou maior segurança para o animal. Para as concentrações de 200 e 250 mg/L deste fármaco, que levaram os pacus ao estágio de anestesia cirúrgica, a melhor e mais segura foi a de 200 mg/L, uma vez que 250 mg/L obteve tempo de recuperação bem prolongado. Para o piscicultor ou produtor, é mais vantajoso utilizar 100 e 200 mg/L de óleo de cravo, para induzir o pacu na faixa de peso estudada aos referidos estágios.
FIGURA 10. Tempo de recuperação de pacus (Piaractus mesopotamicus) submetidos a diferentes concentrações de óleo de cravo.
P
Equação de Regressão Ajustada
Coeficiente deDeterminação
O mentol, a benzocaína e o óleo de cravo são anestésicos que podem ser aplicados durante o manejo da reprodução induzida em pacu. E, estes fármacos podem ainda, em doses menores, ser utilizados para o transporte destes animais, dos tanques onde ficam alocados para o laboratório onde será feito esse procedimento.
5.2 Tilápia-do-nilo da linhagem chitralada
As temperaturas médias da água do tanque onde as tilápias foram acondicionadas antes da anestesia, da caixa de indução à anestesia e a do tanque de recuperação foram, em média, 17,46 ± 2,31 °C; 20,46 ± 2,32 °C e 16,49 ± 0,57 °C, respectivamente.
As concentrações de 100 e 150 mg/L do mentol induziram as tilápias à anestesia profunda, e as dosagens de 200 e 250 mg/L deste anestésico induziram os animais à anestesia cirúrgica. Todas as concentrações testadas de benzocaína induziram os peixes à anestesia cirúrgica. Todas as tilápias testadas com óleo de cravo, em todas as concentrações, atingiram o estágio de anestesia profunda.
Todas as tilápias que chegaram ao estágio de anestesia profunda movimentaram o opérculo regular e lentamente, durante a biometria.
Durante a biometria, as tilápias testadas com 200 e 250 mg/L de mentol, e 250 mg/L de benzocaína, não movimentaram o opérculo, e, os animais testados com 100, 150 e 200 mg/L de benzocaína, movimentaram o opérculo irregularmente.
anestesia voltada para biometria e inspeção visual do animal, a concentração mais adequada foi 150-200 mg/L.
Na tabela 6 estão descritos os valores do tempo de indução e do tempo de recuperação para as concentrações e anestésicos. Verifica-se que houve efeito significativo para todas as fontes de variação tanto para o tempo de indução quanto para o tempo de recuperação.
TABELA 6.
___________________________________________________________________________
QUADRADOS MÉDIOS ______________________________________
F.V GL TI TR
___________________________________________________________________________ AN 2 138305.1** 1172026.0**
Resíduo (a) 6 14321.47 57005.75
C 3 5979.21* 221024.0**
AN x C 6 12400.38** 95004.86**
Resíduo (b) 18 1390.32 21733.38 __________________________________________________________________________
C.V. (%) Parcela 58.44 44.18
C.V. (%) Subparcela 18.21 27,28 __________________________________________________________________________ ** F significativo ao nível de 1% de probabilidade.
* F significativo ao nível de 5% de probabilidade.
NS. F não F significativo ao nível de 5% de probabilidade.
Na tabela 7 encontramos as médias das variáveis tempos de indução (TI) e de recuperação (TR) em segundos, para as concentrações (C) e tipo de anestésicos (AN).
TABELA 7.
TI TR
___________________________ __________________________________
C AN1 AN2 AN3 AN1 AN2 AN3 100 260a 266a 170a 100b 185b 800a
150 420a 146b 98b 180b 594.3a 840a
200 275.6a 179.3ab 101.6b 363a 606.3a 585a
250 323.3a 158b 59b 299.3c 715.6b 1215.3a _____________________________________________________________________________ As médias com pelo menos uma mesma letra na linha para cada variável não diferem entre si ao nível de 10% de probabilidade pelo teste de TUKEY;
TI = tempo de indução em segundos; TR = tempo de recuperação em segundos; C= concentração em mg/L; AN1= Mentol; AN2= Benzocaína; AN3= Eugenol.
Para a concentração de 100 mg/L, os valores médios dos TI das tilápias anestesiadas com AN1, AN2 e AN3 não diferiram estatisticamente. Nessa mesma concentração, o TR dos peixes tratados com AN3 apresentou um aumento significativo em relação aos TR das tilápias anestesiadas com o AN1 e com o AN2. As tilápias testadas com AN1 e AN2 não apresentaram diferença estatística para a variável TR.
Na dosagem de 150 mg/L, o TI dos peixes tratados com AN1 diferiu estatisticamente do TI dos que foram anestesiados com AN2 e AN3. E, o TI dos animais tratados com o AN2 e com o AN3 não diferiram estatisticamente. O TR das tilápias anestesiadas com AN1, nessa concentração, mostrou redução significativa comparado aos TR dos peixes tratados com o AN2 e o AN3. Já, o TR dos peixes anestesiados com AN2 não foi diferente estatisticamente do TR dos animais anestesiados com AN3.
O TI dos animais tratados com AN1 diferiu significativamente do TI dos peixes que foram testados com o AN3, na concentração de 200 mg/L. Esta variável, para as tilápias tratadas com AN2 e AN3, não foi diferente estatisticamente. As respostas obtidas para o TR, nessa mesma concentração,
para as tilápias tratadas com os três anestésicos, não apresentaram diferenças significativas.
Para a concentração de 250 mg/L, o TI dos animais anestesiados com o AN1 apresentou aumento significativo do TI dos peixes tratados com AN2 e AN3. O TI das tilápias tratadas com AN2 não diferiu estatisticamente das que foram anestesiadas com AN3.
As respostas do TR, para as tilápias testadas com os três anestésicos, foram diferentes estatisticamente. COTTER e RODNICK et al. (2006) não encontraram diferença significativa no tempo de recuperação à anestesia em truta arco-íris (Oncorhynchus mykiss), ao avaliarem o eugenol e a benzocaína, respectivamente nas concentrações de 25 e 108 mg/L.
Na tabela 7, pode-se observar que o TI do AN3, mesmo onde não foi apresentada nenhuma redução significativa, foi o menor em relação aos anestésicos AN1 e AN2, em todas as concentrações avaliadas. Isto pode evidenciar que o óleo de cravo possa ser um anestésico mais potente para a tilápia-do-nilo da linhagem chitralada quando comparado ao mentol e à benzocaína. Em relação ao TR das tilápias anestesiadas com AN3, observou-se que nas concentrações de 100, 150 e 250 mg/L, esta variável foi maior quando comparada ao TR das tilápias anestesiadas com AN1 e AN2, mesmo onde não ocorreu diferença significativa. A recuperação dos peixes anestesiados com o óleo de cravo pode ser prolongada devido à natureza persistente deste anestésico na superfície das brânquias, aumentando efetivamente o tempo de exposição (SLADKY et al., 2001).
TABELA 8.
ANESTÉSICOS VARIÁVEL EQUAÇÕES AJUSTADAS R2
AN1 TI Ŷ = 319, 75 -
AN2 TI Ŷ = 560, 4 – 4, 03C + 0, 0098 C2 0, 7547
AN3 TI Ŷ = 222, 43 – 0, 658C 0, 8496 ______________________________________________________________________
AN1 TR Ŷ = -37, 76 + 1, 56C 0, 7301
AN2 TR Ŷ = - 861, 06 + 13,7C – 0, 03 C2 0, 9251
AN3 TR Ŷ = 2136, 65 – 18, 67C + 0, 059 C2 0, 6616
AN1= MENTOL; AN2= BENZOCAÍNA; AN3 = EUGENOL; TI (tempo de indução em segundos); TR (tempo de recuperação em segundos).
O tempo de indução (TI) das tilápias anestesiadas com o mentol (AN1) foi constante, sendo seu valor igual a média (319,75 s). SIMÕES e GOMES (2009), encontraram em juvenis de tilápia-do-nilo (Oreochromis niloticus), um tempo médio de indução (540 s) maior para a concentração de 250 mg/L, que também levou o animal ao estágio de anestesia cirúrgica. Estes mesmos autores encontraram um tempo de indução para as concentrações de 150 e 200 mg/L menor do que o obtido para a tilápia tailandesa.
O tempo de recuperação (TR) das tilápias anestesiadas com o AN1 demonstrou um comportamento linear crescente em função da concentração (Figura 11). Neste caso, a cada 1 mg/L do anestésico, o TR terá um aumento de 1,56 segundos. Os valores encontrados, através da equação de regressão ajustada, para os tempos de recuperação nas concentrações 100, 150, 200 e 250 mg/L, foram 118,24 s; 196,24 s; 274,24 s e 352,24 s, respectivamente.
Como o TI das tilápias testadas com as quatro concentrações de mentol foi o mesmo, deve-se levar em consideração os menores tempos de recuperação para as dosagens que levaram esses animais ao mesmo estágio
de anestesia. Portanto, 100 mg/L de mentol foi a melhor dosagem para induzir tilápia tailandesa com 0,122 ± 0,04 Kg , ao estágio de anestesia profunda. E, para a indução deste peixe ao estágio de anestesia cirúrgica a melhor dosagem foi 200 mg/L. As dosagens de 100 e 200 mg/L de mentol são mais seguras para induzir tilápia tailandesa, cada uma em seu respectivo estágio anestésico, e também mais rentáveis para o piscicultor ou produtor em termos lucrativos.
FAÇANHA e GOMES (2005) avaliaram a eficácia do mentol para juvenis de tambaqui, Colossoma macropomum, (88,69 ± 23,85 g), e determinaram que a melhor concentração de mentol para anestesia cirúrgica foi de 150 mg/L, uma vez que o tempo de indução foi menor, porém a recuperação foi significativamente mais demorada do que para as menores concentrações testadas. E, para uma sedação com finalidade de biometria, estes autores observaram que 100 mg/L foi a melhor concentração.
FIGURA 11.
O TI das tilápias anestesiadas com a benzocaína (AN2), apresentou um comportamento quadrático (Figura 12). A concentração de 205,6 mg/L
Tempo de recuperação de tilápias-do-nilo tailandesas (Oreotchromis niloticus) submetidas a diferentes concentrações de mentol.
Equação de Regressão Ajustada
Coeficiente decorresponde ao TI mínimo igual a 146,09 segundos. Os tempos de indução encontrados, através da equação de regressão ajustada, de acordo com suas respectivas dosagens, foram: 100 mg/L (225,4 s), 150 mg/L (176,4 s), 200 mg/L (146,4 s) e 250 mg/L (165,4 s).
FIGURA 12.
A Figura 13 demonstra que, o tempo de recuperação para os animais anestesiados com benzocaína também exibiu um comportamento quadrático. A concentração de 228,33 mg/L é equivalente ao TR máximo igual a 703,02 segundos. Os tempos de recuperação encontrados através da equação de regressão ajustada, para as concentrações de 100, 150, 200 e 250 mg/L foram 208,94 s; 518,94 s; 678,94s e 688,94 s, respectivamente.
Como as dosagens de benzocaína testadas tiveram a mesma eficiência pois induziram as tilápias tailandesas, na faixa de peso estudada, ao mesmo estágio anestésico, 100 mg/L deste fármaco mesmo apresentado o maior TI, obteve o menor TR, e, levando em consideração que é desejável que o peixe submetido à anestesia se recupere mais rapidamente, esta concentração foi a Tempo de indução de tilápias-do-nilo (Oreochromis niloticus) tailandesas submetidas a diferentes concentrações de benzocaína.
Equação de Regressão Ajustada
Coeficiente deDeterminação
P = Ponto correspondente ao tempo mínimo de indução igual a 146,09 s, para a concentração igual a 205,6 mg/L.
melhor para induzir as tilápias tailandesas à anestesia cirúrgica.E, 100 mg/L de benzocaína também apresenta maior segurança para anestesiar tilápias tailandesas, e para o piscicultor é mais rentável financeiramente.
DELBON et al. (2006), recomendou as dosagens de 100 e 150 mg/L de benzocaína, para tilápia do nilo com 108,28 ± 11,65g, à 23ºC.
GOMES et al. (2001), também consideraram as concentrações de
benzocaína de 100-150 mg/L ideais para juvenis de tambaqui (Colossoma
macropomum),com peso médio de 9,32 ± 3,70 g.
FIGURA 13.
A figura 14, obtida através da equação de regressão ajustada (Tabela 8), mostra que o TI das tilápias anestesiadas com eugenol (AN3) apresentou um comportamento linear decrescente em função da concentração. A cada acréscimo de 1 mg/L do anestésico, o TI diminui 0,658 segundos. Isto demonstra que, o aumento da concentração de eugenol influenciou o tempo de indução à anestesia em tilápias-do-nilo tailandesas. Os tempos de indução
Tempo de recuperação de tilápias-do-nilo (Oreochromis niloticus) tailandesas submetidas a diferentes concentrações de benzocaína.
P
Equação de Regressão Ajustada
Coeficiente deDeterminação
encontrados através da equação, das concentrações 100, 150, 200, 250 mg/L foram 156,63 s; 123,73 s; 90,83 s e 57,93 s, respectivamente.
Na figura 14, é possível visualizar que o tempo de indução foi maior para as menores concentrações de óleo de cravo. HISANO et al. (2008), avaliando o tempo de indução e de recuperação em juvenis de dourados (Salminus brasiliensis), também encontraram maior tempo de indução nas menores dosagens.
FIGURA 14.
Na Figura 15, observa-se que o TR das tilápias anestesiadas com AN3, mostrou um comportamento quadrático. A concentração de 158,22 mg/L está relacionada ao TR mínimo de 659,66 segundos. Os tempos de recuperação encontrados através da equação de regressão ajustada, para as dosagens de 100, 150, 200, 250 foram 859,65 s; 663,65 s; 762,65 s e 1156,65 s, respectivamente. Os tempos de recuperação das tilápias anestesiadas com o óleo de cravo foram bem prolongados. A recuperação pode ser prolongada
Tempo de indução de tilápias-do-nilo (Oreochromis niloticus) tailandesas submetidas a diferentes concentrações de óleo de cravo.
Equação de Regressão Ajustada
Coeficiente dedevido à natureza persistente do óleo de cravo na superfície das brânquias, aumentando efetivamente o tempo de exposição (SLADKY et al., 2001). As concentrações tiveram menor influência no tempo e recuperação.
A dosagem de 150 mg/l de óleo de cravo foi a mais eficiente para anestesiar tilápia-do-nilo da linhagem chitralada na faixa de peso estudada, pois apresentou o menor TR.
PEREIRA-da-SILVA et al. (2009), avaliando o efeito do óleo de cravo em alevinos de lambari com 0,6±0,1g, observaram o mesmo comportamento descrito no atual trabalho, para o tempo de indução à anestesia profunda e o tempo de recuperação.
Outros autores também verificaram que o tempo de indução à anestesia de peixes diminuiu à medida que se aumentou a concentração, porém, não examinaram influência das concentrações no tempo de recuperação (INOUE et al., 2003; VIDAL et al., 2006; VIDAL et al., 2007a).
FIGURA 15.
Nas figuras 12, 13, 14 e 15, comparando-se as concentrações similares dos anestésicos, o eugenol possui tempo de indução menor, porém maior tempo de recuperação em relação à benzocaína. Por exemplo, o TI das concentrações de 100 e 250mg/L, do eugenol e da benzocaína, foram, respectivamente, 156,63 s e 57,93 s; e 225,4 s e 165,4 s. Os tempos de recuperação do eugenol e da benzocaína, nessas mesmas concentrações foram: 859,6 s e 1156,6 s; e, 208,94 s e 688,94 s, respectivamente.
Esses resultados corroboram com os de DELBON (2006), ao comparar concentrações semelhantes do óleo de cravo e da benzocaína, em tilápia do nilo (Oreochromis niloticus). SLADKY et al. (2001), encontraram os mesmo resultados ao compararem os tempos de indução e de recuperação do óleo de cravo e do MS-222.
Tempo de recuperação de tilápias-do-nilo (Oreochromis niloticus) tailandesas submetidas a diferentes concentrações de óleo de cravo.
Equação de Regressão Ajustada
Coeficiente deDeterminação
P = Ponto correspondente ao tempo mínimo de recuperação igual a 659,66 s, para a concentração igual a 158,22 mg/L.