PROGRAMA DE PÓS-GRADUAÇÃO EM SISTEMÁTICA E EVOLUÇÃO
DIVERSIDADE DE SEIRINI
(COLLEMBOLA, ARTHROPLEONA, ENTOMOBRYIDAE)
EM ÁREAS ÚMIDAS DA CAATINGA
________________________________________________
Dissertação de Mestrado
Natal/RN, março de 2013
D
IVERSIDADE DES
EIRINI(C
OLLEMBOLA,
A
RTHROPLEONA,
E
NTOMOBRYIDAE)
EM
Á
REASÚ
MIDAS DAC
AATINGAOrientador: Bruno Cavalcante Bellini
N
ATAL/RN
Catalogação da Publicação na Fonte Universidade Federal do Rio Grande do Norte – UFRN Catalogação de Publicação na Fonte. UFRN – Biblioteca Setorial do Centro de Biociências – CB
Godeiro, Nerivânia Nunes.
Diversidade de Seirini (Collembola, Arthropleona, Entomobryidae) em áreas úmidas da Caatinga / Nerivânia Nunes Godeiro. – Natal, 2013.
90 f.: il.
Orientador: Prof. Dr. Bruno Cavalcante Bellini.
Dissertação (Mestrado) – Universidade Federal do Rio Grande do Norte. Centro de Biociências. Programa de Pós-Graduação em Sistemática e Evolução.
1. Fauna de Solo – Dissertação. 2. Novas espécies – Dissertação. 3. Taxonomia – Dissertação. I. Bellini, Bruno Cavalcante. II. Universidade Federal do Rio Grande do Norte. III. Título.
D
IVERSIDADE DES
EIRINI(C
OLLEMBOLA,
A
RTHROPLEONA,
E
NTOMOBRYIDAE)
EM
Á
REASÚ
MIDAS DAC
AATINGADissertação apresentada ao Programa de Pós-graduação em Sistemática e Evolução da Universidade Federal do Rio Grande do Norte, em cumprimento às exigências para obtenção do título de Mestre em Sistemática e Evolução.
Aprovada em: 25 de março de 2013.
B
ANCA EXAMINADORA:______________________________________________________ Dr.Douglas Zeppelini Filho – UEPB
______________________________________________________ Dr. Eduardo Assis Abrantes – USP
“Dar o melhor de si é mais importante do que ser o melhor.”
A
GRADECIMENTOSA realização desta dissertação marca o fim de uma importante etapa em minha vida. Gostaria de agradecer a todos aqueles que contribuíram de forma decisiva para sua concretização:
Ao Programa de Pós-Graduação em Sistemática e Evolução (PPGSE), pela oportunidade e por todos os meios colocados à disposição para que o trabalho fosse desenvolvido.
Ao meu orientador, Doutor Bruno Cavalcante Bellini, pela oportunidade que me deu ao me aceitar como aluna. Por me apresentar os colêmbolos, organismos tão pequenos, mas com um enorme valor científico. Pela paciência, atenção e amizade, qualidades que tornam um simples professor um grande orientador.
Ao Programa de Pesquisa em Biodiversidade (PPBio) Invertebrados, pelo financiamento das coletas do material utilizado neste trabalho.
Ao corpo docente integrante do PPGSE, pelo conhecimento repassado nas disciplinas tão brilhantemente ministradas.
Aos integrantes da banca examinadora, por aceitarem o convite e colaborarem com a minha formação profissional.
Agradeço à Professora Maria Cleide de Mendonça (Museu Nacional/RJ), que apesar de tê-la conhecido rapidamente, criei uma grande admiração pela profissional que vem dedicando a vida ao estudo dos colêmbolos.
À minha avó Railda Godeiro, por ter assumido o papel de pai e mãe na minha vida, me ensinando os valores que um bom ser humano deve ter. A ela devo também o meu comportamento independente, pois desde cedo soube resolver meus problemas e correr atrás dos meus objetivos.
À Ellis Regina Godeiro e José Nerivan Nunes, meus pais, que mesmo distantes participaram da minha existência.
À Tomaz Gonzaga, meu noivo, que há sete anos entrou na minha vida fazendo meus dias mais felizes. Agradeço por todo o amor dedicado a mim e pela compreensão quando eu precisei ficar no laboratório ou em casa me dedicando ao projeto. Obrigada pelo apoio, por me ensinar a vetorizar os desenhos e por estar sempre ao meu lado.
R
ESUMOA família Entomobryidae é uma das mais diversas famílias de Collembola do Nordeste Brasileiro. Dados sobre sua diversidade podem ser considerados subestimados devido ao baixo esforço de coleta na região. No presente estudo, foram realizadas coletas em cinco localidades do Nordeste, nunca antes amostradas, objetivando avaliar a riqueza de espécies desta família. O estudo foi feito na Serra da Jibóia, município de Santa Teresinha, Bahia; Serra das Confusões, município de Caracol, Piauí; Chapada do Araripe, munícipio do Crato, Ceará; Mata do Pau-Ferro, município de Areia, Paraíba; e Parque Nacional de Ubajara, município de Ubajara, Ceará, todas consideradas áreas úmidas da Caatinga. As coletas foram feitas utilizando-se armadilhas de queda do tipo
pitfall e aspiradores entomológicos. Todo o material coletado foi triado, montado em lâminas, identificado e, por fim, foram feitas as descrições de algumas das espécies novas encontradas. Um total de 48 espécies de Entomobryidae pertencentes a nove gêneros foram registradas e 27 destas são espécies novas para a ciência, o que representa um percentual de 56,25% do total. Um novo registro de espécie para o Brasil foi identificado e novos registros para os estados foram feitos. O gênero que possuiu distribuição mais ampla foi Seira, o único encontrado em todas as áreas e o mais representativo com o maior número de espécies registradas (26). Esse resultado já era esperado, pois indivíduos do gênero Seira possuem uma boa adaptabilidade a ambientes semi-áridos, fato que já foi comprovado em pesquisas anteriores. Sete novas espécies do gênero Seira foram descritas. Uma chave dicotômica de identificação dos gêneros e espécies de Seirini com ocorrência no Brasil foi elaborada. Este trabalho demonstrou o grande potencial de Entomobryidae e Seirini no Nordeste, visto que, apesar de ter sido realizado em áreas bem restritas, obteve resultados importantes para o conhecimento da fauna do grupo.
PALAVRAS-CHAVE: Chave de identificação, fauna de solo, novas espécies, Seira,
A
BSTRACTThe family Entomobryidae is one of the most diverse families of Collembola in Northeast Brazil. Data on its diversity may be considered undervalued due to low collection efforts in the region. In this study, five areas in the Northeast region were sampled, to evaluate the species richness of this family. The study was done in the Serra da Jibóia, Santa Terezinha municipality, Bahia; Serra das Confusões, Caracol municipality, Piauí; Chapada do Araripe, Crato municipality, Ceará; Mata do
Pau-Ferro, Areia municipality, Paraíba and Parque Nacional de Ubajara, Ubajara municipality, Ceará, all considered humid areas of Caatinga. Collections were made using pitfall traps and entomological aspirators. All the collected material was screened, mounted on slides, identified and, finally, the descriptions of some of the new species encountered were made. A total of 48 Entomobryidae species belonging to nine genera were recorded and 27 of these were new to science, representing a percentage of 56.25% of the total. A new record for Brazil was identified and several new records were made to the States. Seira was the genus with wider distribution and it was the only one found in all areas and the most representative with the highest number of recorded species (26). This result was expected, because individuals of the genus Seira have a good adaptability to semi-arid environments, a fact that has already been proven in previous research. Seven new species of Seira were described. A dichotomous key to genera and species of Seirini from Brazil was drafted. This work demonstrates the great potential of Entomobryidae and Seirini in the Northeast, despite having been held in very restricted areas, obtained important results for the knowledge of fauna of the group.
S
UMÁRIO1. Introdução ... 14
1.1 Biologia do solo ... 14
1.2 Classe Collembola ... 16
1.3 Família Entomobryidae ... 19
1.4 Tribo Seirini ... 21
1.5 Caatinga ... 22
1.6 Áreas úmidas da Caatinga... 25
1.7 Estudos de diversidade de Collembola no Nordeste ... 26
2. Justificativa ... 27
3. Objetivos ... 27
3.1 Objetivo geral ... 27
3.2 Objetivos específicos ... 28
4. Metodologia ... 28
4.1 Áreas de coleta ... 28
4.1.1 Serra da Jibóia, município de Santa Teresinha, Bahia ... 30
4.1.2 Serra das Confusões, município de Caracol, Piauí ... 30
4.1.3 Chapada do Araripe, munícipio do Crato, Ceará ... 31
4.1.4 Mata do Pau-Ferro, município de Areia, Paraíba ... 32
4.1.5 Parque Nacional de Ubajara, município de Ubajara, Ceará ... 33
4.2 Métodos de coleta e identificação ... 34
5. Resultados ... 37
5.1. Lista de espécies da família Entomobryidae ... 37
5.2. Novas espécies ... 41
5.2.1 Seira sp. n. 1... 41
5.2.2 Seira sp. n. 6... 44
5.2.3 Seira sp. n. 7... 47
5.2.4 Seira sp. n. 10 ... 50
5.2.5 Seira sp. n. 16 ... 53
5.2.6 Seira sp. n. 17 ... 56
5.2.7 Seira sp. n. 18 ... 59
5.3.1. Chave para gêneros de Seirini do Brasil ... 63
5.3.2. Diagnoses dos gêneros de Seirini do Brasil ... 64
5.3.3. Chave para espécies de Lepidosira do Brasil ... 65
5.3.4. Chave para espécies de Tyrannoseira do Brasil ... 66
5.3.5. Chave para espécies de Seira do Brasil ... 68
6. Discussão ... 76
6.1 Lista de espécies ... 76
6.2 Novas espécies ... 79
6.2.1 Seira sp. n. 1... 79
6.2.2 Seira sp. n. 6... 79
6.2.3 Seira sp. n. 7... 80
6.2.4 Seira sp. n. 10 ... 80
6.2.5 Seira sp. n. 16 ... 81
6.2.6 Seira sp. n. 17 ... 81
6.2.7 Seira sp. n. 18 ... 82
7.Conclusões ... 82
Í
NDICE DEF
IGURASFigura 1. Principais grupos edáficos, mostrando suas inter-relações alimentares
(adaptado de RUITER et al., 1995). ... 14
Figura 2. Anatomia de um colêmbolo Entomobryomorpha (Adaptado de CHRISTIANSEN & BELLINGER, 2003). ... 17
Figura 3. Número de espécies de Collembola descritas por ano. Modificado de DEHARVENG, 2004. ... 18
Figura 4. Um entomobriídeo: Seira mendoncea Bellini & Zeppelini, 2008. Ilustração de Thomaz Carvalho... 20
Figura 5. Áreas prioritárias para a conservação da biodiversidade biológica da Caatinga, exceto as áreas insuficientemente conhecidas (Adaptado de SILVA et al., 2002) ... 23
Figura 6. Perfil esquemático dos brejos de altitude (aqui representado pelo Planalto da Borborema) no Nordeste do Brasil. (Fonte: Tabarelli & Santos 2004) ... 25
Figura 7. Número de espécies registradas no Estado da Paraíba distribuído pelas respectivas famílias. Retirado de Bellini & Zeppelini, 2009. ... 26
Figura 8. Número de espécies por família de colêmbolos identificadas no Rio Grande do Norte. Retirado de Santos-Rocha e colaboradores (2011). ... 27
Figura 9. Mapa do Brasil, em destaque, os estados da região Nordeste. Os marcadores vermelhos indicam os municípios onde foram realizadas as coletas. ... 29
Figura 10. Serra da Jibóia. Foto: Iuri Tarcísio Brito ... 30
Figura 11. Serra das confusões. Foto: Carlos César Durigan ... 31
Figura 12. Chapada do Araripe. Foto: Isário Galvão ... 32
Figura 13. Areia/PB. Foto de Fagnner Gregório ... 33
Figura 14. Parque Nacional de Ubajara/CE. Foto: Edilson Morais Brito ... 34
Figura 15. Modelo de distribuição de macroquetas cefálicas e dorsais de acordo com Christiansen & Bellinger (2000), modificado de Jacquemart (1974). ... 36
Figura 16. Total de espécies por área ... 40
Figura 17. Número de espécies de Entomobryidae por gênero coletadas em cada área de estudo. ... 41
Primeiro complexo empodial; G. Segundo complexo empodial; H. Terceiro complexo empodial; I. Dente e mucro. ... 42
Figura 19. Seira sp. n. 1: Quetotaxia dorsal detalhada do segundo e terceiro segmentos abdominais. ... 43
Figura 20. Seira sp. n. 1: Distribuição de macroquetas dorsais. ... 43
Figura 21. Seira sp. n. 6: A. Hábito; B. Bulbo apical do quarto segmento antenal; C. Mancha ocular esquerda; D. Cerdas do triângulo labial; E. Orgão trocanteral; F. Primeiro complexo empodial; G. Segundo complexo empodial; H. Terceiro complexo empodial; I. Dente e mucro. ... 45
Figura 22. Seira sp. n. 6: Quetotaxia dorsal detalhada do segundo e terceiro segmentos abdominais. ... 46
Figura 23. Seira sp. n. 6: Distribuição de macroquetas dorsais. ... 46
Figura 24. Seira sp. n. 7: A. Hábito; B. Bulbo apical do quarto segmento antenal; C. Mancha ocular esquerda; D. Cerdas do triângulo labial; E. Orgão trocanteral; F. Primeiro complexo empodial; G. Segundo complexo empodial; H. Terceiro complexo empodial; I. Dente e mucro. ... 48
Figura 25. Seira sp. n. 7: Quetotaxia dorsal detalhada do segundo e terceiro segmentos abdominais. ... 49
Figura 26. Seira sp. n. 7: Distribuição de macroquetas dorsais. ... 49
Figura 27. Seira sp. n. 10: A. Hábito; B. Bulbo apical do quarto segmento antenal; C. Mancha ocular esquerda; D. Cerdas do triângulo labial; E. Orgão trocanteral; F. Primeiro complexo empodial; G. Segundo complexo empodial; H. Terceiro complexo empodial; I. Dente e mucro. ... 51
Figura 28. Seira sp. n. 10: Quetotaxia dorsal detalhada do segundo e terceiro segmentos abdominais. ... 52
Figura 29. Seira sp. n. 10: Distribuição de macroquetas dorsais. ... 52
Figura 30. Seira sp. n. 16: A. Hábito; B. Bulbo apical do quarto segmento antenal; C. Mancha ocular esquerda; D. Cerdas do triângulo labial; E. Orgão trocanteral; F. Colóforo; G. Primeiro complexo empodial; H. Segundo complexo empodial; I. Terceiro complexo empodial; J. Cerdas abaoladas do manúbrio; K. Dente e mucro. .. 54
Figura 31. Seira sp. n. 16: Quetotaxia dorsal detalhada do segundo e terceiro segmentos abdominais. ... 55
Figura 32. Seira sp. n. 16: Distribuição de macroquetas dorsais. ... 55
Figura 34. Seira sp. n. 17: A. Hábito; B. Bulbo apical do quarto segmento antenal; C. Mancha ocular esquerda; D. Cerdas do triângulo labial; E. Orgão trocanteral; F. Primeiro complexo empodial; G. Segundo complexo empodial; H. Terceiro complexo
empodial; I. Dente e mucro. ... 57
Figura 35. Seira sp. n. 17: Quetotaxia dorsal detalhada do segundo e terceiro segmentos abdominais. ... 58
Figura 36. Seira sp. n. 17: Distribuição de macroquetas dorsais. ... 58
Figura 37. Hábito de Seira sp. n. 18 em álcool. ... 59
Figura 38. Seira sp. n. 18: A. Hábito; B. Bulbo apical do quarto segmento antenal; C. Mancha ocular esquerda; D. Cerdas do triângulo labial; E. Orgão trocanteral; F. Primeiro complexo empodial; G. Segundo complexo empodial; H. Terceiro complexo empodial; I. Cerdas abaoladas do manúbrio; J. Dente e mucro. ... 60
Figura 39. Seira sp. n. 18: Quetotaxia dorsal detalhada do segundo e terceiro segmentos abdominais. ... 61
Figura 40. Seira sp. n. 18: Distribuição de macroquetas dorsais. ... 61
Figura 41. Mucro de Lepidosira minima Salmon, 1938 ... 63
Figura 42. Mucro falcado ... 63
Figura 43. Fêmur (A) e tibiotarso (B) do primeiro par de pernas em Tyrannoseira (Retirado de Bellini & Zeppelini, 2011) . ... 63
Figura 44. Hábito de Lepidosira villasboasi (retirado de Arlé e Guimarães, 1981) ... 64
Figura 45. Hábito de Tyrannoseira diabolica (Retirado de Bellini & Godeiro, 2012) . 64 Figura 46. Hábito de Seira mendoncea (retirado de Bellini & Zeppelini, 2008) ... 65
Figura 47. Metatórax de L. villasboasi ... 65
Figura 48. Metatórax de L. tapuia ... 66
Figura 49. Fêmur do primeiro par de pernas em Tyrannoseira bicolorcornuta ... 66
Figura 50. Região cefálica 2 de Tyrannoseira raptora ... 67
Figura 51. Região cefálica 2 de Tyrannoseira gladiata ... 67
Figura 52. Região cefálica 6 de Tyrannoseira diabolica... 67
Figura 53. Região cefálica 6 de Tyrannoseira sex ... 67
Figura 55. Detalhe da região B do Abd. II de S. praiana ... 68
Figura 56. Metatórax de S. mirianae ... 68
Figura 57. Metatórax de Seira sp. n. 17... 69
Figura 58. Macroquetas abauladas na parte distal do manúbrio e proximal do dente. . 69
Figura 59. Hábito de S. nigrans ... 69
Figura 60. (A) Hábito de S. xinguensis (B) Detalhe da linha lateral cefálica. ... 70
Figura 61. Abd. I de S. prodiga ... 70
Figura 62. Abd. I de Seira sp. n. 18... 70
Figura 63. Abd. I de Seira sp. n. 16... 70
Figura 64. Unguículus truncado ... 71
Figura 65. Unguículus acuminado. ... 71
Figura 66. Detalhe da região A do Abd. II de S. arenicola ... 71
Figura 67. Detalhe da região 2 do mesotórax de S. mendoncea ... 72
Figura 68. Detalhe da região 2 do mesotórax de S. ritae ... 72
Figura 69. Detalhe da região A do Abd. II de Seira sp. n. 1... 72
Figura 70. Detalhe da região A do Abd. II de S. melloi ... 72
Figura 71. Detalhe da região cefálica 6 de S. mataraquensis ... 73
Figura 72. Detalhe da região cefálica 6 de Seira sp. n. 7 ... 73
Figura 73. Detalhe da região cefálica 6 de Seira sp. n. 10 ... 74
Figura 74. Detalhe da região cefálica 6 de Seira sp. n. 6 ... 74
Figura 75. Detalhe da região A do Abd. III de S. paraibensis ... 74
Figura 76. Detalhe da região A do Abd. III de S. pseudoannulata ... 75
Figura 77. Abd. I de S. nunezae ... 75
Figura 78. Detalhe da região A do Abd. II de S. potiguara ... 75
Figura 79. Detalhe da região cefálica 6 de S. brasiliana ... 76
Í
NDICE DE TABELASTabela 1. Unidades de Conservação existentes na Caatinga (Fonte: IBAMA). ... 24
Tabela 2. Dados relevantes sobre os locais de coleta de Seirini na Caatinga. ... 29
Tabela 3. Lista de espécies de colêmbolos registrados nas referidas localidades de coleta. ... 38
Tabela 4. Espécies do gênero Seira não incluídas na chave de identificação. ... 62
1.
I
NTRODUÇÃO1.1 Biologia do solo
O solo é um ecossistema de alta biodiversidade, o que se deve a grande quantidade de indivíduos edáficos que em conjunto com as diversas formas e funções das raízes das plantas influenciam diretamente o funcionamento do solo. A diversidade de organismos edáficos é muito maior do que a dos organismos que vivem acima dele, contrariando a quantidade de estudiosos, que é muito inferior (HEYWOOD, 1995). Essa vasta quantidade de organismos pode ser reunida com base em seu grupo funcional, que leva em consideração sua preferência alimentar, nichos ocupados e outros parâmetros da história de vida. Juntos, esses grupos formam complexas teias alimentares (RUITER et al., 1994; 1995; fig. 1). Tais organismos edáficos regulam importantes processos nos ecossistemas, como por exemplo, o controle do volume de matéria orgânica e a mineralização de nutrientes. Estes organismos também possuem um papel fundamental em regular o funcionamento do ecossistema, através de um
“feedback” entre a parte subterrânea e a superfície do solo, o que torna ambos ambientes (o edáfico e supra-edáfico) interconectados ecologicamente (BARDGETT et al., 1998; HOOPER et al., 2000; VAN DER PUTTEN et al., 2001; WORM, 2002).
Estudos da taxonomia, sistemática, diversidade e ecologia de organismos são indispensáveis para o entendimento da diversidade biológica dos ecossistemas e seu funcionamento. Informações sobre organismos que habitam o solo são escassas, quando comparadas com organismos de superfície, especialmente do ponto de vista taxonômico. As principais razões dessa escassez de informações são a falta de registros em inventários (LAWTON et al., 1996), a falta de metodologias para extrair, identificar e quantificar a diversidade do solo (ANDRÉ et al., 2002) e a grande quantidade de tempo e esforço necessários para se desenvolver um trabalho taxonômico com organismos de solo (BLOEMERS et al., 1997). O tamanho milimétrico dos organismos, como também sua fragilidade, dificultam o trabalho com colêmbolos, fazendo com que muitos pesquisadores escolham organismos de maior porte, que tornam a coleta, manuseio e, especialmente, a identificação, processos mais simples.
Estudos sobre a biologia dos solos são essenciais para a escolha de áreas de
preservação e manejo de ecossistemas. Obter bons inventários da diversidade local é uma das principais tarefas para a definição de planos de manejo de áreas de conservação e de ações globais para a conservação de espécies e ecossistemas. Segundo Wilson (1988), inventariar a diversidade implica em descrever
qualitativamente as espécies, bem como quantificar e caracterizar a diversidade e os padrões de abundância dos táxons.
solo, se correlacionam positivamente com o número de indivíduos e riqueza das espécies de Collembola. Quanto maior o tempo que a área passou pelo processo de reflorestamento, maior a quantidade de indivíduos encontrada. Portanto, é de extrema importância que mais estudos de diversidade e abundância sejam feitos em áreas ainda protegidas, para que comparações futuras possam ser realizadas em áreas que sofreram perturbação.
1.2 Classe Collembola
A classe Collembola Lubboock, 1870 possui aproximadamente 8.300 espécies descritas (BELLINGER et al., 1996 - 2013). Estes organismos, numericamente dominantes em muitos ecossistemas edáficos, são microartrópodes com tamanho que pode variar de 1 a 5 mm, podendo chegar a 17 mm. São entognatos (com as peças bucais encerradas dentro da cabeça) e todos os indivíduos possuem antenas. A principal característica que esses organismos apresentam é a presença do colóforo, um apêndice modificado, eversível, utilizado para fixação e absorção de umidade do substrato (CHRISTIANSEN, 1964; CHRISTIANSEN & BELLINGER, 1998). A
Figura 2. Anatomia de um colêmbolo Entomobryomorpha (Adaptado de CHRISTIANSEN & BELLINGER, 2003).
Os colêmbolos são de extrema importância para os processos de gênese, ciclagem de nutrientes e decomposição de matéria orgânica. Também são bioindicadores, por fornecerem resposta rápida às variações ambientais, principalmente às relacionadas à ação antrópica. Sua diversidade de espécies e densidade das
populações são influenciadas por vários aspectos do solo como sua estrutura física, temperatura, umidade, aeração, pH, composição da matéria orgânica, disponibilidade de nutrientes, tipo de húmus e vegetação (OLIVEIRA, 1993; SALOMON et al., 2004; COLE et al., 2005).
Tradicionalmente, os Collembola pertenciam ao grupo dos hexápodes, proximamente relacionados aos insetos ápteros (BÖRNER, 1910), mas atualmente existe uma linha de pensamento na qual estes animais são considerados crustáceos altamente especializados ao ambiente edáfico, que tiveram seu clímax evolutivo no Devoniano, quando dominaram a maioria dos ecossistemas terrestres (HOPKIN, 1997). Independente de sua relação com outros artrópodes, Collembola possui várias sinapomorfias que suportam de maneira clara e incontestável seu monofiletismo, como: o número de omatídeos na mancha ocular (máximo oito), antenas com quatro artículos portando musculatura intrínseca, abdômen com apenas seis segmentos, colóforo, retináculo e fúrcula (ZEPPELINI & BELLINI, 2004).
O incremento do uso de ferramentas moleculares, a utilização de novos
embasadas (DEHARVENG, 2004). Análises filogenéticas complexas em Collembola ainda são pontuais dentro do grupo e tratam de táxons restritos. No entanto, análises cladísticas são cada vez mais associadas a revisões taxonômicas e a associação entre técnicas moleculares e morfológicas está crescendo significativamente entre os estudiosos do grupo. O futuro da taxonomia de Collembola, provavelmente, dependerá de como serão resolvidos dois problemas: como desenvolver associações entre abordagens moleculares e taxonômicas e como vincular trabalho taxonômico com atividades de gestão dos ecossistemas (DEHARVENG, 2004).
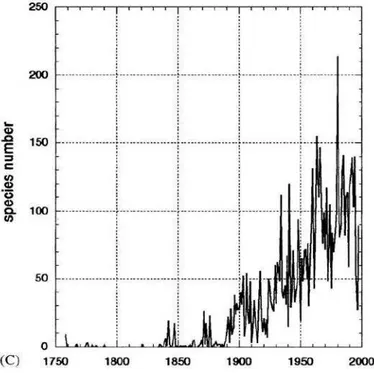
As primeiras descrições de Collembola foram publicadas no século XVIII. Bellinger e colaboradores (1996 - 2013) listaram o número de descrições de espécies do grupo desde 1758. Nos anos seguintes, a média de descrições se manteve baixa e no intervalo de 1984 a 1997, foram descritas mais de 100 espécies por ano (fig. 3). Desde então, o número se mantém numa média de 80 espécies por ano. Em 2012, foram descritas 32 espécies. Esse quadro é normalmente verificado em grandes grupos de
indivíduos (DEHARVENG, 2004). Sugere-se que esse decréscimo seja devido a outros direcionamentos das pesquisas relacionadas ao grupo, como ecologia, filogenia ou ecotoxicologia, que também são de grande importância.
O número de espécies reconhecidas de Collembola no Brasil, até o momento, é de 291, sendo estas pertencentes a 94 gêneros e 19 famílias. Destas, 196 espécies foram originalmente descritas no país (ABRANTES, et al., 2010; 2012; BELLINI & GODEIRO, 2012; ZEPPELINI & LIMA, 2012, ZEPPELINI & SILVA, 2012, MENDONÇA et al. 2012). Essa quantidade de espécies é mínima para um país como o Brasil, com grande território, heterogêneo e esperadamente megadiverso em termos de biodiversidade. Para exemplificar a baixa amostragem, existem ainda alguns estados brasileiros sem nenhum registro do grupo, como Acre, Alagoas, Distrito Federal e Roraima.
A diversidade descrita de Collembola é dividida em quatro ordens: Poduromorpha e Entomobryomorpha, representadas por espécies de formas alongadas e claramente segmentadas; e Symphypleona e Neelipleona, representadas por espécies de hábito globuloso. A ordem Entomobryomorpha, possui atualmente nove famílias (Isotomidae, Actaletidae, Coenaletidae, Tomoceridae, Oncopoduridae,
Praentomobryidae, Microfalculidae, Paronellidae, Entomobryidae). Os integrantes desta ordem caracterizam-se por apresentar corpo alongado revestido por cerdas e escamas, protergito ausente, com protórax sem cerdas (SOTO-ADAMES, 2008).
1.3 Família Entomobryidae
Entomobryidae é a maior família de Entomobryomorpha e mesmo de Collembola. Possui aproximadamente 1.730 espécies. É dividida em duas subfamílias: Orchesellinae Börner, 1906 e Entomobryinae Schött, 1891. Entomobryinae possui quatro tribos: Entomobryini Schött, 1891, Lepidocyrtini Wahlgren, 1906, Willowsini Yoshii & Suhardjono, 1989 e Seirini Yosii, 1961 (SOTO-ADAMES et al., 2008, BELLINGER et al., 1996-2013). No Brasil, a família é representada pelos gêneros DicranocentrusSchött, Entomobrya Rondani, LepidosiraSchött, LepidocyrtusBourlet, NothobryaArlé, PseudosinellaSchäffer, RhynchocyrtusMendonça & Fernandes, Seira Lubbock e Tyrannoseira Bellini & Zeppelini (ABRANTES et al., 2010; 2012; BELLINI & ZEPPELINI, 2004; 2011; MENDONÇA & FERNANDES, 2007).
Tyrannoseira: T. diabolica Bellini & Godeiro, 2012 e T. gladiata Zeppelini & Lima, 2012), aumentando o total de espécies para 57. A família Entomobryidae é a segunda mais diversa no país, perdendo apenas para Isotomidae, que possui 66 espécies listadas. As regiões que mais contribuíram com os últimos registros de espécies de Collembola desta lista foram Rio de Janeiro e Paraíba, o que se justifica pela presença de um maior número de especialistas e estudantes com projetos em andamento nas referidas regiões (ABRANTES et al., 2010; 2012).
Um entomobriídeo pode ser reconhecido por possuir longos apêndices, devido ao hábito epiedáfico (habitam a zona superficial da serrapilheira), corpo coberto por escamas e/ou pequenas microcerdas multiciliadas e macroquetas (fig. 4). Esses animais possuem também complexos abdominais de tricobótrias que incluem microcerdas e pequenas escamas em forma de leque, dente da fúrcula crenulado e mucro pequeno com um ou dois dentes bem desenvolvidos (CHRISTIANSEN & BELLINGER, 1980; SOTO-ADAMES et al., 2008).
Figura 4. Um entomobriídeo: Seira mendoncea Bellini & Zeppelini, 2008. Ilustração de Thomaz Carvalho.
trocanteral, dados morfométricos e quetotaxia geral. A partir de 1960, a introdução de caracteres relacionados à quetotaxia detalhada (YOSII, 1959; GISIN, 1963) ajudou a solucionar muitos problemas taxonômicos e levou ao reconhecimento de um grande número de espécies (SOTO-ADAMES, 2008).
1.4 Tribo Seirini
A tribo Seirini compreende nove gêneros: Acanthocyrtus Handschin, Epimetrura Schött, Lepidocyrtoides Schött, Lepidosinella Handschin, Lepidosira, Seira, Sinelloides Bonet, Tyrannoseira e Vietsira Yoshii. No Brasil, até o momento, foram descritas 30 espécies de Seirini, distribuídas em 3 gêneros: Seira, com 23 espécies; Lepidosira, com 2 espécies; e Tyrannoseira, com 5 espécies (ABRANTES et al., 2010; 2012; BELLINI et al., 2010; BELLINI & ZEPPELINI, 2011; BELLINI & GODEIRO, 2012; ZEPPELINI & LIMA, 2012).
Aproximadamente 70% das espécies de Seirini pertencem ao gênero Seira (BELLINGER et al., 1996–2013). Sendo este um gênero predominantemente tropical, a maioria das espécies foi descrita na África, América Latina e Índia (MARI MUTT et al., 1998-2013, CHRISTIANSEN & BELLINGER, 2000). O gênero Seira é o mais diverso no Brasil, com 23 espécies descritas (ABRANTES, et al., 2012). Os indivíduos
do gênero Seira são geralmente encontrados no solo entre serrapilheira ou sob rochas (BELLINI & ZEPPELINI, 2008).
1.5 Caatinga
O domínio fitogeográfico da Caatinga é exclusivamente brasileiro e abrange
uma área aproximada de 800.000 km² (o que equivale a 11% do território brasileiro), inclui partes dos Estados do Piauí, Ceará, Rio Grande do Norte, Paraíba, Pernambuco, Alagoas, Sergipe, Bahia e Minas Gerais. Trata-se de um domínio semi-árido, com altas taxas de evapotranspiração potencial (1.500–2.000 mm/ano) e baixos índices pluviométricos (300–1.000 mm/ano), geralmente com chuvas concentradas em um a três meses do ano (SAMPAIO, 1995).
Tradicionalmente a Caatinga foi tida como um bioma pobre em diversidade de espécies, sendo considerado homogêneo. Estudos realizados nas últimas décadas discordam dessa afirmação e classificam a Caatinga como um bioma heterogêneo que abriga uma alta diversidade de espécies, inclusive espécies endêmicas (LEAL et al., 2005). Recentemente a Caatinga foi reconhecida como uma das 37 grandes regiões naturais do planeta, conforme estudo coordenado pela Conservation International, por abrigar, pelo menos, 70% da cobertura vegetal original e abrigar área superior a
Figura 5. Áreas prioritárias para a conservação da biodiversidade biológica da Caatinga, exceto as áreas insuficientemente conhecidas (Adaptado de SILVA et al., 2002)
Entre 30,4% e 51,7% da área da Caatinga está sendo alterada por atividades humanas e cerca de 15% da área total é ameaçada pelo processo de desertificação, causado principalmente pelo uso inadequado do solo. De toda a área da Caatinga, somente 0,87% dela é protegida por áreas de conservação e tal porcentagem é representada por 16 Unidades de Conservação federais e sete estaduais (tab. 1) que
Legenda:
1. Bacia do Rio Preguiça 2. Complexo de Campo Maior 3. Médio Poti 4. Serra das Flores 5. Planalto da Ibiapaba do Norte / Jaburuna 6. Reserva da Serra das Almas 7. Serra da Joaninha / Serra da Pipoca 8. Serra de Baturité 9. Quixadá 10.Aiuaba 11.Picos 12.Chapada do Araripe 13. Baixo Jaguaribe /Chapada do Apodi 14. São Bento do Norte 15. Mato Grande 16. Acarí 17. Seridó / Borborema 18. Alto Sertão do Piranhas 19. Patos / Santa Terezinha 20. São José da Mata 21. Cariri Paraibano 22. Caruaru 23. Buíque / Vale do Ipojuca 24. Serra do Cariri 25. Serra Talhada 26. Serra Negra 27. Xingó 28. Rodelas 29. Raso da Catarina 30. Monte Alegre 31. Domo de Itabaiana 32. Curaçá 33. Petrolina 34. Oeste de Pernambuco 35. Parque Nacional da Serra da Capivara 36.Corredor Ecológico Serra da Capivara e das Confusões 37. Parque Nacional
Serra das Confusões 38. Sento Sé 39. Delfino40. Senhor do Bonfim 41. Médio Rio São Francisco 42. Ibotirama 43. Ibipeba
protegem formações de Caatinga e/ou ambientes de transição entre este e outros biomas (LEAL et al., 2005). Esse dado justifica o incremento de estudos dessa área para que sejam criadas mais unidades de conservação, três dessas áreas (Parque Nacional Serra das Confusões, Parque Nacional de Ubajara e APA Chapada do Araripe) fazem parte do presente estudo. O aumento das pressões antrópicas indica que tais ações devem ser tomadas o mais breve possível, antes que boa parte das características climáticas, da fauna e flora típicas dessa região desapareça.
1.6 Áreas úmidas da Caatinga
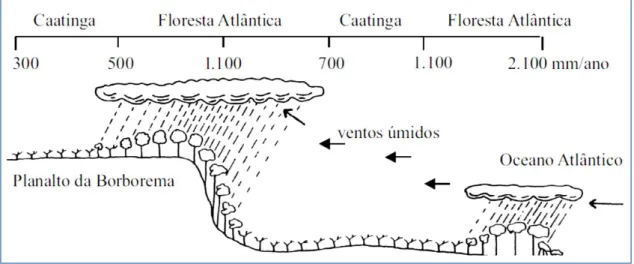
As áreas úmidas da Caatinga conhecidas como “Brejos de Altitude”, são partes da Floresta Atlântica nordestina. Tais áreas podem ser conceituadas como “ilhas” de
floresta úmida estabelecidas na região semi-árida, sendo cercadas por uma vegetação de caatinga (ANDRADE-LIMA, 1982). A formação dessas ilhas de florestas está
associada a existência de planaltos e chapadas entre 500-1.100m de altitude, onde os níveis de precipitação são superiores a 1.200mm/ano (fig. 6). Tais características favorecem a existência de uma temperatura mais amena, uma maior umidade do solo e do ar, como também uma maior cobertura vegetal nos Brejos de Altitude, quando comparados com as regiões semiáridas.
Figura 6. Perfil esquemático dos brejos de altitude (aqui representado pelo Planalto da Borborema) no Nordeste do Brasil. (Fonte: Tabarelli & Santos 2004)
As condições privilegiadas encontradas nos Brejos de Altitude fizeram com que
1.7 Estudos de diversidade de Collembola no Nordeste
Até o momento, foram feitos estudos de diversidade de Collembola nos estados
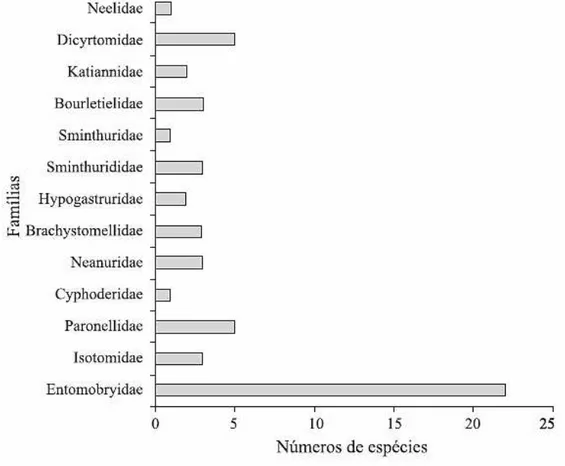
da Paraíba e do Rio Grande do Norte. No trabalho de Bellini & Zeppelini, 2009, realizado na Paraíba em áreas de Mata Atlântica, Mata de Restinga e Brejo de Altitude, foram registradas 57 espécies de Collembola, distribuídas em 25 gêneros e 13 famílias (fig. 7). Já no trabalho de Santos-Rocha e colaboradores (2011) feito no Rio Grande do Norte em áreas de Mata Atlântica e Caatinga, foram encontradas 16 espécies, distribuídas em 12 gêneros e sete famílias (fig. 8). Em ambos os trabalhos, a família Entomobryidae foi a mais representativa.
A fauna de colêmbolos no Nordeste, principalmente na Caatinga, ainda é pouco conhecida, o que não condiz com sua grande diversidade de microhabitats. Esse resultado reflete o baixo esforço de coleta nesse bioma (BELLINI & ZEPPELINI, 2004). De fato, a maior parte do território da Caatinga não foi amostrado para a fauna de Collembola.
Figura 8. Número de espécies por família de colêmbolos identificadas no Rio Grande do Norte. Retirado de Santos-Rocha e colaboradores (2011).
2. J
USTIFICATIVADevido à falta de conhecimento sobre a família Entomobryidae e seu potencial em termos de diversidade, espera-se que o presente estudo contribua para o conhecimento desta família na Caatinga, através do inventário de cinco áreas (Serra da Jibóia/BA, Serra das Confusões/PI, Chapada do Araripe/CE, Areia/PA e Ubajara/CE), sendo duas (Serra das Confusões/PI e Chapada do Araripe/CE) consideradas pela Conservation International como áreas prioritárias para conservação da biodiversidade da Caatinga, com extrema importância biológica. A avaliação da diversidade desse táxon, além de aumentar o conhecimento do mesmo dentro do território brasileiro e da Região Neotropical, tem potencial de criar dados para a implementação de futuras medidas de conservação, assim como estudos de distribuição das espécies e padrões evolutivos e biogeográficos dentro da família.
3.
O
BJETIVOS3.1 Objetivo geral
Avaliar a diversidade e distribuição de espécies da tribo Seirini em cinco áreas
3.2 Objetivos específicos
Identificar a fauna de Entomobryidae nas áreas amostradas;
Descrever parte das novas espécies de Seirini encontradas;
Comparar a fauna encontrada com os registros brasileiros;
Preparar uma chave de identificação para as espécies de Seirini do Brasil.
4.
M
ETODOLOGIA4.1 Áreas de coleta
Figura 9. Mapa do Brasil, em destaque, os estados da região Nordeste. Os marcadores vermelhos indicam os municípios onde foram realizadas as coletas.
Tabela 2. Dados relevantes sobre os locais de coleta de Seirini na Caatinga.
Serra da Jibóia,
Santa Teresinha, BA
Serra das Confusões, Caracol, PI
Chapada do Araripe, Crato, CE
Mata do Pau-Ferro, Areia, PB
PN de Ubajara, Ubajara, CE
Mês/Ano da
coleta Nov./2010 Dez./2010 Fev./2011 Set./2011 Out./2011
Temperatura
Média (30 anos) 24°C 27°C 26°C 25°C 26°C
Precipitação
Média (30 anos) 55 mm 60 mm 84 mm 66 mm 90 mm
Clima Semi-árido sub-
úmido a seco
Semi-árido a seco
Tropical quente
Tropical
úmido Tropical quente úmido
Solo Areias quartzosas
hidromórficas Latossolo Amarelo
4.1.1 Serra da Jibóia, município de Santa Teresinha, Bahia
A Serra da Jibóia é um complexo montanhoso com cerca de 22.000 ha e
altitude entre 750 m e 840 m (TOMASONI & SANTOS, 2003). A temperatura média anual na Serra da Jibóia é de 24°C e o índice pluviométrico é de 1.200 mm/ano, com chuvas concentradas nos meses de abril a julho (TOMASONI & SANTOS, 2003). O clima é semi-árido sub-úmido a seco, de acordo com a classificação de Thornhwaite (SEI, 1997). Estando localizada em uma área de transição entre Caatinga e Mata Atlântica, caracteriza-se por apresentar trechos de caatinga na base, mata higrófila na encosta, e um afloramento rochoso de origem gnáissico granítica no topo. A Serra da Jibóia apresenta uma variedade de tipos vegetacionais, com Floresta Ombrófila Densa (no declive oriental), mudando para a Floresta Estacional Semidecidual, Floresta Estacional Decidual (no declive ocidental), Campo Rupestre latu sensu (no topo) e Caatinga Arbórea (na base) (TOMASONI & SANTOS, 2003).
Figura 10. Serra da Jibóia. Foto: Iuri Tarcísio Brito
4.1.2 Serra das Confusões, município de Caracol, Piauí
O Parque Nacional Serra das Confusões está situado no Sudoeste do Estado do Piauí, próximo à divisa com o Estado da Bahia, abrangendo parte dos municípios de Guaribas e Caracol. A unidade de conservação foi criada em 2 de Outubro de 1998, apresenta uma área aproximada de 500.000 ha e abrange uma região de ecótonos entre
margem direita do Rio Parnaíba, nenhum de seus rios é permanente. A Caatinga é caracterizada por apresentar um clima quente e seco determinado por um regime de chuvas marcadamente sazonais e por índices pluviométricos inferiores a 1.200 mm anuais. Além da baixa pluviosidade, a região é caracterizada por exibir chuvas irregulares entre anos consecutivos. O solo predominante na região é classificado como latossolo amarelo (EMBRAPA, 2006). A vegetação é bem diversa em toda a área do Parque. Predominantemente, encontramos a Caatinga Arbórea Alta, sobre a Serra, que apresenta um dossel de aproximadamente 6 metros de altura. No baixão da Lagoa do Jacú, existe outro tipo de formação vegetal a Mata Pluvial Subperenifólia, com um dossel que pode alcançar até 20 metros de altura. Nas regiões de baixões a vegetação é bem mais heterogênea fisionomicamente, crescendo sobre um solo arenoso ou sobre afloramentos rochosos de arenito mais duro, sendo colonizadas por espécies bem resistentes como cactáceas, velosiáceas e bromeliáceas (GREGORIN et al., 2008).
Figura 11. Serra das confusões. Foto: Carlos César Durigan
4.1.3 Chapada do Araripe, munícipio do Crato, Ceará
principais da ocorrência das florestas serranas aliadas à outra forma de precipitação, o orvalho, determinado pelo nevoeiro sobre os níveis mais elevados. A significativa altitude propicia a existência de um clima ameno no topo da Chapada. De acordo com Radambrasil (1982), nas encostas do lado setentrional, estão localizadas as ressurgências resultantes da infiltração da água no topo, dando origem a pequenos, mas
perenes cursos d’água. Segundo Leite e Marques (1986), a região possui clima tropical
quente com estação chuvosa de janeiro a abril e média pluviométrica de 1.100 mm anuais. Os solos que predominam na Chapada são os latossolos vermelho-amarelo e vermelho-escuro, com boa profundidade, textura média e argilosa, bem drenados a acentuadamente drenados, muito lixiviados e bastante intemperizados em toda sua profundidade. A vegetação da região apresenta, áreas de floresta ombrófila densa montana (mata úmida), de savana (cerrado) e de savana florestada (cerradão) (VELOSO et al., 1991). Além de áreas de carrasco ocorrendo em solos arenosos sobre chapadas contíguas à vegetação de caatinga, mas que podem ser reconhecidas como entidade própria devido a maior densidade de indivíduos, uniestratificação aparente e quase ausência de cactáceas e bromeliáceas (ARAÚJO et al., 1998).
Figura 12. Chapada do Araripe. Foto: Isário Galvão
4.1.4 Mata do Pau-Ferro, município de Areia, Paraíba
e da redução da temperatura. As matas serranas que eles abrigam são consideradas como disjunção ecológica da Mata Atlântica, ilhadas pela vegetação de Caatinga, condição que torna os remanescentes áreas de elevada biodiversidade. A temperatura média anual é de 25º C, umidade relativa em torno de 85% e totais pluviométricos anuais em torno de 1.400 mm (MAYO & FEVEREIRO, 1982). O clima é úmido, os solos são profundos e medianamente férteis e a hidrografia é caracterizada por pequenos e médios cursos d´água. A vazão desses cursos d´água caracteriza-se por grandes oscilações entre os períodos seco e chuvoso, podendo ser classificada como semiperene. No contexto regional, estas condições são consideradas muito favoráveis ao desenvolvimento da agricultura, tendo-se aí, desenvolvidos ciclos de monocultivos, como foi o caso do fumo, do sisal e da cana-de-açúcar. No conjunto, estas condições tornaram a região uma área canavieira-pecuarista-policultora, com elevada concentração populacional (MOREIRA, 1989).
Figura 13. Areia/PB. Foto de Fagnner Gregório
4.1.5 Parque Nacional de Ubajara, município de Ubajara, Ceará
acima do nível do mar, na cidade de Ubajara/CE, a temperatura média é 26ºC. A pluviometria média anual é superior a 1200 mm/a, sendo a distribuição de chuvas regular. O clima é classificado como Tropical Quente Úmido (SILVA & CAVALCANTE, 2004). As diferenças climáticas em relação ao sertão são explicadas pela compartimentação topográfica, que condiciona o comportamento da temperatura e da pluviosidade.
O revestimento vegetal caracteriza-se pelo predomínio da floresta úmida, uma mata perenifólia, com uma elevada quantidade de espécies de componentes arbóreos e componentes herbáceos e arbustivos com menor número espécies. A altitude e a nebulosidade são fatores que favorecem a ocorrência desse padrão fitogeográfico (SILVA, 2005).
Figura 14. Parque Nacional de Ubajara/CE. Foto: Edilson Morais Brito
4.2 Métodos de coleta e identificação
Em cada município foi realizada uma coleta intensiva. Para tanto, foram escolhidas áreas com elevada cobertura vegetal e com presença de folhiço. Os espécimes foram coletados com armadilhas de queda do tipo pitfall de 400 ml, contendo Etanol 70% como agente fixador, enterradas rente à superfície do terreno e
Após a coleta, o material foi identificado e os espécimes foram triados sob microscópio estereoscópico e armazenados em frascos do tipo Eppendorf, contendo Etanol 70%. Em seguida, o material foi montando entre lâminas e lamínulas seguindo os procedimentos descritos por Christiansen & Bellinger (1980). Cada espécime foi diafanizado utilizando-se duas gotas de Hidróxido de Potássio, também conhecido como Potassa Cáustica (KOH) a 5% e logo após, levemente aquecido em duas gotas de Lactofenol a 10%. Outro método de montagem criado por Arlé & Mendonça (1982) foi usado para montagem de parte dos espécimes. Neste segundo método, cada espécime foi diafanizado numa mistura de uma gota de Ácido Clorídrico a 100% e duas gotas de Bicromato de Potássio por 10 minutos. Após o clareamento, o excesso da mistura dos reagentes foi retirado com Líquido de Arlé. Em ambos os métodos foi utilizado Líquido de Hoyer para montagem das lâminas. Em seguida, os espécimes foram identificados sob microscópio óptico com contraste de fases, com o auxílio de chaves de identificação publicadas em Christiansen & Bellinger (2000), Bellinger et al. (1996–2013), Zeppelini & Bellini (2004) e Bellini & Zeppelini (2009, 2011).
Os espécimes de Seirini montados, identificados como novas espécies, foram desenhados com o auxílio de um microscópio óptico com câmara clara. Em seguida, foram digitalizados e vetorizados com auxílio de softwares específicos. Foram
desenhadas e descritas a quetotaxia dorsal da cabeça, do meso e metatórax e dos quatro primeiros segmentos abdominais seguindo os procedimentos de Christiansen & Bellinger (2000) modificado de Jacquemart (1974) (fig. 15). A quetotaxia do II e III segmentos abdominais foi detalhada, com a inclusão de microcerdas, tricobótrias e escamas associados aos complexos tricobotriais de acordo com Soto-Adames (2008). Foram desenhadas a quetotaxia do triângulo labial, número de espinhos do órgão meta-trocanteral, forma dos complexos empodiais, padrão ocular e cerdas interoculares, forma do mucro e região distal da fúrcula e padrões de coloração para os espécimes diafanizados. No caso dos espécimes pertencentes ao subgrupo do gênero Seira que possui cerdas abaoladas na parte distal do manúbrio e proximal do dente, também foi desenhada essa região. Os holótipos também foram medidos para a descrição das novas espécies.
(MN/UFRJ). O restante dos espécimes, montados ou mantidos em álcool, será depositado junto a Coleção Entomológica Adalberto Antônio Varella-Freire, do Centro de Biociências da Universidade Federal do Rio Grande do Norte (UFRN).
Uma lista com as espécies da família Entomobryidae identificadas e descritas no trabalho e os registros foram comparados com outros registros feitos anteriormente em território brasileiro.
Foi preparada uma chave dicotômica ilustrada de identificação para as espécies pertencentes à tribo Seirini encontrados no Brasil, observando-se como modelo as chaves encontradas em Christiansen & Bellinger (2000) e Bellini & Zeppelini (2009, 2011). Também foram apresentadas diagnoses dos gêneros de Seirini encontrados no Brasil. As ilustrações para a chave foram feitas com base nos desenhos das descrições das espécies, sendo redesenhadas com o auxílio de softwares de vetorização. O esquema de distribuição de macroquetas cefálicas e dorsais de Christiansen & Bellinger (2000) modificado de Jacquemart (1974) apresentado na figura 15, foi um dos artifícios usados para identificação das espécies. Para um maior detalhamento, foram acrescentadas as regiões brasileiras onde as espécies foram registradas. No total, foram utilizadas 31 espécies da tribo Seirini para confecção da chave de identificação.
Duas espécies do gênero Lepidosira, cinco espécies do gênero Tyrannoseira e 24 espécies do gênero Seira, sendo sete destas, espécies novas descritas no presente trabalho.
5.
R
ESULTADOS5.1. Lista de espécies da família Entomobryidae
Tabela 3. Lista de espécies de colêmbolos registrados nas referidas localidades de coleta. Táxons Localidades Serra da Jibóia/BA Serra das Confusões/PI Chapada do Araripe/CE Mata do Pau-Ferro/PB P.N. de Ubajara/CE Dicranocentrus heloisae Arlé & Mendonça, 1982 1 Dicranocentrus silvestrii Absolon, 1903 1 Dicranocentrus cf.
thermitophilus
(Handschin, 1924) 1
Dicranocentrus sp. n. 1 1
Entomobrya aff. atrocincta Schött, 1896
1 Entomobrya aff. nivalis
Christiansen, 1958 1 1 Entomobrya nivalis
Rondani, 1861
Entomobrya tupiana
Arlé, 1939 1
Heteromurus aff.
brevicornis Bonet, 1934 1
Heteromurus sp. n. 1 1
Lepidocyrtus
maldonadoi Mari Mutt,
1986 1
Lepidocyrtus nigrosetosus Folsom,
1927 1*
Lepidocyrtus sp. n. 1 1
Lepidocyrtus sp. n. 2 1
Lepidocyrtus sp. n. 3 1
Lepidocyrtus sp. n. 4 1
Lepidocyrtus sp. n. 5 1
Lepidocyrtus sp. n. 6 1
Lepidosira tapuia Arlé
& Guimarães, 1980 1
Táxons Localidades Serra da Jibóia/BA Serra das Confusões/PI Chapada do Araripe/CE Mata do Pau-Ferro/PB P.N. de Ubajara/CE Handschin, 1924 Pseudosinella dubia
Christiansen, 1960 1 1 1 1
Seira eidmanni Stach,
1935 1
Seira mendoncea Bellini
& Zeppelini, 2008 1 1
Seira nigrans Arlé, 1960 1 Seira paraibensis Bellini
& Zeppelini, 2009
1 1*
Seira prodiga Arlé,
1960 1
Seira ritae Bellini & Zeppelini, 2011
1
Seira xinguensis Arlé,
1960 1 1
Seira sp. n. 1** 1
Seira sp. n. 2 1
Seira sp. n. 3 1
Seira sp. n. 4 1
Seira sp. n. 5 1
Seira sp. n. 6** 1
Seira sp. n. 7** 1
Seira sp. n. 8 1
Seira sp. n. 9 1
Seira sp. n. 10** 1
Seira sp. n. 11 1
Seira sp. n. 12 1
Seira sp. n. 13 1
Táxons Localidades Serra da Jibóia/BA Serra das Confusões/PI Chapada do Araripe/CE Mata do Pau-Ferro/PB P.N. de Ubajara/CE
Seira sp. n. 16** 1
Seira sp. n. 17** 1
Seira sp. n. 18** 1
Seira sp. n. 19 1
Verhoeffiella sp. 1 1
TOTAL 14 10 15 9 6
* Espécie registrada anteriormente no referido estado ** Espécie descrita no presente trabalho
A figura 16 mostra o total de espécies por área de estudo. Pode-se observar que as áreas com maior riqueza de espécies foram a Chapada do Araripe/CE com 15 espécies e Serra da Jibóia/BA com 14 espécies coletadas.
Figura 16. Total de espécies por área
Figura 17. Número de espécies de Entomobryidae por gênero coletadas em cada área de estudo.
5.2. Novas espécies
Neste trabalho, foram descritas sete novas espécies de Seirini. A descrição de tais espécies é apresentada a seguir, os comentários sobre as espécies são feitos na discussão do presente trabalho.
5.2.1 Seira sp. n. 1
Material tipo: Holótipo macho, Brasil, Bahia, Santa Terezinha, Serra da Jibóia, 07/XI/2010. Bellini, B. C. col. Parátipo 1 macho, mesmos dados do holótipo.
Descrição: comprimento total do corpo do holótipo 1,225 mm. Hábito tipicamente entomobriídeo (fig. 18A). Cor dos espécimes montados amarelo pálido, com coloração roxa em dois pontos na parte frontal da cabeça e em parte da borda superior do quarto
segmento abdominal (fig. 18A). Escamas arredondadas amareladas ou castanhas cobrindo os segmentos antenais I e II, metades basais dos segmentos antenais III e IV, cabeça, tórax, abdome, pernas e fúrcula. Colóforo sem escamas. Quarto artículo antenal não anulado, apresentando bulbo apical bilobado, não contendo cerdas em forma de pinos (fig. 18B). Manchas oculares ovais, 8+8 lentes oculares, sendo a maior a lente B e a menor, E (fig. 18C). Duas mesocerdas multiciliadas interoculares (fig. 18C). Cerdas pré-labrais e labrais lisas. Triângulo labial com cerda r presente e
0 2 4 6 8 10 12 14 16 Serra das Confusões/PI
Serra da Jibóia/BA Chapada do Araripe/CE
Parque Nacional de Ubajara/CE
Mata do Pau-Ferro/PB
Dicranocentrus Entomobrya Heteromurus Lepidocyrtus Lepidosira
reduzida e M1, M2 e E normais em tamanho, multiciliadas (fig. 18D). Órgão metatrocanteral com aproximadamente 16 espinhos curtos (fig. 18E). Todos os úngues com quatro dentes, dois na base pareados e dois apicais não pareados (figs. 18F - H). Todos os unguículus acuminados, com bordas levemente serrilhadas (figs. 18F - H). Mucro tipicamente falcado (fig. 18I). Ventre do manúbrio com 4+4 cerdas subapicais. Cerdas em forma de espinhos ausentes no manúbrio. Quetotaxia dorsal detalhada do segundo e terceiro segmentos abdominais mostrada na figura 19. Distribuição das macroquetas dorsais em todo corpo mostrada na figura 20.
Figura 19. Seira sp. n. 1: Quetotaxia dorsal detalhada do segundo e terceiro segmentos abdominais.
5.2.2 Seira sp. n. 6
Material tipo. Holótipo macho, Brasil, Piauí, Caracol, Serra das Confusões, 08-15/XII/2010. Bellini, B.C. col. Parátipos 2 fêmeas, mesmos dados do Holótipo. Material tipo foi depositado no CM/MNRJ.
Figura 22. Seira sp. n. 6: Quetotaxia dorsal detalhada do segundo e terceiro segmentos abdominais.
5.2.3 Seira sp. n. 7
Material tipo. Holótipo macho, Brasil, Piauí, Caracol, Serra das Confusões, 08-15/XII/2010. Bellini, B.C. col. Parátipos 2 fêmeas e 1 macho, mesmos dados do Holótipo. Material tipo foi depositado no CM/MNRJ.
Descrição: comprimento total do corpo do holótipo 1,44 mm. Hábito tipicamente entomobriídeo (fig. 24A). Cor dos espécimes em álcool amarelo pálido, com coloração roxa clara nas antenas, metade frontal da cabeça, manchas oculares, borda superior do mesotórax, manchas nas partes distais do terceiro, quarto, quinto e sexto segmento abdominal (fig. 24A). Escamas arredondadas amareladas cobrindo os segmentos antenais I e II, metades basais dos segmentos antenais III e IV, cabeça, tórax, abdome, pernas e fúrcula. Colóforo sem escamas. Quarto artículo antenal não anulado, bulbo apical simples, não contendo cerdas em forma de pinos (fig. 24B). Manchas oculares ovais, 8+8 lentes oculares, sendo a maior a lente A e a menor, E (fig. 24C). Duas mesocerdas multiciliadas interoculares (fig. 24C). Cerdas pré-labrais e labrais multiciliadas. Triângulo labial com cerda r presente e reduzida, M1, M2 e E normais em tamanho, multiciliadas (fig. 24D). Órgão metatrocanteral com 21 espinhos curtos (fig. 24E). Todos os úngues com quatro dentes, dois na base pareados e dois apicais não pareados (figs. 24F - H). Todos os unguículus acuminados, com bordas levemente serrilhadas (figs. 24F - H). Ventre do manúbrio com 5+5 cerdas subapicais. Mucro tipicamente falcado (fig. 24I). Cerdas em forma de espinhos ausentes no manúbrio. Quetotaxia dorsal detalhada do segundo e terceiro segmentos abdominais mostrada na
Figura 25. Seira sp. n. 7: Quetotaxia dorsal detalhada do segundo e terceiro segmentos abdominais.
5.2.4 Seira sp. n. 10
Material tipo: Holótipo fêmea, Brasil, Ceará, Crato, Chapada do Araripe, 06/II/2011. Bellini, B. C. col. Parátipos 2 machos, mesmos dados do holótipo.
Descrição: comprimento total do corpo do holótipo 1,25 mm. Hábito tipicamente entomobriídeo (fig. 27A). Cor dos espécimes montados amarelo pálido, com coloração roxa em parte das bordas do mesotórax e do quarto segmento abdominal (fig. 27A). Escamas arredondadas amareladas ou castanhas cobrindo os segmentos antenais I e II, metades basais dos segmentos antenais III e IV, cabeça, tórax, abdome, pernas e fúrcula. Colóforo sem escamas. Quarto artículo antenal anulado, apresentando bulbo apical bilobado, não contendo cerdas em forma de pinos (fig. 27B). Manchas oculares ovais, 8+8 lentes oculares, sendo a maior a lente B e a menor, G (fig. 27C). Três mesocerdas multiciliadas interoculares (fig. 27C). Cerdas pré-labrais e labrais lisas. Triângulo labial com cerda r presente e reduzida, e M1, M2 e E normais em tamanho, multiciliadas (fig. 27D). Órgão metatrocanteral com aproximadamente 20 espinhos curtos (fig. 27E). Todos os úngues com quatro dentes, dois na base pareado e dois apicais não pareados (figs. 27F - H). Todos os unguículus acuminados, com bordas levemente serrilhadas (figs. 27F - H). Ventre do manúbrio com 4+4 cerdas subapicais. Mucro tipicamente falcado (fig. 27I). Cerdas em forma de espinhos ausentes no manúbrio. Quetotaxia dorsal detalhada do segundo e terceiro segmentos abdominais
Figura 27. Seira sp. n. 10: A. Hábito; B. Bulbo apical do quarto segmento antenal; C. Mancha ocular esquerda; D. Cerdas do triângulo labial; E. Orgão trocanteral; F. Primeiro complexo empodial; G. Segundo complexo empodial; H. Terceiro complexo empodial; I. Dente e mucro.
Figura 28. Seira sp. n. 10: Quetotaxia dorsal detalhada do segundo e terceiro segmentos abdominais.
5.2.5 Seira sp. n. 16
Material tipo. Holótipo fêmea, Brasil, Paraíba, Areia, Mata do Pau-Ferro, 24–
27/IX/2011. Bellini, B.C. col. Parátipos 2 machos e 3 fêmeas, mesmos dados do Holótipo.
Descrição. Comprimento total do corpo do Holótipo 3,07 mm. Hábito entomobriídeo (fig. 30A). Cor dos espécimes montados amarelo claro com pigmento azul escuro cobrindo as manchas oculares (fig. 30A); Escamas marrons e arredondadas cobrindo toda a Ant. I e II, partes basais da Ant. III e IV, cabeça, tórax, abdômen, pernas, fúrcula e colóforo. Ant. IV não anelada, com um bulbo apical simples, sem pin setae e com duas colunas de cerdas lisas no ápice (fig. 30B). Manchas oculares ovais com 8+8 lentes, sendo a maior A e a menor F (fig. 30C). Cinco mesoquetas interoculares multiciliadas (fig. 30C). Cerdas pre–labrais e labrais lisas. Cerdas do triângulo labial M1–2 e E multiciliadas, r reduzida (fig. 30D). Orgão metatrocanteral com aproximadamente 24 pequenos espinhos (fig. 30E). Colóforo com aproximadamente 45 cerdas multiciliadas (fig. 30F). Todos os unguis com quatro dentes, dois basais pareados e dois apicais não pareados (figs. 30G-I). Unguículus acuminado, com bordas
Figura 31. Seira sp. n. 16: Quetotaxia dorsal detalhada do segundo e terceiro segmentos abdominais.
5.2.6 Seira sp. n. 17
Material tipo. Holótipo macho, Brasil, Paraíba, Areia, Mata do Pau-Ferro, 24– 27/IX/2011. Bellini, B.C. col. Parátipos 1 macho e 1 fêmea, mesmos dados do Holótipo. Material tipo foi depositado no CM/MNRJ.
Descrição: comprimento total do corpo do holótipo 2,12 mm. Hábito tipicamente entomobriídeo (fig. 33). Cor dos espécimes em álcool amarelo pálido com pigmento azul claro cobrindo as antenas e a parte distal dos fêmures. Pigmento azul escuro entre as manchas oculares e dois pontos da mesma coloração na parte distal do quarto segmento antenal (fig. 33). Cor dos espécimes montados amarelo pálido, com coloração azul escura nas manchas oculares e na parte distal dos fêmures. Escamas arredondadas castanhas cobrindo os segmentos antenais I e II, metades basais dos segmentos antenais III e IV, cabeça, tórax, abdome, colóforo, pernas e fúrcula. Quarto artículo antenal não anulado, apresentando bulbo apical simples e dois tipos de cerdas: maiores multiciliadas e menores lisas (fig. 34B). Manchas oculares ovais, 8+8 lentes oculares, sendo a maior a lente B e a menor, E (fig. 34C). Cinco mesocerdas multiciliadas interoculares (fig. 34C). Cerdas pré-labrais e labrais lisas. Triângulo labial M1, M2 e E multiciliadas normais em tamanho, cerda r reduzida (fig. 34D). Órgão metatrocanteral com aproximadamente 27 espinhos curtos (fig. 34E). Todos os úngues com quatro dentes, dois na base pareados e dois apicais não pareados (figs. 34F - H). Todos os unguículus acuminados, com bordas levemente serrilhadas (figs. 34F - H). Mucro tipicamente falcado (fig. 34I). Ventre do manúbrio com 8+8 cerdas
subapicais, espinhos ausentes. Quetotaxia dorsal detalhada do segundo e terceiro segmentos abdominais mostrada na figura 35. Distribuição das macroquetas dorsais em todo corpo mostrada na figura 36.
Figura 35. Seira sp. n. 17: Quetotaxia dorsal detalhada do segundo e terceiro segmentos abdominais.
5.2.7 Seira sp. n. 18
Material tipo. Holótipo macho, Brasil, Ceará, Ubajara, Parque Nacional de Ubajara,
24/X/2011. Carvalho, L.S. col. Parátipos 2 machos e 3 fêmeas, mesmos dados do Holótipo. Material tipo foi depositado no CM/MNRJ.
Descrição. Comprimento total do corpo do Holótipo 2,75 mm. Hábito entomobriídeo (fig. 37). Cor dos espécimes em álcool amarelo pálido, manchas escuras nas extremidades dos segmentos das antenas e pernas; e na parte distal do quarto segmento
antenal (fig. 37). Cor dos espécimes montados amarelo claro com pigmento azul escuro cobrindo as manchas oculares (fig. 38A); Escamas marrons e arredondadas
cobrindo toda a Ant. I e II, partes basais da Ant. III e IV, cabeça, tórax, abdômen, pernas, fúrcula e colóforo. Ant. IV fracamente anelada, com um bulbo apical simples,
sem pin setae e com duas colunas de cerdas lisas no ápice, rodeadas por cerdas multiciliadas (fig. 38B). Manchas oculares ovais com 8+8 lentes, sendo a maior A e a menor F (fig. 38C). Quatro mesoquetas interoculares multiciliadas (fig. 38C). Cerdas
pre–labrais e labrais lisas. Cerdas do triângulo labial M1–2 e E multiciliadas, r
reduzida (fig. 38D). Orgão metatrocanteral com aproximadamente 36 pequenos espinhos (fig. 38E). Todos os unguis com quatro dentes, dois basais pareados e dois apicais não pareados (figs. 38F - H). Unguículus acuminado, com bordas levemente
serrilhadas (figs. 38F - H). Ventre do manúbrio com 12+12 cerdas subapicais. Macroquetas com extremidades abaoladas na parte distal do manúbrio e apical do dente (figs. 38I). Mucro tipicamente falcado (fig. 38J). Quetotaxia dorsal detalhada do Abd. II–III na figura 39. Distribuição de macroquetas dorsais do corpo inteiro na figura
40.
Figura 39. Seira sp. n. 18: Quetotaxia dorsal detalhada do segundo e terceiro segmentos abdominais.
5.3.Chaves de identificação para Seirini e diagnoses dos gêneros do Brasil
A seguir é apresentada a chave de gêneros de Seirini do Brasil e suas
respectivas diagnoses. Seis espécies do gênero Seira não foram incluídas na chave, pois não existem dados na literatura suficientes para separá-las adequadamente das demais. A tabela 4 resume as poucas informações encontradas na literatura (HECKMAN, 2001) sobre cinco espécies não incluídas na chave, e para a sexta espécie, Seira reichenspergeri Handschin, 1924 com localidade tipo em Santa Catarina, não foram encontradas informações a respeito de sua identificação.
Tabela 4. Espécies do gênero Seira não incluídas na chave de identificação.
Espécie Autor/Ano de
publicação
Distribuição no Brasil
Descrição
Seira atrolutea Arlé, 1939 MS, SP A cabeça, exceto o ¼ posterior, é preta. Existem duas manchas pretas transversais, uma atravessando a parte anterior do quarto segmento abdominal e a outra cobrindo a maioria do quinto segmento abdominal.
Seira pulcher Handschin, 1924
SC Os dentes da base da garra empodial são proeminentes. A cabeça, os dois primeiros segmentos torácicos, primeiro par de pernas, uma mancha no quinto segmento abdominal são azul escuro, o resto do corpo é amarelo.
Seira paranensis Stach, 1935 PR O unguículus não tem um pequeno dente externo e basal.
Seira subannulata Denis, 1933 ES, RJ Existem faixas escuras no fêmur do segundo e terceiro par de pernas. Não existem manchas escuras no terceiro segmento torácico.
Seira musarum Ridley, 1890 PE (Fernando de
Noronha)